Stap 6: Aankomst op operatiekamer
Uitgangsvraag
- Wat dient er rondom de aankomst op de operatiekamer geregeld te worden en waarom?
- Welke informatie moet er rondom de aankomst op de operatiekamer uitgevraagd en/of gedeeld en vastgelegd worden om de perioperatieve veiligheid van de patiënt te bewaken of vergroten?
- Wie is waarvoor verantwoordelijk rondom de aankomst op de operatiekamer?
De uitgangsvraag omvat de volgende deelvragen:
- Waaraan (of aan welke aspecten/ factoren) moet de time-out procedure inhoudelijk voldoen, om de kwaliteit van zorg (in de zin van patiëntveiligheid en organisatie van zorg) te kunnen waarborgen?
- Welke factoren in de huidige time-out procedure vergroten de patiëntveiligheid het meest?
Aanbeveling
6.1 Controle materialen
Het medisch ondersteunend personeel controleert voorafgaand aan de procedure of de juiste materialen beschikbaar zijn en naar behoren functioneren en informeert de medisch specialist.
Verantwoordelijk: operatieassistent en anesthesiemedewerker
6.2 STOP V: Time-out procedure
Het operatieteam voert een gestructureerd overleg met het gehele operatieteam, in aanwezigheid van de patiënt of wettelijk vertegenwoordiger, vóór de start van de anesthesie. Bespreek tenminste:
- Identificatie patiënt en verificatie juiste patiëntendossier.
- Type operatie.
- Juiste zijde of locatie, inclusief markering.
- Allergieën.
- Aanwezigheid van materialen, instrumentarium en apparatuur.
- Aanwezigheid van protheses.
- Type anesthesie
- Positionering van de patiënt.
- Antibioticabeleid (noteer tijdstip van toediening in patiëntendossier).
- Stollingsstatus.
- Te verwachten anesthesiologische problemen.
- Relevante co-morbiditeiten en relevante medische voorgeschiedenis.
De operateur is verantwoordelijk voor de time-out procedure. Het is een verantwoordelijkheid van alle teamleden om adequaat te participeren in de time-out procedure.
Tijdens bepaalde chirurgische procedures of specialismen gelden aanvullende eisen ten aanzien van de ingreep of de betrokkenheid van meerdere teamleden (al dan niet van een ander specialisme), waarvoor de time-out procedure wordt aangevuld met specifieke aspecten. Deze dienen te worden vastgelegd in een lokaal protocol.
Verantwoordelijk: operateur
* In specifieke omstandigheden kan de aanwezigheid van de anesthesioloog bij de time-out procedure gedelegeerd worden naar de anesthesiemedewerker. De anesthesioloog blijft te allen tijde de eindverantwoordelijke over het uitvoeren van de time-out procedure en de te behandelen inhoud. Deze specifieke omstandigheden zijn:
- er is sprake van een locoregionale techniek als solitaire anesthesievorm, én
- er heeft een pre-time out plaatsgevonden waarbij de anesthesioloog fysiek aanwezig was, én
- deze werkwijze is vastgelegd in een lokaal protocol dat regelmatig wordt geëvalueerd
6.3 Registratie time-out procedure
Registreer het uitvoeren van de time-out procedure en leg daarbij in het patiëntendossier vast dat de time-out procedure is uitgevoerd.
Indien de time-out procedure niet of niet volledig is uitgevoerd, dient geregistreerd te worden wat de oorzaak en/ of reden zijn van het niet uitvoeren van de time-out procedure.
Verantwoordelijk: operateur en anesthesioloog
6.4 Aangepaste time-out procedure
Een aangepaste time-out procedure kan worden uitgevoerd indien:
- Een patiënt, ouder of wettelijk vertegenwoordiger niet in de gelegenheid is actief deel te nemen aan de time-out procedure, voer dan de time-out uit met de leden van het operatieteam, waarbij de operateur verantwoordelijk is voor de gegevens van de patiënt. De operateur controleert:
- of de juiste patiënt aanwezig is op de operatiekamer aan de hand van het patiëntendossier en het polsbandje van de patiënt;
- dat de ingreep wordt uitgevoerd zoals besproken aan de hand van het patiëntendossier en de ingreep aan de juiste zijde wordt gedaan (desgewenst gecontroleerd aan de hand van radiologische beeldvormende diagnostiek).
- Er een spoedsituatie is waarin het operatieteam niet in de mogelijkheid is de time-out procedure uit te voeren, namelijk:
- ingrepen uit categorie 1 volgens de richtlijn “Beleid bij spoedoperaties”;
- wanneer de operateur of anesthesioloog een interventie beoordeeld als zodanig spoedeisend.
Verantwoordelijk: operateur
Wat zijn de wijzigingen in stap 6 ten opzichte van de vorige richtlijn?
- Minimale aspecten van de time-out zijn explicieter uitgeschreven.
- Beschrijving van aangepaste situatie ten aanzien van de time-out procedure.
- Registratie van de time-out procedure.
Overwegingen
Het uitvoeren van een time-out procedure voorafgaand aan de inleiding van anesthesie of aan het uitvoeren van een chirurgische interventie onder lokale anesthesie is al enige tijd gebruikelijk in de ziekenhuiszorg, en verplicht gesteld door onder andere de Inspectie Gezondheidszorg en Jeugd (IGJ), Nederlandse ziekenhuizen en wetenschappelijke verenigingen. Het effect van de time-out procedure was het onderwerp van diverse uitgevoerde onderzoeken, met name op basis van de chirurgische checklist zoals opgesteld door de World Health Organisation (WHO). Doordat deze studies voornamelijk observationeel van aard zijn, heeft dit geresulteerd in een lage GRADE-beoordeling van de gevonden conclusies. Over de specifieke inhoud van een time-out procedure of de onderdelen waaruit deze dient te bestaan, is tot op heden geen literatuur gevonden.
De uitgevoerde literatuurstudie heeft echter aangetoond dat een time-out procedure, mits correct en volledig uitgevoerd, resulteert in een lagere mortaliteit, minder postoperatieve complicaties, en kortere operatieduur. Er zijn aanwijzingen uit recent uitgevoerd onderzoek dat adequate implementatie van een gehele chirurgische checklist (veelal de WHO SSC, of een variant hierop) geassocieerd is met een betere patiëntveiligheid en minder vertragingen rondom operaties. Op basis van deze klinisch relevante resultaten veronderstelt de werkgroep dat een time-out procedure onderdeel moet zijn van het peroperatieve traject en dient uitgevoerd te worden voorafgaand aan de inleiding van anesthesie of de uitvoer van een chirurgische interventie onder lokale anesthesie.
Operatieteam
Tijdens het uitvoeren van de time-outprocedure dient het gehele operatieteam lijfelijk aanwezig te zijn (het team van medewerkers dat de operatie gaat uitvoeren). Idealiter vindt er geen wisseling van teamleden plaats tussen time-out en start operatie. Als wisseling noodzakelijk is, is het team verantwoordelijk voor een goede overdracht.
Het operatieteam bestaat uit:
- Het anesthesiologisch team: het anesthesiologisch team bestaat tenminste uit een anesthesioloog (al dan niet in opleiding, AIOS) en een anesthesiemedewerker (al dan niet in opleiding).
- Het chirurgisch team: het chirurgisch team bestaat uit de operateur(s) (al dan niet in opleiding, AIOS, physician assistant, verpleegkundig specialist) die de operatie gaat/gaan uitvoeren of direct betrokken is/ zijn gedurende de gehele procedure, en tenminste twee operatieassistenten (al dan niet in opleiding), waarbij de rol die zij aannemen voorafgaand aan de time-out procedure duidelijk is vastgelegd (omloop of instrumenterende).
De time-out procedure kan alleen geleid worden door een operateur van het betreffende specialisme waardoor de patiënt behandeld wordt. Indien een teamlid niet bevoegd en/of bekwaam wordt geacht ten aanzien van de betreffende procedure of te gebruiken apparatuur, is het de verantwoordelijkheid van de betrokken operateur en anesthesioloog om te besluiten of de operatie plaats kan vinden. Ook de overige leden van het behandelteam dienen te allen tijde alert te zijn op de bevoegdheid en bekwaamheid van teamleden, en kunnen hier zo nodig actie op ondernemen. Waar in de richtlijn gesproken wordt over een teamlid van een bepaald specialisme, kan ook een teamlid in opleiding bedoeld worden, waarbij bevoegdheid en bekwaamheid leidend zijn. Een zorgverlener wordt bekwaam geacht als hij:
- kennis heeft over de handeling, de technieken, het doel, de anatomie, de risico’s, voor- en nazorg en eventuele complicaties;
- vaardig is in het uitvoeren van de handeling en bijkomende activiteiten (bijvoorbeeld beslissen en informeren).
In specifieke omstandigheden kan de aanwezigheid van de anesthesioloog bij de time-out procedure gedelegeerd worden naar de anesthesiemedewerker. De anesthesioloog blijft te allen tijde de eindverantwoordelijke over het uitvoeren van de voor de anesthesie gerelateerde inhoud van de time-out en de te behandelen inhoud. De aanwezigheid van de anesthesioloog kan naar de anesthesiemedewerker gedelegeerd worden mits beiden akkoord zijn en als is voldaan aan de volgende drie voorwaarden:
- Er is sprake van een locoregionale techniek als solitaire anesthesievorm, én
- Er heeft een pre-time out plaatsgevonden waarbij de anesthesioloog lijfelijk aanwezig was, én
- Deze werkwijze is vastgelegd in een lokaal protocol dat regelmatig wordt geëvalueerd.
Patiënt
De patiënt dient actief betrokken te worden bij de time-out procedure. In het geval van een minderjarige of wilsonbekwame patiënt, gelden aanvullende eisen. Indien een patiënt minderjarig of wilsonbekwaam is, dient een wettelijk vertegenwoordiger aanwezig en betrokken te zijn tijdens de time-out procedure. Als een patiënt niet in de gelegenheid is actief deel te nemen aan de time-out procedure, en de situatie het niet toelaat dat een wilsbekwame in plaats van de patiënt participeert, kan gekozen worden voor het uitvoeren van een aangepaste time-out procedure (zie toelichting onder sectie “time-out procedure niet of slechts gedeeltelijk mogelijk”). Bij patiënten met een taalbarrière dient een tolk aanwezig te zijn om communicatie tussen het operatieteam en de patiënt mogelijk te maken. Deze tolk kan een familielid of nauw betrokkene van de patiënt zijn, of een tolk van extern. Als de patiënt, ouder of wettelijk vertegenwoordiger in uitzonderlijke gevallen niet actief kan meedoen aan de time-out handelt het operatieteam in het kader van de WGBO (goed hulpverlenerschap), in het belang van de patiënt.
Time-out procedure
De time-outprocedure dient te worden uitgevoerd volgens onderstaande criteria. De definitieve werkwijze ten aangezien van de time-outprocedure dient te worden vastgelegd in een lokaal protocol. De time-outprocedure bestaat uit een uniform deel, eventueel aangevuld met specifieke onderdelen. Het uniforme deel van de time-outprocedure dient voorafgaand aan de inleiding van anesthesie of de start van een chirurgische interventie onder lokale anesthesie te worden doorlopen. Het uniforme gedeelte van de time-out procedure bevat een minimaal pakket van aspecten, wat toepasbaar is voor elk medisch specialisme of chirurgische procedure. Het specifieke deel van de time-out procedure wordt afgestemd op het medisch specialisme of chirurgische procedure waarvoor de patiënt behandeld wordt, of naar gelang de situatie in de praktijk. Overige bepalingen kunnen van kracht zijn, afhankelijk van specifieke situaties, waarbij het uniforme gedeelte van de time-out procedure is aangevuld met aspecten die van belang zijn voor het medisch specialisme of chirurgische procedure waarvoor de patiënt behandeld wordt.
Het uniforme deel
Het uniforme deel van de time-out procedure omvat aspecten waaraan de procedure tenminste moet voldoen. Dit vaste onderdeel wordt uitgesplitst in een patiënten-deel (vragen die worden gesteld aan de patiënt in het bijzijn van het complete operatieteam) en medisch-inhoudelijk deel (vragen die worden gesteld aan leden van het operatieteam in het bijzijn van het complete operatieteam en eventueel de patiënt).
- Patiënten-deel: De patiënt wordt bevraagd door de operateur of anesthesioloog in bijzijn van het complete operatieteam naar de volgende aspecten:
- Identiteit. De identiteit van de patiënt wordt geverifieerd volgens VMS en bij de patiënt (of diens wettelijke vertegenwoordiger).
- Verificatie dossier: het operatieteam moet zich ervan vergewissen dat het patiëntendossier van de juiste patiënt geopend is.
- Chirurgische procedure. De uit te voeren procedure wordt geverifieerd aan de hand van het patiëntendossier.
- Operatiezijde of locatie. De zijde waaraan de procedure dient te worden uitgevoerd of de specifieke locatie waarop de procedure dient te worden uitgevoerd (indien van toepassing) wordt geverifieerd aan de hand van het patiëntendossier. Tevens dient te worden vastgesteld of de markering op de juiste zijde of locatie van het lichaam is aangebracht.
- Allergieën. Er dient geverifieerd te worden of de patiënt relevante allergieën heeft. De aanwezigheid van allergieën wordt gecontroleerd aan de hand van het patiëntendossier en het verslag van de preoperatieve evaluatie.
- Medisch-inhoudelijk deel: het operatieteam bespreekt ten aanzien van de uit te voeren procedure:
- Instrumentarium en apparatuur. De operateur verifieert bij de operatieassistent of de juiste materialen, instrumentarium en apparatuur aanwezig zijn voorafgaand aan de procedure en of deze naar behoren functioneren. De anesthesioloog verifieert bij de anesthesiemedewerker of de juiste materialen, instrumentarium en apparatuur aanwezig zijn voorafgaand aan de inleiding en of deze naar behoren functioneren.
- Protheses. De operateur verifieert bij de operatieassistent of de juiste protheses aanwezig zijn voorafgaand aan de procedure en of deze gereed zijn voor gebruik.
- Positionering. De houding of positie waarin de patiënt geplaatst dient te worden gedurende de ingreep wordt door de operateur benoemd. Aanvullend wordt geverifieerd of de juiste steunen en materialen voor de positionering aanwezig zijn.
- Antibioticabeleid. De behandelend operateur controleert of de juiste antibiotica op het juiste tijdstip zijn toegediend.
- Antistolling. Aan de hand van het patiëntendossier en het verslag van de preoperatieve evaluatie wordt gecontroleerd of de patiënt antistolling gebruikt. Geverifieerd dient te worden of de patiënt de inname van deze antistollingsmedicatie volgens afspraak heeft gestaakt of door-gebruikt, en of de bloedwaarden hieromtrent in orde zijn.
- Anesthesiologische problemen. Te verwachten problemen (bijvoorbeeld intubatieproblemen) worden benoemd door de anesthesioloog en geverifieerd bij de anesthesiemedewerker, aan de hand van het patiëntendossier en het verslag van de preoperatieve evaluatie. Aanvullend wordt gecontroleerd of de juiste benodigde materialen aanwezig zijn.
- Co-morbiditeiten. De aanwezigheid van bekende en relevante co-morbiditeiten wordt besproken aan de hand van het patiëntendossier en het verslag van de preoperatieve evaluatie door de behandelend operateur en anesthesioloog.
Specifieke onderdelen
In een lokaal protocol dient vastgelegd te worden welke aspecten of onderdelen aan de time-outprocedure worden toegevoegd. Deze aspecten of onderdelen kunnen gericht zijn op een medisch specialisme, of afgestemd worden op een bepaalde operatieprocedure. Gedacht kan worden aan te verwachten problemen gedurende de procedure, risicovolle momenten, te verwachten bloedverlies, controle van kruisbloed en screening voor irreguliere antistoffen, aanwezigheid van bloedproducten, de anesthesietechniek, het inbrengen van invasieve lijnen, het toepassen van locoregionale technieken, de ASA-classificatie, en of andere specifieke medicatie toegediend moet worden gedurende de chirurgische procedure.
Meerdere operateurs of multidisciplinaire operaties
De operateur is verantwoordelijk voor de compleetheid van de informatie en de uitvoering van de time-outprocedure. Tijdens sommige chirurgische procedures, of bij bepaalde specialismen, gelden aanvullende eisen of de betrokkenheid van meerdere teamleden (al dan niet van een ander specialisme). Als een operatieve procedure wordt uitgevoerd door operateurs (al dan niet in opleiding, AIOS) van diverse specialismen tijdens eenzelfde procedure, dient voorafgaand aan de procedure bepaald te worden welke operateur de eindverantwoordelijke is over de time-out procedure en deze zal gaan leiden. De deelname van de tweede operateur kan worden gedelegeerd naar de eerste operateur (die eindverantwoordelijk is).
In het geval van multidisciplinaire operaties is de operateur die de operatie start aanwezig bij de time-out. De overige operateurs moeten vanaf de time out (telefonisch) bereikbaar zijn en op tijd beschikbaar. De eerste operateur moet dit controleren.
Registratie
In het patiëntendossier wordt vastgelegd dat de time-outprocedure volgens protocol en de geldende richtlijnen is uitgevoerd. Indien de time-outprocedure niet (volledig) is uitgevoerd, dient geregistreerd te worden wat de reden is van het niet (volledig) uitvoeren van de time-outprocedure.
Time-out procedure niet of slechts gedeeltelijk mogelijk
Er kan worden besloten om de time-outprocedure niet uit te voeren, of slechts een gedeelte ervan uit te voeren, op basis van specifieke situaties:
- De patiënt is niet in de gelegenheid actief deel te nemen aan de time-outprocedure. Hierbij kan gedacht worden aan een patiënt die reeds onder anesthesie en geïntubeerd is (patiënt welke overgenomen is van bijvoorbeeld een Intensive Care afdeling) of anderszins niet in de gelegenheid is vragen te beantwoorden, en waarbij de situatie het niet toelaat dat een wilsbekwame in plaats van de patiënt participeert in de time-out procedure. In deze specifieke situatie wordt de time-out uitgevoerd met de leden van het operatieteam, waarbij de operateur verantwoordelijk is voor de gegevens van de patiënt. De operateur dient hierbij te bevestigen dat de juiste patiënt aanwezig is op de operatiekamer (controle aan de hand van het patiëntendossier en het polsbandje van de patiënt), dat de ingreep wordt uitgevoerd zoals besproken aan de hand van het patiëntendossier en aan de juiste zijde (desgewenst gecontroleerd aan de hand van radiologische beeldvormende diagnostiek). De vervolgonderdelen van de time-out procedure dienen te worden uitgevoerd volgens bovengenoemde criteria.
- Er is een spoedsituatie waarin het operatieteam niet in de mogelijkheid is de time-outprocedure uit te voeren. Dit criterium geldt voor ingrepen uit categorie 1 volgens de richtlijn “Spoedoperaties”. Er kan worden afgeweken van de time-outprocedure wanneer de operateur of anesthesioloog een interventie beoordeelt als zodanig spoedeisend dat het uitvoeren van een time-out niet in het belang van de patiënt is.
WHO Surgical Safety Checklist
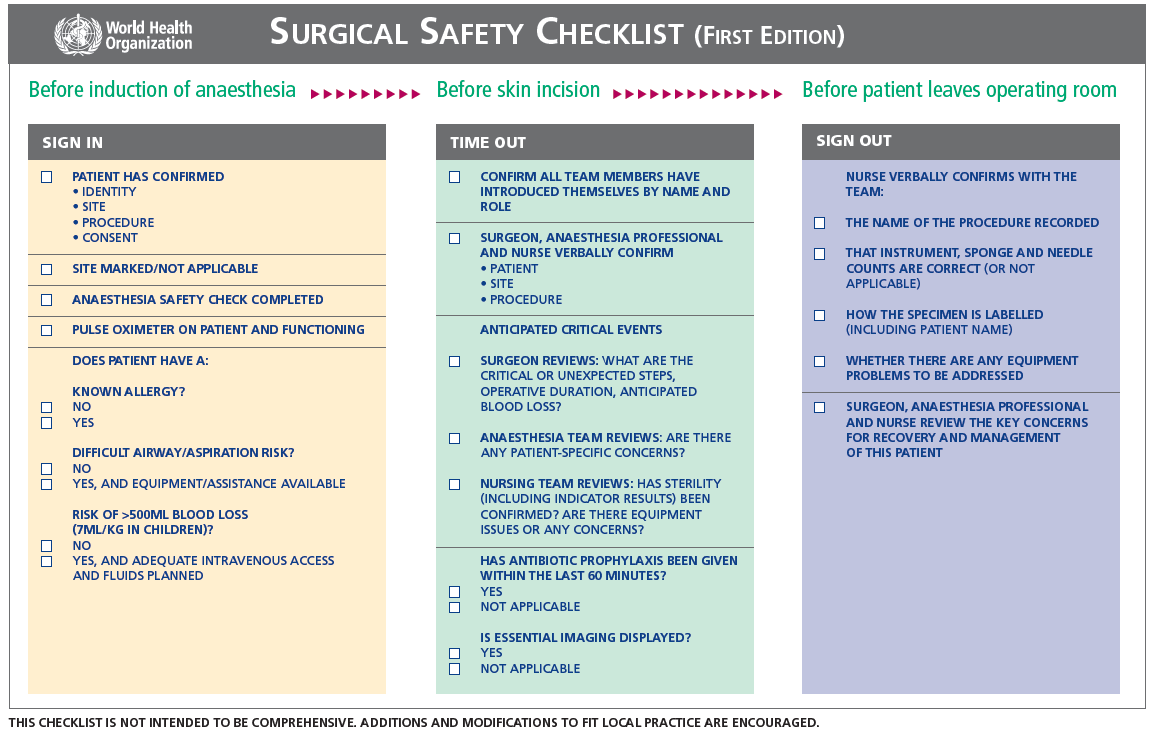
Onderbouwing
Achtergrond
De time-out procedure is een aantal jaar geleden ontworpen en ingevoerd in de Nederlandse (operatieve) gezondheidszorg, waarbij het uitvoeren van een time-outprocedure verplicht werd gesteld voorafgaand aan elke chirurgische procedure. Om een uniforme werkwijze in de Nederlandse gezondheidszorg te bewerkstelligen, waarbij de patiëntveiligheid en kwaliteit van zorg gewaarborgd worden, dient de huidige versie van de time-out procedure inhoudelijk te worden geëvalueerd. Met name de inhoudelijke aspecten van de huidige time-out procedure dient te worden onderzocht en waar nodig te worden aangepast, om een effectieve en efficiënte time-out procedure te kunnen bewerkstelligen die kan worden toegepast binnen elk (chirurgisch) specialisme en bij iedere patiënt.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het gebruik van een chirurgische checklist (inclusief time-out procedure) zou kunnen resulteren in minder sterfte vergeleken met het niet gebruiken van een chirurgische checklist bij patiënten na een operatie.
Bronnen: (Abbott, 2018; de Jager, 2016; Bergs, 2014; de Vries, 2010; Bock, 2016; Haynes, 2017; Zingiryan, 2017) |
|
Zeer laag GRADE |
Het gebruik van een chirurgische checklist (inclusief time-out procedure) zou kunnen resulteren in minder postoperatieve complicaties vergeleken met het niet gebruiken van een chirurgische checklist bij patiënten na een operatie.
Bronnen (Abbott, 2018; de Jager, 2016; Bergs, 2014; de Vries, 2010; Bock, 2016; Haynes, 2017; Zingiryan, 2017) |
|
Zeer laag GRADE |
Het is onzeker of het gebruik van een chirurgische checklist (inclusief time-out procedure) zou kunnen resulteren in een kortere verblijfsduur in het ziekenhuis vergeleken met het niet gebruiken van een chirurgische checklist bij patiënten na een operatie.
Bronnen: (De Jager, 2016; Bock, 2016) |
|
Zeer laag GRADE |
Het is onzeker of het gebruik van een chirurgische checklist (inclusief time-out procedure) zou kunnen resulteren in minder postoperatief bloedverlies vergeleken met het niet gebruiken van een chirurgische checklist bij patiënten na een operatie.
Bronnen: (Bergs, 2014; de Jager 2016 (Boaz, 2014)) |
|
Zeer laag GRADE |
Het is onzeker of het gebruik van een chirurgische checklist (inclusief time-out procedure) zou kunnen resulteren in een kortere operatieduur vergeleken met het niet gebruiken van een chirurgische checklist bij patiënten na een operatie.
Bronnen: (Papaconstantinou, 2013; de Jager, 2016; Boaz, 2014; Haughen, 2015) |
|
- GRADE |
De relatieve kosten en kosteneffectiviteit van een time-out procedure vergeleken met geen time-out procedure zijn onbekend. Geen van de studies rapporteert kosten of kosteneffectiviteit. |
|
- GRADE |
Er zijn aanwijzingen dat er een associatie is tussen adequate implementatie van een chirurgische checklist (inclusief time-out procedure) en patiënt veiligheid (minder mortaliteit, minder postoperatieve complicaties, betere voorverwarmde intraveneuze vloeistoffen, betere voorverwarmde dekens, betere forced air verwarming en betere timing van de antibioticaprofylaxe) en efficiëntie (minder vertraging) bij patiënten na een operatie.
Er zijn aanwijzingen dat het gebruik van zoveel mogelijk onderdelen van de checklist of betekenisvolle voltooiing van de checklist of alle onderdelen samen van de checklist (sign-in, time-out en sign-out) de patiëntveiligheid verbeteren en minder vertraging rondom operaties geven.
Bronnen: (Bergs, 2014; Haugen, 2017; Haynes, 2017; Anderson, 2018; Henderson, 2012; van Klei, 2012; de Vries, 2010) |
Samenvatting literatuur
Beschrijving van de studies: Effectiviteit van de time-out procedure
Een recente systematische review en meta-analyse van Abbott (2018) onderzocht de effectiviteit van de WHO Surgical Safety Checklist (SSC) (zie voorbeeld checklist bij de aanverwante producten) in 11 studies met totaal 453.292 patiënten. Er is gezocht tot en met 2017, ook is een eigen grote prospectieve observationele studie, beschreven in hetzelfde artikel, meegenomen in de review en meta-analyse. De resultaten zijn niet apart gepresenteerd voor de time-out, maar voor de gehele WHO-SSC-checklist, dit houdt in: een sign-in, time-out en sign-out. De sign-in en time-out gecombineerd komt het beste overeen met stopmoment IV in de Nederlandse setting. Enkel studies waarin de WHO-checklist, zonder een aanvullende training, werd geïmplementeerd zijn meegenomen in de review. Mortaliteit en postoperatieve complicaties waren de twee onderzochte uitkomstmaten. Alle geïncludeerde studies hadden een observationele vergelijkende opzet: longitudinaal, retrospectief of prospectief cohort, case-control of een voor-na opzet. Studies vonden plaats in de USA, Iran, Canada, Nederland, Finland, Zwitserland, Chili, de UK en drie internationale studies, waarvan twee wereldwijd en één specifiek in Europa. Acht studies in de review van Abbott (2018) rapporteerden over mortaliteit in het ziekenhuis na een operatie. Mortaliteit was in twee studies gedefinieerd als mortaliteit binnen het ziekenhuis, in vijf studies als mortaliteit in het ziekenhuis binnen 30 dagen en één studie gebruikte de definitie mortaliteit in het ziekenhuis binnen 60 dagen. Van de 230.929 patiënten bij wie de WHO-SSC-checklist werd gebruikt overleden er 2.624 (1,1%) vergeleken met 2.466 (1,3%) van de 188.870 patiënten bij wie geen checklist werd gebruikt. Acht studies in de review van Abbott (2018) rapporteerden postoperatieve complicaties. Van de 161.858 patiënten bij wie een checklist werd gebruikt ontwikkelden er 12.054 (7,4%) postoperatieve complicaties vergeleken met 6.043 (4.9%) van de 123.329 patiënten bij wie geen checklist werd gebruikt (Abbott, 2018).
De systematische review van de Jager (2016) includeerde 25 studies met een uiteenlopend design, waarvan de meerderheid met een voor-na design. Er is gezocht tot en met juni 2015. De in- en exclusiecriteria verschilden van de review van Abbott (2018), aangepaste versies van de WHO-SSC-checklist en interventies inclusief een (cultuur)training werden ook geïncludeerd. Door de grote heterogeniteit in studie-opzet en in operationalisatie van de uitkomstmaten kon volgens de auteurs geen meta-analyse worden uitgevoerd. Mortaliteit werd onderzocht in 18 studies, postoperatieve complicaties in 20 studies en verblijfsduur in vier studies. In totaal waren 17 studies uitgevoerd in ontwikkelde landen (volgens de Wereldbankclassificatie), zes studies in ontwikkelingslanden en twee studies in meerdere landen waarbij resultaten per land werden gepresenteerd (Jager, 2016).
De systematische literatuur review en meta-analyse van Bergs (2014) includeerde zeven studies, die grotendeels overlappen met de studies van Abbott (2018) en de Jager (2014). Omdat de uitkomstmaat bloedverlies is meegenomen en omdat sommige studies wel uitgewerkt zijn in een meta-analyse en daardoor completere data worden gepresenteerd waar dat in de andere reviews niet is gedaan, is deze review ook meegenomen in de literatuursamenvatting.
Alle studies in de beschreven systematische reviews van Abbott (2018), De Jager (2016) en Bergs (2014) hebben bijna alle een studie-opzet waarmee causaliteit niet kan worden onderzocht. De meerderheid van de studie-opzetten zijn voor-na-studies. De auteurs van de systematische reviews geven zelf ook aan dat de gevonden effecten mogelijk niet enkel aan de implementatie van de nieuwe checklist kunnen worden toegeschreven. Onder andere verandering van de (veiligheids)cultuur onder personeel, trainingen en verbeterde medische technieken zijn belangrijke confounders die over de tijd zijn veranderd, waarvoor niet is gecorrigeerd. Bovendien is in alle studies niet enkel de time-out onderzocht, maar een checklist die betrekking heeft op een groter deel van het perioperatieve traject.
Vijf relevante losse of recente studies zijn apart meegenomen in deze literatuursamenvatting, waarmee de reviews en meta-analyses konden worden geüpdatet.
De Vries (2010) beschrijft de effecten voor en na de implementatie van de SURPASS-checklist in zes Nederlandse ziekenhuizen. Vijf controleziekenhuizen waar de SURPASS-checklist niet werd geïmplementeerd (met in totaal 5256 patiënten) werden ook onderzocht op dezelfde manier. In de cohort vóór implementatie zaten 3760 patiënten, die in totaal 4364 operaties ondergingen. In de cohort na implementatie zaten 3820 patiënten, die in totaal 4387 operaties ondergingen. Patiënten in de postinterventiegroep ondergingen vaker een operatie voor een gastro-intestinale aandoening of trauma-gerelateerd en hadden minder vaak een vasculaire aandoening (p<0,001) vergeleken met de pre-implementatiegroep. Postoperatieve complicaties en mortaliteit werden geregistreerd. Het SURPASS-onderzoek is niet meegenomen in de eerder genoemde systematische literatuurstudies omdat deze interventie afwijkend is van de WHO-SSC-checklist. SURPASS betreft een groter deel van het perioperatieve traject, inclusief postoperatieve zorg. De studie van De Vries (2010) is wel in deze literatuursamenvatting en meta-analyse opgenomen vanwege de Nederlandse setting.
Bock (2016) beschrijft een retrospectieve analyse van ziekenhuisdata zes maanden voor en na de implementatie van een aangepaste WHO-SSC-Checklist. Drie aparte checklists werden gebruikt, een standaard checklist, een verkorte checklist voor kleine dagingrepen en een derde checklist voor een sectio caesarea (zie supplement in origineel artikel). Alle checklists bevatten een sign-out, time-out en sign-out procedure. De checklist werd geïntroduceerd op meerdere chirurgische afdelingen in een Italiaans ziekenhuis. In totaal werden 10.741 patiënten geïncludeerd, 5444 vóór de interventie en 5297 na de interventie. 47% was man en de gemiddelde leeftijd was 53,0 (sd 23,0) jaar. Patiënten in de postinterventiegroep waren significant ouder, vaker man en hadden een hogere prevalentie van oncologische en cardiologische aandoeningen. De typen chirurgische procedures verschilden ook tussen beide groepen, er was een toename in vasculaire, thorax- en intracraniële procedures na implementatie van de checklist. In een multipele regressiemodel zijn de gecorrigeerde effecten berekend (Bock, 2016).
Mortaliteit (30 dagen in het ziekenhuis) en verblijfsduur zijn de relevante uitkomstmaten die beschreven zijn in deze literatuursamenvatting.
Zingiryan (2017) beschrijft de effecten twee jaar voor en twee jaar na de implementatie van de WHO-SSC-Checklist in één academisch ziekenhuis in de Verenigde Staten. Via de University Health System Consortium database werden de mortaliteitspercentages en percentages van acht typen complicaties vergeleken. Er werd niet gecorrigeerd voor potentiële confounders. De acht complicatiecategorieën waren mortaliteit ten gevolge van een ernstige behandelbare complicatie, sepsis, respiratoir falen, openspringen van de wond, postoperatieve veneuze trombo-embolie, postoperatieve bloeding/hematoom, reactie op transfusie, achtergebleven operatiemateriaal. De tijdsperiode voor elke complicatie verschilde, en daarmee de totale aantallen patiënten, daarom kunnen voor deze literatuuranalyse de categorieën niet bij elkaar worden opgeteld, waardoor de data niet bruikbaar zijn voor opname in de meta-analyse (Zingiryan, 2017).
Haynes (2017) beschrijft de effecten van een checklist verbeterprogramma op mortaliteit in 58 ziekenhuizen in de USA. In 2011 werd het verbeterprogramma geïntroduceerd in alle ziekenhuizen. De postoperatieve mortaliteitstrends in de periode 2008 tot 2010 werden vergeleken met die in de periode 2011 tot 2013 . Er werd een vergelijking gemaakt tussen 14 ziekenhuizen (n=40.626 operaties) waarin het programma compleet was geïmplementeerd en de overige ziekenhuizen (n=69.094). Deze vergelijking is uitgevoerd met behulp van een difference-in-difference propensity score analyse, waarmee je confounding minimaliseert (Haynes, 2017).
Papaconstantinou (2013) evalueerde één jaar voor en één jaar na implementatie van de WHO SSC checklist de operatiekamertijd en operatietijd in één ziekenhuis in de USA. In totaal werden 35.570 bekeken (Papaconstantinou, 2013).
Resultaten: Effectiviteit van de time-out procedure
1. Postoperatieve mortaliteit
Er zijn drie systematische literatuurreviews geïncludeerd over het effect van de time-out/chirurgische checklist op mortaliteit bij operaties, waarvan twee ook een meta-analyse hebben uitgevoerd (Abbott, 2018; de Jager, 2016; Bergs, 2014). Er zijn nog vier losse studies toegevoegd aan de literatuursamenvatting en meta-analyse (Bock, 2016; de Vries, 2010; Zingiryan, 2017; Haynes, 2017).
Er is voor deze literatuursamenvatting een meta-analyse uitgevoerd waarbij de resultaten van 18 studies zijn gepoold, hierbij zijn studies uit landen met midden en lage inkomens geëxcludeerd. In elf studies werd mortaliteit na 30 dagen gerapporteerd, in zes studies werd in-hospital mortaliteit aangehouden en in één studie werd dit niet duidelijk gerapporteerd. De gepoolde RR is 0,74 (95% BI 0,65 tot 0,85), p<0,0001, random-effects model, I2=75%. Dit betekent dat het gebruik van een checklist resulteert in 26% minder mortaliteit. Het absolute risico op mortaliteit is 1,7% zonder checklist en 1,3% met checklist. Het absolute risicoverschil is 0,4% (95% BI 0,3 tot 0,6%) minder mortaliteit, 4 minder doden per 1000 patiënten. Dit is een klinisch relevante reductie van mortaliteit. Er zit wel een redelijk grote onzekerheid rondom het effect. Er is hoge heterogeniteit in de resultaten, waarschijnlijk kan dit verklaard worden door verschillen in studie-opzet, precieze operationalisatie van de uitkomstmaat, studiegrootte (ook tussen de groepen in één studie) en mate van implementatie (compliance) van de checklist.
In 11 van de 18 studies werd er gecorrigeerd voor potentiële confounders zoals geslacht, leeftijd, comorbiditeit, type chirurgische ingreep, type anesthesie, electieve of urgente chirurgische ingreep et cetera. De meerderheid van de studies had een voor-na design, een nadeel en potentiële confounder hierbij is het tijdseffect, hiervoor is niet gecorrigeerd. Na correctie in de individuele studies voor de confounders werden er meestal geen andere resultaten gevonden. Ongecorrigeerde data zijn gebruikt in de meta-analyse. Haughen (2015) gebruikte een studieopzet waarbij wel gekeken kan worden naar causaliteit (stepped-wedged cluster RCT), in tegenstelling tot de andere studies. Bock (2016) onderzocht naast 30-dagen mortaliteit ook 90-dagen mortaliteit, en vond na correctie voor confounders een significante OR van 0,73 (0,56 tot 0,96), p=0,02.
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint op GRADE ‘laag’. De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: grotendeels voor-na studieopzet en geen correctie voor veranderingen in tijd als confounder) en extrapoleerbaarheid (indirectheid; interventie WHO SSC checklist komt niet overeen met Nederlandse time-out procedure). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Figuur 1 Mortaliteit (30 dagen of in-hospital) vergelijking checklist versus geen checklist
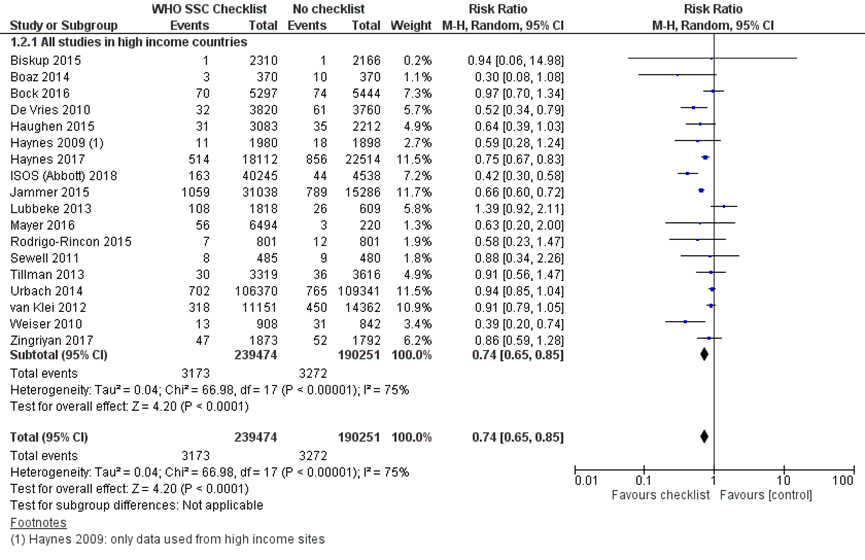
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
2. Postoperatieve complicaties
Er is een meta-analyse uitgevoerd waarbij de resultaten van 14 studies naar het effect van een chirurgische checklist (waaronder een time-out) op postoperatieve complicaties zijn gepoold, hierbij zijn studies uit landen met midden en lage inkomens en studies met te weinig data geëxcludeerd. In de meeste studies is een samengestelde maat gebruikt voor het totale aantal postoperatieve complicaties.
Een risk ratio van 0,76 (0,66 tot 0,87); P<0,01; I2=74% werd gevonden in het voordeel van de checklist (zie figuur 2). Dit komt overeen met een reductie van de kans op postoperatieve complicaties met 24% bij gebruik van een chirurgische checklist. Het absolute risicoverschil is 1,4% (95% BI 0,8 tot 2%) minder postoperatieve complicaties, 14 minder postoperatieve complicaties per 1000 patiënten (20 minder tot 8 minder). Dit is mogelijk geen klinisch relevante reductie van postoperatieve complicaties. Er zit een redelijk grote onzekerheid rondom het effect. Er is grote heterogeniteit in de resultaten, waarschijnlijk kan dit verklaard worden door verschillen in studie-opzet, precieze operationalisatie van de uitkomstmaat, studiegrootte (ook tussen de groepen in één studie) en mate van implementatie (compliance) van de checklist.
In 8 van de 14 van de studies werd er gecorrigeerd voor potentiële confounders zoals geslacht, leeftijd, co-morbiditeit, type chirurgische ingreep, type anesthesie, electief of urgente chirurgische ingreep et cetera. Ongecorrigeerde data zijn gebruikt in de meta-analyse. In de meerderheid van de studies was er geen verschil tussen de gecorrigeerde en ongecorrigeerde effecten.
Figuur 2 Postoperatieve complicaties vergelijking WHO SSC checklist versus geen checklist
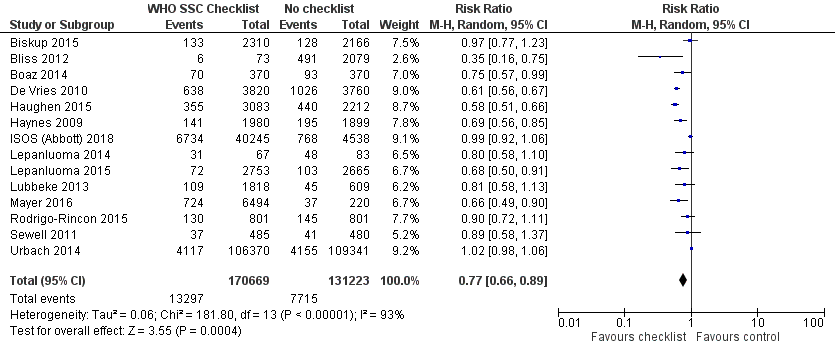
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint op GRADE ‘laag’. De bewijskracht voor de uitkomstmaat postoperatieve complicaties is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; grotendeels voor-na studieopzet en gedeeltelijke correctie voor potentiële confounders); tegenstrijdige resultaten (inconsistentie) en extrapoleerbaarheid (indirectheid; WHO SSC checklist komt niet overeen met Nederlandse time-out procedure). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
3. Postoperatief bloedverlies
Voor de uitkomstmaat geschat postoperatief bloedverlies werden twee studies geïncludeerd uit de review van Bergs (2014) en één losse studie (Boaz, 2014) uit de review van de Jager (2016). Eén studie in de review van Bergs (2014) vond een significant verschil in het percentage patiënten dat een geschat postoperatief bloedverlies had groter dan 500 ml in een cohort van 1750 patiënten (842 voor implementatie en 908 na implementatie) die een urgente niet-cardiale operatie ondergingen. Na implementatie van de checklist verminderde dit percentage van 20% naar 13% (p<0,001). Een tweede studie in de review van Bergs (2014) vond geen significant verschil in het percentage patiënten dat een bloedtransfusie nodig had na implementatie van de checklist bij hoog-risico patiënten (6,1% versus 5,5%, p=0,4). In deze studie werden data gebruikt van 2079 historische controlepatiënten, 246 patiënten bij wie geen checklist werd gebruikt en 73 patiënten bij wie wel een checklist werd gebruikt. Boaz (2014), vond in een studie met totaal 760 patiënten geen significant verschil in aantal patiënten met bloedverlies groter dan 500 ml, namelijk 0,5% zonder de checklist versus 0,8% in de groep met checklist (p=0,69) (Boaz, 2014).
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint op GRADE ‘laag’. De bewijskracht voor de uitkomstmaat postoperatief bloedverlies is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; voor-na studieopzet en geen correctie voor potentiële confounders); imprecisie (grenzen van betrouwbaarheidsinterval overlappen met klinische relevante grens) en extrapoleerbaarheid (indirectheid; WHO SSC checklist komt niet overeen met Nederlandse time-out procedure). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
4. Verblijfsduur
Voor de uitkomstmaat verblijfsduur werden zes studies gevonden, waarvan vier studies werden beschreven in de systematische literatuur review van de Jager (2016). In de review van de Jager (2016) rapporteerde een zeer grote Canadese studie (Urbach, 2014) een significant maar klinisch niet relevant verschil in verblijfsduur van 0,04 dagen (p=0.003). Morgan (2015a) vond een significant verschil in verblijfsduur in het nadeel van de checklist (Pre: 11,1 dagen, Post: 13,2 dagen; p = 0,04). Dit resultaat is echter niet bruikbaar omdat er voor en na het gebruik van de checklist naar een andere patiëntengroep werd gekeken en hier niet voor is gecorrigeerd. De overige twee studies vonden geen verschil in verblijfsduur (Jager, 2016). Bock (2016) rapporteert een statistisch significante, maar niet klinisch relevante kortere gecorrigeerde verblijfsduur van 9,6 (95% BI 9,4 tot 9,7) dagen na de interventie vergeleken met 10,4 (95% BI 10,3 tot 10,6) dagen (p<0,001) na de introductie van de interventie (Bock, 2016). Haughen (2015) vond eenzelfde statistisch significante daling in verblijfsduur van 0,8 dagen (95% BI 0,11 tot 1,43) in een grote Noorse stepped wedged cluster RCT (Haughen, 2015).
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint op GRADE ‘laag’. De bewijskracht voor de uitkomstmaat verblijfsduur is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; grotendeels voor-na studieopzet en gedeeltelijke correctie voor potentiële confounders); tegenstrijdige resultaten (inconsistentie) en extrapoleerbaarheid (indirectheid; WHO SSC checklist komt niet overeen met Nederlandse time-out procedure). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
5. Operatieduur
Voor de uitkomstmaat operatieduur werden drie studies gevonden. Geen van de studies vonden een verschil in OK tijd of operatietijd voor en na de implementatie van de WHO SSC checklist (Papaconstantinou, 2013; Boaz, 2014; Haughen, 2015).
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint op GRADE ‘laag’. De bewijskracht voor de uitkomstmaat operatieduur is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: voor-na studie-opzet en gedeeltelijke correctie voor potentiële confounders) en extrapoleerbaarheid (bias ten gevolge van indirectheid WHO SSC checklist komt niet overeen met Nederlandse time-out procedure). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
6. Kosten
Geen enkele studie rapporteerde over kosten-effectiviteit of relatieve kosten van de time-out procedure. Papaconstantinou (2013) vond wel een significante daling van directe kosten (wegwerpmaterialen, operatiekamerkosten, anesthesie diensten, pathologie diensten en post-anesthesiologische zorg unit diensten, exclusief personeelskosten) ($68 per operatie) in de groep operaties na implementatie van de WHO SSC checklist. (p<0,01) Dit is een significant verschil, maar het is onduidelijk welke onzekerheid er zit rondom dit bedrag. Er zit vaak een zeer grote onzekerheid rondom kosten als uitkomstmaat (Papaconstantinou, 2013).
Bijdrage van de losse elementen van de time-out aan patiëntveiligheid en kwaliteit van zorg
Er zijn geen studies gevonden die de bijdrage van de losse elementen van de time-out aan patiëntveiligheid en kwaliteit van zorg onderzoeken. Er zijn veel verschillende checklists in omloop, de meest onderzochte checklist is de WHO SSC lijst (zie de aanverwante producten), al dan niet met een lokale aanpassing. In Nederland is de SURPASS checklist onderzocht door de Vries (2010), een aangepaste WHO SSC checklist door Van Klei (2012) en de time-out procedure (TOP) zoals beschreven in de vorige versie van deze richtlijn door Van Schoten (2014). Deze laatste studie heeft enkel de compliance onderzocht van de TOP, niet het effect op patiëntveiligheid of efficiëntie-uitkomstmaten zoals benoemd in de PICO. Er zijn wel een aantal studies gevonden die beschrijven dat het gebruik van alle onderdelen van de checklist (compleet) of goede implementatie zorgt voor een betere veiligheid of efficiëntie dan wanneer de checklist slechts gedeeltelijk wordt gebruikt en/of niet goed is geïmplementeerd. Deze studies worden hieronder beschrijvend samengevat. De GRADE-methodiek wordt hier niet gevolgd.
In de systematische review van Bergs (2014) is in zes studies de compliance gemeten, met in totaal 12 ziekenhuislocaties. Van deze 12 sites, was in vijf locaties een adequate compliance gemeten, waarvan vier locaties een significante vermindering van postoperatieve complicaties aantoonden. Van de zeven locaties met een inadequate compliance, toonden twee locaties een significante vermindering van postoperatieve complicaties. De auteurs rapporteren een significante associatie tussen postoperatieve complicaties en adequate compliance (Yule’s Q=0,82, p=0,04). De Yule’s Q is een analyse die mogelijk een overschatting geeft van de associatie.
Haugen (2017) onderzocht de kwaliteit van een WHO SSC checklist implementatie in twee Noorse ziekenhuizen (in totaal vijf chirurgische specialismen) bij 3702 ingrepen (1398 controle- en 2304 interventie-ingrepen), in een stepped wedged cluster RCT. Haugen (2017) concludeert dat het gebruik van alle drie de onderdelen van de checklist (sign-in, time-out, sign-out) zorg voor significant minder complicaties en betere voorverwarmde intraveneuze vloeistoffen, voorverwarmde dekens, forced air verwarming en timing van de antibioticaprofylaxe (Haugen, 2017).
Haynes (2017) zoals hierboven eerder beschreven, liet zien dat er een significant verschil was in mortaliteit tussen ziekenhuizen die een checklist verbeterprogramma compleet implementeerden en ziekenhuizen die het programma niet voltooiden. Vóór implementatie (in 2011) was er geen verschil in mortaliteit tussen de ziekenhuizen (p=0,33). Mortaliteit na 30 dagen was 3,38% in 2010 en 2,84% in 2014 (p<0,0001) in de groep die het programma wel compleet implementeerde. Mortaliteit in de groep die het programma niet voltooide was 3,50% in 2010 en 3,71% in 2013 (p=0,33). Dit is een significant relatief verschil van 22% tussen de groepen (p=0,016), het absolute verschil in percentage mortaliteit was 0,74 (95% BI 0,27 tot 1,22), p=0,002. Dit is geanalyseerd met behulp van een difference-in-difference propensity score analyse, waarmee je confounding minimaliseert. Ook wanneer er meerdere jaren voor en na de implementatie samen worden genomen blijft dat verschil bestaan. Er konden geen kenmerken benoemd worden die geassocieerd waren met implementatie, er waren geen verschillen tussen rurale of stedelijke locaties, grootte of opleidingsmogelijkheden in een ziekenhuis.
Anderson (2018) heeft de adherence (afvinken van checklist) en fidelity (betekenisvolle voltooiing van de checklist elementen) geobserveerd van een SSC checklist programma bij 591 patiënten in een pediatrisch ziekenhuis en dit getracht te relateren aan vertragingen tijdens de operatie. Bij 19% van alle operaties was er vertraging tijdens de operatie, de meerderheid va deze vertragingen was gerelateerd aan het missen (50%) of niet functioneren (30%) van materiaal. In 2014, 2015 en 2016 is de adherence en fidelity geobserveerd, een WHO SSC checklist was al in 2011 ingevoerd. Adherence was stabiel en hoog alle jaren en varieerde tussen de 95 en 98%. Fidelity was lager, 73% in 2014, 74% in 2014 en 88% in 2016. De fidelity was significant lager bij operaties met een vertraging tijdens de operatie vergeleken met operaties zonder een vertraging (respectievelijk 77%±15% versus 81%±7%; p=0,03). Betere fidelity was statistisch significant geassocieerd met de tijd die werd genomen voor de pre-incisie checklist (P=0,04) en het jaar van de procedure (P<0,01). Gemiddeld duurde het afnemen van de checklist 102±42 seconden om te voltooien. De tijd die werd genomen voor de pre-incisie checklist was niet geassocieerd met vertraging (p=0,25) (Anderson, 2018).
Henderson (2012) presenteert de resultaten van een introductie van een ingekorte checklist voor de sign-in, time-out en sign-out met 10 vragen ten opzichte van de oude checklist met 31 vragen. 50 urologische operaties met de lange checklist werden vergeleken met 50 operaties met de korte checklist. De compliance (het gemiddeld aantal voltooide checklist-elementen ten opzichte van het totaal aantal mogelijke elementen uit de checklist) verbeterde significant van 53% naar 92% (P<0,0001). De mediane tijd die nodig was voor de sign-in, time-out en sign-out checklists was 88 seconden met de uitgebreide checklist, dit was significant minder (48 sec, p<0,05) met de verkorte checklist. Uitkomsten op patiëntveiligheid konden niet gemeten worden in deze kleine groep, behalve antibioticaprofylaxe. Met de uitgebreide checklist werd de vraag over timing < 60 minuten bij 80% van de operaties gesteld, waarbij in zeven gevallen het verkeerde antibioticum en/of dosis werd gegeven. In de verkorte checklist werd de vraag geherformuleerd naar welk antibioticum en dosis er gegeven is. Deze vraag werd in 90% van de patiënten gesteld en er werden geen incorrectheden gevonden (Henderson, 2018).
Van Klei (2012) onderzocht het effect van implementatie van een aangepaste WHO SSC Checklist op mortaliteit in de Nederlandse setting. De resultaten hiervan zijn beschreven in de meta-analyse. Van Klei onderzocht ook in welke mate dit effect is gerelateerd aan checklist compliance. Het significante gecorrigeerde effect op mortaliteit was gerelateerd aan checklist compliance. Bij voltooiing van de gehele checklist was de OR 0,44 (95% BI 0,28 tot 0,70) voor mortaliteit, vergeleken met 1,09 (95% BI 0,78 tot 1,52) en 1,16 (95% BI 0,86 tot 1,56), respectievelijk bij gedeeltelijke voltooiing of helemaal geen gebruik van de checklist (van Klei, 2012).
De SURPASS studie van de Vries (2010) zoals hierboven beschreven, liet zien dat er een significant verschil was in het aantal complicaties voor patiënten waarbij de compleetheid van de checklist boven de mediaan was vergeleken bij patiënten waarbij dit op of onder de mediaan was. Het absolute risicoverschil tussen deze groepen was 11.7% (95% BI 7,9 tot 15,6).
Zoeken en selecteren
Om een deel van de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
“wat is het effect (van de verschillende onderdelen) van de time-out procedure in het peroperatieve traject aan de patiëntveiligheid en kwaliteit van zorg?”
P (Patiënten): alle patiënten die een operatie ondergaan;
I (Interventie): time-out procedure (elementen van time-out);
C (Comparison): geen time-out procedure (kan ook zijn vóór implementatie van time-out procedure);
O (Outcomes): mortaliteit, complicaties, operatieduur, geschat bloedverlies, kosten, verblijfsduur in het ziekenhuis.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en complicaties voor de besluitvorming cruciale uitkomstmaten en operatieduur, geschat bloedverlies, kosten, verblijfsduur in het ziekenhuis voor de besluitvorming belangrijke uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Tenzij anders vermeld werden de door de internationale GRADE-working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten. De werkgroep definieerde voor mortaliteit een absoluut risicoverschil van > 0,1% als een klinisch (patiënt) relevant verschil. De werkgroep definieerde een verschil van één dag in verblijfsduur op het ziekenhuis als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 26 juni 2018 met relevante zoektermen gezocht naar Engelstalige systematische reviews, gerandomiseerd gecontroleerd onderzoek en vergelijkend observationeel onderzoek over de time-out procedure vanaf het jaar 2000. De zoekverantwoording is weergegeven onder het tabblad “verantwoording”. De literatuurzoekactie leverde 544 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkend onderzoek (ten minste met een voor-na meting) waarbij de time-out procedure of een chirurgische checklist (waarvan de time-out procedure onderdeel was) werd onderzocht, en ten minste één van de door de werkgroep benoemde relevante uitkomstmaten. Op basis van titel en abstract werden in eerste instantie 89 studies voorgeselecteerd. Na deze selectie is ervoor gekozen om alleen studies uitgevoerd in Europa, USA, Australië of Nieuw Zeeland te includeren. Na raadpleging van de volledige tekst, werden vervolgens 78 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en elf studies definitief geselecteerd.
Acht onderzoeken, waarvan drie systematische literatuurreviews, zijn opgenomen in de literatuuranalyse, waar nodig is extra informatie uit de losse studies geraadpleegd. Aanvullend zijn nog drie extra artikelen opgenomen in de beschrijvende literatuursamenvatting over de relatie tussen adequate implementatie van een chirurgische checklist en relevante uitkomsten voor de patiënt of efficiëntie van het operatieproces. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Abbott TEF, Ahmad T, Phull MK, Fowler AJ, Hewson R, Biccard BM, Chew MS, Gillies M, Pearse RM; International Surgical Outcomes Study (ISOS) group. The surgical safety checklist and patient outcomes after surgery: a prospective observational cohort study, systematic review and meta-analysis. Br J Anaesth. 2018 Jan;120(1):146-155. doi: 10.1016/j.bja.2017.08.002. Epub 2017 Nov 23. PubMed PMID: 29397122.
- de Jager E, McKenna C, Bartlett L, Gunnarsson R, Ho YH. Postoperative Adverse Events Inconsistently Improved by the World Health Organization Surgical Safety Checklist: A Systematic Literature Review of 25 Studies. World J Surg. 2016 Aug;40(8):1842-58. doi: 10.1007/s00268-016-3519-9. Review. PubMed PMID: 27125680; PubMed Central PMCID: PMC4943979.
- Bergs J, Hellings J, Cleemput I, Zurel Ö, De Troyer V, Van Hiel M, Demeere JL, Claeys D, Vandijck D. Systematic review and meta-analysis of the effect of the World Health Organization surgical safety checklist on postoperative complications. Br J Surg. 2014 Feb;101(3):150-8. doi: 10.1002/bjs.9381. Review. PubMed PMID: 24469615.
- Bock M, Fanolla A, Segur-Cabanac I, Auricchio F, Melani C, Girardi F, Meier H, Pycha A. A Comparative Effectiveness Analysis of the Implementation of Surgical Safety Checklists in a Tertiary Care Hospital. JAMA Surg. 2016 Jul 1;151(7):639-46. doi: 10.1001/jamasurg.2015.5490. PubMed PMID: 26842760.
- de Vries EN, Prins HA, Crolla RM, den Outer AJ, van Andel G, van Helden SH, Schlack WS, van Putten MA, Gouma DJ, Dijkgraaf MG, Smorenburg SM, Boermeester MA; SURPASS Collaborative Group. Effect of a comprehensive surgical safety system on patient outcomes. N Engl J Med. 2010 Nov 11;363(20):1928-37. doi:10.1056/NEJMsa0911535. PubMed PMID: 21067384.
- Haynes AB, Edmondson L, Lipsitz SR, Molina G, Neville BA, Singer SJ, Moonan AT, Childers AK, Foster R, Gibbons LR, Gawande AA, Berry WR. Mortality Trends After a Voluntary Checklist-based Surgical Safety Collaborative. Ann Surg. 2017 Dec;266(6):923-929. doi: 10.1097/SLA.0000000000002249. PubMed PMID: 29140848.
- Papaconstantinou HT, Smythe WR, Reznik SI, Sibbitt S, Wehbe-Janek H. Surgical safety checklist and operating room efficiency: results from a large multispecialty tertiary care hospital. Am J Surg. 2013 Dec;206(6):853-9; discussion 859-60. doi: 10.1016/j.amjsurg.2013.08.016. Epub 2013 Oct 8. PubMed PMID: 24112671.
- Zingiryan A, Paruch JL, Osler TM, Hyman NH. Implementation of the surgical safety checklist at a tertiary academic center: Impact on safety culture and patient outcomes. Am J Surg. 2017 Aug;214(2):193-197. doi:10.1016/j.amjsurg.2016.10.027. Epub 2016 Nov 30. PubMed PMID: 28215964.
- Haugen AS, Wæhle HV, Almeland SK, Harthug S, Sevdalis N, Eide GE, Nortvedt MW, Smith I, Søfteland E. Causal Analysis of World Health Organization’s Surgical Safety Checklist Implementation Quality and Impact on Care Processes and Patient Outcomes: Secondary Analysis From a Large Stepped Wedge Cluster Randomized Controlled Trial in Norway. Ann Surg. 2017 Nov 6. doi:10.1097/SLA.0000000000002584. (Epub ahead of print) PubMed PMID: 29112512.
- Anderson KT, Bartz-Kurycki MA, Masada KM, Abraham JE, Wang J, Kawaguchi AL, Austin MT, Kao LS, Lally KP, Tsao K. Decreasing intraoperative delays with meaningful use of the surgical safety checklist. Surgery. 2018 Feb;163(2):259-263. doi: 10.1016/j.surg.2017.08.009. Epub 2017 Nov 10. PubMed PMID: 29129363.
- Henderson J, Fung T, Bhatt J, Bdesha A. A simplified WHO checklist improves compliance and time efficiency for urological surgery. British Journal of Medical and Surgical Urology. 2012 Aug;5, 120-127. doi:10.1016/j.bjmsu.2011.08.003
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is het effect (van de verschillende onderdelen) van de time-out procedure in het peroperatieve traject aan de patiëntveiligheid en kwaliteit van zorg?
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Research question: Wat is het effect (van de verschillende onderdelen) van de time-out procedure in het peroperatieve traject aan de patiëntveiligheid en kwaliteit van zorg?
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Wat is het effect (van de verschillende onderdelen) van de time-out procedure in het peroperatieve traject aan de patiëntveiligheid en kwaliteit van zorg?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Abbott, 2018 |
Yes |
Yes |
No |
Yes |
No |
Yes |
Yes |
Yes |
Yes |
|
De Jager, 2016 |
Yes |
Yes |
No |
Yes |
No |
Yes |
NA |
No |
No |
|
Bergs, 2014 |
Yes |
Yes |
No |
Yes |
No |
No |
Yes |
No |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question: Wat is het effect (van de verschillende onderdelen) van de time-out procedure in het peroperatieve traject aan de patiëntveiligheid en kwaliteit van zorg?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Abbott, 2018 (ISOS cohort study) |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
De Vries, 2010 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Bock, 2016 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Haynes, 2017 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Zingiryan, 2017 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Papaconstantinou, 2013 |
Unlikely |
Unlikely |
Unlikely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
van Schoten, 2014 |
Gaat alleen over compliance |
|
de vries 2012 |
Geen vergelijkend onderzoek |
|
Russ, 2015 |
Geen vergelijkend onderzoek |
|
Sparks, 2013 |
Gaat alleen over compliance (en associatie met operatietijd, starttijd en voorbereidingstijd), zit in review Wangoo |
|
Wangoo 2017 |
Gaat alleen over attitudes en compliance |
|
Rosenberg, 2012 |
Te specifiek: office based in plastische chirurgie checklist |
|
Corley 2014 |
Geen origineel onderzoek: beschrijvend stuk en case report |
|
Haugen 2013 |
Over effect op cultuur en compliance |
|
Lepänluoma 2015 |
DUBBEL |
|
Ong, 2016 |
Alleen over compliance |
|
Rothman 2016 |
Elektronische forced function time-out, niet relevant. |
|
Weingessel 2017 |
Geen vergelijkend onderzoek |
|
Lagoo 2017 |
pediatric SSC, narratieve evidence synthese |
|
Tang 2014 |
Niet bruikbare SR: te weinig info per studie |
|
Patel 2014 |
SR over implementatie van SSC |
|
Gillespie 2014 |
Overlap met andere syst reviews |
|
Lyons 2014 |
Niet bruikbare review en meta-analyses, niet volledige data gepresenteerd en veel overlap met andere reviews |
|
Treadwell 2014 |
Niet bruikbare review, veel verschillende (niet vergelijkende onderzoeks designs) |
|
Bergs 2014 |
Relevante meta-analyse, echter gedateerd, overlapt grotendeels met Abbott 2018 |
|
Russ 2013 |
Outcomes: Teamwork and Communication, niet geprioriteerd |
|
Fudickar 2012 |
Te oude syst review, recentere beschikbaar |
|
Borchard 2012 |
Te oude syst review, recentere beschikbaar |
|
Ko 2011 |
Gedateerde syst review, enkel over acute setting |
|
Boyd 2017 |
Systematische review: te brede definitie van interventie: allerlei soorten checklists, niet alleen time-out |
|
Singh 2013 |
Guideline |
|
Yu, 2017 |
Mainly on motivation and Chinese setting |
|
Haynes, 2009 |
Zit in review abbott en/of de jager |
|
Erestam 2017 |
Geen relevante uitkomsten |
|
Wang 2014 |
Comment on.. |
|
Haugen 2015 |
Zit in review abbott en/of de jager |
|
Fourcade, 2012 |
Gaat over compliance en barrières voor implementatie |
|
Weiser, 2010 |
Zit in review abbott en/of de jager |
|
Pucher, 2014 |
Gaat niet over time-out |
|
Lee, 2012 |
Geen vergelijkende studie, ook geen voor-na meting |
|
Pucher, 2015 |
Geen vergelijkend onderzoek |
|
Lepänluoma 2015 |
Zit in review abbott en/of de jager |
|
Jammer, 2015 |
Zit in review abbott en/of de jager |
|
Boaz 2014 |
Zit in review abbott en/of de jager |
|
Urbach 2014 |
Zit in review abbott en/of de jager |
|
Mastracci 2013 |
Comment on.. |
|
Panesar, 2011 |
Retrospectief onderzoek over voorkombaarheid van wrong site surgery |
|
Wieser, 2018 |
Beschrijvend artikel, geen origineel onderzoek |
|
Vargas 2018 |
Correspondence, geen origineel onderzoek |
|
Pysyk 2018 |
Letter to the editor |
|
Rodrigo 2015 |
Zit in review abbott en/of de jager |
|
Watters 2017 |
Editorial |
|
Vogel 2017 |
Column/letter to the editor |
|
Mccarthy 2017 |
Geen origineel onderzoek: nieuwsitem |
|
Jackson 2015 |
Congress abstract |
|
Hey 2016 |
Beschrijvend artikel, geen origineel onderzoek |
|
Cabral 2016 |
Outcomes: communication, teamwork and safety culture perceptie niet geprioriteerd |
|
Berry 2016 |
Comment on.. |
|
Wyrick 2015 |
Geen relevante uitkomsten, erg specifieke doelgroep |
|
Whitakcker 2015 |
Correspondence, geen origineel onderzoek |
|
Smith 2015 |
Comment on.. |
|
Ranganathan 2015 |
Correspondence, geen origineel onderzoek |
|
Haynes, 2015 |
Comment on.. |
|
Cahill 2015 |
Correspondence, geen origineel onderzoek |
|
vandijck 2014 |
Beschrijvend artikel, geen origineel onderzoek |
|
Porter 2014 |
Gaat alleen over compliance per teammember van een preprocedural pause (time-out) |
|
Ladak 2014 |
Comment on.. |
|
Gugliemli 2014 |
Column |
|
Papaconstantinou 2013 |
Geen relevante uitkomsten |
|
Lubbecke 2013 |
Zit in review abbott en/of de jager |
|
Calland 2013 |
Comment on.. |
|
Bliss 2012 |
Zit in review abbott en/of de jager |
|
Anonymous 2013 |
Editorial |
|
Anonymous 2013 |
Editorial |
|
Oszvald 2012 |
Zit in review abbott en/of de jager |
|
Hayes 2012 |
Beschrijvend artikel, geen origineel onderzoek |
|
Haynes, 2011 |
Geen relevante uitkomsten |
|
Merry 2010 |
Editorial |
|
Birkmeyer 2010 |
Editorial |
|
Sax 2009 |
Beschrijvend artikel, geen origineel onderzoek |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-07-2020
Beoordeeld op geldigheid : 02-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Anesthesiologie en de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Anesthesiologie en de Nederlandse Vereniging voor Heelkunde zijn beide regiehouder van deze richtlijnen eerstverantwoordelijken op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Stap 6. Aankomst op operatiekamer |
NVvH en NVA |
2020 |
2025 |
Elke 5 jaar |
NVvH en NVA |
NVvH en NVA |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn beoogt het bevorderen van veilige zorg rondom alle perioperatieve trajecten (interventies waarbij anesthesiologische zorg gegeven wordt), waarbij de patiënt die dit traject doorloopt centraal staat. Het doel van de richtlijn is het optimaal laten verlopen van het pre-, per- en postoperatieve traject van de patiënt. De focus van de richtlijn is patiëntveiligheid en de inrichting en afstemming van het perioperatief traject.
Doelgroep
Deze richtlijn is geschreven voor leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten die een interventie moeten ondergaan waarbij anesthesiologische zorg gegeven wordt.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor patiënten die een interventie moeten ondergaan waarbij anesthesiologische zorg gegeven wordt.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. P.M.N.Y.H. Go, algemeen chirurg, werkzaam in het Sint Antonius ziekenhuis te Nieuwegein, NVvH (voorzitter)
- Prof. Dr. L. P.H.J. Aarts, anesthesioloog, werkzaam in het Leids Universitair Medisch Centrum, NVA (voorzitter)
- Dr. M.C.O. van den Nieuwenhuyzen, anesthesioloog, werkzaam in het Ikazia ziekenhuis te Rotterdam, NVA
- Dr. M.J. van der Laan, vaatchirurg, werkzaam in het Universitair Medisch Centrum te Groningen en Ommelander Ziekenhuis te Groningen, NVvH
- R. Kranenburg/ R. Lammers/ K. Spijkers, beleidsmedewerker, Patiëntenfederatie Nederland
- Dr. R.A.F. de Lind van Wijngaarden, Cardio-thoracaal chirurg, werkzaam in het Leids Universitair Medisch Centrum, NVT
- Dr. J.H. Becker, gynaecoloog, werkzaam in het Sint Antonius ziekenhuis te Nieuwegein, NVOG
- Drs. R.C.M. Maatman, oogarts, werkzaam in het Alrijne ziekenhuis, NOG
- Drs. F.H.J. van Loon, anesthesiemedewerker, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVAM
- Dr. J. Th. Schmidt, kno-arts, werkzaam in het Ziekenhuis Amstelland, NVKNO
- Dr. N. Kort, orthopedisch chirurg, CortoClinics te Schijndel, NOV
- Drs. I.H. Hoekstra, uroloog, werkzaam in het Diakonessenhuis, NVU
- Drs. R. de Boer, neurochirurg, werkzaam in het Leids Universitair Medisch Centrum en Spaarnegasthuis, NVvN
- N. Dreessen, kwaliteitsfunctionaris, werkzaam in het Zuyderland MC te Heerlen/ Geleen, LVvO
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. M. Pols, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Overige stakeholders
Overige beroepsgroepen en stakeholders zijn op meerdere momenten betrokken geweest bij het richtlijnontwikkeltraject. Bij aanvang van het traject is er een knelpunteninventarisatie uitgevoerd, zoals hieronder beschreven. Voorafgaand aan de commentaarfase heeft er een tweede invitational conference plaatsgevonden om over de voorlopige inhoud van de richtlijn te discussiëren. Hierbij is input verkregen van de overige stakeholders over de belangrijkste wijzigingen ten opzichte van de vorige richtlijnen en zijn missende onderwerpen besproken (zie verslag van deze bijeenkomst in aanverwant product).
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
R. Kranenburg/ R. Lammers/ K. Spijkers |
Beleidsmedewerker(s) Patiëntenfederatie Nederland |
Geen |
Geen |
Geen actie |
|
R. de Lind van Wijngaarden |
Cardio-thoracaal chirurg, Leids Universitair Medisch Centrum |
-Commissie Interne Audit LUMC, onbetaald. |
Geen |
Geen actie |
|
R. van Loon |
Klinisch epidemioloog/ anesthesiemedewerker |
-Bestuurslid, aandachtsgebied onderwijs |
Geen |
Geen actie |
|
J. Schmidt |
KNO Arts Amstelland ziekenhuis |
Geen |
Geen |
Geen actie |
|
M. Maatman |
Oogarts in Alrijne |
-Lid bestuur oogheelkunde Sporadisch adviescommissie -Bayer / Eylea laatste keer was in december 2016 |
Geen |
Geen actie |
|
N. Dreessen |
Kwaliteitsfunctionaris Zuyderland MC |
Bestuurslid LVO (onbetaald) |
Geen |
Geen actie |
|
M. Nieuwenhuyzen |
Anesthesioloog Ikazia Ziekenhuis en Centrum voor bijzondere tandheelkunde Midden Brabant, plaatsvervangend opleider |
Geen |
Geen |
Geen actie |
|
P. Go |
Chirurg st. Antonius ziekenhuis Nieuwegein |
Voorzitter medische staf, vergoeding ziekenhuis |
Geen |
Geen actie |
|
N. Kort |
Orthopedisch chirurg CortoClinics, Schijndel (privékliniek voor heup en knieprothesiologie)
|
Betaald: |
Geen |
Geen actie |
|
L. Aarts |
Afdelingshoofd Anesthesiologie LUMC |
Geen betaalde nevenfuncties |
Geen |
Geen actie |
|
M. van der Laan |
Vaatchirurg, UMCG, Groningen |
Geen |
Geen |
Geen actie |
|
J. Becker |
Gynaecoloog |
Medisch hoofd afdeling Geboortezorg St Antonius ziekenhuis Lid commissie kwaliteitsdocumenten NVOG Voorzitter beroepsbelangen commissie NVOG |
Geen |
Geen actie |
|
R. de Boer |
Neurochirurg LUMC en Spaarnegasthuis |
Geen |
Geen |
Geen actie |
|
I. Hoekstra |
Uroloog, werkgever MSBD (Maatschap Diakonessenhuis Utrecht); tot 1 juli 2018 daarna gepensioneerd |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de werkgroep en een patiënten-enquête. Het rapport hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de NVvH, NVA, NVVC, IGJ, NVKG, NVKF, NVDK, KNMP, NOV, Patiëntenfederatie Nederland, NVvP, NVVR, BRV, NVT, VHIG, V&VN, NVZA, NVZ, NVK, NVAM, NFU, NVKNO, LVO, NAPA, NVIC, NVU, NOG, Zorginstituut Nederland via een enquête en een invitational conference. Een aparte patiënten-enquête is afgenomen door Patiëntenfederatie Nederland. Een verslag van de enquêtes en invitational conference is opgenomen onder aanverwante producten. In de eerste fase van het richtlijnontwikkeltraject is een vertegenwoordiger van de IGJ eenmalig bij de werkgroepvergadering geweest om een aantal knelpunten toe te lichten vanuit het perspectief van de IGJ.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module met algemene uitgangspunten.
Indicatorontwikkeling
Er werden geen nieuwe kwaliteitsindicatoren ontwikkeld voor de herziening van deze richtlijn. De werkgroep stelt voor de bestaande indicator uit de Basisset Medisch Specialistische Zorg, 2019 (1.1.3. Indicator Time-out, percentage juist uitgevoerde stopmomenten) te handhaven. De time-out blijft het belangrijkste stopmoment in het perioperatieve traject.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Deze kennislacunes worden vermeld in de aanverwante producten bij de modules.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de relevante (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – juni 2018
|
1 exp General Surgery/ or exp Preoperative Care/ or exp Intraoperative Care/ or exp Operating Rooms/ or exp Nursing/ or pre?operative.ti,ab. or preoperative.ti,ab. or pre operative.ti,ab. or per?operative.ti,ab. or peroperative.ti,ab. or per operative.ti,ab. or (operating and (room? or thea*)).ti,ab. or surg*.ti,ab. (2090222) 2 (time-out or timeout or surpass or surgical safety system or (checklist* adj3 (surg* or safety or who or world health organization))).ti. (994) 3 1 and 2 (526) 4 limit 3 to (english language and yr="2000 -Current") (478)
= 478 |
544 |
|
Embase (Elsevier) |
('surgery'/exp OR 'preoperative care'/exp OR 'peroperative care'/exp OR 'operating room'/exp OR 'nursing'/exp OR pre?operative:ti,ab OR preoperative:ti,ab OR 'pre operative':ti,ab OR per?operative:ti,ab OR peroperative:ti,ab OR 'per operative':ti,ab OR (operating:ti,ab AND (room?:ti,ab OR thea*:ti,ab)) OR surg*:ti,ab) AND ('time-out':ti OR timeout:ti OR surpass:ti OR 'surgical safety system':ti OR ((checklist* NEAR/3 (surg* OR safety OR who OR 'world health organization')):ti)) AND (2000-2018)/py AND (english)/lim NOT 'conference abstract':it
= 487 |

