Stap 4: Opname in het perioperatief traject
Uitgangsvraag
- Wat dient er tijdens de preoperatieve opname geregeld te worden en waarom?
- Welke informatie moet er tijdens de preoperatieve opname uitgevraagd en/of gedeeld en vastgelegd worden om de veiligheid van de patiënt perioperatief te bewaken/vergroten?
- Wie is waarvoor verantwoordelijk tijdens de preoperatieve opname?
De uitgangsvraag omvat de volgende deelvraag:
- Draagt een dagbriefing met het hele operatieteam voorafgaand aan het dagprogramma binnen het perioperatief traject bij aan het optimaliseren van de patiëntveiligheid en de organisatie van zorg? Zo ja, hoe dient deze ingebed en georganiseerd te worden?
Aanbeveling
4.1 Bij opname
Controleer minimaal de volgende informatie en leg dit vast in het dossier:
- Identiteit bepaald en naambandje aangebracht.
- Type operatie.
- Gezondheidstoestand patiënt.
- Medicatieverificatie uitgevoerd.
- Beleid rondom antistolling volgens afspraak uitgevoerd.
- Premedicatie gegeven volgens afspraak.
- Afspraken met betrekking tot voorbereiding, peroperatieve bijzonderheden en nazorg.
Verantwoordelijk: operateur
4.2 Voor het bestellen van de patiënt
Operatieassistent controleert de volgende benodigdheden en legt dit vast in het dossier:
- Implantaat/prothese.
- Apparatuur en instrumentarium.
Verantwoordelijk: operateur
4.3 Markeren
Markering van de operatieplaats vindt plaats door operateur (of gedelegeerde) en met watervaste stift.
Plaats de markering voordat de patiënt naar de operatiekamer gaat, indien markering geïndiceerd is.
Verantwoordelijk: operateur
4.4 STOPMOMENT III
Controleer na opname van de patiënt en vóór stopmoment IV(a) of alle preoperatieve afspraken zijn uitgevoerd en er geen veranderingen zijn opgetreden in de
gezondheidstoestand van de patiënt sinds de preoperatieve evaluatie.
Verantwoordelijk: operateur
Wat zijn de wijzigingen in deze stap ten opzichte van de vorige richtlijn?
- Er is een literatuuranalyse voor dagbriefing uitgevoerd, echter onvoldoende bewijs om hier een aanbeveling over op te nemen in de richtlijn.
- Controle stollingsstatus is toegevoegd.
- Controle verpleegkundige info is aangepast.
- Er is explicieter aandacht voor markering voordat de patiënt naar de operatiekamer gaat (dus uiterlijk op de holding).
Overwegingen
Stap vier dient tijdig voor de operatie uitgevoerd te worden. Het gaat hierbij om vroege signalering van onvolkomenheden op zowel opnameafdeling als operatieafdeling. Op deze manier kan correctie nog plaats vinden vóór de start van de operatie zonder dat hierdoor vertraging in het rooster ontstaat.
Op basis van de huidige literatuuranalyse is echter onvoldoende bewijs dat het invoeren van een dagbriefing leidt tot minder complicaties, een beter teamklimaat en minder vertraging en onderbrekingen. De onderzochte studies tonen wel een potentieel voor de toekomst. De werkgroep heeft daarom de dagbriefing niet als verplichting toegevoegd aan het operatief traject.
Het is vereist om, voorafgaand aan het bestellen van de patiënt, de patiënt- en operatiegegevens te verifiëren op zowel de afdeling als op het operatiecomplex.
Een belangrijk onderdeel binnen dit verificatieproces is het markeren van de operatieplek. Dit is van belang om zijde- of locatieverwisseling bij operaties te voorkomen. Voordat de patiënt naar de operatiekamer gaat moet de markering zijn gezet met watervaste stift, indien markering geïndiceerd is. De belangrijkste argumenten voor de timing van de markering zijn dat er op deze manier een extra controlemoment is ingebouwd en dat er minder spanning is op de afdeling of holding vergeleken met de operatiekamer.
Onderbouwing
Achtergrond
Vanaf opname op de afdeling tot aankomst van de patiënt op de operatiekamer worden er meermaals door verscheidene zorgverleners patiëntengegevens geverifieerd. Zowel door de verpleegkundige op de afdeling, als door het team op de operatiekamer worden voorbereidingen getroffen. Het is zaak om in deze fase tijdig onvolkomenheden te signaleren zodat hiervoor een oplossing kan worden gevonden. Een gestandaardiseerde methode van analyse en documentatie van dit proces ontbreekt op dit moment.
Een dagbriefing wordt uitgevoerd met het gehele operatieteam voorafgaand aan de start van het operatieprogramma, waarbij de geplande ingrepen en patiënten kort worden doorgesproken. Men richt zich tijdens de dagbriefing enerzijds op de specifieke benodigdheden (instrumenten, apparaten, materialen, disciplines, et cetera), en anderzijds op patiëntgebonden factoren (medische voorgeschiedenis, chirurgisch/ anesthesiologisch behandelplan, aandachtspunten, et cetera). Mogelijkerwijs beïnvloedt een dergelijke dagbriefing de kwaliteit van zorg in positieve mate.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onzeker of een dagstart geassocieerd is met minder peroperatieve incidenten vergeleken met geen of een incomplete dagstart.
Bronnen: (Phadnis, 2018) |
|
Zeer laag GRADE |
Het is onzeker of het invoeren van een dagstart het teamklimaat van een operatieteam verbetert op korte termijn of lange termijn vergeleken met geen dagstart.
Bronnen: (Leung, 2017) |
|
Zeer laag GRADE |
Het is onzeker of een dagstart zorgt voor minder vertraging op een operatiedag vergeleken met geen dagstart.
Bronnen: (Jain, 2015) |
|
Zeer laag GRADE |
Het is onzeker of een dagstart zorgt voor minder onderbrekingen rondom een operatie vergeleken met geen dagstart.
Bronnen: (Jain, 2015) |
|
Zeer laag GRADE |
Het is onzeker of een dagstart zorgt voor geen vertraging in de starttijd van de operatiedag vergeleken met geen dagstart.
Bronnen: (Ali, 2011) |
Samenvatting literatuur
Beschrijving studies en resultaten
Incidenten
Phadnis (2018) beschrijft een prospectieve case-control studie waarin de associatie tussen een dagstart (preoperatieve briefings) en intraoperatieve kleine en (potentieel) grotere nadelige voorvallen is onderzocht in twee fasen. Tijdens de teambriefing dienden de onderwerpen besproken te worden: introductie, personeel, pauzes, en het bespreken van een aantal onderwerpen per patiënt (volgorde, naam, procedure, zijde, positie, antibiotica, bijzonderheden rond anesthesie, chirurgische benodigdheden, tourniquet en röntgenfoto). Tijdens fase 1 werden gedurende twee weken 41 operatie-lijsten (trauma en orthopedisch) prospectief ge-audit door middel van observatie en vragenlijsten. Er werd geregistreerd of de dagbriefings adequaat, gedeeltelijk adequaat of inadequaat/niet werden uitgevoerd. Verschillen in nadelige incidenten werden gerapporteerd, (patiënt-gerelateerd, overdracht-gerelateerd, instrument gerelateerd, stafgerelateerd, anesthesiegerelateerd, misverstand in de volgorde van de operatielijst, overige voorvallen). In fase 2, zes maanden na implementatie van fase 1, werd de interventie verbeterd (onder andere werd de dagstart verplicht gesteld) en in een nieuw cohort onderzocht met 47 operatielijsten gedurende twee weken.
Van de 41 operatielijsten in fase 1 werd er in 10 gevallen de dagstart goed uitgevoerd, 17 gevallen incompleet en 14 gevallen niet. Er waren geen peroperatieve nadelige incidenten in de groep met een dagstart, 13 in de groep met een incomplete dagstart en 24 in de groep zonder dagstart. Materiaal-gerelateerde incidenten werd het meest frequent gerapporteerd. Er werd een significante associatie gevonden tussen het niet of inadequaat uitvoeren van een dagstart en het voorkomen van peroperatieve nadelige incidenten vergeleken met situaties waarin er wel een adequate dagstart werd uitgevoerd. In deze case-control studie is er niet gecorrigeerd voor potentiële confounders. (Phadnis, 2018)
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint ‘laag’. De bewijskracht voor de uitkomstmaat incidenten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: niet representatieve steekproef en geen correctie voor potentiële confounders) en het geringe aantal patiënten en operatieteams (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Teamklimaat
Leong (2017) beschrijft een prospectieve interventiestudie bij vijf operatieteams in een Nederlands ziekenhuis met één meting vooraf aan de interventie (1 maand) en twee metingen na implementatie van de interventie (4 maanden en 2,5 jaar). De interventie bestond uit een dagstart (briefing) en debriefing. De briefing moest worden uitgevoerd met het hele operatieteam voordat de eerste patiënt arriveert in de operatiekamer, waarbij essentiële informatie werd gedeeld over: introductieronde, rolverdeling teamleden en verwachte technische en logistieke issues waarbij extra aandacht nodig is. Bij de debriefing aan het einde van de dag werd het werk van de dag besproken, zowel positieve als problematische dingen. Er is dan ruimte om ervaringen te delen en suggesties voor verbetering te geven gerelateerd aan de kwaliteit en veiligheid van de perioperatieve zorg. De primaire uitkomstmaat was teamklimaat (gemeten met de Team Climate Inventory (TCI) vragenlijst), secundair werden ervaringen over efficiëntie (zonder baseline meting) en de duur van de (de)briefings gemeten, dit was minder dan vier minuten.
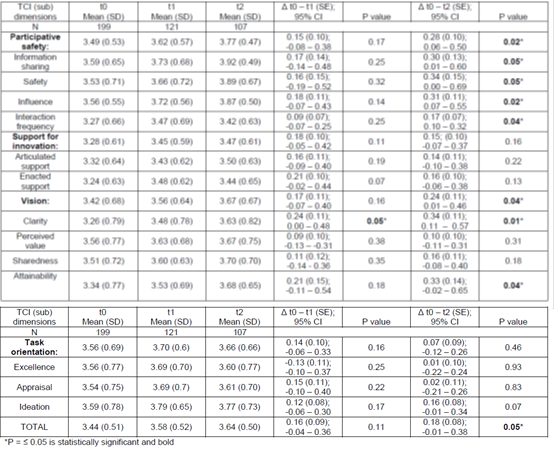
De TCI evalueert vier dimensies: participatieve veiligheid, support voor innovatie, visie en taakoriëntatie op een 5-punts Likertschaal. De TCI werd één maand voor implementatie en vier maanden en 2,5 jaar na de implementatie van de dagstart en debriefing afgenomen.
Vier maanden na implementatie was er geen significante verbetering in teamklimaat, behalve in de dimensie visie (0,24; 95% Betrouwbaarheidsinterval (BI) 0 tot 0,48; p=0,05).
2,5 jaar na de implementatie was er een net niet significante verbetering in de totale TCI score (0,18; 95% BI −0,01 tot 0,38; p=0,05). Met name de dimensies participatieve veiligheid en visie verbeterden, respectievelijk met 0,28 (95% BI 0,06 tot −0,50) p=0,02 en 0,24 (95% BI 0,01 tot 0,46), p=0,04.
Er is niet vermeld of er andere verbeterprojecten op het gebied van kwaliteit liepen tijdens de lange follow-up periode van 2,5 jaar. Er is niet gecorrigeerd voor potentiële confounders. (Leung, 2017)
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint ‘laag’. De bewijskracht voor de uitkomstmaat teamklimaat is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: lage respons op vragenlijst, geen correctie voor potentiële confounders en voor-na studie opzet zonder controlegroep), indirectheid doordat de interventie bestond uit een dagstart én debriefing en het geringe aantal patiënten en operatieteams (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Vertragingen en onderbrekingen
Jain (2015) beschrijft een retrospectieve pilot voor een kwaliteitsverbeterproject met een dagelijkse dagstart (preoperatieve huddle) op een orthopedie afdeling voor 19 operatiedagen met 62 patiënten. Bij de dagstart dient per patiënt besproken te worden de naam en leeftijd van de patiënt, geplande procedure, zijde, positie, tourniquet, essentiële instrumenten, röntgenfoto, antibiotica, zenuwblokkades, verwacht bloedverlies, verwachte duur van de procedure, noodzaak postoperatieve immobilisatie, speciale omstandigheden en vragen. De belangrijkste uitkomsten waren onderbrekingen en vertragingen. Uitkomsten werden op baseline (19 operatiedagen, met 65 patiënten) en na implementatie van de dagstart implementatie gemeten. Een dagstart duurde gemiddeld 3,18 minuten.
Jain (2015) rapporteerde over onverwachte vertragingen tussen operaties, de dagflow werd met een score tussen de 1 tot 10 beoordeeld door de operateur. Voor implementatie van de dagstart was de gemiddelde flow 5,6, na implementatie was deze significant hoger met 8,2, p<0,01.Op de 19 operatiedagen voor implementatie waren er in totaal 19 onverwachte vertragingen, dit waren er na implementatie 4, ook op 19 operatiedagen.
Jain (2015) rapporteerde over onderbrekingen rondom de operatie, gedefinieerd als vragen rondom de operatie, die anders tijdens de dagstart zouden moeten worden gesteld. Het aantal onderbrekingen voor implementatie van de dagstart was 163 op 19 operatiedagen en 35 op 19 operatiedagen na de implementatie. Het aantal vragen per patiënt buiten de dagstart om daalde van 2,5 naar 0,6 vraag per patiënt. Er is geen statistische analyse gerapporteerd over dit verschil. (Jain, 2015)
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint ‘laag’. De bewijskracht voor de uitkomstmaat vertraging en onderbrekingen is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen correctie voor potentiële confounders en voor-na studie opzet zonder controlegroep) en het geringe aantal patiënten en operatieteams (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Starttijd operatie
Ali (2011) beschrijft een prospectieve interventiestudie waarbij een dagstart (briefing) als onderdeel van het gehele WHO National Patient Safety Agency 5-punten proces (briefing, sign-in voor toediening anesthesie, time-out, sign-out, debriefing) werd geïmplementeerd in twee ziekenhuizen. De dagstart werd uitgevoerd voor het starten van de operatielijst en duurde 5 tot 10 minuten. De dagstart dient te beginnen met een teamintroductie, operatielijst volgorde en op een gestructureerde manier dient per patiënt de co-morbiditeiten, operatie, positie, benodigde materialen en de operatielijst volgorde te worden besproken. De uitkomsten starttijd van de operatielijst in 27 operatielijsten voor implementatie en 34 operatielijsten na operatie. Tevredenheid van personeel over de dagstart werd onderzocht, zonder voormeting. (Ali, 2011)
Ali (2011) verzamelde data over de vertraging in starttijd ten opzichte van de operatielijst (gedefinieerd als de tijd in minuten die afwijkt van de geplande starttijd tot de anesthesie starttijd) voor en na implementatie van een dagstart. Er was geen significant verschil tussen de starttijden, met een gemiddeld verschil van 7,2 minuten, p=0,1. Zowel voor als na de implementatie was er vertraging in de starttijd van de operatie ten opzichte van de geplande tijd op de operatielijst, respectievelijk gemiddeld 30,7 (sd19,3) en 23,5 (sd 14,5) minuten, p=0,1. (Ali, 2011)
Bewijskracht van de literatuur
De bewijskracht voor observationele studies begint ‘laag’. De bewijskracht voor de uitkomstmaat vertraging in starttijd operatie is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: geen correctie voor potentiële confounders en voor-na studie opzet zonder controlegroep) en het geringe aantal patiënten en operatieteams (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Zoeken en selecteren
Om een deel van de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag :
Wat zijn de (on)gunstige effecten van een dagbriefing met het hele team vergeleken met geen dagbriefing voor de operatie op de patiëntveiligheid en organisatie van zorg?
P (Patiënten): alle patiënten die een operatie ondergaan;
I (Interventie): dagbriefing;
C (Comparison): geen dagbriefing;
O (Outcomes): complicaties, vertraging/onderbrekingen, operatietijd, (verminderde) werklast, communicatie/teamwork, efficiëntie.
Relevante uitkomstmaten
De werkgroep achtte complicaties een voor de besluitvorming kritieke uitkomstmaat; en vertragingen/onderbrekingen, operatietijd, (verminderde) werklast, communicatie/teamwork en efficiëntie voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Tenzij anders vermeld werden de door de internationale GRADE-working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 15 juni 2018 met relevante zoektermen gezocht naar Engelstalige systematische reviews, gerandomiseerd gecontroleerd onderzoek en vergelijkend observationeel onderzoek vanaf het jaar 2000 over dagbriefing. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 320 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: zowel patiëntenpopulatie, interventie, controle als uitkomst moest overeenkomen met bovenbeschreven PICO. Op basis van titel en abstract werden in eerste instantie 36 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 32 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Phadnis J, Templeton-Ward O. Inadequate Preoperative Team Briefings Lead to More Intraoperative Adverse Events. J Patient Saf. 2018 Jun;14(2):82-86. doi: 10.1097/PTS.0000000000000181. PubMed PMID: 25906404.
- Leung Y, Salfinger S, Mercer A. The positive impact of structured teaching in the operating room. Aust N Z J Obstet Gynaecol. 2015 Dec;55(6):601-5. doi:10.1111/ajo.12392. Epub 2015 Aug 19. PubMed PMID: 26287274.
- Jain AL, Jones KC, Simon J, Patterson MD. The impact of a daily pre-operative surgical huddle on interruptions, delays, and surgeon satisfaction in an orthopedic operating room: a prospective study. Patient Saf Surg. 2015 Feb 21;9:8. doi: 10.1186/s13037-015-0057-6. eCollection 2015. PubMed PMID: 25705257; PubMed Central PMCID: PMC4336479.
- Ali M, Osborne A, Bethune R, Pullyblank A. Preoperative surgical briefings do not delay operating room start times and are popular with surgical team members. J Patient Saf. 2011 Sep;7(3):139-43. doi: 10.1097/PTS.0b013e31822a9fbc. PubMed PMID: 21857241.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: Wat zijn de (on)gunstige effecten van een dagbriefing met het hele team vergeleken met geen dagbriefing voor de operatie op de patiëntveiligheid en organisatie van zorg?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Phadnis, 2018 |
Type of study: Prospective case-control study
Setting: Orthopedic surgery in one hospital
Country: UK
Source of funding: None reported |
Inclusion criteria: Phase 1: During a 2-week period, 41 trauma and orthopedic surgical lists were prospectively audited. The orthopedic registrar designated to be assisting in surgery within each list collected the data. This was performed without the knowledge of any of the other team members and recorded on a standardized electronic form.
Phase 2: a different cohort of registrars were asked to record the data using the same methodology as in phase 1, 6 months after the changes had been implemented.
Exclusion criteria: -
N total at baseline: Phase 1: Cases: 10 complete Control: 17 incomplete and 14 not completed
Phase 2: Cases: 38 completed Control: 8 incomplete and 5 not completed
Important prognostic factors2: Elective 31 (76%) Trauma 10 (24%) Main theater 30 (73%) Day stay unit 11 (27%) Half-day lists 32 (78%) Full-day lists 9 (22%) |
A complete briefing was defined as one where at a minimum, all key medical (lead surgeon and anesthetist) and nursing staff (most senior staff nurse) were present and the briefing included a team introduction and a discussion of the forthcoming list in a systematic manner.
|
An incomplete briefing was one where a briefing was performed but one or more of the criteria mentioned earlier was not met. Briefings were classified as “not performed at all” when no attempt at a formal briefing was made.
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Adverse intraoperative events: Complete briefing: Phase I: 0 Phase 2: 0
Incomplete briefing: Phase 2: 2
No briefing: Phase 2: 1
There was a statistically higher chance of an adverse event occurring when a briefing was not performed, as compared with when a briefing was performed completely (P ≤ 0.01) or when performed incompletely (P = 0.01).
No further analyses were perfomed
|
|
|
Leong, 2017 |
Type of study: Prospective intervention study without control group with stepped wedged implementation of the briefing/debriefing intervention
Setting: Five surgical teams representing seven surgical specialties: general surgery; orthopaedic surgery; gynaecological surgery; neurosurgery/plastic surgery; ear-nosethroat surgery/mouth-jaw-facial surgery in one hospital
Country: The Netherlands
Source of funding: None reported |
Inclusion criteria: Five surgical teams
Exclusion criteria: NA
N total at baseline: Everyone in the 5 surgical teams was invited to fill out the questionnaire on team climate (TCI). The TCI response rate before and after the implementation was 27.0% (184/681) and 16.4% (113/687), respectively.
Important prognostic factors2:
NA
|
Briefing and debriefing Briefing is carried out before the first patient arrives in the operating theatre. All the members of the surgical team share essential information for that day: introduction round, tasks of the team members and expected technical or logistical issues that require extra attention. The aims is to stimulate mutual support for the tasks that day and to immediately resolve the expected technical or logistical problems. (recorded duration <4 minutes)
Debriefing is carried out at the end of the surgical programme. All the members of the surgical team discuss the work of the day stating the positive as well as the problematic issues. Team members have the opportunity to mention their experiences but also to make suggestions for improvement related to the quality and safety of perioperative care. The aims is to identify lessons learnt shortly after the surgeries to improve team performance and the operation processes. |
Before implementation
|
Length of follow-up: 4 months and 2,5 year after implementation
Loss-to-follow-up: Everyone in the 5 surgical teams was invited to fill out the questionnaire on team climate (TCI). The TCI response rate before and after the implementation was 27.0% (184/681) and 16.4% (113/687), respectively.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Team Climate Inventory (questionnaire with 5-point Likert scale for 4 dimensions)
See table below |
Authors conclusion: Perioperative briefing and debriefing improved the team climate of surgical teams and the efficiency of their work within the operating theatre with acceptable duration per briefing. Surgical teams with alternating team compositions have the most benefit of briefing and debriefing.
Results on experiences of perceived efficiency not presented because this has no comparative design (no pre-post measures) |
|
Jain, 2015 |
Type of study: Retrospective pilot study without control group with measurements before and after implementation of the intervention
Setting: Orthopaedic surgery in one hospital (two camuses)
Country: USA
Source of funding: Grant support from the Agency for Healthcare Research and Quality |
Inclusion criteria: Otrhopedic surgery teammembers
Exclusion criteria: NA
N total at baseline: Pre-intervention: 19 surgery days, 65 case Post-Intervention (Huddles): 19 surgery days, 62 cases
Important prognostic factors2:
NA
|
Huddle: The huddle was led by the attending surgeon in the presence of the entire surgical team and was completed prior to the first case of the day. At least one representative person was present at each huddle from anesthesia and surgical nursing, as well as the orthopedic surgeon leading the huddle. Surgeons were given a template to follow for the huddle. The template was developed by the orthopaedic team as a checklist of eleven critical elements that needed to be considered prior to the start of the procedure. The template was small enough to be attached to the surgeon’s identification badge. In addition, surgeons were instructed on the proper way to perform a huddle by author (KJ). All cases for the entire day were discussed, sequentially, at the beginning of the day with the surgical team. The elements on the template were discussed in detail for each planned case and discussion among the team was encouraged by the orthopedic surgeon asking the staff if there were any further questions or concerns at the end of the huddle. The surgical team progressed through the day as usual. |
Before implementation
|
Length of follow-up: NA The 19 operating days were from 6 weeks.
Loss-to-follow-up: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Delay (day’s flow rated by surgeon 1-10): Before: 5.6 After: 8.2 Difference is sign Total unexpected delays: Before: 14 After: 5
Total number of interruptions (questions asked outside huddle): Before: 163 After: 35
Interruptions per case (questions per case) Before: 2.5 After: 0.6
|
Authors conclusion: In this pilot study, a daily pre-operative huddle improved the flow of a surgeon’s day and satisfaction and indirectly provided indications of safety benefits by decreasing the number of interruptions and delays. Further studies in other surgical specialties should be conducted due to the promising results. Data was collected from three orthopedic surgeons in this phase; however, as a next step, data should be drawn from the rest of the orthopedic surgical team and other surgical subspecialties as well |
|
Ali, 2011 |
Type of study: Prospective intervention study without control group with pre-and post intervention measurements
Setting: Two teaching hospitals
Country: UK
Source of funding: None reported
|
Inclusion criteria: 2 elective general surgery theaters, 1 elective vascular surgery, and 1 elective gynecology theater. The safety briefings were regularly observed in these theaters.
Exclusion criteria: Other operating theaters in the hospital not observing safety briefings were excluded from the study.
N total: Before implementation: 27 operating lists in 4 operating theaters during a 2-month period
After implementation: 34 operating lists during 2 months involving the same surgeons and operating theaters.
Important prognostic factors2: There was no difference in the numbers of theater staff (median, 8; range, 7-9 in both groups). |
Preoperative safety briefing: The safety briefing consisted of a 5- to 10-minute meeting in the anesthetic room before the arrival of the first patient on the operating list and included a structured discussion based on the patients’ comorbidity, operation, patient position, equipment required, and the operating list order with the following items: Introduce team members, Planned procedures, Equipment sterility, Position of the patient, Imaging required and when Patient issues including blood loss/airway/monitoring Infection/allergies Reconfirm list order, if changed, inform ward |
Before implementation
|
Length of follow-up: NA
Loss-to-follow-up: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Time to Start of Operating List in minutes Before: Mean 30.7 (sd 19.3) (range 2-77) After: Mean 23.5 (sd 14.5) (range 0-56)
MD: 7.2; p=0.1 |
Authors conclusion: The safety briefings were popular among staff and did not delay the operating theater start time. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Tabel uit Leong 2017; Effect of the perioperative briefing and debriefing on the team climate of 5 surgical teams
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question: Wat zijn de (on)gunstige effecten van een dagbriefing met het hele team vergeleken met geen dagbriefing voor de operatie op de patiëntveiligheid en organisatie van zorg?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Phadnis, 2018 |
Likely |
Unlikely |
Unlikely |
Likely |
|
Leong, 2017 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Jain, 2015 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Ali, 2011 |
Unlikely |
Unlikely |
Unlikely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Glymph 2015 |
Onduidelijke systematische literatuur review, beschrijvend en niet alle studies lijken daadwerkelijk over een dagstart te gaan. |
|
Khoshbin 2009 |
Geen relevante uitkomst: enkel compliance en veiligheidsgevoel (zonder baselinemeting) |
|
Chan 2018 |
Gaat wel over een huddle/dagstart, maar niet preoperatief, maar op de afdeling, veelal over onderwerpen zoals ontslag en postoperatieve issues |
|
Townsend 2017 |
Gaat wel over een huddle/dagstart, maar niet preoperatief, maar op de verpleeg/chirurgie afdeling, veelal over onderwerpen zoals ontslag en postoperatieve issues |
|
Paull 2010 |
Geen dagstart: gaat om time out en sign out per patiënt |
|
Allard 2011 |
Geen dagstart (is erg onduidelijk beschreven in artikel). Er lijkt geen baselinemeting te zijn gedaan, dus geen vergelijkend onderzoek. |
|
McQuaid-Hanson 2017 |
Geen origineel onderzoek |
|
Bandari 2012 |
Geen dagstart: gaat om time out en sign out per patiënt |
|
Anderson 2018 |
Educatie initiatief wordt onderzocht, geen effecten over dagstart |
|
Lingard 2008 |
Gaat niet over dagstart: teambriefing per patiënt |
|
Wright 2005 |
Een evaluatie van een project over een Preoperative Safety Briefing, dit is een time-out geen dagbriefing |
|
Henderson 2012 |
Gaat niet over dagstart: evaluatie van compliance bij kortere checklists voor (de)briefing en sing-in, time-out en sign-out. |
|
Catchpole 2010 |
Aviation training in OK wordt onderzocht, geen effecten specifiek van een dagbriefing. |
|
Berenholtz 2009 |
Gaat over time out en sign out, andere UV |
|
Thanapongsathorn 2012 |
Thaise setting |
|
Anoniem; 2007 |
Beschrijvend stuk, geen origineel onderzoek |
|
McGreevy & Otten 2007 |
Beschrijvend stuk, geen origineel onderzoek |
|
Einav 2010 |
Gaat niet specifiek over dagstart: lijkt op een time-out, per patiënt |
|
Hill 2012 |
Beschrijvend stuk, geen origineel onderzoek |
|
Patterson 2013 |
Beschrijvend stuk, geen origineel onderzoek |
|
Criscitelli 2015 |
Beschrijvend stuk, geen origineel onderzoek |
|
Martin 2017 |
Is time-out, andere UV |
|
Lingard 2011 |
Gaat niet specifiek over dagstart: is een uitgebreidere time-out per patiënt |
|
Whyte 2009 |
Gaat niet specifiek over dagstart: lijkt op een time-out, per patiënt |
|
Wolf 2010 |
Gaat niet over dagstart: teamtraining, met briefing/debriefing die meer lijkt op sign-in, time-out, sign-out |
|
Tibbs & Moss 2014 |
Gaat niet specifiek over dagstart: uitgebreider team programma, waaronder type dagstart. Effecten zijn niet los te beoordelen. |
|
Henrickson 2009 |
Gaat niet over dagstart: preopertieve briefing specifiek voor cardiac surgery van 1 patiënt (time-out achtig) |
|
Defontes & Surbida 2004 |
Een evaluatie van een pilot over een Preoperative Safety Briefing, dit is een time-out geen dagbriefing |
|
Allard 2007 |
Survey study over ervaringen van clinici met briefings |
|
Roberts 2009 |
Beschrijvend stuk, geen origineel onderzoek. Briefing en debriefing is hier iets anders dan dagstart |
|
Porter 2014 |
Time-out, geen dagstart |
|
Paige 2008 |
Time-out, geen dagstart |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-07-2020
Beoordeeld op geldigheid : 02-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Anesthesiologie en de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Anesthesiologie en de Nederlandse Vereniging voor Heelkunde zijn beide regiehouder van deze richtlijnen eerstverantwoordelijken op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Stap 4. Opname |
NVvH en NVA |
2020 |
2025 |
Elke 5 jaar |
NVvH en NVA |
- |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn beoogt het bevorderen van veilige zorg rondom alle perioperatieve trajecten (interventies waarbij anesthesiologische zorg gegeven wordt), waarbij de patiënt die dit traject doorloopt centraal staat. Het doel van de richtlijn is het optimaal laten verlopen van het pre-, per- en postoperatieve traject van de patiënt. De focus van de richtlijn is patiëntveiligheid en de inrichting en afstemming van het perioperatief traject.
Doelgroep
Deze richtlijn is geschreven voor leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten die een interventie moeten ondergaan waarbij anesthesiologische zorg gegeven wordt.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor patiënten die een interventie moeten ondergaan waarbij anesthesiologische zorg gegeven wordt.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. P.M.N.Y.H. Go, algemeen chirurg, werkzaam in het Sint Antonius ziekenhuis te Nieuwegein, NVvH (voorzitter)
- Prof. Dr. L. P.H.J. Aarts, anesthesioloog, werkzaam in het Leids Universitair Medisch Centrum, NVA (voorzitter)
- Dr. M.C.O. van den Nieuwenhuyzen, anesthesioloog, werkzaam in het Ikazia ziekenhuis te Rotterdam, NVA
- Dr. M.J. van der Laan, vaatchirurg, werkzaam in het Universitair Medisch Centrum te Groningen en Ommelander Ziekenhuis te Groningen, NVvH
- R. Kranenburg/ R. Lammers/ K. Spijkers, beleidsmedewerker, Patiëntenfederatie Nederland
- Dr. R.A.F. de Lind van Wijngaarden, Cardio-thoracaal chirurg, werkzaam in het Leids Universitair Medisch Centrum, NVT
- Dr. J.H. Becker, gynaecoloog, werkzaam in het Sint Antonius ziekenhuis te Nieuwegein, NVOG
- Drs. R.C.M. Maatman, oogarts, werkzaam in het Alrijne ziekenhuis, NOG
- Drs. F.H.J. van Loon, anesthesiemedewerker, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVAM
- Dr. J. Th. Schmidt, kno-arts, werkzaam in het Ziekenhuis Amstelland, NVKNO
- Dr. N. Kort, orthopedisch chirurg, CortoClinics te Schijndel, NOV
- Drs. I.H. Hoekstra, uroloog, werkzaam in het Diakonessenhuis, NVU
- Drs. R. de Boer, neurochirurg, werkzaam in het Leids Universitair Medisch Centrum en Spaarnegasthuis, NVvN
- N. Dreessen, kwaliteitsfunctionaris, werkzaam in het Zuyderland MC te Heerlen/ Geleen, LVvO
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. M. Pols, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Overige stakeholders
Overige beroepsgroepen en stakeholders zijn op meerdere momenten betrokken geweest bij het richtlijnontwikkeltraject. Bij aanvang van het traject is er een knelpunteninventarisatie uitgevoerd, zoals hieronder beschreven. Voorafgaand aan de commentaarfase heeft er een tweede invitational conference plaatsgevonden om over de voorlopige inhoud van de richtlijn te discussiëren. Hierbij is input verkregen van de overige stakeholders over de belangrijkste wijzigingen ten opzichte van de vorige richtlijnen en zijn missende onderwerpen besproken (zie verslag van deze bijeenkomst in aanverwant product).
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
R. Kranenburg/ R. Lammers/ K. Spijkers |
Beleidsmedewerker(s) Patiëntenfederatie Nederland |
Geen |
Geen |
Geen actie |
|
R. de Lind van Wijngaarden |
Cardio-thoracaal chirurg, Leids Universitair Medisch Centrum |
-Commissie Interne Audit LUMC, onbetaald. |
Geen |
Geen actie |
|
R. van Loon |
Klinisch epidemioloog/ anesthesiemedewerker |
-Bestuurslid, aandachtsgebied onderwijs |
Geen |
Geen actie |
|
J. Schmidt |
KNO Arts Amstelland ziekenhuis |
Geen |
Geen |
Geen actie |
|
M. Maatman |
Oogarts in Alrijne |
-Lid bestuur oogheelkunde Sporadisch adviescommissie -Bayer / Eylea laatste keer was in december 2016 |
Geen |
Geen actie |
|
N. Dreessen |
Kwaliteitsfunctionaris Zuyderland MC |
Bestuurslid LVO (onbetaald) |
Geen |
Geen actie |
|
M. Nieuwenhuyzen |
Anesthesioloog Ikazia Ziekenhuis en Centrum voor bijzondere tandheelkunde Midden Brabant, plaatsvervangend opleider |
Geen |
Geen |
Geen actie |
|
P. Go |
Chirurg st. Antonius ziekenhuis Nieuwegein |
Voorzitter medische staf, vergoeding ziekenhuis |
Geen |
Geen actie |
|
N. Kort |
Orthopedisch chirurg CortoClinics, Schijndel (privékliniek voor heup en knieprothesiologie)
|
Betaald: |
Geen |
Geen actie |
|
L. Aarts |
Afdelingshoofd Anesthesiologie LUMC |
Geen betaalde nevenfuncties |
Geen |
Geen actie |
|
M. van der Laan |
Vaatchirurg, UMCG, Groningen |
Geen |
Geen |
Geen actie |
|
J. Becker |
Gynaecoloog |
Medisch hoofd afdeling Geboortezorg St Antonius ziekenhuis Lid commissie kwaliteitsdocumenten NVOG Voorzitter beroepsbelangen commissie NVOG |
Geen |
Geen actie |
|
R. de Boer |
Neurochirurg LUMC en Spaarnegasthuis |
Geen |
Geen |
Geen actie |
|
I. Hoekstra |
Uroloog, werkgever MSBD (Maatschap Diakonessenhuis Utrecht); tot 1 juli 2018 daarna gepensioneerd |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de werkgroep en een patiënten-enquête. Het rapport hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de NVvH, NVA, NVVC, IGJ, NVKG, NVKF, NVDK, KNMP, NOV, Patiëntenfederatie Nederland, NVvP, NVVR, BRV, NVT, VHIG, V&VN, NVZA, NVZ, NVK, NVAM, NFU, NVKNO, LVO, NAPA, NVIC, NVU, NOG, Zorginstituut Nederland via een enquête en een invitational conference. Een aparte patiënten-enquête is afgenomen door Patiëntenfederatie Nederland. Een verslag van de enquêtes en invitational conference is opgenomen onder aanverwante producten. In de eerste fase van het richtlijnontwikkeltraject is een vertegenwoordiger van de IGJ eenmalig bij de werkgroepvergadering geweest om een aantal knelpunten toe te lichten vanuit het perspectief van de IGJ.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module met algemene uitgangspunten.
Indicatorontwikkeling
Er werden geen nieuwe kwaliteitsindicatoren ontwikkeld voor de herziening van deze richtlijn. De werkgroep stelt voor de bestaande indicator uit de Basisset Medisch Specialistische Zorg, 2019 (1.1.3. Indicator Time-out, percentage juist uitgevoerde stopmomenten) te handhaven. De time-out blijft het belangrijkste stopmoment in het perioperatieve traject.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Deze kennislacunes worden vermeld in de aanverwante producten bij de modules.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de relevante (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – juni 2018
|
(Briefing or Healthcare Utilizing Deliberate Discussion Linking Events or huddle or interprofessional communication or preoperative brief or team brief).ti,ab. AND limit to (english language and yr="2000 -Current") = 232 |
320 |
|
Embase (Elsevier) |
briefing:ti,ab OR 'healthcare utilizing deliberate discussion linking events':ti,ab OR huddle:ti,ab OR 'interprofessional communication':ti,ab OR 'preoperative brief':ti,ab OR 'team brief':ti,ab = 277 |

