Toediening gekoelde trombocyten
Uitgangsvraag
Wat is de waarde van het geven van gekoelde trombocyten bij patiënten die cardiochirurgie ondergaan?
Aanbeveling
Geef trombocyten bewaard op kamertemperatuur indien hier een indicatie voor is bij patiënten die cardiochirurgie ondergaan.
Tot op heden zijn gekoelde trombocyten in Nederland nog niet beschikbaar. De meerwaarde zal eerst verder in gerandomiseerde onderzoeken moeten worden aangetoond.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek verricht naar de vergelijking tussen koude bloedplaatjes (bevroren of gekoeld) versus bloedplaatjes bewaard op kamertemperatuur bij volwassen patiënten die cardiochirurgie ondergaan. Er zijn drie pilot RCT’s geïncludeerd die deze vergelijking hebben onderzocht. Voor de cruciale uitkomstmaat postoperatief bloedverlies werd er geen klinisch relevant verschil gevonden tussen patiënten die koude bloedplaatjes ontvingen, ten opzichte van patiënten die bloedplaatjes op kamertemperatuur kregen. Voor de belangrijke uitkomstmaten werd gevonden dat de hemoglobine concentratie 1 dag na de ingreep hoger is bij patiënten die bloedplaatjes kregen die zijn bewaard op kamertemperatuur. Daarentegen lieten de studies zien dat een lager aantal patiënten dat gekoelde bloedplaatjes ontving een transfusie nodig had en dat zij mogelijk ook minder bloedproducten nodig hadden en daarnaast ook minder lang opgenomen waren in het ziekenhuis. Voor zowel de cruciale als de belangrijke uitkomstmaten was de bewijskracht echter zeer laag, hier ligt dus een kennislacune. De lage bewijskracht werd met name veroorzaakt door conflicterende resultaten welke van lage precisie waren en gemeten in een kleine patiëntengroep.
Er is ook gezocht naar de vergelijking gekoelde bloedplaatjes (bevroren of gekoeld) versus het niet toedienen van bloedplaatjes. Er zijn geen studies gevonden die deze vergelijking hebben onderzocht. Hier ligt een kennislacune.
Trombocyten concentraten (TC) worden momenteel standaard bewaard bij kamertemperatuur gedurende maximaal 7 dagen vanwege het risico op bacteriële contaminatie. Door de TC gekoeld of bevroren te bewaren zou de bewaarduur verlengd kunnen worden tot 14 dagen of zelfs 1 jaar respectievelijk. Het verlengen van de bewaarduur van TC kan leiden tot logistieke verbeteringen en derhalve mogelijk ook minder verspilling.
Momenteel zijn gekoelde of bevroren TC alleen beschikbaar voor de militaire bloedbank en worden niet routinematig in de klinische praktijk gebruikt in Nederland. Of deze gebruikt zullen gaan worden zal afhangen van verschillende factoren.
Allereerst moet de werkzaamheid (het voorkomen en behandelen van bloedingen) minimaal gelijk zijn tussen de standaard TC en de gekoelde/bevroren TC. Daarnaast is het van belang dat gekoelde/bevroren TC niet leidt tot een groter aantal transfusies, meer transfusie gerelateerde complicaties, hogere mortaliteit, meer trombose, langere opname duur en slechtere kwaliteit van leven. Daarnaast zijn er toegenomen kosten die gepaard gaan met het koelen/invriezen welke moeten worden meegenomen bij de eventuele implementatie van gekoelde en bevroren TC.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het geven van trombocyten kan schadelijk zijn voor patiënten. De potentieel schadelijke effecten van bevroren trombocyten zijn nog niet bekend. Daarnaast worden deze bevroren trombocyten nog niet gebruikt in de dagelijkse praktijk. Het is belangrijk dat er gerandomiseerd onderzoek wordt uitgevoerd om de voor- en nadelen voor de patiënt inzichtelijk te maken.
Kosten (middelenbeslag)
Het koelen/invriezen van TC brengt extra kosten met zich mee. Daar staat tegenover dat er op dit moment veel spillage is van trombocyten vanwege de korte levensduur. Mogelijk zorgt het koelen van trombocyten voor minder spillage omdat deze bloedproducten langer meegaan.
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien in Nederland gekoelde/bevroren TC alleen voor de militaire bloedbank beschikbaar zijn en er in de literatuur nog geen duidelijk voordeel is aangetoond van gekoelde/bevroren TC heeft de werkgroep ervoor gekozen om het gebruik van trombocyten op kamertemperatuur aan te bevelen. Dit is gangbaar met de huidige praktijk, de werkgroep zit hier dan ook geen bezwaren wat betreft de aanvaardbaarheid, haalbaarheid en implementatie van deze aanbeveling.
Mochten gekoelde trombocyten in de toekomst ingezet gaan worden in de ziekenhuizen dan zal dit ertoe leiden dat er een tweede stroom aan trombocyten op de markt komt, wat voor de logistieke uitdagingen kan zorgen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Mogelijk kan er een voordeel worden gezien voor het gebruik van gekoelde trombocyten wat betreft de logistiek (lees: langere houdbaarheid). Daarnaast zijn grote nadelen tot op heden ook nog niet in studieverband aangetoond. Echter het product is momenteel nog niet beschikbaar voor cardiochirurgie in Nederland. Dit zou eerst in een gerandomiseerd onderzoek moeten worden onderzocht. Op dit moment is er een fase 3 studie gaande in Australië naar de effectiviteit van bevroren/gekoelde TC bij de cardiopulmonale chirurgie.
Onderbouwing
Achtergrond
Trombocyten transfusies worden gegeven als therapie bij bloedingen of als profylaxe om bloedingen te voorkomen. Trombocyten concentraten worden zeven dagen bewaard bij kamertemperatuur. Om de bewaarduur te verlengen zouden trombocyten concentraten ingevroren kunnen worden. Momenteel zijn bevroren trombocyten alleen beschikbaar in militaire bloedbanken en zijn deze producten niet beschikbaar voor reguliere hartchirurgische centra. Het geven van trombocyten kan schadelijk zijn voor patiënten. De potentieel schadelijke effecten van bevroren trombocyten zijn nog niet bekend. In deze module zal worden uitgezocht of bevroren trombocyten wellicht ook van meerwaarde zijn voor reguliere hartchirurgische centra.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of cold platelets (frozen or chilled) on postoperative blood loss, hemoglobin concentration, number of patients transfused, blood product consumption, thrombosis, length of stay, and mortality when compared with platelets stored at room temperature in adult patients undergoing cardiac surgery. Sources: McGuinness, 2022; Reade, 2019; Strandenes, 2020 |
|
Very low GRADE |
The evidence is very uncertain about the effect of cold platelets (frozen or chilled) on transfusion reaction caused by platelet transfusion when compared with platelets stored at room temperature in adult patients undergoing cardiac surgery. Source: Strandenes, 2020 |
|
No GRADE |
No evidence was found regarding the effect of cold platelets (frozen or chilled) on quality of life when compared with platelets stored at room temperature in adult patients undergoing cardiac surgery. Sources: - |
|
No GRADE |
No evidence was found regarding the effect of cold platelets (frozen or chilled) on all outcome measures when compared with no platelets in adult patients undergoing cardiac surgery. Sources: - |
Samenvatting literatuur
Description of studies
PICO 1
McGuinness (2022) performed a single center blinded pilot trial to compare the administration of cryopreserved platelets with liquid-stored platelets intraoperatively or during intensive care unit admission in patients who underwent cardiac surgery (CLIP-NZ Pilot). Cardiac patients at high risk of platelet transfusion were included. In total, 10 patients received cryopreserved platelets, compared to 13 patients who received liquid-stored platelets. Indication for platelet transfusion was not protocolized but left to the judgement of clinicians informed by standard laboratory tests, thromboelastography (TEG), clinical assessment of bleeding and national guidelines. Study platelet transfusion could be commenced either in the operating theatre or at any time during the intensive care unit stay. Indication for transfusion of RBC is not reported. The duration of follow-up was 28 days. The study reported the following relevant outcome measures: postoperative blood loss, hemoglobin concentration, blood product consumption (RBC), number of patients transfused (RBC), thrombosis, length of stay, and mortality.
Strandenes (2020) performed a single center two-stage pilot RCT to compare the administration of cold platelets (2°C to 6°C) with platelets stored at room temperature (20°C to 24°C) in adult patients undergoing complex cardiothoracic surgery. Both platelets were stored for up to 7 days. Adult patients hospitalized for cardiothoracic surgery who were scheduled for elective or semi-urgent cardiothoracic surgery with either expected cardiopulmonary bypass (CBP) time over 120 minutes or use of dual platelet inhibition drugs less than 48 hours before surgery. Only the patients who developed indications for platelet transfusion and had orders for study platelets received by the blood bank were enrolled into the study. Indications for platelet or erythrocytes was decided according to standard practice at their institution in collaboration between the surgeon and anesthesiologist. The decision to transfuse platelets was based on prolonged CPB time, excessive bleeding needing a balanced transfusion approach, and/or problems achieving surgical hemostasis. The decision to transfuse erythrocytes is not further specified. The duration of follow-up was 28 days. The study reported the following relevant outcome measures: postoperative blood loss, hemoglobin concentration, blood product consumption (RBC, thrombocytes), transfusion reaction caused by platelet transfusion, thrombosis, length of stay, and mortality.
Reade (2019) performed a double-blind, parallel-group, standard-care controlled multicenter pilot trial conducted in four Australian tertiary academic hospitals to compare cryopreserved platelets with liquid-stored platelets in patients undergoing high-risk cardiothoracic surgery. In total, 23 patients received cryopreserved platelets, compared to 18 patients who received liquid-stored platelets. Patients could receive up to three units of study platelets (cryopreserved or liquid stored) if their treating clinicians decided they required a platelet transfusion (intra-operatively or in the intensive care unit) based on any clinical or laboratory indications. If more than three units were required, open-label PLTs were administered. The decision to transfuse red blood cells are not further specified. The duration of follow-up was 28 days. The study reported the following relevant outcome measures: postoperative blood loss, hemoglobin concentration, blood product consumption (RBC), thrombosis, length of stay, and mortality.
Results
Postoperative blood loss (critical)
Three studies reported the outcome measure postoperative blood loss (McGuinness, 2022; Reade, 2019; Strandenes, 2020). Due to differences in reporting this outcome measure, the results were not pooled.
Cold-stored
Strandenes (2020) reported the amount of postoperative blood loss as median chest drain output. The median chest drain output was 645 ml in patients who received cold-stored platelets, versus 720 ml in patients who received platelets stored at room temperature. The difference in medians between the two groups is 75 ml (95%CI -220 to 425), in favor of cold-stored platelets. This difference is not considered clinically relevant.
Cryopreserved
Reade (2019) reported the estimated blood loss in drains at 24 and 48 hours postoperatively. The median postoperative blood loss at 24 hours was 715 ml in patients who received cryopreserved platelets, and 805 ml in the patients who received platelets stored at room temperature. The difference is -90 ml (95%CI -343.8 to 163.8), in favor of cryopreserved platelets. This difference is not considered clinically relevant.
The median postoperative blood loss at 48 hours was 980 ml in patients who received cryopreserved platelets, and 1075 ml in the patients who received platelets stored at room temperature. The difference is -95 ml (95%CI -476.0 to 286.0), in favor of cryopreserved platelets. This difference is not considered clinically relevant.
McGuinness (2022) reported the estimated blood loss in drains at 24 and 48 hours postoperatively. The median postoperative blood loss at 24 hours was 1375 ml (95%CI 925 to 2390) in patients who received cryopreserved platelets, and 905 ml (95%CI 775 to 2150) in the patients who received platelets stored at room temperature. The median of differences is 195 ml (95%CI -775 to 1145), in favor of platelets stored at room temperature. This difference is not considered clinically relevant.
The median postoperative blood loss at 48 hours was 1375 ml (95%CI 925 to 2390) in patients who received cryopreserved platelets, and 975 ml (95%CI 875 to 2150) in the patients who received platelets stored at room temperature. The median of differences is 150 ml (95%CI -775 to 1390), in favor of platelets stored at room temperature. This difference is not considered clinically relevant.
Hemoglobin concentration (important)
Three studies reported the outcome measure hemoglobin concentration (McGuinness, 2022; Reade, 2019; Strandenes, 2020). Due to differences in reporting this outcome measure, the results were not pooled.
Cold-stored
Strandenes (2020) reported the hemoglobin concentration at baseline and at the next morning. The median hemoglobin concentration in patients who received cold-stored platelets was 11.7 g/dl (IQR 10.6 to 13.0) at baseline and 9.5 g/dl (IQR 8.8 to 10.6) at the next morning. The median hemoglobin concentration in patients who received platelets stored at room temperature was 11.9 g/dl (IQR 10.6 to 12.5) at baseline and 9.7 g/dl (IQR 9.1 to 10.3) at the next morning. The differences are 0.2 g/dl at both time points, in favor of platelets stored at room temperature. These differences are not considered clinically relevant.
Cryopreserved
McGuinness (2022) reported the median hemoglobin concentration at day 1. The median hemoglobin concentration was 86 g/dl (IQR 79 to 101) in patients who received cryopreserved platelets, and 91 g/dl (IQR 82 to 100) in patients who received platelets stored at room temperature. The difference is -3 g/dl (95%CI -14 to 12), in favor of platelets stored at room temperature. This difference is considered clinically relevant.
Reade (2019) reported the median hemoglobin concentration at day 1. The median hemoglobin concentration was 84 g/dl (IQR 77 to 98) in patients who received cryopreserved platelets, and 89.5 g/dl (IQR 83 to 94) in patients who received platelets stored at room temperature. The difference is -5.5 g/dl (95%CI -14.8 to 3.8), in favor of platelets stored at room temperature. This difference is considered clinically relevant.
Number of patients transfused (important)
Two studies reported the outcome measure number of patients transfused (McGuinness, 2022; Reade, 2019). Due to differences in reporting this outcome measure, the results were not pooled.
Cryopreserved
Reade (2019) reported the number of patients that were transfused with RBC. In total, 19 out of the 23 patients (82.6%) who received cryopreserved platelets were transfused with RBC at any stage, compared to 16 out of the 18 patients (88.9%) who received platelets stored at room temperature. The risk difference is - 6.28% (95%CI -27.51 to 14.95), in favor of cryopreserved platelets. This difference is not considered clinically relevant.
McGuiness (2022) reported the number of patients that were transfused with RBC. In total, 8 out of the 10 patients (80%) who received cryopreserved platelets were transfused with RBC at any stage, compared to 12 out of the 13 patients (92%) who received platelets stored at room temperature. The risk difference was -12% (95%CI -41 to 16), in favor of cryopreserved platelets. This difference is considered clinically relevant.
Blood product consumption (important)
Three studies reported the outcome measure blood product consumption (McGuinness, 2022; Reade, 2019; Strandenes, 2020). Due to differences in reporting this outcome measure, the results were not pooled.
Cold stored
Strandenes (2020) did not report the number of units of blood products transfused. They reported that there were no statistically significant differences in total units of transfused platelets, plasma and red blood cells between the two groups.
Cryopreserved
Reade (2019) reported the median number of red blood cell (RBC) units. Patients who received cryopreserved platelets received 3 units (IQR 1 to 5) of red blood cells. Patients who received platelets stored at room temperature received 4 units (IQR 3 to 5) of red blood cells. The median differences are -1 (95%CI -3.1 to 1.1), in favor of cryopreserved platelets. This is considered clinically relevant.
McGuiness (2022) reported the median number of red blood cell (RBC) units. Patients who received cryopreserved platelets received 2 units (IQR 1 to 7) of red blood cells. Patients who received platelets stored at room temperature received 1 unit (IQR 1 to 3) of red blood cells. The median differences are 0.5 (95%CI -1 to 5), in favor of platelets stored at room temperature. This is not considered clinically relevant.
Transfusion reaction caused by platelet transfusion (important)
One study reported the outcome measure transfusion reaction caused by platelet transfusion (Strandenes, 2020).
Cold-stored
Strandenes (2020) reported the outcome measure transfusion reaction caused by platelet transfusion. In total, none of the 25 patients (0%) who received cold-stored platelets had a transfusion reaction, and none of the 25 patients who received platelets stored at room temperature had a transfusion reaction. This means that there is no difference in the number of transfusion reactions given by cold-stored or room temperature platelets.
Thrombosis (important)
Three studies reported the outcome measure thrombosis (McGuinness, 2022; Reade, 2019; Strandenes, 2020). Due to differences in reporting this outcome measure, the results were not pooled.
Cold-stored
Strandenes (2020) reported the number of arterial thromboembolism and venous thromboembolisms. In total, 6 out of the 25 patients (24%) who received cold-stored platelets had an arterial thromboembolism and none of these patients had a venous thromboembolism. Six of the 25 patients (24%) who received platelets stored at room temperature had an arterial thromboembolism, and 2 out of the 25 patients (8%) had a venous thromboembolism. This means that there is no difference in the number of arterial thromboembolisms, while for venous thrombosis his results in a risk difference of -0.08
(95%CI -0.21 to 0.05), in favor of cryopreserved platelets. This difference is, however, not considered clinically relevant.
Cryopreservation
McGuinness (2022) reported the number of patients with a deep venous thrombosis. In total, none of the 10 patients who received cryopreserved platelets had a deep venous thrombosis, and 1 out of the 13 patients (8%) who received platelets stored at room temperature had a deep venous thrombosis. This results in a risk difference of 8%
(95% CI -22% to 7%), in favor of cryopreserved platelets. This difference is not considered clinically relevant.
Reade (2019) reported the number of patients with a deep venous thrombosis. In total, 1 out of the 23 patients (4.3%) who received cryopreserved platelets had a deep venous thrombosis, and 1 out of the 18 patients (5.6%) who received platelets stored at room temperature had a deep venous thrombosis. This results in a risk difference of 1.2% (95% CI -15% to 8%), in favor of cryopreserved platelets. This difference is not considered clinically relevant.
Length of stay (important)
Three studies reported the outcome measure length of stay (McGuinness, 2022; Reade, 2019; Strandenes, 2020). Due to differences in reporting this outcome measure, the results were not pooled.
Cold-stored
Strandenes (2020) reported the length of stay in the intensive care unit in days. The patients who received cold-stored platelets had a median length of stay of 2 days (IQR 1 to 6 days), and patients who received platelets stored at room temperature had a median length of stay of 2 days (IQR 1-5). This means that there is no difference in length of stay in patients who received cold-stored platelets versus patients who received platelets stored at room temperature.
Cryopreserved
McGuiness (2022) reported the hospital length of stay in days. The patients who received cryopreserved platelets had a median length of stay of 9 days (IQR 7 to 12 days), and patients who received platelets stored at room temperature had a median length of stay of 12 days (IQR 8 to 19). The difference in median length of stay is 3 days, in favor of patients who received cryopreserved platelets. This difference is considered clinically relevant.
Reade (2019) reported the hospital length of stay in days. The patients who received cryopreserved platelets had a median length of stay of 18 days (IQR 10 to 28 days), and patients who received platelets stored at room temperature had a median length of stay of 23 days (IQR 16 to 34). The difference in median length of stay is 5 days, in favor of patients who received cryopreserved platelets. This difference is considered clinically relevant.
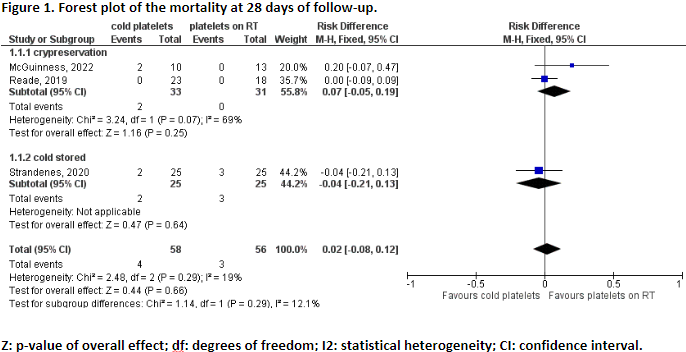
Mortality (important)
Three studies reported the outcome measure mortality (McGuinness, 2022; Reade, 2019; Strandenes, 2020).
All studies reported mortality at 28 days of follow-up. In total, 4 out of the 58 patients (7%) who received cold platelets (cryopreserved or cold stored) died within 28 days, versus 3 out of 56 patients (5%) who received platelets stored at room temperature (Figure 1). The pooled RD was 0.02, 95% CI -0.08 to 1.12). This means that patients who received cold platelets have a higher mortality risk compared to patients who received platelets stored at room temperature. This difference is not considered clinically relevant.
Cold-stored
Strandenes (2020) reported the mortality for patients who received cold-stored platelets. The RD is -0.04 (95%CI -0.21 to 0.13), in favor of cold-stored platelets (Figure 1). This difference is not considered clinically relevant.
Cryopreservation
Reade (2019) and McGuinness (2022) reported the mortality for patients who received cryopreserved platelets. The pooled RD is 0.07 (95%CI -0.21 to 0.13), in favor of platelets stored at room temperature (Figure 1). This difference is not considered clinically relevant.
Quality of life (important)
None of the included studies reported the outcome measure quality of life.
Level of evidence of the literature
The level of evidence regarding the outcome measure postoperative blood loss was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure hemoglobin concentration was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure number of patients transfused was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure blood product consumption was based on RCT’s and therefore starts high. The level of evidence was downgraded by 4 levels because of study limitations (risk of bias, -1), conflicting results (inconsistency, -1) and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure transfusion reaction caused by platelets was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because of a very small number of included patients (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure thrombosis was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because of a very small number of included patients (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure length of stay was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because of a very small number of included patients (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure mortality was based on RCT’s and therefore starts high. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure quality of life could not be graded, as the included studies did not report this outcome measure.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
PICO 1
What are the (un)favorable effects of administering cold platelets compared to platelets kept at room temperature in adult patients undergoing cardiac surgery?
| P: | adult patients undergoing cardiac surgery |
| I: | cold platelets (frozen or chilled) |
| C: | platelets (room temperature) |
| O: | postoperative blood loss, hemoglobin concentration, blood product consumption, number of patients transfused, transfusion reaction caused by platelet transfusion, thrombosis, length of stay, mortality, quality of life |
PICO 2
What are the (un)favorable effects of administering cold platelets compared to no platelets in adult patients undergoing cardiac surgery?
| P: | adult patients undergoing cardiac surgery |
| I: | cold platelets (frozen or chilled) |
| C: | no platelets |
| O: | postoperative blood loss, hemoglobin concentration, blood product consumption, number of patients transfused, transfusion reaction caused by platelet transfusion, thrombosis, length of stay, mortality, quality of life |
Relevant outcome measures
The guideline development group considered postoperative blood loss as a critical outcome measure for decision making; and hemoglobin concentration, number of patients transfused, blood product consumption, transfusion reaction caused by platelet transfusion, thrombosis, length of stay, mortality, quality of life as important outcome measures for decision making.
The working group defined the outcome measures as follows:
-
Number of patients transfused: red blood cells (RBC) and platelets
-
Blood product consumption: red blood cells and platelets
The working group defined the following differences as a minimal clinically (patient) important difference:
-
Mortality: ≥10% (RR < 0.9 and RR > 1.1)
-
Transfusion-related complications: ≥25% (RR < 0.8 and RR > 1.25)
-
Postoperative blood loss: ≥250 cc
-
Hemoglobin concentration: ≥0.625 mmol/liter, 1.0 g/dl
-
Number of patients transfused: ≥10% (RR < 0.9 and RR > 1.1; RD > 0.10)
-
Blood product consumption: ≥1 product
-
Length of stay: ≥1 day
-
/Thrombosis: ≥25% (RR < 0.8 and RR > 1.25)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 25-08-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 299 hits. Studies were selected based on the following criteria: systematic reviews, RCT’s, or comparative studies comparing the administration of cold platelets (frozen or chilled) with the administration of platelets kept at room temperature or no administration of platelets in adult patients undergoing cardiac surgery. Five studies were initially selected based on title and abstract screening. After reading the full text, two studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
None of the included studies compare the administration of cold platelets (cold or cryopreserved) with no administration of platelets. Therefore, only the results for PICO 1 are presented.
Referenties
- McGuinness S, Charlewood R, Gilder E, Parke R, Hayes K, Morley S, Al-Ibousi A, Deans R, Howe B, Johnson L, Marks DC, Reade MC; Australian and New Zealand College of Anaesthetists Clinical Trials Network; Australian and New Zealand Intensive Care Society Clinical Trials Group. A pilot randomized clinical trial of cryopreserved versus liquid-stored platelet transfusion for bleeding in cardiac surgery: The cryopreserved versus liquid platelet-New Zealand pilot trial. Vox Sang. 2022 Mar;117(3):337-345. doi: 10.1111/vox.13203. Epub 2021 Sep 28. PMID: 34581452.
- Strandenes G, Sivertsen J, Bjerkvig CK, Fosse TK, Cap AP, Del Junco DJ, Kristoffersen EK, Haaverstad R, Kvalheim V, Braathen H, Lunde THF, Hervig T, Hufthammer KO, Spinella PC, Apelseth TO. A Pilot Trial of Platelets Stored Cold versus at Room Temperature for Complex Cardiothoracic Surgery. Anesthesiology. 2020 Dec 1;133(6):1173-1183. doi: 10.1097/ALN.0000000000003550. PMID: 32902572.
- Reade MC, Marks DC, Bellomo R, Deans R, Faulke DJ, Fraser JF, Gattas DJ, Holley AD, Irving DO, Johnson L, Pearse BL, Royse AG, Wong J; Cryopreserved vs Liquid Platelet (CLIP) Investigators, the Australian and New Zealand College of Anaesthetists Clinical Trials Network, and the Australian and New Zealand Intensive Care Society Clinical Trials Group. A randomized, controlled pilot clinical trial of cryopreserved platelets for perioperative surgical bleeding: the CLIP-I trial (Editorial, p. 2759). Transfusion. 2019 Sep;59(9):2794-2804. doi: 10.1111/trf.15423. Epub 2019 Jul 10. PMID: 31290573.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
Research question: What are the (un)favorable effects of administering cold platelets compared to platelets kept at room temperature in adult patients undergoing cardiac surgery?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
McGuinness, 2022 |
Type of study: pilot RCT
Setting and country: double-blind, parallel group, single center pilot trial, New Zealand.
Funding and conflicts of interest: the authors declare no conflicts of interest. |
Inclusion criteria: Cardiac surgery patients at high risk of platelet transfusion identified using the TRUST score.
Exclusion criteria: Patients who received a platelet transfusion earlier during that hospital admission, women of childbearing age (to avoid the risk of rhesus immunization), when death was deemed inevitable in <24 hours (as mortality was a study end point), patients who had been enrolled previously in this study or in a clinical trial of a medication (with the exception of aspirin) thought to influence bleeding, patients with a known bleeding diathesis associated with abnormal clotting on investivations taken immediately preoperatively, patients who object to receipt of human blood products, patients with intellectual impairment making them unable to consent to surgery, or if their treating clinician believed participation was not in their best interest.
N total at baseline: Intervention: 10 Control: 13
Important prognostic factors2: age (mean IQR) I: 69 (59 – 77) C: 73 (64-77)
Sex: I: 90% M C: 38.5% M
Groups comparable at baseline? Between-group baseline imbalances were seen in sex, weight and incidence of diabetes (Table 1). Intraoperative complexity was equivalent (Table S1).
|
Describe intervention (treatment/procedure/test):
Cryopreserved platelets
When required for transfusion, the platelet–plasma unit is placed in a 37 °C water bath until reaching a temperature of 30 °C, at which point the plasma is gently mixed with the platelets to disperse any clumps. Reconstituted cryopreserved platelets contain more than 40% of the platelets in the original component, and have a 6-h shelf life. |
Describe control (treatment/procedure/test):
Patients randomized to receive liquid-stored platelets were transfused leucocyte-depleted apheresis or pooled whole-blood derived platelets in either additive solution or plasma, according to the available supply. The hospital blood bank selected the ABO and Rh group according to its standard practice. |
Length of follow-up: 28-days
Loss-to-follow-up: No patients were lost to follow-up.
One patient randomized to liquid-stored platelets was transfused one unit of open-label (liquid stored) platelets before subsequently receiving 3 units of study platelets. This patient was retained in the intention-to-treat analysis as part of the liquid-stored platelet group.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Blood loss There were no differences in the median intra- or postoperative blood loss between study groups up to 48 h (Figure 3 and Table S2).
Transfusion requirement There were no significant differences in the quantities of blood components transfused.
Complications (adverse events) There were no pro-thrombotic arterial or venous complications, including acute myocardial infarction, in either study group. No adverse events were reported to the Data and Safety Monitoring Committee (DSMC).
Mortality Two patients in the cryopreserved platelet group, but none in the liquid-stored group, had died by 28-days postoperatively. |
Conclusion This pilot randomized controlled trial demonstrated the feasibility of the protocol and adds to accumulating data supporting the safety of this intervention. Given the clear advantage of prolonged shelf-life, particularly for regional hospitals in New Zealand, a definitive non-inferiority phase III trial is warranted.
Limitations Finally, transfusion of a unit of cryopreserved platelets was accompanied by the mandatory transfusion of plasma (109 ml) in which the platelets were resuspended. The trial could, therefore, be a comparisonof platelets plus plasma versus platelets alone.
|
|
Strandenes, 2020 |
Type of study: pilot RCT
Setting and country: single center two-stage pilot RCT, Norway
Funding and conflicts of interest: Dr. Spinella reports ongoing financial relationships with Secure Transfusion Services (South San Francisco, California), Cerus (Concord, California), Entegrion (Durham, North Carolina), KaloCyte (Baltimore, Maryland), and Haima (Cleveland, Ohio), and a past financial relationship with Hemanext (Lexington, Massachusetts). The opinion or assertions contained herein are the private views of the authors and are not to be construed as official or as reflecting the views of the U.S. Department of the Army, the U.S. Department of Defense or the Norwegian Armed Forces Medical Services. The remaining authors declare no competing interests. |
Inclusion criteria: The inclusion screening criteria were scheduled elective or semiurgent cardiothoracic surgery with either expected CPB time over 120 min or use of dual platelet inhibition drugs less than 48 h before surgery.
Informed consent was obtained from patients who fulfilled the screening criteria; however, only the subset of consented patients who developed indications for platelet transfusion and had orders for study platelets received by the blood bank were enrolled into the study.
Exclusion criteria: Patients with congenital coagulopathies or hemostatic disorders were ineligible.
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: age ± SD: I: 65 (57-71) C: 61 (46-67)
Sex: I: 68% M C: 64% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Cold-stored platelets (2°C to 6°C). Stored for up to 7 days.
|
Describe control (treatment/procedure/test):
Platelets stored at room temperature (20°C to 24°C). Stored for up to 7 days. |
Length of follow-up: 28 days.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Intervention: 4 patients were excluded (2 reoperation, 1 iatrogenic spleen bleeding, 1 transfused pooled buffycoat platelets).
Control: 4 patients were excluded (1 reoperation, 1 transfused incorrectly processes platelets, 2 transfused room-temperature stored platelets instead of cold-stored platelets.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Blood loss As shown in figure 2, postoperative blood loss measured as median chest drain output was 720 ml (485 to 1,170, 180 to 2,340) for room temperature, 645 ml (460 to 800, 90 to 1,785) for cold-stored up to 7 days.
In the post hoc analysis, the median chest drain output was 720 ml (490 to 1,020, 180 to 2,340), and 590 ml (450 to 720, 90 to 960), for room temperature, cold storage for up to 7 days.
The difference in medians between the room temperature and cold-stored up to 7 days arm was 75 ml (95% CI, -220, 425).
Blood product usage There were no statistically significant differences in total units of transfused platelets (P = 0.124), plasma (P = 0.079), or red cells (P = 0.543) in the room temperature– and cold-stored up to 7 days arms.
Fibrinogen: I: 11 (44%) C: 15 (60%)
Prothrombin: I: 4 (16%) C: 2 (8%)
Platelet function Platelet count increased after platelet transfusion for all study arms (P < 0.05). Multiple electrode aggregation response to all agonists increased after platelet transfusion for all study arms (P < 0.05).
Median thromboelastography Maximum amplitude remained within normal ranges in all study arms
Adverse events No transfusion reactions related to platelet transfusions were observed.
Mortality Overall 28-day hospital mortality of three deaths (12%) in the room temperature group, two (8%) in the cold-stored 7 days arm.
Length of stay For the evaluation of length of stay in intensive care, one patient in the room temperature arm, two patients in the cold-stored up to 7 days arm, and two patients in the cold-stored for 8 to 14 days arm remained in intensive care at the conclusion of the 28-day study period.
Trombose (arterial + venous) I: 6 C: 8 |
Conclusion This pilot trial supports the feasibility of platelets stored cold for up to 14 days and provides critical guidance for future pivotal trials in high-risk cardiothoracic bleeding patients.
Limitations Most patients received the first transfusion episode during surgical hemostasis when multiple blood components and hemostatic products were transfused simultaneously.This might influence results.
The number of patients having previous sternotomies was higher in the cold-stored up to 7 days arm. History of previous sternotomies is associated with increased bleeding and might influence the results; especially chest drain output and blood product use.
Fase II: cold-stored platelets for 8 to 14 days. 15 patients were included. |
|
Reade, 2019 |
Type of study: pilot RCT
Setting and country: double-blind, parallel-group, standard-care controlled multicenter pilot trial conducted in four Australian tertiary academic hospitals
Funding and conflicts of interest: The authors have disclosed no conflicts of interest. |
Inclusion criteria: Adult patients (aged 18 years) were eligible for the study if they were scheduled to undergo cardiac surgery and at least three of the TRUST criteria (which predict a high risk of red blood cell [RBC] transfusion) were present.
Exclusion criteria: Patients were excluded if they had received a PLT transfusion earlier during the same hospital admission; if they were women of childbearing age (18-55 years); if death was deemed inevitable in less than 24 hours; if they had been previously enrolled in this study or a clinical trial of a medication (with the exception of aspirin) or technique thought to influence bleeding; if they had a known bleeding diathesis (for example, hemophilia or Von Willebrand disease)or hematologic malignancy associated with abnormal clotting on blood investigations taken in the immediate pre operative period (i.e., PLT count <100 X10^3 international normalized ratio >1.5, activated partial thromboplastin time >1.5× upper limit of normal); if they had a known allergy to DMSO; if they had a known objection to receipt of human blood products; if they had intellectual impairment such that they were unable to consent for surgery themselves; or if their treating physician believed that it was not in their best interest to participate in the trial.
N total at baseline: Intervention: 23 Control: 18
Important prognostic factors2: age ± SD: I: 71 (66-77) C: 70 (65-75)
Sex: I: 70% M C: 67% M
Groups comparable at baseline? Study groups were generally well balanced at baseline. |
Describe intervention (treatment/procedure/test):
Cryopreserved platelets
In the hospital blood bank, cryopreserved PLTs were thawed in a water bath at 37C and reconstituted using AB or group-specific plasma either thawed specifically for the purpose or maintained prethawed for emergencies. Plasma was transferred to the PLT bag using sterile tubing inserted into the access port. PLTs could be transfused up to 4 hours after reconstitution.
|
Describe control (treatment/procedure/test):
Liquid stored platelets.
Patients randomized to receive liquid-stored PLTs were transfused pooled buffy coat PLTs or (if a suitable buffy coat PLT unit was unavailable) apheresis PLTs prepared by the ARCBS and distributed to hospital blood banks according to routine practice. The hospital blood bank selected the PLT ABO group to be infused according to its standard practice. |
Length of follow-up: 28 days
Loss-to-follow-up: No patients were lost to follow-up.
Incomplete outcome data: Intervention: 3 patients received open-label platelets before 3 study platelet units.
Control: none.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Blood loss There were no differences in any measure of intra- or post operative blood loss (Table 3 and Fig. 2).
Blood products used There were several differences in quantities of blood products transfused between the groups (Table 4). Whole blood was not available for use during the study. RBC transfusion was not different, although numerically fewer patients in the cryopreserved group were transfused in the OR and were transfused one fewer unit overall. Patients in the cryopreserved group were significantly more likely to be transfused FFP, and overall a greater median volume of FFP was transfused to this group. However, among only those patients transfused FFP, the median number of FFP units was not different. Patients in the cryopreserved group received a median of 1 more unit of study PLTs. Very few patients received nonstudy open-label PLT transfusions, and this did not differ between groups. The only difference in laboratory variables the day after surgery was the PLT count, which was significantly lower in the cryopreserved PLT group (Table 5).
Adverse events No transfusion reactions related to platelet transfusions were observed.
Mortality None of the patients died.
Hospital length of stay I: 18 (10-28) days C: 23 (16-34) days
|
|
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
McGuinness, 2022 |
Definitely yes;
Reason: Patients were Randomly allocated 1:1 to study groups Using computer-generated permuted block randomization |
Unclear;
Reason: No more details about the randomization process are presented in the paper. |
Definitely no;
Reason: Clinicians in our trial were blinded using an opaque shroud that could be removed easily.
This shroud was temporarily removed by a clinician not involved in the care of the patient to facilitate correct patient identification prior to transfusion.
Blinding of patients, data collectors, outcome assessors, and data analysts is not reported. |
Definitely yes;
Reason: no patients were lost to follow-up. |
Definitely yes;
Reason: All relevant outcomes were reported; |
Definitely no;
Reason: The major limitation of the trial is its small size, also because it is a pilot RCT. |
High risk of bias (all outcomes)
Reason: due to the very limited sample size and because it is a pilot RCT. |
|
Strandenes, 2020 |
Definitely yes;
Reason: The study weeks were randomized to maintain an inventory for the study without excessive waste. A randomization list for study weeks was generated by use of electronic software. |
Definitely yes;
Reason: The randomization list was only available to study co-workers at the Department of Immunology and Transfusion Medicine. Surgeons screening the patients for eligibility were blinded to the randomization, as were the clinical personnel responsible for the treatment and follow up of the patients. Clinicians were blinded to patient randomization when deciding whether to transfuse and when ordering platelets. |
Definitely no;
Reason: Study coworkers from the Department of Immunology and Transfusion Medicine who obtained written informed consent, collected data from electronic medical records, and registered information in the study database were not blinded. |
Definitely yes;
Reason: a few patients were excluded in the post-hoc analyses. Reasons are given and are similar between the groups. |
Definitely yes;
Reason: All relevant outcomes were reported; |
Definitely no;
Reason: The major limitation of the trial is its small size, also because it is a pilot RCT. A formal sample size calculation was not performed. |
High risk of bias (all outcomes)
Reason: due to the very limited sample size and because it is a pilot RCT. |
|
Reade, 2019 |
Definitely yes;
Reason: Patients were randomized 1:1, stratified by site, using computer generatedpermuted block randomization. |
Unclear;
Reason: No more details about the randomization process are presented in the paper. |
Probably yes;
Reason: When a PLT transfusion was ordered, an unblinded blood bank scientist supplied study PLT units to operating room (OR) or ward staff.
Study PLTs were supplied with an opaque shroud that obscured the storage method. |
Definitely yes;
Reason: none of the patients were lost to follow-up. |
Definitely yes;
Reason: All relevant outcomes were reported; |
Definitely no;
Reason: The major limitation of the trial is its small size, also because it is a pilot RCT. Sample size was not calculated. |
High risk of bias (all outcomes)
Reason: due to the very limited sample size and because it is a pilot RCT. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Menkis AH, Martin J, Cheng DC, Fitzgerald DC, Freedman JJ, Gao C, Koster A, Mackenzie GS, Murphy GJ, Spiess B, Ad N. Drug, devices, technologies, and techniques for blood management in minimally invasive and conventional cardiothoracic surgery: a consensus statement from the International Society for Minimally Invasive Cardiothoracic Surgery (ISMICS) 2011. Innovations (Phila). 2012 Jul-Aug;7(4):229-41. doi: 10.1097/IMI.0b013e3182747699. PMID: 23123988. |
No systematic review, consensus statement. |
|
Yokomuro M, Ebine K, Shiroma K, Tamura S, Kumabe S, Ohtuki M, Suzuki H, Uchida S. Safety and efficacy of autologous platelet transfusion in cardiac surgery: comparison of cryopreservation, blood collection on the day before surgery, and blood collection during surgery. Cryobiology. 1999 May;38(3):236-42. doi: 10.1006/cryo.1999.2167. PMID: 10328913. |
Observational study. Does not comply with the PICO: autologous platelet transfusion, this is a different product.
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-07-2024
Beoordeeld op geldigheid : 05-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan.
Werkgroep
- Dr. M. (Maarten) ter Horst (voorzitter), NVA, anesthesioloog, Erasmus MC
- Drs. J.M.A.A. (Joost) van der Maaten, NVA, anesthesioloog, UMC Groningen
- Dr. A.B.A. (Alexander) Vonk, NVT, cardiothoracaal Chirurg, Amsterdam UMC
- Drs. E.J. (Edgar) Daeter, NVT, cardiothoracaal chirurg, St. Antonius Ziekenhuis
- Dr. R.I. (Rick) Meijer, NIV/NVIVG, internist, Radboud UMC
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, NIV, internist, HagaZiekenhuis
- Dr. A.J.G. (Gerard) Jansen, NIV, internist, Erasmus MC
- Prof. dr. A.P.J. (Alexander) Vlaar, NVIC, intensivist, Amsterdam UMC
- Prof. dr. ir. Y.M.C. (Yvonne) Henskens, NVKC, laboratoriumspecialist klinische chemie, Maastricht UMC
- Dr. N.R. (Nick) Bijsterveld, NVVC, cardioloog, Amsterdam UMC
- Dr. N. (Nienke) van Rein, NVZA, ziekenhuisapotheker, Leiden UMC
- I.G.J. (Ilse) Verstraaten, MSc, beleidsmedewerker Harteraad
Klankbordgroep
- Drs. K. (Karin) Gorter, NeSECC, klinisch perfusionist, UMC Utrecht
- Drs. A.R. (Arnold) van Oostrum, NeSECC, klinisch perfusionist, OLVG
- Dr. A.J. (Sander) Spanjersberg, NVA, cardioanesthesioloog, Isala Zwolle
- Dr. P.A.W. (Peter) te Boekhorst, NIV, internist, Erasmus Medisch Centrum
Met ondersteuning van
- Dr. R. (Romy) Zwarts-van de Putte, adviseur Kennisinstituut
- Drs. E.R.L. (Evie) Verweg, junior adviseur Kennisinstituut
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
ter Horst |
Anesthesioloog (Erasmus MC) |
Bestuurslid sectie cardio-anesthesiologie niet betaald Lid van de Landelijke gebruikersraad van Sanquin namens de NVA niet betaald Lid Leidraad EHH, CCU, ICCU gecoördineerd door kennisinstituut niet betaald lid EACTAIC subcommissie TEE niet betaald |
- Presentatie over eigen onderzoek CLS-Behring over ROTEM (verkoop fibrinogeen) (betaling aan het ziekenhuis, betaling voor tijd), hebben geen invloed op wat er verteld wordt. - Verricht onderzoek naar vermindering van bloedproducten verbruik bij cardiochirurgie: recent artikel over dit onderwerp gepubliceerd. Als er intellectueel belang is dan is dit minimaal. |
Volgens de werkgroep geen restrictie nodig. De betaling van de presentatie is puur voor de tijd die erin wordt gestoken, de financier heeft geen invloed op de inhoud van de presentatie. |
|
van der Maaten |
Anesthesioloog (UMCG) |
Lid RvT Nederlandse Hart Registratie (NHR) |
Geen |
Geen restrictie |
|
Vonk |
Cardiothoracaal Chirurg (AUMC Amsterdam) |
Geen |
Geen |
Geen restrictie |
|
Daeter |
Cardiothoracaal Chirurg (St. Antonius ziekenhuis Nieuwegein) |
Medisch manager eenheid hart antonius ziekenhuis |
Geen |
Geen restrictie |
|
Meijer |
Internist (Radboudumc) |
Geen |
Geen |
Geen restrictie |
|
Kerkhoffs |
Internist-hematoloog (HagaZiekenhuis Den Haag) |
Transfusie Specialist/senior onderzoeker, Sanquin Amsterdam, Research en transfusie consulten FTE 0.2 (onderzoek over bloedplaatjes, verder geen directe link met richtlijn). |
Geen |
Geen restrictie |
|
Jansen |
Internist-hematoloog (Erasmus MC) |
Wetenschappelijk voorzitter NVB |
Research funding: Principia, Argenx, CSL Behring, Sobi, EHA Research Fellowship (PI): personal fellowship for research. - Consultancy: Novartis, Amgen. Paid |
Geen restrictie. De onderzoeken hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld.
|
|
Vlaar |
Intensivist (Amsterdam- UMC) |
Lid Medische adviesraad Sanquin |
PI van PACER trial (ZonMw gefinancierd) Werfen in kind sponsoring CSL Behring studie grant en consultancy LSBR Fellowship op het gebied van TACO VIDI op gebied van TRALI |
Geen restrictie. De farma gesponsorde studies hebben geen betrekking op de modules uit de opgestelde richtlijn. |
|
Henskens |
Klinisch chemicus en waarnemend hoofd Centraal diagnostisch Laboratorium (CDL) Maastricht UMC+, Hoogleraar Klinische Chemie, in het bijzonder hemostase. 0.9 fte (CDL, MUMC+), 0.1 fte Universiteit Maastricht, FHML (faculty of Health, Medicine and Life Sciences). |
VHL Vereniging hematologische laboratoria, voorzitter (onbetaald); Landelijke en regionale gebruikersraad Sanquin (onbetaald), TVB Tijd voor verbinding antistollingszorg Expert team, namens NFU (vacatiegelden), Richtlijn antithrombotisch beleid, op afroep namens NVKC (vacatiegelden), voorzitter concilium NVKC (vacatiegelden), Lid Raad Opleidng FMS (onbetaald). |
Projectleider van de studie: Laboratory Predictors of hemostasis and thrombosis. Financier Siemens, Stago, Roche, Werfen, Nodia (korting of gratis reagentia of apparatuur te leen van bovenstaande bedrijven, zij financieren geen studies). |
Exclusie besluitvorming aanbevelingen module over POC testfacilieit aangezien het extern gefinancierde onderzoek mogelijk tot belangenverstrengeling leidt. Het werkgroeplid heeft geen band met één specifieke firma, alle testen worden onderzocht.
|
|
Bijsterveld |
Cardioloog (Amsterdam UMC) |
Voorzitter NVVC werkgroep Cardiologie en Sport (onbetaald) |
Geen |
Geen restrictie |
|
van Rein |
Ziekenhuisapotheker, Klinische Farmacie en Toxicologie, LUMC. 0.83 FTE. Inkopen en logistiek geneesmiddelen, directe patientenzorg, trials, onderwijs. Assistant progessor, Klinische Epidemiologie, LUMC, 0.17 FTE. Begeleiden promovendi, beurzen schrijven, onderwijs. |
Richtlijn antitrombotisch beleid |
Extern gefinancierd onderzoek (geen projectleider) – ZonMw GGG: Distinct onderzoek: optimaliseren tromboseprophylaxe na orthopedische ingrepen + L-TRRiP studie: optimaliseren trombosebehandeling na eerste veneuze trombose. Ook extern gefinancierd onderzoek vanuit de Trombosestichting: balans bloedingen en trombose optimaliseren dmv proteomics, wel projectleider.
Daarnaast ook verantwoordelijk voor alle geneesmiddelen studies die lopen in het LUMC en het CHDR, maar neem daar niet zelf actief aan deel. |
Geen restrictie, de trials hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld. |
|
Verstraaten |
Beleidsadviseur Harteraad |
Geen |
Geen |
Geen restrictie |
|
Gorter |
Klinisch perfusionist, Heartbeat Dutch Perfusion Service, UMCU |
Geen |
Projectleider van onderzoek verschillende ACT targets tijdens CPB. Financier medtronic. |
Geen restrictie, Gorter is onderdeel van de klankbordgroep en niet actief betrokken bij het formuleren van de aanbevelingen met betrekking tot ACT targets. |
|
van Oostrum |
Klinisch Perfusionist MCL (betaald) |
Voorzitter NeSECC (onbetaald) |
Praktijkvoordeel omdat ik werkzaam ben als klinisch perfusionist, en we hier in de praktijk op de OK baat bij kunnen hebben. |
Geen restrictie |
|
Spanjersberg |
Isala, MSB |
Geen |
Voordracht fibrinogeen in hartchirurgie (sponsor CSL) |
Geen restrictie |
|
te Boekhorst |
Internist-Hematoloog / transfusiespecialist, Erasmus MC |
Voorzitter stichting TRIP |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door benoem gebruikte methode: uitnodigen van de patiëntenvereniging Harteraad voor de invitational conference en een afgevaardigde van de patiëntenvereniging Harteraad in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Toediening koude trombocyten |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepassbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging voor Cardiologie (NVvC), Nederlandse Vereniging voor Intensive Care (NVIC), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskund (NVKC), Harteraad, Inspectie Gezondheidszorg en Jeugd (IGJ), Vereniging Innovatieve Geneesmiddelen (VIG), en de Nederlandse Vereniging voor Anesthesiologiemedewerkers (NVAM) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Kennisvragen
De kennislacunes per module staan onder ‘Bijlagen’ en dan ‘Onderzoek’.
Inleiding
Tijdens de ontwikkeling van de richtlijn peri-operatief bloed en (anti)stollingsmanagement is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based richtlijn ontwikkeling (EBRO) is duidelijk geworden dat er nog kennisvragen bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk.
Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVT - Perioperatief bloed- en (anti)stollingsmanagement voor cardiochirurgie in Nederland |
|
|
Uitgangsvraag: Wat is de waarde van het geven van gekoelde trombocyten bij patiënten die cardiochirurgie ondergaan? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 25-8-2022 |
|
Periode: nvt |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: Cardio- thoracic/vascular surgery AND thrombocyte AND low temperature procedures Alle sleutelartikelen worden gevonden |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 25-8-2022 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over de waarde van het geven van gekoelde trombocyten bij patiënten die cardiochirurgie ondergaan. De literatuurzoekactie leverde 299 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
18 |
3 |
18 |
|
RCTs |
65 |
24 |
64 |
|
Observationele studies |
274 |
83 |
217 |
|
Overig |
|
|
|
|
Totaal |
|
|
299 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#18 |
#13 AND #17 alle sleutelartikelen gevonden |
3 |
|
#17 |
#14 OR #15 OR #16 |
3 |
|
#16 |
a AND randomized, AND controlled AND pilot AND clinical AND trial AND of AND cryopreserved AND platelets AND for AND perioperative AND surgical AND bleeding AND 2019 AND reade |
1 |
|
#15 |
a AND pilot AND randomized AND clinical AND trial AND of AND cryopreserved AND versus AND 'liquid stored' AND platelet AND transfusion AND for AND bleeding AND in AND cardiac AND surgery AND mcguinness |
1 |
|
#14 |
a AND pilot AND trial AND of AND platelets AND stored AND cold AND versus AND at AND room AND temperature AND for AND complex AND cardiothoracic AND surgery |
1 |
|
#13 |
#10 OR #11 OR #12 |
286 |
|
#12 |
#5 AND (#8 OR #9) OBS |
274 |
|
#11 |
#5 AND #7 RCT |
65 |
|
#10 |
#5 AND #6 SR |
18 |
|
#9 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13387684 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
436 |
|
#4 |
#1 AND #2 AND #3 |
826 |
|
#3 |
'low temperature procedures'/exp OR (((cold OR freez* OR frozen OR hypotherm* OR cryo*) NEAR/2 (thrombocyt* OR platelet*)):ti,ab,kw) |
181891 |
|
#2 |
'thrombocyte'/exp OR 'thrombocyte transfusion'/exp OR thrombocyt*:ti,ab,kw OR platelet*:ti,ab,kw |
468301 |
|
#1 |
'thorax surgery'/exp OR 'cardiovascular surgery'/de OR (((cardi* OR chest* OR thoracic OR thorax OR coronar*) NEAR/4 surg*):ti,ab,kw) OR 'coronary bypass*':ti,ab,kw |
782439 |
Ovid/Medline
|
# |
Searches |
Results |
|
13 |
6 and (9 or 10) OBS |
83 |
|
12 |
6 and 8 RCT |
24 |
|
11 |
6 and 7 SR |
3 |
|
10 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5229920 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4228301 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1539674 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
613099 |
|
6 |
5 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
120 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
137 |
|
4 |
1 and 2 and 3 |
143 |
|
3 |
exp Cryopreservation/ or ((cold or freez* or frozen or hypotherm* or cryo*) adj2 (thrombocyt* or platelet*)).ti,ab,kf. |
41853 |
|
2 |
Blood Platelets/ or exp platelet transfusion/ or platelet*.ti,ab,kf. or thrombocyt*.ti,ab,kf. |
308893 |
|
1 |
Thoracic Surgery/ or exp Cardiovascular Surgical Procedures/ or ((cardi* or chest* or thoracic or thorax or coronar*) adj4 surg*).ti,ab,kf. or coronary bypass*.ti,ab,kf. |
510094 |