Temperatuur tijdens CABG
Uitgangsvraag
Wat is de waarde van het koelen van patiënten die een coronaire bypassoperatie ondergaan?
Aanbeveling
Overweeg normothermie bij volwassen patiënten die een coronaire bypassoperatie (CABG) ondergaan.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek verricht naar de vergelijking tussen het koelen van patiënten tot 32-34°C en het niet koelen van patiënten 36-37°C die een coronaire bypassoperatie ondergaan. Er zijn vier RCT’s geïncludeerd die deze vergelijking hebben onderzocht. Voor zowel de cruciale als de belangrijke uitkomstmaten werd geen eenduidig verschil gevonden tussen patiënten die wel of niet gekoeld waren. De bewijskracht is zeer laag, hier ligt een kennislacune. De lage bewijskracht werd met name veroorzaakt door conflicterende resultaten welke van lage precisie waren en gemeten in een kleine patiëntengroep. Hiernaast zijn het meer dan 15 jaar oude studies waardoor ze minder representatief kunnen zijn door voortschrijdend inzicht in antistollingsbeleid, medicatie en apparatuur.
Door de zeer lage bewijskracht zal de keuze voor de het wel of niet koelen van de lichaamstemperatuur dus afhangen van andere factoren.
Postoperatieve cognitieve achteruitgang komt vaak voor na hartchirurgie. Een recente meta-analyse van Linassi (2022) onderzocht de relatie tussen deze cognitieve achteruitgang en de rol van intra-operatieve factoren, waaronder de temperatuur tijdens de ingreep. De meta-analyse van observationele studies liet zien dat de temperatuur niet van invloed is op het voorkomen van neurocognitieve stoornissen, beroerte en overlijden bij hartchirurgie. Wel lijkt normothermische cardiopulmonale bypass, vooral bij een mean arterial pressure (MAP) > 70 mmHg, het risico op postoperatief neurocognitieve achteruitgang na hartchirurgie te verminderen (Linassi, 2022). Omdat deze conclusie is gebaseerd op observationeel onderzoek is de bewijskracht laag tot zeer laag.
Aan het einde van de operatie worden gekoelde patiënten actief opgewarmd met de hartlongmachine. Hyperthermie (> 37 °C) van de hersenen moet worden voorkomen en wordt bewaakt middels een nasopharyngeale temperatuur sonde.
In de klinische praktijk leidt peroperatieve hypothermie soms tot een langere CPB-tijd en hierdoor kostbare OK tijd, tenzij men besluit om op de intensive care verder op te warmen. Dit verlengt het tijdstip tot extubatie en kan de doorstroming van de intensive care naar de vervolg afdeling belemmeren.
Het gebruik van normothermie past in het kader van fasttrack protocol, waarbij de patiënt zo kort mogelijk beademd wordt en sneller de IC/PACU kan verlaten.
Bij een on-pump benadering wordt het protocol van het ziekenhuis gevolgd wat betreft het koelen van de patiënt, waarbij de chirurg onderbouwd af kan wijken van het protocol n.a.v. de coronair anatomie, de soort plegie en de eventuele hypertrofie van het hart, en de voorkeur van de chirurg in het algemeen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bied patiënten en hun naasten begrijpelijke informatie over de operatie, de bijbehorende risico’s en de benodigde medicatie. Geef aan hoe en met wie zij contact kunnen opnemen bij eventuele vragen of complicaties.
Kosten (middelenbeslag)
De kosten zullen lager zijn als een patiënt normotherm behandeld wordt aangezien de patiënt dan sneller van de beademing kan, er een trend is tot minder gebruik van bloedproducten en de operatieduur korter zal zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
Wat betreft de aanvaardbaarheid zal dit afhangen van de gewoonte van de chirurg. Vooral oudere chirurgen zijn opgeleid met het koelen tijdens klem.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er zijn diverse voordelen die pleiten voor het gebruik van normothermie tijdens een CABG.
-
Bloedproducten: Het aantal patiënten die bloed en plaatjestransfusies krijgen lijkt minder te zijn in de normothermie groep. Het aantal transfusies per patiënt is minder in de normothermie groep in vergelijking met de hypothermiegroep. Elke transfusie brengt kosten met zich mee en heeft een negatieve invloed op de overleving.
-
Operatietijd en tijdstip tot extubatie: Opwarmen kan zorgen voor een langer Hartlongmachine/operatie tijd en tijd tot extubatie.
Onderbouwing
Achtergrond
Er is momenteel veel praktijkvariatie in Nederland wat betreft het koelen van patiënten tijdens een Coronary artery bypass grafting (CABG) met koude cardioplegie. Er zijn andere technieken zoals off-pump CABG en CABG met bloedcardioplegie, waarbij de lichaamstemperatuur van de patiënt niet wordt verlaagd. Sommige centra koelen hun patiënten die koude cardioplegie toegediend krijgen niet, andere centra koelen tot 32, 33 of 34 graden. Op dit moment is onbekend wat wordt verstaan onder de beste zorg. De lichaamstemperatuur heeft namelijk o.a. invloed op de stolling en daarmee wellicht op het verbruik van bloedproducten. Hiernaast kan langzame opwarming leiden tot een verlengde tijd op de hartlongmachine. Ook kan het koelen leiden tot verhoogde kans op infecties en cerebrale hyperthermie in de opwarmfase. Een veel gebruikt argument om wel te koelen tijdens een CABG is dat koelen het risico op myocardschade zou verminderen. Er zijn dus verschillende argumenten voor en tegen het koelen. Met deze richtlijn willen we meer houvast bieden om tot een uniformiteit te komen met betrekking tot dit onderwerp.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of hypothermia (32°C to 34°C) on the number of patients transfused when compared to normothermia (36°C to 37°C) in adult patients undergoing coronary artery bypass grafting (CABG). Sources: Boodhwani, 2007; Nathan, 2004; Rasmussen, 2007 |
|
Very low GRADE |
The evidence is very uncertain about the effect of hypothermia (32°C to 34°C) on the blood product consumption when compared to normothermia (36°C to 37°C) in adult patients undergoing coronary artery bypass grafting (CABG).
Sources: Grimm, 2000; Nathan, 2004; Rasmussen, 2007 |
|
Very low GRADE |
The evidence is very uncertain about the effect of hypothermia (32°C to 34°C) on mortality and complications compared to normothermia (36°C to 37°C) in adult patients undergoing coronary artery bypass grafting (CABG).
Sources: Boodhwani, 2007; 2006; Grimm, 2000; Nathan, 2004; |
|
no GRADE |
No evidence was found regarding the effect of hypothermia (32°C to 34°C) on the operation time when compared to normothermia (36°C to 37°C) in adult patients undergoing coronary artery bypass grafting (CABG). Source: - |
|
Very low GRADE |
The evidence is very uncertain about the effect of hypothermia (32°C to 34°C) on quality of life when compared to normothermia (36°C to 37°C) in adult patients undergoing coronary artery bypass grafting (CABG). Sources: Boodhwani, 2007 |
Samenvatting literatuur
Description of studies
Boodhwani (2007) evaluated the effects of sustained mild intraoperative hypothermia on neurocognitive function after coronary artery bypass surgery. Patients aged 60 years or older undergoing non-urgent coronary surgery were randomized to an intraoperative nasopharyngeal temperature of 34°C (hypothermic group, n=133) or 37°C (normothermic group, n=134). The temperature was maintained using water-circulating thermal control pads. No active rewarming was used. The follow-up was until three months after surgery. The following relevant outcome measures were reported: number of patients transfused, complications, and quality of life.
Grimm (2000) measured the effects of mild hypothermic (32°C) versus normothermic (37°C) cardiopulmonary bypass (CPB) on cognitive brain function in a prospective randomized study. In total, 144 patients who were referred for low-risk, elective CABG were included in the study. The indication for CABG was multi-vessel coronary heart disease resulting in stable angina in all patients. The patients were randomized to either mildly hypothermic CPB (n=72) or normothermic CPB (n=72). The follow-up was until four months after surgery. The following relevant outcome measures were reported: blood product consumption and complications.
Nathan (2004) explored the safety of mild hypothermia versus true normothermia in comparable groups of cardiac surgery patients. Patients older than 60 years who were scheduled to undergo nonemergency coronary artery surgery were included. In total, 144 patients were randomized to hypothermia (34°C, n=71) or normothermia (37°C, n=73). Patients were kept as close as possible to nasopharyngeal temperatures of 37°C or 34°C throughout the intraoperative period. The follow-up was until hospital discharge. The following relevant outcome measures were reported: number of patients transfused, blood product consumption and complications.
Rasmussen (2007) investigated the effect of systemic cardiopulmonary bypass (CPB) temperature on the production of key mediators of the systemic inflammatory response to CABG surgery. Patients who were scheduled for first-time CABG surgery with CPB were randomized to hypothermic CPB (active cooling to a bladder temperature of 32°C, n=15) or to normothermic CPB (active warming to a bladder temperature of 36°C, n=14). Inclusion criteria were: elective surgery, left-ventricular ejection fraction > 0.5, age ≤ 70 years, with no obstructive or restrictive pulmonary disease, no renal disease, a BMI ≤30 kg/m2 and no steroid therapy. The follow-up was until 44 hours in the ICU after surgery. The following relevant outcome measures were reported: number of patients transfused and blood product consumption.
Results
Number of patients transfused (critical)
Three studies reported the outcome measure number of patients transfused (Boodhwani, 2007; Nathan, 2004; Rasmussen, 2007). Due to study heterogeneity, the results were not pooled.
Boodhwani (2007) reported the number of patients requiring blood products. In total, 41 out of the 134 patients (31%) who were kept at normothermia required blood products, versus 52 out of the 133 patients (39%) who were brought at hypothermia. The relative risk (RR) was 1.28 (95% confidence interval (CI) 0.92 to 1.78), in favour of normothermia. This difference is considered clinically relevant.
Nathan (2004) reported the number of patients receiving intraoperative allogeneic red blood cells, and blood utilization in the ICU. In total, 7 out of the 73 patients (10%) who were kept at normothermia used intraoperative allogeneic red blood cells, versus 4 out of the 71 patients (6%) who were brought to hypothermia. The RR was 0.59 (95%CI 0.18 to 1.92), in favour of hypothermia. This difference is considered clinically relevant.
In total, 23 out of the 73 patients (32%) who were kept at normothermia used allogeneic red blood cells in the ICU, versus 24 out of the 71 patients (34%) who were brought to hypothermia (Nathan, 2004). The RR was 1.07 (95%CI 0.67 to 1.72), in favour of normothermia. This difference is not considered clinically relevant.
In total, 1 out of the 73 patients (1%) who were kept at normothermia used platelets in the ICU, versus 1 out of the 71 patients (2%) who were brought to hypothermia (Nathan, 2004). The RR was 1.03 (95%CI 0.07 to 16.12), in favour of normothermia. This difference is not considered clinically relevant.
Rasmussen (2007) reported the number of patients that required blood substitutes within the first 24 hours in the ICU after surgery. In total, 5 out of the 15 patients (33%) that were brought to hypothermia required packed erythrocytes, versus 5 out of the 14 patients (36%) that were kept at normothermia. The RR was 0.93 (95%CI 0.34 to 2.54), in favour of hypothermia. This difference is not considered clinically relevant.
Furthermore, 3 out of the 15 patients (20%) that were brought to hypothermia required platelets, versus 1 out of the 14 patients (7%) that were kept at normothermia (Rasmussen, 2007). The RR was 2.80 (95%CI 0.33 to 23.86), in favour of normothermia. This difference is considered clinically relevant.
Blood product consumption (critical)
Three studies reported the outcome measure blood product consumption (Grimm, 2000; Nathan, 2004; Rasmussen, 2007). Due to study heterogeneity, the results were not pooled.
Grimm (2000) reported the mean number of blood units. Patients who were brought to hypothermia (n=72) had a mean of 1.8 ± 0.8 blood units, patients who were kept at normothermia (n=72) had a mean of 1.3 ± 0.5 blood units. The mean difference is 0.50 (95% CI 0.28 to 0.72) blood units, in favor of normothermia. This difference is not considered clinically relevant.
Nathan (2004) reported the number of units of red blood cells and platelets in the ICU. In total, the 73 patients who were kept at normothermia used 0.7 units ± 1.4 of allogeneic red blood cells in the ICU, versus 0.7 units ± 1.2 in the 71 patients who were brought to hypothermia. This means that there is no difference in the number of red blood cell units used among the two patient groups (mean difference (MD) 0.00, 95%CI -0.43 to 0.43). In total, the 73 patients who were kept at normothermia used 0.1 units ± 0.9 platelets in the ICU, versus 0.1 units ± 0.7 in the 71 patients who were brought to hypothermia. This means that there is no difference in the number platelet units used among the two patient groups (MD 0.00, 95%CI -0.26 to 0.26).
Rasmussen (2007) reported the total volume of blood substitutes (mL) within the first 24 hours in the ICU after surgery. Five out of the fifteen patients that were brought to hypothermia required 3300 mL packed erythrocytes, versus five out of the the fourteen patients that were kept at normothermia required 2700 mL packed erythrocytes. The difference is 600 mL in favour of normothermia, the mean difference is 120 mL. This difference is considered not clinically relevant. Furthermore, three out of the 15 patients that were brought to hypothermia required 1200 mL platelets, versus 1 out of the 14 patients that were kept at normothermia required 300 mL platelets. The difference is 900 mL, in favour of normothermia, the mean difference is 100 mL. This difference is not considered clinically relevant.
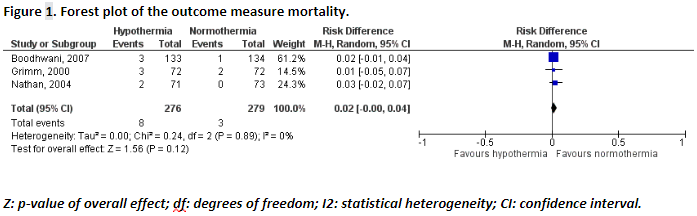
Mortality (important)
Three studies reported the outcome measure mortality (Boodhwani, 2007; Grimm, 2000; Nathan, 2004). In total, 3 out of the 279 patients (1%) that were kept at normothermia died, versus 8 out of the 276 patients (3%) that were brought to hypothermia. The pooled risk difference (RD) was 0.02 (95%CI -0.00 to 0.04), in favour of normothermia (Figure 1). This difference is not considered clinically relevant.
Complications (important)
Three studies reported the outcome measure complications (Boodhwani, 2007; Grimm, 2000; Nathan, 2004). The results are presented for the individual complications below.
Reopening for bleeding
Two studies reported the outcome measure reopening for bleeding (Boodhwani, 2007; Nathan, 2004). As only two studies were included, the results were not pooled.
Boodhwani (2007) reported the complication reopening for bleeding. In total, 3 out of the 134 patients (3%) who were kept at normothermia were reopened for bleeding, versus 3 out of the 133 patients (2%) who were brought at hypothermia. The RD was 0.00 (95%CI -0.04 to 0.04), this means that there is no difference between the two groups.
Nathan (2004) reported the complication reopening for bleeding. In total, 2 out of the 73 patients (3%) who were kept at normothermia were reopened for bleeding, versus 2 out of the 71 patients (3%) who were brought to hypothermia. The RD was 0.00 (95%CI -0.05 to 0.05), this means that there is no difference between the two groups.
Neurological complications
One study (Boodhwani, 2007) reported the outcome measure neurological complications (neurologic deficits and encephalopathy).
Boodhwani (2007) reported the complication focal neurologic deficits. In total, 0 out of the 134 patients (0%) who were kept at normothermia had a focal neurological complication, versus 1 out of the 133 patients (1%) who were brought at hypothermia. The RD was 0.01 (95%CI -0.01 to 0.03), in favour of normothermia. This difference is not considered clinically relevant.
Boodhwani (2007) also reported the complication encephalopathy. In total, 4 out of the 134 patients (3%) who were kept at normothermia had encephalopathy, versus 4 out of the 133 patients (3%) who were brought at hypothermia. The RD was 0.00 (95%CI -0.04 to 0.04), this means that there is no difference between the two groups.
Cardiovascular complications
Three studies reported the outcome measure cardiovascular complications (atrial fibrillation, heart muscle damage, myocardial infarction, and stroke). Due to study heterogeneity, the results were not pooled.
Boodhwani (2007) reported the complication perioperative atrial fibrillation. In total, 49 out of the 134 patients (39%) who were kept at normothermia had a cardiovascular complication, versus 44 out of the 133 patients (34%) who were brought at hypothermia. The RD was -0.03 (95%CI -0.15 to 0.08), in favour of hypothermia. This difference is not considered clinically relevant.
Grimm (2000) reported the complication atrial fibrillation. In total, 25 out of the 72 patients (35%) who were brought to hypothermia had atrial fibrillation, versus 26 out of the 72 patients (36%) kept at normothermia. The RD was -0.01 (95%CI -0.17 to 0.14), in favour of hypothermia. This difference is not considered clinically relevant.
Grimm (2000) reported the complication myocardial infarction. In total, 1 out of the 72 patients (1%) who were brought to hypothermia had a myocardial infarction, versus 1 out of the 72 patients (1%) kept at normothermia. The RD was 0.00 (95%CI -0.04 to 0.04), this means that there is no difference between the two groups.
Grimm (2000) reported the complication stroke. In total, 0 out of the 72 patients (0%) who were brought to hypothermia had a stroke, versus 0 out of the 72 patients (0%) kept at normothermia. This means that there is no difference between the groups regarding the complication stroke.
Wound infections
Two studies reported the complication wound infections (Boodhwani, 2007; Grimm, 2000). As only two studies were included, the results were not pooled.
Boodhwani (2007) reported the complication wound infections. In total, 8 out of the 134 patients (6%) who were kept at normothermia had a wound infection, versus 4 out of the 133 patients (3%) who were brought at hypothermia. The RD was -0.03 (95%CI -0.08 to 0.02), in favour of hypothermia. This difference is not considered clinically relevant.
Grimm (2000) reported the complication wound infections. In total, 2 out of the 72 patients (3%) who were brought to hypothermia died, versus 1 out of the 72 patients (1%) kept at normothermia. The RD was 0.01 (95%CI -0.03 to 0.06), in favour of normothermia. This difference is not considered clinically relevant.
Operating time
None of the included studies reported the outcome measure operating time.
Quality of life
One study reported the outcome measure quality of life (Boodhwani, 2007). Boodhwani (2007) reported the quality of life (physical and mental component scores) at baseline and after three months of follow-up using the short form health survey 12 items (SF-12).
Physical component score
At three months of follow-up the patients who were kept at normothermia had a physical component score of 42.3 ± 10.4, patients who were brought at hypothermia had a physical component score of 44.0 ± 9.1. The mean difference is 1.70 (95%CI -0.64 to 4.04), in favour of hypothermia. This difference is not considered clinically relevant.
Mental component score
At three months of follow-up the patients who were kept at normothermia had a mental component score of 54.1 ± 7.8, patients who were brought at hypothermia had a physical component score of 55.2 ± 7.0. The mean difference is 1.10 (95%CI -0.68 to 2.88), in favour of hypothermia. This difference is not considered clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome measure number of patients transfused was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), conflicting results (inconsistency, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure blood product consumption was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), conflicting results (inconsistency, -1), and because of a very small number of patients (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure mortality was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure complications was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), conflicting results (inconsistency, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
The level of evidence regarding the outcome measure operation time could not be graded, as the included studies did not report this outcome measure.
The level of evidence regarding the outcome measure quality of life was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of cooling (up to 32-34°C) of adult patients undergoing a coronary artery bypass grafting (CABG) with cold cardioplegia compared to not cooling the patient?
| P: | adult patients undergoing CABG |
| I: | cooling (up to 32-34°C) |
| C: | not cooling the patient (36-37°C) |
| O: | number of patients transfused, blood product consumption, complications, operating time, quality of life |
Relevant outcome measures
The guideline development group considered number of patients transfused, blood product consumption, as critical outcome measures for decision making; and mortality, complications, operating time, and quality of life as important outcome measures for decision making.
The working group defined the outcome measures as follows:
-
Number of patients transfused: erythrocytes and thrombocytes
-
Blood product consumption: erythrocytes and thrombocytes
A priori, the working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically (patient) important difference.
-
Mortality: ≥10% (RR < 0.9 and RR > 1.1; RD > 0.10)
-
Complications: 25% (RR < 0.8 and RR > 1.25)
-
Number of patients transfused: 10% (RR < 0.9 and RR > 1.1)
-
Blood product consumption: (1 product, 270 ml)
-
Operating time: 15 minutes
-
Quality of life: 2 points (10 point scale), 20 points (100 point scale)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 23-09-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 695 hits. Studies were selected based on the following criteria: systematic reviews and randomized controlled studies comparing cooling of adult patients undergoing CABG up to 32-34°C versus not cooling the patients (36-37°C). In total, twenty studies were initially selected based on title and abstract screening. After reading the full text, sixteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Boodhwani M, Rubens F, Wozny D, Rodriguez R, Nathan HJ. Effects of sustained mild hypothermia on neurocognitive function after coronary artery bypass surgery: a randomized, double-blind study. J Thorac Cardiovasc Surg. 2007 Dec;134(6):1443-50; discussion 1451-2. doi: 10.1016/j.jtcvs.2007.08.016. Epub 2007 Oct 29. PMID: 18023662.
- Engelman RM, Pleet AB, Hicks R, Rousou JA, Flack JE 3rd, Deaton DW, Pekow PS, Gregory CA. Is there a relationship between systemic perfusion temperature during coronary artery bypass grafting and extent of intraoperative ischemic central nervous system injury? J Thorac Cardiovasc Surg. 2000 Feb;119(2):230-2. doi: 10.1016/S0022-5223(00)70177-2. PMID: 10649197.
- Grimm M, Czerny M, Baumer H, Kilo J, Madl C, Kramer L, Rajek A, Wolner E. Normothermic cardiopulmonary bypass is beneficial for cognitive brain function after coronary artery bypass grafting--a prospective randomized trial. Eur J Cardiothorac Surg. 2000 Sep;18(3):270-5. doi: 10.1016/s1010-7940(00)00510-8. PMID: 10973534.
- Linassi F, Maran E, De Laurenzis A, Tellaroli P, Kreuzer M, Schneider G, Navalesi P, Carron M. Targeted temperature management in cardiac surgery: a systematic review and meta-analysis on postoperative cognitive outcomes. Br J Anaesth. 2022 Jan;128(1):11-25. doi: 10.1016/j.bja.2021.09.042. Epub 2021 Nov 30. PMID: 34862000.
- Nathan HJ, Parlea L, Dupuis JY, Hendry P, Williams KA, Rubens FD, Wells GA. Safety of deliberate intraoperative and postoperative hypothermia for patients undergoing coronary artery surgery: a randomized trial. J Thorac Cardiovasc Surg. 2004 May;127(5):1270-5. doi: 10.1016/j.jtcvs.2003.07.018. PMID: 15115982.
- Rasmussen BS, Sollid J, Rees SE, Kjaergaard S, Murley D, Toft E. Oxygenation within the first 120 h following coronary artery bypass grafting. Influence of systemic hypothermia (32 degrees C) or normothermia (36 degrees C) during the cardiopulmonary bypass: a randomized clinical trial. Acta Anaesthesiol Scand. 2006 Jan;50(1):64-71. doi: 10.1111/j.1399-6576.2006.00897.x. PMID: 16451153.
- Rasmussen BS, Sollid J, Knudsen L, Christensen T, Toft E, Tønnesen E. The release of systemic inflammatory mediators is independent of cardiopulmonary bypass temperature. J Cardiothorac Vasc Anesth. 2007 Apr;21(2):191-6. doi: 10.1053/j.jvca.2006.02.030. Epub 2006 May 30. PMID: 17418730.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: What are the (un)favorable effects of cooling (up to 32-34 degrees) of adult patients undergoing a CABG with cold cardioplegia compared to not cooling the patient?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Boodhwani, 2007 |
Type of study: RCT
Setting and country: prospective, Canada
Funding and conflicts of interest: not reported. |
Inclusion criteria: Patients aged 60 years or older who were scheduled to undergo non-urgent coronary artery surgery.
Exclusion criteria: Patients with known neurologic deficits (previous stroke, history of Parkinson disease, CNS score <11.5, or abnormal MMMS scores), serum creatinine greater than twice the normal level, and patients undergoing repeat cardiac surgery.
N total at baseline: Intervention: 134 Control: 133
Important prognostic factors2: age ± SD: I: 68.2 (6) C: 69.3 (6)
Sex: I: 85% M C: 87% M
Groups comparable at baseline? Baseline characteristics were similar between groups.
|
Describe intervention (treatment/procedure/test):
Hypothermic intraoperative nasopharyngeal temperature (34°C).
|
Describe control (treatment/procedure/test):
Normothermic intraoperative nasopharyngeal temperature (37°C). |
Length of follow-up: Three months.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
number of patients transfused Intervention: 52 (39%) Control: 41 (31%)
blood product consumption not reported.
complications (including bleeding and heart muscle damage CK-MB) in-hospital mortality intervention: 3 (2%) control: 1 (1%)
focal neurologic deficits intervention: 1 (1%) control: 0 (0%)
encephalopathy intervention: 4 (3%) control: 4 (3%)
reopening for bleeding intervention: 3 (2%) control: 3 (2%)
perioperative atrial fibrillation intervention: 44 (34%) control: 49 (39%)
wound infections intervention: 4 (3%) control: 8 (6%)
postoperative cognitive deficit intervention: 49% control: 45%
operating time not reported.
quality of life (SF-12) physical component: intervention: 34.8 (9.4) control: 35.4 (10.3)
mental component score intervention: 52.4 (9.2) control: 52.8 (8.0)
After 3 months: physical component: intervention: 44.0 (9.1) control: 42.3 (10.4)
mental component score intervention: 55.2 (7.0) control: 54.1 (7.8)
|
Author’s conclusion Mild intraoperative hypothermia has no major adverse effects but does not decrease the incidence of neurocognitive deficits in patients undergoing coronary artery bypass surgery. In the absence of rewarming and cerebral hyperthermia, sustained mild hypothermia does not improve cognitive outcome. |
|
Codispoti, 2006 |
Type of study: RCT
Setting and country: prospective, UK
Funding and conflicts of interest: The study has been supported by a grant from the British Heart Foundation. |
Inclusion criteria: Patients undergoing coronary artery bypass grafting (CABG) with intermittent cross-clamping and ventricular fibrillation.
Exclusion criteria: Patients who had already undergone CABG and those requiring associated procedures necessitating the opening of a heart chamber; patients with evidence of recent (less than seven days) myocardial infarction (due to the effects on measured biochemical indices of necrosis), and/or those with elevated levels of cTnI at baseline; patients of age greater than 70 years and those taking oral sulfonylurea agents.
N total at baseline: Intervention: 26 Control: 26
Important prognostic factors2: age ± SD: I: 63.3 (2.4) C: 62.4 (2.2)
Sex (M/F) I: 20/6 C: 19/7
Groups comparable at baseline? There were no significant differences between groups for pre- and intra-operative variables that might have influenced the chosen endpoints.
|
Describe intervention (treatment/procedure/test):
Systemic and cardiac temperatures were controlled by means of nasopharyngeal and anterior interventricular septal probes.
Patients were brought to hypothermia (31.5±0.5 °C) after onset of cardiopulmonary bypass and maintained at that level until completion of the last distal anastomosis.
|
Describe control (treatment/procedure/test):
Systemic and cardiac temperatures were controlled by means of nasopharyngeal and anterior interventricular septal probes.
Patients were kept at normothermia (36.5±0.5 °C) throughout the duration of their operation.
|
Length of follow-up: cTnI levels were measured until 72 hours after cardiopulmonary bypass. Total follow-up is until hospital discharge.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
number of patients transfused not reported.
blood product consumption not reported.
complications (including bleeding and heart muscle damage CK-MB) Patients in the normothermia group had 1.3 ± 0.2 µg/l cTnI release, patients in the hypothermia group had 0.8 ± 0.1 µg/l cTnI release. operating time not reported.
quality of life not reported.
|
Author’s conclusion: not applicable, focus on the induction of ischaemic preconditioning. |
|
Grimm, 2000 |
Type of study: RCT
Setting and country: prospective RCT, Austria
Funding and conflicts of interest: not reported. |
Inclusion criteria: Patients who were referred for low-risk, elective CABG. The indication for CABG was multi-vessel coronary heart disease resulting in stable angina.
Exclusion criteria: Not reported.
N total at baseline: Intervention: 72 Control: 72
Important prognostic factors2: age ± SD: I: 61.0 (6.5) C: 62.4 (6.1)
Sex M:F: I: 65/7 C: 62/10
Groups comparable at baseline? Both patient groups were well comparable according to demographic data.
|
Describe intervention (treatment/procedure/test):
Hypothermic (32 °C) cardiopulmonary bypass.
|
Describe control (treatment/procedure/test):
Normothermic (37 °C) cardiopulmonary bypass. |
Length of follow-up: Four months after surgery.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
number of patients transfused Not reported.
blood product consumption Intervention: 1.8 units (SD 0.8) Control: 1.3 units (SD 0.5)
complications (including rebleeding and heart muscle damage CK-MB) myocardial infarction: Intervention: 1 Control: 1
stroke: Intervention: 0 Control: 0
death: Intervention: 3 Control: 2
Wound infections Intervention: 2 Control: 1
Atrial fibrillation: Intervention: 25 Control: 26
operating time Not reported.
quality of life Not reported. |
Author’s conclusion: Subclinical impairment of cognitive brain function is more pronounced in patients undergoing mildly hypothermic CPB as compared with normothermic CPB for CABG. |
|
Nathan, 2004 |
Type of study: RCT
Setting and country: prospective, Canada
Funding and conflicts of interest: not reported. |
Inclusion criteria: Patients older than 60 years who were scheduled to undergo nonemergency coronary artery surgery
Exclusion criteria: Patients with neurological deficits, serum creatinine more than twice normal and those with a history of cardiac surgery.
N total at baseline: Intervention:71 Control: 73
Important prognostic factors2: age ± SD: I: 68 (6) C: 70 (7)
Sex: I: 90% M C: 84% M Groups comparable at baseline? The preoperative characteristics were similar. |
Describe intervention (treatment/procedure/test):
On arrival in the operating room, high-efficiency thermal pads were applied to the patient’s back and posterior aspect of the upper leg. The pads were connected to a water-circulating thermal control system and cooling to 34 °C was begun.
Patients were kept as close as possible to nasopharyngeal temperatures of 34 °C throughout the intraoperative period.
|
Describe control (treatment/procedure/test):
Patients in the normothermic group were warmed with a forced-air heating blanket for 15 to 30 minutes before entering the operating room.
On arrival in the operating room, high-efficiency thermal pads were applied to the patient’s back and posterior aspect of the upper leg. The pads were connected to a water-circulating thermal control system and warming to 37 °C was begun.
Patients were kept as close as possible to nasopharyngeal temperatures of 37 °C throughout the intraoperative period.
|
Length of follow-up: Until hospital discharge.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
number of patients transfused In total, 7 out of the 73 patients (10%) who were kept at normothermia used intraoperative allogeneic red blood cells, versus 4 out of the 71 patients (6%) who were brought to hypothermia.
In total, 23 out of the 73 patients (32%) who were kept at normothermia used allogeneic red blood cells in the ICU, versus 24 out of the 71 patients (34%) who were brought to hypothermia.
In total, 1 out of the 73 patients (1%) who were kept at normothermia used platelets in the ICU, versus 1 out of the 71 patients (2%) who were brought to hypothermia.
blood product consumption In total, the 73 patients who were kept at normothermia used 0.7 units ±1.4 of allogeneic red blood cells in the ICU, versus 0.7 units ±1.2 in the 71 patients who were brought to hypothermia. This means that there is no difference in the number of red blood cell units used among the two patient groups. In total, the 73 patients who were kept at normothermia used 0.1 units ± 0.9 platelets in the ICU, versus 0.1 units ± 0.7 in the 71 patients who were brought to hypothermia. This means that there is no difference in the number platelet units used among the two patient groups.
complications (including bleeding and heart muscle damage CK-MB)
In total, 2 out of the 73 patients (3%) who were kept at normothermia were reopened for bleeding, versus 2 out of the 71 patients (3%) who were brought to hypothermia.
In total, 0 out of the 73 patients (0%) who were kept at normothermia died, versus 2 out of the 71 patients (3%) who were brought to hypothermia.
operating time not reported.
quality of life not reported. |
Author’s conclusion: Our data support the safety of perioperative mild hypothermia in patients undergoing elective non-reoperative coronary artery surgery with cardiopulmonary bypass.
These findings suggest that complete rewarming after hypothermic cardiopulmonary bypass is not necessary in all cases. |
|
Rasmussen, 2007 |
Type of study: RCT
Setting and country: prospective, Denmark.
Funding and conflicts of interest: Supported by grants from the Danish Heart Foundation and The Research Foundation of the Northern County of Jutland, Denmark.
Conflicts of interest are not reported. |
Inclusion criteria:
Patients who were scheduled for first-time CABG surgery with CPB, elective surgery, left-ventricular ejection fraction > 0.5, age ≤ 70 years, with no obstructive or restrictive pulmonary disease, no renal disease, a BMI ≤30 kg/m2 and no steroid therapy.
Exclusion criteria: Not reported.
N total at baseline: Intervention: 15 Control: 14
Important prognostic factors2: age ± SD: I: 60 (38-66) C: 63 (50-68)
Sex (M/F): I: 14/1 C: 13/1
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Hypothermic CPB: active cooling to a bladder temperature of 32°C.
|
Describe control (treatment/procedure/test):
Normothermic CPB: active warming to a bladder temperature of 36°C. |
Length of follow-up: The follow-up was until 44 hours in the ICU after surgery.
Loss-to-follow-up: Intervention: none.
Control: one patient from the normothermic group was excluded during the study because of an allergic reaction before CPB.
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
number of patients transfused In total, 5 out of the 15 patients (33%) that were brought to hypothermia required packed erythrocytes, versus 5 out of the 14 patients (36%) that were kept at normothermia. Furthermore, 3 out of the 15 patients (20%) that were brought to hypothermia required platelets, versus 1 out of the 14 patients (7%) that were kept at normothermia.
blood product consumption The 15 patients that were brought to hypothermia required 3300 mL packed erythrocytes, the 14 patients that were kept at normothermia required 2700 mL packed erythrocytes. The difference is 600 mL, in favour of normothermia.
Furthermore, the 15 patients that were brought to hypothermia required 1200 mL platelets, the 14 patients that were kept at normothermia required 300 mL platelets. The difference is 900 mL, in favour of normothermia.
complications (including bleeding and heart muscle damage CK-MB) not reported.
operating time not reported.
quality of life not reported. |
Author’s conclusion: The release of systemic inflammatory mediators after cardiac surgery was independent of mild hypothermia (32°C) versus normothermia (36°C) during CPB. |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What are the (un)favorable effects of cooling (up to 32-34 degrees) of adult patients undergoing a CABG with cold cardioplegia compared to not cooling the patient?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Boodhwani, 2007 |
Definitely yes
Reason: central randomization with computer generated randomization list. |
Definitely yes
Reason: treatment assignment was concealed in opaque, sealed envelopes that were assigned sequentially as patients were enrolled, according to age block. |
Probably yes
Reason: patients were unaware of the treatment assignment, which was not concealed from the clinical staff. |
Probably yes
Reason: loss to follow-up is not reported. |
Definitely yes;
Reason: all relevant outcome measures were reported. |
Definitely no;
Reason: The study was terminated early as funds were exhausted. |
Some concerns (all outcomes) |
|
Codispoti, 2006 |
No information
Not reported. |
No information
Not reported. |
No information
Not reported. |
Probably yes
Reason: loss to follow-up is not reported. |
Definitely yes
All relevant outcome measures were reported. |
Definitely no;
Small study sample (n=26 per group). Power calculations are not reported.
They selected a very specific patient sample, excluding factors that are present in a significant proportion of a normal patient population. |
HIGH (all outcomes) |
|
Grimm, 2000 |
No information
Not reported. |
No information
Not reported. |
No information
Not reported. |
Probably yes
Reason: loss to follow-up is not reported. |
Definitely yes
All relevant outcome measures were reported. |
Definitely no
Small study sample. Power calculations are not reported. |
HIGH (all outcomes) |
|
Nathan, 2004 |
Definitely yes
Reason: central randomization with computer generated randomization list. The randomization was stratified according to age, and blocks of 8 were used. |
Definitely yes
Reason: treatment assignment was concealed in opaque, sealed envelopes that were assigned sequentially as patients were enrolled, according to age block. |
Probably yes
Reason: patients were unaware of the treatment assignment, which was not concealed from the clinical staff. |
Probably yes
Reason: loss to follow-up is not reported. |
Definitely yes
All relevant outcome measures were reported. |
Definitely no
Small study sample. Power calculations are not reported. |
Some concerns (all outcomes) |
|
Rasmussen, 2007 |
No information
Not reported. |
No information
Not reported. |
No information
Not reported. |
Definitely yes
Only one patient was excluded during the study. |
Definitely yes
All relevant outcome measures were reported. |
Definitely no
Small study sample. Power calculations are not reported. |
HIGH (all outcomes) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Abbasciano RG, Koulouroudias M, Chad T, Mohamed W, Leeman I, Pellowe C, Kunst G, Klein A, Murphy GJ. Role of Hypothermia in Adult Cardiac Surgery Patients: A Systematic Review and Meta-analysis. J Cardiothorac Vasc Anesth. 2022 Jul;36(7):1883-1890. doi: 10.1053/j.jvca.2022.01.026. Epub 2022 Jan 31. PMID: 35221222. |
The systematic review does not include evidence tables and risk of bias assessment and is therefore not suited to be included. |
|
Codispoti M, Sundaramoorthi T, Saad RA, Reid A, Sinclair C, Mankad P. Optimal myocardial protection strategy for coronary artery bypass grafting without cardioplegia: prospective randomised trial. Interact Cardiovasc Thorac Surg. 2006 Jun;5(3):217-21. doi: 10.1510/icvts.2005.116863. Epub 2006 Jan 12. PMID: 17670550. |
Different patient group: patients do not receive CABG with cold cardioplegia. |
|
Engelman RM, Pleet AB, Hicks R, Rousou JA, Flack JE 3rd, Deaton DW, Pekow PS, Gregory CA. Is there a relationship between systemic perfusion temperature during coronary artery bypass grafting and extent of intraoperative ischemic central nervous system injury? J Thorac Cardiovasc Surg. 2000 Feb;119(2):230-2. doi: 10.1016/S0022-5223(00)70177-2. PMID: 10649197. |
Different intervention: cooling below 32 degrees (20 and 32 degrees is analysed as 1 group). |
|
Habibi V, Habibi MR, Habibi A, Emami Zeydi A. The protective effect of hypothermia on postoperative cognitive deficit may be attenuated by prolonged coronary artery bypass time: Meta-analysis and meta-regression. Adv Clin Exp Med. 2020 Oct;29(10):1211-1219. doi: 10.17219/acem/121920. PMID: 33064380. |
Different intervention: the meta-analysis also includes studies on cooling below 32 degrees. |
|
Ho KM, Tan JA. Benefits and risks of maintaining normothermia during cardiopulmonary bypass in adult cardiac surgery: a systematic review. Cardiovasc Ther. 2011 Aug;29(4):260-79. doi: 10.1111/j.1755-5922.2009.00114.x. Epub 2009 Dec 23. PMID: 20041882. |
Different intervention: the meta-analysis also includes studies on cooling below 32 degrees. |
|
Honore PM, Jacquet LM, Beale RJ, Renauld JC, Valadi D, Noirhomme P, Goenen M. Effects of normothermia versus hypothermia on extravascular lung water and serum cytokines during cardiopulmonary bypass: a randomized, controlled trial. Crit Care Med. 2001 Oct;29(10):1903-9. doi: 10.1097/00003246-200110000-00009. PMID: 11588449. |
Different outcomes: inflammatory mediators. |
|
Ip-Yam PC, Thomas SD, Jackson M, Rashid A, Behl S. Effects of temperature strategy during cardiopulmonary bypass on cerebral oxygen balance. J Cardiovasc Surg (Torino). 2000 Feb;41(1):1-6. PMID: 10836213. |
Different outcomes: arterial and jugular venous blood gases and lactate. |
|
Kadoi Y, Saito S, Takahashi K, Fujita N, Goto F. Jugular venous oxygen saturation during mild hypothermic versus normothermic cardiopulmonary bypass in elderly patients. Surg Today. 2004;34(5):399-404. doi: 10.1007/s00595-003-2736-7. PMID: 15108076. |
Different outcomes: hemodynamic parameters and arterial and jugular venous blood gases. |
|
Khatri P, Babyak M, Croughwell ND, Davis R, White WD, Newman MF, Reves JG, Mark DB, Blumenthal JA. Temperature during coronary artery bypass surgery affects quality of life. Ann Thorac Surg. 2001 Jan;71(1):110-6. doi: 10.1016/s0003-4975(00)02350-x. PMID: 11216728. |
Different intervention: cooling below 32 degrees. |
|
Linassi F, Maran E, De Laurenzis A, Tellaroli P, Kreuzer M, Schneider G, Navalesi P, Carron M. Targeted temperature management in cardiac surgery: a systematic review and meta-analysis on postoperative cognitive outcomes. Br J Anaesth. 2022 Jan;128(1):11-25. doi: 10.1016/j.bja.2021.09.042. Epub 2021 Nov 30. PMID: 34862000. |
Systematic review only includes observational studies instead of randomized controlled trials. |
|
Lomivorotov VV, Shmirev VA, Efremov SM, Ponomarev DN, Moroz GB, Shahin DG, Kornilov IA, Shilova AN, Lomivorotov VN, Karaskov AM. Hypothermic versus normothermic cardiopulmonary bypass in patients with valvular heart disease. J Cardiothorac Vasc Anesth. 2014 Apr;28(2):295-300. doi: 10.1053/j.jvca.2013.03.009. Epub 2013 Aug 17. PMID: 23962460. |
Different patient group: valvular heart disease. |
|
Nappi G, Torella M, Romano G. Clinical evaluation of normothermic cardiopulmonary bypass and cold cardioplegia. J Cardiovasc Surg (Torino). 2002 Feb;43(1):31-6. PMID: 11803324. |
Different intervention: cooling below 32 degrees. |
|
Okano N, Owada R, Fujita N, Kadoi Y, Saito S, Goto F. Cerebral oxygenation is better during mild hypothermic than normothermic cardiopulmonary bypass. Can J Anaesth. 2000 Feb;47(2):131-6. doi: 10.1007/BF03018848. PMID: 10674506. |
Different outcomes: hemodynamic parameters and arterial and jugular venous blood gases. |
|
Rasmussen BS, Sollid J, Rees SE, Kjaergaard S, Murley D, Toft E. Oxygenation within the first 120 h following coronary artery bypass grafting. Influence of systemic hypothermia (32 degrees C) or normothermia (36 degrees C) during the cardiopulmonary bypass: a randomized clinical trial. Acta Anaesthesiol Scand. 2006 Jan;50(1):64-71. doi: 10.1111/j.1399-6576.2006.00897.x. PMID: 16451153. |
Different outcomes: oxygenation. |
|
Rees K, Beranek-Stanley M, Burke M, Ebrahim S. Hypothermia to reduce neurological damage following coronary artery bypass surgery. Cochrane Database Syst Rev. 2001;2001(1):CD002138. doi: 10.1002/14651858.CD002138. PMID: 11279752; PMCID: PMC8407455. |
Different intervention: the meta-analysis also includes studies on cooling below 32 degrees. |
|
Speziale G, Ferroni P, Ruvolo G, Fattouch K, Pulcinelli FM, Lenti L, Gazzaniga PP, Marino B. Effect of normothermic versus hypothermic cardiopulmonary bypass on cytokine production and platelet function. J Cardiovasc Surg (Torino). 2000 Dec;41(6):819-27. PMID: 11232964. |
Different intervention: cooling below 32 degrees. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-07-2024
Beoordeeld op geldigheid : 05-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan.
Werkgroep
- Dr. M. (Maarten) ter Horst (voorzitter), NVA, anesthesioloog, Erasmus MC
- Drs. J.M.A.A. (Joost) van der Maaten, NVA, anesthesioloog, UMC Groningen
- Dr. A.B.A. (Alexander) Vonk, NVT, cardiothoracaal Chirurg, Amsterdam UMC
- Drs. E.J. (Edgar) Daeter, NVT, cardiothoracaal chirurg, St. Antonius Ziekenhuis
- Dr. R.I. (Rick) Meijer, NIV/NVIVG, internist, Radboud UMC
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, NIV, internist, HagaZiekenhuis
- Dr. A.J.G. (Gerard) Jansen, NIV, internist, Erasmus MC
- Prof. dr. A.P.J. (Alexander) Vlaar, NVIC, intensivist, Amsterdam UMC
- Prof. dr. ir. Y.M.C. (Yvonne) Henskens, NVKC, laboratoriumspecialist klinische chemie, Maastricht UMC
- Dr. N.R. (Nick) Bijsterveld, NVVC, cardioloog, Amsterdam UMC
- Dr. N. (Nienke) van Rein, NVZA, ziekenhuisapotheker, Leiden UMC
- I.G.J. (Ilse) Verstraaten, MSc, beleidsmedewerker Harteraad
Klankbordgroep
- Drs. K. (Karin) Gorter, NeSECC, klinisch perfusionist, UMC Utrecht
- Drs. A.R. (Arnold) van Oostrum, NeSECC, klinisch perfusionist, OLVG
- Dr. A.J. (Sander) Spanjersberg, NVA, cardioanesthesioloog, Isala Zwolle
- Dr. P.A.W. (Peter) te Boekhorst, NIV, internist, Erasmus Medisch Centrum
Met ondersteuning van
- Dr. R. (Romy) Zwarts-van de Putte, adviseur Kennisinstituut
- Drs. E.R.L. (Evie) Verweg, junior adviseur Kennisinstituut
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
ter Horst |
Anesthesioloog (Erasmus MC) |
Bestuurslid sectie cardio-anesthesiologie niet betaald Lid van de Landelijke gebruikersraad van Sanquin namens de NVA niet betaald Lid Leidraad EHH, CCU, ICCU gecoördineerd door kennisinstituut niet betaald lid EACTAIC subcommissie TEE niet betaald |
- Presentatie over eigen onderzoek CLS-Behring over ROTEM (verkoop fibrinogeen) (betaling aan het ziekenhuis, betaling voor tijd), hebben geen invloed op wat er verteld wordt. - Verricht onderzoek naar vermindering van bloedproducten verbruik bij cardiochirurgie: recent artikel over dit onderwerp gepubliceerd. Als er intellectueel belang is dan is dit minimaal. |
Volgens de werkgroep geen restrictie nodig. De betaling van de presentatie is puur voor de tijd die erin wordt gestoken, de financier heeft geen invloed op de inhoud van de presentatie. |
|
van der Maaten |
Anesthesioloog (UMCG) |
Lid RvT Nederlandse Hart Registratie (NHR) |
Geen |
Geen restrictie |
|
Vonk |
Cardiothoracaal Chirurg (AUMC Amsterdam) |
Geen |
Geen |
Geen restrictie |
|
Daeter |
Cardiothoracaal Chirurg (St. Antonius ziekenhuis Nieuwegein) |
Medisch manager eenheid hart antonius ziekenhuis |
Geen |
Geen restrictie |
|
Meijer |
Internist (Radboudumc) |
Geen |
Geen |
Geen restrictie |
|
Kerkhoffs |
Internist-hematoloog (HagaZiekenhuis Den Haag) |
Transfusie Specialist/senior onderzoeker, Sanquin Amsterdam, Research en transfusie consulten FTE 0.2 (onderzoek over bloedplaatjes, verder geen directe link met richtlijn). |
Geen |
Geen restrictie |
|
Jansen |
Internist-hematoloog (Erasmus MC) |
Wetenschappelijk voorzitter NVB |
Research funding: Principia, Argenx, CSL Behring, Sobi, EHA Research Fellowship (PI): personal fellowship for research. - Consultancy: Novartis, Amgen. Paid |
Geen restrictie. De onderzoeken hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld.
|
|
Vlaar |
Intensivist (Amsterdam- UMC) |
Lid Medische adviesraad Sanquin |
PI van PACER trial (ZonMw gefinancierd) Werfen in kind sponsoring CSL Behring studie grant en consultancy LSBR Fellowship op het gebied van TACO VIDI op gebied van TRALI |
Geen restrictie. De farma gesponsorde studies hebben geen betrekking op de modules uit de opgestelde richtlijn. |
|
Henskens |
Klinisch chemicus en waarnemend hoofd Centraal diagnostisch Laboratorium (CDL) Maastricht UMC+, Hoogleraar Klinische Chemie, in het bijzonder hemostase. 0.9 fte (CDL, MUMC+), 0.1 fte Universiteit Maastricht, FHML (faculty of Health, Medicine and Life Sciences). |
VHL Vereniging hematologische laboratoria, voorzitter (onbetaald); Landelijke en regionale gebruikersraad Sanquin (onbetaald), TVB Tijd voor verbinding antistollingszorg Expert team, namens NFU (vacatiegelden), Richtlijn antithrombotisch beleid, op afroep namens NVKC (vacatiegelden), voorzitter concilium NVKC (vacatiegelden), Lid Raad Opleidng FMS (onbetaald). |
Projectleider van de studie: Laboratory Predictors of hemostasis and thrombosis. Financier Siemens, Stago, Roche, Werfen, Nodia (korting of gratis reagentia of apparatuur te leen van bovenstaande bedrijven, zij financieren geen studies). |
Exclusie besluitvorming aanbevelingen module over POC testfacilieit aangezien het extern gefinancierde onderzoek mogelijk tot belangenverstrengeling leidt. Het werkgroeplid heeft geen band met één specifieke firma, alle testen worden onderzocht.
|
|
Bijsterveld |
Cardioloog (Amsterdam UMC) |
Voorzitter NVVC werkgroep Cardiologie en Sport (onbetaald) |
Geen |
Geen restrictie |
|
van Rein |
Ziekenhuisapotheker, Klinische Farmacie en Toxicologie, LUMC. 0.83 FTE. Inkopen en logistiek geneesmiddelen, directe patientenzorg, trials, onderwijs. Assistant progessor, Klinische Epidemiologie, LUMC, 0.17 FTE. Begeleiden promovendi, beurzen schrijven, onderwijs. |
Richtlijn antitrombotisch beleid |
Extern gefinancierd onderzoek (geen projectleider) – ZonMw GGG: Distinct onderzoek: optimaliseren tromboseprophylaxe na orthopedische ingrepen + L-TRRiP studie: optimaliseren trombosebehandeling na eerste veneuze trombose. Ook extern gefinancierd onderzoek vanuit de Trombosestichting: balans bloedingen en trombose optimaliseren dmv proteomics, wel projectleider.
Daarnaast ook verantwoordelijk voor alle geneesmiddelen studies die lopen in het LUMC en het CHDR, maar neem daar niet zelf actief aan deel. |
Geen restrictie, de trials hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld. |
|
Verstraaten |
Beleidsadviseur Harteraad |
Geen |
Geen |
Geen restrictie |
|
Gorter |
Klinisch perfusionist, Heartbeat Dutch Perfusion Service, UMCU |
Geen |
Projectleider van onderzoek verschillende ACT targets tijdens CPB. Financier medtronic. |
Geen restrictie, Gorter is onderdeel van de klankbordgroep en niet actief betrokken bij het formuleren van de aanbevelingen met betrekking tot ACT targets. |
|
van Oostrum |
Klinisch Perfusionist MCL (betaald) |
Voorzitter NeSECC (onbetaald) |
Praktijkvoordeel omdat ik werkzaam ben als klinisch perfusionist, en we hier in de praktijk op de OK baat bij kunnen hebben. |
Geen restrictie |
|
Spanjersberg |
Isala, MSB |
Geen |
Voordracht fibrinogeen in hartchirurgie (sponsor CSL) |
Geen restrictie |
|
te Boekhorst |
Internist-Hematoloog / transfusiespecialist, Erasmus MC |
Voorzitter stichting TRIP |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door benoem gebruikte methode: uitnodigen van de patiëntenvereniging Harteraad voor de invitational conference en een afgevaardigde van de patiëntenvereniging Harteraad in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Temperatuur tijdens CABG |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepassbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging voor Cardiologie (NVvC), Nederlandse Vereniging voor Intensive Care (NVIC), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskund (NVKC), Harteraad, Inspectie Gezondheidszorg en Jeugd (IGJ), Vereniging Innovatieve Geneesmiddelen (VIG), en de Nederlandse Vereniging voor Anesthesiologiemedewerkers (NVAM) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Kennisvragen
De kennislacunes per module staan onder ‘Bijlagen’ en dan ‘Onderzoek’.
Inleiding
Tijdens de ontwikkeling van de richtlijn peri-operatief bloed en (anti)stollingsmanagement is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based richtlijn ontwikkeling (EBRO) is duidelijk geworden dat er nog kennisvragen bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk.
Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVT Perioperatief bloed- en (anti)stollingsmanagement voor cardiochirurgie in Nederland |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van koelen (tot 32-34 graden) van volwassen patiënten die een CABG met koude cardioplegie ondergaan ten opzichte van het niet koelen van de patiënt? |
|
|
Database(s): Ovid/Medline, Embase |
Datum:23-9-2022 |
|
Periode: 2000- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: Coronary artery surgery AND induced hypothermia Vanwege de aantallen wordt eerst gestart met de SRs en RCTs. Van de vier sleutelartikelen worden alleen die van Hendriks en Greason gevonden. In overleg met de adviseur afgestemd dat dit geen probleem oplevert, omdat deze niet aansluiten op de vraag. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 23-9-2022 met relevante zoektermen gezocht vanaf 2000 naar Srs en RCTs over de (on)gunstige effecten van koelen (tot 32-34 graden) van volwassen patiënten die een CABG ondergaan. De literatuurzoekactie leverde 695 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
66 |
59 |
87 |
|
RCTs |
461 |
484 |
598 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
695 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#23 |
#19 AND #22 2 sleutelartikelen gevonden |
2 |
|
#22 |
#10 OR #11 OR #12 |
1276 |
|
#21 |
#19 NOT #20 |
1 |
|
#20 |
#5 AND #19 |
3 |
|
#19 |
#15 OR #16 OR #17 OR #18 sleutelartikelen |
4 |
|
#18 |
'temperature management and monitoring practices during adult cardiac surgery under cardiopulmonary bypass':ti |
1 |
|
#17 |
'rewarming temperature during cardiopulmonary bypass and acute kidney injury':ti |
1 |
|
#16 |
'hypothermia and operative mortality during on-pump coronary artery bypass grafting':ti |
1 |
|
#15 |
'mild hypothermia during cardiopulmonary bypass assisted cabg is associated with improved short- and long-term survival':ti |
1 |
|
#14 |
#12 NOT #11 NOT #10 |
854 |
|
#13 |
#11 NOT #10 RCT |
461 |
|
#12 |
#5 AND (#8 OR #9) |
1330 |
|
#11 |
#5 AND #7 |
492 |
|
#10 |
#5 AND #6 SR |
66 |
|
#9 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13467005 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#5 |
#4 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2232 |
|
#4 |
#3 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
4708 |
|
#3 |
#1 AND #2 |
4876 |
|
#2 |
'coronary artery surgery'/exp OR (((coronar* OR aortacoronar* OR aorticocoronar*) NEAR/3 (bypass* OR shunt* OR anastomos* OR graft*)):ti,ab,kw) OR ((bypass* NEAR/3 surger*):ti,ab,kw) OR cabg:ti,ab,kw |
181553 |
|
#1 |
'induced hypothermia'/exp OR 'cardioplegia'/exp OR 'cardioplegic agent'/exp OR 'artificial hibernation':ti,ab,kw OR 'body cooling':ti,ab,kw OR 'chilling':ti,ab,kw OR 'hypothermia':ti,ab,kw OR 'refrigeration anaesthesia':ti,ab,kw OR 'refrigeration anesthesia':ti,ab,kw OR 'targeted temperature management':ti,ab,kw OR ((hyportherm* NEAR/4 (extracorporeal OR cooling OR induction OR therap* OR artificial OR induced)):ti,ab,kw) OR cardiopleg*:ti,ab,kw OR 'del nido solution*':ti,ab,kw OR 'thomas solution*':ti,ab,kw OR custadiol:ti,ab,kw OR 'cold blood':ti,ab,kw OR (((32 OR 33 OR 34 OR 35) NEAR/2 degrees):ti,ab,kw) |
76449 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
6 and 8 RCT |
484 |
|
9 |
6 and 7 SR |
59 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1547940 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
619323 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1902 |
|
5 |
limit 4 to yr="2000 -Current" |
2102 |
|
4 |
3 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
4910 |
|
3 |
1 and 2 |
5498 |
|
2 |
Cardiac Surgical Procedures/ or ((coronar* or aortacoronar* or aorticocoronar*) adj3 (bypass* or shunt* or anastomos* or graft*)).ti,ab,kf. or (bypass* adj3 surger*).ti,ab,kf. or cabg.ti,ab,kf. |
127543 |
|
1 |
exp Hypothermia, Induced/ or exp Heart Arrest, Induced/ or Cardioplegic Solutions/ or artificial hibernation.ti,ab,kf. or body cooling.ti,ab,kf. or chilling.ti,ab,kf. or hypothermia.ti,ab,kf. or refrigeration anaesthesia.ti,ab,kf. or refrigeration anesthesia.ti,ab,kf. or targeted temperature management.ti,ab,kf. or (hyportherm* adj4 (extracorporeal or cooling or induction or therap* or artificial or induced)).ti,ab,kf. or cardiopleg*.ti,ab,kf. or del nido solution*.ti,ab,kf. or thomas solution*.ti,ab,kf. or custadiol.ti,ab,kf. or cold blood.ti,ab,kf. or (("32" or "33" or "34" or "35") adj2 degrees).ti,ab,kf. |
79267 |