Preoperatieve Hb-optimalisatie met IV-ijzer
Uitgangsvraag
Wat is de waarde van het toepassen van hemoglobine optimalisatie in de vorm van intraveneuze ijzertoediening bij patiënten die cardiochirurgie ondergaan?
De uitgangsvraag omvat de volgende deelvragen:
-
Wat is de waarde van hemoglobine optimalisatie in de vorm van IV-ijzer toediening bij patiënten die cardiochirurgie ondergaan?
-
Welke andere vormen van hemoglobine optimalisatie zijn rationeel en voor welke patiëntengroepen?
Aanbeveling
Aanbeveling-1
Overweeg het optimaliseren van Hb met intraveneus ijzer bij anemische (Hb < 10 g/dl = 6,2 mmol/L) of licht anemische (Hb 10-13 g/dl = > 6,2 mmol/l - < 8,1 mmol/L) patiënten, dit lijkt zinvol voor de herstelfase van een postoperatieve anemie een maand na de operatie.
Het kan zinvol zijn om verschillende afkapwaarden te hanteren voor mannen en vrouwen.
Aanbeveling-2
Dien intraveneus ijzer minimaal zeven dagen voor de operatie toe om de transfusiebehoefte gunstig te beïnvloeden.
Aanbeveling-3
Overweeg toediening van intraveneus ijzer, mits voldaan wordt aan aanbeveling 1 en 2, met als doel een sneller herstel van een postoperatieve anemie. Met name patiënten met een preoperatief vastgestelde anemie, Jehova’s getuigen en mogelijk patiënten met een lage ejectiefractie zouden hiervan kunnen profiteren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van ijzer op anemie, omdat anemie bij patiënten die hartchirurgie ondergaan frequent voorkomt (George, 2012; Hazen, 2022). Er werden vier RCTs geïncludeerd die de vergelijking tussen het toedienen van intraveneus ijzer en niet toedienen van intraveneus ijzer hebben onderzocht (Garrido-Martín, 2012; Johansson, 2015; Shokri, 2022; Song, 2022). Één studie (Shokri 2022) liet voor de uitkomstmaat transfusie zien dat patiënten die intraveneus ijzer ontvingen minder vaak een transfusie nodig hadden. De studie van Song (2022) vond zo’n verschil alleen bij een subgroep van licht anemische patiënten. Song (2022) en Shokri (2022) melden verschillen. Song (2022) dient intraveneus ijzer 3 dagen voor en 3 dagen na OK toe en vindt alleen verschil bij patiënten met een a priori lager Hb. Shokri (2022) dient intraveneus ijzer 7 dagen voor OK toe en vindt meer meetbare effecten dan Song (2022). Dit leidt ertoe dat er voor deze patiënten meer tijd is geweest om bloedcellen aan te maken. De studies lieten geen klinisch relevant verschil in postoperatief bloedverlies zien, maar de studies waren methodologisch niet geschikt om dat goed te beoordelen en daarnaast verschilden het moment van toediening, de vorm van toediening en de dosis. Alleen de studie van Shokri (2022) liet een klinisch relevant verschil zien in direct postoperatieve hemoglobine concentratie tussen de patiënten die intraveneus ijzer ontvingen en de patiënten die placebo ontvingen, in het voordeel van de patiënten die intraveneus ijzer hadden gekregen. Shokri (2022) vermeldt een kortere opnameduur, zonder daar een verklaring voor te geven. Het is uiterst onwaarschijnlijk dat de behandeling met intraveneus ijzer 7 dagen voor OK zo’n groot verschil verklaart. Het is opvallend dat de aortaklemtijden significant verschillen tussen de interventie en de controlegroep, terwijl de perfusietijden niet verschillen tussen deze twee groepen. Mogelijk spelen andere factoren mee, of wordt het beeld vertroebeld door een aantal patiënten, in de langere opnameduur bij patiënten die placebo ontvingen. Voor zowel de cruciale als de belangrijke uitkomstmaten was de bewijskracht laag. Hier ligt dus een kennislacune. De lage bewijskracht werd met name veroorzaakt door resultaten van lage precisie gemeten in kleine patiëntengroepen.
Anemie is bij hartoperaties geassocieerd met hogere morbiditeit en mortaliteit en met meer kosten door een verhoogde behoefte aan toediening van rode bloedcellen.
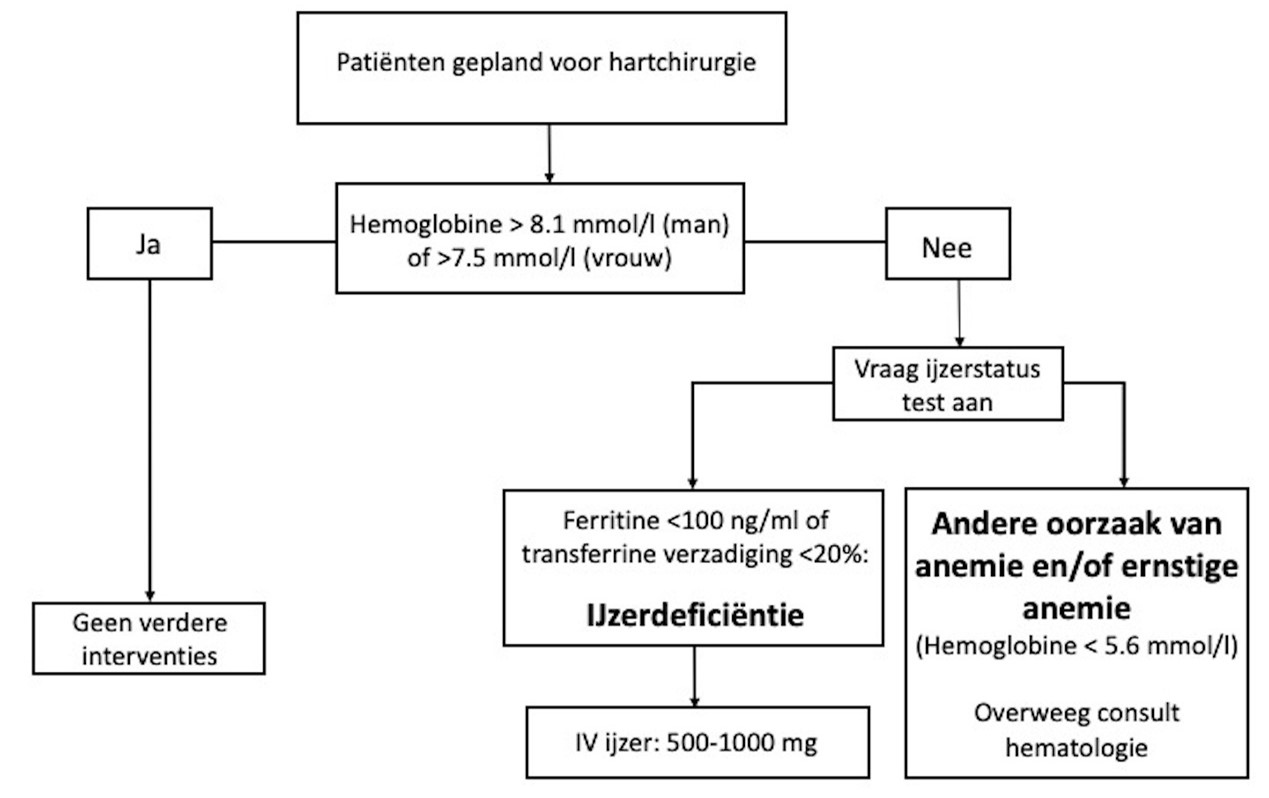
In een uitgebreide review uit 2023 (Kloeser, 2023) wordt de impact van strategieen om een preoperatieve anemie te behandelen voorafgaand aan hartchirurgie besproken. Er wordt onderscheid gemaakt tussen enerzijds absolute ijzer deficiëntie die wordt gezien bij verminderde ijzeropname en chronisch bloedverlies en anderzijds functioneel ijzergebrek, dat voorkomt bij chronische ontsteking (ook vaak subklinisch), maligniteit, nierfalen en bij hoge leeftijd. Om te discrimineren wordt geadviseerd om naast hemoglobine (Hb) ook Mean Corpuscular Volume (MCV), ferritine, transferrine, kreatinine en C-reactive protein (CRP) te bepalen, eventueel aangevuld met reticulocyten, en serumijzer. Bij het vermoeden van een onderliggende ziekte wordt uiteraard doorverwijzing geadviseerd (naar bijvoorbeeld MDL-arts of hematoloog). Voor meer informatie over de analyse van anemie kan men de NHG standaard Anemie raadplegen.
Een stroomdiagram met betrekking tot anemie uit deze studie is bijgevoegd, zie hieronder.
Stroomschema om patienten met bloedarmoede door ijzertekort en patiénten met ernstige bloedarmoede te identificeren. Intraveneuze (IV) ijzertherapie kan direct worden uitgevoerd na snelle laboratoriumtesten in de preoperatieve anesthesiekliniek.
De auteurs (Kloeser, 2023) postuleren dat het grotere effect van intraveneus ijzer gezocht moet worden in een grotere farmacologische beschikbaarheid van ijzer, met minder bijwerkingen (hoewel ernstige anafylaxie bij intraveneus ijzer toediening kan voorkomen). Bij patiënten met een anemie ten gevolge van ontsteking of chronische ziekte wordt geadviseerd ijzer te combineren met erythropoietine (Weiss, 2018).
IJzersuppletie wordt geadviseerd volgens de huidige richtlijnen bij milde en ernstige anemie (Tibi, 2021). Er is geen gunstig effect te verwachten bij niet-anemische patiënten en routinematig toepassen van (intraveneuze) ijzertoediening wordt niet geadviseerd. Routinematig toepassen van ijzersuppletie kan zelfs gecontraindiceerd zijn bij een anemie ten gevolge van chronische ontsteking (Hoffman, 2021; Spahn, 2022). Routine optimalisatie van het Hb bij niet anemische patiënten is derhalve omstreden. Het vereist nuancering en er dient rekening gehouden te worden met inflammatie- en ijzerstatus. Indien er sprake is van anemie bij inflammatie of chronische ziekte kan het zinvol zijn om ijzertherapie te combineren met epo (dus indien er sprake is van een niet uitsluitend door ijzergebrek veroorzaakte anemie) (Spahn, 2022). Meerdere studies tonen dat ijzersuppletie niet leidt tot een verminderde transfusiebehoefte. In ieder geval bepaalt de duur tot aan operatie of transfusiebehoefte vermindert, m.a.w. of ijzer (met of zonder EPO) voldoende tijd hebben gehad om effect te hebben op bloedaanmaak. Er zijn echter ook studies waarin kort (3 dagen) tot zeer kort (1 dag) voor de operatie epo met intraveneus ijzer gecombineerd toegediend werd die een vermindering van PRBC-transfusie lieten zien alsmede een hoger postoperatief Hb.
De indicatie voor het gebruik van intraveneus ijzer hangt van het doel af dat beoogd wordt. Uit de literatuur blijkt immers dat het preoperatief toedienen van ijzer niet leidt tot een lagere transfusiebehoefte, zodat dit geen rationele toepassing is. Echter, uit meerdere studies, onder andere uit de vier studies naar intraveneus ijzer die uit de PICO naar voren kwamen, blijkt dat het toedienen van intraveneus ijzer effectief is om een postoperatief gedaald Hb in de dagen tot weken na de operatie sneller te laten herstellen en een postoperatieve anemie sneller te doen verminderen. Dit blijkt ook uit een recente studie van Friedman (Friedman, 2023). Hazen, 2022 toonde aan dat preoperatieve anaemia geassocieerd was met een verhoogd risico op mortaliteit na 120 dagen (adjusted odds ratio [aOR] 1.7; 95% confidence interval [CI]: 1.4e1.9; P<0.001)). Aangezien het risico op morbiditeit en mortaliteit toeneemt bij patiënten met anemie die hartchirurgie ondergaan, dat ook is aangetoond door andere auteurs (Hazen, 2022; Padmanabhan, 2019), is het aannemelijk dat een sneller herstel van een postoperatieve anemie kan helpen om het operatierisico in de weken na de operatie te verminderen. Het tijdstip van toediening van intraveneus ijzer is van invloed. Hoe eerder de ijzervoorraad in het lichaam maximaal wordt gesuppleerd, hoe beter het perioperatieve effect. Hoewel de erytropoëse direct postoperatief al na 5 dagen onder invloed van intraveneus ijzer aantoonbaar toeneemt, wordt het effect op Hb pas later duidelijk (Johansson, 2015). Het effect op het verminderen van (de kans op) transfusies door het gebruik van intraveneus ijzer is beperkt tot patiënten met een (lichte) anemie (Hb<13 g/dl = 8 mmol/l). Dit vereist aanpassing van preoperatieve procedures, waarbij de urgentie van de operatie moet worden meegewogen. Bij electieve chirurgie kan routinematige toediening van intraveneus ijzer bij patiënten met een lichte anemie zeven dagen voor de operatie in samenspraak met de patiënt.
Concluderend uit de studie van Song (2022) lijkt optimalisatie van Hb met intraveneus ijzer bij (licht) anemische patiënten met een Hb < 8,1 mmol/l g/dl (maar > 6,2 mmol/l voor mannen en > 5,6 mmol/l voor vrouwen, onder die waarde is er sprake van ernstige anemie en dat was een exclusiecriterium voor deze studie) zinvol voor het herstel van een postoperatieve anemie. Intraveneus ijzer kan de transfusiebehoefte gunstig kan beïnvloeden indien het zeven dagen voor de operatie wordt toegediend.
Andere vormen van Hb-optimalisatie (bijvoorbeeld door middel van erythropoietine (EPO)) is omstreden in verband met een verhoogd risico op trombo-embolie (Mueller, 2019). De financiële verschillen tussen intraveneus ijzer en erythropoietine zijn beperkt. Niettemin worden in specifieke patientenpopulaties de combinatie van zowel iv als oraal ijzer en erythropoietine aanbevolen in de Europese richtlijn (Boer, 2017).
Kleine patiënten met bijvoorbeeld een BSA van < 1,7m2 of een BMI < 20 ondervinden meer Hb-daling ten gevolge van hemodilutie door het gebruik van een hartlongmachine dan patiënten met een groter postuur. Daardoor zouden kleinere patiënten ook baat kunnen hebben bij optimalisatie van het Hb door middel van preoperatieve iv ijzertoediening in de postoperatieve periode, omdat zij postoperatief een grotere kans hebben op een laag Hb. Bij voorkeur zal het intraveneus ijzer bij deze patiënten minimaal zeven dagen voor de operatie gegeven moeten worden om ook de kans op transfusie rondom de ingreep te verminderen. Omdat vrouwen in het algemeen kleiner zijn en gemiddeld een lager Hb hebben dan mannen, geldt dit argument generaliserend principieel voor vrouwelijke patiënten.
Enerzijds hebben vrouwen gemiddeld een lager Hb, en zijn zij kleiner dan mannen (kleinere BSA) en vertonen zij zoals hiervoor beschreven meer hemodilutie ten gevolge van de extracorporele circulatie. Hierdoor is de marge tot het bereiken van kritisch lage Hb waarden bij vrouwen kleiner. Vrouwen kunnen dus meer gebaat zijn bij preoperatieve Hb-optimalisatie dan mannen. Het feit dan (pre-)anemische patiënten een Hb-daling beter verdragen dan niet-anemische patiënten wordt hierbij buiten beschouwing gelaten (Karkouti, 2008).
Omdat ijzer deficiëntie vaak voorkomt bij hartfalen is het aannemelijk dat ijzersuppletie voor een hartoperatie bij patiënten met en slechte linkerventrikelfunctie zinvol is (McDonagh, 2021).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De belangrijkste doelen voor de patiënt zijn het risico op een verdere anemie tijdens de operatie te verminderen en het herstel van anemie postoperatief te versnellen. Verder zijn er in de literatuur weinig risico’s beschreven wat betreft het preoperatief toedienen van intraveneus ijzer. Het nadeel is echter dat de toediening van intraveneus ijzer in de klinische setting moet gebeuren. Het kan dus zo zijn dat de patiënt hiervoor extra naar het ziekenhuis moet komen. Waar mogelijk zou dit in combinatie met andere ziekenhuis afspraken gedaan kunnen worden, bij voorkeur in een perifeer centrum ten gunste van de reisafstand.
Het is belangrijk om de voor- en nadelen met de patiënt te bespreken zodat er in overleg met de patiënt (en evenuteel hun naasten) een weloverwogen beslissing gemaakt kan worden. Voornamelijk de patiënten met een anemie en patiënten met een laagnormaal Hb hebben baat bij de preoperatieve ijzer optimalisatie.
Kosten (middelenbeslag)
Hoewel er een aantoonbaar effect is bij patiënten zonder anemie, vertaalt dit zich in de genoemde studies niet in klinische verbetering. Een sneller herstel van de postoperatieve anemie kan wel indirecte financiële voordelen opleveren door kortere opnameduur of minder transfusiebehoefte. Daarom lijkt het erop dat de kosten in beperkte mate opwegen tegen de directe baten.
Intraveneus ijzer is kostbaar. In Nederland worden vooral ijzer(III)carboxymaltose (Ferinject R, €327 gemiddeld voor 1000mg) en ijzer(III)derisomaltose (Monofer R €298,- gemiddeld voor 1000mg) als parenteraal ijzer gebruikt (Farmaceutisch kompas). Niettemin kunnen de prijzen per locatie door prijsafspraken aanzienlijk verschillen. De prijs van de interventie lijkt niet op te wegen tegen meetbare financiële voordelen. Immers de kans op transfusie wordt weliswaar iets kleiner bij toepassing bij geselecteerde patiëntengroep, met name als het minimaal zeven dagen voor de operatie wordt toegediend, maar daarmee is niet duidelijk of en hoeveel transfusies daardoor bespaard zouden kunnen worden. Echter, het is aannemelijk dat ook het herstel iets sneller kan verlopen. Dit is echter niet concreet in ziekenhuisopname uit te drukken omdat daarvoor geen verschil werd aangetoond in de studies.
Aanvaardbaarheid, haalbaarheid en implementatie
Het effect op transfusies is aangetoond als intraveneus ijzer zeven dagen preoperatief wordt toegediend. Dit vereist aanpassing van preoperatieve procedures, waarbij de urgentie van de operatie moet worden meegewogen. Hoewel dit een wijziging van de logistiek impliceert, lijkt dit ondervangen te kunnen worden door een eenmalige aanpassing in het werkschema.
In een recente enquête onder Nederlandse hartchirurgische centra werd gevraagd of de oorzaak van een preoperatieve anemie werd onderzocht. Drie centra gaven aan dit niet te doen. Echter, een anemie blijkt meestal primair uit de brief van de verwijzer. De verwijzer wordt dan gevraagd de oorzaak van de anemie te (laten) onderzoeken, en de patiënt wordt dan, als de urgentie van de operatie het toelaat, pas geopereerd als de oorzaak duidelijk is en bij voorkeur ook de anemie behandeld is. Mogelijk heeft de enquête hier geen rekening mee gehouden.
In 13 van 14 Nederlandse hartchirurgische centra wordt het Hb niet routinematig geoptimaliseerd voor een electieve operatie. Eén centrum geeft aan dit wel te doen. Voorkeursbehandeling is intraveneus ijzer, dieetadvies of een RBC-transfusies in dit centrum. Vrouwen worden anders behandeld, over het algemeen krijgen ze meer ijzer toegediend, mogelijk omdat vrouwen van nature een lager Hb hebben.
Vaak is er geen consistent beleid. Chirurgen en anesthesiologen die bij bloedmanagement betrokken zijn zullen eerder aandringen op behandeling bij anemie dan anderen. Routinematige voorbereiding bij alle patiënten is daardoor zeldzaam (dieetadvies is dan de eerste stap om de ijzer voorraad te “verzadigen”).
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
Perioperatief is het voordeel van het kort voor de operatie toedienen van intraveneus ijzer beperkt en niet meetbaar in termen van het verminderen van bloedverlies of bloedtransfusies. Wel is duidelijk aangetoond dat het preoperatief toedienen van intraveneus ijzer het postoperatieve herstel van een anemie op langere termijn kan bevorderen. Daar staat tegenover dat voor tijdig toedienen van intraveneus ijzer de preoperatieve logistiek aangepast moet worden om het effect (wat wel duidelijk is aangetoond) te behalen.
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventies
Het effect op transfusies is aangetoond als intraveneus ijzer minimaal zeven dagen preoperatief wordt toegediend.
Rationale van aanbeveling 3: weging van argumenten voor en tegen de interventies
Hoewel de geïncludeerde studies randomiseerden bij uitsluitend niet-anemische patiënten, en slechts één studie een subgroep van patiënten met een laag-normaal Hb beschreef, is het aannemelijk dat de gevonden resultaten zeker ook gelden voor patiënten met een preoperatief vastgestelde anemie. Ook Jehova’s getuigen kunnen worden beschouwd als een groep kunnen zijn waarvoor dit geldt omdat deze patiënten, als er geen bloedtransfusies mogen worden gegeven, potentieel door een lager “Hb-dal” gaan dan patiënten die wel een transfusie kunnen krijgen. Intraveneus ijzer kan dan helpen deze fase met een laag Hb te beperken. Ook patiënten met een laag Hb of een manifeste anemie kunnen ondanks transfusies sneller herstellen. Tot slot is het aannemelijk dat een sneller herstel van een anemie bij patiënten met een lage ejectiefractie, bijvoorbeeld < 20% door middel van het geven van intraveneus ijzer gunstig kan zijn voor de uitkomst bij patiënten, hoewel ook dit niet specifiek is onderzocht.
Onderbouwing
Achtergrond
Een multidisciplinair geïntegreerd pre- peri- en postoperatief “Hemoglobine (Hb)-beleid” kan klinische en financiële voordelen hebben. Het primaire knelpunt wordt in het algemeen gevormd door de perceptie dat ten aanzien van het preoperatieve Hb meestal een reactieve organisatie volstaat, extreme anemieen bij niet-acute patiënten daargelaten. Hb-beleid, zowel pre als perioperatief vertoont landelijk een grote spreiding, die verband zou kunnen houden met bewustzijn van betrokken behandelaars, dat niet altijd even groot is. Dit uit zich o.a. in grote verschillen in transfusie-aantallen, mogelijk omdat de richtlijnen voor “patient blood management” (PBM) niet altijd worden toegepast.
Bij de aanmelding van een patiënt voor een hartoperatie door een cardioloog via het zogenaamde hartteam wordt vereist dat een Hb-waarde van de patiënt als onderdeel van oriënterend laboratoriumonderzoek bekend is. Niettemin lijkt het erop dat veel centra in Nederland voorafgaand aan een operatie de oorzaak van een licht verlaagd Hb niet structureel onderzoeken. Daarnaast wordt het Hb niet routinematig geoptimaliseerd voordat electieve cardiochirurgie plaats vindt. Het is de vraag of het toepassen van pre-operatieve Hb-optimalisatie de uitkomsten van de patiënt beïnvloedt. Er zijn verschillende vormen van Hb-optimalisatie: oraal of intraveneus ijzer (al dan niet gecombineerd met EPO), en RBC-transfusie. In deze module zal met name de wetenschappelijke waarde van Hb-optimalisatie door middel van intraveneuze ijzertoediening worden besproken. In de overwegingen komt tevens orale ijzertoediening aan de orde.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous and oral iron administration on the number of patients transfused when compared with no iron administration for Hb-optimalisation in adult patients undergoing elective cardiac surgery. Source: Garrido-Martín, 2012; Johansson, 2015; Shokri, 2022; Song, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous and oral iron administration on blood product consumption when compared with no iron administration for Hb-optimalisation in adult patients undergoing elective cardiac surgery. Source: Garrido-Martín, 2012 |
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous and oral iron administration on postoperative blood loss when compared with no iron administration for Hb-optimalisation in adult patients undergoing elective cardiac surgery. Source: Garrido-Martín, 2012; Shokri, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous and oral iron administration on hemoglobin concentration when compared with no iron administration for Hb-optimalisation in adult patients undergoing elective cardiac surgery. Source: Garrido-Martín, 2012; Shokri, 2022; Song, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous iron administration on length of stay when compared with no iron administration for Hb optimalisation in adult patients undergoing elective cardiac surgery. Source: Shokri, 2022; Song, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous iron administration on adverse events when compared with no iron administration for Hb-optimalisation in adult patients undergoing elective cardiac surgery. Source: Johansson, 2015; Shokri, 2022 |
Samenvatting literatuur
Description of studies
Garrido-Martín (2012) performed a double-blind randomized clinical trial to test the clinical effectiveness of oral and intravenous iron supplementation in correcting anemia and its effect on blood transfusion requirements in patients undergoing elective cardiopulmonary bypass surgery. Patients older than 18 years, undergoing elective cardiac surgery under extracorporeal circulation, without previous anemia were eligible for trial participation. In total, 210 patients were randomized and allocated to three interventions, but due to loss-to-follow-up and incomplete outcome data, 159 patients were received the allocated intervention and were included in the analysis. Those patients were randomized into three groups. Group I (n=54) received three doses of 100 mg/24h intravenous iron(III)-hydroxide sucrose complex during pre- and postoperative hospitalization, complemented with one pill/24h of oral placebo during pre- and postoperative hospitalization and for one month after discharge. Group II (n=53) received intravenous placebo during pre- and postoperative hospitalization and one oral ferrous fumarate iron pill/24h during pre- and postoperative hospitalization and during one month after discharge. Group III (n=52) received oral and intravenous placebo during pre- and postoperative hospitalization. Low output syndrome associated with hemoglobin level <8 g/dL in coronary patients or < 7 g/dL in valve surgery patients were used as criteria for red blood cell transfusion. The duration of the follow-up was one month after discharge. The study reported the following relevant outcome measures: hemoglobin concentration (measured at exit operating room), number of patients transfused, blood product consumption, and postoperative blood loss.
Johansson (2015) performed a double-blind randomized clinical trial to explore whether intravenous iron supplementation results effect hemoglobin concentrations in patients undergoing cardiac surgery. Patients older than 18 years, undergoing elective or subacute coronary artery bypass graft (CABG), valve replacement or a combination thereof, with hemoglobin concentrations of at least 12.0 g/dL for women and at least 13.0 g/dL for men were eligible for trial participation. In total, 60 patients were eligible and received the allocated intervention. Those patients were randomized into two groups. The intervention group (n=30) received iron isomaltoside 1000 as a single-dose infusion of 1000 mg for 15 minutes, with a maximum single dose of 20 mg/kg. The control group (n=30) received a placebo, saline, as a single-dose infusion of 100 ml for 15 minutes. The criteria for red blood cell transfusion were not reported. The duration of the follow-up was 4 weeks postoperatively. The study reported the following relevant outcome measures: hemoglobin concentration, number of patients transfused, and adverse events.
Shokri (2022) performed a prospective randomized trial to investigate the effect of intravenous iron supplementation on hemoglobin concentrations, blood transfusion requirements, and adverse events in patients undergoing artery bypass grafting. Patients aged between 52 and 67, undergoing elective CABG, with hemoglobin concentrations lower than 12 g/dL for women and lower than 13 g/dL for men, were eligible for trial participation. In total, 80 patients were eligible and received the allocated intervention. Those patients were randomized into two groups. The intervention group (n=40) received a single intravenous dose of 1000 mg in 100 mL saline ferric carboxymaltose, infused for 15 minutes, 7 days before surgery. The control group (n=40) received a single intravenous dose of 100 mL saline, infused for 15 minutes, 7 days before surgery. The criteria for red blood cell transfusion were not reported. The duration of the follow-up was 4 weeks after discharge. The study reported the following relevant outcome measures: hemoglobin concentration, number of patients transfused, length of stay, adverse events, and mortality.
Song (2022) performed a prospective, randomized, double-blinded placebo-controlled trial to investigate whether routine perioperative intravenous iron supplementation reduces the requirement for packed erythrocytes (pRBC) transfusion in patients undergoing complex cardiac surgery. Adult patients, undergoing elective complex cardiac surgery (involving both mitral and aortic valve, valve surgery with concomitant coronary artery bypass graft or graft replacement of the ascending aorta, or redo surgery) were eligible for trial participation. In total, 204 patients were eligible and received the allocated intervention. Those patients were randomized into two groups. The intervention group (n=103) received ferric derisomaltose 20 mg/kg, with a maximum single dose of 1000 mg, over 15 minutes, two times during the perioperative period, three days before the surgery and three days after the surgery. The control group (n=101) received an equal volume of 0.9% sodium chloride at the same time points. A hemoglobin level less than 8 g/dL was used as the criterium for red blood cell transfusion. The duration of the follow-up was three weeks postoperative. The study reported the following relevant outcome measures: hemoglobin concentration, number of patients transfused, mortality, and length of stay.
Results
Number of patients transfused (critical)
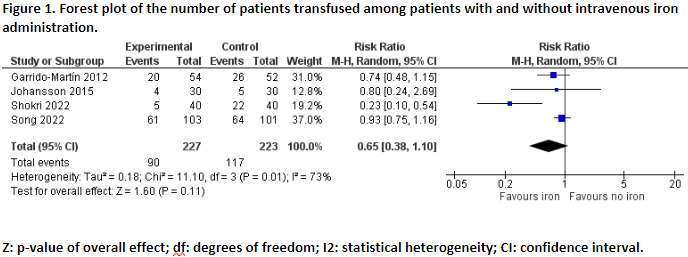
Four studies reported the outcome measure number of patients transfused (Garrido-Martín, 2012; Johansson, 2015; Shokri, 2022; Song, 2022).
Intravenous administration
In total, 90 of the 227 patients (39.6%) who received intravenous iron, received a blood transfusion, versus 117 of the 223 patients (52.5%) who received no iron (placebo). The pooled RR was 0.65 (95%CI 0.38 to 1.10), in favour of intravenous iron (Figure 1). This difference is considered clinically relevant.
Oral administration
Garrido-Martín (2020) also reported the number of patients who were transfused for the comparison of oral iron administration versus placebo. In total, 27 of the 53 patients (51%) who received oral iron, and 26 of the 52 (50%) patients who received no iron (placebo) were transfused. The RR of the patients who received oral iron compared to the patients who received no iron is 1.02 (95% CI 0.70 to 1.49), in favour of the patients who received no iron. This difference is not considered clinically relevant.
Blood product consumption (critical)
One study reported the outcome measure use of blood products (Garrido-Martín, 2012), which was defined as the number of units of red blood cells.
Intravenous administration
Garrido-Martín (2012) reported the number of units of RBCs (red blood cells) transfused. The patients who received intravenous iron (n=54), received 0.65 units of RBCs per patient. The patients who received no iron (n=52), received 0.79 units of RBC per patient. The mean difference between the group of patients who received intravenous iron and the group of patients who received no iron was -0.14 units, in favour of the patients who received intravenous iron. This difference is not considered clinically relevant.
Oral administration
Garrido-Martín (2012) reported the number of units of RBCs (red blood cells) transfused. The patients who received oral iron (n=53) received 0.83 units of RBCs per patient. The patients who received no iron (n=52), received 0.79 units of RBCs per patient. The mean difference between the group of patients who received oral iron and the group of patients who received no iron was 0.04 units, in favour of the patients who received no iron. This difference is not considered clinically relevant.
Postoperative blood loss (important)
Two studies reported the outcome measure postoperative blood loss (Garrido-Martín, 2012; Shokri, 2022). As only two studies were included, the results were not pooled.
Intravenous administration
Garrido-Martín (2012) reported 24-h postoperative bleeding. The patients who received intravenous iron (n=54) had a mean 24-h postoperative bleeding volume of 665 mL (SD ± 534 mL). The patients who received no iron (n=52) had a mean 24-h postoperative bleeding volume of 609 mL (SD ± 310 mL). The mean difference (MD) between the patients who received intravenous iron compared with patients who received no iron is 56.00 mL (95% CI -109.48 to 221.48), in favour of the patients who received no iron. This difference is not considered clinically relevant.
Shokri (2022) reported postoperative blood loss. The patients who received intravenous iron (n=40) had a mean postoperative blood loss of 1239.4 mL (SD ± 172.43 mL), and the patients who received no iron (n=40) had a mean postoperative blood loss of 1247.33 mL (SD ± 183.43 mL). The MD was -7.93 mL (95% CI -85.95 to 70.09), in favour of the patients who received intravenous iron. This difference is not considered clinically relevant.
Oral administration
Garrido-Martín (2012) reported 24-h postoperative bleeding. The patients who received oral iron (n=53) had a mean 24-h postoperative bleeding volume of 684 mL (SD ± 455 mL). The patients who received no iron (n=52) had a mean 24-h postoperative bleeding volume of 609 mL (SD ± 310 mL). The MD between the patients who received oral iron compared to the patients who received no iron was 75.00 mL (95% CI -73.68 to 223.68), in favour of the patients who received no iron. This difference is not considered clinically relevant.
Hemoglobin concentration (important)
Three studies reported postoperative hemoglobin concentration (Garrido-Martín, 2012; Shokri, 2022; Song, 2022). Due to heterogeneity in outcome reporting by the studies, the results were not pooled.
Intravenous administration
The patients who received intravenous iron (n=54) had a mean postoperative hemoglobin concentration of 10.5 g/dL (SD ± 1.39 g/dL) (Garrido-Martín, 2012). The patients who received no iron (n=52) had a mean postoperative hemoglobin concentration of 10.5 g/dL (SD ± 1.56 g/dL). The mean difference between the intravenous iron group and no iron group is 0.00 g/dL (95% CI -0.56 to 0.56). This means there is no difference between the groups in postoperative Hb concentration.
The patients who received intravenous iron (n=40) had a mean postoperative hemoglobin concentration of 9.1 g/dL (SD ± 0.63 g/dL), and the patients who received no iron (n=40) had a mean postoperative hemoglobin concentration of 7.55 g/dL (SD ± 0.6 g/dL) (Shokri, 2022). The mean postoperative difference between the groups is 1.55 g/dL (95% CI 1.28 to 1.82), in favour of the patients who received iron. This difference is considered clinically relevant.
The patients who received intravenous iron (n=103) had a mean postoperative hemoglobin concentration of 10.41 g/dL, and the patients who received no iron (n=101) had a mean postoperative hemoglobin concentration of 10.11 g/dL (Song, 2022). The mean difference was 0.3 g/dL, in favour of the patients who received intravenous iron. This difference is not considered clinically relevant.
Oral administration
The patients who received oral iron (n=53) had a mean postoperative hemoglobin concentration of 10.7 g/dL (SD ± 1.41 g/dL) (Garrido-Martín, 2012). The patients who received no iron (n=52) had a mean postoperative hemoglobin concentration of 10.5 g/dL (SD ± 1.56 g/dL). The mean difference between the oral iron group and no iron group is 0.2 g/dL (95% CI -0.37 to 0.77), in favour of the patients who received no iron. This difference is not considered clinically relevant.
Length of stay (important)
Two studies reported the outcome measure length of hospital stay (Shokri, 2022; Song, 2022). Due to study heterogeneity in outcome reporting, the results were not pooled.
Intravenous administration
Shokri (2022) reported the length of hospital stay in days. The patients who received intravenous iron (n=40) had a mean length of hospital stay of 4.33 days (SD ± 1). The patients who received no iron (n=40) had a mean length of hospital stay of 8.68 days (SD ± 1.1 days). The difference in mean length of hospital stay between the groups is -4.4 days (95% CI -4.88 to -3.82), in favour of patients who received intravenous iron. This difference is considered clinically relevant.
Shokri (2022) also reported the length of ICU stay in days. The patients who received intravenous iron (n=40) had a mean length of ICU stay of 1.28 days (SD ± 0.45 days). The patients who received no iron (n=40) had a mean length of ICU stay of 2.23 days (SD ± 0.95 days). The difference in mean length of ICU stay between the groups is -1 days (95% CI -1.28 to -0.62), in favour of the patients who received intravenous iron. This difference is considered clinically relevant.
Song (2022) reported the duration of hospitalization in days. The patients who received intravenous iron (n=103) had a median length of hospital stay of 12 days (IQR 10 to 14 days). The patients who received no iron (n=101) had a median length of hospital stay of 11 days (IQR 9 to 16 days). The difference in medians between the groups was 1 day, in favour of the patients who received no iron. This difference is considered clinically relevant.
Adverse events (important)
Two studies reported the outcome measure adverse events (Johansson, 2015; Shokri, 2022). As only two studies were included, the results were not pooled.
Intravenous administration
Johansson (2015) reported the number of patients who had serious treatment-emerged adverse events (mild, moderate, and severe adverse events). In total, 8 of the 30 patients (26.7%) who received intravenous iron had a serious treatment-emerged adverse event, versus 9 of the 30 patients (30%) who received no iron had a serious treatment-emerged adverse event. The RR was 0.89 (95% CI 0.40 to 1.99), in favour of the patients who received intravenous iron. This difference is considered clinically relevant.
Shokri (2022) reported the number of patients who had adverse cardiovascular events. In total, 5 of the 40 patients (12.5%) who received intravenous iron had an adverse cardiovascular event, versus 7 of the 40 patients (17.5%) who received no iron had an adverse cardiovascular event. The RR was 0.71 (95% CI 0.25 to 2.06), in favour of the patients who received intravenous iron. This difference is considered clinically relevant.
Level of evidence of the literature
Number of patients transfused
The level of evidence regarding the outcome measure number of patients transfused was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
Blood product consumption
The level of evidence regarding the outcome measure blood product consumption was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because of a very small number of included patients (imprecision, -2). The level of evidence is therefore very low.
Postoperative blood loss
The level of evidence regarding the outcome measure postoperative blood loss was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because of a small number of patients (imprecision, -2). The level of evidence is therefore very low.
Hemoglobin concentration
The level of evidence regarding the outcome measure hemoglobin concentration was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and the small study population (imprecision, -2). The level of evidence is therefore very low.
Length of stay
The level of evidence regarding the outcome measure length of hospital stay was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of the small study population (imprecision, -2), and because of conflicting results (inconsistency, -1). The level of evidence is therefore very low.
Mortality
The level of evidence regarding the outcome measure mortality was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because the confidence interval exceeds the levels for clinical relevance (imprecision, -2), and because of conflicting results (inconsistency, -1). The level of evidence is therefore very low.
Adverse events
The level of evidence regarding the outcome measure adverse events was based on RCTs and therefore starts high. The level of evidence was downgraded by three levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of using Hb-optimalisation (iron) versus no Hb-optimalisation in adult patients with a pre-operative anemia undergoing elective cardiac surgery?
| P: | adult patients with a pre-operative anemia undergoing elective cardiac surgery |
| I: | Hb-optimalisation (iron) |
| C: | no Hb-optimalisation (no iron) |
| O: |
number of patients transfused, blood product consumption, postoperative blood loss, hemoglobin concentration, length of stay, and adverse events |
Relevant outcome measures
The guideline development group considered number of patients transfused and blood product consumption as critical outcome measures for decision making; and postoperative blood loss, hemoglobin concentration, length of stay, and adverse events as important outcome measures for decision making.
The working group defined the outcome measures as follows:
-
Number of patients transfused: blood transfusion
-
Blood product consumption: red blood cells
A priori, the working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically (patient) important differences:
-
Number of patients transfused: ≥10% (RR < 0.9 and RR > 1.1)
-
Blood product consumption: ≥1 product
-
Postoperative blood loss: ≥250 cc
-
Hemoglobin concentration: ≥0.625 mmol/liter, 1.0 g/dl
-
Length of stay: ≥1 day
-
Adverse events: ≥25% (RR < 0.8 and RR > 1.25)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 15-09-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 212 hits. Studies were selected based on the following criteria: systematic reviews or RCT’s comparing the use of Hb-optimalisation (iron) versus no use of Hb-optimalisation (no iron) in patients who underwent elective cardiac surgery with a pre-operative anemia. Ten studies were initially selected based on title and abstract screening. After reading the full text, six studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four randomized controlled trials were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Boer C, Meesters MI, Milojevic M, Benedetto U, Bolliger D, von Heymann C, Jeppsson A, Koster A, Osnabrugge RL, Ranucci M, Ravn HB, Vonk ABA, Wahba A, Pagano D. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery. J Cardiothorac Vasc Anesth. 2018 Feb
- Friedman T, Dann EJ, Bitton-Worms K, Makhoul M, Glam R, Weis A, Tam DY, Bolotin G. Intravenous iron administration before cardiac surgery reduces red blood cell transfusion in patients without anaemia. Br J Anaesth. 2023 Dec;131(6):981-988. doi: 10.1016/j.bja.2023.09.007. Epub 2023 Oct 12. PMID: 37838604.
- Garrido-Martín P, Nassar-Mansur MI, de la Llana-Ducrós R, Virgos-Aller TM, Rodríguez Fortunez PM, Ávalos-Pinto R, Jimenez-Sosa A, Martínez-Sanz R. The effect of intravenous and oral iron administration on perioperative anaemia and transfusion requirements in patients undergoing elective cardiac surgery: a randomized clinical trial. Interact Cardiovasc Thorac Surg. 2012 Dec;15(6):1013-8. doi: 10.1093/icvts/ivs344. Epub 2012 Aug 31. PMID: 22940889; PMCID: PMC3501294.
- George TJ, Beaty CA, Kilic A, Haggerty KA, Frank SM, Savage WJ, Whitman GJ. Hemoglobin drift after cardiac surgery. Ann Thorac Surg. 2012 Sep;94(3):703-9. doi: 10.1016/j.athoracsur.2012.03.038. Epub 2012 May 19. PMID: 22609121; PMCID: PMC3610599.
- Hazen YJJM, Noordzij PG, Gerritse BM, Scohy TV, Houterman S, Bramer S, Berendsen RR, Bouwman RA, Eberl S, Haenen JSE, Hofland J, Ter Horst M, Kingma MF, Van Klarenbosch J, Klok T, De Korte MPJ, Van Der Maaten JMAA, Spanjersberg AJ, Wietsma NE, van der Meer NJM, Rettig TCD; Cardiothoracic Surgery Registration Committee of the Netherlands Heart Registration. Preoperative anaemia and outcome after elective cardiac surgery: a Dutch national registry analysis. Br J Anaesth. 2022 Apr;128(4):636-643. doi: 10.1016/j.bja.2021.12.016. Epub 2022 Jan 12. PMID: 35031105.
- Johansson PI, Rasmussen AS, Thomsen LL. Intravenous iron isomaltoside 1000 (Monofer®) reduces postoperative anaemia in preoperatively non-anaemic patients undergoing elective or subacute coronary artery bypass graft, valve replacement or a combination thereof: a randomized double-blind placebo-controlled clinical trial (the PROTECT trial). Vox Sang. 2015 Oct;109(3):257-66. doi: 10.1111/vox.12278. Epub 2015 Apr 20. PMID: 25900643; PMCID: PMC4690506.
- Karkouti K, Wijeysundera DN, Yau TM, McCluskey SA, van Rensburg A, Beattie WS. The influence of baseline hemoglobin concentration on tolerance of anemia in cardiac surgery. Transfusion. 2008 Apr;48(4):666-72. doi: 10.1111/j.1537-2995.2007.01590.x. Epub 2008 Jan 10. PMID: 18194382.
- Kloeser R, Buser A, Bolliger D. Treatment Strategies in Anemic Patients Before Cardiac Surgery. J Cardiothorac Vasc Anesth. 2023 Feb;37(2):266-275. doi: 10.1053/j.jvca.2022.09.085. Epub 2022 Sep 22. PMID: 36328926.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726. doi: 10.1093/eurheartj/ehab368. Erratum in: Eur Heart J. 2021 Oct 14;: PMID: 34447992.
- Mueller MM, Van Remoortel H, Meybohm P, Aranko K, Aubron C, Burger R, Carson JL, Cichutek K, De Buck E, Devine D, Fergusson D, Folléa G, French C, Frey KP, Gammon R, Levy JH, Murphy MF, Ozier Y, Pavenski K, So-Osman C, Tiberghien P, Volmink J, Waters JH, Wood EM, Seifried E; ICC PBM Frankfurt 2018 Group. Patient Blood Management: Recommendations From the 2018 Frankfurt Consensus Conference. JAMA. 2019 Mar 12;321(10):983-997. doi: 10.1001/jama.2019.0554. PMID: 30860564.
- Padmanabhan H, Siau K, Curtis J, Ng A, Menon S, Luckraz H, Brookes MJ. Preoperative Anemia and Outcomes in Cardiovascular Surgery: Systematic Review and Meta-Analysis. Ann Thorac Surg. 2019 Dec;108(6):1840-1848. doi: 10.1016/j.athoracsur.2019.04.108. Epub 2019 Jun 21. PMID: 31233718.
- Shokri H, Ali I. Intravenous iron supplementation treats anemia and reduces blood transfusion requirements in patients undergoing coronary artery bypass grafting-A prospective randomized trial. Ann Card Anaesth. 2022 Apr-Jun;25(2):141-147. doi: 10.4103/aca.aca_209_20. PMID: 35417958; PMCID: PMC9244267.
- Song JW, Soh S, Shim JK, Lee S, Lee SH, Kim HB, Kim MY, Kwak YL. Effect of Perioperative Intravenous Iron Supplementation for Complex Cardiac Surgery on Transfusion Requirements: A Randomized, Double-blinded Placebo-controlled Trial. Ann Surg. 2022 Feb 1;275(2):232-239. doi: 10.1097/SLA.0000000000005011. PMID: 34171864. ;32(1):88-120. doi: 10.1053/j.jvca.2017.06.026. Epub 2017 Sep 30. PMID: 29029990.
- Spahn DR, Kaserer A. Intravenous Iron for All in Cardiac Surgery? Ann Surg. 2022 Feb 1;275(2):240-241. doi: 10.1097/SLA.0000000000005277. PMID: 35007226.
- Tibi P, McClure RS, Huang J, Baker RA, Fitzgerald D, Mazer CD, Stone M, Chu D, Stammers AH, Dickinson T, Shore-Lesserson L, Ferraris V, Firestone S, Kissoon K, Moffatt-Bruce S. STS/SCA/AmSECT/SABM Update to the Clinical Practice Guidelines on Patient Blood Management. J Cardiothorac Vasc Anesth. 2021 Sep;35(9):2569-2591. doi: 10.1053/j.jvca.2021.03.011. Epub 2021 Jun 30. PMID: 34217578.
- Weiss G, Ganz T, Goodnough LT. Anemia of inflammation. Blood. 2019 Jan 3;133(1):40-50. doi: 10.1182/blood-2018-06-856500. Epub 2018 Nov 6. PMID: 30401705; PMCID: PMC6536698.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Garrido-Martín, 2012 |
Randomized clinical trial
Setting and country: Hospital Universitario de Canarias, Santa Cruz de Tenerife, Spain
Source of funding: Not stated
Conflicts of interest: None declared |
Inclusion criteria: Patients older than 18 years, elective cardiac surgery under extracorporeal circulation (EC), no previous anemia, susceptible to treatment, no previous blood transfusion, able to complete all study visits and provide written informed consent
Exclusion criteria: Elective cardiac surgery without extracorporeal circulation (EC), treatment with fibrinolytic therapy 48 hours before surgery, history of impaired renal function, previous surgery for active endocarditis, redo-surgery patients, pregnant or lactating, gastrointestinal bleeding, vitamin B12 deficit, ferropenic anemia, clinical history of asthma or allergy, active infection, included in another study, hepatic disease, history of allergy to iron, unlikely to adhere to protocol, unable to comply with the study protocol
N total at baseline: Intervention group I: 66 Intervention group II: 67 Control group III: 63
Important prognostic factors Age ± SD: Intervention group I: 65 ± 11 Intervention group II: 65 ± 10 Control group III: 65 ± 12
Gender (male/female): Intervention group I: 38/16 Intervention group II: 38/15 Control group III: 40/12
EuroSCORE: Intervention group I: 7.0 ± 4.8 Intervention group II: 6.6 ± 3.07 Control group III: 7.2 ± 4.83
Type of surgery (coronary/valvular/mixed): Intervention group I: 19/29/6 Intervention group II: 21/25/7 Control group III: 28/18/6
Hemoglobin at baseline (g/dl) Intervention group I: 14.0 ± 1.63 Intervention group II: 13.7 ± 1.46 Control group III: 14 ± 1.35
Immature reticulocyte fraction preoperative: Intervention group I: 0.34 ± 0.68 Intervention group II: 0.35 ± 0.70 Control group III: 0.33 ± 0.07
Reticulocyte count percentage preoperative: Intervention group I: 1.4 ± 0.60 Intervention group II: 1.5 ± 0.93 Control group III: 1.4 ± 0.59
Serum ferritin preoperative (ng/ml): Intervention group I: 276 ± 186 Intervention group II: 229 ± 211 Control group III: 169 ± 127
Groups were comparable at baseline, except for gender distribution |
Intervention group I: Three doses of 100 mg of intravenous iron (III)-hydroxide sucrose complex per 24 hours, during pre- and postoperative hospitalization. One pill per 24 hours of oral placebo, pre- and postoperative and during 1 month after discharge
Intervention group II: One pill of ferrous fumarate iron (105 mg of iron) per 24 hours, pre- and postoperative and during 1 month after discharge. Three doses of intravenous placebo per 24 hours during pre- and postoperative hospitalization. |
Control group III: Oral and intravenous placebo during pre- and postoperative hospitalization (and oral placebo during 1 month after discharge) |
Length of follow-up: 30 days after discharge
Loss-to-follow-up: Intervention group I: N = 2 - Exitus (n=2)
Intervention group II: N = 3 - Exitus (n=2) - Dropout (n=1)
Control group III: N = 3 - Exitus (n=2) - Dropout (n=1)
Discontinued intervention: Intervention group I: N = 10 - Redo surgery (n=4) - Prolonged length of stay (n=1) - Without extracorporeal surgery (n=1) - Excessive bleeding (n=1) - Intolerance to intravenous iron (n=3)
Intervention group II: N = 7 - Redo surgery (n=4) - Prolonged length of stay in ICU (n=1) - Important complications in surgery unit (n=1) - Excessive bleeding (n=1)
Control group III: N = 7 - Redo surgery (n=4) - Prolonged extracorporeal circulation (n=1) - Without extracorporeal surgery (n=2)
Incomplete outcome data: Intervention group I: N = 0
Intervention group II: N = 1
Control group III: N = 1
|
Hemoglobin levels (g/dL): Intervention group I – at baseline: 14.0 ± 1.63 Intervention group I – postoperative: 10.5 ± 1.39 Intervention group I – at discharge: 11.1 ± 1.52 Intervention group II – at baseline: 13.7 ± 1.46 Intervention group II – postoperative: 10.7 ± 1.41 Intervention group II – at discharge: 11.0 ± 1.28 Control group III – at baseline: 14 ± 1.35 Control group II – postoperative: 10.5 ± 1.56 Control group III – at discharge: 11.0 ± 1.44 Control group III – one month after discharge: 12.3 ± 1.15
p-value at baseline: 0.62 p-value postoperative: 0.22 p-value at discharge: 0.96
Immature reticulocyte fraction (IRF): Intervention group I – at discharge: 0.48 ± 0.10 Intervention group I – one month after discharge: 0.37 ± 0.05 Intervention group II – at discharge: 0.43 ± 0.08 Intervention group II – one month after discharge: 0.37 ± 0.05 Control group III – at discharge: 0.44 ± 0.07 Control group III – one month after discharge: 0.36 ± 0.06
p-value at discharge: 0.04 p-value one month after discharge: 0.81
RC: Intervention group I – at discharge: 1.8 ± 0.75 Intervention group I – one month after discharge: 1.4 ± 0.58 Intervention group II – at discharge: 1.7 ± 0.71 Intervention group II – one month after discharge: 1.2 ± 0.45 Control group III – at discharge: 1.5 ± 0.44 Control group III – one month after discharge: 1.2 ± 0.53
p-value at discharge: 0.059 p-value one month after discharge: 0.26
Serum ferritin levels: Intervention group I – at discharge: 1321 ± 495 Intervention group I – one month after discharge: 610 ± 387 Intervention group II – at discharge: 541 ± 471 Intervention group II – one month after discharge: 212 ± 147 Control group III – at discharge: 485 ± 331 Control group III – one month after discharge: 219 ± 222
p-value at discharge: <0.001 p-value one month after discharge: <0.001
Number of patients transfused: In intervention group I 20 patients were transfused, in intervention group II 27 patients were transfused, and in control group III 26 patients were transfused.
Blood product consumption (units): Intervention group I: 35 units Intervention group II: 44 units Control group III: 41 units |
Authors conclude that Hb levels were similar for the three groups through the postoperative period. In intervention group I a significant increase in immature reticulocyte fraction was observed, compared to intervention group II and control group III. RC initially increased between preoperative and at discharge, but then decreased again one month after discharge. Between groups, there were no significant differences. Serum ferritin levels within groups increased at discharge (day 10) compared to day 1, but decreased one month after discharge.
Authors concluded that there were no differences between groups in the mean number of blood units transfused, and the number of patients transfused. In addition, no differences were found in requirement for transfusion between the three groups. Authors concluded that patients under 75 years old from intervention group I needed fewer blood units per patients, compared to control group III.
No adverse effects were found. |
|
Johansson, 2015 |
Randomized clinical trial
Setting and country: Copenhagen University Hospital, Copenhagen, Denmark
Source of funding: Pharmacosmos A/S (Holbaek, Denmark)
Conflicts of interest: The institution (Department of Clinical Immunology, Copenhagen University Hospital) received a fee per patient. No further conflicts of interest. |
Inclusion criteria: Patients of 18 years and older who undergo elective of subacute CABG, valve replacement or a combination, An Hb of 12.0 g/dl (7.45 mmol/L) or over for women and an Hb of 13.0 g/dl (8.1 mmol/L) or over for men, willing to provide written informed consent.
Exclusion criteria: Iron overload, disturbances in utilization of iron, s-ferritin higher than 800 ng/ml, hypersensitivity to excipients in the drug products, history of multiple allergies, decompensated liver cirrhosis and hepatitis, alanine aminotransferase more than three times upper value, acute infections, rheumatoid arthritis with symptoms or signs of active joint inflammation, pregnant or nursing, participation in other clinical trials (trial drug has not passed five half-lives prior to screening), untreated vitamin B12 or folate deficiency, other IV or oral iron treatment (within four weeks prior to screening visit), erythropoietin treatment (within four weeks prior to screening visit), impaired renal function, receiving blood transfusion less than 30 days before screening and/or during elective or subacute CABG, valve replacement.
N total at baseline: Intervention: n=30 Control: n=30
Important prognostic factors Age ± SD: Intervention: 65 ± 8 Control: 65 ± 11
Gender (male/female): Intervention: 26/4 Control: 26/4
Type of surgery: (CBAG/valve replacement/combination: Intervention: 17/11/2 Control: 21/9/0
Hemoglobin at baseline (g/dl): Intervention: 14.25 Control: 13.98
Transferrin saturation (%) Intervention: 19 Control: 21
Ferritin (ng/ml) Intervention: 254 Control: 286
Groups were comparable at baseline |
Intervention: A single-dose infusion of 1000 mg iron isomaltoside 1000 over 15 minutes with a maximum single dose of 20 mg/kg.
|
Control: A single-dose infusion of 100 ml saline (Natriumklorid 9 mg/ml) over 15 minutes. |
Length of follow-up: 4 weeks postoperatively
Loss-to-follow-up: Intervention: N = 4 - Withdrawal of consent (n=1) - Patient non-compliance (n=3)
Control: N = 5 - Patient non-compliance (n=5)
Incomplete outcome data: Intervention: N = 8 - FAS: Did not have at least 1 post baseline Hb assessment at visit 4 (n=4) - PP: Have major protocol deviation and received blood transfusion (n=4)
Control: N = 9 - FAS: Did not have at least 1 post baseline Hb assessment at visit 4 (n=5) - PP: Have major protocol deviation and received blood transfusion (n=4)
|
Hemoglobin concentration (g/dL): At baseline: Intervention: 14.3 Control: 14.0 Day 5: Intervention: 10.2 Control: 10.5 FAS: Decrease in Hb concentration, significantly less in intervention group compared to control group. Week 4: p=0.0124
PP: Similar results
Need of blood transfusion: FAS: Four patients in the intervention group and three patients in the control group needed blood transfusion.
Total blood transfusions done: Postoperative visit: in the intervention group 4 patients received blood transfusion, 26 patients did not. In the control group 6 patients received blood transfusion, 24 patients did not. Postoperative to day 5: in the intervention group 4 patients received blood transfusion, 26 patients did not. In the control group 5 patients received blood transfusion, 25 did not. After day 5 to week 4: in the intervention group none of the patients received blood transfusion. In the control group 1 patient received blood transfusion, 24 patients did not.
S-ferritin concentrations: FAS: Increase in s-ferritin concentration in the intervention group compared to the control group. Day 5: p<0.0001 Week 4: p<0.0001
S-iron concentrations: FAS: Significantly less decrease in s-iron concentration in intervention group as compared to the control group. Day 5: p<0.0001 Week 4: p<0.05
Transferrin saturation (TSAT): FAS: Increase in TSAT concentration in the intervention group compared to the control group. Day 5: p<0.0001 Week 4: p=0.0015
Reticulocytes: FAS: Increase in reticulocyte counts from baseline to day 5 in the intervention group compared to the control group. Day 5: p=0.0157
Total number of treatment-emerged adverse events reported: In the intervention group 73 adverse events were reported, in the control group 66 adverse events were reported. |
Authors concluded there was a decrease in mean Hb concentration (from baseline to week 4) in both the intervention and the control group, both in the FAS and PP analysis, but the decrease was significantly less in the control group.
Authors concluded that the significant increase in reticulocyte count at day 5 in the intervention group compared to the control group shows a rapid onset of the erythropoietic effect. |
|
Shokri, 2022 |
Randomized parallel-group study
Setting and country: Cardiothoracic Academy of Ain Shams University, Cairo, Egypt
Source of funding: No funding
Conflicts of interest: None declared |
Inclusion criteria: Age 52-67 years, elective CABG surgery scheduled, eligibility to receive study medication, clopidogrel interruption 10 days before surgery, anemia defined as Hb less than 13 g/dL for men and less than 12 g/dL for women.
Exclusion criteria: Hypersensitivity to iron, hepatitis B or C or human immunodeficiency virus, folate or vitamin B12 deficiency, unstable angina, history of stroke in the last 6 months, Hb <8 g/dL, active severe infection, suspicion of iron overload (ferritin >300 µg/L or autologous blood transfusion in the last month, pregnancy or nursing, impaired renal function (s-creatinine >150 µmol/L, hemochromatosis, or hemosiderosis), vitamin B12 or folic acid deficiency, and anemia from intestinal bleeding.
N total at baseline: Intervention: n=40 Control: n=40
Important prognostic factors2: Age ± SD: Intervention: 58.35 ± 4.44 Control: 60.08 ± 4.79
Gender (male/female): Intervention: 18/22 Control: 25/15
Hemoglobin on admission (g/dL): Intervention: 9.52 ± 0.84 Control: 9.77 ± 0.74
Hemoglobin preoperative (g/dL): Intervention: 12.76 ± 0.88 Control: 10.03 ± 0.83
Reticulocyte count preoperative (%): Intervention: 1.46 ± 0.38 Control: 1.54 ± 0.27
Groups were comparable at baseline |
Intervention: A single intravenous dose of ferric carboxymaltose of 1000 mg in 100 mL saline, infused for 15 minutes 7 days before surgery. |
Control: A single-dose infusion of 100 mL saline for 15 minutes 7 days before surgery. |
Length of follow-up: 4 weeks after discharge
Loss-to-follow-up: Intervention: N = 0
Control: N = 0
Discontinued intervention: Intervention: N = 0
Control: N = 0
Incomplete outcome data: Not stated
|
Hemoglobin concentration (g/dL): Incidence of anemia in 4 weeks after discharge in 32% of the patients in the intervention group compared to 80% of the patients in the control group (p<0.0001). Hb levels were significantly higher in the intervention group preoperative, postoperative and 4 weeks after discharge. - On admission: Intervention: 9.52 ± 0.84 Control: 9.77 ± 0.74 - Postoperative: Intervention: 9.1 ± 0.63 Control: 7.55 ± 0.6 - One week after discharge: Intervention: 10.35 ± 0.89 Control: 10.18 ± 0.85
Number of pRBCs units given postoperatively: The number of pRBCs given was significantly higher in the control group than in the intervention group postoperatively (p<0.0001). Intervention: 5 (12.5%) Control: 22 (55%)
Hospital stay and ICU stay: The length of hospital stay and ICU stay was significantly longer in the control group than in the intervention group (p<0.0001). - Length of hospital stay: Intervention: 4.33 ± 1 Control: 8.68 ± 1.1. - ICU stay: Intervention: 1.28 ± 0.45 Control: 2.23 ± 0.95
Adverse cardiovascular events: No significant difference in incidence between the intervention and the control group. Intervention: 5 (12.5%) Control: 7 (17.5%)
Mortality: No significant difference in mortality rate between the intervention and control group (p=0.644). Intervention: 2 (5%) Control: 3 (7.5%)
Reticulocytes: Significantly higher percentage of reticulocytes in the control group than in the intervention group postoperatively and one week after discharge (p<0.0001). - Postoperative Intervention: 1.88 ± 0.19 Control: 4.3 ± 0.27 - One week after discharge Intervention: 1.72 ± 0.52 Control: 7.96 ± 0.41 |
Authors concluded that Hb levels increased after preoperative intravenous iron therapy, postoperatively and 4 weeks after discharge. There was a significant decrease in the postoperative RBC requirements and shorter hospital and ICU stay length. Percentage of reticulocytes was significantly higher in the control group compared to the intervention group postoperatively and one week after discharge. |
|
Song, 2022 |
Randomized controlled trial
Setting and country: Severance Cardiovascular Hospital, Seoul, South Korea
Source of funding: Supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education. And faculty research grant of Yonsei University College of Medicine.
Conflicts of interest: None declared |
Inclusion criteria: Adult patients, undergoing elective complex cardiac surgery (surgery involving both mitral and aortic valve, valve surgery with concomitant coronary artery bypass graft or graft replacement of the ascending aorta, or redo surgery).
Exclusion criteria: Severe preoperative anemia (hemoglobin <10 g/dL for male and <9 g/dL for women), erythropoietin treatment within 4 weeks before surgery, hemolytic anemia or aplastic anemia, known hypersensitivity to intravenous iron formulations, patients who were managed in the ICU preoperatively due to heart failure or major organ dysfunction.
N total at baseline: Intervention: n=107 Control: n=107
Important prognostic factors2: Age ± SD: Intervention: 61 ± 11 Control: 63 ± 11
Gender (male/female): Intervention: 39/64 Control: 42/59
Preoperative Anemia (Hemoglobin <13 g/dL): Intervention: 52 (50.5) Control: 53 (52.3)
Type of surgery (double valve/ valve+CABG/ valve+aorta): Intervention: 80/10/13 Control: 81/11/9
Preoperative iron deficiency (ferritin <100ng/ml): Intervention: 82 (79.6) Control: 72 (71.3)
EuroSCORE: Intervention: 5 [3-6] Control: 5 [3-7.5]
Groups were comparable at baseline. |
Intervention: FDI 20 mg/kg with a maximum single dose of 1000 mg, over 15 minutes, twice during the perioperative period: 3 days before and after the surgery. |
Control: Equal volume of 0.9% sodium chloride, over 15 minutes, twice during the perioperative period: 3 days before and after the surgery. |
Length of follow-up: 3 weeks postoperative
Loss-to-follow-up: Intervention: N = 4 - Acute postoperative bleeding requiring re-exploration (n=2) - Cancelled surgery (n=2)
Control: N = 6 - Acute postoperative bleeding requiring re-exploration (n=4) - Cancelled surgery (n=2)
|
Proportion of patients who received pRBC transfusion: Within 10 days postoperatively, in the intervention group 57.2% of the patients received transfusion, compared to 60.4% of the patients in the control group. OR 0.88, 95% CI 0.50-1.54, p=0.651
The frequency and amount of allogenic plasma product transfusion were similar between the two groups.
The odds ratio of pRBC transfusion for the intervention group versus the control group in the subgroup of anemic patients was 0.34 (95% CI 0.12-0.94, p=0.024), which was significantly lower than the subgroup of non-anemic patients.
Hemoglobin concentration (g/dL): Hemoglobin concentration did not differ between the two groups from baseline until postoperative day 10 or the day of discharge. A significant increase in hemoglobin concentration was observed in the intervention group compared to the control group at 3 weeks after surgery. - At baseline: Intervention: 13.01 Control: 12.90 - Postoperative: Intervention: 10.41 Control: 10.11 - After 5 days: Intervention: 9.11 Control: 9.00
Reticulocyte count: Reticulocyte counts increased postoperatively in both groups. At postoperative day 10, the intervention group showed higher reticulocyte count and percentage than the control group. Intervention: 6.7 (4.5-8.8) % Control: 5.5 (3.7-6.8) % P=0.011
Serum iron: Serum iron decreased postoperatively in the control group (p<0.05). In the intervention group, serum iron increased from the time of induction of anesthesia until three weeks after surgery (p<0.001).
Transferrin saturation: Transferrin saturation decreased postoperatively in the control group (p<0.05). In the intervention group, transferrin saturation increased from the time of induction of anesthesia until three weeks after surgery (p<0.001).
Serum ferritin: Serum ferritin increased postoperatively in the control group (p<0.05). In the intervention group, serum ferritin increased from the time of induction of anesthesia until three weeks after surgery (p<0.001).
Serum erythropoietin: Both the intervention and the control group showed increased serum erythropoietin concentrations at postoperative day three compared to baseline values (p=0.003). There were no between-group differences.
Mortality: Similar between the intervention and control group. Intervention: 2 (1.9) Control: 1 (1.0) P=0.572
Duration of hospitalization (d): Similar between the intervention and control group. Intervention: 12 [10-14] Control: 11 [9-16] P=0.299 |
Authors conclude that perioperative administration of intravenous iron during hospitalization led to an increase in transferrin saturation and total body iron stores. No difference was observed in transfusion requirements until postoperative day 10 between the intervention and the control group.
In addition, authors conclude that there was an increase in hemoglobin concentration at 3 weeks after surgery, without any differences in other morbidity endpoints between the intervention and the control group. |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Garrido-Martín, 2012 |
Definitely yes;
Reason: Randomization with computer-generated random numbers. |
Probably yes
(Performed by hospital research unit). |
Probably yes
Reason: double-blind trial (however, it was not specified who was blinded). |
Definitely no
Reason: Loss to follow-up 12 in intervention group I, 10 in intervention group II, and 10 in control group III. |
Probably yes
Reason: All outcomes in abstract reported in results. |
Definitely no
Reason: The study was underpowered. |
HIGH
Due to frequent loss to follow-up and the study being underpowered. |
|
Johansson, 2015 |
Definitely yes
Reason: Randomized with interactive web response system method. Unique randomization number was generated for the patients. |
Probably yes
Performed by contract research organisation. Randomization list was prepared by a contract research organisation, screening and enrolment of patients was performed by the investigator, entering patient data into the interactive web response system was performed by trial nurse or coordinator. |
Probably yes
Reason: double-blind trial (however, it was not specified who was blinded). |
Definitely no
Reason: Loss to follow-up 4 in intervention group and 5 in placebo group, in total 9 of 60 patients. |
Probably no
Reason: Secondary outcomes not reported: number of postoperative days to discharge, changes in New York Heart Association (NYHA) classification from baseline to 4 weeks. |
Definitely no
Reason: Exploratory trial with sample size of only 60 patients. |
HIGH
Due to small sample size, frequent loss to follow-up and selective outcome reporting.
|
|
Shokri, 2022 |
Definitely yes
Reason: Computer-generated randomization. |
Definitely yes
Reason: Opaque sealed envelopes were used. |
Probably yes
Reason: Patients and researchers were blinded, all infusion syringes, infusion lines, and disposables were wrapped in aluminium foil by the pharmacist who was unaware of the nature of the study, and the research team was blinded to the treatment allocation. |
Definitely yes
Reason: No losses to follow-up. |
Probably yes
Reason: All outcomes in abstract reported in results. |
Definitely no
Reason: The study has a relatively small sample size. |
HIGH
Due to small sample size.
|
|
Song, 2022 |
Definitely yes
Reason: Computer-generated randomization with a block size of 4. |
No information
|
Probably yes
Reason: Apart from one investigator, who was dedicated to the preparation and administration of the study drug, the information on the assigned group was hidden from all participants, investigators, and caregivers. For the drug administration, a concealed administration set was used. |
Definitely yes
Reason: Loss to follow-up in intervention (n=4) and control group (n=6). In total, 10 of 214 participants were not taken into account in the analysis. |
Probably yes
Reason: All outcomes in abstract reported in results. |
Definitely no
Reason: Relatively small-sized study. The study was not adequately powered to confirm the treatment effects across the subset of patients. |
HIGH
Due to small sample size.
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Beris P, Muñoz M, García-Erce JA, Thomas D, Maniatis A, Van der Linden P. Perioperative anaemia management: consensus statement on the role of intravenous iron. Br J Anaesth. 2008 May;100(5):599-604. doi: 10.1093/bja/aen054. Epub 2008 Mar 27. PMID: 18372258. |
Concensus statment, no original research. |
|
Gupta S, Panchal P, Gilotra K, Wilfred AM, Hou W, Siegal D, Whitlock RP, Belley-Cote EP. Intravenous iron therapy for patients with preoperative iron deficiency or anaemia undergoing cardiac surgery reduces blood transfusions: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg. 2020 Aug 1;31(2):141-151. doi: 10.1093/icvts/ivaa094. PMID: 32642775. |
Only one study included in this systematic review is relevant. The individual study is included. |
|
Hogan M, Klein AA, Richards T. The impact of anaemia and intravenous iron replacement therapy on outcomes in cardiac surgery. Eur J Cardiothorac Surg. 2015 Feb;47(2):218-26. doi: 10.1093/ejcts/ezu200. Epub 2014 May 13. PMID: 24824650. |
More recent systematic reviews are available. |
|
Lin DM, Lin ES, Tran MH. Efficacy and safety of erythropoietin and intravenous iron in perioperative blood management: a systematic review. Transfus Med Rev. 2013 Oct;27(4):221-34. doi: 10.1016/j.tmrv.2013.09.001. Epub 2013 Oct 15. PMID: 24135037. |
Does not match PICO: not in patients undergoing cardiac surgery. |
|
Tankard KA, Park B, Brovman EY, Bader AM, Urman RD. The Impact of Preoperative Intravenous Iron Therapy on Perioperative Outcomes in Cardiac Surgery: A Systematic Review. J Hematol. 2020 Dec;9(4):97-108. doi: 10.14740/jh696. Epub 2020 Oct 1. PMID: 33224389; PMCID: PMC7665859. |
Only two studies included in this systematic review are relevant. The individual studies are included. |
|
Yang SS, Al Kharusi L, Gosselin A, Chirico A, Baradari PG, Cameron MJ. Iron supplementation for patients undergoing cardiac surgery: a systematic review and meta-analysis of randomized controlled trials. Can J Anaesth. 2022 Jan;69(1):129-139. English. doi: 10.1007/s12630-021-02113-z. Epub 2021 Sep 24. PMID: 34559371. |
Only two studies included in this systematic review are relevant. The individual studies are included. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-07-2024
Beoordeeld op geldigheid : 05-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan.
Werkgroep
- Dr. M. (Maarten) ter Horst (voorzitter), NVA, anesthesioloog, Erasmus MC
- Drs. J.M.A.A. (Joost) van der Maaten, NVA, anesthesioloog, UMC Groningen
- Dr. A.B.A. (Alexander) Vonk, NVT, cardiothoracaal Chirurg, Amsterdam UMC
- Drs. E.J. (Edgar) Daeter, NVT, cardiothoracaal chirurg, St. Antonius Ziekenhuis
- Dr. R.I. (Rick) Meijer, NIV/NVIVG, internist, Radboud UMC
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, NIV, internist, HagaZiekenhuis
- Dr. A.J.G. (Gerard) Jansen, NIV, internist, Erasmus MC
- Prof. dr. A.P.J. (Alexander) Vlaar, NVIC, intensivist, Amsterdam UMC
- Prof. dr. ir. Y.M.C. (Yvonne) Henskens, NVKC, laboratoriumspecialist klinische chemie, Maastricht UMC
- Dr. N.R. (Nick) Bijsterveld, NVVC, cardioloog, Amsterdam UMC
- Dr. N. (Nienke) van Rein, NVZA, ziekenhuisapotheker, Leiden UMC
- I.G.J. (Ilse) Verstraaten, MSc, beleidsmedewerker Harteraad
Klankbordgroep
- Drs. K. (Karin) Gorter, NeSECC, klinisch perfusionist, UMC Utrecht
- Drs. A.R. (Arnold) van Oostrum, NeSECC, klinisch perfusionist, OLVG
- Dr. A.J. (Sander) Spanjersberg, NVA, cardioanesthesioloog, Isala Zwolle
- Dr. P.A.W. (Peter) te Boekhorst, NIV, internist, Erasmus Medisch Centrum
Met ondersteuning van
- Dr. R. (Romy) Zwarts-van de Putte, adviseur Kennisinstituut
- Drs. E.R.L. (Evie) Verweg, junior adviseur Kennisinstituut
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
ter Horst |
Anesthesioloog (Erasmus MC) |
Bestuurslid sectie cardio-anesthesiologie niet betaald Lid van de Landelijke gebruikersraad van Sanquin namens de NVA niet betaald Lid Leidraad EHH, CCU, ICCU gecoördineerd door kennisinstituut niet betaald lid EACTAIC subcommissie TEE niet betaald |
- Presentatie over eigen onderzoek CLS-Behring over ROTEM (verkoop fibrinogeen) (betaling aan het ziekenhuis, betaling voor tijd), hebben geen invloed op wat er verteld wordt. - Verricht onderzoek naar vermindering van bloedproducten verbruik bij cardiochirurgie: recent artikel over dit onderwerp gepubliceerd. Als er intellectueel belang is dan is dit minimaal. |
Volgens de werkgroep geen restrictie nodig. De betaling van de presentatie is puur voor de tijd die erin wordt gestoken, de financier heeft geen invloed op de inhoud van de presentatie. |
|
van der Maaten |
Anesthesioloog (UMCG) |
Lid RvT Nederlandse Hart Registratie (NHR) |
Geen |
Geen restrictie |
|
Vonk |
Cardiothoracaal Chirurg (AUMC Amsterdam) |
Geen |
Geen |
Geen restrictie |
|
Daeter |
Cardiothoracaal Chirurg (St. Antonius ziekenhuis Nieuwegein) |
Medisch manager eenheid hart antonius ziekenhuis |
Geen |
Geen restrictie |
|
Meijer |
Internist (Radboudumc) |
Geen |
Geen |
Geen restrictie |
|
Kerkhoffs |
Internist-hematoloog (HagaZiekenhuis Den Haag) |
Transfusie Specialist/senior onderzoeker, Sanquin Amsterdam, Research en transfusie consulten FTE 0.2 (onderzoek over bloedplaatjes, verder geen directe link met richtlijn). |
Geen |
Geen restrictie |
|
Jansen |
Internist-hematoloog (Erasmus MC) |
Wetenschappelijk voorzitter NVB |
Research funding: Principia, Argenx, CSL Behring, Sobi, EHA Research Fellowship (PI): personal fellowship for research. - Consultancy: Novartis, Amgen. Paid |
Geen restrictie. De onderzoeken hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld.
|
|
Vlaar |
Intensivist (Amsterdam- UMC) |
Lid Medische adviesraad Sanquin |
PI van PACER trial (ZonMw gefinancierd) Werfen in kind sponsoring CSL Behring studie grant en consultancy LSBR Fellowship op het gebied van TACO VIDI op gebied van TRALI |
Geen restrictie. De farma gesponsorde studies hebben geen betrekking op de modules uit de opgestelde richtlijn. |
|
Henskens |
Klinisch chemicus en waarnemend hoofd Centraal diagnostisch Laboratorium (CDL) Maastricht UMC+, Hoogleraar Klinische Chemie, in het bijzonder hemostase. 0.9 fte (CDL, MUMC+), 0.1 fte Universiteit Maastricht, FHML (faculty of Health, Medicine and Life Sciences). |
VHL Vereniging hematologische laboratoria, voorzitter (onbetaald); Landelijke en regionale gebruikersraad Sanquin (onbetaald), TVB Tijd voor verbinding antistollingszorg Expert team, namens NFU (vacatiegelden), Richtlijn antithrombotisch beleid, op afroep namens NVKC (vacatiegelden), voorzitter concilium NVKC (vacatiegelden), Lid Raad Opleidng FMS (onbetaald). |
Projectleider van de studie: Laboratory Predictors of hemostasis and thrombosis. Financier Siemens, Stago, Roche, Werfen, Nodia (korting of gratis reagentia of apparatuur te leen van bovenstaande bedrijven, zij financieren geen studies). |
Exclusie besluitvorming aanbevelingen module over POC testfacilieit aangezien het extern gefinancierde onderzoek mogelijk tot belangenverstrengeling leidt. Het werkgroeplid heeft geen band met één specifieke firma, alle testen worden onderzocht.
|
|
Bijsterveld |
Cardioloog (Amsterdam UMC) |
Voorzitter NVVC werkgroep Cardiologie en Sport (onbetaald) |
Geen |
Geen restrictie |
|
van Rein |
Ziekenhuisapotheker, Klinische Farmacie en Toxicologie, LUMC. 0.83 FTE. Inkopen en logistiek geneesmiddelen, directe patientenzorg, trials, onderwijs. Assistant progessor, Klinische Epidemiologie, LUMC, 0.17 FTE. Begeleiden promovendi, beurzen schrijven, onderwijs. |
Richtlijn antitrombotisch beleid |
Extern gefinancierd onderzoek (geen projectleider) – ZonMw GGG: Distinct onderzoek: optimaliseren tromboseprophylaxe na orthopedische ingrepen + L-TRRiP studie: optimaliseren trombosebehandeling na eerste veneuze trombose. Ook extern gefinancierd onderzoek vanuit de Trombosestichting: balans bloedingen en trombose optimaliseren dmv proteomics, wel projectleider.
Daarnaast ook verantwoordelijk voor alle geneesmiddelen studies die lopen in het LUMC en het CHDR, maar neem daar niet zelf actief aan deel. |
Geen restrictie, de trials hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld. |
|
Verstraaten |
Beleidsadviseur Harteraad |
Geen |
Geen |
Geen restrictie |
|
Gorter |
Klinisch perfusionist, Heartbeat Dutch Perfusion Service, UMCU |
Geen |
Projectleider van onderzoek verschillende ACT targets tijdens CPB. Financier medtronic. |
Geen restrictie, Gorter is onderdeel van de klankbordgroep en niet actief betrokken bij het formuleren van de aanbevelingen met betrekking tot ACT targets. |
|
van Oostrum |
Klinisch Perfusionist MCL (betaald) |
Voorzitter NeSECC (onbetaald) |
Praktijkvoordeel omdat ik werkzaam ben als klinisch perfusionist, en we hier in de praktijk op de OK baat bij kunnen hebben. |
Geen restrictie |
|
Spanjersberg |
Isala, MSB |
Geen |
Voordracht fibrinogeen in hartchirurgie (sponsor CSL) |
Geen restrictie |
|
te Boekhorst |
Internist-Hematoloog / transfusiespecialist, Erasmus MC |
Voorzitter stichting TRIP |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door benoem gebruikte methode: uitnodigen van de patiëntenvereniging Harteraad voor de invitational conference en een afgevaardigde van de patiëntenvereniging Harteraad in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Preoperatieve Hb-optimalisatie met IV-ijzer |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepassbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging voor Cardiologie (NVvC), Nederlandse Vereniging voor Intensive Care (NVIC), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskund (NVKC), Harteraad, Inspectie Gezondheidszorg en Jeugd (IGJ), Vereniging Innovatieve Geneesmiddelen (VIG), en de Nederlandse Vereniging voor Anesthesiologiemedewerkers (NVAM) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Kennisvragen
De kennislacunes per module staan onder ‘Bijlagen’ en dan ‘Onderzoek’.
Inleiding
Tijdens de ontwikkeling van de richtlijn peri-operatief bloed en (anti)stollingsmanagement is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based richtlijn ontwikkeling (EBRO) is duidelijk geworden dat er nog kennisvragen bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk.
Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVT Perioperatief bloed- en (anti)stollingsmanagement voor cardiochirurgie in Nederland |
|
|
Uitgangsvraag: UV1 Wat is de waarde van routinematig toepassen van Hb-optimalisatie in de vorm van ijzer toediening bij patiënten die cardiochirurgie ondergaan? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 15-9-2022 |
|
Periode: 2000- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: Cardiovasculaire chirurgie EN anemie EN iron suppletie of bloedtransfusie EN perioperatieve periode EN volwassenen Van de 11 sleutelartikelen worden 2 studies niet gevonden omdat in het artikel van Miles anemie ontbreekt in titel, abstract en indexterm en in het artikel van Tonino cardiovasculaire patiënten ontbreken in titel, abstract, indexterm |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 15-9-2022 met relevante zoektermen gezocht vanaf 2000 naar studies over het toepassen van Hb optimalisatie in de vorm van ijzer bij volwassen patiënten die cardiochirurgie ondergaan. De literatuurzoekactie leverde 212 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
86 |
30 |
96 |
|
RCTs |
88 |
70 |
16 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
212 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#29 |
#19 AND #20 |
86 |
|
#28 |
#26 NOT #25 NOT #24 OBS |
467 |
|
#27 |
#25 NOT #24 RCT |
88 |
|
#26 |
#19 AND (#22 OR #23) |
565 |
|
#25 |
#19 AND #21 |
115 |
|
#24 |
#19 AND #20 SR |
87 |
|
#23 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13447463 |
|
#22 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#21 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#20 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#19 |
#18 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1125 |
|
#18 |
#17 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1690 |
|
#17 |
#13 AND #14 AND #15 AND #16 |
1830 |
|
#16 |
'perioperative period'/exp OR intraoperat*:ti,ab,kw OR perioperat*:ti,ab,kw OR postoperat*:ti,ab,kw OR 'intra operat*':ti,ab,kw OR 'peri operat*':ti,ab,kw OR 'post operat*':ti,ab,kw OR 'after surger*':ti,ab,kw OR postsurg*:ti,ab,kw OR intrasurg*:ti,ab,kw OR perisurg*:ti,ab,kw |
1950603 |
|
#15 |
'anemia'/exp OR 'anaemi*':ti,ab,kw OR 'anemi*':ti,ab,kw OR 'iron deficiency'/exp OR 'asiderosis':ti,ab,kw OR 'sideropaenia':ti,ab,kw OR 'sideropenia':ti,ab,kw OR (((fe OR iron) NEAR/2 deficien*):ti,ab,kw) |
513153 |
|
#14 |
'iron therapy'/exp OR 'erythropoietin'/exp OR 'recombinant erythropoietin'/exp OR 'iron derivative'/exp OR 'iron'/exp OR 'antianemic agent'/exp OR 'blood transfusion'/exp OR 'ferric carboxymaltose'/exp OR 'eiseninject':ti,ab,kw OR 'ferinject':ti,ab,kw OR 'injectafer':ti,ab,kw OR 'iroprem':ti,ab,kw OR 'renegy':ti,ab,kw OR 'z 213':ti,ab,kw OR 'z213':ti,ab,kw OR 'erythropoietin':ti,ab,kw OR rhepo:ti,ab,kw OR 'oral iron':ti,ab,kw OR 'intravenous iron':ti,ab,kw OR 'iron suppletion':ti,ab,kw OR ferric:ti,ab,kw OR ferrous:ti,ab,kw OR 'blood transfusion':ti,ab,kw OR 'blood management':ti,ab,kw OR (((hb OR hemoglobin OR haemoglobin OR iron OR fe) NEAR/3 (optimization OR optimisation)):ti,ab,kw) |
667477 |
|
#13 |
'thorax surgery'/exp OR 'cardiovascular surgery'/exp OR (((cardi* OR chest* OR thoracic OR thorax OR coronar* OR myocard* OR heart) NEAR/3 (operat* OR resect* OR surg*)):ti,ab,kw) OR 'coronary bypass*':ti,ab,kw |
1174378 |
|
#12 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 OR #11 sleutelartikelen |
11 |
|
#11 |
preoperative AND anemia AND transfusion AND in AND cardiac AND surgery AND a AND 'single centre' AND retrospective AND study AND nguyen |
1 |
|
#10 |
effects AND of AND preoperative AND intravenous AND erythropoietin AND plus AND iron AND on AND outcome AND in AND anemic AND patients AND after AND cardiac AND valve AND replacement |
1 |
|
#9 |
(erythropoietin AND plus AND iron AND versus AND control AND treatment AND including AND placebo OR iron) AND for AND preoperative AND anaemic AND adults AND undergoing AND 'non cardiac' AND surgery |
1 |
|
#8 |
cardiac AND vascular AND surgery AND interventional AND anaemia AND response AND klein AND 2020 |
1 |
|
#7 |
anaemia AND in AND cardiac AND surgery AND quarterman |
1 |
|
#6 |
the AND impact AND of AND iron AND store AND on AND red AND blood AND cell AND transfusion AND gaudriot |
1 |
|
#5 |
prevalence AND of AND iron AND deficiency AND red AND blood AND cell AND transfusions AND in AND surgical AND patients AND tonino |
1 |
|
#4 |
effect AND of AND intravenous AND oral AND iron AND administration AND on AND perioperative AND anaemia AND transfusion AND requirements AND in AND patients AND undergoing AND elective AND cardiac AND surgery |
1 |
|
#3 |
intravenous AND iron AND isomaltoside AND 1000 AND johansson AND 2015 |
1 |
|
#2 |
intravenous AND iron AND supplementation AND treats AND anemia AND reduces AND blood AND transfusion AND requirements AND in AND patients AND undergoing AND coronary AND artery AND bypass AND grafting |
1 |
|
#1 |
associations AND between AND 'non anaemic' AND iron AND deficiency AND outcomes AND following AND elective AND cardiac AND surgery |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
17 |
15 not 14 not 13 OBS |
252 |
|
16 |
14 not 13 RCT |
70 |
|
15 |
8 and (12 or 13) |
342 |
|
14 |
8 and 10 |
83 |
|
13 |
8 and 9 SR |
30 |
|
12 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5246523 |
|
11 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4246061 |
|
10 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1545869 |
|
9 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
617909 |
|
8 |
limit 7 to yr="2000 -Current" |
669 |
|
7 |
6 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
800 |
|
6 |
5 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
820 |
|
5 |
1 and 2 and 3 and 4 |
892 |
|
4 |
exp Perioperative Period/ or intraoperat*.ti,ab,kf. or perioperat*.ti,ab,kf. or postoperat*.ti,ab,kf. or intra operat*.ti,ab,kf. or peri operat*.ti,ab,kf. or post operat*.ti,ab,kf. or after surger*.ti,ab,kf. or postsurg*.ti,ab,kf. or intrasurg*.ti,ab,kf. or perisurg*.ti,ab,kf. |
996653 |
|
3 |
exp Anemia/ or exp Iron Deficiencies/ or anaemi*.ti,ab,kf. or anemi*.ti,ab,kf. or asiderosis.ti,ab,kf. or sideropaenia.ti,ab,kf. or sideropenia.ti,ab,kf. or ((fe or iron) adj2 deficien*).ti,ab,kf. |
257014 |
|
2 |
exp Erythropoietin/ or exp Iron Compounds/ or exp Iron, Dietary/ or exp blood transfusion/ or Anemia, Iron-Deficiency/ or Iron/ or erythropoietin.ti,ab,kf. or rhepo.ti,ab,kf. or oral iron.ti,ab,kf. or intravenous iron.ti,ab,kf. or iron suppletion.ti,ab,kf. or ferric.ti,ab,kf. or ferrous.ti,ab,kf. or blood transfusion*.ti,ab,kf. or anemia.ti,ab,kf. or iron deficienc*.ti,ab,kf. or iron therap*.ti,ab,kf. or eiseninject.ti,ab,kf. or ferinject.ti,ab,kf. or injectafer.ti,ab,kf. or iroprem.ti,ab,kf. or renegy.ti,ab,kf. or z 213.ti,ab,kf. or z213.ti,ab,kf. or blood management.ti,ab,kf. or ((hb or hemoglobin or haemoglobin or iron or fe) adj3 (optimization or optimisation)).ti,ab,kf. |
439122 |
|
1 |
Thoracic Surgery/ or exp Cardiovascular Surgical Procedures/ or ((cardi* or chest* or thoracic or thorax or coronar* or myocard* or heart*) adj4 (operat* or surg* or resect*)).ti,ab,kf. or coronary bypass*.ti,ab,kf. |
534745 |