Heparine en protamine
Uitgangsvraag
Welke streefwaarde voor activated clotting time (ACT) dient gebruikt te worden voordat iemand op de hart-long machine kan worden aangesloten?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is het verschil in streefwaarde tussen de verschillende apparaten die gebruikt worden om de ACT te meten?
- Wat zijn optimale protamine doseerschema’s om heparine te antagoneren?
Aanbeveling
Aanbeveling-1
Streef naar minimaal een ACT van 400 seconden, maar raadpleeg hiervoor de apparaat-specifieke kenmerken. Er zijn aanwijzingen dat een lagere ACT ook veilig kan zijn.
Streef bij het gebruik van de hart-longmachine met een open systeem naar een ACT boven de 400. Raadpleeg voor de minimale ACT de apparaat-specifieke kenmerken.
Aanbeveling-2
Doseer protamine in een ratio van 0,8:1 tot 1:1 ten opzichte van heparine.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek verricht naar de vergelijking tussen lage ACT streefwaarden (<350 s) en hoge streefwaarden (>420 s) in volwassenen die cardiochirurgie ondergaan aan de hart-longmachine. Echter zijn er geen studies gevonden die deze vergelijking hebben onderzocht. Bovendien is er geen gouden standaard voor de remming van de stolling. Hier ligt dus een kennislacune.
Tijdens het selecteren van literatuur zijn er wel studies gevonden die relevant zijn, maar niet helemaal aan de PICO voldeden aangezien alleen over mini-ECC (ExtraCorporele Circulatie) -systemen gaan, en dus niet toepasbaar zijn bij standaard hartchirurgie, desondanks worden deze hieronder beschreven:
Bauer (2019) heeft een RCT uitgevoerd naar het gebruik van een ACT streefwaarde van 300 seconden versus een ACT streefwaarde van 450 seconden in 71 patiënten die een bypassoperatie ondergingen met gebruik van MiECC (minimal invasive ECC). Patiënten werden gerandomiseerd naar de interventie groep (ACT 300s) of de controlegroep (ACT 450s). De patiënten in de interventie groep ontvingen minder heparine en protamine dan de patiënten in de controlegroep. Er werd gevonden dat zowel in de interventiegroep als in de controlegroep één patiënt overleed. Daarnaast hadden de patiënten in de interventiegroep met een lage streefwaarde 3 patiënten een nieuwe operatie nodig, versus 1 patiënt in de groep met de hoge streefwaarde. Tussen de groepen zat geen verschil in de hoeveelheid trombo-embolische complicaties, de studiegroepen waren echter te klein om hier definitieve uitspraken over te doen.
NIlsson (2012) heeft een RCT uitgevoerd naar verschillende ACT-streefwaardes bij het gebruik van een mini-cardiopulmonaire bypass. Patiënten werden gerandomiseerd naar een ACT van 250 seconden (interventie groep) of 420 seconden (controlegroep). In de interventie groep waren geen rode bloedceltransfusies nodig, terwijl vier van de 29 patiënten in de controle groep 10 eenheden rode bloedcellen nodig hadden. Één eenheid rode bloedcellen wordt reeds beschouwd als een klinisch relevant verschil. Bovendien was het verblijf op de intensive care korter in de interventie groep, hadden ze minder aanvullende zuurstof nodig, herstelden ze sneller en hadden ze minder pijn.
Karlsson (2020) heeft een RCT verricht naar het gebruik van twee verschillende systemen voor cardiopulmonale bypass met een gesloten systeem in patiënten die zowel ticagrelor als acetylsalicylzuur gebruikten tot <96 uur voor operatie. Bij de ene groep werd een ACT <250 seconden (interventie) aangehouden werd en bij de ander >480 seconden (controlegroep). Bovendien waren er nog andere intraoperatieve verschillen als gevolg van de gekozen systemen. In de interventie groep was minder heparine en protamine nodig. De interventie leidde tot hogere hemoglobine concentraties postoperatief (6,7 mmol/l vs 5,7 mmol/l) en minder erythrocytentransfusies (7% vs 53% van de deelnemers).
Shapira (2014) heeft prospectief een cohort mensen bestudeerd die werden geopereerd met een biocompatibel gesloten systeem zonder cardiotomie reservoir. Hierbij werd een doel-ACT van 250-300 seconden aangehouden. CABG met dit systeem had goede klinische uitkomsten, en had weinig bloedtransfusies nodig. Er zijn geen goede aanbevelingen te doen voor subgroepen patiënten, hoewel bij een gesloten biocompatibel systeem mogelijk lagere ACT-streefwaardes aangehouden kunnen worden. Een complicerende factor is dat bij openhartchirurgie (dus niet bypass-chirurgie) frequent CO2 flooding van het operatieveld wordt toegepast. Dit verhoogt de zuurgraad van het bloed in het cardiotomiereservoir en kan leiden tot stolselvorming in dit reservoir.
Meesters (2016) heeft een RCT verricht naar een lagere protamine-heparine ratio bij operaties met een cardiopulmonaire bypass. Een ratio van 0.8 (laag), en van 1.3 (hoog) werd vergeleken. De primaire uitkomstmaat was bloedverlies. In de lage groep werd minder protamine gegeven, ondanks dat was de ACT na protamine toediening vergelijkbaar tussen beide groepen. Bloedverlies was hoger in de hoge protamine-heparine ratio groep, en ook was daar meer plasmatransfusie nodig.
Er zijn aanwijzingen in vitro die suggereren dat protamine een intrinsiek anticoagulant effect heeft (Chu, 2001; Khan, 2006; Khan, 2010). Dit lijkt ondersteund te worden door de RCT van Meesters (2016), evenals een oudere studie (Berger, 1968).
Geindividualiseerde heparine doses zijn vergeleken met conventionele heparine doseringen. Dit leidde tot gelijke hoeveelheden heparine gebruik, maar minder protamine gebruik (ratio 0.546:1 vs 0.854:1 Een lagere dosis protamine leidt dan weer tot een toename in postoperatief bloedverlies (420 ml versus 345 ml), overigens zonder dat dit tot een toename in transfusies leidt (Hoenicka, 2015). Er is een enquete uitgevoerd in Nederland, waar bleek dat een protamine:heparine ratio van 0,8 tot 1,0:1,0 het meest gebruikt wordt in Nederland. Aanbevolen wordt derhalve om een protamine:heparine ratio van 0.8:1, en niet groter dan 1:1 aan te houden. In een Nederlandse studie werd in een voor-na studie een protamine:heparine ratio van 0.6:1 vergeleken met een ratio van 0.8:1 met betrekking tot postoperatief bloedverlies, bij patienten die een cardiopulmonaire bypass ondergingen. Dit leidde bij ingrepen met een mediaan van 90 minuten tot minder bloedverlies in de groep waarin een ratio van 0.6:1 werd aangehouden (24 ml vs 280 ml), en minder transfusies (Goedhart, 2020).
Er is dus een onderscheid tussen het type ingreep: minisyteem, zonder cardiotomie, compleet systeem, eventueel ook als er CO2 flooding wordt gebruikt, en mogelijk de duur van de ingreep. Dit moet bij de lokale uitvoering meegenomen worden.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het betreft hier geen voorkeursgevoelige beslissing, echter is het wel aan te raden dit in lokale protocollen te beschrijven. De doelen van de heparine en protamine behandeling zijn de veilige antistolling gedurende de tijd dat de patiënt is aangesloten op de hart-long-machine en de veilige normalisatie van de antistolling. Daardoor kan het perioperatief bloedverlies en de noodzaak tot het geven van bloedproducten, of verlengde opnameduur verminderd worden. Patiënten zullen minder bloedverlies en een kortere opnameduur prefereren, dit is het voornaamste doel van de interventie. De belasting van de behandeling zelf maakt niet uit voor de patiënt. Patiënten die eerder protamine hebben gekregen, een vasectomie hebben ondergaan, een zalm-allergie hebben of met insuline behandeld worden hebben een hoger risico op een allergische reactie. Echter, in de praktijk valt dit mee.
Kosten (middelenbeslag)
Verschil in kosten met betrekking tot protamine en heparine zijn tussen beide protocollen nauwelijks verschillend. Hierdoor spelen kosten van medicatie geen rol in de overweging.
Het gebruik van een ACT rond de 420 is gangbaar in Nederland. Zowel heparine als protamine zijn relatief goedkope middelen. Dus ondanks dat het nastreven van een lagere ACT tot minder heparine gebruik zou leiden, evenals het dientengevolge gebruik van een lagere protamine dosis, zal dit niet tot een aanmerkelijke kostenreductie leiden. Het risico op stolsels in de hart-long machine neemt ook navenant toe met een lagere ACT. Eventuele verandering in de kosten zullen voornamelijk volgen uit een reductie in complicaties, nabloedingen, bloedproduct gebruik, en (IC-) opnameduur.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn onvoldoende kwalitatieve studies om harde uitspraken te doen over de aanvaardbaarheid en haalbaarheid van verschillende ACTs tijdens het gebruik van de hart-long-machine. Door dit gebrek aan kwalitatief bewijs is er ruimte voor eigen interpretatie. Er wordt liever te veel heparine gegeven met de zekerheid dat er geen stolsels vormen, dan dat er risico wordt genomen. Bij mini-systemen zou wel een lagere waarde aangehouden kunnen worden. Daarnaast kunnen ook patiënten hun bedenkingen hebben bij de aanbevelingen. Daarom zijn goede studies nodig naar de optimale ontstollingsstrategieën bij het gebruik van de hart-long-machine. Er zullen echter geen morele of ethische bezwaren zijn.
Er worden verschillende apparaten gebruikt in de verschillende ziekenhuizen in Nederland, wat tot regionale verschillen in de optimale antistollingsstrategie zal kunnen leiden. Echter, doordat de optimale ACT assay-specifiek is, zal dit tot dezelfde uitkomsten moeten leiden per centrum. Mits er niet gewisseld wordt van apparatuur, zal dit dus geen effect hebben op de uitkomstmaten. Alle centra waar operaties aan de hart-long-machine uitgevoerd worden beschikken over de benodigde apparatuur.
Mogelijke belemmerende factoren op het gebied van implementatie zijn aanvaardbaarheid, samenwerking en afstemming met andere disciplines/stakeholders binnen en buiten het ziekenhuis en kennisniveau en kunde. Kennisniveau en kunde moet aan gewerkt worden, maar dit is wel oplosbaar aangezien stakeholders goed bereikbaar zijn. Beleidsverandering heeft hoogstwaarschijnlijk weinig draagvlak vanwege het gebrek aan noodzaak en bewijs.
Bij het gebruik van mini-systemen (zonder cardiotomiereservoir) zou een lagere ACT nagestreefd kunnen worden.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
Voor het gebruik van open systemen missen kwalitatieve studies om harde uitspraken te doen over de optimale ACT-waardes. Bovendien is er variatie in de systemen die gebruikt worden om de ACT te meten. In Nederland wordt gestreefd naar een ACT tussen de 400-480 seconden, en dat blijkt veilig. Zonder duidelijk bewijs van de veiligheid van het verlagen van de ACT-streefwaarde lijkt het dus niet verstandig om deze streefwaarde te veranderen.
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventie
Een protamine:heparine ratio van 0,8:1 – 1:1 wordt het meest gebruikt in Nederland. Daar wordt op basis van expert opinion geadviseerd dit aan te houden. Een lage ratio van 0,8:1 blijkt veilig, maar nog lagere ratios leiden tot een toename van bloedverlies.
Onderbouwing
Achtergrond
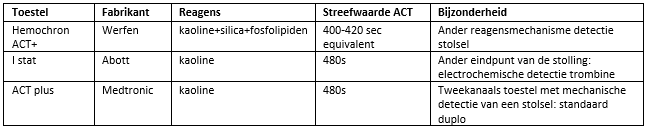
In Nederland worden op dit moment drie verschillende systemen gebruikt voor het meten van de ACT. Onderling verschillen deze systemen en de metingen zijn zeker niet altijd overeenkomend. Per ziekenhuis wordt wel eenzelfde systeem gehanteerd. Er is hierdoor praktijkvariatie wat betreft de streefwaardes die worden gebruikt bij ACT in Nederland. Een uitgevoerde enquête heeft aangetoond dat men normaal gesproken streeft naar ACT waarden 400 en 480 seconden. Met de nieuwe systemen is een waarde van 420 wellicht te streng en zou een waarde 350 acceptabel kunnen zijn.
Onderstaande tabel geeft een overzicht van de gebruikte apparatuur met de aanbevolen ACT. Gezien de historische aard van een ACT van 480 sec (uit de tijd van niet heparine of equivalent gecoate systemen en zelfs nog bubble oxygenatoren) is er een trend om lagere ACT’s na te streven. Met name bij het toepassen van extracorporele systmen zonder cardiotomiereservoir (dus zonder stase van het bloed) zouden lagere ACT’s geaccepteerd kunnen worden. De achterliggende gedachte is dat bij minder heparine gebruik ook minder protamine nodig is en zo minder inbreuk wordt gedaan op de toch al kwetsbare hemostase bij cardiochirurgische patiënten. Veiligheid wordt daarbij meestal gedefinieerd als zichtbare stolsels in het cardiotomiereservoir. Een complicerende factor is dat bij openhartchirurgie (dus niet bypass-chirurgie) frequent CO2 flooding van het operatieveld wordt toegepast. Dit verhoogt de zuurgraad van het bloed in het cardiotomiereservoir en kan leiden tot stolselvorming in dit reservoir (Gorter, 2017). Mogelijk moet er dus ook gedifferentieerd worden naar type ingreep.
Conclusies / Summary of Findings
|
No GRADE |
No evidence was found regarding the effect of low target value on all outcome measures when compared with high target value in adults undergoing cardiac surgery on heart-lung machine.
Source: - |
Samenvatting literatuur
Description of studies
No studies were included in the analysis of the literature.
Results
No results were found regarding the outcome measures mortality, blood product consumption, blood clots in patients, blood clots in heart-lung machine, postoperative blood loss, and re-thoracotomy.
Level of evidence of the literature
The level of evidence regarding the outcome measures mortality, blood product consumption, blood clots in patients, blood clots in heart-lung machine, postoperative blood loss, and re-thoracotomy could not be graded, as no studies were included in the analysis of the literature.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of using low ACT target values versus high ACT target values in adult patients undergoing cardiac surgery on heart-lung machine?
| P: | adult patients undergoing cardiac surgery on heart-lung machine |
| I: | low ACT target value (250s/350s) |
| C: | high ACT target value (440s) |
| O: | mortality, blood product consumption, blood clots in patients, blood clots in heart-lung machine, postoperative blood loss, re-thoracotomy |
Relevant outcome measures
The guideline development group considered blood product consumption as a critical outcome measure for decision making; and mortality, blood clots in patients, blood clots in heart-lung machine, postoperative blood loss, and re-thoracotomy as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically (patient) important differences:
-
Mortality: 10% (RR < 0.9 and RR > 1.1)
-
Adverse events: 25% (RR < 0.8 and RR > 1.25)
-
Postoperative blood loss: 250 cc
-
Blood product consumption: 1 product
-
Blood clots in patients: 25% (RR <0.8 and RR >1.25)
-
Blood clots in heart-lung machine: 25% (RR <0.8 and RR >1.25)
-
Re-thoracotomy: 25% (RR <0.8 and RR >1.25)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 06-12-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 520 hits. Studies were selected based on the following criteria systematic reviews, RCT’s or observational studies comparing low target values versus high target values in patients undergoing cardiac surgery on heart-lung machine. In total, 26 studies were initially selected based on title and abstract screening. After reading the full text, 26 studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included.
Results
No studies were included in the analysis of the literature.
Referenties
- Chu AJ, Wang ZG, Raicu M, et al. Protamine inhibits tissue factor-initiated extrinsic coagulation. Br J Haematol 2001; 115: 392399
- Goedhart ALM, Gerritse BM, Rettig TCD, van Geldorp MWA, Bramer S, van der Meer NJM, Boonman-de Winter LJ, Scohy TV. A 0.6-protamine/heparin ratio in cardiac surgery is associated with decreased transfusion of blood products. Interact Cardiovasc Thorac Surg. 2020 Sep 1;31(3):391-397. doi: 10.1093/icvts/ivaa109. PMID: 32620960.
- Gorter KA, Stehouwer MC, Van Putte BP, Vlot EA, Urbanus RT. Acidosis induced by carbon dioxide insufflation decreases heparin potency: a risk factor for thrombus formation. Perfusion. 2017 Apr;32(3):214-219. doi: 10.1177/0267659116677307. Epub 2016 Oct 27. PMID: 27789847.
- Karlsson 2020: Karlsson M, Hannuksela M, Appelblad M, Hällgren O, Johagen D, Wahba A, Svenmarker S. Cardiopulmonary bypass and dual antiplatelet therapy: a strategy to minimise transfusions and blood loss. Perfusion. 2020 Apr;35(3):236-245. doi: 10.1177/0267659119867005. Epub 2019 Aug 24. PMID: 31446845.
- Khan NU, Wayne CK, Barker J, et al. The effects of protamine overdose on coagulation parameters as measured by the thrombelastograph. Eur J Anaesthesiol 2010; 27: 624 627;
- Nielsen VG. Protamine enhances fibrinolysis by decreasing clot strength: role of tissue factor-initiated thrombin generation. Ann Thorac Surg 2006; 81: 17201727
- Nilsson 2012: Nilsson J, Scicluna S, Malmkvist G, Pierre L, Algotsson L, Paulsson P, Bjursten H, Johnsson P. A randomized study of coronary artery bypass surgery performed with the Resting Heart System utilizing a low vs a standard dosage of heparin. Interact Cardiovasc Thorac Surg. 2012 Nov;15(5):834-9. doi: 10.1093/icvts/ivs345. Epub 2012 Aug 21. PMID: 22914806; PMCID: PMC3480612.
- Shapira OM, Korach A, Pinaud F, Dabah A, Bao Y, Corbeau JJ, de Brux JL, Baufreton C. Safety and efficacy of biocompatible perfusion strategy in a contemporary series of patients undergoing coronary artery bypass grafting - a two-center study. J Cardiothorac Surg. 2014 Dec 18;9:196. doi: 10.1186/s13019-014-0196-3. PMID: 25519179; PMCID: PMC4274677.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Andrews J, Winkler AM. Challenges with Navigating the Precarious Hemostatic Balance during Extracorporeal Life Support: Implications for Coagulation and Transfusion Management. Transfus Med Rev. 2016 Oct;30(4):223-9. doi: 10.1016/j.tmrv.2016.07.005. Epub 2016 Aug 4. PMID: 27543261. |
Not conform PICO: no comparison
|
|
Bauer A, Hausmann H, Schaarschmidt J, Szlapka M, Scharpenberg M, Eberle T, Hasenkam JM. Is 300 Seconds ACT Safe and Efficient during MiECC Procedures? Thorac Cardiovasc Surg. 2019 Apr;67(3):191-202. doi: 10.1055/s-0037-1609019. Epub 2017 Dec 31. PMID: 29290078. |
Not conform PICO: wrong population (cardiac surgery with MiECC system) |
|
Carter KT, Kutcher ME, Shake JG, Panos AL, Cochran RP, Creswell LL, Copeland H. Heparin-Sparing Anticoagulation Strategies Are Viable Options for Patients on Veno-Venous ECMO. J Surg Res. 2019 Nov;243:399-409. doi: 10.1016/j.jss.2019.05.050. Epub 2019 Jul 2. PMID: 31277018. |
Not conform PICO: wrong population (VV-ECMO), wrong comparison (full heparin vs heparin-sparing)
|
|
Golmohammadi, M., Saeidi, M., & Khalkhali, H. R. (2015). mpact of Low-Dose Heparin on Accurate Anticoagulation during Cardiopulmonary Bypass and Postoperative Blood Loss in Cardiac Surgery. Iranian Heart Journal, 16(3), 11-15. |
Not conform PICO: wrong comparison (different doses of heparin)
|
|
Haider, A., Yunus, A., & BANNA, H. U. (2015). Impact of Activated Clotting Time on Post Cardiopulmonary Bypass Blood Loss. PAKISTAN JOURNAL OF MEDICAL & HEALTH SCIENCES, 9(4), 1114-1119. |
Not conform PICO: wrong comparison (ACT <550 vs >550 to 999) |
|
Hong JI, Hwang J, Shin HJ. Satisfactory outcome with low activated clotting time in extracorporeal membrane oxygenation. Rev Cardiovasc Med. 2021 Dec 22;22(4):1589-1594. doi: 10.31083/j.rcm2204164. PMID: 34957799. |
Not conform PICO: wrong population (ECMO), wrong comparison (ACT <150 vs >150) |
|
Jiritano F, Fina D, Lorusso R, Ten Cate H, Kowalewski M, Matteucci M, Serra R, Mastroroberto P, Serraino GF. Systematic review and meta-analysis of the clinical effectiveness of point-of-care testing for anticoagulation management during ECMO. J Clin Anesth. 2021 Oct;73:110330. doi: 10.1016/j.jclinane.2021.110330. Epub 2021 May 4. PMID: 33962338. |
Not conform PICO: wrong population (ECMO for respiratory or cardiac failure), wrong comparison (Point of Care testing vs control)
|
|
Judd M, Strauss ER, Hasan S, Abuelkasem E, Li J, Deshpande S, Mazzeffi MA, Ogawa S, Tanaka KA. Clotting Time Results Are Not Interchangeable Between EXTEM and FIBTEM on Rotational Thromboelastometry. J Cardiothorac Vasc Anesth. 2020 Jun;34(6):1467-1473. doi: 10.1053/j.jvca.2019.12.030. Epub 2019 Dec 23. PMID: 32139339. |
Wrong study design: niet-vergelijkend onderzoek (before-after)
|
|
Karlsson M, Hannuksela M, Appelblad M, Hällgren O, Johagen D, Wahba A, Svenmarker S. Cardiopulmonary bypass and dual antiplatelet therapy: a strategy to minimise transfusions and blood loss. Perfusion. 2020 Apr;35(3):236-245. doi: 10.1177/0267659119867005. Epub 2019 Aug 24. PMID: 31446845. |
Not conform PICO: wrong comparison (closed cortiva heparin-coated circuit with low systemic heparinization vs balance coated open circuit with full systemic heparinization) |
|
Lax M, Pesonen E, Hiippala S, Schramko A, Lassila R, Raivio P. Heparin Dose and Point-of-Care Measurements of Hemostasis in Cardiac Surgery-Results of a Randomized Controlled Trial. J Cardiothorac Vasc Anesth. 2020 Sep;34(9):2362-2368. doi: 10.1053/j.jvca.2019.12.050. Epub 2020 Jan 7. PMID: 32127275. |
Not conform PICO: wrong comparison (ACT >400 vs >600) |
|
Ma HP, Fu M, Masula M, Xing CS, Zhou Q, Tan JT, Wang J. miR-3064-5p and miR-4745-5p affect heparin sensitivity in patients undergoing cardiac surgery by regulating AT-III and factor X mRNA levels. Front Physiol. 2022 Aug 12;13:914333. doi: 10.3389/fphys.2022.914333. PMID: 36035472; PMCID: PMC9412912. |
Not conform PICO: wrong comparison (ACT <480 vs 480-760 vs >760) |
|
Ma HP, Xu WF, Yu J, Wang J, Zheng H. Heparin sensitivity and postoperative blood loss in patients undergoing cardiac surgery with cardiopulmonary bypass. Eur J Anaesthesiol. 2020 Mar;37(3):162-169. doi: 10.1097/EJA.0000000000001148. PMID: 31895135. |
Not conform PICO: wrong comparison (ACT <480 vs 480-750 vs >750) |
|
Mahmood S, Bilal H, Zaman M, Tang A. Is a fully heparin-bonded cardiopulmonary bypass circuit superior to a standard cardiopulmonary bypass circuit? Interact Cardiovasc Thorac Surg. 2012 Apr;14(4):406-14. doi: 10.1093/icvts/ivr124. Epub 2012 Jan 6. PMID: 22228288; PMCID: PMC3309813. |
Wrong study design: literature review (not systematic), Not conform PICO: no comparison
|
|
Matsushita S, Kishida A, Wakamatsu Y, Mukaida H, Yokokawa H, Yamamoto T, Amano A. Factors influencing activated clotting time following heparin administration for the initiation of cardiopulmonary bypass. Gen Thorac Cardiovasc Surg. 2021 Jan;69(1):38-43. doi: 10.1007/s11748-020-01435-x. Epub 2020 Jul 12. PMID: 32656705. |
Comparison: reach ACT >450s vs short ACT <450s, wrong outcomes
|
|
Nilsson J, Scicluna S, Malmkvist G, Pierre L, Algotsson L, Paulsson P, Bjursten H, Johnsson P. A randomized study of coronary artery bypass surgery performed with the Resting Heart™ System utilizing a low vs a standard dosage of heparin. Interact Cardiovasc Thorac Surg. 2012 Nov;15(5):834-9. doi: 10.1093/icvts/ivs345. Epub 2012 Aug 21. PMID: 22914806; PMCID: PMC3480612. |
Not conform PICO: wrong comparison (low dose heparin (target ACT 250s) vs control dose heparin (target ACT >420s)) |
|
Palmer K, Ridgway T, Al-Rawi O, Poullis M. Heparin therapy during extracorporeal circulation: deriving an optimal activated clotting time during cardiopulmonary bypass for isolated coronary artery bypass grafting. J Extra Corpor Technol. 2012 Sep;44(3):145-50. PMID: 23198395; PMCID: PMC4557526. |
Not conform PICO: no comparison
|
|
Raman J, Alimohamed M, Dobrilovic N, Lateef O, Aziz S. A comparison of low and standard anti-coagulation regimens in extracorporeal membrane oxygenation. J Heart Lung Transplant. 2019 Apr;38(4):433-439. doi: 10.1016/j.healun.2019.01.1313. Epub 2019 Jan 31. PMID: 30744940. |
Not conform PICO: wrong population (VA ECMO), comparison (ACT 180-220 vs low heparin)
|
|
Rochon AG, Bélisle S, Couture P, Fortier A, Lebon JS, Deschamps A. In Vivo Protamine Titration Using Activated Coagulation Time to Neutralize Heparin Anticoagulation in Cardiac Surgery: Proof of Concept. J Cardiothorac Vasc Anesth. 2020 Sep;34(9):2369-2374. doi: 10.1053/j.jvca.2019.12.046. Epub 2020 Jan 7. PMID: 32014311. |
Not conform PICO: wrong comparison (fixed heparin/protamine ratio vs in vivo protamine titration)
|
|
Rosin MW, Holt D. Heparin dose and postoperative bleeding in patients undergoing cardiopulmonary bypass. J Extra Corpor Technol. 2013 Dec;45(4):228-34. PMID: 24649570; PMCID: PMC4557495. |
Not conform PICO: wrong comparison (based on HDR slope)
|
|
Runge M, Møller CH, Steinbrüchel DA. Increased accuracy in heparin and protamine administration decreases bleeding: a pilot study. J Extra Corpor Technol. 2009 Mar;41(1):10-4. PMID: 19361026; PMCID: PMC4680217. |
Not conform PICO: wrong comparison (Hemochron RxDx vs weight based heparin dose)
|
|
Sniecinski RM, Levy JH. Anticoagulation management associated with extracorporeal circulation. Best Pract Res Clin Anaesthesiol. 2015 Jun;29(2):189-202. doi: 10.1016/j.bpa.2015.03.005. Epub 2015 Mar 31. PMID: 26060030. |
Not conform PICO: no comparison
|
|
Sy E, Sklar MC, Lequier L, Fan E, Kanji HD. Anticoagulation practices and the prevalence of major bleeding, thromboembolic events, and mortality in venoarterial extracorporeal membrane oxygenation: A systematic review and meta-analysis. J Crit Care. 2017 Jun;39:87-96. doi: 10.1016/j.jcrc.2017.02.014. Epub 2017 Feb 12. PMID: 28237895. |
Not conform PICO: wrong population: VA-ECMO, wrong comparison
|
|
Vonk AB, Veerhoek D, van den Brom CE, van Barneveld LJ, Boer C. Individualized heparin and protamine management improves rotational thromboelastometric parameters and postoperative hemostasis in valve surgery. J Cardiothorac Vasc Anesth. 2014 Apr;28(2):235-41. doi: 10.1053/j.jvca.2013.09.007. Epub 2013 Dec 15. PMID: 24342152. |
Not conform PICO: wrong comparison (ACT group vs HepCon Hemostasis Management System group)
|
|
Yie K, Chon SH, Na CY. Activated clotting time test alone is inadequate to optimize therapeutic heparin dosage adjustment during post-cardiopulmonary resuscitational extracorporeal membrane oxygenation (e-CPR). Perfusion. 2016 May;31(4):307-15. doi: 10.1177/0267659115604710. Epub 2015 Sep 9. PMID: 26354740. |
Not conform PICO: wrong outcomes, groups not initially divided by ACT
|
|
Zghaibe W, Scheuermann S, Munting K, Blaudszun G, Besser M, Ortmann E, Klein AA. Clinical utility of the Quantra® point-of-care haemostasis analyser during urgent cardiac surgery. Anaesthesia. 2020 Mar;75(3):366-373. doi: 10.1111/anae.14942. Epub 2019 Dec 17. PMID: 31845321. |
Not conform PICO: wrong comparison (Quantra system vs TEG and standard laboratory testing) |
|
Zhang Y, Liu K, Li W, Xue Q, Hong J, Xu J, Wu L, Ji G, Sheng J, Wang Z. An Adjusted Calculation Model of Reduced Heparin Doses in Cardiopulmonary Bypass Surgery in a Chinese Population. J Cardiothorac Vasc Anesth. 2016 Oct;30(5):1179-83. doi: 10.1053/j.jvca.2016.04.005. Epub 2016 Apr 12. PMID: 27475733. |
Not conform PICO: wrong comparison (traditional regimen heparin dose 300 U vs adjusted regimen)
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-07-2024
Beoordeeld op geldigheid : 05-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan.
Werkgroep
- Dr. M. (Maarten) ter Horst (voorzitter), NVA, anesthesioloog, Erasmus MC
- Drs. J.M.A.A. (Joost) van der Maaten, NVA, anesthesioloog, UMC Groningen
- Dr. A.B.A. (Alexander) Vonk, NVT, cardiothoracaal Chirurg, Amsterdam UMC
- Drs. E.J. (Edgar) Daeter, NVT, cardiothoracaal chirurg, St. Antonius Ziekenhuis
- Dr. R.I. (Rick) Meijer, NIV/NVIVG, internist, Radboud UMC
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, NIV, internist, HagaZiekenhuis
- Dr. A.J.G. (Gerard) Jansen, NIV, internist, Erasmus MC
- Prof. dr. A.P.J. (Alexander) Vlaar, NVIC, intensivist, Amsterdam UMC
- Prof. dr. ir. Y.M.C. (Yvonne) Henskens, NVKC, laboratoriumspecialist klinische chemie, Maastricht UMC
- Dr. N.R. (Nick) Bijsterveld, NVVC, cardioloog, Amsterdam UMC
- Dr. N. (Nienke) van Rein, NVZA, ziekenhuisapotheker, Leiden UMC
- I.G.J. (Ilse) Verstraaten, MSc, beleidsmedewerker Harteraad
Klankbordgroep
- Drs. K. (Karin) Gorter, NeSECC, klinisch perfusionist, UMC Utrecht
- Drs. A.R. (Arnold) van Oostrum, NeSECC, klinisch perfusionist, OLVG
- Dr. A.J. (Sander) Spanjersberg, NVA, cardioanesthesioloog, Isala Zwolle
- Dr. P.A.W. (Peter) te Boekhorst, NIV, internist, Erasmus Medisch Centrum
Met ondersteuning van
- Dr. R. (Romy) Zwarts-van de Putte, adviseur Kennisinstituut
- Drs. E.R.L. (Evie) Verweg, junior adviseur Kennisinstituut
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
ter Horst |
Anesthesioloog (Erasmus MC) |
Bestuurslid sectie cardio-anesthesiologie niet betaald Lid van de Landelijke gebruikersraad van Sanquin namens de NVA niet betaald Lid Leidraad EHH, CCU, ICCU gecoördineerd door kennisinstituut niet betaald lid EACTAIC subcommissie TEE niet betaald |
- Presentatie over eigen onderzoek CLS-Behring over ROTEM (verkoop fibrinogeen) (betaling aan het ziekenhuis, betaling voor tijd), hebben geen invloed op wat er verteld wordt. - Verricht onderzoek naar vermindering van bloedproducten verbruik bij cardiochirurgie: recent artikel over dit onderwerp gepubliceerd. Als er intellectueel belang is dan is dit minimaal. |
Volgens de werkgroep geen restrictie nodig. De betaling van de presentatie is puur voor de tijd die erin wordt gestoken, de financier heeft geen invloed op de inhoud van de presentatie. |
|
van der Maaten |
Anesthesioloog (UMCG) |
Lid RvT Nederlandse Hart Registratie (NHR) |
Geen |
Geen restrictie |
|
Vonk |
Cardiothoracaal Chirurg (AUMC Amsterdam) |
Geen |
Geen |
Geen restrictie |
|
Daeter |
Cardiothoracaal Chirurg (St. Antonius ziekenhuis Nieuwegein) |
Medisch manager eenheid hart antonius ziekenhuis |
Geen |
Geen restrictie |
|
Meijer |
Internist (Radboudumc) |
Geen |
Geen |
Geen restrictie |
|
Kerkhoffs |
Internist-hematoloog (HagaZiekenhuis Den Haag) |
Transfusie Specialist/senior onderzoeker, Sanquin Amsterdam, Research en transfusie consulten FTE 0.2 (onderzoek over bloedplaatjes, verder geen directe link met richtlijn). |
Geen |
Geen restrictie |
|
Jansen |
Internist-hematoloog (Erasmus MC) |
Wetenschappelijk voorzitter NVB |
Research funding: Principia, Argenx, CSL Behring, Sobi, EHA Research Fellowship (PI): personal fellowship for research. - Consultancy: Novartis, Amgen. Paid |
Geen restrictie. De onderzoeken hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld.
|
|
Vlaar |
Intensivist (Amsterdam- UMC) |
Lid Medische adviesraad Sanquin |
PI van PACER trial (ZonMw gefinancierd) Werfen in kind sponsoring CSL Behring studie grant en consultancy LSBR Fellowship op het gebied van TACO VIDI op gebied van TRALI |
Geen restrictie. De farma gesponsorde studies hebben geen betrekking op de modules uit de opgestelde richtlijn. |
|
Henskens |
Klinisch chemicus en waarnemend hoofd Centraal diagnostisch Laboratorium (CDL) Maastricht UMC+, Hoogleraar Klinische Chemie, in het bijzonder hemostase. 0.9 fte (CDL, MUMC+), 0.1 fte Universiteit Maastricht, FHML (faculty of Health, Medicine and Life Sciences). |
VHL Vereniging hematologische laboratoria, voorzitter (onbetaald); Landelijke en regionale gebruikersraad Sanquin (onbetaald), TVB Tijd voor verbinding antistollingszorg Expert team, namens NFU (vacatiegelden), Richtlijn antithrombotisch beleid, op afroep namens NVKC (vacatiegelden), voorzitter concilium NVKC (vacatiegelden), Lid Raad Opleidng FMS (onbetaald). |
Projectleider van de studie: Laboratory Predictors of hemostasis and thrombosis. Financier Siemens, Stago, Roche, Werfen, Nodia (korting of gratis reagentia of apparatuur te leen van bovenstaande bedrijven, zij financieren geen studies). |
Exclusie besluitvorming aanbevelingen module over POC testfacilieit aangezien het extern gefinancierde onderzoek mogelijk tot belangenverstrengeling leidt. Het werkgroeplid heeft geen band met één specifieke firma, alle testen worden onderzocht.
|
|
Bijsterveld |
Cardioloog (Amsterdam UMC) |
Voorzitter NVVC werkgroep Cardiologie en Sport (onbetaald) |
Geen |
Geen restrictie |
|
van Rein |
Ziekenhuisapotheker, Klinische Farmacie en Toxicologie, LUMC. 0.83 FTE. Inkopen en logistiek geneesmiddelen, directe patientenzorg, trials, onderwijs. Assistant progessor, Klinische Epidemiologie, LUMC, 0.17 FTE. Begeleiden promovendi, beurzen schrijven, onderwijs. |
Richtlijn antitrombotisch beleid |
Extern gefinancierd onderzoek (geen projectleider) – ZonMw GGG: Distinct onderzoek: optimaliseren tromboseprophylaxe na orthopedische ingrepen + L-TRRiP studie: optimaliseren trombosebehandeling na eerste veneuze trombose. Ook extern gefinancierd onderzoek vanuit de Trombosestichting: balans bloedingen en trombose optimaliseren dmv proteomics, wel projectleider.
Daarnaast ook verantwoordelijk voor alle geneesmiddelen studies die lopen in het LUMC en het CHDR, maar neem daar niet zelf actief aan deel. |
Geen restrictie, de trials hebben geen overlap met de onderwerpen die in de richtlijn worden behandeld. |
|
Verstraaten |
Beleidsadviseur Harteraad |
Geen |
Geen |
Geen restrictie |
|
Gorter |
Klinisch perfusionist, Heartbeat Dutch Perfusion Service, UMCU |
Geen |
Projectleider van onderzoek verschillende ACT targets tijdens CPB. Financier medtronic. |
Geen restrictie, Gorter is onderdeel van de klankbordgroep en niet actief betrokken bij het formuleren van de aanbevelingen met betrekking tot ACT targets. |
|
van Oostrum |
Klinisch Perfusionist MCL (betaald) |
Voorzitter NeSECC (onbetaald) |
Praktijkvoordeel omdat ik werkzaam ben als klinisch perfusionist, en we hier in de praktijk op de OK baat bij kunnen hebben. |
Geen restrictie |
|
Spanjersberg |
Isala, MSB |
Geen |
Voordracht fibrinogeen in hartchirurgie (sponsor CSL) |
Geen restrictie |
|
te Boekhorst |
Internist-Hematoloog / transfusiespecialist, Erasmus MC |
Voorzitter stichting TRIP |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door benoem gebruikte methode: uitnodigen van de patiëntenvereniging Harteraad voor de invitational conference en een afgevaardigde van de patiëntenvereniging Harteraad in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Heparine en protamine |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepassbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg rondom perioperatief bloed- en (anti)stollingsmanagement voor patiënten die cardiochirurgie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging voor Cardiologie (NVvC), Nederlandse Vereniging voor Intensive Care (NVIC), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskund (NVKC), Harteraad, Inspectie Gezondheidszorg en Jeugd (IGJ), Vereniging Innovatieve Geneesmiddelen (VIG), en de Nederlandse Vereniging voor Anesthesiologiemedewerkers (NVAM) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Kennisvragen
De kennislacunes per module staan onder ‘Bijlagen’ en dan ‘Onderzoek’.
Inleiding
Tijdens de ontwikkeling van de richtlijn peri-operatief bloed en (anti)stollingsmanagement is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based richtlijn ontwikkeling (EBRO) is duidelijk geworden dat er nog kennisvragen bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk.
Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: Perioperatief bloed- en (anti)stollingsmanagement voor cardiochirurgie in Nederland |
|
|
Uitgangsvraag: Module 4 Welke streefwaarde ACT dient gebruikt te worden voordat iemand op de hart-long machine kan worden aangesloten? |
|
|
Database(s): Ovid/Medline, Embase |
Datum:6-12-2022 |
|
Periode: 2010- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: Extracorporeal circulation EN anticoagulants EN (ACT of blood clotting time) Momenteel is gezocht vanaf 2010. Wanneer geen voldoende bewijs wordt gevonden, kan worden overwogen om verder terug te zoeken. Van de vier sleutelartikelen wordt het artikel van Beuafreton niet gevonden omdat het ouder is dan 2010. Baufreton C, de Brux JL, Binuani P, Corbeau JJ, Subayi JB, Daniel JC, Treanor P. A combined approach for improving cardiopulmonary bypass in coronary artery surgery: a pilot study. Perfusion. 2002 Nov;17(6):407-13. doi: 10.1191/0267659102pf615oa. PMID: 12470029.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 6-12-2022 met relevante zoektermen gezocht vanaf 2010 naar systematische reviews, RCTs en observationele studies over ACT waarden bij patiënten die aangesloten worden op een hart long machine. De literatuurzoekactie leverde 520 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
19 |
22 |
33 |
|
RCTs |
83 |
86 |
133 |
|
Observationele studies |
212 |
234 |
354 |
|
Overig |
|
|
|
|
Totaal |
|
|
520 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#21 |
#19 NOT #18 NOT #17 OBS |
212 |
|
#20 |
#18 NOT #17 RCT |
83 |
|
#19 |
#12 AND (#15 OR #16) |
298 |
|
#18 |
#12 AND #14 |
87 |
|
#17 |
#12 AND #13 SR |
19 |
|
#16 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13668006 |
|
#15 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#14 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#13 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#12 |
#9 AND #11 |
566 |
|
#11 |
'blood clotting time'/exp OR act:ti,ab,kw OR (((clot* OR coagulat*) NEAR/3 time):ti,ab,kw) |
405972 |
|
#10 |
#5 AND #9 |
3 |
|
#9 |
#8 AND [1-1-2010]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
4260 |
|
#8 |
#6 AND #7 |
11379 |
|
#7 |
'heparin'/exp OR 'anticoagulant agent'/exp OR 'heparin derivative'/exp OR heparin:ti,ab,kw OR 'hemochron'/exp OR hepcon:ti,ab,kw OR 'i-stat act':ti,ab,kw OR rotem*:ti,ab,kw OR anticoagulant*:ti,ab,kw |
827976 |
|
#6 |
'extracorporeal circulation'/exp OR 'cardiopulmonary bypass'/exp OR 'atriopulmonary shunt':ti,ab,kw OR 'cardiopulmonary bypass':ti,ab,kw OR 'cardiopulmonary shunt':ti,ab,kw OR 'heart lung bypass':ti,ab,kw OR 'cardio pulmonary bypass':ti,ab,kw |
91034 |
|
#5 |
#1 OR #2 OR #3 OR #4 |
4 |
|
#4 |
'a combined approach for improving cardiopulmonary bypass in coronary artery surgery: a pilot study' |
1 |
|
#3 |
'will high-dose heparin affect blood loss and inflammatory response in patients undergoing cardiopulmonary bypass' |
1 |
|
#2 |
'heparin dose and point-of-care measurements of hemostasis in cardiac surgery-results of a randomized controlled trial' |
1 |
|
#1 |
'cardiopulmonary bypass and dual antiplatelet therapy: a strategy to minimise transfusions and blood loss' |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
15 |
13 not 12 not 11 OBS |
234 |
|
14 |
12 not 11 RCT |
86 |
|
13 |
6 and (9 or 10) |
316 |
|
12 |
6 and 8 |
91 |
|
11 |
6 and 7 SR |
22 |
|
10 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5304815 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4309184 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1567553 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
634320 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
552 |
|
5 |
limit 4 to yr="2010 -Current" |
610 |
|
4 |
1 and 2 and 3 |
1668 |
|
3 |
exp Blood Coagulation/ or act.ti,ab,kf. or ((clot* or coagulat*) adj3 time).ti,ab,kf. |
385216 |
|
2 |
exp Anticoagulants/ or heparin.ti,ab,kf. or hepcon.ti,ab,kf. or 'i-stat act'.ti,ab,kf. or rotem*.ti,ab,kf. or anticoagulant*.ti,ab,kf. |
297830 |
|
1 |
exp Extracorporeal Circulation/ or coronary bypass*.ti,ab,kf. or extracoperal circulat*.ti,ab,kf. or atriopulmonary shunt.ti,ab,kf. or cardiopulmonary bypass.ti,ab,kf. or cardiopulmonary shunt.ti,ab,kf. or heart lung bypass.ti,ab,kf. or cardio pulmonary bypass.ti,ab,kf. |
116072 |