Antivirale middelen bij behandeling van een perifere aangezichtsverlamming
Uitgangsvraag
Wat is de toegevoegde waarde van een behandeling met antivirale middelen naast corticosteroïden binnen de behandeling van patiënten met een perifere aangezichtsverlamming?
Aanbeveling
Overweeg in overleg met de patiënt het gebruik van antivirale middelen als toevoeging op een behandeling met corticosteroïden bij patiënten met een idiopathische perifere aangezichtsverlamming.
Behandel bij patiënten met een perifere aangezichtsverlamming ten gevolge van Herpes Zoster (Ramsey Hunt), standaard met een combinatie van corticosteroïden en antivirale therapie.
De aanbevolen dosering voor antivirale medicatie is, het liefst binnen 72 uur, starten met 3 maal daags 1000 mg valaciclovir oraal (voorkeur) of aciclovir 5 maal daags 800 mg oraal gedurende 7 dagen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek uitgevoerd naar de voor- en nadelen van behandeling met een combinatie van antivirale middelen en corticosteroïden, vergeleken met corticosteroïden alleen bij patiënten met perifere aangezichtsverlamming. Herstel van functie werd gedefinieerd als cruciale uitkomstmaat en bijwerkingen werden gedefinieerd als belangrijke uitkomstmaat.
De 15 gevonden trials suggereren dat een behandeling met een combinatie van antivirale middelen en corticosteroïden mogelijk een verlaagd risico geeft op incompleet herstel bij patiënten met een perifere aangezichtsverlamming (Relatief Risico RR: 0.52, 95% Betrouwbaarheidsinterval BI: 0.37 tot 0.72). Er bestaat echter onzekerheid rond dit gevonden effect, aangezien niet alle studies een effect in het voordeel van behandeling met antivirale therapie laten zien (inconsistentie). Daarnaast zijn er ook beperkingen in de studieopzet, waaronder een gebrek aan blindering en onduidelijk randomisatie procedures, waardoor er het risico op bias is.
Voor de belangrijke uitkomstmaat bijwerkingen werd slechts bewijs met een zeer lage bewijskracht gevonden waardoor het onduidelijk is of behandeling met een combinatie van antivirale middelen en corticosteroïden leidt tot meer, of minder bijwerkingen. In de praktijk heeft de werkgroep nauwelijks tot geen bijwerkingen gezien die het gebruik van antivirale middelen belemmeren bij patiënten met een perifere aangezichtsverlamming. Algemene bijwerkingen die kunnen optreden zijn misselijkheid, braken, diarree, buikpijn, hoofdpijn en koorts (zie ook het farmacotherapeutisch kompas). Ook kunnen neurologische symptomen optreden, met name bij ouderen en een verminderde nierfunctie. Pas de dosering van aciclovir en valaciclovir aan bij een verlaagde nierfunctie.
Twee trials die geïncludeerd zijn in het review van Gagyor (2019) rapporteerden de lange termijn uitkomsten synkinesieën en krokodillentranen. Het poolen van deze resultaten (n = 469) laat zien dat het risico op synkinesieën en krokodillentranen lager is bij patiënten die met antivirale middelen zijn behandeld (RR 0.56, 95% BI 0.36 tot 0.87). Het toevoegen van antivirale middelen aan de behandeling van perifere aangezichtsverlamming, heeft dus ook op de lange termijn mogelijk voordelen.
Het review van Gagyor (2019) concludeert dat er geen duidelijk verschil is in incompleet herstel tussen behandeling met antivirale middelen en behandeling met corticosteroïden alleen. Het gevonden relatieve risico van 0.54 (95% BI: 0.38 tot 0.77) dat gerapporteerd wordt in dit review suggereert echter wel dat er een klinisch relevant en statistisch significant effect is.
In de geïncludeerde studies werd er gemiddeld tien dagen met corticosteroïden (prednison) behandeld. In de geïncludeerde studies werd aciclovir, valaciclovir of famciclovir gebruikt als antivirale therapie, er werd tussen de 5 en 10 dagen behandeld. Dit sluit aan bij de Nederlandse praktijk. Gezien het milde bijwerkingsprofiel en de mogelijkheid van zoster sine herpete heeft de commissie gekozen voor 3dd 1000 mg valaciclovir (voorkeur i.v.m. betere orale beschikbaarheid) of als alternatief aciclovir 5dd 800 mg oraal gedurende 7 dagen, als er gekozen wordt voor antivirale middelen. Bij verminderde nierfunctie dienen de doseringen te worden aangepast, zie hiervoor het farmacotherapeutisch kompas of swabid.nl
In Nederland wordt niet standaard met antivirale middelen behandeld, echter in meerdere klinieken wordt antivirale therapie wel toegevoegd aan corticosteroïd behandeling indien het een perifere aangezichtsverlamming betreft met een House-Brackmann (HB) score van 5 of hoger. De literatuur laat dit onderscheid echter niet zien en suggereert ook een effect bij patiënten met een HB-score lager dan 5. Dit sluit aan bij de Amerikaanse Richtlijn Bell’s Palsy, waarin het onderscheid tussen de verschillende HB-scores niet wordt gemaakt. In deze richtlijn wordt een behandeling met een combinatie van steroïden en antivirale therapie als optioneel beschreven, ongeacht de graad van de parese (Baugh, 2013). Er zijn echter ook internationale richtlijnen die behandeling met antivirale therapie wel pas aanbevelen bij ernstigere vormen van perifere aangezichtsverlamming (Franse richtlijn bij severe cases, Fieux, 2020; Canadese richtlijn bij mild to moderate cases, Almeida, 2014).
In het geval van een perifere aangezichtsverlamming volgens Ramsey Hunt (met blaasjes rond de gehoorgang en/of oorschelp) is het, zeker indien de therapie binnen 72h na start van de symptomen gestart kan worden, raadzaam om sowieso antivirale middelen toe te voegen, omdat dit een uiting is van een Varicella Zoster Virus infectie van de nervus facialis.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Over het algemeen wil de patiënt er alles aan doen om zo snel mogelijk van de klachten (een scheef gezicht) af te komen. Voor de patiënt zal het over het algemeen niet uitmaken of die één of twee middelen in moet nemen. Gezien de lage kwaliteit van het bewijs zal er echter in overleg met de patiënt tot een beslissing moeten worden gekomen omtrent het al dan niet starten van antivirale behandeling (samen beslissen).
Kosten (middelenbeslag)
De toevoeging van antivirale middelen aan de behandeling van patiënten met een perifere aangezichtsverlamming, zal naar verwachting leiden tot een kleine toename in kosten. De therapie duurt gemiddeld 7 dagen en kost ongeveer €6,- per dag. Gezien deze prijs voor antivirale therapie verwacht de werkgroep echter dat de toename in kosten geen beperkende factor zijn voor het wel of niet voorschrijven van antivirale therapie.
Aanvaardbaarheid, haalbaarheid en implementatie
Patiënten met een lagere score worden in de regel behandeld met enkel corticosteroïden. Wanneer wordt aanbevolen ook patiënten met een lagere HB-score te behandelen met antivirale therapie, zal dit mogelijk leiden tot een verhoging van de hoeveelheid antivirale therapie die wordt voorgeschreven. Beide middelen zijn over het algemeen gemakkelijk te verkrijgen. Daarbij is het aantal patiënten dat jaarlijks medicamenteus behandeld wordt voor een perifere aangezichtsverlamming beperkt. De werkgroep verwacht dan ook geen problemen wat betreft de aanvaardbaarheid, haalbaarheid en/of implementatie. Verspreiding van de richtlijn is noodzakelijk om de behandeld arts bekend te maken met het feit dat ook patiënten met lagere HB-scores mogelijk gebaat zijn bij behandeling met antivirale therapie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het gevonden bewijs (een meta-analyse met 15 trials) suggereert een mogelijk positief effect van het toevoegen van antivirale middelen aan de standaardbehandeling met corticosteroïden bij patiënten met een perifere aangezichtsverlamming. Hoewel de bewijskracht voor dit gevonden effect laag is, zijn er vanuit de praktijk geen zwaarwegende nadelen bekend over behandeling met antivirale therapie. Daarbij heeft behandeling met een combinatie van steroïden en antivirale middelen op de langere termijn mogelijk ook positieve effecten (synkinesieën en krokodillentranen). Het gevonden laat geen onderscheid zien in de uitkomsten van antivirale therapie voor de verschillende HB scores. De patiënt heeft de wens om zo snel mogelijk behandeld te worden en zal dan ook gebaat zijn bij de meest effectieve therapie, met zo min mogelijk restverschijnselen. Antivirale therapie is tegen een lage prijs beschikbaar en over het algemeen gemakkelijk te verkrijgen. De werkgroep verwacht dan ook geen barrières omtrent de kosten en implementatie van een aanbeveling ten faveure van een combinatie van steroïden met antivirale therapie.
Onderbouwing
Achtergrond
De etiologie van perifere aangezichtsverlamming is nog niet geheel duidelijk. Een van de theorieën is dat virale infecties, met name herpesvirusinfecties, mogelijk een rol spelen bij (een deel van) de patiënten met perifere aangezichtsverlamming. Momenteel wordt bij patiënten bij wie het oog niet meer sluit aanbevolen om te starten met corticosteroïden, o.b.v. bewijs uit de literatuur. Deze aanbevelingen over behandeling met corticosteroïden zijn te vinden in de module corticosteroïden bij behandeling van een IPAV. Er bestaat echter controverse over de effecten van het toevoegen van antivirale medicatie aan de behandeling van een perifere aangezichtsverlamming op de lange termijn uitkomsten. Om deze vraag te beantwoorden is extra literatuuronderzoek verricht.
Conclusies / Summary of Findings
|
Low GRADE |
Treatment with a combination of antiviral therapy and corticosteroids may reduce the risk of incomplete recovery when compared to treatment with corticosteroids only in patients with facial nerve palsy.
Source: Gagyor (2019), Talib (2021), Karthika (2023) |
|
Very low GRADE |
The evidence is very uncertain about the effect of treatment with a combination of antiviral therapy and corticosteroids on adverse events, when compared to treatment with corticosteroids only in patients with facial nerve palsy.
Source: Gagyor (2019) |
Samenvatting literatuur
Description of studies
Gagyor (2019) performed a systematic (Cochrane) review to assess the effects of antiviral treatments alone or in combination with any other therapy for Bell's palsy. The databases Cochrane Register of Studies, CENTRAL, MEDLINE, Embase and LILIACS were searched for relevant trials published until July 2019. There was also a search for registered trials. Randomized controlled trials (RCTs) and quasi-RCTs involving an antiviral alone or in combination with any other therapy in the treatment of Bell’s Palsy were included in the analysis. Studies on any oral antiviral licensed for the treatment of herpes simplex infection in immunocompetent participants were included. The study population had to consist of participants with a diagnosis of unilateral facial paralysis of unknown cause. In total, 14 studies were included in the systematic review, of which 13 studies were considered relevant for the purpose of this guideline (Adour, 1996; Li, 1997; Kwaguchi, 200; Sullivan, 2007; Hato, 200; Engström, 2008; Minnerop, 2008; Vazquez, 2008; Yeo, 2008; Shahidullah, 2011; Lee, 2013; Khajeh, 2015; Khedr, 2016). The study that was not considered relevant for the purpose of this guideline did not compare corticosteroids + antivirals versus corticosteroids alone (De, Diego, 1998). Antivirals that were studied in the trials were aciclovir (in 6 trials; Adour, 1996; Li, 1997; Sullivan, 2007; Yeo, 2008; Yeo, 2008; Khajeh, 2015; Khedr, 2016), valaciclovir (in 4 trials; Kawaguchi, 2007; Hato, 2007; Vázquez, 2008; Engström, 2008), and famciclovir (in 3 trials; Minnerop, 2008; Shahidullah, 2011; Lee, 2013), see Table 1. Follow-up duration varied from 3 months to 12 months, see Table 1. All studies reported incomplete recovery at the end of the study duration as an outcome. The studies of Sullivan (2007) and Engstrom (2008) additionally reported side effects as an outcome. The authors graded the risk of bias moderate or high in the majority of the included studies. Only three trials were considered to have low risk of bias (Adour, 1996; Sullivan, 2007 and Engström, 2008).
Talib (2021) performed a randomized controlled trial to compare the pharmacological effects of corticosteroids in comparison to corticosteroids with antiviral drugs for the treatment of Bell’s Palsy. Patients aged 18 years and older, with a confirmed diagnosis of Bell’s Palsy, presenting at the hospital (Pakistan) within 4 days of symptoms were eligible to participate. Patients with diabetes, Herpes Zoster, sarcoidosis, Multiple Sclerosis, systemic infection, suppurative otitis media, bleeding peptic ulcers, pregnant and breastfeeding patients were excluded. In total, 60 patients were enrolled in the study. Patients randomized to the intervention group (n = 30)) received oral acyclovir (400 mg, 4 times/day) and prednisone (1 kg/mg bodyweight for 10 days, tampered for the next 5 days). Patients randomized to the control group received prednisone alone, in the same regimen as the intervention group. Complete recovery of function, measured as House-Brackmann (HB)-score 1, at final follow-up at 8 weeks was reported as outcome. None of the patients was lost to follow-up.
Karthika (2023) performed a randomized controlled trial to compare the efficacy of acyclovir with corticosteroids and corticosteroids alone in the management of Bell’s Palsy with respect to recovery time. Patients with acute symptoms of facial nerve palsy aged 18 – 60 years old were included in the study, which was executed in India. Patients with facial palsy due to other causes e.g., abnormalities of the brain, neoplasm, or surgery were excluded from the study. In total, 100 patients were included in this study. Patients randomized to the control group (n = 50) received oral acyclovir (400 mg, 5 times/day) and methylprednisolone (1 mg/kg/day). Patients in the control group received methylprednisolone (1 mg/kg/day) alone. Both groups additionally received physiotherapy, which included galvanic electrical stimulation and facial massage. Follow-up was at 2 months and at 6 months. Outcomes included complete recovery of function (HB-score I or II) at final follow-up.
Table 1: baseline characteristics of the included studies
mg: milligram, kg: kilogram, acv: aciclovir
|
|
N |
Intervention |
Control |
Follow-up |
|
Adour 1996 (from Gagyor 2019) |
119 |
ACV + prednisone ACV: 2000 mg/day for 10 days Prednisone 1mg/kg for 5 days tapered to 10mg/day for remaining 5 days |
Placebo + prednisone Prednisone 1mg/kg for 5 days tapered to 10mg/day for remaining 5 days
|
3 months |
|
Li 1997 (from Gagyor 2019) |
51 |
ACV + prednisone ACV: 800 mg 5 times/day for 7 days Prednisone: 60 mg for 5 days, tapered in steps of 10 mg for a further 5 days |
Placebo + prednisone Prednisone: 60 mg for 5 days, tapered in steps of 10 mg for a further 5 days |
6 months |
|
Kwaguchi 2007 (from Gagyor 2019) |
150 |
Val-ACV + prednisone Val-ACV: 500 mg twice/day for 5 days Prednisone: 20 mg 3 times/day for 5 days, then 10 mg 3 times/day for 2 days, then 10 mg/day for 2 days |
Prednisone prednisone: 20 mg 3 times/day for 5 days, then 10 mg 3 times/day for 2 days, then 10 mg/day for 2 days
|
6 months |
|
Sullivan 2007 (from Gagyor 2019) |
551 |
ACV + prednisone ACV: 400 mg 5 times/day for 10 days Prednisone: 25 mg twice/day for 10 days |
Prednisone Prednisone: 25 mg twice/day for 10 days
|
3 months and 9 months |
|
Hato 2007 (from Gagyor 2019) |
296 |
Val-ACV + prednisone ValACV: 1000 mg/day for 5 days Prednisone: 60 mg/day for 5 days, then 30 mg/day for 3 days, then 10 mg/day for 2 days |
Prednisone Prednisone:60 mg/day for 5 days, then 30 mg/day for 3 days, then 10 mg/day for 2 days
|
1, 3 and 6 months |
|
Engström 2008 (from Gagyor 2019) |
829 |
Val-ACV + prednisone ValACV: 1000 mg 3 times/day for 7 days prednisone: 60 mg/day for 5 days |
Prednisone Prednisone: 60 mg/day for 5 days
|
1, 2, 3, 6 and 12 months |
|
Minnerop 2008 (from Gagyor 2019) |
167 |
Famciclovir + prednisone Famciclovir: 250 mg 3 times/day for 7 days Prednisone: 1 mg/kg bodyweight for 4 days, tapered over following 8 days |
Prednisone Prednisone: 1 mg/kg bodyweight for 4 days, tapered over the following 8 day
|
3 months |
|
Vazquez 2008 (from Gagyor 2019) |
42 |
Val-ACV + prednisone ValACV: 2g for 7 days Prednisone: 1 mg/kg bodyweight for 7 days, reduced doses for 14 days |
Prednisone Prednisone: 1 mg/kg body weight for 7 days, reduced doses for 14 days
|
6 months |
|
Yeo 2008 (from Gagyor 2019) |
91 |
ACV + prednisone ACV: 2400 mg/day for 5 days Prednisone: 1 mg/kg/day for 5 days then tapered on days 6 to 10 |
Prednisone Prednisone: 1 mg/kg/day for 5 days then tapered on days 6 to 10"
|
2 months 6 months |
|
Shahidullah 2011 (from Gagyor 2019) |
107 |
Famciclovir + prednisone Famciclovir: 250 mg 3 times/day for 5 days Prednisone: 60 mg/day for 7 days |
Prednisone Prednisone: 60 mg/day for 7 days
|
3 months |
|
Lee 2013 (from Gagyor 2019) |
207 |
Famciclovir + prednisone Famciclovir (intravenously) 750 mg/day for 7 days Prednisone: 64 mg for 4 days, 48 mg for 2 days, 32 mg for 2 days, and 16 mg for 2 days |
Prednisone Prednisone: 64 mg for 4 days, 48 mg for 2 days, 32 mg for 2 days, and 16 mg for 2 days
|
6 months |
|
Khajeh 2015 (from Gagyor 2019) |
43 |
ACV + prednisone ACV: 10 mg/kg/day every 8 hours for 7 days Prednisone: 2 mg/kg/day every 8 hours for 7 days |
Prednisone Prednisone: 2 mg/kg/day every 8 hours for 7 days
|
no information |
|
Khedr 2016 (from Gagyor 2019) |
65 |
ACV + prednisone ACV: 400 mg 3 times/day for 5 days Prednisone: 60 mg/day for 7 days |
Prednisone Prednisone: 2 mg/kg/day every 8 hours for 7 days |
3 months |
|
Talib, 2021 |
60 |
ACV + prednisone ACV: 400 mg 4 times/day Prednisone: 1mg/kg bodyweight for 10 days, tampered for the next 5 days. |
Prednisone Prednisone: 1mg/kg of bodyweight for 10 days, tampered for the next 5 days. |
2 months |
|
Khartika 2023 |
100 |
ACV + methylprednisone ACV: 400 mg 5 times/day Methylprednisolone: 1mg/kg bodyweight/day |
Methylprednisone Methyl prednisone: 1mg/kg bodyweight/day |
2 months, 6 months |
Results
Incomplete recovery at final follow-up
The studies of Talib (2021) and Karthika (2023) only reported the number of patients with complete recovery. The number of patients with incomplete recovery was determined by subtracting the number of patients with complete recovery, from the total study population, as is suggested in Gagyor (2019).
All included studies (Gagyor 2019; Talib 2021; Khartika 2023) reported the outcome incomplete recovery for treatment with antiviral therapy (acyclovir, famciclovir, valaciclovir) and corticosteroids. The results were pooled in a meta-analysis. The pooled number of patients with incomplete recovery after treatment with antiviral therapy and corticosteroids was 106/952 (11.1%). In the patients receiving only corticosteroids, the pooled number of patients with incomplete recovery was 185/937 (19.7%). The pooled Relative Risk Ratio (RR) 0.52 (95% CI: 0.37 to 0.72), favoring treatment with antiviral therapy and corticosteroids (Figure 1). This was considered clinically relevant.
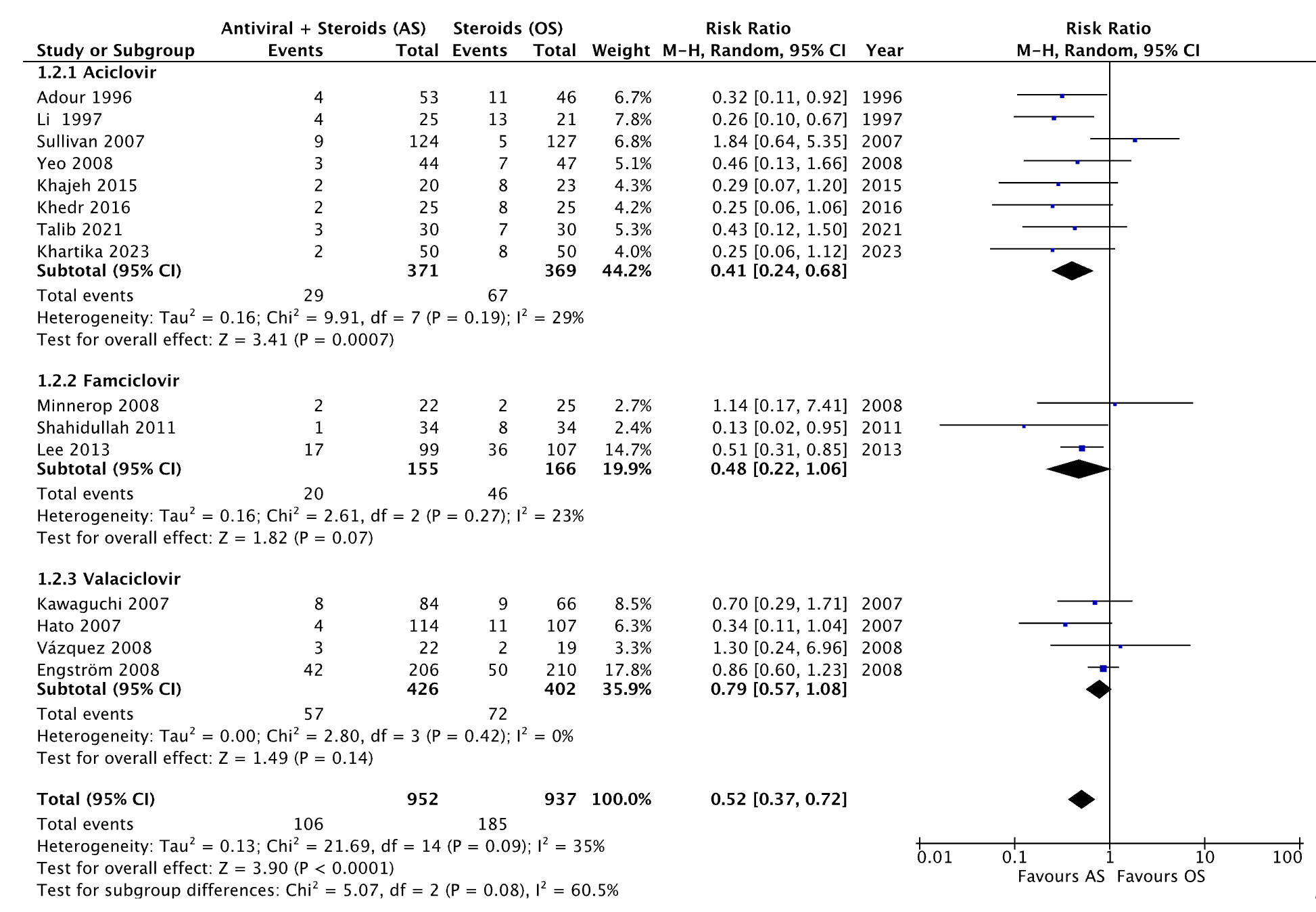
Figure 1. Forest plot showing the comparison between treatment with antiviral therapy and corticosteroids versus corticosteroids alone for the outcome incomplete recovery. RR: Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity
Adverse events
Four studies included in the review from Gagyor (2019) reported the outcome side effects (Hato 2007; Sullivan 2007; Engström 2008; Shahidullah 2011) for treatment with antiviral therapy and corticosteroids. The results were pooled in a meta-analysis. Of the patients receiving antiviral therapy and corticosteroids 61/474 (12.8%) experienced side effects. The pooled number of patients experienced side effects after receiving only corticosteroids was 53/471 (11.3%). The pooled RR was 1.16 (95% CI: 0.82 to 1.62), favoring treatment with corticosteroids alone (Figure 2). This was not considered clinically relevant.
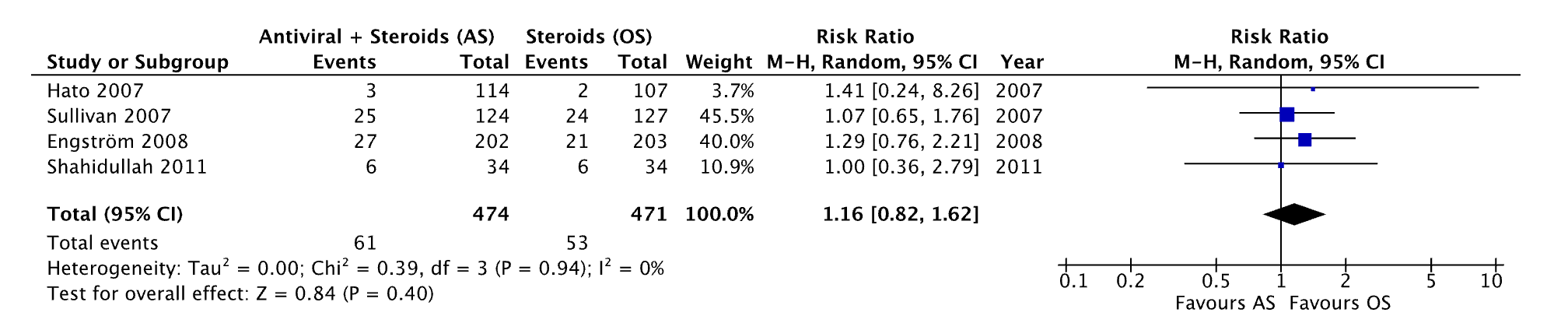
Figure 2. Forest plot showing the comparison between treatment with antiviral therapy and corticosteroids versus corticosteroids alone for the outcome adverse events. RR: Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity
Level of evidence of the literature
The level of evidence regarding the outcome measure incomplete recovery was retrieved from randomized controlled trials and therefore started ‘high’. The level of evidence was downgraded by two levels because of study limitations including unclear randomization procedures and lack of blinding (-1 risk of bias) and conflicting results (-1 inconsistency). The final level of evidence was graded ‘low’.
The level of evidence regarding the outcome measure adverse events was retrieved from randomized controlled trials and therefore started ‘high’. The level of evidence was downgraded by three levels because of study limitations including unclear randomization procedures and lack of blinding (-1 risk of bias); conflicting results (-1 inconsistency) and the 95% confidence intervals crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded ‘very low’.
Zoeken en selecteren
What are the favorable and unfavorable effects of treatment with corticosteroids and antiviral agents compared to corticosteroids alone in patients with facial nerve palsy?
A systematic review of the literature was performed to answer the following question:
| P= | patients with facial nerve palsy |
| I= | treatment with corticosteroids and antiviral agents |
| C= | treatment with corticosteroids alone |
| O= | recovery (full or partial recovery), adverse events |
Relevant outcome measures
The guideline development group considered recovery as a critical outcome measure for decision making; and adverse events as an important outcome measure for decision making.
A priori, the guideline development group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically (patient) important differences:
- Recovery (full or partial): 10% relative risk (RR) (RR<0.90 or RR>1.10)
- Adverse events: 25% RR (RR<0.80 or RR>1.25)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 24th of April 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 337 hits. Studies were selected based on the following criteria: systematic reviews and RCTs studies comparing treatment of facial palsy with corticosteroids and antiviral agents with treatment with corticosteroids alone. The search resulted in 337 unique hits. Twenty studies were initially selected based on title and abstract screening. After reading the full text, seventeen studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
One systematic review and two RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- de Almeida JR, Guyatt GH, Sud S, Dorion J, Hill MD, Kolber MR, Lea J, Reg SL, Somogyi BK, Westerberg BD, White C, Chen JM; Bell Palsy Working Group, Canadian Society of Otolaryngology - Head and Neck Surgery and Canadian Neurological Sciences Federation. Management of Bell palsy: clinical practice guideline. CMAJ. 2014 Sep 2;186(12):917-22. doi: 10.1503/cmaj.131801. Epub 2014 Jun 16. PMID: 24934895; PMCID: PMC4150706.
- Baugh, R.F., Basura, G.J., Ishii, L.E., Schwartz, S.R., Drumheller, C.M., Burkholder, R., Deckard, N.A., Dawson, C., Driscoll, C., Gillespie, M.B., Gurgel, R.K., Halperin, J., Khalid, A.N., Kumar, K.A., Micco, A., Munsell, D., Rosenbaum, S. and Vaughan, W. (2013), Clinical Practice Guideline: Bell's Palsy. Otolaryngology–Head and Neck Surgery, 149: S1-S27.
- Fieux M, Franco-Vidal V, Devic P, Bricaire F, Charpiot A, Darrouzet V, Denoix L, Gatignol P, Guevara N, Montava M, Roch JA, Tankéré F, Tronche S, Veillon F, Vergez S, Vincent C, Lamas G, Tringali S. French Society of ENT (SFORL) guidelines. Management of acute Bell's palsy. Eur Ann Otorhinolaryngol Head Neck Dis. 2020 Dec;137(6):483-488. doi: 10.1016/j.anorl.2020.06.004. Epub 2020 Jul 4. PMID: 32636146.
- Gagyor I, Madhok VB, Daly F, Sullivan F. Antiviral treatment for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 2019 Sep 5;9(9):CD001869. doi: 10.1002/14651858.CD001869.pub9. PMID: 31486071; PMCID: PMC6726970.
- KaRThiKa, S. R., PRiya, K., RajaSEKaRaN, S., & Balaji, D. (2023). Acyclovir with Steroid and Steroid Alone in the Treatment of Idiopathic Facial Nerve Palsy: A Randomised Double-blinded Clinical Study from a Tertiary Care Centre, Chennai, India. Journal of Clinical & Diagnostic Research, 17(1).
- Talib A, Baloch G, Haider Naqvi I, Ubaid M. Steroids with and Without Antivirals in the Treatment of Bell’s Palsy: Does It Make any Difference in Recovery? A Study at a Tertiary Care Center, Karachi, Pakistan. Arch Neurosci. 2021;8(3):e115645. https://doi.org/10.5812/ans.115645.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Gagyor 2019 (Cochrane)
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of 14 RCTs, of which 13 were considered relevant
Literature search up to July 2019
A: Adour 1996, B: Li 1997, C: Kawaguchi 2007, D: Sullivan 2007 , E: Hato 2007, F: Engström 2008, G: Minnerop 2008, H: Vazquez 2008, I: Yeo 2008, J: Shahidullah 2011, K: Lee 2013, L: Khajeh 2015, M: Khedr 2016,
Setting and Country: A: Single-centre, USA B: Singe-centre, China C: Multicentre: 12 university hospitals, Japan D: Multicentre: 17 hospitals, Scotland, UK E: Multicentre: 6 hospitals, Japan F: Multicentre: 16 centres, Sweden + Finland G: Single-centre, Germany H: Single-centre, Uruguay I: Single-centre, Sout-Korea J: Single-centre, Bangladesh K: Single-centre, South-Korea L: Single-centre, Iran M: Single-centre, Egypt
Source of funding and conflicts of interest: A: Non-commercial grant B: no information C: Non-commercial grant D: Non-commercial grant E: non-commercial grant F: Commercial Grant G: no information H: no information I: no information J: no information K: non-commercial grant L: no information M: no information |
Inclusion criteria SR: - (quasi) RCTs involving an antiviral alone or in combination with any other therapy in the treatment of bell’s palsy - trials where participants had a diagnosis of unilateral facial paralysis of unknown cause - trial of treatment with any oral antiviral licensed for the treatment of herpes simplex infection in immunocompetent participants
14 studies included
Important patient characteristics at baseline:
N total A: 119 B: 51 C: 150 D: 551 E: 296 F: 829 G: 167 H: 42 I: 91 J: 107 K: 207 L: 43; M: 65
Mean age I/C A: I: 41.9 ± 14.1 / C: 44.6 ± 15.1 B: I: 39.2 / C: 40.3 C: I: 54.5± 17.3 / C: 47.0 ± 18.6 D: 44.0 ± 16.4 E: I: 48.4 / C: 52.3 F: I: 42 / C: 38 G: I: 42.6 ± 30.9 / C: 40.6 ± 20.5 H: 42.5 ± 20.8 / C: 40.1 ± 18.5 I: I: 42.7 ± 15.7 / C: 40.2 ± 18.4 J: I: 31 ± 9.6 / C: 35.1 ± 11.7 K:; I: 46.7 ± 16.2 / C: 48.6 ± 15.1 L: Children; I: 8.4 ± 4.9 / C: 8.6 ± 5.1 M: I: 36.3 ± 14.0 / C: 37.4 ± 13.4
Sex: A: i: 45 / c: 57 B: no information C: i: 58 / c: 62 D: no information E: i: 48 / c: 47 F: i: 39 / c: 42 G: no information H: no information I: no information J: no information K: i: 50 / c: 52 L: i: 55 / c: 39 M: no information
Groups comparable at baseline? A: probably yes B: prbably yes C: probably yes D: probably yes E: probably yes F: probably yes G: probably yes H: probably yes I: probably yes J: probably yes K: probably yes L: probably yes M: probably yes |
A: Aciclovir + prednisone Aciclovir: 2000 mg/day for 10 days Prednisone 1mg/kg for 5 days tapered to 10mg/day for remaining 5 days"
B: aciclovir + prednisone Aciclovir: 800 mg 5 times/day for 7 days Prednisone: 60 mg for 5 day, tapered in steps of 10 mg for a further 5 days
C: Valaciclovir + prednisone valaciclovir: 500 mg twice/day for 5 days prednisone: 20 mg 3 times/day for 5 days, then 10 mg 3 times/day for 2 days, then 10 mg/day for 2 days
D: Aciclovir + prednisone Aciclovir: 400 mg 5 times/day for 10 days Prednisone: 25 mg twice/day for 10 days "
E: Valaciclovir + prednisone valaciclovir: 1000 mg/day for 5 days prednisone: 60 mg/day for 5 days, then 30 mg/day for 3 days, then 10 mg/day for 2 days"
F: Valaciclovir + prednisone valaciclovir: 1000 mg 3 times/day for 7 days prednisone: 60 mg/day for 5 days "
G: famciclovir + prednisone valaciclovir: 250 mg 3 times/day for 7 days prednisone: 1 mg/kg bodyweight for 4 days, tapered over following 8 days"
H: Valaciclovir + prednisone valaciclovir: 2g for 7 days prednisone: 1 mg/kg body weight for 7 days, reduced doses for 14 days
I: Aciclovir + prednisone Aciclovir: 2400 mg/day for 5 days Prednisone: 1 mg/kg/day for 5 days then tapered on days 6 to 10"
J: Famciclovir + prednisone Famciclovir: 250 mg 3 times/day for 5 days Prednisone: 60 mg/day for 7 days "
K: Famciclovir + prednisone Famciclovir (intravenously) 750 mg/day for 7 days Prednisone: 64 mg for 4 days, 48 mg for 2 days, 32 mg for 2 days, and 16 mg for 2 days"
L: Aciclovir + prednisone Aciclovir: 10 mg/kg/day every 8 hours for 7 days Prednisone: 2 mg/kg/day every 8 hours for 7 days
M: Aciclovir + prednisone Aciclovir: 400 mg 3 times/day for 5 days Prednisone: 60 mg/day for 7 days" |
A: Placebo + Prednisone Prednisone 1mg/kg for 5 days tapered to 10mg/day for remaining 5 days
B: Placebo + prednisone Prednisone: 60 mg for 5 day, tapered in steps of 10 mg for a further 5 days
C: Prednisone prednisone: 20 mg 3 times/day for 5 days, then 10 mg 3 times/day for 2 days, then 10 mg/day for 2 days
D: Prednisone Prednisone: 25 mg twice/day for 10 days
E: Prednisone Prednisone:60 mg/day for 5 days, then 30 mg/day for 3 days, then 10 mg/day for 2 days
F: Prednisone Prednisone: 60 mg/day for 5 days
G: Prednisone Prednisone: 1 mg/kg bodyweight for 4 days, tapered over the following 8 day
H: Prednisone Prednisone: 1 mg/kg body weight for 7 days, reduced doses for 14 days
I: Prednisone Prednisone: 1 mg/kg/day for 5 days then tapered on days 6 to 10"
J: Prednisone Prednisone: 60 mg/day for 7 days
K: Prednisone Prednisone: 64 mg for 4 days, 48 mg for 2 days, 32 mg for 2 days, and 16 mg for 2 days
L: Prednisone Prednisone: 2 mg/kg/day every 8 hours for 7 days
M: Prednisone Prednisone: 2 mg/kg/day every 8 hours for 7 days" |
Duration of follow-up A: 3 months B: 6 months C: 6 months D: 3 months and 9 months E: 1, 3 and 6 months F: 1, 2, 3, 6 and 12 months G: 3 months H: 6 months I: 2 and 6 months J: 3 months K: 6 months L: no information M:3 months
For how many participants were no complete outcome data available? A: Data available for 99 participants (i: n = 53 - c: n = 46) B: 5 patients LTFU C: 10% LTFU D:data available for 496 participants E: 52 patients LTFU (25.3%) F: no information G: 50 patients LTFU H: no information I: no information L: no information J: 9 patients LTFU K: no information M: no information
|
Outcome measure-1 incomplete recovery at end of study Pooled effect (random effects model): 0.54 (95% CI 0.38 to 0.77] Heterogeneity (I2): 0%
Sensitivity analysis: only studies with low RoB (Adour, 1996; Sullivan 2007;, Engstrom 2008) Pooled effect (random effects model): 0.81 (95% CI 0.38 to 1.74] Heterogeneity (I2): 0%
Outcome measure-2: Side effects D: RR: 1.07 (95% CI: 0.65 to 1.76) F: RR: 1.29 (95% CI; 0.76 to 2.21) Pooled 1.17 (95% CI: 0.81 to 1.69)
|
The authors concluded that: “The combination of antivirals and corticosteroids may have little or no eKect on rates of incomplete recovery in comparison to corticosteroids alone in Bell's palsy of various degrees of severity, or in people with severe Bell's palsy, but the results were very imprecise”
GRADE assessment authors Outcome 1: Low Grade (-1 inconsistency, -1 imprecision) Only studies with low RoB were included
Outcome 2: Very low (-1 publication bias, -2 imprecision)
Risk of Bias: (random sequence/allocation/blinding participants/blinding assessors/incomplete outcome data/selective reporting/other sources of bias)
A: +/+/+/+/-/-/+ B: ?/?/+/?/?/?/+ C: ?/-/-/-/+/-/+ D: +/+/+/+/+/+/+ E: ?/?/-/-/-/+/? F: +/+/+/+/+/+/+ G: -/-/-/-/-/?/? H: ?/?/?/?/+/?/+ I: ?/?/?/?//?//?+ J: -/?/-/-/-/+/- K: +/?/-/-/-/?/? L: ?/?/-/-/?/?/? M: ?/?/?/?/+/-/+
AS: antiviral + corticosteroids AO: antiviral alone or with placebo |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Talib 2021 |
Type of study: RCT
Setting and country: Single centre, Pakistan.
Funding and conflicts of interest: None |
Inclusion criteria: - confirmed diagnosis of Bell’s Palsy - Aged 18 years or older - presentation within 4 days of symptoms of Bell’s Palsy
Exclusion criteria: - patients with diabetes, Herpes Zoster, sarcoidosis, MS, systemic infection, suppurative otitis media, bleeding peptic ulcers - pregnant and breast feeding patients
N total at baseline: Intervention: 30 Control: 30
Important prognostic factors2: age ± SD: I: 39.9 C: 31.1
Sex: % female I: 40% C: 44.4%
HB-score I: 3.4 ± 1.1 C: 3.9 ± 0.9
Groups comparable at baseline? Probably yes |
Aciclovir + prednisone
Aciclovir: 400 mg 4 times/day Prednisone: 1mg/kg of bodyweight for 10 days, tampered for the next 5 days.
Group B
|
Prednisone
Prednisone: 1mg/kg of bodyweight for 10 days, tampered for the next 5 days.
Group A |
Length of follow-up: 4 weeks, 8 weeks
Loss-to-follow-up: None reported
|
Outcome-1 facial nerve recovery (HB) – complete recovery (grade I) at final follow-up
I: 27/30 (90%) C: 23/30 (77%)
|
The author’s concluded that: “This study concludes that the combination of prednisone with acyclovir is superior to prednisone alone in the pharmacological management of Bell’s Palsy” |
|
Karthika 2023 |
Type of study: RCT
Setting and country: Single centre, India from September 2021 to February 2022
Funding and conflicts of interest: None |
Inclusion criteria: - acute symptoms of facial nerve palsy without any underlying cause - aged 18 – 60 years
Exclusion criteria: - patients with facial palsy due to other causes (e.g. abnormalities of the brain, neoplasm, or surgery) - acute and chronic middle ear diseases
N total at baseline: Intervention: 51 Control: 51
Important prognostic factors2: age ± SD: I: 34.5 ± 11.5 C: 36.0 ± 10.7
Sex: % female I: 52% C: 44%
HB-score I: 3.28 ± 0.93 C: 3.44 ± 0.76
Groups comparable at baseline? Probably yes |
Acyclovir with methylprednisolone
Aciclovir: 400 mg 5 times/day Methyl prednisone: 1mg/kg bodyweight/day
Both |
Methylprednisolone
Methyl prednisone: 1mg/kg bodyweight/day |
Length of follow-up: 2 months, 6 months
Loss-to-follow-up: I: n = 0 C: n = 1
Reason: patient did not show up |
Outcome-1 facial nerve recovery (HB) – complete recovery (HB-grade I and II) at final follow-up
I: 48/50 (96%) C: 42/50 (84%)
|
The authors’ concluded that: “The combination of acyclovir with steroids in the treatment of Bell’s palsy has better recovery compared to steroid alone therapy.”
Both groups received physiotherapy, which included galvanic electrical stimulation, facial massage in the Department of Physiotherapy while they came for review. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/ notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Gagyor 2019 |
Yes
Reason: PICO clearly defined |
Yes
Reason: 8 databases and/or trial registries were searched, of which MEDLINE and EMBASE |
Yes;
Reason: flowchart of study selection and exclusion table |
Yes;
Reason: overview of baseline characteristics per included study |
Not applicable |
Yes;
Reason: RoB assessment with Cochrane RoB tool |
Yes;
Reason: there is hetereogeneity, but I2 is calculated and subanalyses are performed |
Yes
Reason: funnel plot is presented |
Yes
Reason: included in baseline characteristics, however most studies did not report any information on conflicts of interest. |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Talib, 2021 |
No information
Reason: not clear how allocation sequence was generated |
Definitely no
Reason: patients in control group were given even numbers, patients in study group were given odd numbers |
Unclear
Reason: it was stated that ‘all patients recruiters and assessors were blind to medications given’, however the text does not describe the trial was placebo-controlled
|
Probably yes
Reason: no LTFU reported |
Probably yes;
Reason: all outcomes in method section are reported
|
Probably yes;
Reason: no other sources of bias could be identified |
Outcome recovery:
some concerns – due to unclear and inadequate randomization and allocation procedures and blinding procedures
|
|
Khartika, 2023 |
Probably yes;
Reason: randomisation was done using a systematic sampling method. |
Definitely no
Reason: every odd number was randomized to intervention group, odd numbers were randomized to control group |
Unclear
Reason: it was stated that ‘all patients recruiters and assessors were blind to medications given’, however the text does not describe the trial was placebo-controlled
|
Definitely yes;
Reason: only one person was lost to follow-up |
Probably yes
Reason: Outcomes stated in the method section are reported |
Probably yes
Reason: no other sources of bias could be identified |
Outcome recovery:
some concerns – due to unclear and inadequate randomization and allocation procedures and blinding procedures
|
Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
Lost to follow-up: If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
Selective outcome reporting: Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
Other biases: Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Cao J, Zhang X, Wang Z. Effectiveness comparisons of antiviral treatments for Bell palsy: a systematic review and network meta-analysis. J Neurol. 2022 Mar;269(3):1353-1367. doi: 10.1007/s00415-021-10487-9. Epub 2021 Mar 5. Erratum in: J Neurol. 2022 Feb 1;: PMID: 33674936. |
Systematic review of higher quality available (Gagyor, 2019) |
|
Shi J, Lu D, Chen H, Shu M, Xu Y, Qian J, Ouyang K, Huang H, Luo Z, Wang C, Zhang Y. Efficacy and Safety of Pharmacological and Physical Therapies for Bell's Palsy: A Bayesian Network Meta-Analysis. Front Neurol. 2022 Apr 18;13:868121. doi: 10.3389/fneur.2022.868121. PMID: 35528739; PMCID: PMC9074786. |
Review also includes other treatment modalities (e.g. physical therapy)
|
|
Jalali MM, Soleimani R, Soltanipour S, Jalali SM. Pharmacological Treatments of Bell's Palsy in Adults: A Systematic Review and Network Meta-Analysis. Laryngoscope. 2021 Jul;131(7):1615-1625. doi: 10.1002/lary.29368. Epub 2021 Jan 6. PMID: 33404068. |
Not all included studies comply with the PICO
|
|
Furukawa T, Abe Y, Ito T, Kubota T, Hull M, Goto T, Sugiyama M, Kakehata S. Benefits of High-Dose Corticosteroid and Antiviral Agent Combination Therapy in the Treatment of House-Brackman Grade VI Ramsay Hunt Syndrome. Otol Neurotol. 2022 Aug 1;43(7):e773-e779. doi: 10.1097/MAO.0000000000003582. PMID: 35878642. |
Wrong study design: retrospective case review |
|
Fieux M, Franco-Vidal V, Devic P, Bricaire F, Charpiot A, Darrouzet V, Denoix L, Gatignol P, Guevara N, Montava M, Roch JA, Tankéré F, Tronche S, Veillon F, Vergez S, Vincent C, Lamas G, Tringali S. French Society of ENT (SFORL) guidelines. Management of acute Bell's palsy. Eur Ann Otorhinolaryngol Head Neck Dis. 2020 Dec;137(6):483-488. doi: 10.1016/j.anorl.2020.06.004. Epub 2020 Jul 4. PMID: 32636146. |
Wrong study design: French guideline |
|
Kim Y, Doo JG, Chon J, Lee JH, Jung J, Lee JM, Kim SH, Yeo SG. Steroids plus antiviral agents are more effective than steroids alone in the treatment of severe Bell's palsy patients over 40 years of age. Int J Immunopathol Pharmacol. 2021 Jan-Dec;35:20587384211042124. doi: 10.1177/20587384211042124. PMID: 34633253; PMCID: PMC8511921. |
wrong study design: retrospective review |
|
Goo B, Kim HN, Kim JH, Nam SS. A bibliometric analysis of research on the treatment of facial nerve palsy. Medicine (Baltimore). 2021 Aug 20;100(33):e26984. doi: 10.1097/MD.0000000000026984. PMID: 34414977; PMCID: PMC8376370. |
study on research published on treatment of facial palsy |
|
Paudel D , Chettri ST , Sah BP , Dahal R , Pyakurel P . Analysis of Prognostic Factors of Bell's Palsy in a Tertiary Care Centre of Eastern Nepal. Kathmandu Univ Med J (KUMJ). 2021 Jul-Sept.;19(75):325-329. PMID: 36254418. |
wrong study design: retrospective review |
|
Yoo MC, Park DC, Yeo SG. Association between Initial Severity of Facial Weakness and Outcomes of Bell's Palsy. J Clin Med. 2021 Aug 30;10(17):3914. doi: 10.3390/jcm10173914. PMID: 34501363; PMCID: PMC8432204. |
wrong study design: retrospective cohort |
|
Jeong DY, Kim H, Cho SI. Clinical analysis of acute peripheral facial palsy in older adults. J Laryngol Otol. 2022 Nov;136(11):1113-1117. doi: 10.1017/S0022215121004412. Epub 2022 Jan 7. PMID: 35920320. |
study on the clinical characteristics of facial palsy patients |
|
Yoo MC, Park DC, Byun JY, Yeo SG. Clinical Prognostic Factors Associated with Good Outcomes in Pediatric Bell's Palsy. J Clin Med. 2021 Sep 24;10(19):4368. doi: 10.3390/jcm10194368. PMID: 34640384; PMCID: PMC8509832. |
wrong study design: retrospective cohort |
|
Gürbüz, Gürkan. "The Efficacy of Acyclovir in Childhood Bell's Palsy." Turkish Journal of Neurology/Turk Noroloji Dergisi 26.2 (2020). |
wrong study design: retrospective review |
|
Yoo MC, Soh Y, Chon J, Lee JH, Jung J, Kim SS, You MW, Byun JY, Kim SH, Yeo SG. Evaluation of Factors Associated With Favorable Outcomes in Adults With Bell Palsy. JAMA Otolaryngol Head Neck Surg. 2020 Mar 1;146(3):256-263. doi: 10.1001/jamaoto.2019.4312. PMID: 31971554; PMCID: PMC6990801. |
wrong study design: retrospective cohort |
|
Kafle DR, Thakur SK. Evaluation of prognostic factors in patients with Bell's palsy. Brain Behav. 2021;11(11):e2385. doi:10.1002/brb3.2385 |
wrong study design: prospective cross-sectional study |
|
Dalrymple SN, Row JH, Gazewood J. Bell Palsy: Rapid Evidence Review. Am Fam Physician. 2023 Apr;107(4):415-420. PMID: 37054419. |
Niet systematische review |
|
Bayoumy, Ahmed B., and J. Alexander de Ru. "Cochrane Systematic Review Antiviral Treatment for Bell’s Palsy: an Opposing Opinion!." SN Comprehensive Clinical Medicine 2.7 (2020): 928-932. |
wrong design: discussion of a review |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-05-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Samenstelling cluster
Voor het herzien van de richtlijnmodules is in 2021 een multidisciplinair cluster ingesteld (cluster otologie). Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met een perifere aangezichtsverlamming.
Expertisegroep perifere aangezichtsverlamming
- Dr. K.J.A.O. (Koen) Ingels (voorzitter), KNO-arts, Radboud UMC; NVKNO
- Dr. I.J. (Ingrid) Kleiss, KNO-arts, Rijnstate Arnhem; NVKNO
- Dr. F.V.W.J. (Floris) van Zijl, KNO-arts, Erasmus MC; NVKNO
- Dr. A.M.M. (Anne) Oonk, KNO-arts, Gelre Ziekenhuis; NVKNO
- Dr. N. (Nienke) Grotenhuis, KNO-arts, Maasstad Ziekenhuis; NVKNO
- Dr. R.H. (Rolien) Free, KNO-arts, UMC Groningen, NVKNO,
- Prof. Dr. B.F.A.M. (Bernard) van der Laan, KNO-arts, Haaglanden MC; NVKNO
- Dr. C. (Caroline) Driessen, plastisch chirurg, Amsterdam UMC; NVPC
- Dr. G.J. (Gerben) van Hinte, fysiotherapeut, Radboud UMC; KNGF
- Dr. J.J. (Jos) Kerremans, medisch microbioloog, Alrijne Ziekenhuis; NVMM
- E. (Esmee) Ruizendaal, medisch microbioloog, Radboud UMC; NVMM
- Dr. E.A. (Elisabeth) Cats, (kinder)neuroloog, Gelre Ziekenhuis; NVN
Met ondersteuning van
- Dr. R. (Romy) Zwarts - van de Putte, adviseur, Kennisinstituut van Medisch Specialisten
- D.G. (Dian) Ossendrijver, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Expertisegroep
Tabel 1. Gemelde (neven)functies en belangen expertisegroep IPAV
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Ingels * |
KNO-arts, Radboudumc, Nijmegen
|
dr. K. Ingels is tevens werkzaam bij Eyelift en Neuscorrectie-specialist, waar respectievelijk ooglidcorrecties en Neuscorrecties worden uitgevoerd (geen patiënten met aangezichtsverlamming). |
Geen |
Geen restrictie |
|
Smit |
Plastisch chirurg AUMC |
UEMS vertegenwoordiger; onbetaald |
The Breast trial / The breast trail 2. Geen rol bij deze richtlijn
|
Geen restrictie |
|
Ruizendaal |
Arts-microbioloog, Radboudumc (4 dagen per week, betaald) |
Geen |
Geen |
Geen restrictie |
|
Van Zijl |
0,9 FTE KNO-arts Erasmus MC 0,1 FTE KNO-arts Boerhaave kliniek en Eyelift.nl (klinieken voor cosmetische aangezichtschirurgie) |
Lid kerngroep aangezichtschirurgie KNO Vereniging Lid werkgroep kennisagenda aangezichtschirurgie |
Geen |
Geen restrictie |
|
Schmidt-Grotenhuis |
KNO-arts Maasstad ziekenhuis 0,6FTE |
Geen |
Geen |
Geen restrictie |
|
Van Hinte |
Fysiotherapeut, gezondheidswetenschapper, Radboudumc Nijmegen (34u pw). |
Betaald: |
Geen |
Geen restrictie |
|
Driessen |
Plastisch chirurg in Amsterdam UMC 0.8FTE |
Geen |
Geen |
Geen restrictie |
|
Kleiss |
KNO-arts Rijnstate Arnhem (0.8 FTE) |
Accreditatie Commissie KNO Vereniging Lid werkgroep kennisagenda aangezichtschirurgie NvKNO |
Geen |
Geen restrictie |
|
van der Laan |
KNO-arts |
Geen |
Geen |
Geen restrictie |
|
Kerremans |
Arts-microbioloog vrijgevestigd werkend via MSB Alrijne; laboratorium is eigendom van Eurofins; |
Lid Commissie kwaliteit NVMM onbezoldigd |
Geen |
Geen restrictie |
|
Oonk |
KNO-arts bij Gelre ziekenhuizen (betaald). |
Geen |
Geen |
Geen restrictie |
|
Cats |
Kennisinstituut FMS/NVN |
Ik werk als kinderneuroloog in het Gelre ziekenhuis Apeldoorn. Ik heb geen nevenwerkzaamheden |
Geen |
Geen restrictie |
|
Free |
KNO-arts/Otoloog, Pediatrische KNO, Voorzitter CI team Noord-Nederland, UMCG Groningen, afdeling KNO heelkunde |
Lid Voortgangstoets commissie KNO-vereniging |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update en/of prioritering. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodule is tevens ter commentaar voorgelegd aan alle relevante patiëntenorganisaties in de stuur- en expertisegroep (zie ‘Samenstelling cluster’ onder ‘Verantwoording’) en aan alle patiëntenorganisaties die niet deelnemen aan de stuur- en expertisegroep, maar wel hebben deelgenomen aan de need-for-update (zie ‘Need-for-update’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Tabel 2. Uitkomsten kwalitatieve raming
|
Richtlijnmodule |
Uitkomst raming |
Toelichting |
|
Antivirale middelen bij behandeling perifere aangezichtsverlamming
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (april, 2021) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd. Per richtlijnmodule is aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De richtlijnmodules waarbij door één of meerdere partijen werd aangegeven herzien te worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules werden doorgezet naar de prioriteringsronde. Afgevaardigden vanuit de partijen in de stuur- en expertisegroep werden gevraagd om te prioriteren (zie ‘Samenstelling cluster’ onder ‘Verantwoording’). Hiervoor werd de RE-weighted Priority-Setting (REPS) – tool gebruikt. De uitkomsten (ranklijst) werd gebruikt als uitgangspunt voor de discussie. Voor de geprioriteerde richtlijnmodules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. (Review Manager 5.4) werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 3. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 4. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
