Mycoplasma genitalium en PID
Uitgangsvraag
Moet de antibiotische behandeling bij verdenking op PID worden aangepast bij een positieve test op Mycoplasma genitalium (MG)?
Aanbeveling
Voer geen aangepaste antibiotische behandeling uit bij vrouwen met een positieve test op Mycoplasma genitalium en verdenking op pelvic inflammatory disease (PID).
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de literatuur werd een positieve associatie gevonden tussen vrouwen met een positieve test op MG en PID. Het vertrouwen in de literatuur over het risico dat MG geeft voor het ontwikkelen van PID is echter zeer laag vanwege mogelijke selectiebias en de heterogeniteit in de gehanteerde definities van PID en de geïncludeerde populaties (hoog en laag risicopopulaties). Hierdoor is de overall bewijskracht voor de uitkomstmaat PID diagnose ja/nee gegradeerd als ‘zeer laag’.
Veelal in hoog risico populaties (vrouwen die een SOA kliniek bezochten, soms met hoge prevalentie van HIV, Chlamydia en gonorroe) werd een positieve associatie gevonden tussen een positieve test op MG en PID. Hoewel de veelvuldig gevonden associatie tussen MG en PID causaliteit waarschijnlijk maakt, werd in de sensitiviteitsanalyse van studies waarvan met zekerheid kon worden vastgesteld dat de MG infectie vooraf aan de PID was geweest én de PID diagnose overeenkwam met de klinische diagnose zoals in Nederland wordt gesteld, een beperkt (en niet statistisch significant) effect van een positieve test op MG gevonden. In deze studie was incidentie van PID bij vrouwen met een positieve test op MG 3,9%, vergeleken met 1,7% bij vrouwen zonder MG (Oakshott, 2010).
Daarnaast is er weinig bekend over het natuurlijk beloop van MG dragerschap, noch over de gevolgen hiervan op de fertiliteit, dit wordt daarom beschouwd als een kennislacune. Op dit moment is er dan ook onvoldoende bewijs dat MG in dezelfde mate PID en infertiliteit kan bewerkstelligen zoals Chlamydia en gonorroe dit doen (Cina, 2019; Lis, 2015; Oliphant, 2015).
Het is onbekend in welke mate de huidige antibiotische behandeling voor PID (ofloxacine en metronidazol) de aanwezigheid van MG bij PID effectief behandelt. Op theoretische gronden kan worden verondersteld dat wel effect zal optreden. Of er volledige conversie zal optreden, is onvoldoende bekend in de literatuur. De klinische impressie is echter dat met de huidige antibiotische behandeling recidiverende PID geen klinisch relevant probleem is.
Indien er in de toekomst nieuw wetenschappelijk bewijs komt waarin zou worden aangetoond dat MG dragerschap bij PID ook infertiliteit, extra uteriene graviditeit (EUG) en chronische buikpijnklachten veroorzaakt, dan is een specifieke behandeling voor de patiënte en ook voor de geïnfecteerde partner aangewezen. De eerste keus voor behandeling zou dan azitromycine zijn. MG is echter in toenemende mate resistent tegen azitromycine. Het aangewezen alternatief is moxifloxacine, dat meer bijwerkingen kent dan de standaard antibiotische behandeling en bovendien het reserve antibioticum is in Nederland waar overigens ook al resistentie voor is gerapporteerd (Sethi, 2017). Dit laatste is daarmee nog een reden om op dit moment geen aanpassing van het antibiotisch beleid bij MG te overwegen. Hoewel MG in een aantal ziekenhuizen automatisch, tezamen met een NAAT op Chlamydia en gonorroe, wordt bepaald bij vrouwen met PID, biedt bovenstaande redenatie dus geen aanleiding voor het bepalen van MG bij PID. Bij een positieve MG uitslag is om dezelfde redenen geen test of cure of partnerbehandeling nodig. In onderzoeksetting zou MG wel bepaald kunnen worden.
Dit is restrictiever dan de Europese richtlijn en BASHH richtlijn, waarin wel wordt geadviseerd om vrouwen met verdenking PID te testen op MG, en bij een positieve test passend te behandelen. Hier wordt dus om voorgenoemde reden van afgeweken in deze richtlijn.
Het College ter Beoordeling van Geneesmiddelen (CBG) heeft in april 2019 een waarschuwing afgegeven over het risico op schade aan spieren en het zenuwstelsel bij het gebruik van fluorochinolonen. Voor de behandeling bij PID-TOA wordt er geen aanleiding gezien de behandeling aan te passen n.a.v. deze waarschuwing.
(waarschuwing CBG: https://www.cbg-meb.nl/actueel/nieuws/2019/04/09/bij-gebruik-fluorochinolonen-verhoogd-risico-op-schade-aan-spieren-en-zenuwstelsel).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Er wordt vanuit gegaan dat patiënten optimaal, maar zeker niet onnodig willen worden behandeld voor hun klachten. Met de huidige kennis is het echter niet bekend of een maximale behandeling een optimale behandeling is.
Kosten (middelenbeslag)
Testen op MG bij patiënte en partner zal extra kosten met zich meebrengen evenals de extra antibiotische behandeling van patiënte en partner. Dit zullen zowel kosten voor de gebruikers (eigen risico), het ziekenhuis en de ziektekostenverzekeraar zijn. Het test- en behandelvoordeel is niet aangetoond.
Aanvaardbaarheid voor de overige relevante stakeholders
Er worden geen bezwaren verwacht van overige stakeholders.
Haalbaarheid en implementatie
Indien wordt overwogen om vrouwen met PID met een extra of ander antibioticum te behandelen wordt geen negatief effect verwacht op haalbaarheid en implementatie hiervan, mits het niet langer duurt dan de standaard behandeling, en niet meer bijwerkingen geeft.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Er werd in de literatuur te weinig bewijs gevonden voor een causale relatie tussen de aanwezigheid van MG voorafgaand aan de klinische diagnose PID zoals in Nederland wordt gesteld. Dit, samen met de afwezigheid van een duidelijke relatie tussen een positieve test op MG en infertiliteit, extra uteriene graviditeit (EUG) en/of chronische buikpijnklachten, levert onvoldoende reden om de huidige antibiotische behandeling van vrouwen met verdenking PID (ofloxacine en metronidazol) bij een positieve NAAT op MG, aan te passen aan een op MG gerichte behandeling (reserve antibioticum moxifloxacine.
Onderbouwing
Achtergrond
In de vorige versie van de richtlijn pelvic inflammatory disease/ tubo-ovarieel abces (PID/TOA) werd nog geen advies gegeven over het testen op Mycoplasma genitalium (MG) bij PID, maar de laatste jaren is MG in toenemende mate in de belangstelling komen staan.
In de Europese PID-richtlijn uit 2017 en de BASHH richtlijn PID 2019 https://www.bashhguidelines.org/current-guidelines/systemic-presentation-and-complications/pid-2019/ staat dat bij vrouwen met verdenking PID een NAAT (nucleic acid amplification test) op MG moet worden afgenomen, en bij een positieve test vrouwen moeten worden behandeld met een passend antibioticum. In een aantal ziekenhuizen in Nederland wordt een MG bepaling automatisch uitgevoerd en gerapporteerd aan de gynaecoloog bij een aanvraag op een NAAT voor Chlamydia en gonorroe.
Aanvankelijk werd MG als een nieuwe SOA beschouwd na buitenlandse bevindingen (waaronder ontwikkelingslanden) in hoog-risico populaties. Deze overtuiging lijkt inmiddels te zijn afgezwakt, omdat bij studies in laag-risico populaties de relatie tussen MG en PID minder duidelijk naar voren lijkt te komen. Dit laatste is voor de Nederlandse praktijk belangrijk, omdat juist vrouwen uit een laag risico populatie worden gezien op de polikliniek gynaecologie. Het is daarom van belang om eerst de literatuur te beoordelen over de relatie tussen MG dragerschap en het optreden van PID en dit in een Nederlands perspectief te plaatsen. Op basis van deze kritische beoordeling moet vervolgens worden afgewogen of dit aanleiding geeft om de huidige antibiotische behandeling bij vrouwen met verdenking PID met een positieve NAAT op MG aangepast moet worden.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Bij vrouwen met een positieve test op Mycoplasma genitalium lijkt PID vaker gerapporteerd te worden dan bij vrouwen bij wie geen Mycoplasma genitalium wordt aangetoond.
Bronnen: (Lis, 2015; Oliphant, 2016; Taylor, 2018) |
Samenvatting literatuur
Beschrijving studies
Lis (2015) verrichtte een systematische review en meta-analyse naar de associatie tussen een Mycoplasma genitalium (MG) infectie en aandoeningen aan de vrouwelijke geslachtsorganen, waaronder pelvic inflammatory disease (PID). De search werd verricht op 25 juni 2014 in Medline, Embase, Biosis en Cochrane Library. Daarnaast werden de referentielijsten van de geïdentificeerde artikelen gecontroleerd. Er werden in totaal 10 studies geïncludeerd, waarvan 5 cohort studies (Haggerty, 2008; Lind, 1987; Oakeshott, 2010; Taylor-Robinson, 2012; Vandepitte, 2012) en 5 case-control studies (Bjartling, 2010; Bjartling, 2012; Cohen, 2002; Jurstrand, 2007; Simms, 2003). De geïncludeerde studies beschreven veelal vrouwen die zich met klachten presenteerden in het ziekenhuis of (SOA-) polikliniek (Bjartling, 2012; Cohen, 2002; Haggerty, 2008; Jurstrand, 2007; Lind, 1987; Simms, 2003; Taylor-Robinson, 2012). Bjartling (2010) beschreef een populatie vrouwen met een verzoek tot abortus. Oakshott (2010) beschreef het voorkomen van MG en PID in een cohort van seksueel actieve studentes ≤ 27 jaar; Vandepitte (2012) beschreef dit in een populatie sekswerkers. Zeven studies detecteerden MG op basis van PCR (polymerasekettingreactie) (Bjartling, 2010; Bjartling, 2012; Cohen, 2002; Haggerty, 2008; Oakeshott, 2010; Simms, 2003; Vandepitte, 2012), twee studies op basis van serologie (Jurstrand, 2007; Lind, 1987) en 1 studie rapporteerde zowel de resultaten voor PCR als voor serologie (Taylor-Robinson, 2012). Omdat het bepalen van MG op basis van serologie als onbetrouwbaar wordt beschouwd in de Nederlandse praktijk, werden de studies van Jurstrand (2007) en Lind (1987) niet opgenomen in de analyse.
Oliphant (2016) verrichtte een cross-sectionele cohortstudie waarin werd gekeken naar het voorkomen van PID bij vrouwen die werden onderzocht in een SOA polikliniek (n=261). Om de sample size berekening te halen werden daarnaast ook vrouwen met de diagnose PID geïncludeerd die gedurende de studieperiode hiervoor werden behandeld (n=82). In totaal werden 343 vrouwen geïncludeerd, waarvan 91 vrouwen met PID (gemiddelde leeftijd 24,5 jaar (range 16 tot 45)) en 252 vrouwen zonder PID (gemiddelde leeftijd 28,2 jaar (range 16 tot 57)). Het voorkomen van seksueel overdraagbare aandoeningen was als volgt voor vrouwen met en zonder PID: MG (9,9 versus 8,7%), C. trachomatis (27,5 versus 9,9%), N. gonorrhoeae (5,5% versus. 2%), Trichomonas vaginalis (3,2 versus 5,5%). Een infectie met MG werd vastgesteld op basis van PCR. Multivariate logistische regressieanalyses tussen MG en PID werden gecorrigeerd voor leeftijd, etniciteit, het hebben van een nieuwe seksuele partner en de aanwezigheid van een C. trachomatis infectie op basis van de resultaten uit univariate logistische regressie analyses.
Taylor (2018) verrichtte een secundaire data-analyse van een prospectieve cohortstudie waarin vrouwen met (of risico op) een SOA, maar zonder tekenen van een PID werden gevolgd. De vrouwen waren geworven uit drie SOA poliklinieken. Het doel van deze studie was om te kijken naar het voorkomen van MG en endometritis, dat werd beschouwd als een indicator van PID. In totaal werden 246 vrouwen geïncludeerd, waarvan het bij 135 vrouwen ook bekend was of ze endometritis hadden. Er werd niet getoetst voor mogelijke verschillen in populatiekenmerken tussen de populaties met en zonder uitkomstdata. Het was onbekend wat de gemiddelde leeftijd was. In totaal hadden 46 van de 135 vrouwen endometritis (34,1%). Het voorkomen van seksueel overdraagbare aandoeningen was als volgt voor vrouwen met en zonder endometritis: MG (32,6 versus. 7,9%), C. trachomatis (39,1% versus onbekend), N. gonorrhoeae (4,3% versus onbekend), T. vaginalis (15,2% versus onbekend). Een infectie met MG werd vastgesteld op basis van PCR. Multivariate Poisson regressieanalyse tussen MG en endometritis (PID) werden gecorrigeerd voor etniciteit, een C. trachomatis infectie, een N. gonorrhoeae infectie en bacteriële vaginose op basis van de resultaten uit univariate regressie analyses.
Resultaten
1. Diagnose PID ja/nee
Eén meta-analyse van 8 studies (Lis, 2015) en twee cohortstudies (Oliphant, 2016; Taylor, 2018) beschreven de uitkomstmaat diagnose PID ja/nee. Alle studies rapporteerden ongecorrigeerde data en zes studies rapporteerden daarnaast ook gecorrigeerde data (Bjartling, 2010; Bjartling, 2012; Haggerty, 2008; Hay, 2016; Oliphant, 2016; Taylor, 2018). Van alle studies was de ongecorrigeerde effectschatter gerapporteerd als een odds ratio (OR) of kon het achteraf worden berekend als OR op basis van losse aantallen. Voor de gecorrigeerde data werd in 4 studies de gecorrigeerde OR gerapporteerd (Bjartling, 2010; Bjartling, 2012; Haggerty, 2008: cross-sectionele data; Oliphant, 2016) en in 2 studies het gecorrigeerde relatief risico (RR) (Haggerty, 2008: prospectieve data; Taylor, 2018). Het was daarom niet mogelijk om alle studies met gecorrigeerde data te poolen in één meta-analyse doordat er verschillende effectschatters werden gerapporteerd. De gehanteerde definities van de diagnose PID worden per studie beschreven in tabel 1.
Bij vrouwen met een MG infectie werd een grotere kans gerapporteerd op het ontwikkelen van PID vergeleken met vrouwen zonder MG infectie: de gepoolde OR was 2,64 (95%BI 1,67 tot 4,19) op basis van ongecorrigeerde data uit alle studies (Figuur 1). Op basis van gecorrigeerde data werd hetzelfde risico gerapporteerd voor beide type effectschatters: gecorrigeerde gepoolde OR 2,59 (95%BI 1,04 tot 6,47) (Figuur 2) en gecorrigeerde gepoolde RR 2,76 (95%BI 1,04 tot 7,33) (Figuur 3).
Er werd een sensitiviteitsanalyse uitgevoerd waarin louter studies werden geïncludeerd waarvan met zekerheid kan worden gesteld dat de MG infectie vooraf aan de (eventuele) PID had plaats gevonden én de definitie van PID overeenkomt met de klinische diagnose zoals deze in Nederland wordt gesteld. In deze analyse blijft alleen de studie van Oakeshott (2010) over, waarin de incidentie van PID bij vrouwen met een positieve test op MG 3,9% (3/77 vrouwen) was vergeleken met 1,7% bij vrouwen zonder MG (36/2169 vrouwen) (ongecorrigeerd RR 2,35; 95%BI 0,74 tot 7,46).
Tabel 1. Beschrijving uitkomstmaat diagnose PID per studie
|
Auteur (jaartal) |
Diagnose PID |
|
Bjartling (2010), Bjartling (2012) |
Onderbuikpijn, gevoeligheid van de cervix, uterus of adnex(en) tijdens bimanueel onderzoek, tezamen met één van de volgende kenmerken: pathologisch nat preparaat, pussige afvloed uit het endocervicale kanaal, verhoogd CRP >8 of koorts >38 graden Celsius. |
|
Cohen (2002) |
Aanwezigheid van endometritis, gedefinieerd als de aanwezigheid van ten minste één plasmacel in het endometrium- of cervixstroma per 120x vergroot microscopisch veld. |
|
Haggerty (2008) |
Aanwezigheid van endometritis: ≥5 neutrofielen in het oppervlakte epitheel per 400x vergroot microscopische veld, afwezigheid van menstrueel endometrium en/of ≥2 stromale plasmacellen per 120x vergroot microscopisch veld. |
|
Hay (2016) |
Op basis van aangepaste klinische criteria van Hager en van de richtlijnen van het Centers for Disease Control and Prevention (niet nader toegelicht) |
|
Oakeshott (2010) |
Pijn onder in de buik, cervicale bewegingspijn en drukpijnlijke uterus of adnex(en). |
|
Oliphant (2016) |
Op basis van een internationaal erkende definitie: recent ontstane pijn onder in de buik met tenminste cervicale bewegingspijn of een pijnlijke uterus of pijnlijke fornices bij bimanueel onderzoek. |
|
Simms (2003) |
Aanwezigheid van pijn onder in de buik, gevoeligheid van de adnex(en), gevoeligheid bij beweging van cervix of uterus. |
|
Taylor (2012) |
Aanwezigheid van salpingitis (laparoscopisch bevestigd) |
|
Taylor (2018) |
Aanwezigheid van endometritis (het was niet mogelijk PID diagnose te stellen, endometritis was indicatie van PID). |
|
Vandepitte (2012) |
Pijn onder in de buik en/of dyspareunia (bevestigd tijdens bimanueel onderzoek). |
Figuur 1. Forest plot van het risico op PID bij vrouwen die positief zijn getest op MG vergeleken met vrouwen die geen MG hebben, op basis van ongecorrigeerde data
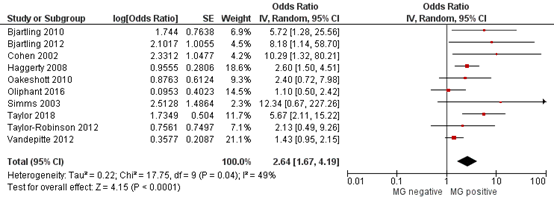
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 2. Forest plot van het risico op PID bij vrouwen die positief zijn getest op MG vergeleken met vrouwen die geen MG hebben, op basis van gecorrigeerde data (odds ratio’s)
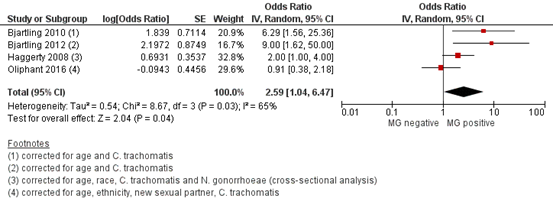
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 3. Forest plot van het risico op PID bij vrouwen die positief zijn getest op MG vergeleken met vrouwen die geen MG hebben, op basis van gecorrigeerde data (risk ratio’s)
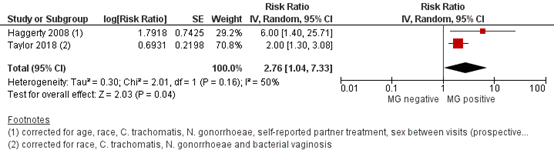
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Prognostische studies beginnen op een hoog niveau van bewijs. De bewijskracht voor de uitkomstmaat diagnose PID ja/nee is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: er is risico op selectiebias in de studies van Lis (2015), Oliphant (2016) en Taylor (2018)), met één niveau wegens heterogeniteit in de gehanteerde definities van PID tussen de studies en met één niveau wegens heterogeniteit in de geïncludeerde populatie (hoog en laag risicopopulaties). Hierdoor kwam de bewijskracht uit op zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de voorspellende waarde van een Mycoplasma genitalium (MG) infectie voor het ontwikkelen van pelvic inflammatory disease (PID) bij vrouwen bij wie een MG bepaling wordt gedaan?
P: vrouwen bij wie MG bepaling wordt gedaan;
I: aanwezigheid voorspellende factor: MG positief;
C: afwezigheid voorspellende factor: MG negatief;
O: diagnose PID ja/nee.
Relevante uitkomstmaten
De werkgroep achtte de diagnose van PID ja/nee een voor de besluitvorming cruciale uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hield de GRADE default grenzen (25% voor dichotome uitkomstmaten en 0,5 SD voor continue uitkomstmaten) aan als een klinisch (patiënt) relevant verschil (Schünemann, 2013)
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 3 april 2019 met relevante zoektermen gezocht naar systematische reviews en meta-analyses, randomized controlled trials (RCT’s) en observationele studies waarin gekeken werd naar de associatie tussen MG en PID bij vrouwen die getest werden op MG. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 86 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: 1) populatie bestaande uit patiënten met of zonder klachten die getest werden op MG infectie; 2) er werd een multivariate analyse uitgevoerd waarin de associatie tussen de prognostische factor ‘MG-infectie’ en de uitkomst ‘PID’ werd bestudeerd. Op basis van titel en abstract werden in eerste instantie 26 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 23 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies definitief geselecteerd.
Resultaten
Eén systematische review en meta-analyse en twee observationele cohortstudies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bjartling C, Osser S, Persson K. Mycoplasma genitalium in cervicitis and pelvic inflammatory disease among women at a gynecologic outpatient service. Am J Obstet Gynecol 2012; 206:476.e1–8.
- Bjartling C, Osser S, Persson K. The association between Mycoplasma genitalium and pelvic inflammatory disease after termination of pregnancy. BJOG 2010; 117:361–4.
- Cina M, Baumann L, Egli-Gany D, Halbeisen FS, Ali H, Scott P, Low N. Mycoplasma genitalium incidence, persistence, concordance between partners and progression: systematic review and meta-analysis. Sex Transm Infect. 2019 Aug;95(5):328-335.
- Cohen CR, Manhart LE, Bukusi EA, et al. Association between Mycoplasma genitalium and acute endometritis. Lancet 2002; 359:65–6.
- Haggerty CL, Totten PA, Astete SG, Lee S, Hoferka SL, Kelsey SF, Ness RB. Failure of cefoxitin and doxycycline to eradicate endometrial Mycoplasma genitalium and the consequence for clinical cure of pelvic inflammatory disease. Sex Transm Infect. 2008 Oct;84(5):338-42.
- Jurstrand M, Jensen JS, Magnuson A, Kamwendo F, Fredlund H. A serological studyof the role of Mycoplasma genitalium in pelvic inflammatory disease and ectopic pregnancy. Sex Transm Infect 2007; 83:319–23.
- Lind K, Kristensen GB. Significance of antibodies to Mycoplasma genitalium in salpingitis. Eur J Clin Microbiol 1987; 6:205–7.
- Lis R, Rowhani-Rahbar A, Manhart LE. Mycoplasma genitalium infection and female reproductive tract disease: a meta-analysis. Clin Infect Dis. 2015 Aug 1;61(3):418-26.
- Oakeshott P, Aghaizu A, Hay P, Reid F, Kerry S, Atherton H, Simms I, Taylor-Robinson D, Dohn B, Jensen JS. Is Mycoplasma genitalium in women the "New Chlamydia?" A community-based prospective cohort study. Clin Infect Dis. 2010 Nov 15;51(10):1160-6.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Sethi S, Zaman K, Jain N. Mycoplasma genitalium infections: current treatment options and resistance issues. Infect Drug Resist. 2017 Sep 1;10:283-292.
- Simms I, Eastick K, Mallinson H, et al. Associations between Mycoplasma genitalium, Chlamydia trachomatis, and pelvic inflammatory disease. Sex Transm Infect 2003; 79:154–6.
- Taylor-Robinson D, Jensen JS, Svenstrup H, Stacey CM. Difficulties experienced in defining the microbial cause of pelvic inflammatory disease. Int J STD AIDS 2012; 23:18–24.
- Vandepitte J, Bukenya J, Hughes P, et al. Clinical characteristics associated with Mycoplasma genitalium infection among women at high risk of HIV and other STI in Uganda. Sex Transm Dis 2012; 39:487–91.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Estimates of prognostic effect |
Comments |
|
Lis, 2015
(individual study characteristics deduced from (1st author, year of publication)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of (cohort / case-control studies)
Literature search up to (June 25th 2014)
A: Lind, 1987 B: Cohen, 2002 C: Simms, 2003 D: Jurstrand, 2007 E: Haggerty, 2008 F: Bjartling, 2010 G: Oakeshott, 2010 H: Bjartling, 2012 I: Taylor-Robinson, 2012 J: Vandepitte, 2012
Study design: A: cohort (cross-sectional) B: case-control C: case-control D: case-control E: cohort (cross-sectional and prospective cohort) F: case-control G: cohort H: case-control I: cohort (cross-sectional) J: cohort (cross-sectional)
Setting and Country: A: Denmark B: Kenya C: England D: Sweden E: USA F: Sweden G: London, UK H: Sweden I: London, UK J: Uganda
Source of funding and conflicts of interest: L. E. M. has received grants from the National Institutes of Health; reagents and test kits from Hologic Gen-Probe; study drugs from Pfizer, Inc; honoraria for scientific advisory board membership from Qiagen, Inc, and Hologic Inc; and honoraria for lectures from the American Sexual Health Association. All other authors report no potential conflicts. All authors have submitted the ICMJE Form for Disclosure of Potential Conflicts of Interest. Conflicts that the editors consider relevant to the content of the manuscript have been disclosed. |
Inclusion criteria SR: Using preestablished criteria, studies were included if they (1) reported data from an original peer-reviewed study; (2) employed across-sectional, cohort, or case-control design; (3) provided adequate description of the assay used; (4) defined the outcome with sufficient detail to evaluate comparability with other studies; (5) reported sufficient data to determine the association with reproductive tract syndromes; and (6) were published in English
Exclusion criteria SR: Studies were excluded if they reported on the development of laboratory assays, studied genomics, constituted case series or animal studies, had no comparison group, or reported only prevalence. Clinical guidelines, editorials, and letters were also excluded, as well as conference abstracts given their preliminary nature and limited information about study design.
10 studies included on MG and PID
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 62 B: 58 cases, 57 controls C: 45 cases, 37 controls D: 193 cases, 246 controls E: CS: 502; cohort: 586 F: 49 cases, 168 controls G: 2246 H: 81 cases, 317 controls I: 109 J: 972
Sex: 100% Female
Groups comparable at baseline? Unclear, not reported. |
Describe prognostic factor(s) and method of measurement:
Prognostic factor was in all studies MG infection yes/no.
Method of measurement: A: serology (titre ≥80) B: PCR C: PCR D: Serology (LAMP-EIA) E: PCR F: PCR G: PCR H: PCR I: PCR and serology J: PCR
|
Duration or endpoint of follow-up: not rerported per study.
For how many participants were no complete outcome data available? N (%): not reported per study.
Reasons for incomplete outcome data described? Not reported per study. |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
Prognostic factor: MG infection: Unadjusted effect estimate per individual study (OR or RR (95%CI)): A: OR 0.23 (95% CI: 0.01, 4.70) B: OR 10.29 (95% CI: 1.32, 458.62) C: OR ∞ (95% CI: 1.41, ∞) D: OR 1.2 (95% CI: 0.69-2.08) E: OR 2.6 (95% CI: 1.5, 4.6) F: OR 5.72 (95% CI: 1.28, 28.53) G: RR 2.35 (95% CI: 0.74, 7.46) H: OR 8.18 (95% CI: 1.14, 91.31) I: PCR OR 2.13 (95% CI: 0.31, 10.99); Antibodies OR 2.24 (95% CI: 0.75, 6.54) J: OR 1.43 (95% CI: 0.95, 2.15)
Adjusted effect estimate per individual study (OR or RR (95%CI)), including covariates: A: not studied B: not studied C: not studied D: AOR 1.0 (95% CI: 0.6-1.7); covariates: Age, CT E: CS: AOR 2.0 (95% CI: 1.0, 4.2); covariates: CS: Age, race, NG, CT. Cohort: ARR 6.0 (95% CI: 1.4, 27.1); covariates: Cohort: Age, NG, CT, race, self-reported partner treatment, sex between visits. F: AOR 6.29 (95% CI: 1.56, 25.2) G: not studied H: AOR 9.00 (95% CI: 1.62, 49.89) I: not studied J: not studied
Adjusted pooled effect estimate (crude effect estimate in all other cases*) (OR (95%CI)): 2.14 (95% CI, 1.31–3.49) I2 =51.3% (95% CI, .0%–76.3%)) but no significant publication bias (Begg P=.98; Egger P=.055)
*analysis with corrected/ uncorrected data did not significantly differ.
Excluding studies that used serology, the pooled OR was 2.73 (95% CI, 1.60–4.66) (Supplementary Appendix Figure 5) with moderate between study heterogeneity (I2 =42.2% (95% CI, .0%–74.4%)). Among studies that accounted for coinfections (20, 41–43), the pooled OR was 2.53 (95% CI, 1.03–6.26) with moderate between-study heterogeneity (I2 =73.0% (95% CI, 24.0%–90.4%)).
Incremental predictive value1: not reported. |
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Abbreviations: MG= mycoplasma genitalium; PCR= polymerase chain reaction; PID= pelvic inflammatory disease
Evidence table for prognostic factor studies
Research question:
Pre-defined core set of confounders:
1. high risk population (sex workers, HIV infection et cetera)
2. co-infections (Chlamydia, gonorrhoea etc.)
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Estimates of prognostic effect |
Comments |
|
Oliphant, 2016 |
Type of study: cross-sectional cohort study
Setting and country: STD clinic, New Zealand
Funding and conflicts of interest: This work was supported by a grant obtained from the Auckland District Health Board. No conflicts of interest declared. |
Inclusion criteria: all consecutively attending women across an 8-week period were invited to participate in the study if they required a screen for STIs. If the woman consented, an extra swab for the detection of M. genitalium was obtained in order to establish the baseline prevalence in this population as previously reported. In order to investigate the association of M. genitalium with PID, recruitment continued of additional women with a clinical diagnosis of PID until a sufficient sample size was obtained to enable a comparative analysis.
Exclusion criteria: women were not eligible to participate if they were aged less than 16 years of age ; had not been sexually active in the past 3 months ;had taken antibiotics within the previous 2 weeks; were pregnant or had undergone any cervical procedure within the past month; had declined a speculum examination; or had had a hysterectomy or their cervix could not be located during the examination. There was one additional exclusion criterion relating to a diagnosis of PID, namely: women with a history of abdominal pain for longer than 1 month
N= 343 (91 PID+; 252 PID-)
Mean age ± SD: PID+: 24.5 (range 16–45) PID-: 28.2 (range 16–57)
Sex: 0% M / 100% F
Potential confounders or effect modifiers: MG infection: PID+: 9 (9.9%) PID-: 22 (8.7%)
Chlamydia infection: PID+: 25 (27.5%) PID-: 25 (9.9%)
Neisseria gonorrhoea infection: PID+: 5 (5.5%) PID-: 5 (2%)
Trichomonas vaginalis: PID+: 8 (3.2%) PID-: 5 (5.5%) |
Describe prognostic factor(s) and method of measurement:
Prognostic factor of interest: MG infection
Method of measurement: Cervical swabs for M. genitalium detection were initially refrigerated at 4 degrees C in the clinics before being transported to the laboratory and stored at 80degrees C. At completion of recruitment, swabs were transported on dry ice to the Royal Women’s Hospital in Melbourne for analysis. M. genitalium was detected as previously described16 by use of a qualitative polymerase chain reaction assay (LC480 real-time instrument; Roche Diagnostics, Indianapolis, IN, USA).
|
Duration or endpoint of follow-up: NA, cross-sectional
For how many participants were no complete outcome data available? N (%): 2 people had missing data for Trichomonas vaginalis infection, both PID-. All other data was complete.
Reasons for incomplete outcome data described? No |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
Incremental predictive value1:
Unadjusted OR (95%CI): MG: 1.1 (0.5–2.6); P=0.740
Adjusted OR (95%CI): MG: 0.91 (0.38–2.20); P=0.84 Covariates: age (P<0.05); ethnicity (P<0.05); New sexual partner (P>0.05); Chlamydia infection (P<0.05)
|
Diagnosis of PID: The internationally recognised definition of a clinical diagnosis of PID was used; namely, a history of recent onset of lower abdominal pain with additional minimum findings of either cervical motion tenderness or uterine or forniceal tenderness on bimanual examination |
|
Taylor, 2018 |
Type of study: secondary data analysis of prospective cohort study
Setting and country: three urban outpatient clinics, USA
Funding and conflicts of interest: SLH received funding from Becton Dickinson and Cepheid, which market products for the detection of STIs. All other authors have no conflicts to disclose. |
Inclusion criteria: Eligibility criteria included mucopurulent cervicitis, diagnosis of chlamydial infection prior to treatment or reported sexual contact with an individual with a recent diagnosis of chlamydial urethritis or non-gonococcal urethritis.
Exclusion criteria: Women with PID according to the Centers for Disease Control and Prevention guidelines were excluded
N= 246
Mean age ± SD: MG+: 21±2.4 years MG-: not reported
Sex: 0% M / 100% F
Potential confounders or effect modifiers: Among n=135 women with histological data on endometritis: MG+: Endometritis+: 15/46 (32.6%) Endometritis-: 7/89 (7.9%)
Chlamydia+: Endometritis+: 18/46 (39.1%) Endometritis-: not reported. Bacterial vaginosis+: Endometritis+: 23/46 (50%) Endometritis-: not reported. T. vaginalis+: Endometritis+: 7/46 (15.2%) Endometritis-: not reported. N. gonorrhoeae+: Endometritis+: 2/46 (4.3%) Endometritis-: not reported.
|
Describe prognostic factor(s) and method of measurement:
Prognostic factor of interest: MG infection.
Method of measurement: cervical, vaginal and endometrial swab samples. Nucleic acid amplification tests (NAAT) detected M. genitalium (APTIMA MG, Gen Probe). Among women positive for M. genitalium by Aptima testing, DNA was extracted using a Quick-DNA Universal Kit (Zymo Research, Irvine, California, USA) from 100 μL to 300 μL of reserved cervical swab eluates to quantify M. genitalium burden, strain typing and detection of 23S rRNA alleles. The abundance of M. genitalium DNA was determined by quantitative PCR with SsoAdvanced SYBR mix (Bio-Rad) using primers directed against the highly conserved MG190 locus16 using a CFX iCycler (Bio-Rad) in duplicate. Primer design ( M. genitalium 190 Forward: GAGA TCAG GATA GAAC TGAG GAGTA, M. genitalium 190 Reverse: TGAT CGCT CCAC TTGC ATTAT) was based on the genome sequence of M. genitalium strain G37, GenBank Accession #NC_000908.2. Nested PCR amplified a fragment of mgpB for genotyping and region V of the 23S rRNA locus where macrolide resistance mutations accumulate.17 PCR cycling parameters were: one cycle of 98°C for 3 min, 38 cycles of 98°C for 30 s, 58°C for 30 s and 72°C for 30 s, followed by one cycle of 72°C for 3 min using Phusion Flash High-Fidelity PCR master mix (Thermo Scientific, Waltham, Massachusetts, USA). The resultant PCR products were cleaned and concentrated using a ‘DNA Clean and Concentrator-5 ’ kit (Zymo Research) prior to sequencing. Sequencing results were analysed using Clone Manager (Scientific & Educational Software, Denver, Colorado, USA) and Geneious (Auckland, New Zealand). |
Duration or endpoint of follow-up: mean duration of follow-up was not reported. Follow-up questionnaires were filled in at 1, 4, 8 and 12 months, addressing the participant’s interim medical and sexual history. Vaginal fluid and vaginal and cervical swabs were collected at each follow-up visit for STI and BV diagnosis.
For how many participants were no complete outcome data available? N (%): 111 (45.1%), number of women without histological data on endometritis.
Reasons for incomplete outcome data described? No. |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available):
Incremental predictive value1: not reported.
Among n=135 women with complete histological data on endometritis
Unadjusted RR (95%CI): MG: 2.5 (1.3 to 4.6); P=0.004
Adjusted RR (95%CI): Covariates: race, chlamydia, gonorrhoea and bacterial vaginosis
Additional analysis with: Adjusted RR (95%CI): MG for women with co-infection (chlamydia or gonorrhoeae): 1.9 (1.1 to 3.6); P=0.04 Covariates: race, bacterial vaginosis
|
PID diagnosis: none, histological endometritis was regarded as an indicator of pelvic inflammatory disease. |
1 Incremental predictive value is the predictive value beyond standard demographic factors and the established risk factors (for example smoking, blood pressure, lipid levels, diabetes, cancer stage, et cetera), for example change in c-statistic
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Lis, 2015 |
Yes |
Yes |
Yes, see supplementary data, figure 3. |
Yes, see supplementary data, table 2 |
No, data should at least be corrected for high-risk populations, such as HIV patients, and data should be corrected for Chlamydia or Gonorrhoea infections. Most studies were not corrected, or only corrected for some factors. |
Yes, an adaptation of the Cochrane Collaboration’s domain-based approach for randomized controlled trials was used. |
Unclear, description of included population is not elaborate enough to decipher whether pooling is justified with regard to high risk populations, such as sex workers or people with HIV infections. Sensitivity analysis were performed based on type of assay and for studies that accounted for coinfections. |
No, quality of individual studies was reported, but not studied in sensitivity analysis. |
No, conflict of interest for individual studies not reported. Potential conflict of interest for author of review Lis, 2015. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of quality assessment - prognostic factor (PF) studies
Based on: QUIPSA (Haydn, 2006; Haydn 2013)
|
Study reference
(first author, year of publication) |
Study participation1
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition2
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement3
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement3
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding4
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting5
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Oliphant, 2016 |
High risk, patients recruited at STD clinic. In addition, patients with known PID were included to boost sample size of patients with PID+. |
Low risk |
Low risk |
Low risk |
Low risk, appropriate adjustment for coinfection with Chlamydia. Other coinfections were not significantly associated with PID in univariate analysis. |
Low risk. |
|
Taylor, 2018 |
High risk, patients were recruited at outpatient clinics who were at risk or infected with Chlamydia. In addition, almost 50% of the sample did not have histological data for outcome present and were excluded for analysis. Not tested for differences |
Unclear |
Low risk |
Moderate risk, outcome is not PID but endometritis, which is considered an indication of PID but not a definite diagnosis |
Low risk, appropriate adjustment for coinfection with Chlamydia, N. gonorrhoeae of bacterial vaginosis, |
Low risk. |
1 Adequate description of: source population or population of interest, sampling and recruitment, period and place of recruitment, in- and exclusion criteria, study participation, baseline characteristics.
2 Adequate response rate, information on drop-outs and loss to follow-up, no differences between participants who completed the study and those lost to follow-up.
3 Method of measurement is valid, reliable, setting of measurement is the same for all participants.
4 Important confounders are listed, method of measurement is valid, reliable, setting of measurement is the same for all participants, important confounders are accounted for in the design (matching, stratification, initial assembly of comparable groups), or analysis (appropriate adjustment)
5 Enough data are presented to assess adequacy of the analysis, strategy of model building is appropriate and based on conceptual framework, no selective reporting.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Amirmozafari, 2009 |
Exclusie, voldoet niet aan PICO |
|
Ashshi, 2015 |
Exclusie, voldoet niet aan PICO |
|
Birger, 2017 |
Exclusie, voldoet niet aan PICO |
|
Bjartling, 2012 |
Exclusie, reeds geïncludeerd in Lis (2015) |
|
Chappell, 2012 |
Exclusie, voldoet niet aan PICO |
|
Haggerty, 2011 |
Exclusie, reeds geïncludeerd in Lis (2015) |
|
Hay, 2009 |
Exclusie, voldoet niet aan PICO |
|
Hay, 2016 |
Exclusie, dubbele van Oakshott (2010), reeds geïncludeerd. |
|
Judlin, 2009 |
Exclusie, voldoet niet aan PICO |
|
Latimer, 2019 |
Exclusie, voldoet niet aan PICO |
|
Macones, 2012 |
Exclusie, voldoet niet aan PICO |
|
Manhart, 2013 |
Exclusie, voldoet niet aan PICO |
|
McGowin, 2011 |
Exclusie, voldoet niet aan PICO |
|
Oakeshott, 2010 |
Exclusie, reeds geïncludeerd in Lis (2015) |
|
Ona,2016 |
Exclusie, geen systematische review (narrative review) |
|
Refaat, 2016 |
Exclusie, voldoet niet aan PICO |
|
Ross, 2009 |
Exclusie, voldoet niet aan PICO |
|
Short, 2009 |
Exclusie, voldoet niet aan PICO |
|
Short, 2010 |
Exclusie, voldoet niet aan PICO |
|
Taylor, 2011 |
Exclusie, voldoet niet aan PICO |
|
Taylor-Robinson, 2012 |
Exclusie, reeds geïncludeerd in Lis (2015) |
|
Weinstein, 2011 |
Exclusie, geen systematische review (narrative review) |
|
Wiesenfeld, 2017 |
Exclusie, voldoet niet aan PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-03-2020
Beoordeeld op geldigheid : 22-04-2020
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Mycoplasma en PID |
NVOG |
2020 |
2025 |
2-jaarlijks |
NVOG |
Veranderingen in antibiotische behandelingen voor MG. Veranderingen in causaliteit tussen MG en PID, en fertiliteit, EUG en chronische buikpijn |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnmodule is ter goedkeuring/geen bezwaar voorgelegd aan:
- Nederlands Huisartsen Genootschap
- Stichting Bekkenbodem4All
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. A. Timmermans, gynaecoloog, NVOG (voorzitter werkgroep (proces))
- Dr. P.J.M. van Kesteren, gynaecoloog, NVOG (inhoudelijk voorzitter)
- Dr. H.S. Kok, gynaecoloog, NVOG
- M. Bosch, patiëntvertegenwoordiger, Bekkenbodem4All
Klankbordgroep
- Drs. L. Verlee, wetenschappelijk medewerker, NHG
- Dr. H. Berkhout, arts-microbioloog, NVMM
- Dr. C. van der Leij, (interventie)radioloog, NVvR
Met ondersteuning van
- Dr. E.J.M. den Breejen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 15 juni 2019)
- Dr. A. Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. Wessels, MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hanneke Berkhout (klankbordgroep), NVMM |
arts-microbioloog Canisius-Wilhemina Ziekenhuis Nijmegen |
Vakdeskundige Raad van Accreditatie betaald. |
Geen |
Geen |
|
Bosch |
Stichting Bekkenbodem4All: PR/Communicatie en belangenbehartiging |
Fotograaf Bisdom Groningen-Leeuwarden, deels betaald, deels vrijwilliger Bestuur Dutch Foundation for Ladakhi Nuns: onbetaald PR medewerker Stichting Uit De Kunst, Zuidhorn: onbetaald" |
Geen |
Geen |
|
Kesteren |
Gynaecoloog |
Geen |
Geen |
Geen |
|
Kok |
Gynaecoloog Alrijne Ziekenhuis Leiden en LUMC Leiden |
Geen |
Geen |
Geen |
|
van der Leij (klankbordgroep NVvR) |
Interventieradioloog Maastricht UMC+ |
Secretaris NVIR - onbetaald |
Geen |
Geen |
|
Timmermans |
Gynaecoloog werkzaam bij Amsterdam UMC locatie AMC (0.4 fte) en gedetacheerd naar Bergman Vrouwenzorg Amsterdam (0.4 fte) |
Lid commissie kwaliteitsdocumenten NVOG (onbetaald) |
Mede-aanvrager op ZONMW subsidie aanvraag naar effectiviteit van insertie Mirena aansluitend aan novasure endometriumablatie (proces loopt, nog geen bericht of subsidie aanvraag is toegekend) |
Geen |
|
Verlee (klankbordgroep NHG) |
Wetenschappelijk medewerker Richtlijnontwikkeling en wetenschap, Nederland Huisartsen Genootschap, 0,6 fte. Beleidsmedewerker programma professionals, Soa Aids Nederland, 0,22 fte. |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntvertegenwoordiger als werkgroeplid te betrekken bij de ontwikkeling van deze module. De conceptmodule werd tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door de werkgroep bleek dat er een noodzaak was voor revisie van deze richtlijnmodule. Tijdens deze inventarisatie zijn er knelpunten aangedragen door relevante partijen via een schriftelijke enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews;
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek;
- ACROBAT-NRS - voor observationeel onderzoek;
- QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Op verzoek van de NVOG werden er geen indicatoren ontwikkeld bij deze module vanwege het beperken van de registratielast van medisch specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes, te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Uitgangsvraag: Wat is de voorspellende waarde van een MG infectie voor het ontwikkelen van PID bij vrouwen bij wie een MG bepaling wordt gedaan? |
|
|
Database(s): Medline, Embase |
Datum: 03-04-2019 |
|
Periode: 2009-heden |
Talen: E |
|
Database |
Zoektermen |
Totaal |
|
Medline 2009-april 2019
Engels
|
1 Mycoplasma genitalium/ or Mycoplasma Infections/ or ("m. genitalium" or mycoplasma).ti,ab,kf. (22361) 2 exp Pelvic Inflammatory Disease/ or ("Pelvic Inflammatory Disease*" or PID or adnexitis or pelvioperitonitis or salpingitis or endometritis or oophoritis or parametritis).ti,ab,kf. (17847) 3 1 and 2 (412) 4 limit 3 to (english language and yr="2009 -Current") (115) 9 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy* or meta synthes* or metasynthes* or meta ethnograph* or metaethnograph* or meta summar* or metasummar* or meta-aggregation or metareview or meta-review or overview of reviews).ti,ab,kf. or ((systematic* or scoping or umbrella or meta-narrative or metanarrative or evidence based) and (review* or overview*)).ti,kf. or ((evidence or narrative or metanarrative or qualitative) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or preferred reporting items or quadas*).ti,ab,kf. or ((systematic* or literature) adj2 review*).ti,ab,kf. or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Letter/ or (animals/ not humans/)) (413479) 10 4 and 9 (6) 11 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1844291) 12 4 and 11 (18) 13 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2872039) 14 4 and 13 (29) 15 10 or 12 or 14 (44) 18 (12 or 14) not 10 (38) |
86 |
|
Embase (Elsevier) |
(('mycoplasma genitalium'/exp OR 'mycoplasmosis'/exp OR 'm. genitalium':ti,ab OR mycoplasma*:ti,ab) AND ('pelvic inflammatory disease'/de OR 'adnexitis'/exp OR 'pelvioperitonitis'/exp OR 'pelvis abscess'/exp OR 'salpingitis'/exp OR 'pelvic inflammatory disease*':ti,ab OR pid:ti,ab OR adnexitis:ti,ab OR pelvioperitonitis:ti,ab OR salpingitis:ti,ab OR endometritis:ti,ab OR oophoritis:ti,ab OR parametritis:ti,ab) AND (english)/lim AND ((embase)/lim OR (pubmed-not-medline)/lim) AND (2009-2019)/py NOT 'conference abstract':it) AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) (6) – 3 uniek (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) OR ('major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)))) (63) – 39 uniek. |
|
