Drainage van het tubo-ovarieel abces (TOA)
Uitgangsvraag
Wat is de plaats van drainage vergeleken met een afwachtend beleid indien er een tubo-ovarieel abces (TOA) aanwezig is?
Aanbeveling
Aanbevelingen 1
Behandel patiënten met een TOA primair met antibiotische therapie.
Overweeg bij patiënten met een TOA van ≥6 cm een vroegtijdige drainage van het abces uit te voeren naast de gebruikelijke antibiotische behandeling.
Voer een abcesdrainage uit bij patiënten met onvoldoende respons op antibiotische therapie na (24 tot) 48 uur, zoals bij persisterende koorts of een verslechterende klinische conditie.
Laat de methode van drainage, transvaginaal, laparoscopisch, echo- of CT-geleid, afhangen van de lokalisatie/bereikbaarheid van het abces, de abcesgrootte, de mate van invasiviteit van de drainagemethode en de in de kliniek aanwezige mogelijkheden en expertise.
Aanbevelingen 2
Bied gedraineerd materiaal van een TOA altijd aan voor NAAT op Chlamydia en gonorroe en een banale kweek.
Neem altijd een cervicale uitstrijk af en stuur dit in voor NAAT op Chlamydia en gonorroe als dit nog niet verricht is bij vrouwen met een TOA.
Aanbevelingen 3
Pas het antibiotisch beleid aan bij patiënten met een tubo-ovarieel abces (TOA) bij uitblijvende respons op antibiotische behandeling en waarbij abcesdrainage niet mogelijk is.
Voer alleen een adnex- en/ of uterusextirpatie uit bij patiënten met een TOA waarbij abcesdrainage geen verbetering geeft of niet mogelijk is en aanpassing van het antibiotisch beleid niet leidt tot een verbetering van de situatie.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Deelvraag 1 - Drainage van het TOA
Op basis van de literatuur is er mogelijk een voordeel bij behandeling van het TOA middels echo- of CT-geleide drainage als aanvulling op antibiotica, vergeleken met vrouwen die alleen antibiotisch werden behandeld voor de kans op herstel. De sterkte van de bewijskracht van deze uitkomstmaat is volgens de GRADE-classificatie ‘laag’.
Op basis van de literatuur is het onbekend wat het effect is van echo- of CT-geleide drainage vergeleken met antibiotisch beleid op het vóórkomen van complicaties (darmlaesies, bloedingen, infectie) bij patiënten met een TOA in de acute fase.
De overall bewijskracht voor de cruciale uitkomstmaten van deelvraag 1 (drainage van het TOA) is gegradeerd als ‘zeer laag’. Dit komt doordat er geen bewijs is gevonden voor de uitkomstmaat complicaties en doordat voor de uitkomstmaat herstelduur er een risk of bias wordt vermoed voor beide studies en er mogelijk sprake is van imprecisie wegens een laag aantal patiënten in de studies.
Deelvraag 2 - diametergrootte van het TOA:
Op basis van de resultaten van de literatuuranalyse lijkt er een klinisch relevant effect te zijn van de diametergrootte van het TOA op de cruciale uitkomstmaat ‘falen van conservatieve behandeling met antibiotica/ conversie naar (chirurgische) interventie’ bij vrouwen met een TOA in de acute fase.
Er werd een gepoolde OR van 4,21 (95%BI 1,90 tot 9,34) gevonden voor de kans op het falen van conservatieve behandeling met antibiotica/ conversie naar chirurgische behandeling van het TOA voor vrouwen met een ‘grote diameter’ vergeleken met een ‘kleine diameter’ van het TOA. Deze associatie werd gevonden voor alle in de studies gehanteerde afkappunten van het TOA:
- ≥ 6 cm versus < 6 cm (Topcu, 2015);
- ≥ 6,5 cm versus < 6,5 cm (Kinay, 2016);
- ≥ 7 cm versus < 7 cm (Fouks, 2018; Köstü, 2017);
- onbekend afkappunt of definitie (Greenstein, 2013).
De overall bewijskracht voor de cruciale uitkomstmaat van deelvraag 2 (diametergrootte van het TOA) is gegradeerd als ‘laag’. Dit komt doordat er een risk of bias wordt vermoed voor drie studies met betrekking tot de selectie van patiënten en doordat er in alle studies niet voor alle verplichte confounders werd gecorrigeerd.
De vraag of men een vrouw met een TOA beter primair antibiotisch kan behandelen, of primair het abces kan draineren, blijkt onvoldoende te zijn onderzocht zodat hierover geen adviezen kunnen worden gegeven op basis van hooggradig bewijs. In de klinische praktijk worden vrouwen met een TOA in de acute fase primair behandeld met antibiotica. Het behandelen met enkel breedspectrum antibiotica is succesvol bij 34 tot 87,5% van de vrouwen met een TOA (McNeeley, 1998). Klinische respons (zich klinisch beter voelen, dalende temperatuur en daling van het CRP) wordt vaak binnen 24 tot 48 uur gezien.
In het verleden was men terughoudend met het aanpassen van de abcesbehandeling en werd langer gewacht (72 uur) met ingrijpen bij uitblijvende respons op antibiotische behandeling, veelal doordat een abcesbehandeling toentertijd een laparotomische adnex- en/of uterusextirpatie inhield. In de huidige praktijk blijkt dat bij een stagnerende of verslechterende klinische situatie niet zo lang wordt afgewacht, omdat een drainage tegenwoordig een relatief eenvoudig uit te voeren ingreep is. Daarnaast lijkt het risico op complicaties bij abcesbehandeling klein te zijn, zoals ook wordt gesuggereerd in een grote cohortstudie onder 27.000 Japanse vrouwen met PID (Shigemi, 2019). Dit, tezamen met de huidige radiologische expertise omtrent abcesdrainage en de verwachting dat abcesreductie het klinisch herstel versnelt, maakt het dan ook klinisch realistisch om de gegeven tijdsindicatie voor het ingrijpen bij uitblijvende reactie op antibiotische behandeling in te korten van 72 naar (24 tot) 48 uur.
Wanneer in uitzonderlijke gevallen drainage niet mogelijk is, wordt geadviseerd het antibiotisch beleid aan te passen, bijvoorbeeld toevoegen van gentamicine (zie de module i.v. therapie bij PID). Hiervoor kan zo nodig overleg plaatsvinden met een arts-microbioloog. Het alternatief voor drainage, een meestal laparotomisch uitgevoerde adnex- en/of uterusextirpatie, wordt in deze situatie in eerste instantie afgeraden omdat hierbij het verlies optreedt van reproductieve organen, met een hoge veronderstelde kans op complicaties als gevolg van beschadiging van omliggende weefsels. Echter, wanneer een drainage niet het beoogde resultaat heeft en patiënte zieker wordt, kan het zijn dat toch moet worden besloten tot extirpatieve chirurgie. Dit kan ook het geval zijn bij patiënten bij wie drainage niet mogelijk is en een aangepaste antibiotische behandeling geen verbetering geeft.
Vanwege het ontbreken van vergelijkende studies voor het beantwoorden van deelvraag 1 (drainage van het TOA) is het niet duidelijk welke benadering van drainage de voorkeur heeft: echogeleide punctie of laparoscopische drainage door een gynaecoloog of CT- of echogeleide punctie door een radioloog. Het is verstandig om deze keuze af te laten hangen van de bereikbaarheid van de puslokalisatie en abcesgrootte bij de patiënte, de invasiviteit van de drainagemethode, de beschikbare mogelijkheden en de aanwezige expertise.
Op basis van de literatuuranalyse van deelvraag 2 (diametergrootte van het TOA) lijkt het reëel om bij een diametergrootte van het TOA van ≥ 6 cm over te gaan op vroegtijdige drainage naast antibiotische therapie. In alle studies werd een associatie gevonden tussen een grotere diameter van het TOA en het falen van de conservatieve behandeling met antibiotica/conversie naar (chirurgische) interventie. De gehanteerde afkappunten varieerden tussen 6 en 7 cm doorsnede van het abces.
De mogelijkheden en expertise voor het uitvoeren van drainage verschillen per techniek. Een drainage kan transvaginaal echogeleide worden uitgevoerd met behulp van een naald door een gynaecoloog met ervaring met IVF-puncties. Een extra dikke naald met passende naaldgeleider die over de echoprobe moet worden geplaatst wordt geadviseerd zodat ook visceuze pus kan worden gedraineerd. Bij een palpabele abceszwelling in de fornix posterior kan transvaginaal onder narcose worden gedraineerd door middel van incisie van de zwelling. Een pigtail drain kan worden achtergelaten zodat de abcesholte kan worden gespoeld.
Ook kan door de gynaecoloog een laparoscopische drainage worden uitgevoerd. Dit kan echter beschadigingen geven van het omliggende weefsel (onder andere darmen) die door de infectie kwetsbaar zijn geworden en verkleefd zijn geraakt met het abces. Dit is echter geen reden om op voorhand deze ingreep niet uit te voeren, maar wel een advies om bij een ‘frozen pelvis’ in deze fase geen uitgebreide adhesiolyse te verrichten.
Een (interventie-)radiologische, echo- of CT-geleide transabdominale of transgluteale drainage is een weinig invasieve, veilige en effectieve drainagemethode die bijna altijd onder lokale verdoving kan worden uitgevoerd. De manier van draineren en route is afhankelijk van de anatomie en lokale expertise. Er kan een (pigtail) drainage catheter worden geplaatst met verschillende diameters, afhankelijk van de viscositeit van het materiaal en ten behoeve van het spoelen van de holte. Bij obstructie van de drain is deze eenvoudig te verwisselen.
Drainage materiaal dient altijd te worden ingestuurd voor banale kweek, omdat dit afkomstig is uit de in principe steriele intra-abdominale holte, en hieruit gekweekte micro-organismen als verantwoordelijk kunnen worden beschouwd voor de infectie. Daarbij dient naast de intravaginale/cervicale afname, het drainage materiaal ook te worden aangeboden voor een NAAT (nucleic acid amplification test) voor onderzoek op gonorroe en Chlamydia, omdat deze verwekkers soms niet gelijktijdig op de verschillende locaties in de tractus genitalis aantoonbaar zijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een vlot herstel met weinig kans op complicaties en het behoud van reproductieve organen worden als de belangrijkste doelen voor de patiënte beschouwd. De afweging tussen vlotter herstel en mogelijke complicaties lijken in het voordeel te zijn van abcesdrainage, maar hier is slechts laaggradig bewijs voor en dit is niet voorgelegd aan een patiëntenpanel.
In de praktijk blijkt dat vrouwen met een klein abces vaak vlot opknappen met alleen antibiotica en dat vrouwen met grotere abcessen een langzamer herstel kennen, waarbij nu dan ook vroegtijdige drainage (bij een abces > 6cm in diameter) wordt aanbevolen.
Bij het ontbreken van verbetering ondanks antibiotische behandeling dwingt de kliniek vaak tot drainage die in de klinische praktijk weinig complicaties kent. Het is belangrijk dat de vrouw voorafgaande aan de behandeling geïnformeerd wordt over de mogelijke complicaties (bloeding, laesie aangrenzende structuren) en de kans dat deze vóórkomen. Op basis van de literatuur is het onbekend wat het effect is van wel (of geen) drainage van het TOA op fertiliteitsuitkomsten van de vrouw. Vanwege het verlies van reproductieve organen en de veronderstelde hoge kans op complicaties moet het uitvoeren van extirpatieve chirurgie (verwijdering van uterus en/of adnex(a)) worden vermeden, tenzij dit niet anders kan. In uitzonderlijke gevallen zou dit kunnen vóórkomen bij vrouwen bij wie abcesdrainage niet mogelijk is of niet het gewenste effect heeft en aanpassing van het antibiotisch beleid geen verbetering geeft.
Kosten (middelenbeslag)
Een vlotter herstel door drainage zou mogelijk tot een verkorting van de ziekenhuisopname en ziekteverzuim kunnen leiden. Wetenschappelijke onderbouwing hiervoor ontbreekt, er is tot dusver geen (kosten)effectiviteitsanalyse voor dit onderwerp gedaan.
Aanvaardbaarheid voor de overige relevante stakeholders
Er wordt niet verwacht dat er relevante bezwaren van overige relevante stakeholders zijn.
Haalbaarheid en implementatie
Indien er wordt gekozen voor drainage zal de keuze voor de techniek, naast de bereikbaarheid van de puslokalisatie en abcesgrootte bij de patiënte, ook afhangen van de beschikbare middelen en expertise van zowel de gynaecoloog als de radioloog. Een drainage kan transvaginaal echogeleide worden uitgevoerd met behulp van een naald door een gynaecoloog met ervaring met IVF-puncties, of een palpabele zwelling in Douglas kan transvaginaal onder narcose worden geïndiceerd. Ook kan het abces laparoscopisch worden gedraineerd. De gynaecologische expertise en/of beschikbare hulpmiddelen zullen echter niet in elk ziekenhuis aanwezig zijn, wat de haalbaarheid van deze interventie kan verlagen. In verband met toegenomen (interventie-)radiologische expertise worden abcessen tegenwoordig vaak primair door de radioloog gedraineerd onder CT of echoscopische beeldvorming. Deze techniek is nu in de meeste ziekenhuizen beschikbaar zodat er, alles meegenomen, geen nadelig effect op de implementatie wordt verwacht.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Aanbevelingen 1
Als primaire behandeling kan bij patiënten met een TOA gestart worden met antibiotische therapie, waarbij een groot deel van de patiënten met enkel breedspectrum antibiotica zal herstellen. Bij patiënten die onvoldoende snel beter worden, zal naast de antibiotische behandeling sneller worden gekozen voor abcesdrainage, vooral als het abces gemakkelijk bereikbaar is voor deze interventie. Ook de grootte van het abces is van invloed op deze keuze, men dient hierbij te overwegen om bij een abcesgrootte ≥6cm in diameter naast antibiotica ook te draineren.
Aanbevelingen 2
Drainage materiaal dient altijd te worden ingestuurd voor banale kweek, omdat dit afkomstig is uit de in principe steriele intra-abdominale holte, en hieruit gekweekte micro-organismen als verantwoordelijk kunnen worden beschouwd voor de infectie. Daarbij dient naast de intravaginale/cervicale afname, het drainage materiaal ook te worden aangeboden voor een NAAT (nucleic acid amplification test) voor onderzoek op gonorroe en chlamydia, omdat deze verwekkers soms niet gelijktijdig op de verschillende locaties in de tractus genitalis aantoonbaar zijn.
Aanbevelingen 3
In uitzonderlijke gevallen, bij uitblijvende respons op antibiotische behandeling en wanneer drainage niet mogelijk is, wordt geadviseerd het antibiotisch beleid aan te passen. Hiervoor kan zo nodig overleg plaatsvinden met een arts-microbioloog. Het alternatief voor drainage, een meestal laparotomisch uitgevoerde adnex- en/of uterusextirpatie, wordt in eerste instantie afgeraden omdat hierbij het verlies optreedt van reproductieve organen, met een hoge veronderstelde kans op complicaties als gevolg van beschadiging van omliggende weefsels. Als een drainage echter niet het beoogde resultaat heeft en patiënte zieker wordt, kan het zijn dat toch moet worden besloten tot extirpatieve chirurgie. Dit kan ook het geval zijn bij patiënten bij wie drainage niet mogelijk is en een aangepaste antibiotische behandeling geen verbetering geeft.
Onderbouwing
Achtergrond
In Nederland worden patiënten met een tubo-ovarieel abces (TOA) primair behandeld met antibiotica, en als deze behandeling niet aanslaat, wordt geadviseerd het abces te draineren. De praktijk leert dat ondanks deze behandeling, vrouwen met een TOA een langdurig ziektebeloop kennen. Dit wordt mogelijk door een voortvarend uitgevoerde drainage verkort, wat in overeenstemming is met oude medische adagium ’ubi pus ibi evacua’. Daar staat tegenover dat abcesdrainage gepaard zou kunnen gaan met complicaties. Eerder was het advies van de richtlijn om te overwegen bij patiënten met een verhoogde kans op onvoldoende respons op antibiotische therapie (zoals dubbelzijdige abcessen, een eerdere pelvic inflammatory disease (PID) of een TOA met een afmeting > 8 cm of > 100 ml) een echo- of CT-geleide abcesdrainage uit te voeren in combinatie met antibiotische therapie. Het werd daarbij niet benoemd dat een abces van 100 ml overeenkomt met een bolronde vorm van bijna 6 cm doorsnede. Op dit moment wordt in de praktijk vaak een diameter > 8 cm gehanteerd als afkapwaarde waarboven voortvarend zou moeten worden gehandeld met abcesdrainage.
De afgelopen jaren zijn in de literatuur verschillende studies verschenen over dit onderwerp, hetgeen ertoe heeft geleid om deze publicaties kritisch te beoordelen met de vraag of een hernieuwde formulering van het eerder gegeven advies noodzakelijk is.
Conclusies / Summary of Findings
Deelvraag 1 - Drainage van het TOA
|
Laag GRADE |
Het is mogelijk dat echo- of CT-geleide drainage van een TOA als aanvulling op behandeling met intraveneuze antibiotica de kans op herstel vergroot, vergeleken met een behandeling met alleen antibiotica.
Bronnen: (Gohorkhay, 2007; Perez-Medina, 1996) |
|
- GRADE |
Het is onbekend wat het effect is van echo- of CT-geleide drainage van een TOA als aanvulling op behandeling met intraveneuze antibiotica op complicaties (darmlaesies, bloedingen, infectie) bij vrouwen met een TOA in de acute fase. |
Deelvraag 2 - Diametergrootte van het TOA
|
Laag GRADE |
Een grotere diameter van het TOA is mogelijk geassocieerd met de kans op het falen van conservatieve behandeling met antibiotica/ conversie naar (chirurgische) interventie van het TOA (gepoolde OR 4,21 (95%BI 1,90 tot 9,34)).
Bronnen: (Fouks, 2018; Greenstein, 2013; Kinay, 2016; Köstü, 2017; Topcu, 2015)
Deze mogelijke associatie werd gevonden voor de volgende vergelijkingen tussen ‘grote diameter’ van het TOA en een ‘kleine diameter’ van het TOA:
|
|
- GRADE |
Het is onbekend wat de voorspellende waarde van de diametergrootte van het TOA is op de herstelduur en complicaties (darmlaesies, bloedingen, infectie) bij vrouwen met een TOA in de acute fase. |
Samenvatting literatuur
Deelvraag 1 - drainage van het TOA
Resultaten
In de literatuur (gezocht tot februari 2010 in Medline en tot oktober 2010 in Embase) werden één RCT en één retrospectieve vergelijkende studie gevonden. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
UPDATE: Er werden geen nieuwe studies gevonden tijdens de update van deze richtlijnmodule in januari 2019.
Beschrijving studies
De studie van Goharkhay (2007) betrof een retrospectieve cohortstudie waarin 58 patiënten werden geïncludeerd met een gemiddeld volume van de TOA van 145,7 ml (range 8,0 - 442,4). De studie werd uitgevoerd in de Verenigde Staten. De gemiddelde diameter van het TOA werd niet gerapporteerd. De studie vergeleek de respons bij behandeling met intraveneuze antibiotica met patiënten die werden behandeld met intraveneuze antibiotica en binnen 24 uur na opname een echo-of CT-geleide drainage van het TOA ondergingen. Alle patiënten werden behandeld met gentamicine, clindamycine en ampicilline (mits er geen penicilline-allergie bekend was), dosering werd niet beschreven.
De studie van Perez-Medina (1996) betrof een RCT waarin 40 patiënten werden geïncludeerd met een unilateraal TOA < 10 cm (gemiddeld 6 cm doorsnede, standaard deviatie (SD) onbekend). De studie werd uitgevoerd in Spanje. Er werd behandeld met intraveneuze antibiotica en vervolgens gerandomiseerd voor een aanvullende echogeleide drainage 6 tot 12 uur na het starten van de antibiotica of géén drainage. Alle patiënten werden behandeld met gentamicine en clindamycine volgens doseringsschema van het Centers for Disease Control uit 1991.
Resultaten
Herstelduur
Geen van de geïncludeerde studies rapporteerde de exacte herstelduur. Twee studies rapporteerden wel de respons op (Goharkhay, 2007) of het herstel na behandeling (Perez-Medina, 1996). Goharkhay (2007) definieerde de uitkomst als ‘een complete respons op de primaire behandeling zonder andere interventies zoals chirurgie of secundaire drainage in de primaire antibioticagroep’. Perez-Medina (1996) definieerde het herstel niet expliciet, maar aangenomen wordt dat dit het tegenovergestelde van het falen van de behandeling inhield. Het vroegtijdig falen van de behandeling was gedefinieerd als ‘het uitblijven van klinisch verbetering (persisterendee pijn of- koorts), wanneer laboratorium onderzoek verhoogd CRP of leukocytose laat zien, wanneer echografisch onderzoek een persisterende massa of vermoeden van ruptuur in de eerste 48 tot 72 uur na behandeling oproept, of wanneer na initiële verbetering er een terugval volgt. In dat geval werd de patiënt laparotomisch behandeld’.
Goharkhay (2007) rapporteerde dat alle vrouwen (n=8; 100%) in de drainagegroep geheel herstelden tijdens de opname, vergeleken bij 29 van de 50 (58%) patiënten in de antibioticagroep zonder aanvullende interventie (P= 0,019). Bij 2 patiënten in de controlegroep bij wie de initiële klinische respons uitbleef werd een uterusextirpatie met bilaterale adnexextirpatie verricht. De overige 19 van de 21 patiënten kregen alsnog een ‘secundaire’ drainage. Hierna trad er een complete klinische respons op bij 18 van de 19 patiënten (94,7%).
Perez-Medina (1996) rapporteerde bij 18 van 20 (90%) vrouwen in de drainagegroep een initiële respons vergeleken bij 13 van 20 (65%) van de vrouwen in de antibioticagroep zonder drainage (RR 1,38 (95%BI 0,97 tot 1,97)). Chirurgische interventies werden uitgevoerd bij 2 van 20 vrouwen (10%) in de drainagegroep en bij 7 van 20 vrouwen (35%) in de controlegroep, veelal bestaande uit een enkel- of dubbelzijdige adnexextirpatie. Het werd niet gerapporteerd of alle vrouwen herstelden hierna.
Complicaties
Eén studie rapporteerde de uitkomstmaat complicaties (Goharkhay, 2007). De studie rapporteerde geen exacte definitie, maar beschreef dit als ‘procedure-gerelateerde complicaties, zoals blaas- of darmverwondingen of sepsis’.
Goharkhay (2007) rapporteerde dat er ‘geen grote complicaties waren bij alle patiënten die middels drainage werden behandeld’, dit werd niet nader gespecificeerd. Het werd niet beschreven of er complicaties waren in de antibioticagroep.
Bewijskracht van de literatuur
Interventiestudies (RCTs) starten op een hoog niveau van bewijskracht. De bewijskracht voor de uitkomstmaat herstelduur is met twee niveaus verlaagd vanwege risk of bias (er werd niet gecorrigeerd voor mogelijke verschillen tussen de groepen en het was onduidelijk hoe de uitkomst complicaties was gedefinieerd door Goharkhay (2007); methode voor randomisatie en blindering werd niet beschreven en loss to follow-up werd niet toegelicht door Perez-Medina (1996)) en met één niveau voor imprecisie (laag aantal patiënten in de studie van Goharkhay (2007) (n=58) en Perez-Medina (1996) (n=40)). Hiermee kwam de bewijskracht uit op laag.
Er werd geen GRADE beoordeling uitgevoerd voor de uitkomstmaat complicaties, omdat er onvoldoende informatie beschikbaar was in de studie van Goharkhay (2007).
Deelvraag 2 - diametergrootte van het TOA
Resultaten
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Beschrijving studies
Fouks (2018) voerde een retrospectieve cohortstudie uit onder vrouwen die waren opgenomen met een gecompliceerde pelvic inflammatory disease (PID) of bij wie een tubo-ovarieel abces (TOA) werd vermoed. De studie werd uitgevoerd in Israël. In totaal werden 335 vrouwen geïncludeerd: 168 werden conservatief behandeld met antibiotica (gemiddelde leeftijd 36,6 (SD 11,0)) en 167 vrouwen ondergingen een chirurgische behandeling nadat conservatieve behandeling faalde (gemiddelde leeftijd 40,9 jaar (SD 11,2)). De gemiddelde grootte van het TOA was voor de twee groepen vrouwen respectievelijk 47,4 mm (SD 20) en 66,3 mm (SD 20). Conservatieve behandeling bestond uit intraveneuze toediening van derde-generatie cefalosporine (ceftriaxon) (1000 mg per dag), metronidazol iv (500 mg, 3 maal daags) en oraal doxycycline (100 mg, 2 maal daags). Chirurgische behandeling betrof bij 150 patiënten een laparoscopische interventie (60 drainage, 94 salpingectomie; waarvan 4 conversie naar laparotomie) en bij 17 patiënten een laparotomische interventie (13 (gedeeltelijke) adnectomie, 4 salpingectomie). Echo-geleide of CT-geleide drainage van het abces werd bij 7 patiënten uitgevoerd, waarvan 2 patiënten hierna nog een laparoscopische interventie ondergingen.
Greenstein (2013) voerde een retrospectieve cohortstudie uit onder vrouwen met een TOA in de Verenigde Staten. De vrouwen waren geselecteerd op basis van een International Classification of Diseases, 9th revision (ICD-9) code 614.2 voor salpingo-oöforitis, waarin TOA wordt gespecificeerd. Gevallen van chronische salpingitis en oöforitis werden geëxcludeerd (ICD-9 code 614.1). In totaal werden 122 vrouwen bestudeerd: 80 werden conservatief behandeld met parenterale antibiotica (gemiddelde leeftijd 28 (SD onbekend)) en 42 ondergingen een chirurgische behandeling of echo-geleide drainage nadat conservatieve behandeling faalde (gemiddelde leeftijd 39 jaar (SD onbekend)). De gemiddelde grootte van het TOA was voor de twee groepen vrouwen respectievelijk 4,4 cm (SD onbekend) en 7,3 cm (SD onbekend). Het was onbekend met welk(e) type(n) antibiotica de patiënten werden behandeld. Chirurgische behandelding of drainage bevatte de volgende procedures: 12 patiënten ondergingen een totale abdominale hysterectomie met bilaterale salpingo-oöforectomie; 17 patiënten ondergingen een salpingo-oöforectomie (15 unilateraal/2 bilateraal); 6 patiënten ondergingen drainage (laparotomische drainage of laparoscopische drainage, bestaande uit 1 colpotomie, 2 echo-geleide drainage, 1 bilaterale salpingostomie; 2 salpingectomieën en 1 ovariële cystectomie.
Kinay (2016) voerde een retrospectieve cohortstudie uit onder vrouwen met een TOA in Turkije. Alle vrouwen voldeden aan de kenmerken van PID zoals vastgesteld door de US Centers for Disease Control and Prevention. In totaal werden 164 vrouwen geïncludeerd: 121 werden succesvol behandeld met antibiotica (gemiddelde leeftijd 37,1 (SD 8,6)) en 43 werden chirurgisch behandeld nadat conservatieve behandeling met antibiotica faalde (gemiddelde leeftijd 40,2 (SD 7,8)). De gemiddelde grootte van het TOA was voor de twee groepen vrouwen respectievelijk 6,1 cm (SD 1,5) en 7,1 cm (SD 1,7). Alle patiënten werden behandeld met een breedspectrum antibiotica (clindamycine-gentamycine of ceftriaxon-metronidazol, dosering onbekend). Parenterale antibiotische behandeling duurde 10 dagen. Chirurgische behandeling of drainage bevatte de volgende procedures: echo-geleide transvaginale drainage (n=11 (25,6%)), laparoscopische of laparotomische uni-/bilaterale salpingectomie/ salpingo-oöforectomie (n=18 (41,9%)), totale abdominale hysterectomie gecombineerd met uni-/bilaterale salpingectomie/ salpingo-oöforectomie (n=14 (32,6%)). Echo- of CT-geleide transabdominale drainage was niet beschikbaar in dit ziekenhuis.
Köstü (2017) voerde een retrospectieve cohortstudie uit onder vrouwen met een TOA in Turkije. De diagnose van PID was gebaseerd op de aanwezigheid van tenminste twee majeure kenmerken (drukpijnlijke onderbuik, cervicale bewegingspijn, drukpijnlijke adnexa) en tenminste één mineur criterium (lichaamstemperatuur > 38,0 graden Celsius, cervico-vaginale mucopurulente afscheiding, > 10000 witte bloedcellen/ml, erytrocytbezinkingssnelheid > 15 mm/uur of CRP >10 mg/l). De diagnose TOA werd gesteld op basis van aanwezigheid van de diagnostische criteria en aanwezigheid van een abces op de echo, CT of MRI. Patiënten die in de eerste 48 uur na opname chirurgisch werden behandeld voor een acute buik en/of patiënten met maligniteiten werden geëxcludeerd.
In totaal werden 62 vrouwen geïncludeerd: 53 werden succesvol behandeld met antibiotica (gemiddelde leeftijd 34,5 (SD 8,7)) en 9 werden chirurgisch behandeld nadat conservatieve behandeling met antibiotica faalde (gemiddelde leeftijd 38,1 (SD 5,6)). De gemiddelde grootte van het TOA was voor de twee groepen vrouwen respectievelijk 4,9 cm (SD 0,9) en 7,5 cm (SD 1,1). Alle patiënten werden parenteraal behandeld met een breedspectrum antibiotica (type antibiotica en dosering werden niet gerapporteerd). Bij succesvolle behandeling met antibiotica, gedefinieerd als klinisch en biochemisch bevestigd herstel binnen 96 uur na start antibiotica, werden patiënten ontslagen uit het ziekenhuis met een recept voor behandeling met doxycycline 100 mg/12 uur voor 14 dagen. Chirurgische behandeling bestond uit transvaginale drainage, unilaterale salpingo-oöforectomie, totale abdominale hysterectomie en bilaterale salpingo-oöforectomie. Het aantal patiënten per procedure werd niet gerapporteerd.
Topcu (2015) voerde een retrospectieve cohortstudie uit onder vrouwen met een TOA in Turkije. Diagnose van het TOA was gesteld op basis van de PID criteria van het Centers for Disease Control and Prevention (CDC) en abces formatie overeenkomstig met PID bevestigd op echo. Vrouwen met maligniteiten werden geëxcludeerd. In totaal werden 109 vrouwen geïncludeerd. De vrouwen werden verdeeld over 2 groepen: 1) de ‘gunstige prognose groep’ (n=22; mediane leeftijd 40,5 (range 22 - 48)), gedefinieerd als behandeling met antibiotica en binnen 7 dagen ontslagen uit het ziekenhuis zonder complicaties; 2) de ‘ongunstige prognose groep’ (n=87 (mediane leeftijd 41,0 jaar (range 20 - 55)), gedefinieerd als vrouwen die na meer dan 7 dagen werden ontslagen uit het ziekenhuis na antibiotische behandeling (n=2) of vrouwen die chirurgisch werden behandeld (n=85). De gemiddelde grootte van het TOA was voor de twee groepen vrouwen respectievelijk 4,5 cm (SD 1,7) en 6,4 cm (SD 2.2). Alle patiënten werden parenteraal behandeld met breedspectrum antibiotica zoals aanbevolen door het CDC (type antibiotica en dosering werd niet gerapporteerd). Chirurgische behandeling omvatte drainage, unilaterale salpingo-oöforectomie en totale abdominale hysterectomie met bilaterale salpingo-oöforectomie middels laparotomie (n=25), drainage en unilaterale salpingo-oöforectomie middels laparoscopie (n=60).
Resultaten
Falen van conservatieve behandeling met antibiotica/ conversie naar chirurgie
Vijf studies beschreven de voorspellende waarde van de grootte van het TOA voor de uitkomstmaat falen van behandeling met antibiotica/ conversie naar chirurgie (Fouks, 2018; Greenstein, 2013; Kinay, 2016; Köstü, 2017; Topcu, 2015). De gehanteerde afkappunten van de diametergrootte van het TOA, de definities van de uitkomstmaat en de covariaten in de multivariabele analyses worden per studie gepresenteerd in tabel 1. Alle studies werden opgenomen in de meta-analyse. Op basis van het gehanteerde afkappunt van de diametergrootte van het TOA werden subgroepen gecreëerd in de meta-analyse.
De overall voorspellende waarde van de diametergrootte van het TOA voor de kans op het falen van conservatieve behandeling met antibiotica/ conversie naar chirurgie was OR 4,21 (95%BI 1,90 tot 9,34) in alle studies voor een ‘grote diameter’ vergeleken met een ‘kleine diameter’ van het TOA. Alle subgroep-analyses lieten een effect in dezelfde richting zien (Figuur 1).
Tabel 1. Overzicht van de associatie tussen de diametergrootte van het TOA en de kans op het falen van de conservatieve behandeling met antibiotica/ conversie naar chirurgie op basis van multivariabele logistische regressie analyses
|
Auteur (jaartal) |
Afkappunt diametergrootte TOA |
Definitie uitkomst ‘falen antibiotische behandeling/ conversie naar chirurgische behandeling’ |
Covariaten |
|
Fouks (2018) |
Diametergrootte ≥70 mm versus. <70 mm
|
Een patiënt die niet klinisch verbeterde binnen 72 uur ondanks behandeling met antibiotica en/of een acute klinische achteruitgang bij klinisch bewezen sepsis of geruptureerd abces en gegeneraliseerde peritonitis |
Leeftijd, aanwezigheid van bilateraal abces, gemiddeld aantal witte bloedcellen, gemiddeld CRP, inadequate antibiotische behandeling (gedefinieerd als resistentie voor alle drie de antibiotica) |
|
Greenstein (2013) |
Diametergrootte TOA (afkappunt onbekend)
|
Het was onbekend wat werd verstaan onder het falen van behandeling met antibiotica en conversie naar chirurgische behandeling of drainage. |
Leeftijd, pariteit en maximaal aantal leukocyten. |
|
Kinay (2016) |
Diametergrootte TOA ≥ 6,5 cm versus. < 6,5 cm |
Een patiënt die niet klinisch verbeterde binnen 72 uur ondanks behandeling met antibiotica, beeld passend bij peritonitis of vermoeden van een geruptureerd abces. |
Leeftijd, pariteit, curettage in de voorgeschiedenis, bilateraal TOA, gemiddeld aantal witte bloedcellen, gemiddelde erytrocytbezinkingssnelheid, koorts bij opname en duur van opname |
|
Köstü (2017) |
Diametergrootte TOA ≥ 7 cm versus. < 7 cm |
Chirurgische behandeling werd toegepast wanneer binnen 96 uur na start van de behandeling geen herstel werd geobserveerd of op basis van klinische achteruitgang of laboratorium uitslagen (niet nader gedefinieerd). |
Pariteit, eerdere PID in de voorgeschiedenis, intra-uteriene anticonceptie, gemiddeld aantal witte bloedcellen, gemiddeld CRP, koorts, gemiddelde erytrocytbezinkingssnelheid. |
|
Topcu (2015) |
Diametergrootte TOA ≥6 cm versus. <6 cm |
Chirurgische behandeling van het TOA was geïndiceerd bij weinig of geen klinische reactie binnen 72 uur na start met antibiotische behandeling, gedefinieerd als orale lichaamstemperatuur >38,3 graden Celsius, geen afname in abces diameter en de aanwezigheid van pijn in de pelvis. Daarnaast vielen ook 2 vrouwen die na meer dan 7 dagen werden ontslagen uit het ziekenhuis na antibiotische behandeling onder deze uitkomst |
Aanwezigheid van bilateraal abces, gemiddeld aantal witte bloedcellen, gemiddeld CRP, sectio caesarea, duur van intra-uterien anticonceptie middel gebruik en menopauzale status. |
Afkortingen: 95%BI: 95% betrouwbaarheidsinterval; AB: antibiotische behandeling; CB: chirurgische behandeling; CRP: C-Reactive Protein.
Figuur 1. Meta-analyse uitkomstmaat ‘falen van conservatieve behandeling met antibiotica/ conversie naar chirurgie’ op basis van gecorrigeerde data
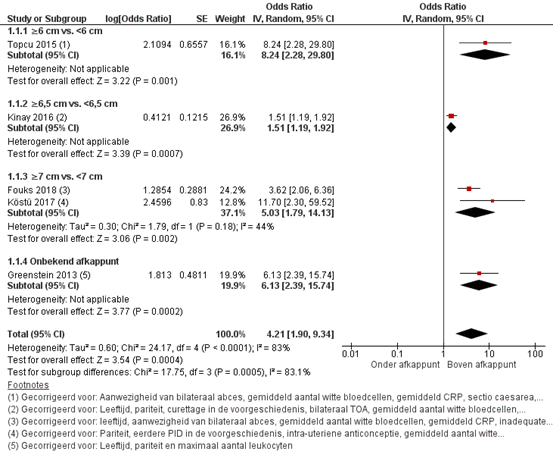
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Er werden geen studies gevonden waarin de uitkomsten herstelduur en complicaties (darmlaesies, bloedingen, infectie) werden gerapporteerd.
Bewijskracht van de literatuur
Prognostische observationele studies starten op een hoog niveau van bewijskracht. Het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van een klinisch relevant effect (OR 4,21 (95%BI 1,90 tot 9,34)). De bewijskracht voor de uitkomstmaat falen van conservatieve behandeling met antibiotica/ conversie naar chirurgische behandeling is met twee niveaus verlaagd vanwege risk of bias (mogelijke selectiebias in de studies van Fouks (2018), Köstü (2017) en Topcu (2015); geen van de vijf studies corrigeerde voor alle verplichte confounders). Hiermee kwam de bewijskracht uit op laag.
Er werden geen studies gevonden waarin de uitkomsten herstelduur en complicaties (darmlaesies, bloedingen, infectie) werden gerapporteerd en zodoende kon er geen GRADE beoordeling worden uitgevoerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 1: Wat is de effectiviteit van transvaginaal echo- of CT-geleide drainage vergeleken met antibiotisch beleid (expectatief beleid) bij vrouwen met een TOA in de acute fase?
P: patiënten met een TOA in de acute fase;
I: antibiotisch beleid met transvaginaal echo- of CT-geleide drainage;
C: alleen antibiotisch beleid (breedspectrum IV antibiotica) (expectatief beleid);
O: herstelduur, complicaties (darmlaesies, bloedingen, infectie).
Deelvraag 2: Wat is de voorspellende waarde van de diametergrootte van het TOA voor de kans op het falen van conservatieve behandeling met antibiotica/conversie naar chirurgie, de herstelduur en complicaties bij vrouwen met een TOA in de acute fase?
P: patiënten met een TOA in de acute fase;
I: prognostische waarde van diametergrootte van het TOA boven vastgesteld afkappunt;
C: prognostische waarde van diametergrootte van het TOA onder vastgesteld afkappunt;
O: falen van conservatieve behandeling met antibiotica/conversie naar (chirurgische) interventie, herstelduur, complicaties (darmlaesies, bloedingen, infectie).
Relevante uitkomstmaten
Voor deelvraag 1 (drainage van het TOA) achtte de werkgroep de uitkomstmaten herstelduur en complicaties (darmlaesies, bloedingen, infectie) voor de besluitvorming cruciale uitkomstmaten.
Voor deelvraag 2 (diametergrootte van het TOA) achtte de werkgroep de uitkomstmaten het falen van conservatieve behandeling met antibiotica danwel het verrichten van een (chirurgische) interventie een voor de besluitvorming cruciale uitkomstmaat; daarbij waren herstelduur en complicaties (darmlaesies, bloedingen, infectie) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hield de GRADE-default grenzen (25% voor dichotome uitkomstmaten en 0,5 SD voor continue uitkomstmaten) aan als een klinisch (patiënt) relevant verschil (Schüneman, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is respectievelijk in februari 2010 en in oktober 2010 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele studies die behandeling van een tubo-ovarieel abces (TOA) beschreven. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 325 treffers op. Voor deze module werden studies geselecteerd wanneer behandeling van het TOA middels drainage werd vergeleken met antibiotische beleid. Het is onbekend hoeveel studies werden geselecteerd op basis van titel en abstract. Na raadpleging van de volledige tekst werden 2 studies definitief geselecteerd.
UPDATE: In de databases Medline (via OVID) en Embase (via Embase.com) is op 11 januari 2019 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele studies die drainage van een tubo-ovarieel abces (TOA) onder geleide van CT of echo vergeleken met conservatieve behandeling met antibiotica bij patiënten met een TOA in de acute fase. De zoekstrategie betrof een update van de richtlijnmodule uit 2010. De zoekverantwoording van de update uit 2019 is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 309 treffers op.
Voor het beantwoorden van deelvraag 1 (Drainage van het TOA) werden studies geselecteerd op grond van de volgende selectiecriteria: 1) populatie bestaande uit patiënten met een TOA in de acute fase; 2) transvaginale echo- of CT-geleide drainage werd vergeleken met antibiotisch beleid (breedspectrum IV antibiotica). Op basis van titel en abstract werden in eerste instantie 25 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 25 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 0 studies definitief geselecteerd voor deelvraag 1.
Voor het beantwoorden van deelvraag 2 werden studies geselecteerd op grond van de volgende selectiecriteria: 1) populatie bestaande uit patiënten met een TOA in de acute fase; 2) er werd een multivariate analyse uitgevoerd waarin de associatie tussen de prognostische factor ‘diametergrootte van het TOA’ en één van onze uitkomsten werd bestudeerd. Op basis van titel en abstract werden in eerste instantie 25 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 20 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 5 studies definitief geselecteerd voor het beantwoorden van deelvraag 2.
Referenties
- Fouks Y, Cohen A, Shapira U, Solomon N, Almog B, Levin I. Surgical Intervention in Patients with Tubo-Ovarian Abscess: Clinical Predictors and a Simple Risk Score. Journal of Minimally Invasive Gynecology. 2018;11:11
- Goharkhay, N., Verma, U., & Maggiorotto, F. (2007). Comparison of CT- or ultrasound-guided drainage with concomitant intravenous antibiotics versus. intravenous antibiotics alone in the management of tubo-ovarian abscesses. Ultrasound Obstet.Gynecol., 29, 65-69.
- Greenstein Y, Shah AJ, Vragovic O, Cabral H, Soto-Wright V, Borgatta L, et al. Tuboovarian abscess. Factors associated with operative intervention after failed antibiotic therapy. Journal of Reproductive Medicine. 2013;58(3-4):101-6.
- Kinay T, Unlubilgin E, Cirik DA, Kayikcioglu F, Akgul MA, Dolen I. The value of ultrasonographic tubo-ovarian abscess morphology in predicting whether patients will require surgical treatment. International Journal of Gynaecology & Obstetrics. 2016;135(1):77-81.
- Köstü B, Özer A. Analysis of risk factors predicting surgery in cases with tubo-ovarian abscess. Journal of Clinical and Analytical Medicine. 2017;8(4):267-70.
- Perez-Medina, T., Huertas, M. A., & Bajo, J. M. (1996). Early ultrasound-guided transvaginal drainage of tubo-ovarian abscesses: a randomized study. Ultrasound Obstet.Gynecol., 7, 435-438.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Shigemi D, Matsui H, Fushimi K, Yasunaga H. Laparoscopic Compared With Open Surgery for Severe Pelvic Inflammatory Disease and Tubo-Ovarian Abscess. Obstet Gynecol. 2019 Jun;133(6):1224-1230.
- Topcu HO, Kokanali K, Guzel AI, Tokmak A, Erkilinc S, Umit C, et al. Risk factors for adverse clinical outcomes in patients with tubo-ovarian abscess. Journal of Obstetrics & Gynaecology. 2015;35(7):699-702.
Evidence tabellen
Deelvraag 1 - Drainage van het TOA
Evidencetabellen uit richtlijnmodule (2010):
|
Referentie |
Type studie |
Kenmerken (studie/ patiënten) |
Interventie (I) |
Controle (C) |
Uitkomst maten en follow-up duur |
Resultaten |
Beoordeling kwaliteit studie |
|
Perez- Medina 1996 |
RCT
N= 40 |
Inclusiecriteria: Vrouwen met klinische en US diagnose van een TOA < 10 cm.
Inclusie klinische symptomen: pijn in de onderbuik of in het bekken en/of leukocytose (> 10.500 per ul) en/of koorts (37,8°C)
Leeftijd: gemiddelde ongeveer 28.
TOA-diameter , (gemiddelde) 60,5 mm
|
Antibiotica: iv. clindamycine en gentamicine + 6-12 uur na start antibiotica: US 16 gauge needle drainage (transvaginaal). Aspiratie van de abcesholten totdat geen debris meer werd verkregen
N = 20 |
Antibiotica: iv. clindamycine en gentamicine.
N = 20 |
Uitkomst: Treatment failure, gemeten binnen 48-72 uur:
En bij de 4 weken follow-up: - echografisch persisterende massa
Secundair:
Follow-up: 4 weken |
|
Randomisatie* (+) methode niet beschreven
Allocation concealment: onduidelijk
Behandelaar geblindeerd* (-) Patiënt geblindeerd* (-) Effectbeoordelaar geblindeerd* (?).
Interventie- en controlegroep vergelijkbaar* (+): geen verschillen in de klinische presentatie.
Follow-up voldoende (≥ 80%) (+)
Intention-to-treatanalyse* niet specifiek vermeld, maar lijkt van wel. Financiering: niet vermeld.
|
|
Goharkhay 2007 |
Retrospectief statusonderzoek (cohort, vergelijkend)
N= 58 |
Inclusiecriteria: Alle patiënten die in de periode 1 april 1999 - 30 september 2001 werden opgenomen in universitair centrum Miami. Geselecteerd in een database met diagnostische codes.
Exclusiecriteria: onbekend (geen laparotomieën bijv.?)
Leeftijd: gemiddelde 31,7 (range 16-61)
Totaal volume TOA (ml, gemiddelde, range): 145,7 (8,0-442,4)
|
Antibiotica i.v.: gentamicine, clindamicine en ampicilline (geen ampicilline bij penicillineallergie) + primaire drainage binnen 24 h na opname. Echo- of CT-geleide drainage, transvaginale of transabdominale benadering. alle toegankelijke cysteuze ruimtes werden gedraineerd. Bij echogeleide drainage werd 900 mg clindamycine opgelost in Nacl in het gedraineerde abces achtergelaten.
N = 8 |
Antibiotica i.v.: gentamicine, clindamicine en ampicilline (gen ampicilline bij penicillineallergie)
N = 50 |
Primaire uitkomsten: Percentage complete respons na primaire behandeling, zonder extra interventies.
Secundaire uitkomsten: noodzaak tot extra interventies, duur tot verdwijnen koorts, opnameduur, procedure gerelateerde complicaties (blaas en darmlaesies, sepsis)
Extra evaluatie van secundaire drainage bij patiënten waarbij primaire antibiotische behandeling had gefaald.
Follow-upduur: niet specifiek gemeld, waarschijnlijk gedurende de opname (?) |
29 (58%) in de controlegroep (alleen AB) had een complete respons versus 8/8 (100%) in de drainagegroep. -> P= 0,019
21 patiënten hadden na falende ab-behandeling extra interventie nodig: 2 TAH + BSO, 19 salvage en drainage.
Koorts persisteerde langer in de ab-behandelde groep dan in de interventiegroep. -> significant, echter uitgangssituatie was al verschillend.
Opnameduur in de controlegroep: 7 (range 4-16) versus 4,5 (4-8) in de primaire drainagegroep. -> p < 0,02)
Er traden geen procedure-gerelateerde bijwerkingen op.
Extra evaluatie: Bij 18 v.d. 19 (94,7%) patiënten die een secundaire drainage kregen trad complete klinische respons op.
Kenmerken van de non-responders in deze studie:
|
Randomisatie* (-) primaire drainage werd gedaan naar de voorkeur van de behandelend arts.
Toewijzing verborgen* (-) Behandelaar geblindeerd* (-) Patiënt geblindeerd* (-) Effectbeoordelaar geblindeerd* (-)
Interventie- en controlegroep vergelijkbaar* groepgroottes verschillen erg, qua demografie, kliniek en echografische bevindingen vergelijkbaar. Echter in de drainagegroep hadden 7/8 ptn koorts versus 34/50 in de ab-groep, hierin zijn de groepen sign. verschillend.
Follow-up voldoende (≥ 80%) (?)
Intention-to-treatanalyse* (-) Financiering: niet vermeld
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Perez-Medina, 1996 |
Not described |
Unclear |
Unclear |
Unclear |
Unclear |
Likely, among others, the effect on subsequent pregnancies was reported to be studied but not reported in text. |
Likely, loss to follow-up was reported in both groups without reasons. |
Unclear |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Goharkhay, 2007 |
Unlikely (NB: no patients with IUD usage and HIV infections included in the intervention group compared to the control group, see final column for risk of bias). |
Unclear |
Likely, complications were reported as secondary outcome measure, but only reported in text as ‘no major side effects occurred’. |
Likely, only univariable analysis performed (not corrected for differences between groups based on patient characteristics). |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Deelvraag 2 -diametergrootte van het TOA
Research question: What is the predictive value of the TOA size for the risk of failure of antibiotic treatment/conversion to surgery, recovery time and/or complications in women with an acute TOA?
Pre-defined core set of confounders:
- Previous gynaecological infection
- Immune status/immune compromised
- Smoking
- IUD in situ
- Age
Abbreviations: AB: antibiotic treatment; CDC: Centers for Disease Control and Prevention; CRP: c-reactive protein; ESR: erythrocyte sedimentation rate; ICD-9: International Classification of Diseases, 9th revision; NA: not applicable; OR: odds ratio; PID: pelvic inflammatory disease; SD: standard deviation; TOA: tuba-ovarian abscess; WBC: white blood cells;
1 Incremental predictive value is the predictive value beyond standard demographic factors and the established risk factors (e.g. smoking, blood pressure, lipid levels, diabetes, cancer stage, etc.), for example change in c-statistic
Table of quality assessment - prognostic factor (PF) studies
Based on: QUIPSA (Haydn, 2006; Haydn 2013)
Research question: What is the predictive value of the TOA size for the risk of failure of antibiotic treatment/conversion to surgery, recovery time and/or complications in women with an acute TOA?
|
Study reference
(first author, year of publication) |
Study participation1
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition2
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement3
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement3
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding4
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting5
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Fouks, 2018 |
High risk (It seems unlikely that an almost equal number of patients required surgery or was successfully treated with AB. Suspected selection bias). |
NA (cross-sectional measurement) |
Low risk |
Low risk |
High risk (corrected for only 1 out of 5 previously defined important confounders (i.e. previous gynaecological infection; immune status/immune compromised; smoking; IUD in situ; age) |
Moderate risk, unknown how selection of variables in multivariable analysis was made. |
|
Greenstein, 2013 |
Low risk |
NA (cross-sectional measurement) |
Moderate risk, method of measurement was adequate, but TOA size was not defined in analysis: it was unknown whether it was studied as a continuous or dichotomous variable. |
Low risk |
High risk (corrected for only 1 out of 5 previously defined important confounders (i.e. previous gynaecological infection; immune status/immune compromised; smoking; IUD in situ; age) |
Low risk (selection of confounders based on significant univariate associations) |
|
Kinay (2016) |
Low risk |
NA (cross-sectional measurement) |
Low risk |
Low risk |
High risk (corrected for only 1 out of 5 previously defined important confounders (i.e. previous gynaecological infection; immune status/immune compromised; smoking; IUD in situ; age) |
Low risk (selection of confounders based on P<0.25 univariate associations) |
|
Köstü (2017) |
High risk (Patients requiring surgical intervention due to acute abdomen within the first 48 hours were excluded) |
NA (cross-sectional measurement) |
Unclear (definition and method of measurement not reported) |
Low risk |
High risk (corrected for only 2 out of 5 previously defined important confounders (i.e. previous gynaecological infection; immune status/immune compromised; smoking; IUD in situ; age) |
Low risk (selection of confounders based on significant univariate associations) |
|
Topcu (2015) |
High risk (study reports it is a case-control study, but does not further specify and every other detail suggests it is a retrospective cohort study. Unclear whether patients were selected). |
NA (cross-sectional measurement) |
Unclear (method of measurement not reported) |
Low risk |
High risk (corrected for only 1 out of 5 previously defined important confounders (i.e. previous gynaecological infection; immune status/immune compromised; smoking; IUD in situ; age) |
Low risk (selection of confounders based on significant univariate associations) |
1 Adequate description of: source population or population of interest, sampling and recruitment, period and place of recruitment, in- and exclusion criteria, study participation, baseline characteristics.
2 Adequate response rate, information on drop-outs and loss to follow-up, no differences between participants who completed the study and those lost to follow-up.
3 Method of measurement is valid, reliable, setting of measurement is the same for all participants.
4 Important confounders are listed, method of measurement is valid, reliable, setting of measurement is the same for all participants, important confounders are accounted for in the design (matching, stratification, initial assembly of comparable groups), or analysis (appropriate adjustment)
5 Enough data are presented to assess adequacy of the analysis, strategy of model building is appropriate and based on conceptual framework, no selective reporting
Exclusietabel
Deelvraag 1 - Drainage van het TOA
Tabel Exclusie deelvraag 1 - drainage van het TOA na het lezen van het volledige artikel (literatuurselectie update 2019)
|
Auteur en jaartal |
Redenen van exclusie |
|
Akkurt, 2015 |
Exclusie, voldoet niet aan PICO |
|
Aydin, 2018 |
Exclusie, voldoet niet aan PICO |
|
Brun, 2016 |
Exclusie, betreft Franse richtlijn |
|
Chappell, 2012 |
Exclusie, voldoet niet aan PICO |
|
Chong, 2016 |
Exclusie, voldoet niet aan PICO |
|
Chu, 2019 |
Exclusie, voldoet niet aan PICO |
|
Demirtas, 2013 |
Exclusie, voldoet niet aan PICO |
|
Ekin, 2012 |
Exclusie, voldoet niet aan PICO |
|
Farid, 2016 |
Exclusie, voldoet niet aan PICO |
|
Fouks, 2018 |
Exclusie, voldoet niet aan PICO |
|
Greenstein, 2013 |
Exclusie, voldoet niet aan PICO |
|
Gungorduk, 2014 |
Exclusie, voldoet niet aan PICO |
|
Habbouh, 2016 |
Exclusie, voldoet niet aan PICO |
|
Inal, 2018 |
Exclusie, voldoet niet aan PICO |
|
Kim, 2015 |
Exclusie, voldoet niet aan PICO |
|
Kinay, 2016 |
Exclusie, voldoet niet aan PICO |
|
Köstü, 2017 |
Exclusie, voldoet niet aan PICO |
|
Kuru, 2012 |
Exclusie, voldoet niet aan PICO |
|
Lin, 2018 |
Exclusie, voldoet niet aan PICO |
|
Mizushima, 2013 |
Exclusie, voldoet niet aan PICO |
|
Rosen, 2009 |
Exclusie, voldoet niet aan PICO |
|
Silva, 2015 |
Exclusie, voldoet niet aan PICO |
|
To, 2014 |
Exclusie, voldoet niet aan PICO |
|
Topcu, 2015 |
Exclusie, voldoet niet aan PICO |
|
Uyar, 2012 |
Exclusie, voldoet niet aan PICO |
Exclusietabel deelvraag 1 van literatuurselectie versie richtlijnmodule uit 2010 niet beschikbaar.
Deelvraag 2 - Diametergrootte van het TOA
Tabel Exclusie deelvraag 2 - diametergrootte van het TOA na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Akkurt, 2015 |
Exclusie, alleen univariate analyses |
|
Aydin, 2018 |
Exclusie, alleen beschrijvende statistiek |
|
Brun, 2016 |
Exclusie, betreft Franse richtlijn |
|
Chappell, 2012 |
Exclusie, voldoet niet aan PICO |
|
Chong, 2016 |
Exclusie, voldoet niet aan PICO |
|
Chu, 2019 |
Exclusie, alleen univariate analyses |
|
Demirtas, 2013 |
Exclusie, voldoet niet aan PICO |
|
Ekin, 2012 |
Exclusie, voldoet niet aan PICO |
|
Farid, 2016 |
Exclusie, alleen beschrijvende statistiek |
|
Gungorduk, 2014 |
Exclusie, alleen univariate analyses |
|
Habbouh, 2016 |
Exclusie, voldoet niet aan PICO |
|
Inal, 2018 |
Exclusie, alleen univariate analyses |
|
Kim, 2015 |
Exclusie, voldoet niet aan PICO |
|
Kuru, 2012 |
Exclusie, alleen beschrijvende statistiek |
|
Lin, 2018 |
Exclusie, alleen beschrijvende statistiek |
|
Mizushima, 2013 |
Exclusie, case control studie |
|
Rosen, 2009 |
Exclusie, voldoet niet aan PICO |
|
Silva, 2015 |
Exclusie, voldoet niet aan PICO |
|
To, 2014 |
Exclusie, alleen beschrijvende statistiek |
|
Uyar, 2012 |
Exclusie, alleen beschrijvende statistiek |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-03-2020
Beoordeeld op geldigheid : 22-04-2020
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Drainage TOA |
NVOG |
2020 |
Eind 2025 |
Elke 2 jaar |
NVOG |
Ontwikkelingen in het vakgebied |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnmodule is ter goedkeuring/geen bezwaar voorgelegd aan:
- Nederlands Huisartsen Genootschap
- Stichting Bekkenbodem4All
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. A. Timmermans, gynaecoloog, NVOG (voorzitter werkgroep (proces))
- Dr. P.J.M. van Kesteren, gynaecoloog, NVOG (inhoudelijk voorzitter)
- Dr. H.S. Kok, gynaecoloog, NVOG
- M. Bosch, patiëntvertegenwoordiger, Bekkenbodem4All
Klankbordgroep
- Drs. L. Verlee, wetenschappelijk medewerker, NHG
- Dr. C. van der Leij, interventieradioloog, NVvR, NVIR
Met ondersteuning van
- Dr. E.J.M. den Breejen, senior adviseur, Kennisinstituut van de federatie Medisch Specialisten (tot 15 juni 2019)
- Dr. A. Bijlsma-Rutte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. Wessels, MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bosch |
Stichting Bekkenbodem4All: PR/Communicatie en belangenbehartiging |
Fotograaf Bisdom Groningen-Leeuwarden, deels betaald, deels vrijwilliger Bestuur Dutch Foundation for Ladakhi Nuns: onbetaald PR medewerker Stichting Uit De Kunst, Zuidhorn: onbetaald" |
Geen |
Geen |
|
Kesteren |
Gynaecoloog |
Geen |
Geen |
Geen |
|
Kok |
Gynaecoloog Alrijne Ziekenhuis Leiden en LUMC Leiden |
Geen |
Geen |
Geen |
|
van der Leij (klankbordgroep NVvR) |
Interventieradioloog Maastricht UMC+ |
Secretaris NVIR - onbetaald |
Geen |
Geen |
|
Timmermans |
Gynaecoloog werkzaam bij Amsterdam UMC locatie AMC (0.4 fte) en gedetacheerd naar Bergman Vrouwenzorg Amsterdam (0.4 fte) |
Lid commissie kwaliteitsdocumenten NVOG (onbetaald) |
Mede-aanvrager op ZONMW subsidie aanvraag naar effectiviteit van insertie Mirena aansluitend aan novasure endometriumablatie (proces loopt, nog geen bericht of subsidie aanvraag is toegekend) |
Geen |
|
Verlee (klankbordgroep NHG) |
Wetenschappelijk medewerker Richtlijnontwikkeling en wetenschap, Nederland Huisartsen Genootschap, 0,6 fte. Beleidsmedewerker programma professionals, Soa Aids Nederland, 0,22 fte. |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntvertegenwoordiger als werkgroeplid te betrekken bij de ontwikkeling van deze module. De conceptmodule werd tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door de werkgroep bleek dat er een noodzaak was voor revisie van deze richtlijnmodule. Tijdens deze inventarisatie zijn er knelpunten aangedragen door relevante partijen via een schriftelijke enquête. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews;
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek;
- ACROBAT-NRS - voor observationeel onderzoek;
- QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Indicatorontwikkeling
Op verzoek van de NVOG werden er geen indicatoren ontwikkeld bij deze module vanwege het beperken van de registratielast van medisch specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes, te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekverantwoording update richtlijnmodule 2019:
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 2010-jan 2019 Engels |
1 exp Ovarian Cysts/ or exp Fallopian Tube Diseases/ or Ovarian Diseases/ or Pelvic Inflammatory Disease/ or (((fallopian or uterine) adj tube*) or salpin*).ti,ab. (49514) 2 abscess/ or abdominal abscess/ or abscess*.ti,ab,kf. (80695) 3 1 and 2 (1262) 4 ((tuboovarian or tubo-ovarian or pelvic) adj (abscess* or complex*)).ti,ab,kf. (1894) 5 3 or 4 (2448) 6 exp Laparoscopy/ or Drainage/ or exp Ultrasonography/ or (laparoscop* or drainage or Ultrason* or ultrasound or echo*).ti,ab,kf. or (abscess* adj3 (diameter* or size* or cm or mm)).ti,ab,kf. (875432) 7 5 and 6 (1046) 8 limit 7 to yr="2010 -Current" (362) 9 limit 7 to ed=20100101-20191231 (332) 10 8 or 9 (381) 11 limit 10 to english language (350) Annotation: Search gebaseerd op search voor richtlijn uit 2011, deze search is weer gebaseerd op die uit de RCOG-greentop guideline ‘Management of Pelvic Inflammatory Disease’ 17 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (380909) 18 11 and 17 (16) 19 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or clinic$ trial$1.tw. or (clinic$ adj trial$1).tw. or ((singl$ or doubl$ or treb$ or tripl$) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo$.tw. or randomly allocated.tw. or (allocated adj2 random$).tw.) not (animals/ not humans/) (1419221) 20 11 and 19 (24) 21 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2824476) 22 11 and 21 (134) 23 18 or 20 or 22 (152) |
309 |
|
Embase (Elsevier)
|
('tuboovarian abscess'/mj OR 'ovary abscess'/mj OR 'pelvis abscess'/mj OR 'uterine tube abscess'/exp/mj OR ((('tubo ovarian' OR tuboovarian OR ovarian) NEAR/3 abscess*):ti,ab) OR (('fallopian tube'/exp OR 'fallopian tube*':ti,ab OR salpin*:ti,ab) AND ('abscess'/exp/mj OR abscess*:ti,ab))) AND ('laparoscopy'/exp/mj OR 'abscess drainage'/de OR 'ultrasound'/exp OR 'transvaginal echography'/exp OR laparoscop*:ti,ab OR drainage:ti,ab OR ultrason*:ti,ab OR ultrasound:ti,ab OR echo*:ti,ab OR ((abscess* NEAR/3 (diameter* OR size* OR cm OR mm)):ti,ab)) AND (embase)/lim AND (english)/lim AND (1-1-2010)/sd NOT (1-3-2019)/sd AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) OR 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti OR 'clinical study'/exp) NOT 'conference abstract':it" 205 referenties > 157 uniek |
Zoekverantwoording richtlijnmodule 2010:
|
Onderwerp |
Data-base |
Zoektermen |
Aantal hits[1] |
|
2. Behandeling van een TOA |
Medline (PubMed) 1949-februari 2010
Embase 1980-oktober 2010 |
((‘ovarian cysts’(mesh) OR ‘Fallopian tube diseases’(mesh) OR ‘ovarian diseases’(mesh)) AND (‘abscess’(mesh) OR abscess*) OR ‘tuboovarian abscess’(tiab) OR ‘tuboovarian abscesses’(tiab) OR ‘tuboovarian complex’(tiab) OR ‘tubo-ovarian abscess’(tiab) OR ‘tubo-ovarian abscesses’(tiab) OR ‘tubo-ovarian complex’(tiab) OR ‘tubo-ovarian complexes’(tiab) OR ‘pelvic abscess’(tiab) OR ‘pelvic abscesses’(tiab)) AND (‘Laparoscopy’(Mesh) OR laparoscop*(tiab) OR ((‘Drainage’(Mesh) OR drainage) AND (‘Ultrasonography’(Mesh) OR ultrasound OR ultrason* OR transvaginal)) OR suction OR ‘Radiography, Interventional’(Mesh))
(tubo-ovarian abscess*.mp. OR tuboovarian abscess*.mp. OR exp tuboovarian abscess/ OR exp ovary abscess/ OR ovarian abscess*.mp. OR pelvic abscess*.mp. OR exp pelvis abscess/ OR ((exp abscess/ OR abscess*.mp.) AND (fallopian tube.mp. OR exp uterine tube/))) AND (exp laparoscopy/ OR laparascop*.mp. OR ((exp abscess drainage/ OR drainage.mp.) AND (ultrason*.mp. OR exp ultrasound/ OR ultrasound.mp. OR exp transvaginal echography/ OR transvaginal.mp.)) OR suction.mp. OR exp suction/ OR exp suction drainage/ OR interventional radiography.mp. OR exp interventional radiology/) |
315 hits
196 unieke hits (325 totaal) |
Het aantal referenties genoemd voor de search in Embase is na exclusie van de referenties gevonden via Medline
SR= systematische reviews, RCT = randomised controlled trial. Wanneer geen type onderzoeksdesign vermeld staat achter het aantal hits, is niet beperkt op het type onderzoeksdesign.
