Medicamenteuze preventie emergence delier (ED)
Uitgangsvraag
Wat zijn de meest effectieve, best hanteerbare en veilige medicamenteuze interventies ter preventie of voor het behandelen van kinderen met een emergence delier?
De uitgangsvraag omvat de volgende deelvragen:
- Welke algehele anesthetica gaan gepaard met de kleinste kans op het ontstaan van een emergence delier?
- Welke adjuvantia in de breedste zin kunnen de kans op een emergence delier verkleinen?
Aanbeveling
Aanbeveling 1
Kies voor propofol-anesthesie indien er geen patiënt gerelateerde contra-indicaties zijn en het kind een hoog risico voor ED heeft.
Aanbeveling 2
Gebruik bij het geven van sevofluraan-anesthesie adjuvante medicatie om het risico op het ontstaan van ED te verlagen.
Aanbeveling 3
Kies voor een effectief middel met zo min mogelijk bijwerkingen én waarvan het bijwerkingenprofiel vertrouwd en bekend is.
In aanmerking komen α2-agonisten: dexmedetomidine en clonidine. Van de opiaten: fentanyl en sufentanil. Op indicatie kan gekozen worden voor (es)ketamine of propofol.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuur laat zien dat propofol-anesthesie een kleinere kans lijkt te geven op het ontstaan van een emergence delier in vergelijking met sevofluraan-anesthesie. Bij sevofluraan-anesthesie kan de kans op ED verminderen door het profylactische geven van zogenoemde adjuvantia. Zo kan bijvoorbeeld propofol (bijvoorbeeld 1 mg/kg) kort voor uitleiding als adjuvans gegeven worden. Het toedienen van adjuvantia in combinatie met sevofluraan verlaagt de kans op emergence delier in vergelijking met placebo.
Dexmedetomidine, fentanyl, ketamine en sufentanil geven als adjuvantia bij sevofluraan-anesthesie een lagere kans op het ontstaan van emergence delier. Waarschijnlijk geven ook clonidine, propofol of remifentanil bij sevofluraan-anesthesie een lager risico op emergence delier. Het blijft ingewikkeld om de middelen met elkaar te vergelijken, omdat er een grote mate van heterogeniteit is in de ingrepen die de patiënten ondergaan.
Het is niet altijd mogelijk primair propofol-anesthesie te geven. Er kunnen contra-indicaties zijn voor het gebruik van propofol of er wordt voor een primaire kap-inductie gekozen. Als gedurende de gehele operatieve procedure gebruik wordt gemaakt van damp-anesthesie (sevofluraan), dan is het belangrijk om een goedwerkend adjuvans in te zetten.
Zowel dexmedetomidine als clonidine zijn α2-agnoisten, waarbij dexmedetomidine meer α2-specifiek is. Beide middelen kunnen leiden tot bradycardie en hypotensie, met name bij te snelle toediening of te hoge doseringen. Dit is reversibel zodra het middel begint uit te werken. Dexmedetomidine heeft een kortere halfwaardetijd (1,5 uur) dan clonidine (15 uur).
Dexmedetomidine is het laatste decennium veel onderzocht, met name in de Verenigde staten waar de intraveneuze vorm van clonidine niet verkrijgbaar is. Of er verschil is tussen beide middelen qua preventieve werking op het voorkomen van ED is alleen indirect via placebostudies onderzocht. Daarmee is er geen duidelijk bewijs dat het één beter is dan het ander. Verder kan een langere werking van clonidine voordelig zijn, omdat het tot een lagere postoperatieve pijn score kan leiden (Dahamani, 2010).
De werking van de opiaten (pijnbestrijders) fentanyl, sufentanil, remifentanil, zal mogelijk beter zijn bij die patiënten waar pijn een rol speelt in het ontwikkelen van een ED. Opiaten kunnen ademdepressie veroorzaken, en daarmee kan een verlengde tijd tot detubatie ontstaan. Fentanyl werkt snel (< 3 min.) en werkt ½ tot 1 uur, remifentanil werkt zeer kort (max. 10 min.) en wordt, indien geïndiceerd, als continue infuus toegediend. Sufentanil, is een krachtige pijnbestrijder en in de operatieve setting zeer goed werkzaam. Sufentanil en fentanyl hebben een soortgelijk bijwerkingen profiel, waarbij ademdepressie er één is om rekening mee te houden in de dosering. Beide zijn prima te titreren en daarmee is er vanuit de literatuur geen duidelijke voorkeur voor kortdurende ingrepen. Echter bij langdurende continue toediening heeft sufentanil als voordeel een context-sensitieve halfwaardetijd.
Propofol werkt met name goed als op zichzelf staand anestheticum. Het heeft als adjuvans een korte werkingsduur en nagenoeg geen bijwerkingen bij kortdurend of eenmalig gebruik.
(Es)ketamine in lage dosering (0,1 tot 0,25 mg/kg) werkt bijna even goed als fentanyl of sufentanil en kan door zijn antihyperalgetisch en analgetisch effect synergistisch werken met andere centrale pijnbestrijdingsmiddelen. Maar juist deze synergistische werking met opioïden kan de uitleidingstijden verlengen.
Er zijn een aantal andere overwegingen die meegenomen moeten worden vanuit de literatuur, vanwege hun mogelijke invloed op ED. Als eerste te noemen is luchtweg-management gedurende de ingreep. Er zijn aanwijzingen in de literatuur dat de keuze voor een larynxmasker in plaats van endotracheale intubatie het risico op postoperatief ED zou kunnen beperken (Lee, 2011; Keles, 2018). Voorwaarde hierbij is dat onder diepe anesthesie het larynxmasker wordt verwijderd. Ook zou de keuze voor lokale anesthesie met effectieve pijnbestrijding, door een blokkade aan te leggen, mogelijk preventief werken op het ontwikkelen van ED (Wang, 2015). Hoewel een andere studie geen effect vond (Ohashi, 2016). Verder werd een artikel gevonden dat beschreef dat bij tonsillectomie het type chirurgische techniek het risico op ED zou kunnen beïnvloeden (Celebi, 2013).
In de module ‘Risicofactoren ED’ komt naar voren dat er mogelijk een associatie is tussen onrust en angst tijdens de inleiding van anesthesie en het ontwikkelen van ED postoperatief. Daarnaast zijn er ook andere redenen om een gecontroleerde inleiding na te streven, met een coöperatieve patiënt. Midazolam werd en wordt nog altijd voorgeschreven als premedicatie. Een medicamenteus alternatief is clonidine (Almenrader, 2007; Dahmani, 2010).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Hoewel ED in bijna alle gevallen zelflimiterend is, is het beangstigend voor kind en ouders. Verder is het om dezelfde reden belangrijk de ouders vooraf in te lichten over ED als bijwerking van het ondergaan van anesthesie. Het is een bijwerking waar het kind achteraf geen herinnering aan heeft en waarschijnlijk ook geen langdurige last van zal ondervinden.
Het wordt aanbevolen als eerste het kind te kalmeren en tot rust te brengen waarbij het kind behoed moet worden zichzelf schade toe te brengen. Alleen als het kind door zijn gedrag een gevaar is voor zichzelf, het operatie resultaat, of de eventueel aanwezige lijnen, is sedatie middels propofol of ander sedativum geïndiceerd.
Voor zowel patiënten als ouders/verzorgers is voorlichting en begeleiding van groot belang.
Kosten (middelenbeslag)
Clonidine is goedkoper dan Dexmedetomidine (gemiddeld € 1,09 voor 150 mcg clonidine tegen € 45,70 voor 400 mcg dexmedetomidine) waarbij bij kinderen 1 ampul clonidine volstaat voor een eenmalige gift. De kleinste ampul kost €6-7 en soms kan een ampul ook opgesplitst worden voor meerdere kinderen. Sommige adjuvante medicamenten kunnen tot een marginaal verlengd verblijf op de PACU leiden.
Het blijft van belang om preventieve maatregelen (medicamenteus en/of niet-medicamenteus middelen) te nemen bij verhoogd risico op ED.
Aanvaardbaarheid, haalbaarheid en implementatie
De aanbevelingen bestaan uit algemeen aanvaarde en reeds bekende middelen. Dus wat betreft de implementatie lijken er op voorhand geen obstakels.
Rationale
Aanbeveling-1
Er lijken voldoende aanwijzingen in de literatuur dat propofol-anesthesie minder risico geeft op het ontstaan van ED postoperatief dan sevofluraan-anesthesie. Na propofol-anesthesie is er een korte ontwakingstijd. Propofol heeft in de operatieve setting een relatief gunstig bijwerkingen profiel, specifieke contra-indicaties buiten beschouwing gelaten.
Aanbeveling-2 en 3
Indien er reden is voor sevofluraan-anesthesie te kiezen, dan helpt adjuvante medicatie zoals dexmedetomidine en clonidinehet risico op ED te verlagen. Uit de groep van opiaten lijken fentanyl en sufentanil het meest geschikt hiervoor. (Es)ketamine kan ook als adjuvans gebruikt worden, waarbij met mogelijke bijwerkingen rekening gehouden moet worden. Propofol heeft als adjuvans minder voordelen dan als primair anestheticum.
Onderbouwing
Achtergrond
Emergence delier (ED) is niet altijd te voorkomen. Het risico op ED is inherent aan het geven van anesthesie, zeker in bepaalde patiëntencategorieën. De anesthesioloog kan pre-, intra- en postoperatief keuzes maken om het risico op het ontwikkelen van ED postoperatief zoveel mogelijk te beperken. Er is tot op heden geen (landelijke) richtlijn die enig advies geeft om tot een keuze te komen tussen de beschikbare middelen.
Conclusies / Summary of Findings
|
Laag GRADE |
Propofol lijkt een verminderd risico te geven op het ontstaan van emergence delier bij kinderen die algehele anesthesie ondergaan in vergelijking met sevofluraan.
Bronnen: (Kanaya, 2014) |
|
Hoog GRADE |
Dexmedetomidine, fentanyl, ketamine of sufentanil vermindert het risico op emergence delier bij kinderen die algehele anesthesie met sevofluraan ondergaan (in vergelijking met placebo).
Bronnen: (Wang, 2017) |
|
Redelijk GRADE |
Clonidine, propofol of remifentanil vermindert waarschijnlijk het risico op emergence delier bij kinderen die algehele anesthesie met sevofluraan ondergaan (in vergelijking met placebo).
Bronnen: (Wang, 2017) |
|
Laag GRADE |
Midazolam in combinatie met sevofluraan zou het risico op emergence delier bij kinderen die algehele anesthesie ondergaan kunnen verminderen in vergelijking met placebo.
Bronnen: (Wang, 2017) |
|
Laag GRADE |
Dexmedetomidine in combinatie met sevofluraan zou het risico op emergence delier bij kinderen die algehele anesthesie ondergaan kunnen verminderen in vergelijking met midazolam.
Bronnen: (Wang, 2017) |
|
Zeer laag GRADE |
Het is onduidelijk of fentanyl in combinatie met sevofluraan het risico op emergence delier bij kinderen die algehele anesthesie ondergaan kan verminderen in vergelijking met midazolam.
Bronnen: (Wang, 2017) |
Samenvatting literatuur
Beschrijving studies
De studie van Kanaya (2014) beschrijft 14 prospectieve gerandomiseerde studies die sevofluraan en propofol met elkaar vergeleken bij kinderen jonger dan 15 jaar, in deze meta-analyse zijn 560 patiënten geïncludeerd die sevofluraan kregen en 548 patiënten die propofol kregen.
De netwerk meta-analyse van Wang (2017) vergeleek acht verschillende soorten adjuvantia (ketamine, propofol, dexmedetomidine, clonidine, midazolam, fentanyl, remifentanil en sufentanil) die gecombineerd werden met sevofluraan en vervolgens met sevofluraan plus placebo. In deze netwerk meta-analyse zijn in totaal 67 RCT’s geïncludeerd. Om medicatie met elkaar te vergelijken werden ze eerst afzonderlijk per studie vergeleken, meestal paarsgewijs. Vervolgens werden alle vergelijkingen in een netwerk meta-analyse gezet.
Resultaten
De studies in de meta-analyse van Kanaya (2014) gebruikten verschillende definities voor agitatie/emergence delier, een aantal studies gebruikten een PAED-score > 10 voor het vaststellen van emergence delier (Bryan, 2009; Köning, 2009) en de studie van Pieters (2010) gebruikte een PAED-score van ≥ 16 voor het vaststellen van emergence delier. Andere geïncludeerde studies gebruikten geen PAED-scores, maar andere methoden om het emergence delier of agitatie vast te stellen. De meta-analyse in figuur 1 laat zien dat er een klinisch relevant verschil is tussen propofol en sevofluraan in de incidentie van emergence delier; propofol geeft een minder groot risico geeft op het emergence delier in vergelijking met sevofluraan (OR 0.25, 95 % CI 0.16–0.39, P = 0.000).
Figuur 1 emergence delier bij propofol en sevofluraan
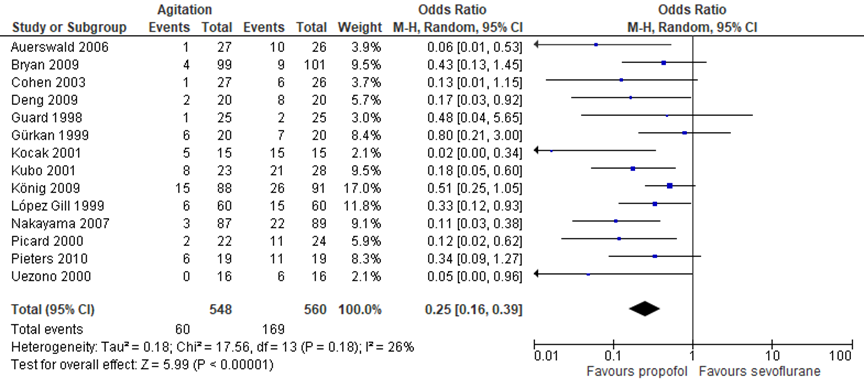
Onderstaande tabel (tabel 1) presenteert de resultaten van de netwerkmeta-analyse van Wang (2017), waarin de medicatie werd vergeleken met placebo (categorie 1) en de medicatie onderling waarbij duidelijk wordt welke medicatie het meest effectief is (categorie 2). Dit wordt ook weergegeven met de SUCRA-score, deze score geeft de rangorde aan; hoe dichter bij de 100 hoe waarschijnlijker dit medicijn in de top van rangorde staat. De resultaten laten zien dat alle acht de adjuvantia beter zijn dan placebo, en dat dexmedetomidine OR 0.39 (95%CI: 0.21 tot 0.68) en fentanyl OR 0.41 (95%CI: 0.21 tot 0.80) in combinatie met sevofluraan een lager risico geven op het ontstaan van een emergence delier.
Tabel 1 Emergence delier bij toediening van adjuvantia
|
Bewijskracht |
Klassificatie |
Interventie |
Interventie versus Placebo OR (95%CrI) |
SUCRA |
|
Hoge Zekerheid (Gemiddeld- to hoge-bewijskracht)
|
Categorie 1: Effectiever dan placebo |
Dexmedetomidine |
0.18 (0.12 tot 0.25) |
73.65 |
|
Fentanyl |
0.19 (0.12 tot 0.30) |
68.04 |
||
|
Sufentanil |
0.20 (0.08 tot 0.50) |
60.81 |
||
|
Ketamine |
0.21 (0.13 tot 0.34) |
59.99 |
||
|
Clonidine |
0.25 (0.14 tot 0.46) |
47.74 |
||
|
Remifentanil |
0.29 (0.13 tot 0.68) |
40.15 |
||
|
Propofol |
0.32 (0.18 tot 0.56) |
33.23 |
||
|
Lage zekerheid (Lage- tot Zeer lage-bewijskracht) |
Categorie 1: Effectiever dan placebo |
Midazolam |
0.46 (0.27 tot 0.77) |
16.33 |
|
Bewijskracht |
Klassificatie |
Interventie |
Interventie verses midazolam OR (95%CrI) |
SUCRA |
|
Lage Zekerheid (Lage- tot Zeer Lage-bewijskracht) |
Categorie 2: Kan één van de meest effectieve zijn |
Dexmedetomidine |
0.39 (0.21 tot 0.68) |
- |
|
Fentanyl |
0.41 (0.21 tot 0.80) |
- |
Bewijskracht van de literatuur
De bewijskracht voor de meta-analyse van Kanaya (2014) startte op hoog, is verlaagd met twee niveaus naar laag door de grote mate van heterogeniteit in de geïncludeerde studies; diverse studiepopulaties en diverse definities van emergence delier.
Bovenstaande tabel geeft ook weer hoe de bewijskracht is van de resultaten die gepresenteerd zijn in de netwerkmeta-analyse van Wang (2017). De bewijskracht is hoog voor de genoemde medicijnen in categorie 1 in vergelijking met placebo, met uitzondering van midazolam, daarvoor is de hoge bewijskracht verlaagd met twee niveaus gezien het geringe aantal patiënten (imprecisie) en heterogeniteit. De bewijskracht voor categorie 2 is verlaagd gezien de heterogeniteit en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende twee PICO’s:
P: patiënten < 18 jaar at risk voor emergence delier;
I: propofol;
C: sevofluraan anesthesie;
O: incidentie emergence delier en mate van emergence delier.
P: patiënten < 18 jaar at risk voor emergence delier;
I: adjuvant;
C: placebo/ander adjuvant;
O: incidentie emergence delier en mate van emergence delier.
Relevante uitkomstmaten
De werkgroep achtte de incidentie van emergence delier en de mate van emergence delier (gemeten met de PAED-score) voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De default grenzen van GRADE voor klinische besluitvorming zijn gebruikt in de beoordeling van de bewijskracht (1,25 en 0,8).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 22 januari 2020 met relevante zoektermen gezocht naar literatuur over risicofactoren voor een emergence delier, zie de module ‘Risicofactoren ED’. In dezelfde databases is op 20 februari 2020 met relevante zoektermen gezocht naar aanvullende literatuur over medicamenteuze interventies ter preventie van een emergence delier. De zoekverantwoording voor deze aanvullende search is weergegeven onder het tabblad Verantwoording. De aanvullende literatuurzoekactie leverde 110 aanvullende treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s, bij voorkeur vergelijkende studies (cohort) naar medicamenteuze interventies, primair (origineel) onderzoek uitgevoerd bij N>2, er werd beschreven hoe emergence delier werd vastgesteld en werd geëvalueerd, de studiepopulatie betrof kinderen opgenomen op de PACU of kinderafdeling. Artikelen die handelden over PD werden geëxcludeerd. Op basis van titel en abstract werden in eerste instantie twee netwerk meta-analyses studies voorgeselecteerd uit de search over risicofactoren. Uit de aanvullende search zijn drie reviews voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 3 review studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 netwerk meta-analyses geselecteerd.
Resultaten
Twee netwerkmeta-analyses werden gevonden in het literatuuronderzoek (Guo, 2016; Wang, 2017). De netwerkmeta-analyse van Guo (2016) beschrijft 5 verschillende anesthetica (desfluraan, halothaan, isofluraan, propofol, en sevofluraan) en bekijkt welke van deze anesthetica het laagste risico op emergence delier geeft. In de Nederlandse setting zijn niet al deze anesthetica van toepassing, het gaat eigenlijk om de vergelijking sevofluraan en propofol. Daarom heeft de werkgroep besloten om alleen deze vergelijking mee te nemen. Om deze vergelijking uit te werken is de meta-analyse van Kanaya (2014) als uitgangspunt genomen in plaats van de netwerkmeta-analyse van Guo. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Almenrader N, Passariello M, Coccetti B, Haiberger R, Pietropaoli P. Premedication in children: a comparison of oral midazolam and oral clonidine. Paediatr Anaesth. 2007 Dec;17(12):1143-9.
- Celebi S, Topak M, Develioglu ON, Caglar E, Yalcin E, Unsel M, Kulekci M. Effect of thermal welding tonsillectomy on emergence agitation. J Craniofac Surg. 2013;24(5):1844-8.
- Dahmani S, Stany I, Brasher C, et al. Pharmacological prevention of sevoflurane- and desflurane-related emergence agitation in children: a meta-analysis of published studies. Br J Anaesth 2010; 104:216– 223.
- Guo J., Jin X., Wang H., Yu J., Zhou X., Cheng Y., Tao Q., Liu L., Zhang J. (2017). Emergence and Recovery Characteristics of Five Common Anesthetics in Pediatric Anesthesia: a Network Meta-analysis. Mol Neurobiol; 54:4353–4364.
- Kanaya K., Kuratani N., Satoh D. Kurosawa S. (2014). Lower incidence of emergence agitation in children after propofol anesthesia compared with sevoflurane: a meta-analysis of randomized controlled trials. J Anesth; 28:4–11.
- Kim SJ, Oh YJ, Kim KJ, Kwak YL, Na S. The effect of recorded maternal voice on perioperative anxiety and emergence in children. Anaesth Intensive Care. 2010 Nov;38(6):1064-9.
- Keles S, Kocaturk O. Postoperative discomfort and emergence delirium in children undergoing dental rehabilitation under general anesthesia: comparison of nasal tracheal intubation and laryngeal mask airway. J Pain Res. 2018 Jan 4;11:103-110.
- Lee YC, Kim JM, Ko HB, Lee SR. Use of laryngeal mask airway and its removal in a deeply anaesthetized state reduces emergence agitation after sevoflurane anaesthesia in children. J Int Med Res. 2011;39(6):2385-92.
- Ohashi N, Denda S, Furutani K, Yoshida T, Kamiya Y, Komura R, Nishimaki H, Iinuma Y, Hirayama Y, Naitou S, Nitta K, Baba H. Ultrasound-guided ilioinguinal/iliohypogastric block did not reduce emergence delirium after ambulatory pediatric inguinal hernia repair: a prospective randomized double-blind study. Surg Today. 2016 Aug;46(8):963-9.
- Wang X., Deng Q., Liu B, Yu Xiangdi. (2017). Drugs with Sevoflurane for Pediatric Anesthesia: A Network Meta-Analysis. Mol Neurobiol; 54:7312–7326.
- Wang H, Liu G, Fu W, Li ST. The effect of infraorbital nerve block on emergence agitation in children undergoing cleft lip surgery under general anesthesia with sevoflurane. Paediatr Anaesth. 2015 Sep;25(9):906-10.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Kanaya, 2014 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Unclear |
Yes |
|
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for exampleChi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat zijn de meest effectieve, best hanteerbare en veilige medicamenteuze interventies ter preventie of voor het behandelen van kinderen met een emergence delier?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Kanaya, 2014
|
SR and meta-analysis of 14 RCTs
Country: Japan
Source of funding and conflicts of interest: No conflicts of interest
|
Inclusion criteria SR: prospective RCT comparing propofol and sevoflurane, ambulatory procedures on children <16 years, reporting incidence of emergence delirium after general anaesthesia
Exclusion criteria SR: articles with insufficient data
Important patient characteristics at baseline: 548 patients received propofol 560 patients received sevoflurane |
Describe intervention: Propofol with or without premedication |
Describe control: Sevoflurane with or without premedication
|
For how many participants were no complete outcome data available? unknown
|
Outcome measure OR = 0.25 (95% CI 0.16–0.39) p=0.000
|
Indicating that propofol resulted in a lower incidence of EA compared to sevoflurane
|
Risk of bias table network meta-analysis (Wang, 2017): GRADE-beoordeling per vergelijking
|
Comparison |
Number of studies |
Within-study bias |
Reporting bias |
Indirectness |
Imprecision |
Heterogeneity |
Incoherence |
Confidence rating |
|
Clonidine:Dexmedetomidine |
1 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
No concerns |
Moderate |
|
Clonidine:Fentanyl |
1 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Clonidine:Midazolam |
3 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
Major concerns |
Very low |
|
Clonidine:Placebo |
6 |
Some concerns |
Undetected |
No concerns |
No concerns |
No concerns |
No concerns |
Moderate |
|
Dexmedetomidine:Fentanyl |
3 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Dexmedetomidine:Ketamine |
1 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Dexmedetomidine:Midazolam |
4 |
No concerns |
Undetected |
No concerns |
No concerns |
Major concerns |
No concerns |
Low |
|
Dexmedetomidine:Placebo |
22 |
No concerns |
Undetected |
No concerns |
No concerns |
No concerns |
No concerns |
High |
|
Dexmedetomidine:Propofol |
1 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
No concerns |
Moderate |
|
Fentanyl:Ketamine |
4 |
Some concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Very low |
|
Fentanyl:Placebo |
12 |
No concerns |
Undetected |
No concerns |
No concerns |
No concerns |
No concerns |
High |
|
Fentanyl:Propofol |
1 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
No concerns |
Moderate |
|
Fentanyl:Sufentanil |
3 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Ketamine:Midazolam |
1 |
No concerns |
Undetected |
No concerns |
Some concerns |
Major concerns |
No concerns |
Very low |
|
Ketamine:Placebo |
10 |
No concerns |
Undetected |
No concerns |
No concerns |
No concerns |
No concerns |
High |
|
Ketamine:Propofol |
2 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
No concerns |
Moderate |
|
Midazolam:Placebo |
6 |
No concerns |
Undetected |
No concerns |
No concerns |
Major concerns |
No concerns |
Low |
|
Midazolam:Propofol |
1 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Placebo:Propofol |
7 |
No concerns |
Undetected |
No concerns |
No concerns |
Some concerns |
No concerns |
Moderate |
|
Placebo:Remifentanil |
4 |
No concerns |
Undetected |
No concerns |
No concerns |
Some concerns |
No concerns |
Moderate |
|
Placebo:Sufentanil |
2 |
No concerns |
Undetected |
No concerns |
No concerns |
No concerns |
No concerns |
High |
|
Clonidine:Ketamine |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Clonidine:Propofol |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Clonidine:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Clonidine:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Dexmedetomidine:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Dexmedetomidine:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Fentanyl:Midazolam |
0 |
No concerns |
Undetected |
No concerns |
Some concerns |
Major concerns |
No concerns |
Very low |
|
Fentanyl:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Ketamine:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Ketamine:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Midazolam:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Midazolam:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Some concerns |
Some concerns |
No concerns |
Moderate |
|
Propofol:Remifentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Propofol:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
Remifentanil:Sufentanil |
0 |
No concerns |
Undetected |
No concerns |
Major concerns |
No concerns |
No concerns |
Low |
|
0 studies betekent alleen indirect bewijs |
||||||||
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Dahmani, 2010a |
Verouderd ten opzichte van geïncludeerde studies |
|
Dahmani, 2010b |
Verouderd ten opzichte van geïncludeerde studies |
|
Yuen, 2010 |
Verouderd ten opzichte van geïncludeerde studies |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2021
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Deze richtlijn is ontwikkeld in samenwerking met:
- V&VN kinderen
- V&VN IC
- Stichting Kind en Ziekenhuis
- Nederlandse Associatie van Physician Assistants
Doel en doelgroep
Doel
Het doel van de richtlijn is om de zorg voor en behandeling van het kritisch zieke kind met een PD en voor kinderen met een ED verder te optimaliseren en om zo de overlevingskansen verder te optimaliseren. De richtlijn wil op wetenschappelijke gronden aanbevelingen doen voor optimale preventie, diagnostiek en behandeling van een PD en ED in het algemene/academische ziekenhuis door het verwerken van recente wetenschappelijke inzichten. Meer specifiek zijn de aanbevelingen over medicatie aangepast.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen met een PD en ED.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met een PD te maken hebben.
Werkgroep
- Prof. Dr. J.J.M.H. (Jacqueline) Strik, psychiater en voorzitter van de werkgroep, werkzaam in MUMC+ te Maastricht, NVvP
- Dr. J.N.M. (Jan) Schieveld, psychiater, werkzaam als adviseur bij het MUMC+ te Maastricht en de Mutsaers Stichting te Venlo, NVvP
- Dr. L. (Lisette) ‘t Hart-Kerkhoffs, kinder- en jeugdpsychiater, werkzaam bij Levvel (voorheen de Bascule) en het Emma kinderziekenhuis AUMC Amsterdam, NVvP
- Drs. S.B.J. (Bas) Oude Ophuis, kinder- en jeugdpsychiater, werkzaam in het UMC Utrecht en Prinses Máxima Centrum, NVvP
- Dr. H. (Hennie) Knoester, kinderarts-intensivist, werkzaam in Emma Kinderziekenhuis, AUMC, Amsterdam, NVK
- Prof. Dr. S. N. (Saskia) de Wildt, kinderarts-intensivist, klinisch farmacoloog, werkzaam in het Radboud UMC, Nijmegen en Erasmus MC, Rotterdam, NVK
- Dr. W.G. (Erwin) Ista, universitair hoofddocent verplegingswetenschap, kinder-IC verpleegkundige, werkzaam in Erasmus MC, Rotterdam, V&VN IC
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in Emma Kinderziekenhuis UMC, Amsterdam, V&VN kinderen
- G.S.M. (Dianne) van der Weerden, physician assistant, werkzaam in UMC Utrecht, NAPA
- Dr. dr. M.F. (Markus) Stevens, kinderanesthesioloog, AUMC Amsterdam, NVA
- Drs. E. (Erik) Koomen, anesthesioloog-kinderintensivist, werkzaam in UMC, Utrecht, NVA
Klankbordgroep
- Dr. C. (Coriene) E. Catsman-Berrevoets, neuroloog-kinderneuroloog, voor pensionering (juli 2020) werkzaam in Erasmus MC/Sophia kinderziekenhuis, Rotterdam. Nu werkzaam HAGA/Juliana Kinderziekenhuis, Den Haag
- J. (Janine) Pingen, Stichting Kind en Ziekenhuis te Utrecht, tot 1 december 2020
- R. (Rowy) Uitzinger, Stichting Kind en Ziekenhuis te Utrecht, vanaf 1 december 2020
Met ondersteuning van
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Mirre) Den Ouden, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Catsman |
Kinderneuroloog, |
geen |
geen |
geen |
|
’t Hart-Kerkhofs |
Kinder- en jeugdpsychiater |
geen |
geen |
geen |
|
Ista |
Universitair hoofddocent en verplegingswetenschapper |
Lid cie. richtlijnen V&VN tot 01-01-2019, lid CCMO |
Ontwikkelaar SOS-PD schaal |
Andere werkgroepleden kritisch laten tegenlezen |
|
Koomen |
Anesthesioloog-kinderintensivist |
geen |
Bezig met ontwikkeling nieuwe PICU met devices bedrijven |
Geen, aangezien dit niet richtlijn onderwerpen betreft |
|
Knoester |
Kinderarts-intensivist |
geen |
geen |
geen |
|
Molag |
Adviseur, methodoloog |
geen |
geen |
geen |
|
de Neef |
Verpleegkundig onderzoeker kinder-IC |
geen |
geen |
geen |
|
Oude Ophuis |
Kinder- en jeugdpsychiater |
geen |
geen |
geen |
|
Pingen / Uitzinger |
Stichting kind en ziekenhuis, |
geen |
geen |
geen |
|
Strik |
Psychiater Kind en Jeugd, hoogleraar kind en jeugd psychiatrie en somatische comorbiditeit hoofdopleider psychiatrie, plaatsvervangend medisch afdelingshoofd |
geen |
geen |
geen |
|
Schieveld |
Gepensioneerd kinder- en jeugdpsychiater |
adviseur MUMC+ en Mutsaers Venlo |
geen |
geen |
|
Stevens |
Kinderanesthesioloog |
geen |
Grant onderzoek post hospital behavioral questionnaire |
geen |
|
Van der weerden |
Physician assistant PICU |
geen |
geen |
geen |
|
De Wildt |
Kinderarts-intensivist Klinisch farmacoloog |
Directeur Kinderformularium |
Lidmaatschap wetenschappelijke adviesraden en editorial boards, zie verder volledige belangenverklaring |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de Klankbordgroep en een enquête bij ouders van kinderen die een delier hebben doorgemaakt. Een verslag hiervan (zie bijlagen) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten met een schriftelijke uitvraag bij wetenschappelijke verenigingen en hoofden van de kinder-IC. Daaruit kwam de behoefte naar voren ook een addendum emergence delier te ontwikkelen.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Pediatrisch Delier 2014 op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door ouders via een uitvraag van Kind en Ziekenhuis, een schriftelijke Invitational conference en consultatie onder afdelingshoofden van de kinder-IC. De aangedragen knelpunten zijn verwerkt in de richtlijn.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de bijlagen.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur).
Indicatorontwikkeling
Er werd besloten geen indicatoren te ontwikkelen. De bij de vorige richtlijn opgeleverde indicatoren werden niet gebruikt in de praktijk.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules werden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptrichtlijnmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodules werden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
