Medicamenteuze interventies ter preventie van een pediatrisch delier (PD)
Uitgangsvraag
Welke waarde heeft een medicamenteuze interventie ter preventie van een pediatrisch delier (op de kinder-IC en kinderafdeling)?
Aanbeveling
Geef geen medicatie zoals antipsychotica ter preventie van PD.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Alle beschikbare studies uitgevoerd bij kinderen hebben methodologisch forse beperkingen in de zin dat de onderzoeksgroep, de interventie of de uitkomstmaten niet goed zijn omschreven en geen controlegroep beschikbaar is noch onderscheid in type delier is gemaakt. Placebogecontroleerd onderzoek naar antipsychotica bij deze indicatie bij kinderen ontbreekt. Daarom werd de literatuur bij volwassenen bestudeerd. Het gebruik van haloperidol had geen klinisch relevant effect op alle uitkomstmaten (ernstige bijwerkingen, mortaliteit, incidentie van het delier, duur van het delier, verblijfsduur IC en kwaliteit van leven) in vergelijking met placebo. Dit geldt ook voor het gebruik van risperidon, waarbij ook geen klinisch relevante effecten werden gezien op de duur van het delier. Er is slechts een lage evidentie dat haloperidol de verblijfsduur in het ziekenhuis iets verkort in vergelijking met placebo. De overall bewijskracht is echter laag, mede gezien het feit dat men geen onderscheid maakt in type delier.
Ook bij volwassen of ouderen bestaat over het algemeen geen evidentie voor de medicamenteuze preventie van delier. Het preventief gebruik van medicatie wordt dan ook niet geadviseerd. Wel is het belangrijk om preventief in te zetten op niet-medicamenteuze interventies en tijdige screening bij patiënten met een hoog-risicoprofiel (zie hiervoor de module ‘Niet-medicamenteuze interventies PD’).
Er zijn beschrijvingen van een delier dat uitgelokt wordt door medicatie bij volwassenen. Hierbij gaat het onder andere om benzodiazepines delier dat uitgelokt wordt door medicatie bij volwassenen. Hierbij gaat het onder andere om benzodiazepines en antipsychotica met meer anticholinergische effecten zoals clozapine en olanzapine die vooral bij kwetsbare ouderen een verhoogd risico geven (Alagiakrishnan & Wiens, 2004).
Ondanks dat jonge kinderen net als ouderen een risicogroep vormen voor het ontstaan van een delier, wordt hierover bij hen niet gerapporteerd. De werkgroep acht het gebruik van medicatie (bijvoorbeeld antipsychotica) ter preventie van PD niet aangewezen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Preventieve behandeling gaat in essentie over het voorkomen van het PD. Voor zowel patiënten als ouders/verzorgers zijn hierbij voorlichting en niet-medicamenteuze interventies van belang, in het bijzonder voor de hoog-risicogroepen (zie de module ‘Risicofactoren PD’).
Kosten (middelenbeslag)
Gezien de kosten welke het PD met zich meebrengt, vanwege onder andere een langer verblijf in het ziekenhuis of op de kinder-IC (ligduur), zijn preventieve interventies van belang. Echter zullen deze interventies niet-medicamenteus van aard zijn. Voor preventief medicatiegebruik is onvoldoende bewijskracht.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen problemen te verwachten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Aangezien effectiviteit niet werd aangetoond en er wel potentiële bijwerkingen zijn wordt preventieve medicatie ontraden.
Onderbouwing
Achtergrond
Medicamenteuze interventies worden toegepast bij het pediatrisch delier (PD)om symptomen als angst, onrust, hallucinaties en verstoorde slaap te voorkomen. In de praktijk gaat het veelal om primaire preventie, waarbij het ontstaan van een delier wordt getracht te voorkomen. Hierbij is het van belang om in een vroeg stadium een risicotaxatie te doen, waarbij risicogroepen en risicofactoren in kaart worden gebracht. De risicofactoren zoals genoemd in de module ‘Risicofactoren PD’ kunnen hierin ondersteunend zijn.
Deze module spitst zich toe op de vraag of medicatie gegeven kan worden ter preventie van een PD op de kinder-IC, de afdeling of op de SEH.
Conclusies / Summary of Findings
Ernstige bijwerkingen (cruciaal)
|
Zeer laag GRADE |
Er werd geen klinisch relevant verschil gezien in ernstige bijwerkingen, tussen preventieve behandeling met haloperidol of placebo.
Bronnen: (Al-Qadheeb, 2016; Page, 2013; Van den Boogaard, 2018; Wang, 2012) |
Mortaliteit (cruciaal)
|
Laag GRADE |
Preventieve behandeling of behandeling van het subsyndromale delier met haloperidol had geen effect op mortaliteit.
Bronnen: (Al-Qadheeb, 2016; Page, 2013; Van den Boogaard, 2016; Wang, 2012) |
Incidentie van delier
|
Zeer laag GRADE |
Het effect van preventieve behandeling met haloperidol op de incidentie van delier is onzeker.
Bronnen: (Al Qadheeb, 2016; van den Boogaard, 2018; Wang, 2012) |
Duur van delier
|
Laag GRADE |
Preventieve behandeling met antipsychotica (risperidon of haloperidol) lijkt de gemiddelde duur van delier niet te verminderen.
Bronnen: (Girard, 2010; Wang, 2012; Hakim, 2012) |
Ziekenhuis verblijfsduur
|
Laag GRADE |
De verblijfsduur in het ziekenhuis lijkt iets korter na preventieve behandeling met haloperidol dan na placebo.
Bronnen: (Page, 2013; Van Den Boogaard, 2018; Wang, 2012) |
Verblijfsduur IC
|
Laag GRADE |
Preventieve behandeling met haloperidol lijkt geen invloed te hebben op de IC verblijfsduur.
Bronnen: (AlQadheeb, 2016; Girard, 2010; Page, 2013 |
Kwaliteit van leven
|
Laag GRADE |
Preventieve behandeling met haloperidol had geen effect op kwaliteit van leven.
Bronnen: (Rood, 2019 |
Samenvatting literatuur
Beschrijving studies
Studies bij kinderen
Om de effectiviteit van medicamenteuze interventies te beoordelen zijn RCT’s nodig waarin de medicamenteuze interventie wordt vergeleken met een controlegroep. Die studies zijn voor kinderen echter niet voorhanden. Daarom is verder gezocht naar studies die zijn uitgevoerd bij volwassenen.
Haloperidol versus placebo
De literatuursearch bij volwassenen leverde één geschikte meta-analyse op (Zayed, 2019). Hierin staan vier mogelijk bruikbare RCT’s beschrevens (Girard, 2010; Page, 2013, Van den Boogaard, 2018; Wang, 2012). Voorts is hier een RCT in opgenomen die zich richt op de behandeling van een subsyndromaal delier (Al-Qadheeb, 2016).
Overige antipsychotica versus placebo
De literatuursearch bij volwassenen leverde één geschikte meta-analyse op (Al-Qadheeb, 2014). Hierin is één RCT opgenomen die zich richt op de behandeling van een subsyndromaal delier, waarbij risperidon vergelijken wordt met placebo (Hakim, 2012).
Overige middelen versus placebo
De literatuursearch bij volwassenen leverde één geschikte meta-analyse op (Al-Qadheeb, 2014). Hierin is één RCT opgenomen die clonidine vergelijkt met placebo (Rubino, 2010).
Cruciale uitkomstmaten
Ernstige bijwerkingen
De gerapporteerde bijwerkingen voor haloperidol versus placebo werden weergegeven in een forest plot (zie figuur 1). Eén studie beschreef patiënten met een subsyndromaal delier (Al-Qadheeb, 2016) en liet geen klinisch relevant effect op ernstige bijwerkingen zien met een RR 0,80; 95% BI (0,32 tot 2,00). Er werd echter geen onderscheid gemaakt in bijwerkingen op basis van type delier. De overige studies betroffen preventieve interventies (Page, 2013; Van den Boogaard, 2018; Wang, 2012). Hier werden geen statistisch significante verschillen gevonden tussen de groepen op het gebied van ernstige bijwerkingen (serious adverse events) RR 0,74; 95% BI (0,40 tot 1,39); drie studies met 1031 versus 1006 patiënten) (zie figuur 1).
Figuur 1 Ernstige bijwerkingen bij haloperidol versus placebo
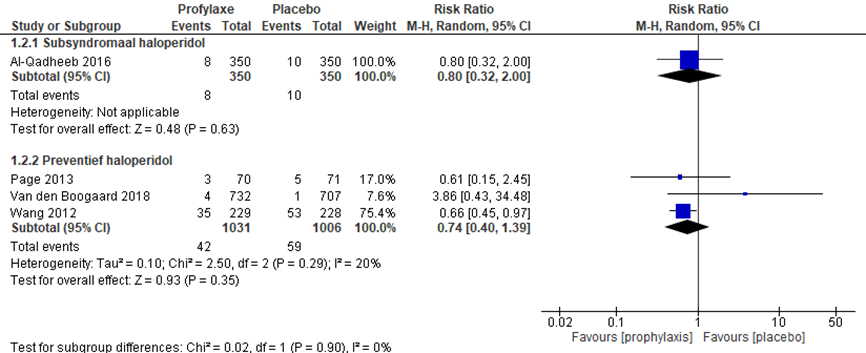
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Zayed (2019)
Mortaliteit
Er werd geen klinisch relevant verschil gezien in mortaliteit wanneer haloperidol (1067 patiënten) vergeleken werd met placebo (1041 patiënten) op de korte termijn (≤ 28 dagen) tussen beide groepen RR 0,95; 95% BI (0,77; 1,17) (zie figuur 2).
Twee studies naar behandeling van het subsyndromale delier lieten ook geen klinische relevant verschil zien voor haloperidol (Al-Qadheeb, 2016) RR 1,29;95% BI (0,54 tot 3,06) en risperidon (Hakim 2012) RR 1,96; 95% BI (0,18 tot 20,94), 101 patiënten).
Figuur 2 Mortaliteit bij medicamenteuze preventie versus placebo
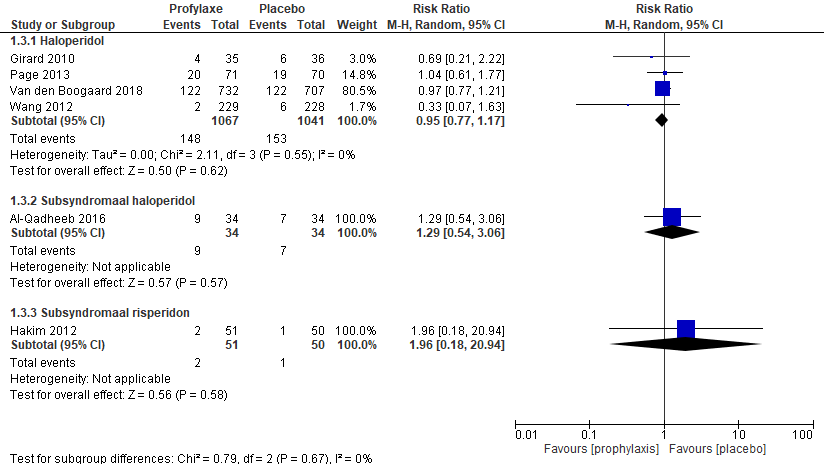
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: (Zayed, 2019; AlQadheeb, 2014).
Belangrijke uitkomstmaten
Incidentie van delier
De uitkomst incidentie van delier werd bestudeerd in vier RCT’s waarin haloperidol werd vergeleken met placebo. De resultaten van de meta-analyse zijn weergegeven in een forrest plot (zie figuur 3). Eén studie beschreef patiënten met een subsyndromaal delier (Al-Qadheeb, 2016). Bij subsyndromaal delier behandeling met haloperidol werd een mogelijke voorkeur voor placebo gezien RR 1,50 95% BI (0,70 tot 3,20). Bij een andere studie (Hakim, 2012) over het subsyndromaal delier leek risperidon een gunstig effect te hebben RR 0,40;95% BI (0,18 tot 0,89). Bij de andere twee preventieve studies (Van den Boogaard, 2018; Wang, 2012) werd geen klinisch relevant verschil gevonden in de incidentie van delier voor de vergelijking haloperidol (patiënten) versus placebo (patiënten), hierbij werd een RR gezien van 0,85; 95% BI (0,56 tot 1,29).
Figuur 3 Delier incidentie bij haloperidol (prophylaxis) versus placebo

Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Zayed (2019)
Duur van het delier
Behandeling met antipsychotica (risperidon of haloperidol) versus placebo had geen klinisch relevant effect op de gemiddelde duur van het delier. Voor preventief haloperidol was dit 0 dagen; 95% BI (-2,09 tot 2,09), 523 patiënten en voor subsyndromaal delier risperidon 0 dagen 95% BI (-1,09 tot 1,09), 101 patiënten (zie figuur 4).
Figuur 4 Duur van delier bij medicamenteuze preventie versus placebo

Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Verblijfsduur in ziekenhuis
In de geïncludeerde studies leek de verblijfsduur in het ziekenhuis iets korter na haloperidol behandeling dan placebo met een gemiddeld verschil van -2,31 dagen; 95% BI (-4,80 tot 0,18, I2=93%, P=0,07) (zie figuur 5).
Figuur 5 Verblijfsduur in ziekenhuis bij haloperidol (profylaxe) versus placebo
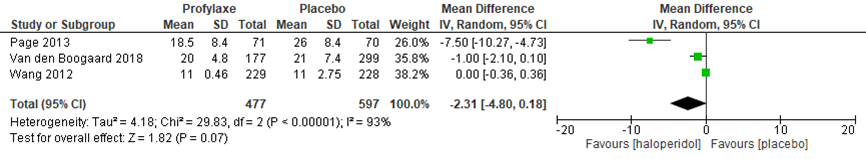
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Zayed (2019)
Verblijfsduur op intensive care
Er werd geen klinisch relevant verschil gezien in de verblijfsduur op de IC: gemiddeld verschil 0,12 dagen; 95% BI (-0,84; 1,08) (zie figuur 6).
Figuur 6 Verblijfsduur op intensive care bij haloperidol versus placebo

Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Zayed (2019)
Kwaliteit van leven
Dit werd gemeten in de studie van Rood 2019 met de SF12-vragenlijst; één en zes maanden na IC opname. In deze studie werden 558 patiënten behandeld met haloperidol en 329 met placebo. De score na zes maanden voor de fysieke component was 39 ± 11 voor beide groepen en voor de mentale component 50 ± 10 en 51 ± 10 (Rood 2019).
Bewijskracht van de literatuur
Ernstige bijwerkingen
De bewijskracht van een RCT start hoog. De bewijskracht voor de uitkomstmaat ernstige bijwerkingen is met drie niveaus verlaagd naar zeer laag gezien extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen); en wegens imprecisie (zeer brede betrouwbaarheidsintervallen, geen onderscheid in type delier).
Mortaliteit
De bewijskracht van een RCT start hoog. De bewijskracht voor de uitkomstmaat mortaliteit is met twee niveaus verlaagd naar laag gezien de extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen) en imprecisie (grenzen van klinische relevantie worden overschreden, geen onderscheid in type delier).
Incidentie delier
De bewijskracht van een RCT start hoog. De bewijskracht voor de uitkomstmaat incidentie delier is met één niveau verlaagd naar zeer laag gezien de extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen) en wegens imprecisie (grenzen van klinische relevantie worden overschreden, geen onderscheid in type delier).
Duur van delier
De bewijskracht voor de uitkomstmaat duur van delier is met twee niveaus verlaagd naar redelijk gezien de extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen) en imprecisie (grenzen van klinische relevantie worden overschreden, geen onderscheid in type delier).
Verblijfsduur ziekenhuis
De bewijskracht voor de uitkomstmaat verblijfsduur ziekenhuis is met drie niveaus verlaagd naar zeer laag gezien extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen); de heterogene resultaten en imprecisie (grenzen van klinische relevantie worden overschreden, geen onderscheid in type delier).
Verblijfsduur IC
De bewijskracht voor de uitkomstmaat verblijfsduur IC is met twee niveaus verlaagd naar redelijk gezien de extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen) en imprecisie (grenzen van klinische relevantie worden overschreden, geen onderscheid in type delier).
Kwaliteit van leven
De bewijskracht van een RCT start hoog. De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd naar laag gezien de extrapoleerbaarheid (bias ten gevolge van indirectheid aangezien de studies werden uitgevoerd bij volwassenen in plaats van kinderen) en imprecisie (het betrof slechts één studie, geen onderscheid in type delier).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van medicamenteuze interventies ten opzichte van placebo ter preventie van een pediatrisch delier (op de kinder-IC en kinderafdeling)?
P: patiënten met een pediatrisch delier (hypo/hyperactief);
I: medicamenteuze interventies ter preventie en behandeling van een pediatrisch delier;
C: placebo;
O: mortaliteit, ernstige bijwerkingen, incidentie van delier, duur van het PD, verblijfsduur IC en ziekenhuis, duur van mechanische ventilatie en kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte ernstige bijwerkingen en mortaliteit van een PD voor de besluitvorming cruciale uitkomstmaten; incidentie PD, duur van het PD, verblijfsduur in het ziekenhuis en op kinder-IC de duur van mechanische ventilatie en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Grenzen klinische relevantie
Voor ernstige bijwerkingen werd uitgegaan van een klinisch relevant verschil van RR< 0,80 of > 1,25.
De werkgroep definieerde een reductie van de incidentie van delier van RR<0,80 of >1,25 als een klinisch (patiënt) relevant verschil.
Voor duur van het delier werd uitgegaan van een klinisch relevant verschil van 1 dag.
Voor verblijfsduur in het ziekenhuis werd uitgegaan van een klinisch relevant verschil van 1 dag.
Voor verblijfsduur op de kinder-IC werd uitgegaan van een klinisch relevant verschil van 1 dag.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 20 februari 2019 met relevante zoektermen gezocht naar nieuwe literatuur over medicamenteuze interventies ter preventie en behandeling van een PD. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 574 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s naar medicamenteuze interventies met bijvoorbeeld haloperidol, olanzapine, risperidon of quetiapine, primair (origineel) onderzoek uitgevoerd bij N> 2, er werd beschreven hoe het delier werd vastgesteld en geëvalueerd, de studiepopulatie betrof kinderen opgenomen op de kinder-IC of kinderafdeling. Artikelen die handelden over delier na anesthesie (emergence delier) werden geëxcludeerd en worden elders in deze richtlijn beschreven. Op basis van titel en abstract werden in eerste instantie 186 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens al deze studies geëxcludeerd aangezien deze de PICO niet beantwoordden of niet het juiste onderzoeksdesign hadden.
Aangezien de vraag niet beantwoord kon worden, is gebruik gemaakt van een vergelijkbare search naar preventieve interventies bij volwassenen op de IC. Daarom werd in de databases Medline (via Ovid) en Embase (via embase.com) een search verricht op 23 maart 2018, deze search leverde 394 hits op. De search werd geüpdate op 10 juli 2019, deze update leverde 103 hits op. Van deze 394+103 hits werden er dertien geselecteerd en fulltekst ingezien. Eén artikel werd geëxcludeerd (zie exclusietabel). Verschillende meta-analyses (Zayed, 2019 en Al-Qadheeb, 2014) leverden uiteindelijk zes RCT’s op die voldeden aan de PICO (Girard, 2010; Page, 2013; Van den Boogaard, 2018; Rood, 2019; Wang, 2012; Rubino, 2010). Twee aanvullende RCT’s hadden betrekking op ‘behandeling’ van het subsyndromale delier, maar werden om die reden beschouwd als preventieve studies (Al-Qadheeb, 2016; Hakim, 2012). Twee andere meta-analyses en systemische reviews (Herling, 2018, Santos, 2017) zijn ook beoordeeld, maar bevatten geen nieuwe studies. De resultaten hieronder worden uitgesplitst naar type medicatie.
Resultaten
Er werden acht studies opgenomen in de literatuuranalyse over de preventieve behandeling van het PD. Voor de belangrijkste studiekarakteristieken en resultaten wordt verwezen naar de evidencetabellen. Voor de beoordeling van de individuele studieopzet (risk of bias) wordt verwezen naar de systematische reviews.
Referenties
- Al-Qadheeb NS, Skrobik Y, Schumaker G, et al. Preventing ICU Subsyndromal Delirium Conversion to Delirium With Low-Dose IV Haloperidol: A Double-Blind, Placebo-Controlled Pilot Study. Crit Care Med. 2016;44(3):583–591.
- Al-Qadheeb NS, Balk EM, Fraser GL, Skrobik Y, Riker RR, Kress JP, Whitehead S, Devlin JW. Randomized ICU trials do not demonstrate an association between interventions that reduce delirium duration and short-term mortality: a systematic review and meta-analysis. Crit Care Med. 2014 Jun;42(6):1442-54.
- Alagiakrishnan K, Wiens CA. An approach to drug induced delirium in the elderly. Postgrad Med J. 2004;80(945):388-393.
- Girard TD, Pandharipande PP, Carson SS, Schmidt GA, Wright PE, Canonico AE, Pun BT, Thompson JL, Shintani AK, Meltzer HY, Bernard GR, Dittus RS, Ely EW; MIND Trial Investigators. Feasibility, efficacy, and safety of antipsychotics for intensive care unit delirium: the MIND randomized, placebo-controlled trial. Crit Care Med. 2010 Feb;38(2):428-37.
- Hakim SM, Othman AI, Naoum DO. Early treatment with risperidone for subsyndromal delirium after on-pump cardiac surgery in the elderly: a randomized trial. Anesthesiology. 2012;116(5):987–997.
- Herling SF, Greve IE, Vasilevskis EE, Egerod I, Bekker Mortensen C, Møller AM, Svenningsen H, Thomsen T. Interventions for preventing intensive care unit delirium in adults. Cochrane Database Syst Rev. 2018 Nov 23;11:CD009783.
- Page VJ, Ely EW, Gates S, Zhao XB, Alce T, Shintani A, Jackson J, Perkins GD, McAuley DF. Effect of intravenous haloperidol on the duration of delirium and coma in critically ill patients (Hope-ICU): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2013 Sep;1(7):515-23.
- Rood PJT, Zegers M, Slooter AJC, et al. Prophylactic Haloperidol Effects on Long-term Quality of Life in Critically Ill Patients at High Risk for Delirium: Results of the REDUCE Study. Anesthesiology. 2019;131(2):328–335.
- van den Boogaard M, Slooter AJC, Brüggemann RJM, Schoonhoven L, Beishuizen A, Vermeijden JW, Pretorius D, de Koning J, Simons KS, Dennesen PJW, Van der Voort PHJ, Houterman S, van der Hoeven JG, Pickkers P; REDUCE Study Investigators, van der Woude MCE, Besselink A, Hofstra LS, Spronk PE, van den Bergh W, Donker DW, Fuchs M, Karakus A, Koeman M, van Duijnhoven M, Hannink G. Effect of Haloperidol on Survival Among Critically Ill Adults With a High Risk of Delirium: The REDUCE Randomized Clinical Trial. JAMA. 2018 Feb 20;319(7):680-690.
- Wang, E.H.Z., Mabasa, V.H., Loh, G.W., Ensom, M.H.H., (2012). Haloperidol dosing strategies in the treatment of delirium in the critically-ill. Neurocritical Care, 16, 170-183.
- Zayed Y, Barbarawi M, Kheiri B, Banifadel M, Haykal T, Chahine A, Rashdan L, Aburahma A, Bachuwa G, Seedahmed E. Haloperidol for the management of delirium in adult intensive care unit patients: A systematic review and meta-analysis of randomized controlled trials. J Crit Care. 2019 Apr;50:280-286.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the optimal pharmacological prophylaxis and treatment of delirium?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Zayed, 2019 |
SR and meta-analysis of (RCTs / cohort / case-control studies)
Literature search up to (month/year)
A: Girard, 2010 B: Wang, 2012 C: Page, 2013 D: Al-Qadheeb, 2016 E: Van den Boogaard, 2018 F: Girard, 2018
Study design: RCT
Setting and Country: A: Multi-center, randomized, double-blind, placebo-controlled trial. B: Prospective, randomized, double-blind, and placebo controlled trial in two centers. C: Single center double-blind, placebo-controlled randomized trial D: Single center randomized, double-blind, placebo-controlled trial. E: Multi-center randomized, double-blind, placebo-controlled trial F: Multi-center randomized, double-blind, placebo-controlled, phase 3 trial
Country not reported.
Source of funding and conflicts of interest:
Not reported |
Inclusion criteria SR: trials that compared haloperidol versus placebo for the management, both treatment and prophylaxis, of delirium in ICU patients.
Exclusion criteria SR: Before-andafter treatment trials, cohort studies, and retrospective studies were excluded.
6 studies were included
N, mean age A: 101 (3 arms) B: 457 C: 141 D: 68 E: 1789 (3 arms) F: 566 (3 arms)
Age, male sex (intervention/ control): A: 51/56 y, 57/61% B: 74/74 y, 63/63% C: 68/69 y, 52/64% D: 69/62 y, 53/59% E: 67/67 y, 63/61% F: 61/59 y, 56/58%
Groups comparable at baseline in characteristics, APACHE 2 score, ventilation. |
Haloperidol
A: Haloperidol 5 mg every 6h. Haloperidol was stopped if patient was delirium free for 48 h, experienced a predefined side effects or at day 14 of study period. B: Bolus injection of 0.5 mg haloperidol followed by continuous infusion at a rate 0.1 mg/h haloperidol for 12h. C: Haloperidol 2.5 mg Every 8 h. Medication was discontinued on ICU discharge, once delirium-free and coma free for 2 consecutive days, or after a maximum of 14 days of treatment, whichever came first. Medication was restarted if patient developed delirium. D: Haloperidol 1 mg every 6 h. Study medication was stopped when one of the following occurred: delirium, ICU discharge, 10 days of therapy had elapsed, or development of adverse effects necessitating study drug discontinuation. E: Haloperidol 1 mg or 2 mg every 6 h. Medication was started within 24 h of admission to the ICU through day 28, until ICU discharge (whichever came first), or until delirium occurred. F: 2.5-10 mg every 12 h for patients <70y. 1.25-5 mg every 12 h for patients >70y. -Patients received up to 10 mg every 12 h and up to 20 mg every 24 h. Trial drug or placebo was discontinued if patient had no delirium for 48 h, development of a pre-defined side effects, after the 14-days intervention period or at ICU discharge, whichever occurred first. |
Placebo
Not specified |
End-point of follow-up:
A: 21 days B: 28 days C: 28 days D: 10 days and until disposition E: 90 days F: 90 days
For how many participants were no complete outcome data available? (intervention/control)
Not reported |
Prevention: delirium incidence RR (95% CI) D: 1.50 (0.70, 3.20) E: 1.01 (0.87, 1.17) B: 0.66 (0.45, 0.97) Pooled effect (random effects model): 0.93 (0.65, 1.34) Heterogeneity (I2): 64%
Treatment: delirium duration Not described
Treatment: mortality RR (95% CI) D: 1.29 (0.54, 3.06) A: 0.69 (0.21, 2.22) F: 0.96 (0.68, 1.34) C: 1.04 (0.61, 1.77) E: 0.97 (0.77, 1.21) B: 0.33 (0.07, 1.63) Pooled effect (random effects model): 0.96 (0.81, 1.14) Heterogeneity (I2): 0%
Treatment: hospital length of stay Not described
Treatment: ICU length of stay RR (95% CI) D: -0.50 (-2.16, 1.16) A: 3.50 (-8.54, 15.54) F: -0.30 (-1.88, 1.28) C: -1.45 (-5.38, 2.48) E: 0.58 (-0.66, 1.82) Pooled effect (random effects model): 0.00 (-0.82, 0.83) Heterogeneity (I2): 0%
Treatment: QoL Not described
Treatment: Adverse events RR (95% CI) Serious adverse events A: Not estimable C: 0.59 (0.15, 2.38) D: 0.33 (0.04, 3.05) E: 1.93 (0.18, 21.26) Pooled effect (random effects model): 0.65 (0.23, 1.88)
Corrected QT interval prolongation A: 0.69 (0.12, 3.86) B: 0.80 (0.22, 2.93) C: 0.77 (0.30, 1.95) D: 4.00 (0.47, 33.97) E: 0.89 (0.56, 1.40) F: 0.82 (0.45, 1.49) Pooled effect (random effects model): 0.87 (0.63, 1.19)
Extrapyrimidal symptoms A: 1.11 (0.61, 2.01) B: Not estimable C: 0.33 (0.01, 7.93) D: 3.00 (0.13, 71.15) E: 0.71 (0.41, 1.22) F: 0.24 (0.03, 2.12) Pooled effect (random effects model): 0.84 (0.57, 1.23)
Total pooled effect (random effects model): 0.84 (0.66, 1.07) favouring haloperidol Heterogeneity (I2): 0%
Other relevant outcomes were not reported. |
|
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gamberini 2009 |
Geen DSM en ook geen CAP-D |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2021
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Deze richtlijn is ontwikkeld in samenwerking met:
- V&VN kinderen
- V&VN IC
- Stichting Kind en Ziekenhuis
- Nederlandse Associatie van Physician Assistants
Doel en doelgroep
Doel
Het doel van de richtlijn is om de zorg voor en behandeling van het kritisch zieke kind met een PD en voor kinderen met een ED verder te optimaliseren en om zo de overlevingskansen verder te optimaliseren. De richtlijn wil op wetenschappelijke gronden aanbevelingen doen voor optimale preventie, diagnostiek en behandeling van een PD en ED in het algemene/academische ziekenhuis door het verwerken van recente wetenschappelijke inzichten. Meer specifiek zijn de aanbevelingen over medicatie aangepast.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen met een PD en ED.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met een PD te maken hebben.
Werkgroep
- Prof. Dr. J.J.M.H. (Jacqueline) Strik, psychiater en voorzitter van de werkgroep, werkzaam in MUMC+ te Maastricht, NVvP
- Dr. J.N.M. (Jan) Schieveld, psychiater, werkzaam als adviseur bij het MUMC+ te Maastricht en de Mutsaers Stichting te Venlo, NVvP
- Dr. L. (Lisette) ‘t Hart-Kerkhoffs, kinder- en jeugdpsychiater, werkzaam bij Levvel (voorheen de Bascule) en het Emma kinderziekenhuis AUMC Amsterdam, NVvP
- Drs. S.B.J. (Bas) Oude Ophuis, kinder- en jeugdpsychiater, werkzaam in het UMC Utrecht en Prinses Máxima Centrum, NVvP
- Dr. H. (Hennie) Knoester, kinderarts-intensivist, werkzaam in Emma Kinderziekenhuis, AUMC, Amsterdam, NVK
- Prof. Dr. S. N. (Saskia) de Wildt, kinderarts-intensivist, klinisch farmacoloog, werkzaam in het Radboud UMC, Nijmegen en Erasmus MC, Rotterdam, NVK
- Dr. W.G. (Erwin) Ista, universitair hoofddocent verplegingswetenschap, kinder-IC verpleegkundige, werkzaam in Erasmus MC, Rotterdam, V&VN IC
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in Emma Kinderziekenhuis UMC, Amsterdam, V&VN kinderen
- G.S.M. (Dianne) van der Weerden, physician assistant, werkzaam in UMC Utrecht, NAPA
- Dr. dr. M.F. (Markus) Stevens, kinderanesthesioloog, AUMC Amsterdam, NVA
- Drs. E. (Erik) Koomen, anesthesioloog-kinderintensivist, werkzaam in UMC, Utrecht, NVA
Klankbordgroep
- Dr. C. (Coriene) E. Catsman-Berrevoets, neuroloog-kinderneuroloog, voor pensionering (juli 2020) werkzaam in Erasmus MC/Sophia kinderziekenhuis, Rotterdam. Nu werkzaam HAGA/Juliana Kinderziekenhuis, Den Haag
- J. (Janine) Pingen, Stichting Kind en Ziekenhuis te Utrecht, tot 1 december 2020
- R. (Rowy) Uitzinger, Stichting Kind en Ziekenhuis te Utrecht, vanaf 1 december 2020
Met ondersteuning van
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Mirre) Den Ouden, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Catsman |
Kinderneuroloog, |
geen |
geen |
geen |
|
’t Hart-Kerkhofs |
Kinder- en jeugdpsychiater |
geen |
geen |
geen |
|
Ista |
Universitair hoofddocent en verplegingswetenschapper |
Lid cie. richtlijnen V&VN tot 01-01-2019, lid CCMO |
Ontwikkelaar SOS-PD schaal |
Andere werkgroepleden kritisch laten tegenlezen |
|
Koomen |
Anesthesioloog-kinderintensivist |
geen |
Bezig met ontwikkeling nieuwe PICU met devices bedrijven |
Geen, aangezien dit niet richtlijn onderwerpen betreft |
|
Knoester |
Kinderarts-intensivist |
geen |
geen |
geen |
|
Molag |
Adviseur, methodoloog |
geen |
geen |
geen |
|
de Neef |
Verpleegkundig onderzoeker kinder-IC |
geen |
geen |
geen |
|
Oude Ophuis |
Kinder- en jeugdpsychiater |
geen |
geen |
geen |
|
Pingen / Uitzinger |
Stichting kind en ziekenhuis, |
geen |
geen |
geen |
|
Strik |
Psychiater Kind en Jeugd, hoogleraar kind en jeugd psychiatrie en somatische comorbiditeit hoofdopleider psychiatrie, plaatsvervangend medisch afdelingshoofd |
geen |
geen |
geen |
|
Schieveld |
Gepensioneerd kinder- en jeugdpsychiater |
adviseur MUMC+ en Mutsaers Venlo |
geen |
geen |
|
Stevens |
Kinderanesthesioloog |
geen |
Grant onderzoek post hospital behavioral questionnaire |
geen |
|
Van der weerden |
Physician assistant PICU |
geen |
geen |
geen |
|
De Wildt |
Kinderarts-intensivist Klinisch farmacoloog |
Directeur Kinderformularium |
Lidmaatschap wetenschappelijke adviesraden en editorial boards, zie verder volledige belangenverklaring |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de Klankbordgroep en een enquête bij ouders van kinderen die een delier hebben doorgemaakt. Een verslag hiervan (zie bijlagen) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten met een schriftelijke uitvraag bij wetenschappelijke verenigingen en hoofden van de kinder-IC. Daaruit kwam de behoefte naar voren ook een addendum emergence delier te ontwikkelen.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Pediatrisch Delier 2014 op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door ouders via een uitvraag van Kind en Ziekenhuis, een schriftelijke Invitational conference en consultatie onder afdelingshoofden van de kinder-IC. De aangedragen knelpunten zijn verwerkt in de richtlijn.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen in de bijlagen.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur).
Indicatorontwikkeling
Er werd besloten geen indicatoren te ontwikkelen. De bij de vorige richtlijn opgeleverde indicatoren werden niet gebruikt in de praktijk.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules werden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de conceptrichtlijnmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodules werden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
