Behandelvoorkeur bij pijnbestrijding pancreascarcinoom
Uitgangsvraag
Welke behandeling heeft de voorkeur ter bestrijding of voorkoming van pijn bij patiënten met pancreascarcinoom?
Aanbeveling
Geef medicamenteuze behandeling volgens de pijnladder (zie ook richtlijn pijn bij kanker).
Overweeg een kort palliatief radiotherapieschema toe te voegen of een Coeliacus blokkade te verrichten in geval van onvoldoende effect van medicamenteuze pijnbehandeling of bijwerkingen hiervan.
Overwegingen
Voor radiotherapie versus medicamenteuze behandeling:
Er bestaan geen vergelijkende studies waarin het palliatieve effect van radiotherapie is vergeleken met dat van alleen medicamenteuze pijnstilling. Wel zijn er observationele gegevens van een verbetering van pijn Visual Analog scale (VAS) of Numeric Rating Scale (NRS) en/of een reductie van dagelijkse morfine dosis (oral morphine equivalent (OME) daily dose) ten opzichte van baseline. Het betreft hier overwegend studies die tumorcontrole van lokaal uitgebreid pancreascarcinoom tot primair doel hadden met bijvoorbeeld Stereotactic Body Radiation Therapy (SBRT) of hoge doses radiotherapie met of zonder chemotherapie (Buwenge 2018; Tian 2018; Comito 2017; Wolny-Rokicka 2016; Su 2015; Van Geenen 2002; Morganti 2003). De studies rapporteerden als post hoc observatie dat pijn verminderde bij de subgroep van patiënten die pijn hadden. De score van pijn en pijnreductie was wisselend in de verschillende studies (range 34-100%). Een review (Buwenge 2018) over de pijnvermindering na stereotactische radiotherapie beschreef 14 studies (479 patiënten) waarbij 12 van de 14 studies het percentage van pijn response beschreven, met een gemiddelde overall response (compleet en partieel) van 84%. Het niveau van evidence van deze observaties is zeer laag, en een langdurige radiochemotherapie schema of SBRT is niet het eerste waaraan men denkt bij een in opzet palliatieve behandeling tegen pijn.
Er is dus geen vergelijkende evidence voor het palliatieve effect van radiotherapie op pijn bij pancreascarcinoom. Wel zijn er aanwijzingen dat radiotherapie een pijnverminderend of analgetica verminderend effect kan hebben. Aangezien conventionele medicamenteuze pijnstilling vaak onvoldoende effectief is zou in onze visie een kortdurend palliatief radiotherapieschema kunnen worden overwogen.
Voor coeliacus blokkade versus medicamenteuze behandeling:
Mogelijk is te overwegen om de nadelige effecten van medicatiegebruik te bespreken. Een coeliacus blokkade zou de consumptie van pijnmedicatie kunnen verminderen. Arcidiacono 2011 voert een tweetal meta-analyses uit m.b.t. complicaties van medicatiegebruik die mogelijk interessant zijn voor de overwegingen (zie ook de conclusie van Arcidiacono 2011). Afhankelijk van de richting van de overwegingen zijn er mogelijk een aantal relevante artikelen die niet (geheel) aan de selectiecriteria voldeden voor opname in de literatuur analyse:
Patiëntenperspectief
De werkgroep is van mening dat gedeelde besluitvorming noodzakelijk is bij de keuze voor een bepaalde pijnbehandeling. In de module over voorlichting en communicatie is dit proces beschreven.
Onderbouwing
Achtergrond
Pijn is een veel voorkomend symptoom bij patiënten met een pancreascarcinoom. Op het moment van diagnose hebben ongeveer 60-70% van de patiënten pijn. Uiteindelijk ontwikkelt meer dan 90% van de patiënten pijnklachten, die vaak ernstig en invaliderend van aard zijn. De patiënten klagen ofwel van buikpijn met of zonder krampen die naar de rug uitstraalt ofwel van rugpijn die kan uitstralen naar de buik. Soms is de pijn vaag. Er zijn verschillende behandelingen mogelijk: het toedienen van pijnstillers, palliatieve radiotherapie en coeliakus blokkade. Het is momenteel niet duidelijk wat de beste behandeling is.
Conclusies / Summary of Findings
|
Geen GRADE |
Er konden voor de vergelijking van radiotherapie tegenover enkel een medicamenteuze behandeling geen studies worden geselecteerd die aan de selectiecriteria voldeden.
|
|
Laag GRADE |
Een coeliacus blokkade i.c.m. een medicamenteuze behandeling resulteert niet in een klinisch relevante reductie van pijn ten opzichte van enkel een medicamenteuze behandeling.
Bronnen: Arcidiacono 2011; Gao 2014; Zhong 2014 |
|
Laag GRADE |
Een coeliacus blokkade i.c.m. een medicamenteuze behandeling zou de consumptie van pijnmedicatie kunnen verminderen ten opzichte van enkel een medicamenteuze behandeling.
Bronnen: Arcidiacono 2011; Wyse 2011; Gao 2014; Zhong 2014 |
|
Zeer laag GRADE |
Er is onvoldoende bewijslast dat de kwaliteit van leven na een coeliacus blokkade i.c.m. een medicamenteuze behandeling tegenover enkel een medicamenteuze behandeling verbetert
Bronnen: Kawamata 1996; Wong 2004; Zhang 2008; Wyse 2011; Gao 2014 |
|
Geen GRADE |
Er konden voor de vergelijking van HIFU tegenover enkel een medicamenteuze behandeling geen studies worden geselecteerd die aan de selectiecriteria voldeden. |
Samenvatting literatuur
Beschrijving van studies over radiotherapie
Er konden geen studies worden geselecteerd die aan de selectiecriteria voldeden.
Beschrijving studies over coeliacus blokkade
Zhong 2014 includeerde alleen Engelse onderzoeksrapportages van RCT’s die de hevigheid van pijn vergeleken tussen een coeliacus blokkade en een medicamenteuze behandeling in de systematische review. Reviews, niet-gerandomiseerd onderzoek, en studies die de interventie niet vergeleken met een medicamenteuze behandeling werden geëxcludeerd. Er werd uiterlijk tot november 2012 gezocht in MEDLINE, Google Scholar en de Cochrane Library naar relevante studies. Acht studies werden geïncludeerd en zeven studies werden gebruikt voor meta-analyses. Resultaten van de RCT die niet werd gebruikt voor de meta-analyses werden niet beschreven. Zhong 2014 maakte geen gebruik van een formele risk of bias-tool, maar rapporteerde of er sprake was van randomisatie en blindering voor groepsallocatie. De procedure van de interventie en de in- en exclusiecriteria van de individuele studies werden door Zhong 2014 ook onder risk of bias besproken. Publicatiebias werd beoordeeld aan de hand van funnel plots, waarbij de auteurs tot de conclusie kwamen dat er geen sprake was van publicatiebias. De steekproefgrootte van de interventiegroep varieerde van 10 tot 65 deelnemers, tegenover 10 tot 74 deelnemers in controlegroepen. Het percentage mannen in de groepen varieerde van 40% tot 60% in 5 studies. Twee studies rapporteerden alleen het percentage mannen in de gehele steekproef (62,5% en 70,8%) en voor één studie werden hier geen gegevens over gepresenteerd in de systematische review. De gemiddelde leeftijd varieerde van 58 jaar tot 67 jaar (voor één studie werden er geen leeftijden gepresenteerd). Omdat er een beperkt aantal karakteristieken werd omschreven in de systematische review is het onduidelijk of de steekproeven vergelijkbaar zijn. In de interventiegroepen werden coeliacus blokkades met alcohol injecties (50%-100%) toegediend. Eén studie gebruikte 10ml bupivacaine en 20ml absolute alcohol voor de coeliacus blokkade. Een andere studie beschreef dat er gewoonlijk alcohol werd gebruikt voor de blokkade waardoor het waarschijnlijk is dat enkele deelnemers aan deze studie geen blokkade o.b.v. een alcoholinjectie hebben gehad. Er werd niet beschreven welke injecties er gegeven zouden kunnen zijn wanneer er geen alcohol werd gebruikt. De medicamenteuze behandeling voor de controlegroepen bestond voornamelijk uit morfine, eventueel in combinatie met NSAIDs. Meta-analyses werden uitgevoerd met Comprehensive Meta-Analysis (CMA, versie 2.0) statistische software.
Arcidiacono 2011 includeerde in de systematische review alleen RCT’s met een minimale follow-up van 4 weken die een steekproef hadden van deelnemers ouder dan 18 jaar met abdominale of rugpijn vanwege pancreascarcinoom. De interventie moest hierbij een coeliacus blokkade zijn (e.v.t. volgens een chirurgische procedure of een endoscopische ultrageluid geleide neurolyse) en de controle een medicamenteuze behandeling. Abstracts, niet-Engelstalige literatuur, en steekproeven van personen met benigne laesies en/of ernstige (bloed)stollingsveranderingen werden geëxcludeerd. Van januari 1990 tot en met december 2010 werd er in CENTRAL, MEDLINE, GATEWAY en EMBASE gezocht naar relevante studies. Er werden 6 studies geselecteerd (welke ook werden geselecteerd en gebruikt in de meta-analyses van Zhong 2014) en gebruikt voor meta-analyses die een coeliacus blokkade vergeleken met medicamenteuze behandelingen. De referentielijsten van de geïncludeerde studies werden doorzocht om gemiste relevante studies te identificeren. Om het risico op bias van de geïncludeerde studies te beoordelen werd er gebruik gemaakt van de Cochrane Risk of Bias Tool. Echter werd hiermee alleen de randomisatie, blindering voor groepsallocatie, en blindering voor interventie beoordeeld. Publicatiebias werd niet beoordeeld. De grootte van de interventiegroepen varieerde van 10 tot 50 deelnemers, tegenover 10 tot 72 deelnemers in de controlegroepen. Het percentage mannen per groep varieerde van 40% tot 60% in 3 studies. Voor 2 studies werd alleen het percentage mannen over de gehele steekproef gegeven (62.5% en 70.8%) en voor één studie werden er hier geen gegevens over beschreven in de systematische review. De gemiddelde leeftijden varieerden tussen 58 jaar en 68 jaar. Voor één studie werden er geen leeftijden gepresenteerd in de systematische review. Er werd een beperkt aantal karakteristieken gepresenteerd in de systematische review waardoor het onduidelijk is of de steekproeven met elkaar te vergelijken zijn. De interventiegroep kreeg een coeliacus blokkade met een alcohol injectie (50%-100%). De controlegroep ontving een medicamenteuze behandeling met morfine en NSAIDs, echter werden er voor twee studies de medicamenteuze behandeling niet omschreven in de systematische review. Er werd niet beschreven met welke statistische software de meta-analyses werden uitgevoerd.
Gao 2014 voerde in China een RCT uit die een groep mensen die coeliacus neurolysis ondergingen en pijnmedicatie ontvingen vergeleek met een groep mensen die een schijningreep (i.e. injectie in het lumen van de maag) en pijnmedicatie ontvingen. De interventiegroep bestond uit 68 deelnemers (sekse verdeling onbekend) die gemiddeld 65,5 (SD: 10,2) jaar oud waren en 67,9 (SD: 3,1) kilogram wogen. De controlegroep had 32 deelnemers (sekse verdeling onbekend) van gemiddeld 66,6 (SD: 9,9) jaar oud met een gewicht van 68,1 (SD: 2,8) kilogram. Beide groepen hadden vergelijkbare pijnscores op de baseline (interventiegroep: 7,5 [SD: 0,4); controlegroep 7,4 [SD: 0,5]). Het was onduidelijk hoe de randomisatie en de eventuele blindering voor groepsallocatie tot stand zijn gekomen.
Wyse 2011 voerde een RCT in Canada uit om de effecten van een coeliacus neurolysis met tevens het voorschrijven van pijnmedicatie te vergelijken met enkel het voorschrijven van pijnmedicatie. De interventiegroep bestond uit 49 deelnemers (26 mannen; 23 vrouwen) met een gemiddelde leeftijd van 66,6 (SD: 9,32) jaar. Deze groep had een baseline Morphine Equivalent (MEQ, 30mg morfine = 1 MEQ) van 41,9 (SD: 74,1) MEQ en een gemiddeld bestaande duur van de pijn van 8,6 (SD: 5,4) weken. De controlegroep bevatte 49 deelnemers (21 mannen; 28 vrouwen) met een gemiddelde leeftijd van 66,5 (SD: 10). De MEQ consumptie in deze groep was op de baseline 36,8 (SD: 61,7) MEQ, waarbij de een gemiddeld bestaande duur van pijn 9,6 (SD: 8,4) weken was. Er werd niet aangegeven wat de MEQ consumptie per tijdseenheid was en het was onduidelijk hoe er werd omgegaan met de blindering voor groepsallocatie, de blindering voor de zorggevers (i.e. de voorschrijver van de pijnmedicatie) en met de blindering van deelnemers.
Beschrijving studies over HIFU
Er konden geen studies worden geselecteerd die aan de selectiecriteria voldeden.
Resultaten van studies over radiotherapie
Er konden geen resultaten van studies worden beschreven die aan de selectiecriteria voldeden.
Resultaten van studies over coeliacus blokkade
Pijn
Zowel Zhong 2014 als Arcidiacono 2011 includeerden dezelfde 4 studies om het effect van een coeliacus blokkade op pijn af te zetten tegenover het effect van een medicamenteuze behandeling op pijn na 4 weken. Pijn werd in alle studies gemeten op een 0-10 schaal, waarbij 0 voor ‘geen enkele pijn’ staat en 10 voor ‘maximale pijn’. Voor de meta-analyses werden in beide systematische reviews hoogstwaarschijnlijk een verschillend statistisch software pakket gebruikt, waardoor de in de manuscripten gerapporteerde uitkomsten enigszins van elkaar verschillen. Zhong 2014 rapporteerde een gemiddeld gepoold verschil van -0.382 punten in het voordeel van een coeliacus blokkade (SE=0,136, fixed effects model, I2: 0%), maar vermeldde hierbij niet het betrouwbaarheidsinterval rondom de effectschatter en hoeveel deelnemers er in de analyse zaten. Arcidiacono 2011 vond een gemiddeld gepoold verschil van -0,43 (95%BHI: -0,73 tot -0,14, n=88 in de interventiegroep, n=85 in controlegroep, fixed effects model, I2: 0%). Zie Figuur 1 voor de bijbehorende forest plot.
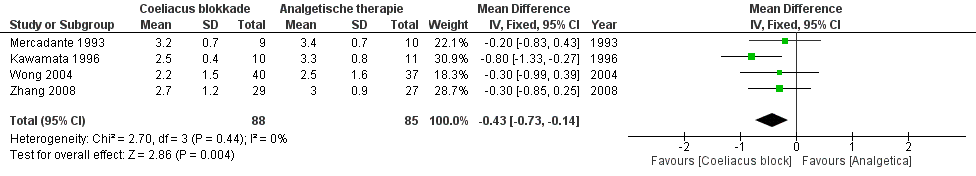
Figuur 1 – Forest plot van de pijnscore (VAS) na 4 weken.
Zhong 2014 gebruikte zes studies voor de meta-analyse om na acht weken de pijnstillende effecten van een coeliacus blokkade te vergelijken met een medicamenteuze behandeling. Pijn werd in de geïncludeerde studies om een schaal van 0 tot 10 gemeten , waarbij 0 voor ‘geen enkele pijn’ stond en 10 voor ‘maximale pijn’. Er werd een gemiddeld gepoold verschil gevonden van -0,265 punten in het voordeel van een coeliacus blokkade (SE=0,217, random effects model, I2: 92%). In Figuur 2 werd de meta-analyse van Zhong 2014 volgens een ander statistisch model uitgevoerd, waarbij er een gemiddeld verschil van -0.51 punten werd gevonden in het voordeel van een coeliacus blokkade (95%BHI: -0,94 tot -0,07, n=141 in de interventiegroep, n=138 in de controlegroep, random effects model I2=86%). Arcidiacono 2011 includeerde vijf van de zes studies die Zhong 2014 ook includeerde voor de meta-analyse over pijn na acht weken en vond daarmee een gemiddeld verschil van -0,44 punten in het voordeel van een coeliacus blokkade (95%BHI: -0,89 tot 0,01, n=134 in de interventiegroep, n=127 in de controlegroep, random effects model, I2=89%).
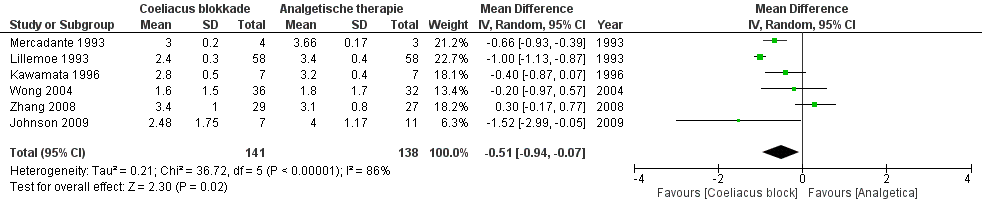
Figuur 2 – Forest plot van de pijnscore (VAS) na 8 weken.
Gao 2014 vond na 3 maanden een significant verschil tussen de pijnbeleving van de groep die een coeliacus blokkade had ontvangen (VAS≈4) en de groep die de schijningreep hadden ontvangen (VAS≈7). Er werd een p-waarde van kleiner dan 0,05 gevonden (p<0,05, geen exacte p-waarde gerapporteerd). De VAS-scores van de groepen werden niet numeriek gerapporteerd, waardoor de eerdergenoemde VAS-scores een benadering uit een staafdiagram zijn. Gao 2014 kon vanwege de duur van de follow-up niet worden opgenomen in de meta-analyses.
Reductie van pijnmedicatie
Zhang 2014 gebruikte 5 studies voor de meta-analyse om de hoeveelheid opioïde inname op 4 weken en bij het laatste gebruik te vergelijken bij mensen die een coeliacus blokkade hadden ondergaan en bij mensen die een medicamenteuze behandeling voorgeschreven kregen. Van de 5 geïncludeerde studies waren 4 studies gelijk aan de geïncludeerde studies in de meta-analyses van Arcidiacono 2011. De vijfde, toegevoegde, studie in Zhong 2014 rapporteerde medianen die in de meta-analyse als gemiddelde zijn gebruikt. Het is onduidelijk of de gebruikte standaarddeviatie van de oorspronkelijk gerapporteerde interkwartiel-afstanden zijn afgeleid. Hierdoor werd er gekozen om de resultaten van deze meta-analyses niet te presenteren in de richtlijn. Arcidiacono 2011 gebruikte 4 studies om na 4 weken (Figuur 3) en op de dag voor overlijden (Figuur 4) het opioïde gebruik te vergelijken tussen mensen die een coeliacus blokkade hadden ondergaan en mensen die een medicamenteuze behandeling ontvingen. Na 4 weken werd er een gemiddeld gepoold verschil van -55,07 mg/dag gevonden ten voordele van een coeliacus blokkade (95%BHI: -82,71 tot -19,43, n=60 in de interventiegroep, n=60 in de controlegroep, random effects model, I2=92%). Het gemiddelde gepoolde verschil van de opioïde inname op de laatste dag voor overlijden bedroeg -48.52 mg/dag in het voordeel van een coeliacus blokkade (95%BHI: -68.82 tot -28.22, n=57 in de interventiegroep, n=54 in de controlegroep, fixed effects model, I2=0%).
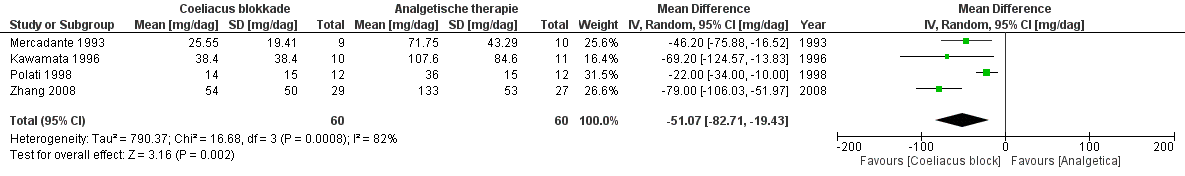
Figuur 3 – Forestplot van opioïde gebruik (mg/dag) na 4 weken
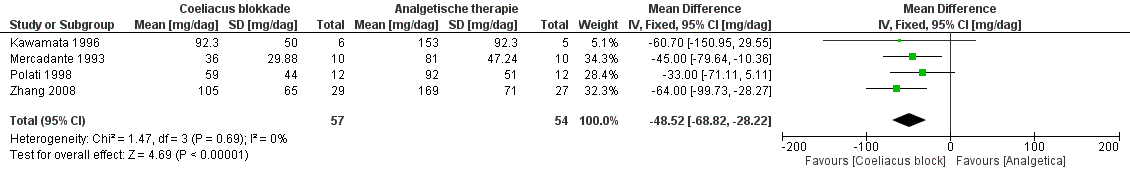
Figuur 4 – Forestplot van opioïde gebruik (mg/dag) op de laatste dag voor overlijden.
Gao 2014 rapporteerde een significante percentuele reductie van pijnmedicatiegebruik tussen de interventie en controlegroep na 3 maanden voor NSAIDs (interventiegroep -66.1% [SD: 0,3]; controlegroep -11,5% [SD: 0,6], p<0,05), morfine (interventiegroep -88.9% [SD: 0,4]; controlegroep -12.3% [SD: 0,5], p<0.01), oxycondone (interventiegroep -78.2% [SD: 1,2]; controlegroep -9,8% [SD: 0,3], p<0.05), en overige pijnmedicatie (interventiegroep -88,4 [SD: 1,7], controlegroep -6,6 [SD: 1,1], p<0.05).
Wyse 2011 vond na 3 maanden een gemiddeld verschil van -49,6 (95%BHI: -127,5 tot 7,0) MEQ tussen de interventie- en controlegroep. Er werd geen significant verschil gerapporteerd (p=0,10).
Gao 2014 en Wyse 2011 konden door variatie in de gerapporteerde uitkomstmaat en de duur van follow-up niet worden opgenomen in de meta-analyses.
Kwaliteit van leven
Resultaten met betrekking tot kwaliteit van leven werden niet in de systematische reviews van Zhong 2014 en Arcidiacono 2011 gepresenteerd. De onderstaande data over kwaliteit van leven werd uit de individuele studies gehaald die Zhong 2014 includeerde. Vier studies uit Zhong 2014rapporteerden over kwaliteit van leven.
Wyse 2011 vond na 1 en 3 maanden geen significante verschillen in kwaliteit van leven tussen patiënten die een coeliacus blokkale ondergingen en patiënten die een medicamenteuze behandeling kregen (geen p-waarde gerapporteerd). Kwaliteit van leven werd gemeten met de Digestive Disease Questionnaire (DDQ-15). De interventiegroep had na 1 maand een gemiddelde vooruitgang van 15% ten opzichte van de baseline en een vooruitgang van 19% na 3 maanden. In de controlegroep was dit 8% na 1 maand en 18% na 3 maanden.
Om de kwaliteit van leven te beoordelen gebruikte Zhang 2008 een vragenlijst die eetlust, slaap, en communicatie scoorde op een 0 tot 10 schaal (0 is geen verstoring, 10 is maximale verstoring). Er werden geen significante verschillen tussen de groepen gevonden (geen p-waarde gerapporteerd).
Wong 2004 gebruikte de Functional Assessment of Cancer Therapy scale for Pancreatic Cancer (FACT-PA) om de kwaliteit van leven te beoordelen en drukte de scores als percentage van het maximale puntenaantal uit. Over de loop van 24 weken was de range van gemiddelde scores 50.5% (SD:15) tot 70.4% (SD: 15.5) voor de mensen die een coeliacus blokkade hadden ondergaan, tegenover 60.9% (SD: 17.5) tot 64.2% (SD: 17.1) voor de mensen die een medicamenteuze behandeling ondergingen. Er werden geen significante verschillen gezien tussen de groepen over het verloop van 24 weken (p=0.46).
Kawamata 1996 gebruikte een visueel analoge schaal (VAS, schaal: 0-10) om de kwaliteit van leven te beoordelen. Na 2 weken scoorde de groep die een coeliacus blokkade hadden ondergaan gemiddeld 5.4 punten (SD: 1.7), tegenover 5.5 punten (SD: 1.8) in de groep mensen die een medicamenteuze behandeling ondergingen. De groep die een coeliacus blokkade had ondergaan had na 8 weken een gemiddelde score van 4.6 punten (SD: 1.1), tegenover 4.0 punten (SD: 0.7) in de groep die een medicamenteuze behandeling ontving. Er werden geen significante verschillen tussen de groepen gevonden (geen p-waarde gerapporteerd). Kawamata 1996 gebruikte ook een eigen-geconstrueerde vragenlijst om de kwaliteit van leven mee te meten. Met deze vragenlijst werden geen significante verschillen tussen de groepen gevonden (geen p-waarde gerapporteerd).
Gao 2014 gebruikte de Quality of Life (QLQ-C30) vragenlijst om de kwaliteit van leven te meten. Op de baseline werden er geen significante verschillen tussen de groepen gevonden (geen p-waarde gerapporteerd). Er werd na 3 maanden een significant verschil gevonden (p<0,05, geen exacte p-waarde gerapporteerd) in het voordeel van de groep mensen die een coeliacus blokkade en pijnmedicatie hadden ontvangen (QLQ-C30 score: 65,6 [SD: 0,4]) tegenover de groep mensen die een schijnbehandeling en pijnmedicatie hadden ontvangen (QLQ-C30 score: 51.3 [SD: 0,5]).
Resultaten van studies over HIFU
Er konden geen resultaten van studies worden beschreven die aan de selectiecriteria voldeden.
Bewijskracht van de literatuur
Om de imprecisie van de uitkomstmaat ‘pijn’ te kunnen beoordelen werd er een steekproefgrootteberekening gemaakt, gezien de steekproef minder dan 2000 deelnemers bevatte. De vier studies die Arcidiacono 2011 gebruikte voor het verkrijgen van de gepoolde schatter voor pijn na 4 weken werden als uitgangspunt genomen. Op basis van deze vier studies was de gemiddelde pijn in de coeliacusblokkade groep 2.65 punten (gepoolde SD: 1.26, n=88) tegenover 3.05 punten (gepoolde SD: 1.24, n=85) in de controlegroep. De effectgrootte werd berekend met E = (Meangroep2 – Meangroep1)/SDpooled en was daarmee 0.32. De steekproefgrootte werd berekend aan de hand van de formule: N = AB/(E/SDpooled)2 met α = 0.05 en β = 0.2, waarbij A = (1/proportiegroep1 + 1/proportiegroep2) en B = (Zα + Zβ)2. Dit resulteerde in N = (4*7.84) / (0.32/1.25)2 = 31.36 / 0.2562 = 478.52 ≈ 479, wat een benodigde steekproef van 240 en 239 deelnemers in respectievelijk twee studie armen weergeeft.
De bewijskracht voor de uitkomstmaat ‘pijn’ is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (1 niveau voor risk of bias: het aantal factoren met een risico op bias is beperkt beoordeeld [Zhong 2014: geen formele RoB-tool, Arcidiacono 2011: slechts enkele RoB onderdelen]; het risico op bias in de beoordeelde factoren is veelal onduidelijk) en het geringe aantal patiënten (1 niveau voor imprecisie).
De bewijskracht voor de uitkomstmaat ‘reductie van pijnmedicatie’ is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (1 niveau voor risk of bias: het aantal factoren met een risico op bias is beperkt beoordeeld [Zhong 2014: geen formele RoB-tool, Arcidiacono 2011: slechts enkele RoB onderdelen]; het risico op bias in de beoordeelde factoren is veelal onduidelijk) en het geringe aantal patiënten (1 niveau voor imprecisie).
De bewijskracht voor de uitkomstmaat ‘kwaliteit van leven’ is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (2 niveaus voor risk of bias: het aantal factoren met een risico op bias is beperkt beoordeeld [Studies uit Zhong 2014: geen formele RoB-tool]; het risico op bias in de beoordeelde factoren is veelal onduidelijk) en het geringe aantal patiënten (1 niveau voor imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de voor- en nadelen van palliatieve radiotherapie, coeliacus blokkade, of HIFU op de ervaren pijn, het medicatiegebruik, en de kwaliteit van leven bij patiënten met irresectabel pancreas carcinoom ten opzichte van patiënten die enkel medicamenteus behandeld worden?
P: Patiënten met pancreascarcinoom met een irresectabele tumor
I: Radiotherapie, coeliacus blokkade, HIFU
C: medicamenteuze pijnstilling
O: Pijn (VAS), reductie van pijnmedicatie, kwaliteit van leven
Relevante uitkomstmaten
De werkgroep achtte pijn en reductie van pijnmedicatie de voor de besluitvorming cruciale uitkomstmaten; en kwaliteit van leven voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Tevens werden er a priori geen follow-up momenten bepaald, maar werden de in de studies gehanteerde follow-up duur gebruikt.
De werkgroep definieerde 2 punten (NRS, schaal: 0-10 punten) of 20 millimeter (VAS, schaal: 0-100 millimeter) als een klinisch (patiënt) relevant verschil voor pijn.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 20-11-2017 met relevante zoektermen gezocht vanaf het jaar 1995 naar systematische reviews en randomized controlled trials die radiotherapie, coeliacus blokkade, of HIFU vergeleken met een medicamenteuze behandeling tegen pijn bij personen met een irresectabele pancreas carcinoom. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 230 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: Deelnemers hadden een irresectabel pancreas carcinoom, Radiotherapie/coeliacus blokkade/HIFU ter pijnstilling werd vergeleken met medicamenteuze pijnstilling, en in de studie werd ten minste één van de volgende uitkomstmaten gemeten en gerapporteerd: pijn, reductie van pijnmedicatie, kwaliteit van leven. Op basis van titel en abstract werden in eerste instantie 30 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 6 studies definitief geselecteerd (2 systematische reviews en 4 RCT’s). Twee van de geselecteerde RCT’s (Johnson 2009, Wong 2004) werden ten minste in één van de meta-analyses van de geselecteerde systematische reviews gebruikt (Zhong 2014, Aricidiacono 2011), waardoor deze RCT’s in de evidencetabel onder de betreffende systematische reviews werden beschreven. Een andere geselecteerde RCT (Wyse 2011) werd ook opgenomen in de systematische review van Zhong 2014, maar deze werd niet gebruikt in de gepresenteerde analyses. De RCT van Wyse 2011 werd daarom in deze richtlijn apart beschreven in literatuursamenvatting, de resultaten en in de tabellen.
Twee systematische reviews (á 6 en 8 geïncludeerde studies) en twee RCT’s werden opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Arcidiacono PG, Calori G, Carrara S, et al. (2011) Celiac plexus block for pancreatic cancer pain in adults. Cochrane Database Syst Rev.;(3):CD007519. doi: 10.1002/14651858.CD007519.pub2. Review. PubMed PMID: 21412903.
- Buwenge M, Macchia G, Arcelli A, et al. (2018) Stereotactic radiotherapy of pancreatic cancer: a systematic review on pain relief. J Pain Res;11:2169-2178.
- Comito T, Cozzi L, Zerbi A, et al. (2017) Clinical results of stereotactic body radiotherapy (SBRT) in the treatment of isolated local recurrence of pancreatic cancer after R0 surgery: a retrospective study. Eur J Surg Oncol;43:735742.
- Geenen RC van, Keyzer-Dekker CM, van Tienhoven G. (2002) Pain management of patients with unresectable peripancreatic carcinoma. World J Surg;26:715720.
- Johnson CD, Berry DP, Harris S, et al. (2009) An open randomized comparison of clinical effectiveness of protocol-driven opioid analgesia, celiac plexus block or thoracoscopic splanchnicectomy for pain management in patients with pancreatic and other abdominal malignancies, Pancreatology;9(6):755-63. doi: 10.1159/000199441. Epub 2010 Jan 15. PubMed PMID: 20090396.
- Kawamata M, Ishitani K, Ishikawa K, et al. (1996)Comparison between celiac plexus block and morphine treatment on quality of life in patients with pancreatic cancer pain. Pain;64(3):597-602. PubMed PMID: 8783327.
- Lillemoe KD, Cameron JL, Kaufman HS, et al. (1993) Chemical splanchnicectomy in patients with unresectable pancreatic cancer. A prospective randomized trial. Ann Surg;217(5):447-55; discussion 456-7. PubMed PMID: 7683868; PubMed Central PMCID: PMC1242819.
- Mercadante S. (1993) Celiac plexus block versus analgesics in pancreatic cancer pain. Pain;52(2):187-92. PubMed PMID: 8455966.
- Morganti AG, Trodella L, Valentini V, et al. (2003) Pain relief with short-term irradiation in locally advanced carcinoma of the pancreas. J Palliat Care;19:258262.
- Polati E, Finco G, Gottin L, et al. (1998). Prospective randomized double-blind trial of neurolytic coeliac plexus block in patients with pancreatic cancer. Br J Surg;85(2):199-201. PubMed PMID: 9501815.
- Su TS, Liang P, Lu HZ, et al. (2015) Stereotactic body radiotherapy using CyberKnife for locally advanced unresectable and metastatic pancreatic cancer. Worl J Gastroenterol;21:81568162.
- Tian Q, Zhang F, Wang Y. (2018) Clinical assessment of palliative radiotherapy for pancreatic cancer. Cancer Radiother;pii: S1278-3218 [Epub ahead of print].
- Wolny-Rokicka E, Sutkowski K, Grzadziel A, et al. (2016) Tolerance and efficacy of palliative radiotherapy for advanced pancreatic cancer: a retrospective analysis of single-institutional experiences. Mol Clin Oncol;4:10881092.
- Wong GY, Schroeder DR, Carns PE, et al. (2004) Effect of neurolytic celiac plexus block on pain relief, quality of life, and survival in patients with unresectable pancreatic cancer: a randomized controlled trial. JAMA;291(9):1092-9. PubMed PMID: 14996778.
- Wyse JM, Carone M, Paquin SC, et al (2011). Randomized, double-blind, controlled trial of early endoscopic ultrasound-guided celiac plexus neurolysis to prevent pain progression in patients with newly diagnosed, painful, inoperable pancreatic cancer. J Clin Oncol;29(26):3541-6. doi: 10.1200/JCO.2010.32.2750. Epub 2011 Aug 15. PubMed PMID: 21844506.
- Zhang CL, Zhang TJ, Guo YN, et al. (2008) Effect of neurolytic celiac plexus block guided by computerized tomography on pancreatic cancer pain. Dig Dis Sci;53(3):856-60. Epub 2007 Aug 4. PubMed PMID: 17676392.
- Zhong W, Yu Z, Zeng JX, et al. (2014) Celiac plexus block for treatment of pain associated with pancreatic cancer: a meta-analysis. Pain Pract;14(1):43-51. doi: 10.1111/papr.12083. Epub 2013 May 20. PubMed PMID: 23682788.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Zhong 2014
individual study characteristics deduced from Zhong 2014
*From Arcidiacono 2011
**from individual studies |
SR and meta-analysis of RCTs
Literature search up to November 2012
A: Wyse 2011 B: Johnson 2009 C: Zhang 2008 D: Wong 2004 E: Polati 1998 F: Kawamata 1996 G: Mercadante 1993 H: Lillemoe 1993
Study design: RCT A: RCT B: RCT C: RCT D: RCT E: RCT F: RCT G: RCT H: RCT
Setting and Country: Not described in Zhong 2014
Source of funding: Not described in Zhong 2014
|
Inclusion criteria SR: RCT, comparing pain severity for celiac block vs medical management, English literature
Exclusion criteria SR: Review article, not randomized, no comparison to medical management
8 studies included
Important patient characteristics at baseline: Nintervention/Ncontrol: A: 48/48 B: 20/24 C: 29/27 D: 50/51 E: 12/12 F: 10/11 G: 10/10 H: 65/72
Sex intervention/ sex control (% male): A: 53.1%/42.9% B: 50%/67% C: 62.5% male overall D: 48%/58% E: 70.8% male overall F: 40%/45.5% G: 50%/60% H: -
Age intervention/ age control (year): A: 66.6/66.5 B: 60.5/65.5 C: 58 years overall D: 62.6/63.4 E: 57/60 F: 67/68 G: 61.8/63.7 H: -
Groups comparable at baseline? Unclear |
Describe intervention*:
A**: endoscopic ultrasound guided celiac block, bilateral injection at celiac axis, 10ml 0.5% bupivacaine and 20ml absolute alcohol. B: image guided celiac block, usually alcohol, bilateral + Morphine (or other opioids) and adjuvant analgesia for neuropathic pain and liver capsule pain C: CT-guided posterior bilateral celiac block 20ml 100% alcohol D: fluoroscopic posterior bilateral 10ml 100% alcohol E: fluoroscopic posterior bilateral 7ml 100% alcohol F: Celiac block, posterior bilateral x-ray, 15-20ml 80% alcohol G: celiac block, posterior bilateral x-ray, 25 ml 75%alcohol H: Chemical splanchnicectomy 20ml 50% alcohol at celiac axis
|
Describe control*:
A**: no celiac block B: Morphine (or other opioids) and adjuvant analgesia for neuropathic pain and liver capsule pain C: Not reported in characteristics D: NSAID and morphine E: NSAID and morphine F: NSAIDs and morphine G: NSAID and morphine H: 20ml saline injection at celiac axis
|
End-point of follow-up:
A: Not reported in characteristics B: at least 8 weeks C: at least 8 weeks D: at least 8 weeks E: at least 4 weeks F: at least 8 weeks G: at least 8 weeks H: at least 8 weeks
For how many participants were no complete outcome data available? Not reported in the SR
|
Pain at 4 weeks Defined as pain score (VAS score: 0-10) from celiac block group minus pain score from medical management group.
Effect measure: mean difference [95% CI]: C: -0.3 (no CI reported in numbers) D: -0.3 (no CI reported in numbers) F: -0.8 (no CI reported in numbers) G: -0.2 (no CI reported in numbers)
Pooled effect (fixed effects model): -0.382 [95% CI not reported] favoring celiac block. Heterogeneity (I2): 0%
Pain at 8 weeks Defined as pain score (VAS score: 0-10) from celiac block group minus pain score from medical management group Effect measure: RR, RD, mean difference [95% CI]:
B: 3.0 (no CI reported in numbers) C: 0.3 (no CI reported in numbers) D: -0.2 (no CI reported in numbers) E: F: -0.4 (no CI reported in numbers) G: -0.66 (no CI reported in numbers) H: -1.0 (no CI reported in numbers)
Pooled effect (random effects model): -0.265 [95% CI not reported] favoring celiac block Heterogeneity (I2): 91.861%
Opioid use at 4 weeks Defined as daily intake of morphine (or other opioids) in milligrams
Effect measure: mean difference [95% CI]: C: -79 (no CI reported in numbers) D: -27 (no CI reported in numbers) E: -22 (no CI reported in numbers) F: -69.2 (no CI reported in numbers) G: -46.2 (no CI reported in numbers)
Pooled effect (random effects model): -49.765 [95% CI not reported] favoring celiac block Heterogeneity (I2): 75.98%
Opioid use at last report Defined as daily intake of morphine (or other opioids) in milligrams
Effect measure: mean difference [95% CI]: C: -64 (no CI reported in numbers) D: -21 (no CI reported in numbers) E: -33 (no CI reported in numbers) F: -60.7 (no CI reported in numbers) G: -45 (no CI reported in numbers)
Pooled effect (fixed effects model): -48.290 [95% CI not reported] favoring celiac block Heterogeneity (I2): 0%
QoL individual studies, not presented in the SR**: A: mean % change from baseline intervention: 1mo: +15% (95%CI 7-19%) , 3mo: +19 (95%CI 10-27) / mean % change from baseline control: 1mo: +6% (95%CI 0-11%), 3mo: +18% (95%CI 12-26%); No Sign differences, p-value not reported, measured with Digestive Disease Questionnaire (DDQ-15) B: did not compare celiac block vs medical management for QoL C: QoL based on 0-10 (no-max interference) scores for: appetite, sleep, communication. No sign differences between groups, no p-value reported. D: Score is expressed as a % from max score: Range of mean % (SD) intervention over 24 weeks: 50.5 (15)-70.4(15.5), range of mean % (SD) control over 24 weeks: 60.9 (17.5)-64.2 (17.1); nog sign differences between groups over time, p=0.46, as measured with Functional Assessment of Cancer Therapy scale for Pancreatic Cancer (FACT-PA) E: Did not report on QoL F: mean (SD) VAS for QoL: intervention at 2 weeks: 5.4(1.7) / at 8 weeks: 4.8(1.1); control at 2 weeks: 5.5(1.8) / at 8 weeks: 4.0(0.7), up to 10 weeks no sign difference between groups, p-value not reported. A self-constructed QoL questionnaire was also used, no sign difference between groups up to 10 weeks, no p-value reported. G: Did not report on QoL H: Did not report on QoL |
The exact same analysis was performed in Arcidiacono 2011, with a slightly different statistical model. Some analyses in Zhong 2014 are performed with more included studies.
Meta-analyses only report graphical confidence intervals and do not report confidence intervals as numbers. Analyses do not show the sample sizes.
Wyse 2011 not included in analyses.
Opioid use at 4 weeks, and Opioid use at last report contain Wong 2004. However, Wong 2004 presents skewed data and reports therefore medians and IQR. Zhong 2014 used the median as a mean in the meta-analysis and used a SD that may or may not have been derived from the IQR.
|
|
Arcidiacono 2011
individual study characteristics deduced from Arcidiacono 2011 |
SR and meta-analysis of RCTs
Literature search from January 1990 to December 2010
A: Kawamata 1996 B: Lillemoe 1993 C: Mercadante D: Polati 1998 E: Wong 2004 F: Zhang 2008
Study design: RCTs
Setting and Country: Two from Italy, two from USA, one from Japan, one from China.
Source of funding: Not reported
|
Inclusion criteria SR: RCT, min follow-up 4 weeks, aged >18, abdominal or back pain due to pancreatic cancer at any stage (confirmed by CT/ US/ EUS / clinical criteria), control group medical management, use of celiac block / surgical approach/ EUS-guided neurolysis
Exclusion criteria SR: abstracts, non-English, benign lesions and severe alterations of coagulation.
6 studies included
Important patient characteristics at baseline:
Nintervention/Ncontrol: A: 10/11 B: 65/72 C: 10/10 D: 12/12 E: 50/51 F: 29/27
Sex intervention/ sex control (% male): A: 40%/45.5% B: - C: 50%/60% D: 70.8% male overall E: 48%/58% F: 62.5% male overall
Age intervention/ age control (year): A: 67/68 B: - C: 61.8/63.7 D: 57/60 E: 62.6/63.4 F: 58 years overall
Groups comparable at baseline? Unclear |
Describe intervention:
A: Celiac block, posterior bilateral x-ray, 15-20ml 80% alcohol B: Chemical splanchnicectomy, 20ml 50% alcohol at celiac axis C: celiac block, posterior bilateral x-ray, 25 ml 75%alcohol D: fluoroscopic posterior bilateral 7ml 100% alcohol E: fluoroscopic posterior bilateral 10ml 100% alcohol F: CT-guided posterior bilateral celiac block, 20ml 100% alcohol
|
Describe control:
A: NSAIDs and morphine B: 20ml saline injection at celiac axis (medical management not described in characteristics) C: NSAID and morphine D: NSAID and morphine E: NSAID and morphine F: Not described in characteristics
|
End-point of follow-up:
A: at least 8 weeks B: at least 8 weeks C: at least 8 weeks D: at least 4 weeks E: at least 8 weeks F: at least 8 weeks
For how many participants were no complete outcome data available? Not reported.
|
Pain at 4 weeks Defined as VAS score (0-10) at 4 weeks.
Effect measure: mean difference [95% CI]: A: -0.80 (-1.33- -0.27) C: -0.20 (-0.83-0.43) E: -0.30 (-0.99-0.39) F: -0.30 (-0.85-0.25)
Pooled effect (fixed effects model): -0.43 [95% CI -0.73 to -0.14] favoring celiac block Heterogeneity (I2): 0% Nintervention: 88 Ncontrol: 85
Pain at 8 weeks Defined as VAS score (0-10) at 4 weeks.
Effect measure: mean difference [95% CI]: A: -0.40 (-0.87-0.07) B: -1.00 (-1.13- -0.07) C: -0.66 (-0.93- -0.39) E: -0.20 (-0.97-0.57) F: 0.30 (-0.17-0.77)
Pooled effect (random effects model): -0.44 [95% CI -0.89 to 0.01] favoring celiac block Heterogeneity (I2): 89% Nintervention: 134 Ncontrol: 127
Opioid use at 4 weeks Defined as daily intake of morphine (or other opioids) in milligrams.
Effect measure: mean difference [95% CI]: A: -69.20 (-124.57- -13.83) C: -46.20 (-75.88- -16.52) D: -22.00 (-34.00- -10.00) F: -79.00 (-106.03- -51.97)
Pooled effect (random effects model): -51.07 [95% CI 82.71 to -19.43] favoring celiac block Heterogeneity (I2): 82% Nintervention: 60 Ncontrol: 60
Opioid use last day before death: Defined as daily intake of morphine (or other opioids) in milligrams.
Effect measure: mean difference [95% CI]: A: -60.70 (-150.95-, 29.55) C: -45.00 (-79.64- -10.36) D: -33.00 (-71.11-5.11) F: -64.00 (-99.73- -28.27)
Pooled effect (fixed effects model): -48.52 [95% CI -68.82 to -28.22] favoring celiac block Heterogeneity (I2): 0% Nintervention: 57 Ncontrol: 54
|
Facultative:
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Zhong 2014 |
No
Reason: No study aim/question formulated. Not deducible from inclusion criteria that patients should have (had) pancreatic cancer. |
Yes
Reason: multiple databases were searched with given keywords. Search date is given. However, the search string/strategy is not clear. |
Yes
Reason: reason and number of excluded studies is given. Not referenced. |
No
Reason: No information on potential confounders besides age and sex. Some variables presented in Characteristics are results used in the meta-analyses. |
NA
Reason: the included studies were all RCTs |
No
Reason: No formal tool was used for the quality appraisal. Only allocation and randomization were discussed as potential methodological sources of bias. |
Yes
Reason: similar procedures for intervention and control. Population seem to match between studies overall. |
Yes
Reason: Funnel plots were assessed. (However, less than 10 studies were included) |
No
Reason: Not reported, however source of funding was reported. |
|
Arcidiacono 2011 |
Yes
Reason: Aim is stated completely |
Yes
Reason: Multiple databases were searched. Date was given. Search strategy was given in an appendix. |
Yes
Reason: Reasons for exclusion were given and studies were referenced. |
No
Reason: No information on potential confounders besides age and sex. |
NA
Reason: the included studies were all RCTs |
Yes
Reason: Cochrane risk of bias tool was used, however a minimal number of domains were appraised |
Yes
Reason: similar procedures for intervention and control. Population seem to match between studies overall. |
No
Reason: No statistical tests or funnel plots to assess publication bias. |
Yes
Reason It is stated that there are no known conflicts of interest. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Gao 2014 |
Type of study: RCT
Setting: Hospital/ free-living
Country: China
Source of funding: Education department of Jiangsu Province, Stem cell and biomedical material key laboratory of Jiangsu province, Science and Technology Bureau of Suzhou City. |
Inclusion criteria: >18 years, unresectable or inoperable pancreas carcinoma, presence of mid-abdominal pain at least 2 day a week lasting >1h, no coagulopathy, life expectancy >3 months.
Exclusion criteria: Unable to sign informed consent, previous blocks, chronic pancreatitis
N total at baseline: Intervention: 68 Control: 32
Important prognostic factors2: age ± SD: I: 65.5 (10.2) C: 66.6 (9.9)
Sex: Not described
Mean body weight, kg (SD): I: 67.9 (3.1) C: 68.1 (2.8)
History of smoking, n(%): I: 5/68 (7.4%) C: 6/32 (18.8%)
History of alcohol use, n(%): I: 7/68 (10.3%) C: 8/32 (25%)
Mean baseline pain score, VAS score (SD): I: 7.5 (0.4) C: 7.4 (0.5)
Groups comparable at baseline? Unclear, sex is not described and history of smoking and alcohol use are represented in a higher proportion in the control group. |
Describe intervention (treatment/procedure/test):
Neurolysis of celiac plexus by using standard bupivacaine and ethanol + pain medication.
|
Describe control (treatment/procedure/test):
Bupivacaine and ethanol injected into gastric lumen + pain medication. |
Length of follow-up: 3 months
Loss-to-follow-up: Unclear as the sample size was not reported for each analysis. However, loss-to-follow-up is not reported in the manuscript.
Incomplete outcome data: Unclear as the sample size was not reported for each analysis. However, incomplete data is not reported in the manuscript.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain at 3 months: Pain score is an approximation from a bar-chart. I: 4 C: 7 Sign differences between groups (p<0.05). Pain in intervention group dropped approx. 3 points from baseline to 3 months. Pain in intervention group dropped approx. stayed around 7 at baseline and 3 months.
Oral analgesic reduction at 3 months: NSAIDs, % reduction (SD): I: 66.1 (0.3) C: 11.5 (0.6) Sign difference between groups (p<0.05)
Morphine, % reduction (SD): I: 88.9 (0.4) C: 12.3 (0.5) Sign. difference between groups (p<0.01)
Oxycondone, % reduction (SD): I: 78.2 (1.2) C: 9.8 (0.3) Sign. difference between groups (p<0.05)
Other analgesics, % reduction (SD): I: 88.4 (1.7) C: 6.6 (1.1) Sign difference between groups (p<0.05)
Quality of life at 3 months (Quality of Life Questionnaire, QLQ-C30), Global quality score (SD): I: 65.6 (0.4) C: 51.3 (0.5) Sign. difference between groups (p<0.05) At baseline there were no sign. differences between groups (p-value not reported) Functional scales ‘Physical’ and ‘Emotional’ sign. differences between groups (both p<0.05), favouring intervention. Symptom scales ‘Fatigue’ (p<0.05), ‘Pain’, ‘Insomnia’, and ‘Appetite loss’ (others p<0.01).
|
Analgesic medication use: unclear what the original scale and measure were (e.g. number of mg/day or mg/week) |
|
Wyse 2011 |
Type of study: RCT
Setting: Hospital/free-living
Country: Canada
Source of funding: Not reported |
Inclusion criteria: Age >18, suspected pancreatic cancer, new-onset cancer-related pain.
Exclusion criteria: Allergy to bupivacaine, possible future surgical management for tumour, life expectancy <3 months, inability/ unwillingness to provide informed consent.
N total at baseline: Intervention: 49 Control:49
Important prognostic factors2: age ± SD: I: 66.6 (9.32) C: 66.5 (10)
Sex: I: 26/49 (53.1%) M C: 21/49 (42.9%) M
Baseline narcotic consumption, mean MEQ (SD): I: 41.9 (74.1) C: 36.8 (61.7)
Pain history, weeks (SD): I: 8.6 (5.4) C: 9.6 (8.4)
Groups comparable at baseline? Groups seem fairly similar in characteristics with probably a few outliers in some characteristics, however weight was not reported |
Describe intervention (treatment/procedure/test):
Endoscopic Ultrasound guided celiac plexus neurolysis with bilateral injection around celiac axis (10ml 0.5% bupivacaine and 20ml absolute alcohol) + pain management by referring physician
|
Describe control (treatment/procedure/test):
Pain management by referring physician. |
Length of follow-up: 1 and 3 months after randomization.
Loss-to-follow-up: At 1 month: I: n=10 (20.4%) C: n=5 (10.2%) Reasons: death
At 3 months: I: n=9 (18.3%) C: n=14 (28.5%) Reasons: death
Incomplete outcome data (other than loss-to-follow-up): Baseline intervention group (T0): Pain score (n=1, 2%) Medication consumption (n=5, 10.2%) QoL (n=4, 8.1%)
At 1 month intervention group (T1): Pain (n=1, 2.5%) QoL (n=1, 2.5%)
At three months intervention group (T3): Pain score (n=1, 3,3%) Medication consumption (n=1, 3.3%) QoL (n=4, 13.3%)
Baseline control group (T0): Medication consumption (n=3, 6.1%) QoL (n=3, 6.1%)
At 1 month control group (T1): Pain score (n=2, 4.5%) QoL (n=3, 6,8%)
At 3 months control group (T3): Pain score (n=1, 3.3%) QoL (n=2, 6.6%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain score: NA
Medication consumption at 1 month, mean difference MEQ (95%CI): Mean difference = -1.0 (95%CI: -47.7-47.2) No sign. differences between groups (p=0.99)
Medication consumption at 3 months, mean difference MEQ (95%CI): -49.5 (95%CI: -127.5-7.0) No sign difference between groups (p=0.10)
Quallity of life (DDQ-15), score (SD): No scores reported for both groups. No sign. differences between groups (p-value not reported) |
After 1 month, participants were allowed to undergo open-label EUS-CPN at the referring physician’s discretion.
For pain, a mean and a percentage change were calculated from a Likert-scale. Thus outcomes (i.e. means and %) were calculated from a categorical scale and therefore not recorded into this evidence table.
MEQ = Morphine equivalent (30mg morphine = 1 MEQ / 20mg oxycondone = 1.5 MEQ) |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Gao 2014 |
Participants were randomly assigned to the groups at the time of staging |
Unclear
Reason: No description of allocation concealment. |
Unlikely
Reason: Although not explicitly stated, it is highly probable that the patients were blinded (due to the procedure: neurolysis vs. sham) |
Unclear
Reason: blinding of participants, study personnel, care givers, and outcome assessors not described. |
Unclear
Reason: blinding of participants, study personnel, care givers, and outcome assessors not described. |
Unlikely
Reason: Outcomes of interest were stated in the methods and results. |
Unclear
Reason: Loss to follow-up not described. Also, the number of participants included in each analysis is not described. |
Unclear
Reason: The number of participants included in each analysis is not described. |
|
Wyse 2011 |
A computer generated number sequence was used. Participants were allocated to a group with sealed envelopes. |
Unclear
Reason: Unclear who generated the random list and where the allocation list was stored and who had access to the allocation list. Not reported that the envelopes were opaque. |
Unclear
Reason: Unclear if the patient was blinded for the treatment. No sham injections were given. |
Unclear
Reason: Unclear if the prescriber of the pain medication was blinded for the procedure. The surgeon who gave the procedure could not be blinded. |
Unlikely
Reason: participants were randomized directly after diagnostic procedures. The outcome assessor was not present while diagnosing and randomizing. However it remains unclear whether they had access to the allocation schedule in some way or not. |
Unlikely
Reason: Outcomes of interest were stated in the methods and results |
Unlikely
Reason: these numbers of loss-to-follow-up due to death can be expected in a sample with inoperable pancreas carcinoma. Drop-out was similar in both groups |
Unlikely
Reason: ITT was followed |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-06-2019
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Op modulair niveau moet in 2019 gekeken worden of de module ‘Screening' herzien moet worden naar aanleiding van het uitkomen van de update van de internationale consensus guideline over pancreassurveillance (Canto 2013). De module ‘Neoadjuvante behandeling van (borderline) resectabel pancreascarcinoom’ moet worden beoordeeld zodra de resultaten van de PREOPANC-1 studie zijn gepubliceerd. De module ‘Adjuvante therapie’ moet worden beoordeeld zodra de lange termijn data van lopend onderzoek (gemcitabine capecitabine, MFOLFIRINOX, nab-paclitaxel/gem) zijn gepubliceerd.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Eerstvolgende beoordeling actualiteit richtlijn |
|
Screening |
2020 |
|
Diagnostische strategie |
2024 |
|
Screening en diagnostiek voedingstoestand |
2024 |
|
Indicatie resectie |
2024 |
|
Voeding in het peri-operatieve beleid |
2024 |
|
Peri-operatief gebruik Somatostatine (analogen) |
2024 |
|
Uitgebreidheid resectie |
2024 |
|
Follow-up na resectie |
2024 |
|
Pancreasenzymen, vitaminen, omega-3 vetzuren en kurkuma |
2024 |
|
Pathologie |
2024 |
|
Neoadjuvante behandeling van (borderline) resectabel pancreascarcinoom |
2021 of na publicatie PREOPANC-1 studie |
|
Adjuvante therapie |
2021 of na publicatie van lange termijn data van lopend onderzoek (gemcitabine capecitabine, MFOLFIRINOX, nab-paclitaxel/gem) |
|
Behandeling van lokaal gevorderd pancreascarcinoom |
2024 |
|
Behandeling voor patiënten met gemetastaseerd pancreascarcinoom |
2024 |
|
Preoperatief en palliatief stenten |
2024 |
|
Behandelvoorkeur bij pijnbestrijding voor lokaal uitgebreid pancreascarcinoom |
2024 |
|
Voeding in de palliatieve fase |
2024 |
|
Psychosociale zorg |
2024 |
|
Voorlichting en communicatie |
2024 |
|
Organisatie van zorg |
2024 |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om het beleid bij patiënten te standaardiseren en af te stemmen op de wensen van deze patiënten in alle fasen van hun ziekte en aanbevelingen zo te formuleren dat zij implementeerbaar zijn.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met pancreascarcinoom, zoals chirurgen, radiotherapeuten, medisch oncologen, maag-darm-leverartsen, radiologen, nucleair-geneeskundigen, pathologen, huisartsen, oncologieverpleegkundigen, IKNL-consulenten, maatschappelijk werkers, diëtisten en psychologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een pancreascarcinoom.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. O.R.C. (Olivier) Busch, HPB chirurg, Amsterdam UMC locatie AMC, Amsterdam (voorzitter)
- C.J.M. (Charlotte) van den Bosch MSc, diëtist chirurgie-oncologie, Amsterdam UMC locatie VUmc (vanaf 1/5/2018)
- dr. L.A.A. (Lodewijk) Brosens, patholoog, UMC Utrecht, Utrecht en RadboudUMC, Nijmegen
- prof. dr. M.J. (Marco) Bruno, afdelingshoofd MDL, Erasmus MC, Rotterdam
- L.J.P.M. (Lieke) Corpelijn, verpleegkundig specialist, Maastricht UMC, Maastricht
- prof. dr. P. (Paul) Fockens, hoofd afdeling MDL, Amsterdam UMC, Amsterdam
- dr. B. (Bas) Groot Koerkamp, HPB chirurg en epidemioloog, Erasmus MC, Rotterdam
- drs. E.J.R.J. (Erik) van der Hoeven, abdominaal radioloog, St. Antonius Ziekenhuis, Nieuwegein
- dr. C. (Casper) Jansen, klinisch patholoog, LabPON, Hengelo
- de heer L. (Leo) Kwakkenbos, ervaringsdeskundige
- M. (Marjan) Mullers MSc, diëtist chirurgie-oncologie, Maastricht UMC, Maastricht
- dr. J.J. (Joost) Nuyttens, radiotherapeut, Erasmus MC, Rotterdam
- drs. T.P. (Thomas) Potjer, klinisch geneticus, LUMC, Leiden
- dr. M.W.J. (Martijn) Stommel, HPB chirurg, Radboudumc, Nijmegen
- drs. G. (Geertjan) van Tienhoven, radiotherapeut oncoloog, Amsterdam UMC locatie AMC, Amsterdam
- drs. J. (Judith) de Vos – Geelen, medisch oncoloog, Maastricht UMC, Maastricht
- dr. J.W. (Hanneke) Wilmink, internist-oncoloog, Amsterdam UMC locatie AMC, Amsterdam
- J.E. (Jill) Witvliet-van Nierop MSc, diëtist chirurgie-oncologie, Amsterdam UMC locatie VUmc (tot 1/5/2018)
Met ondersteuning van
- Dr. J.S. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Michiel) Oerbekke MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.A. (Annefloor) van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- J. (Jill) Heij, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
prof. dr. O.R.C. (Olivier) Busch |
HPB chirurg |
Geen andere betaalde functies |
Voorzitter Dutch Pancreatic Cancer Group (DPCG)
Voorzitter Dutch Pancreatic Cancer Audit (DPCA bij DICA)
Lid toetsingscommissie dataverificatie DPCA
Coördinator bij PancreasParel, biobanking bij Parelsnoer Instituut |
Geen acties ondernomen |
|
dr. B. (Bas) Groot Koerkamp |
HPB chirurg Epidemioloog |
Bestuurslid Wetenschappelijke vereniging van de DPCG (Ducth Pancreas Cancer Group), onbetaald |
Subsidie van ZonMW (300.000 Euro) voor fase 3 trial naar neoadjuvante FOLFIRINOX versus direct opereren en adjuvante chemotherapie voor patiënten met (borderline) resectabel pancreascarcinoom.
Subsidie van KWF (600.000 Euro) voor fase 3 trial naar intra-arteriele chemotherapie met een pomp voor patiënten resectabele colorectale levermetastase. |
Geen acties ondernomen |
|
dr. M.W.J. (Martijn) Stommel |
HPB chirurg |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
dr. J.W. (Hanneke) Wilmink |
Internist-oncoloog |
Geen nevenfuncties |
Bestuurslid van de Dutch Pancreatic Cancer Group (DPCG)
Heeft extern gefinancierd onderzoek, maar de financier daarvan heeft geen belang bij resultaat van het onderzoek |
Geen acties ondernomen |
|
drs. J. (Judith) de Vos – Geelen |
Medisch oncoloog |
Lid van de wetenschappelijke commissie DPCG |
Lid adviescommissie Celgene, Baxalta en Ipsen. Geen directe financiële belangen in een farmaceutisch bedrijf. |
Geen acties ondernomen |
|
dr. L.A.A. (Lodewijk) Brosens |
Patholoog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
dr. C. (Casper) Jansen |
Klinisch patholoog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
drs. E.J.R.J. (Erik) van der Hoeven |
Abdominaal radioloog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
prof. dr. P. (Paul) Fockens |
Hoofd afdeling MDL |
Geen nevenfuncties |
Consultancy op onregelmatige basis voor biomedische bedrijven. In de afgelopen 2 jaar voor Boston Scientific, Cook, Fujifilm, Medtronic en Olympus.
Geen financiele belangen in biomedische bedrijven
Externe financiering van wetenschappelijk onderzoek naar complicaties van pancreatitis door Bosont Scientific |
Geen acties ondernomen |
|
prof. dr. M.J. (Marco) Bruno |
MDL-arts |
- Lecturer en consultant Boston Scientific - Lecturer en consultant Cook Medical - Lecturer 3M - Lecturer Pentax Medical - Consultant Mylan
|
Lid van de Wetenschappelijke Advies Raad (WAR), commissie Care & Cure, Zorginstituut Nederland
Committee member Scientific Committee of United European Gastroenterology (UEG)
ZonMw NutsOhra financiering voor studie naar effect ERCP en papillotomie voorspelt ernstige pancreatitis
Financiering Cook Medical voor investigator initiated studie naar optimalisatie van EUS geleide weefselbiopten (oa pancreaskanker) en training en kwaliteit van ERCP
Financiering Boston Scientific voor investigator initiated studie naar nut en effect van pancreatoscopische behandeling van pacreasstenen bij chronische pancreatitits
Deelname aan verschillende industry initiated ERCP en/of EUS gerelateerde device/accessoires studies
Studie naar infectie prevalentie ERCP scopen gefinancieerd door ministerie van VWS
Studie aangaande endoscoop reiniging gefinancierd door 3M
Studie aangaande endoscoop reiniging gefinancierd door Pentax Medical |
Geen acties ondernomen |
|
dr. J.J. (Joost) Nuyttens |
Radiotherapeut |
Onbekend |
Geen belangen |
Geen acties ondernomen |
|
drs. G. (Geertjan) van Tienhoven |
Radiotherapeut oncoloog |
Geen nevenfuncties |
Onderzoek gefinancierd door (onafhankelijk) KWF |
Geen acties ondernomen |
|
drs. T.P. (Thomas) Potjer |
Klinisch geneticus i.o. |
PhD student erfelijk pancreascarcinoom / melanoom (betaald) |
Geen belangen |
Geen acties ondernomen |
|
L.J.P.M. (Lieke) Corpelijn |
Verpleegkundig Specialist HPB-Chirurgie |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
M. (Marjan) Mullers MSc |
Diëtist |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
J.E. (Jill) Witvliet-van Nierop MSc |
Diëtist |
Geen nevenfuncties |
Heeft voedingsonderzoek uitgevoerd rondom IRE van pancreascarcinoom (PAN-NUTRIENT studie), gefinancierd door Nationaal Fonds tegen Kanker. De financierder heeft geen belangen bij de resultaten. |
Geen acties ondernomen |
|
C.J.M. (Charlotte) van den Bosch MSc |
Diëtist |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
L. (Leo) Kwakkenbos |
Ervaringsdeskundige |
Voorzitter WijkNogLeuker
PACO-lid KWF
Lid Voorzittersoverleg Adviesraad KWF
Bestuurslid DPCG (betaald)
Bestuurslid (voorzitter) Living With Hope (Landelijk Patiënten Platform Alvleesklier kanker) (tot januari 2019)
Overige functies zijn onbetaald |
Geen belangen |
Geen acties ondernomen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van patiëntvertegewoordigers aan de invitational conference (zie verslag invitational conference bij de aanverwante producten) en deelname van dhr. Leo Kwakkenbos (ervaringsdeskundige) in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Living With Hope Foundation.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Pancreascarcinoom (IKNL 2011) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van:
- Klinische relevantie.
- De beschikbaarheid van (nieuwe) evidence van hoge kwaliteit.
- De te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Gebruik van beschikbare evidence Belgische richtlijn Pancreascarcinoom
Het Federaal Kenniscentrum voor de Gezondheidszorg (KCE) en het College voor Oncologie publiceerden in 2017 een selectieve update van hun klinische richtlijn uit 2009 over de diagnose en behandeling van pancreascarcinoom. Het KCE concentreerde zich op drie vragen:
- Wat is de waarde van de volgende onderzoeken bij de diagnose van pancreascarcinoom: ultrasonografie (US), computertomografie (CT), beeldvorming door magnetische resonantie (MRI), endoscopische ultrasonografie (EUS) + fijnenaaldaspiratie (FNA) van de primaire tumor, positronemissietomografiescan (PET-scan), endoscopische retrograde cholangiopancreatografie (ERCP), dosering van tumormarkers en analyse van cystevocht?
- Gaat toediening van een neoadjuvante behandeling met chemotherapie, radiotherapie of beide gepaard met een betere overleving, reseceerbaarheid en kwaliteit van leven (QoL) en met minder complicaties: a) bij patiënten met een reseceerbaar pancreascarcinoom? b) bij patiënten met lokaal invasieve borderlin e reseceerbaar pancreascarcinoom?
- Wat is de optimale behandelingsstrategie bij patiënten met recidief pancreascarcinoom?
De Nederlandse werkgroep beoordeelde de kwaliteit van:
- de strategie voor zoeken en selecteren van literatuur;
- het beoordelen van de methodologische kwaliteit van de studies en
- de literatuursamenvattingen
als hoog en heeft er daarom voor gekozen om de literatuursamenvattingen van KCE te gebruiken (na instemming van KCE) bij het formuleren van overwegingen en aanbevelingen voor de modules Diagnostiek, Neoadjuvante behandeling en Behandeling gemetastaseerd pancreascarcinoom. De literatuursamenvattingen, -resultaten, -beoordelingen en -conclusies van de eerder genoemde modules werden door het KCE in het Engels opgesteld en werden niet vertaald voor het gebruik in de huidige richtlijn. Tevens koos de werkgroep ervoor om de literatuurbeschrijvingen en -resultaten (inclusief evidence tabellen) voor enkele modules in het Engels op te stellen om deze eventueel internationaal te kunnen uitwisselen.
Strategie voor zoeken en selecteren van literatuur
De literatuurspecialist zocht aan de hand van specifieke zoektermen naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DPCA indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. (2010) AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ, 182(18):E839-42. doi: 10.1503/cmaj.090449. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Schünemann HJ, Oxman AD, Brozek J, et al. (2008) Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ, 336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ, 336(7654). doi: 10.1136/bmj.a139. Schünemann, Holger J. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. (2016) How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc, 104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
