Diagnostische strategie bij pancreascarcinoom
Uitgangsvraag
Wat is de beste diagnostische strategie bij verdenking op een pancreascarcinoom?
Aanbeveling
Verricht bij alle patiënten met verdenking op een pancreascarcinoom diagnostische beeldvorming middels een abdominale CT met vroeg-portale en portoveneuze fase.
Indien de CT inconclusief is: Verricht EUS ter detectie van een laesie en eventueel FNA ter differentiatie tussen een benigne en maligne laesie.
Gebruik MRI en PET niet standaard voor de differentiatie tussen benigne en maligne laesies.
Gebruik EUS niet ter beoordeling van vasculaire betrokkenheid van het pancreascarcinoom.
Gebruik serum tumor markers CA19-9 en CEA niet als individuele test bij de primaire diagnose van het pancreascarcinoom.
Start bij patiënten met een verdenking resectabel pancreascarcinoom de exploratie bij voorkeur met een diagnostische laparoscopie.
Overwegingen
Balans tussen klinische opbrengst en risico’s
De volgende drie overwegingen zijn afkomstig uit Veereman 2017:
- Ondanks dat de waarde van de diagnostische work-up ten aanzien van de beoordeling van resectabiliteit werd onderzocht, was er geen formele onderzoeksvraag ten aanzien van stadiëring.
- Laparoscopische exploratie gevolgd door laparotomie of laparoscopische resectie in sommige centra worden systematisch als één procedure uitgevoerd. Deze systematiek is door verschillen in logistiek en organisatie niet universeel.
- Het is noodzakelijk een cytologische of histocytologische diagnose te verkrijgen middels EUS met FNA, voordat er gestart wordt met chemotherapie.
Kosten
Kosten werden niet geanalyseerd in deze richtlijn.
Patiënten perspectief
Veereman (2017) consulteerde patiëntorganisaties tijdens een Stakeholder meeting. Hier benadrukten de patiëntorganisaties het belang van open communicatie en het verschaffen van informatie met betrekking tot de verwachte voordelen en risico’s in begrijpelijke taal. Clinici dienen bij het maken van keuzes omtrent diagnostiek rekening te houden met de persoonlijke voorkeuren en kwaliteit van leven van patiënten. De Nederlandse richtlijnwerkgroep ondersteunt en sluit aan bij deze bevindingen.
Professioneel perspectief
Bij alle patiënten met verdenking op een pancreascarcinoom dient diagnostiek te worden verricht middels een hoge kwaliteit CT. Een hoge kwaliteit diagnostisch CT onderzoek van het pancreas bestaat uit een scan in vroeg portale fase van de bovenbuik en een scan in portoveneuze fase van het gehele abdomen voor optimale beoordeling van lokale uitbreiding, aanwezigheid van eventuele metastasen en vasculaire anatomie. De werkgroep adviseert het door de NVvR geadviseerde scanprotocol voor stadiëring te gebruiken. Een CT wordt beschouwd als inconclusief indien er twijfel is over de aan- of afwezigheid van een laesie of indien er twijfel is over de aard van een laesie. Als er twijfel is over de aard van de gevonden afwijking kan een EUS worden verricht met of zonder FNA ter nadere karakterisatie van de laesie. Een MRI kan worden overwogen in specifieke cases, bijvoorbeeld indien in de differentiaaldiagnose focale vervetting of een sereus cysteadenoom wordt overwogen.
Laparoscopie met als doel het voorkomen van een onnodige laparotomie bij patiënten met een hoog risico op aanwezigheid van metastasen kan met name worden overwogen bij tumoren in de staart en bij grotere (>3 cm) tumoren.
Verschillende observationele studies hebben aangetoond dat gestructureerde verslaglegging een gunstig effect heeft op de kwaliteit van verslaglegging en preoperatieve planning (Brook 2015, Marcal 2015). De werkgroep adviseert daarom bij verslaglegging van de radiologische diagnostiek gebruik te maken van gestructureerde verslaglegging zoals de “checklist radiologisch verslag bij solide pancreastumor” welke wordt aanbevolen door de NVvR en DPCG.
Onderbouwing
Achtergrond
De verdenking op een pancreascarcinoom is meestal gebaseerd op een bevinding bij beeldvorming van de bovenbuik in verband met pijnloze icterus, niet specifieke bovenbuikklachten of op een toevalsbevinding bij beeldvorming voor andere indicaties. Vaak is een CT de eerste gebruikte beeldvormende modaliteit waarop verder (diagnostisch en therapeutisch) beleid zal worden bepaald. Het maken van het onderscheid tussen een benigne of maligne aard van een gevonden pancreaslaesie is de eerste diagnostische uitdaging. Indien een focale pancreaslaesie als suspect maligne is beoordeeld en chirurgische resectie overwogen wordt dient te worden beoordeeld of de laesie resectabel is.
Conclusies / Summary of Findings
|
Laag GRADE |
Bij patiënten met verdenking op een pancreascarcinoom:
|
Samenvatting literatuur
1 Imaging tests to diagnose malignant pancreatic lesions
A protocol for a Cochrane SR was found on the diagnostic accuracy of imaging tests for characterizing focal pancreatic lesions. The authors of the corresponding manuscript agreed to share the final manuscript before publication (Gurusamy 2012; Best 2016). This study searched for studies on imaging tests published until July 2016. The authors identified 53 studies (with a total of 3118 patients) that evaluated the diagnostic accuracy of various index tests for different final diagnoses (including benign, precancerous and cancerous lesions). Imaging tests that were searched for were CT, MRI, PET, EUS, EUS elastography, and EUS-guided biopsy either alone or in combination with another test.
Not all studies in this review were relevant to the RQ at hand; only the studies that looked at the ability of various imaging modalities to differentiate between cancerous and benign lesions (11 studies, 533 patients) or between either precancerous (low grade dysplasia) or cancerous and benign lesions (7 studies, 204 patients) were relevant and summarized here.
1.1 Differentiating between cancerous and benign lesions
Of the 11 studies on differentiating between cancerous versus benign lesions there were two studies on EUS, two studies on EUS with FNA cytology (fine needle aspiration), three studies on PET, one study on PET (Standardised Uptake Value: SUV max >3.5), two studies on CT, and one study on MRI. The median pre-test probability of a malignant lesion in these studies was 70% (range 23 to 89%). The respective pooled (or single study) estimates (with 95% confidence interval (CI)) of sensitivity and specificity were 0.95 (0.84-0.99) and 0.53 (0.31-0.74) for EUS, 0.58 (0.37-0.77) and 1.0 (95% CI 0.87 to 1.00) for EUS FNA, 0.92 (0.80-0.97) and 0.65 (0.39-0.85) for PET, 0.96 (0.87-0.99) and 0.62 (0.43-0.78) for PET (SUV max >3.5), 0.98 (0.00-1.00) and 0.76 (0.02-1.00) for CT, and 0.80 (0.58-0.92) and 0.89 (0.57-0.98) for MRI.
1.2 Differentiating between precancerous or cancerous and benign lesions
Seven studies on the accuracy of imaging tests to differentiate between precancerous or cancerous versus benign lesions were found: EUS, EUS with FNA, EUS with FNA (CEA > 50 ng/ml), PET (standardized uptake values (SUV) max 2.4), CT and MRI. Only one study was found for each of these, except for EUS FNA, for which two were found. The median pre-test probability of a malignant lesion in these studies was 71% (range 52 to 75%). The estimates of sensitivity and specificity from these studies were as follows: 0.92 (0.74-0.98) and 0.60 (0.31-0.83) for EUS, 0.73 (0.01-1.00) and 0.94 (0.15-1.00) for EUS FNA (cytology), 0.29 (0.08-0.64) and 0.25 (0.05-0.70) for EUS FNA (CEA > 50 ng/ml), 0.94 (0.74-0.99) and 0.93 (0.69-0.99) for PET (SUV max 2.4), 0.62 (0.45-0.76) and 0.64 (0.39-0.84) for CT, and 0.93 (0.69-0.99) and 0.85 (0.58-0.96) for MRI.
It is difficult to make any conclusion on the basis of the results of the studies found in Best’s SR because of the small number of available studies, and the small size of these studies, as well as due to serious methodological limitations of the studies related to patient selection, reference standard, and flow and timing. In particular, there is likely a problem with the selection of participants for such studies as all studies used surgical excision as the reference standard, suggesting that only patients with a high risk of malignancy were included.
2 Serum tumour markers in the diagnostic work-up of pancreatic lesions
2.1 Carbohydrate antigen 19-9 (CA 19-9)
One SR was found addressing the diagnostic accuracy of CA 19-9 for assessing malignancy in patients with a pancreatic lesion on imaging (Cao 2016). This review searched for studies published up to March 2016 and found 13 studies that contained a total of 1437 patients. Three of these studies were on any type of pancreatic cystic neoplasms (PCNs) and the rest were specifically on intraductal papillary mucinous neoplasms (IPMNs). The majority of studies in the review used a cut-off value of 37 u/ml for CA 19.9.
The estimated sensitivity and specificity were 0.47 (95% CI: 0.35-0.59) and 0.88 (95% CI: 0.86 - 0.91), respectively.
A search update revealed one additional study. This study by Gu et al. including 60 patients had estimates of sensitivity and specificity of 0.88 and 0.60, respectively at the cut-off of 37 u/ml.8 A hypothesis as to why these findings are not be in-line with the Cao et al. review is that it was not possible to rule out that this study was not a case-control design. Because of concerns that Gu et al. might be a case-control study, we did not update the meta-analysis by Cao et al.
In the SR there was a high variability of estimates of sensitivity between the studies and the authors were not able to identify the cause of this heterogeneity. While the specificity of around 88% for CA 19-9 is satisfactory, the sensitivity of 47% is too poor for this marker to be used as sole test.
2.2 Carcino Embryonal Antigen (CEA)
The search did not reveal any SRs on the accuracy of CEA for assessing malignancy in patients with focal pancreatic lesions. Therefore, a SR was performed (see appendix for details on search). In addition to the items specified in the RQ, an additional restriction regarding study design was that case-control studies were not accepted since these may not be applicable.
Three studies were identified: Aljebreen 2007, Goh 2008, and Ni 2005. The quality of these studies was assessed and a forest plot was constructed Figure 1. In total, these studies included 471 patients; 46, 220 and 205 respectively. These studies were conducted on patients with pancreatic lesions in hospitals in Canada, Singapore and China and included patients with a mean age of around 60 years.
Across the studies, 37% of the patients were diagnosed with malignant pancreatic cancer. CEA cut-offs were 3.1 nl/mL, 3.1 nl/mL and 5 nl/mL, respectively. All studies may have a higher risk patient population than in clinical practice because the authors selected either patients who had undergone operations11 or biopsy with histologic examinations 9,10 for suspected pancreatic cancer.
Accuracy estimates varied widely across the studies. Because there were only three studies and a high heterogeneity, estimates were not summarized in a meta-analysis, but instead presented visually in a forest plot (Figure 1). Sensitivities ranged from 24% in the study by Goh et al. to 80% in the study by Ni et al. Specificities also showed heterogeneity, ranging from 43% in Ni et al. to 96% in Goh. The uncertainty around the accuracy of this test, including low estimates of sensitivity and specificity signal that this marker is not accurate enough to be used alone to diagnose malignancy in patients with focal pancreatic lesions.
Future research is needed to assess whether the combination of biomarkers leads to improved sensitivity while retaining acceptable specificity or if it may be useful in patients with lesions carrying a lower risk of malignancy, such as IPMNs. The fact that these tests are not sufficiently sensitive to guide clinical decisions does not negate their potential value as prognostic tools.
Figure 1 – Forest plot for diagnostic test accuracy of serum CEA in diagnosing malignancy in patients with focal pancreatic lesions
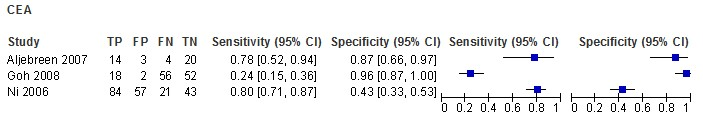
TP: total positives, FP: false positives, FN: false negatives, TN: total negatives
3 Tests to assess curative resectability of pancreatic cancer
Two Cochrane SRs were found that addressed the diagnostic accuracy of tests for assessing curative resectability in patients with a pancreatic lesion on imaging: Allen et al and Tamburrino et al., both published in 2016. The review by Allen et al. focused on laparoscopy and found 16 studies. The review by Tamburrino et al. searched for accuracy studies on imaging tests (MRI, PET scan, and EUS performed as an add-on test or PET-CT as a replacement test to CT scanning), but unfortunately only found two small studies on EUS. No other studies regarding the diagnostic accuracy of imaging modalities for assessing resectability were identified.
3.1 Laparoscopy
The SR by Allen et al. assessed the role of laparoscopy after the diagnostic work-up of patients suspected of pancreatic cancer (and planned to receive curative resection) in predicting that disease was not resectable. The search was performed in May 2016 and found 16 primary studies that contained 1146 patients. Because the reference standard (histology) was also part of the index test (laparoscopy with histologic confirmation), false positives (FP) were not possible. Therefore, only sensitivity and post-test probability of unresectable disease were calculated. Pooled sensitivity was 0.64 (95% CI 0.50 to 0.77). At the median pre-test probability (prevalence) of unresectabilitiy of 0.41, the post-test probability of unresectability was 0.20 (95% CI 0.15 to 0.27), when laparoscopy indicates ‘resectable disease’. This means that if a person is found to have disease on CT scan and laparoscopy indicates that the lesion is resectable, their probability of unresectable disease will be 20%. There was a very low consistency in the results and a high risk of bias across the studies. A limitation of these studies is that different definitions of unresectability were used, namely surgeon’s judgment on unresectability was accepted when histopathological confirmation of liver or peritoneal involvement was not possible. Despite the poor methodological quality of the studies, the authors concluded that diagnostic laparoscopy appears to be beneficial in avoiding unnecessary laparotomies. On average, given a prevalence of unresectability of 0.41, if laparoscopy is used in 100 patients where resection of cancer with curative intent is planned, it helps avoid unnecessary laparotomies in 21 patients.
3.2 EUS
The SR by Tamburrino et al. assessed the role of EUS in predicting unresectability of disease. The search date of the review was November 2015. The overall risk of bias of the review was judged to be low, although the source of funding or support was not reported for each of the included studies. The review included two studies with a total of 34 patients, both of which reported sufficient data to calculate sensitivity and specificity for unresectability. However, the planned analysis, which considered a borderline category result of EUS, was not possible, as the review did not report this information. Both studies suffered from differential verification (different reference standards for different patients) and one of the studies had a high risk of bias due to only selecting patients with tumours of less than 3 cm in diameter. Because the results were similar between the studies, they were pooled. The pooled sensitivity for detecting non-resectable tumours was 0.87 (95% CI 0.54 to 0.97) and pooled specificity was 0.80 (95% CI 0.40 to 0.96). In a hypothetical study of 1000 patients and with a prevalence unresectability of 60.5% (average prevalence of two included studies) EUS prevents unnecessary surgery in 264 patients (95% CI 205 to 314). However, 146 patients (95% CI 96 to 205) will be incorrectly classified as being resectable (FN) and 79 patients (95% CI 16 to 237) will be incorrectly classified as unresectable (FP).
The authors concluded that there is significant uncertainty in the utility of EUS as a diagnostic tool for resectable pancreatic tumours detected on CT scan. They also state that there is “no evidence to suggest that it should be performed routinely in people with pancreatic cancer thought to have resectable disease on CT scan.”
Bewijskracht van de literatuur
Erg laag voor aanbevelingen 1,2,3,5 en erg laag tot laag voor aanbeveling 4.
Het verschil tussen de beschikbare evidence gebaseerd op het aantal geïncludeerde patiënten in klinische studies en het aantal uitgevoerde onderzoeken in de klinische praktijk is opmerkelijk.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden gebruikte de werkgroep de systematische literatuuranalyse beschreven in Management of pancreatic cancer Part 2: Diagnosis (Veereman 2017). Veereman (2017) verrichtte een literatuurstudie naar de uitgangsvraag en formuleerde de volgende PICO:
Patiënten:
-
- Patiënten met verdenking op een resectabel pancreascarcinoom.
- Patiënten met verdenking op een bordeline resectabel pancreascarcinoom.
- Patiënten met verdenking op een lokaal gevorderd pancreascarcinoom.
Interventie: Computed tomography (CT) magnetic resonance imaging (MRI), magnetic resonance cholangiopancreatography (mRCP) endoscopic ultrasound (EUS) +/- fine needle aspiration (FNA) +/- cystevocht analyse positron emission tomography (PET) scan tumor markers: carbohydrate antigen 19-9 (CA19.9) en carcino embryonal antigen (CEA), laparoscopie.
Controle: Histopathologie en/of klinische follow-up en/of chirurgie
Outcome: Diagnose, beoordeling resectabiliteit.
Vaak is een CT de eerste gebruikte beeldvormende modaliteit waarop verder (diagnostisch en therapeutisch) beleid zal worden bepaald. EUS (eventueel met FNA), MRI (inclusief MRCP) en biomarkers kunnen worden gebruikt voor verdere analyse van de gevonden laesie of wanneer CT geen afwijking laat zien maar de klinische verdenking blijft bestaan. Het maken van het onderscheid tussen een benigne of maligne aard van een gevonden pancreaslaesie is de eerste stap in de diagnostische uitdaging. Om de beste diagnostische strategie voor deze vraag te bepalen werd de volgende PICO gebruikt.
Patiënten: Volwassenen ≥18 jaar oud met een focale pancreas laesie bij beeldvorming.
Interventie: CT, MRI / MRCP, PET(/CT), EUS met of zonder FNA met of zonder cystevocht analyse, tumor markers: CA19.9, CEA
Controle: Onderzoeken zijn onderling vergeleken, direct (head-to-head) of indirect.
Outcome: Diagnostische uitkomsten: sensitiviteit, specificiteit, voorspellende waarden voor pancreas of periampulaire maligniteit vs geen maligniteit (benigne laesies bevestigd door histopathologie en/of klinische follow-up en/of chirurgie).
Indien een focale pancreaslaesie als suspect maligne is beoordeeld en chirurgische resectie overwogen wordt dient te worden beoordeeld of de laesie resectabel is. Een laesie is niet resectabel Indien er sprake is van gevorderde lokale uitbreiding en/of aanwezigheid van afstandsmetastasen (bijvoorbeeld naar de lever, longen of het peritoneum). Als een tumor als resectabel is beoordeeld zal een resectie volgen (vaak zonder histologische bevestiging van de diagnose). Een andere uitkomst van de diagnostische work-up kan zijn dat de laesie wordt beoordeeld als borderline resectabel (twijfel over de resectabiliteit) of als niet resectabel. Daarom werd het tweede deel van de PICO als volgt opgesteld:
Patiënten: Volwassen patiënten (≥18 jaar oud) met een als suspect maligne beoordeelde focale pancreas laesie op CT (of een andere beeldvormende modaliteit).
Interventie: CT; MRI, MRCP, PET(/CT) EUS met of zonder FNA, laparoscopie als add-on bij afwijkende bevindingen op beeldvormend onderzoek (meestal CT).
Controle: Onderzoeken zijn onderling vergeleken, direct (head-to-head) of indirect of zonder verder vergelijk.
Outcome: Diagnostische uitkomsten: sensitiviteit, specificiteit, voorspellende waarden voor curatieve resectie (volgens NCCN criteria) beoordeeld door histopathologie en/of klinische follow-up en/of chirurgie.
Relevante uitkomstmaten
De werkgroep achtte sensitiviteit, specificiteit en voorspellende waarden voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (Methode)
De werkgroep verwijst naar Veereman (2017) voor gedetailleerde informatie over het zoek- en selectieproces.
Referenties
- Veereman G, Mohammad N.H., Van Leeuwen M, et al. Management of pancreatic cancer Part 2: Diagnosis. Good Clinical Practice (GCP) Brussels: Belgian Health Care Knowledge Centre (KCE). 2017. KCE Reports 286. D/2017/10.273/30.
- Best LM, Rawji V, Pereira, SP, et al. Imaging modalities for characterising focal pancreatic lesions. Cochrane Database Syst Rev. 2017;4:CD010213.
- Cao S, Hu Y, Gao X, et al. Y. Serum Carbohydrate Antigen 19-9 in Differential Diagnosis of Benign and Malignant Pancreatic Cystic Neoplasms: A Meta-Analysis. PLoS ONE. 2016;11(11):e0166406.
- Aljebreen AM, Romagnuolo J, Perini R, et al. Utility of endoscopic ultrasound, cytology and fluid carcinoembryonic antigen and CA 19-9 levels in pancreatic cystic lesions. World Journal of Gastroenterology. 2007;13(29):3962-6.
- Goh BK, Tan YM, Thng CH, et al. How useful are clinical, biochemical, and cross-sectional imaging features in predicting potentially malignant or malignant cystic lesions of the pancreas? Results from a single institution experience with 220 surgically treated patients. Journal of the American College of Surgeons. 2008;206(1):17-27.
- Ni XG, Bai XF, Mao YL, et al. The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. European Journal of Surgical Oncology. 2005;31(2):164-9.
- Tamburrino D, Riviere D, Yaghoobi M, et al. Diagnostic accuracy of different imaging modalities following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer. Cochrane Database Syst Rev. 2016;9:Cd011515.
- Gurusamy K and Davidson B. Imaging modalities for characterising focal pancreatic lesions. Cochrane Database of Systematic Reviews. 2012(11).
- Allen VB, Gurusamy KS, Takwoingi Y, et al. Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer. Cochrane Database Syst Rev. 2016;7:Cd009323.
- Brook OR, Brook A, Vollmer CM, et al. Structured reporting of multiphasic CT for pancreatic cacer: potential effect on staging and surgical planning. Radiology. 2015;274(2):464-72.
- Marcal LP, Fox PS, Evans DB, et al. Analysis of free-form dications for completeness and clarity for pancreatic cancer staging. Abdom Imaging. 2015;40(7):2391-7.
Evidence tabellen
De werkgroep verwijst naar Veereman (2017) voor gedetailleerde evidence-tabellen.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-04-2019
Beoordeeld op geldigheid : 03-06-2019
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Op modulair niveau moet in 2019 gekeken worden of de module ‘Screening' herzien moet worden naar aanleiding van het uitkomen van de update van de internationale consensus guideline over pancreassurveillance (Canto 2013). De module ‘Neoadjuvante behandeling van (borderline) resectabel pancreascarcinoom’ moet worden beoordeeld zodra de resultaten van de PREOPANC-1 studie zijn gepubliceerd. De module ‘Adjuvante therapie’ moet worden beoordeeld zodra de lange termijn data van lopend onderzoek (gemcitabine capecitabine, MFOLFIRINOX, nab-paclitaxel/gem) zijn gepubliceerd.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Eerstvolgende beoordeling actualiteit richtlijn |
|
Screening |
2020 |
|
Diagnostische strategie |
2024 |
|
Screening en diagnostiek voedingstoestand |
2024 |
|
Indicatie resectie |
2024 |
|
Voeding in het peri-operatieve beleid |
2024 |
|
Peri-operatief gebruik Somatostatine (analogen) |
2024 |
|
Uitgebreidheid resectie |
2024 |
|
Follow-up na resectie |
2024 |
|
Pancreasenzymen, vitaminen, omega-3 vetzuren en kurkuma |
2024 |
|
Pathologie |
2024 |
|
Neoadjuvante behandeling van (borderline) resectabel pancreascarcinoom |
2021 of na publicatie PREOPANC-1 studie |
|
Adjuvante therapie |
2021 of na publicatie van lange termijn data van lopend onderzoek (gemcitabine capecitabine, MFOLFIRINOX, nab-paclitaxel/gem) |
|
Behandeling van lokaal gevorderd pancreascarcinoom |
2024 |
|
Behandeling voor patiënten met gemetastaseerd pancreascarcinoom |
2024 |
|
Preoperatief en palliatief stenten |
2024 |
|
Behandelvoorkeur bij pijnbestrijding voor lokaal uitgebreid pancreascarcinoom |
2024 |
|
Voeding in de palliatieve fase |
2024 |
|
Psychosociale zorg |
2024 |
|
Voorlichting en communicatie |
2024 |
|
Organisatie van zorg |
2024 |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om het beleid bij patiënten te standaardiseren en af te stemmen op de wensen van deze patiënten in alle fasen van hun ziekte en aanbevelingen zo te formuleren dat zij implementeerbaar zijn.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met pancreascarcinoom, zoals chirurgen, radiotherapeuten, medisch oncologen, maag-darm-leverartsen, radiologen, nucleair-geneeskundigen, pathologen, huisartsen, oncologieverpleegkundigen, IKNL-consulenten, maatschappelijk werkers, diëtisten en psychologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een pancreascarcinoom.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- prof. dr. O.R.C. (Olivier) Busch, HPB chirurg, Amsterdam UMC locatie AMC, Amsterdam (voorzitter)
- C.J.M. (Charlotte) van den Bosch MSc, diëtist chirurgie-oncologie, Amsterdam UMC locatie VUmc (vanaf 1/5/2018)
- dr. L.A.A. (Lodewijk) Brosens, patholoog, UMC Utrecht, Utrecht en RadboudUMC, Nijmegen
- prof. dr. M.J. (Marco) Bruno, afdelingshoofd MDL, Erasmus MC, Rotterdam
- L.J.P.M. (Lieke) Corpelijn, verpleegkundig specialist, Maastricht UMC, Maastricht
- prof. dr. P. (Paul) Fockens, hoofd afdeling MDL, Amsterdam UMC, Amsterdam
- dr. B. (Bas) Groot Koerkamp, HPB chirurg en epidemioloog, Erasmus MC, Rotterdam
- drs. E.J.R.J. (Erik) van der Hoeven, abdominaal radioloog, St. Antonius Ziekenhuis, Nieuwegein
- dr. C. (Casper) Jansen, klinisch patholoog, LabPON, Hengelo
- de heer L. (Leo) Kwakkenbos, ervaringsdeskundige
- M. (Marjan) Mullers MSc, diëtist chirurgie-oncologie, Maastricht UMC, Maastricht
- dr. J.J. (Joost) Nuyttens, radiotherapeut, Erasmus MC, Rotterdam
- drs. T.P. (Thomas) Potjer, klinisch geneticus, LUMC, Leiden
- dr. M.W.J. (Martijn) Stommel, HPB chirurg, Radboudumc, Nijmegen
- drs. G. (Geertjan) van Tienhoven, radiotherapeut oncoloog, Amsterdam UMC locatie AMC, Amsterdam
- drs. J. (Judith) de Vos – Geelen, medisch oncoloog, Maastricht UMC, Maastricht
- dr. J.W. (Hanneke) Wilmink, internist-oncoloog, Amsterdam UMC locatie AMC, Amsterdam
- J.E. (Jill) Witvliet-van Nierop MSc, diëtist chirurgie-oncologie, Amsterdam UMC locatie VUmc (tot 1/5/2018)
Met ondersteuning van
- Dr. J.S. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Michiel) Oerbekke MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.A. (Annefloor) van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- J. (Jill) Heij, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
prof. dr. O.R.C. (Olivier) Busch |
HPB chirurg |
Geen andere betaalde functies |
Voorzitter Dutch Pancreatic Cancer Group (DPCG)
Voorzitter Dutch Pancreatic Cancer Audit (DPCA bij DICA)
Lid toetsingscommissie dataverificatie DPCA
Coördinator bij PancreasParel, biobanking bij Parelsnoer Instituut |
Geen acties ondernomen |
|
dr. B. (Bas) Groot Koerkamp |
HPB chirurg Epidemioloog |
Bestuurslid Wetenschappelijke vereniging van de DPCG (Ducth Pancreas Cancer Group), onbetaald |
Subsidie van ZonMW (300.000 Euro) voor fase 3 trial naar neoadjuvante FOLFIRINOX versus direct opereren en adjuvante chemotherapie voor patiënten met (borderline) resectabel pancreascarcinoom.
Subsidie van KWF (600.000 Euro) voor fase 3 trial naar intra-arteriele chemotherapie met een pomp voor patiënten resectabele colorectale levermetastase. |
Geen acties ondernomen |
|
dr. M.W.J. (Martijn) Stommel |
HPB chirurg |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
dr. J.W. (Hanneke) Wilmink |
Internist-oncoloog |
Geen nevenfuncties |
Bestuurslid van de Dutch Pancreatic Cancer Group (DPCG)
Heeft extern gefinancierd onderzoek, maar de financier daarvan heeft geen belang bij resultaat van het onderzoek |
Geen acties ondernomen |
|
drs. J. (Judith) de Vos – Geelen |
Medisch oncoloog |
Lid van de wetenschappelijke commissie DPCG |
Lid adviescommissie Celgene, Baxalta en Ipsen. Geen directe financiële belangen in een farmaceutisch bedrijf. |
Geen acties ondernomen |
|
dr. L.A.A. (Lodewijk) Brosens |
Patholoog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
dr. C. (Casper) Jansen |
Klinisch patholoog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
drs. E.J.R.J. (Erik) van der Hoeven |
Abdominaal radioloog |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
prof. dr. P. (Paul) Fockens |
Hoofd afdeling MDL |
Geen nevenfuncties |
Consultancy op onregelmatige basis voor biomedische bedrijven. In de afgelopen 2 jaar voor Boston Scientific, Cook, Fujifilm, Medtronic en Olympus.
Geen financiele belangen in biomedische bedrijven
Externe financiering van wetenschappelijk onderzoek naar complicaties van pancreatitis door Bosont Scientific |
Geen acties ondernomen |
|
prof. dr. M.J. (Marco) Bruno |
MDL-arts |
- Lecturer en consultant Boston Scientific - Lecturer en consultant Cook Medical - Lecturer 3M - Lecturer Pentax Medical - Consultant Mylan
|
Lid van de Wetenschappelijke Advies Raad (WAR), commissie Care & Cure, Zorginstituut Nederland
Committee member Scientific Committee of United European Gastroenterology (UEG)
ZonMw NutsOhra financiering voor studie naar effect ERCP en papillotomie voorspelt ernstige pancreatitis
Financiering Cook Medical voor investigator initiated studie naar optimalisatie van EUS geleide weefselbiopten (oa pancreaskanker) en training en kwaliteit van ERCP
Financiering Boston Scientific voor investigator initiated studie naar nut en effect van pancreatoscopische behandeling van pacreasstenen bij chronische pancreatitits
Deelname aan verschillende industry initiated ERCP en/of EUS gerelateerde device/accessoires studies
Studie naar infectie prevalentie ERCP scopen gefinancieerd door ministerie van VWS
Studie aangaande endoscoop reiniging gefinancierd door 3M
Studie aangaande endoscoop reiniging gefinancierd door Pentax Medical |
Geen acties ondernomen |
|
dr. J.J. (Joost) Nuyttens |
Radiotherapeut |
Onbekend |
Geen belangen |
Geen acties ondernomen |
|
drs. G. (Geertjan) van Tienhoven |
Radiotherapeut oncoloog |
Geen nevenfuncties |
Onderzoek gefinancierd door (onafhankelijk) KWF |
Geen acties ondernomen |
|
drs. T.P. (Thomas) Potjer |
Klinisch geneticus i.o. |
PhD student erfelijk pancreascarcinoom / melanoom (betaald) |
Geen belangen |
Geen acties ondernomen |
|
L.J.P.M. (Lieke) Corpelijn |
Verpleegkundig Specialist HPB-Chirurgie |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
M. (Marjan) Mullers MSc |
Diëtist |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
J.E. (Jill) Witvliet-van Nierop MSc |
Diëtist |
Geen nevenfuncties |
Heeft voedingsonderzoek uitgevoerd rondom IRE van pancreascarcinoom (PAN-NUTRIENT studie), gefinancierd door Nationaal Fonds tegen Kanker. De financierder heeft geen belangen bij de resultaten. |
Geen acties ondernomen |
|
C.J.M. (Charlotte) van den Bosch MSc |
Diëtist |
Geen nevenfuncties |
Geen belangen |
Geen acties ondernomen |
|
L. (Leo) Kwakkenbos |
Ervaringsdeskundige |
Voorzitter WijkNogLeuker
PACO-lid KWF
Lid Voorzittersoverleg Adviesraad KWF
Bestuurslid DPCG (betaald)
Bestuurslid (voorzitter) Living With Hope (Landelijk Patiënten Platform Alvleesklier kanker) (tot januari 2019)
Overige functies zijn onbetaald |
Geen belangen |
Geen acties ondernomen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van patiëntvertegewoordigers aan de invitational conference (zie verslag invitational conference bij de aanverwante producten) en deelname van dhr. Leo Kwakkenbos (ervaringsdeskundige) in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Living With Hope Foundation.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Pancreascarcinoom (IKNL 2011) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van:
- Klinische relevantie.
- De beschikbaarheid van (nieuwe) evidence van hoge kwaliteit.
- De te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Gebruik van beschikbare evidence Belgische richtlijn Pancreascarcinoom
Het Federaal Kenniscentrum voor de Gezondheidszorg (KCE) en het College voor Oncologie publiceerden in 2017 een selectieve update van hun klinische richtlijn uit 2009 over de diagnose en behandeling van pancreascarcinoom. Het KCE concentreerde zich op drie vragen:
- Wat is de waarde van de volgende onderzoeken bij de diagnose van pancreascarcinoom: ultrasonografie (US), computertomografie (CT), beeldvorming door magnetische resonantie (MRI), endoscopische ultrasonografie (EUS) + fijnenaaldaspiratie (FNA) van de primaire tumor, positronemissietomografiescan (PET-scan), endoscopische retrograde cholangiopancreatografie (ERCP), dosering van tumormarkers en analyse van cystevocht?
- Gaat toediening van een neoadjuvante behandeling met chemotherapie, radiotherapie of beide gepaard met een betere overleving, reseceerbaarheid en kwaliteit van leven (QoL) en met minder complicaties: a) bij patiënten met een reseceerbaar pancreascarcinoom? b) bij patiënten met lokaal invasieve borderlin e reseceerbaar pancreascarcinoom?
- Wat is de optimale behandelingsstrategie bij patiënten met recidief pancreascarcinoom?
De Nederlandse werkgroep beoordeelde de kwaliteit van:
- de strategie voor zoeken en selecteren van literatuur;
- het beoordelen van de methodologische kwaliteit van de studies en
- de literatuursamenvattingen
als hoog en heeft er daarom voor gekozen om de literatuursamenvattingen van KCE te gebruiken (na instemming van KCE) bij het formuleren van overwegingen en aanbevelingen voor de modules Diagnostiek, Neoadjuvante behandeling en Behandeling gemetastaseerd pancreascarcinoom. De literatuursamenvattingen, -resultaten, -beoordelingen en -conclusies van de eerder genoemde modules werden door het KCE in het Engels opgesteld en werden niet vertaald voor het gebruik in de huidige richtlijn. Tevens koos de werkgroep ervoor om de literatuurbeschrijvingen en -resultaten (inclusief evidence tabellen) voor enkele modules in het Engels op te stellen om deze eventueel internationaal te kunnen uitwisselen.
Strategie voor zoeken en selecteren van literatuur
De literatuurspecialist zocht aan de hand van specifieke zoektermen naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DPCA indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. (2010) AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ, 182(18):E839-42. doi: 10.1503/cmaj.090449. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Schünemann HJ, Oxman AD, Brozek J, et al. (2008) Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ, 336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ, 336(7654). doi: 10.1136/bmj.a139. Schünemann, Holger J. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. (2016) How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc, 104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
