Intraveneuze medicatie bij delier
Uitgangsvraag
Wat is de waarde van intraveneuze medicatie bij een delier bij Intensive care (IC)-patiënten?
Aanbeveling
Overweeg toepassing van medicamenteuze behandeling enkel bij een delier met onvoldoende effect van niet-medicamenteuze interventies en wanneer sprake is van ernstige symptomen zoals bij lijdenslast van de patiënt (agitatie, angst, hallucinaties, wanen, etc.), gevaar voor de patiënt en/of omgeving, of wanneer het delier de behandeling op de IC sterk belemmert. Wanneer wordt gekozen voor medicatie ligt de voorkeur bij haloperidol (iv of oraal), quetiapine (oraal) of dexmedetomidine (iv).
Gebruik geen rivastigmine ter behandeling van een delier op de intensive care.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
a). Intraveneuze medicatie
Uit de literatuur tot 2021 blijkt dat intraveneuze toediening van klassieke antipsychotica (haloperidol) geen klinisch relevant positief effect laat zien op de duur van delier op de IC. De bewijskracht voor dit gevonden effect was respectievelijk hoog en gemiddeld. Daarbovenop geeft haloperidol wel een groter risico op bijwerkingen/adverse events (inclusief aritmie, extrapiramidale bijwerkingen en QTc-verlenging). Aanvullend hierop, zijn recent 2 artikelen gepubliceerd welke beiden gebaseerd zijn op het Europese AID-ICU onderzoek (Andersen-Ranberg, 2022; Andersen-Ranberg, 2023), welke mogelijk een ander resultaat tonen. In dit placebo-gecontroleerde onderzoek met 1000 IC patiënten met een delier is gekeken naar het effect van haloperidol op het aantal dagen overleving of ontslag uit het ziekenhuis 90 dagen na randomisatie. In de AID-ICU trial had 45% van de patiënten een hyperactief delier, daarnaast hadden maar weinig patiënten vooraf een onderliggende cognitieve stoornis. Hoewel het eerste artikel geen klinisch relevant voordeel van haloperidol laat zien op de primaire uitkomstmaat (overleving en ontslag uit het ziekenhuis na 90 dagen), is de 90 dagen mortaliteit met 43,3% voor de placebogroep en 36,6% voor de haloperidol groep in het voordeel van haloperidol. De vooraf geplande Bayesiaanse analyse van de data (Andersen-Ranberg, 2023) laat een genuanceerder en duidelijker voordeel van haloperidol zien op een aantal vlakken; een hoge posterior kans op een voordeel van haloperidol op mortaliteit (99%), aantal dagen levend zonder delier of coma (98%), aantal dagen in leven zonder beademing (95%) en het percentage patiënten dat rescue medicatie nodig had (91%), terwijl het aantal patiënten dat bijwerkingen ervoer gelijk was (97%). De kracht van dit onderzoek zit in het grote aantal patiënten, welke gerandomiseerd werden in 16 Europese landen, het onderzoek was placebo-gecontroleerd, en geblindeerd en er was weinig loss to follow up. De analyse is zorgvuldig uitgevoerd. Het onderzoek schept echter geen duidelijkheid over welke subgroepen het meest van haloperidol zullen profiteren. Ook zijn in AID-ICU onderzoek geen uitkomsten opgenomen die gekoppeld zijn aan het delier (zoals ernst of duur van het delier), terwijl dit doorgaans wel de reden is om haloperidol toe te passen.
Verder is er ook een recente Nederlandse randomized controlled trial gepubliceerd die onderzoek heeft gedaan naar haloperidol intraveneus (3dd2.5-5mg iv) vs placebo bij IC-patiënten. Deze studie toont geen verschil op de primaire uitkomstmaat, namelijk dagen zonder delier of coma. Dit was ook de reden dat de studie voortijdig is afgebroken. Wel wordt er gezien dat patiënten die haloperidol kregen minder benzodiazepinen kregen dan de patiënten die placebo kregen. Er werden ook trends gezien dat de patiënten die haloperidol kregen minder vaak andere indirecte verschijnselen voor agitatie hadden (minder anti-psychotica gebruik verder, minder verwijderen van hulpmiddelen inclusief verwijderen van de tube), maar deze uitkomsten waren niet significant.
De uitkomsten van deze recente onderzoeken, welke nog niet zijn meegenomen in onze analyse, het feit dat haloperidol een veel toegepast middel is, dat zowel oraal als IV gegeven kan worden en dat laagdrempelig beschikbaar is, maakt dat een voorzichtige toepassing van dit middel wel gelegitimeerd blijft. Ondanks dat bekend is dat hallucinaties, wanen, angst en agitatie veel voorkomt bij delier, is het effect van haloperidol op deze symptomen in geen van de studies onderzocht, terwijl de lijdenslast voor de patiënt evident is.
Intraveneuze toediening van alpha-2 agonist dexmedetomidine bleek de delierduur wel te verminderen (bewijskracht laag). Het nadeel van laagdrempelig starten met dexmedetomidine is naast de nog onduidelijke effectiviteit ook dat het enkel op de IC kan worden gegeven. Hierdoor kan dit ook de ligduur op de IC verlengen (al werd dit niet gezien in de beperkte beschikbare literatuur) of zou het delier na overplaatsing kunnen verergeren. Ook de belangrijke uitkomstmaten (IC-opnameduur, mortaliteit, medische adverse events en kwaliteit van leven) lieten in de meeste gevallen geen klinisch relevant voor- of nadeel zien van medicatie ter behandeling van delier op de IC. De bewijskracht van deze gevonden effecten was laag tot hoog. Het bewijs voor medische adverse events was zeer laag. De lagere bewijskracht werd veroorzaakt door kleine patiënten aantallen en brede betrouwbaarheidsintervallen die de grenzen van klinische relevantie overschreden. Hiermee kunnen de literatuurconclusies weinig richting geven aan de besluitvorming om wel of geen intraveneuze farmacologische middelen in te zetten bij de behandeling van een delier.
Het is opvallend dat geen verschil werd gezien in medische adverse events bij het gebruik van dexmedetomidine, omdat in de praktijk wel regelmatig bijwerkingen worden gezien, met name in de hemodynamiek (bradycardie en hypotensie). Bovendien is in 2021 uit het SPICE III onderzoek (post-hoc analyse met Bayesiaanse statistische analyses) gebleken dat er een grotere kans (98,5%) op een verhoogd risico op 90-dagen sterfte (odds ratio 1,26 [95% betrouwbaarheidsinterval 1,02-1,56]) was bij patiënten van ≤65 jaar en in de groep van >65 jaar juist een grotere kans (97,7%) op een gunstig effect op 90-dagen sterfte (odds ratio 0,83 [betrouwbaarheidsinterval 0,68-1]). Derhalve adviseert de werkgroep voorzichtigheid te betrachten bij het gebruik van hoge dosering dexmedetomidine (>1 mcg/kg/u) voor symptomatische behandeling van delier bij ernstig zieke IC-patiënten onder 65 jaar.
* In juni 2022 verscheen een Direct Healthcare Professional Communication (DHPC) vanuit het College ter Beoordeling van Geneesmiddelen (CBG) over het gebruik van dexmedetomidine bij IC-patiënten. De werkgroep heeft de waarschuwing besproken en de resultaten van de studies, waarop de waarschuwing is gebaseerd, gewogen. Zowel de subgroep analyse van de SPICE III-studie (Shehabi, 2021) waarop deze waarschuwing verscheen, als de originele SPICE III studie (Shehabi, 2019) werden niet beschreven in de geïncludeerde reviews die zijn opgenomen in de literatuuranalyse van de richtlijn. Bovendien kreeg de controlegroep in de originele SPICE III studie standaardzorg (midazolam of propofol) toegediend, waarbij geen onderscheid werd gemaakt in de analyse tussen midazolam (PICO2) en propofol (PICO3) in beide publicaties. De werkgroep is van mening dat (conform het standpunt van de NVIC) de in het studieprotocol beschreven behandelwijze in dusdanige mate afwijkt van de dagelijkse Nederlandse praktijk en dat de uitkomsten van de subgroep analyse geen invloed heeft op de door de werkgroep vastgestelde aanbevelingen. Het verschil met de Nederlandse praktijkvoering wordt gezien in hoge dosering, RASS-niveau (in studie gebruikt voor diepe sedatie), moment in behandeling (in studie als primair sedativum binnen 12 uur, in Nederland voornamelijk als add-on en/of later in de behandeling). Daarnaast is er geen verklaring gevonden voor de reden van overlijden en zijn er geen verschillen gevonden in adverse events. Hierdoor betwijfelt de werkgroep of hier sprake is van een causale relatie tussen dexmedetomidine en mortaliteit. De werkgroep adviseert de voorschrijver van dexmedetomidine kennis te laten nemen van de waarschuwing en bovengenoemde nuancering. Derhalve adviseren we voorzichtigheid te betrachten bij het gebruik van hoge dosering dexmedetomidine (>1 mcg/kg/u) voor symptomatische behandeling van delier bij ernstig zieke IC-patiënten onder 65 jaar.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Zowel bekend uit de literatuur, als uit het vragenlijstonderzoek wat onder voormalig IC-patiënten en hun naasten is gehouden voor deze richtlijn, is het krijgen van een delier ernstig belastend. Het gebruik van medicatie in de behandeling voor een delier wordt door patiënten en hun naasten als wisselend ervaren. Dit maakt een algemeen voorkeur voor een patiënt niet goed te benoemen. Er zijn patiënten en naasten die het gebruik van medicatie als heel helpend ervaren, maar ook mensen die het idee hebben dat de medicatie averechts werkt. Hierom is het met name van belang om samen met patiënt en naasten het effect en de eventuele bijwerkingen van de medicatie te bespreken en te evalueren en voorkeuren mee te wegen. De mate waarin de patiënt mee kan denken in de medicamenteuze behandeling is uiteraard afhankelijk van de wilsbekwaamheid ten tijde van een delier, maar niet altijd onmogelijk.
Kosten (middelenbeslag)
De kosten van de orale medicatie zijn laag. Bij orale medicatie spelen kosten daarom geen belangrijke rol.
Dexmedetomidine 4 flacons a 400mg, kost rond de 160 euro (zonder kortingsregeling). Voor 5 flacons a 200mg bedragen de kosten ongeveer 100 euro (zonder kortingsregeling). Haloperidol kost voor 5 flacons à 5 mg ongeveer 6 euro.
Aanvaardbaarheid, haalbaarheid en implementatie
Ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie worden geen barrières verwacht van de verschillende (orale en intraveneuze) medicamenteuze opties.
Onderbouwing
Conclusies / Summary of Findings
I. Classical antipsychotics
1. Delirium duration (critical)
|
High GRADE |
Classical antipsychotics (haloperidol) result in little to no difference in delirium duration when compared with placebo in ICU patients.
Sources: Al Quadheeb, 2016; Girard, 2018; Page, 2013. |
2. Length of ICU stay (important)
|
High GRADE |
Classical antipsychotics (haloperidol) result in little to no difference in length of ICU stay when compared with placebo in ICU patients.
Sources: Al Quadheeb, 2016; Girard, 2018; Page, 2013. |
3. Mortality (important)
|
Moderate GRADE |
Classical antipsychotics (haloperidol) likely result in little to no difference in mortality when compared with placebo in ICU patients.
Sources: Al Quadheeb, 2016; Girard, 2018; Page, 2013. |
4. Self-removed catheters (important)
|
Low GRADE |
Classical antipsychotics (haloperidol) may result in little to no difference in self-removed catheters when compared with placebo in ICU patients.
Sources: Page, 2013. |
5. Medical adverse events (important)
|
Moderate GRADE |
Classical antipsychotics (haloperidol) likely result in little to no difference in medical adverse events when compared with placebo in ICU patients.
Sources: Al-Qadheeb, 2016; Girard, 2018; Page, 2013. |
6. Quality of life (important)
|
No GRADE |
No evidence was found regarding the effect of classical antipsychotics on quality of life when compared with no medical intervention, placebo or usual care in ICU patients.
Sources: - |
II. Alpha-2 agonists
1. Delirium duration (critical)
|
Low GRADE |
Alpha-2 agonists (dexmedetomidine) may result in little to no difference in delirium duration when compared with placebo in ICU patients.
Sources: Reade, 2016 |
3. Length of ICU stay (important)
|
Very low GRADE |
The evidence is very uncertain about the effects of alpha-2 agonists (dexmedetomidine) on length of ICU stay when compared with placebo or usual care (haloperidol) in ICU patients.
Sources: Reade, 2009; Reade, 2016 |
4. Mortality (important);
|
Low GRADE |
Alpha-2 agonists (dexmedetomidine) may result in little to no difference in mortality when compared with usual care (haloperidol) in ICU patients.
Sources: Reade, 2009. |
5. Self-removed catheters (important);
|
No GRADE |
No evidence was found regarding the effect of alpha-2 agonists on self-removed catheters when compared with no intervention, placebo or usual care in ICU patients
Sources: - |
6. Medical adverse events (important);
|
Very low GRADE |
The evidence is very uncertain about the effects of alpha-2 agonists (dexmedetomidine) on medical adverse events when compared with usual care (haloperidol) in ICU patients.
Sources: Reade, 2009; Bakri, 2015. |
7. Quality of life (important)
|
No GRADE |
No evidence was found regarding the effect of alpha-2 agonists on quality of life when compared with no intervention, placebo or usual care in ICU patients.
Sources: - |
Samenvatting literatuur
Description of studies
Systematic review
Burry (2019) described a systematic review and meta-analysis assessing the effects of pharmacological interventions for the treatment of delirium in critically ill adults. The databases Ovid MEDLINE, OVID MEDLINE IN-Process & Other Non-Indexed Citations, Embase Classic+Embase and PsycINfo were searched up to March 21, 2019. Studies were included if 1) they were RCTs of pharmacological treatment of delirium treatment in critically ill adults; 2) a drug intervention was comped to another drug, placebo or non-pharmacological intervention. In total, 14 RCTs were included in the review, representing 1844 patients. In order the answer the clinical question of this module, only six RCTs were eligible (see the table with reasons for exclusion under the tab Methods) from which four applied intravenous drug treatment. The methodological quality was evaluated by the GRADE approach (https://gradepro.org/). The effects on the duration of delirium, duration if ICU stay, mortality, medical adverse events (arrhythmias) were evaluated. Individual study descriptives, sorted by category of the intervention, are shown in table 1.
Table 1: Study descriptives sorted by category of the intervention.
|
Study |
Design |
Population |
Intervention |
Control |
Outcome |
|
Classical antipsychotics |
|||||
|
Al- Qadheeb, 2016 |
RCT (3 ICU’s) |
Critically ill patients diagnosed with subsyndromal delirium (ICDSC score 1 to 3) (n=68). |
1 mg intravenous haloperidol every 6 hours until the occurrence of delirium (ICDSC score >4), a maximum of 10 days of treatment, discharge from the ICU, or an adverse effect necessitating study drug discontinuation. |
1 mg intravenous placebo every 6 hours until the occurrence of delirium (ICDSC score >4), a maximum of 10 days of treatment, discharge from the ICU, or an adverse effect necessitating study drug discontinuation. |
Delirium incidence Length of ICU stay Mortality Medical adverse events |
|
Girard, 2018 |
RCT (16 ICU’s) |
Adult (> 18 years) medical/surgical ICU participants on mechanical or non-invasive positive-pressure ventilation and/or requiring vasopressors due to shock, or an intra-aortic balloon pump, and diagnosed with delirium by CAM-ICU (n= 566). |
Haloperidol (up to 10 mg every 12 hours, administered by intravenous bolus over up to 5 minutes at concentrations of 5 mg/mL). Participants were treated until delirium had resolved for 48 hours, or when 14 days of treatment had elapsed, whichever occurred first. |
Placebo (up to 10 mg every 12 hours, administered by intravenous bolus over up to 5 minutes). Participants were treated until delirium had resolved for 48 hours, or when 14 days of treatment had elapsed, whichever occurred first. |
Delirium duration Mortality Length of ICU stay
|
|
Page, 2013 |
RCT (single) |
Critically ill patients requiring mechanical ventilation within 72 hours of ICU admission (n=141). |
Haloperidol 2.5 mg, intravenously, every 8 hours. |
Placebo: An equal volume of 0.9% saline, intravenously, every 8 hours. |
Length of ICU stay Mortality Self-removed catheters Medical adverse events
|
|
Alpha-2 Agonists |
|||||
|
Reade, 2009 |
RCT (sinle) |
Patients who they considered required mechanical ventilation only because their degree of agitation required such a high dose of sedative medication that extubation was not possible (n=20) |
Dexmedetomidine was administered intravenously as a maintenance infusion of 0.2 to 0.7 μg/kg/hour for as long as deemed necessary by the treating physician. The clinician was given the option of using a loading dose of 1.0 μg/kg intravenously over 20 minutes, as recommended by the manufacturer. |
Usual care: Haloperidol was administered as a continuous intravenous infusion of 0.5 to 2 mg/hour for as long as necessary, preceded by a loading dose of 2.5 mg if desired. |
Length of ICU stay Mortality (ICU) Medical adverse events
|
|
Reade, 2016 |
RCT (15 ICU’s) |
Patients who required continued mechanical ventilation because their level of agitation was so severe that reducing sedation or extubation was deemed unsafe (n=71). |
Intravenous dexmedetomidine started at a dose of 0.5 μg/kg/h (option of 1.0 dg/kg bolus over 20 minutes). Study drug was titrated by the bedside nurse between 0 and 1.5 dg/kg/h to achieve RASS score of 0 or to physician-prescribed target. |
Placebo (saline), started at a dose of 0.5 dg/kg/h (option of 1.0 dg/kg bolus over 20 minutes). Study drug was titrated by the bedside nurse between 0 and 1.5 dg/kg/h to achieve RASS score of 0 or to physician-prescribed target. |
Length of ICU stay |
|
Bakri, 2015 |
RCT (single) |
Adult postoperative trauma patients who screened delirium-positive, by using Intensive Care Delirium Screening Checklist (ICDSC) were candidate for inclusion in this study (n=64) |
1 μg/kg dexmedetomidine administered as a continuous intravenous infusion over 20 min. Study medications were started after diagnosis of delirium and were given twice daily for 3 consecutive days (6 doses). |
Usual care: 5 mg haloperidol administered as a continuous intravenous infusion over 20 min. Study medications were started after diagnosis of delirium and were given twice daily for 3 consecutive days (6 doses). |
Medical adverse events |
|
Abbreviations: RCT, randomized controlled trial; ICU’s, intensive care units; RASS, Richmond Agitation-Sedation Scale; ICDSC, Intensive Care Delirium Screening Checklist. |
|||||
Results
A total of three studies reported on the use of classical antipsychotics (haloperidol) and three on alpha-2 agonists (dexmedetomidine)). The results are reported per pharmacological group.
- Classical antipsychotics
1. Delirium duration (critical)
The effect of classical antipsychotics (haloperidol) on delirium duration was assessed by three studies, comprising 537 patients. Pooled data resulted in a mean difference (MD) of
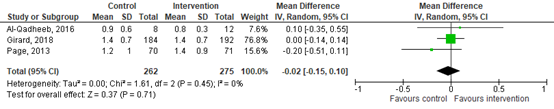
-0.02 days (95% Confidence Interval (CI) -0.15 to 0.10) favoring usual care. This difference was not considered clinically relevant. Results are shown in figure 4.
Figure 4. Forest plot showing the effect of classical antipsychotics compared usual care on delirium duration in ICU patients.
2. Length of ICU stay (important)
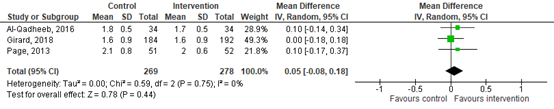
The effect of classical antipsychotics (haloperidol) on length of ICU stay was assessed by three studies, comprising 547 patients. Pooled data resulted in a MD of 0.05 days (95% CI of -0.08 to 0.18) favoring classical antipsychotics. This difference was not considered clinically relevant. Results are shown in figure 5.
Figure 5. Forest plot showing the effect of classical antipsychotics compared usual care on length of ICU stay in ICU patients.
3. Mortality (important)
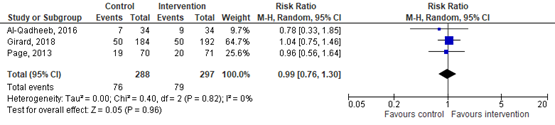
The effect of classical antipsychotics (haloperidol) on mortality was assessed by four studies, comprising 585 patients. Pooled data resulted in a risk ratio (RR) of 0.99 [95% CI 0.76 to 1.30) favoring placebo. This difference was not considered clinically relevant. Results are shown in figure 6.
Figure 6. Forest plot showing the effect of classical antipsychotics compared usual care on mortality in ICU patients.
4. Self-removed catheters (important)
The effect of classical antipsychotics (haloperidol) on self-removed catheters was assessed by one study (Page, 2013), comprising 141 patients. Data resulted in an incidence of 1/71 (1,4%) and 2/70 (2,9%) in the intervention group and control group respectively. This difference was not considered clinically relevant.
5. Medical adverse events (important)
The effect of classical antipsychotics (haloperidol) on medical adverse events was assessed by three studies, comprising 586 patients.
- Al-Qadheeb (2016) showed an incidence of 1/34 (2.9%) in the intervention group and 1/24 (2.9%) in the control group, including hypotension.
- Girard (2018) showed an incidence of 2/192 (1.0%) in the intervention group and 0/184 (0%) in the control group, including arrhythmias, extrapyramidal symptoms and QTC prolongation.
- Page (2013) showed an incidence of 13/72 (18.1%) in the intervention group and 5/70 (7.1%) in the control group, including arrhythmias, extrapyramidal symptoms, unintentional device removal and QTc prologation; which is the only study showing a clinically relevant effect in favour of the control group.
Due to low number of events, data was not pooled in a forest plot.
6. Quality of life (important)
None of the included studies assessed the effect of classical antipsychotics on quality of life.
- Alpha-2 agonists
1. Delirium duration (critical)
The effect of alpha-2 agonists (dexmedetomidine) on delirium duration was assessed by one study (Reade, 2016), comprising 71 patients. Data resulted in a mean delirium duration of 0.3 (SD 0.7) and 0.9 (SD 0.6) days in the intervention and in the control group respectively. This difference was not considered clinically relevant in favour of the intervention group.
2. Length of ICU stay (important)
The effect of alpha-2 agonists (dexmedetomidine) on length of ICU stay was assessed by two studies (Reade, 2009; Reade, 2016), comprising 91 patients.
- Reade, 2009: Data resulted in a median duration of 4.5 days (IQR 2 to 7) in the intervention (dexmedetomidine) group and 8.0 days (IQR 7 to 11) in the control group (haloperidol). This difference was considered clinically relevant in favor of dexmedetomidine.
- Reade, 2016: Data resulted in a mean duration of 1.7 days (SD 0.7) and 1.9 days (SD 0.6) in the intervention (dexmedetomidine) and in the control (placebo) group respectively. This difference was not considered clinically relevant.
3. Mortality (important);
The effect of alpha-2 agonists (dexmedetomidine) on mortality was assessed by one study (Reade, 2009), comprising 20 patients. Data resulted in a similar hospital mortality rate of 0/10 in the intervention group (dexmedetomidine) and control group (haloperidol) respectively.
4. Self-removed catheters (important)
None of the included studies assessed the effect of alpha-2 agonists on self-removed catheters.
5. Medical adverse events (important);
The effect of alpha-2 agonists (dexmedetomidine) on medical adverse events was assessed by two study (Reade, 2009; Bakri, 2015), comprising 84 patients.
- Reade, 2009: Data showed an adverse event rate of 0/10 (0%) in the intervention group (dexmedetomidine) versus 10/10 (100%) in the control group (haloperidol), including excessive prolongation of QTc interval/necessitating drug discontinuation. This difference was considered clinically relevant.
- Bakri, 2015: Data showed a similar adverse event rate of 0/32 (0%) in both groups (not clinically relevant).
6. Quality of life (important)
None of the included studies assessed the effect of alpha-2 agonists on quality of life.
Level of evidence in the literature
For all outcome measures, the level of evidence started at high because they were based on randomized controlled trials.
I. Classical antipsychotics
- Delirium duration (critical): The level of evidence was not downgraded. The final level was high.
- Length of ICU stay (important): The level of evidence was not downgraded. The final level was high.
- Self-removed catheters (important): The level of evidence was downgraded due to low number of events (-2, imprecision). The final level is low.
- Mortality (important): The level of evidence was downgraded by one level due to crossing the border of clinical relevance (-1, imprecision). The final level is moderate.
- Medical adverse events (important): The level of evidence was downgraded by one level due to low number of events (-1, imprecision). The final level is moderate.
- Quality of life (important): The level of evidence was not graded due to lack of data.
II. Alpha-2 agonists
- Delirium duration (critical): The level of evidence was downgraded due to not reaching optimal information size (-2, imprecision). The final level is low.
- Length of ICU stay (important): The level of evidence was downgraded due to not reaching optimal information size (-2, imprecision) and conflicting results (-1, inconsistency). The final level is very low.
- Mortality (important): The level of evidence was downgraded due to not reaching optimal information size (-2, imprecision). The final level is low. Self-removed catheters (important): The level of evidence was not graded due to lack of data.
- Medical adverse events (important): The level of evidence was downgraded due to not reaching optimal information size (-2, imprecision) and conflicting results (-1, inconsistency). The final level is very low. Quality of life (important): The level of evidence was not graded due to lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of intravenous pharmacological agents for treating delirium in ICU patients?
| P: | adult ICU patients with delirium |
| I: |
intravenous pharmacological agents: Classical antipsychotics: haloperidol Alpha-2 agonists: dexmedetomidine, clonidine |
| C: | no pharmaceutical intervention, placebo, usual care |
| O: |
delirium duration, length of ICU stay, mortality, self-removed catheters, medical adverse events, quality of life.
|
Relevant outcome measures
The guideline development group considered delirium duration as a critical outcome measure for decision making; and length of ICU stay, mortality, self-removed catheters, medical adverse events and quality of life as important outcome measures for decision making.
A priori, the working group defined the outcome measures listed above and their clinically (patient) important difference as in table 1.
Table 1. Definitions and clinically important differences for the identified outcome measures.
|
Outcome measure |
Definition |
Clinically important difference |
|
Delirium duration |
Number of days |
Difference of 1 day. |
|
Length of ICU stay |
Number of days until discharge from ICU |
Difference of 1 day. |
|
Mortality |
Number of patients who died during follow-up |
A difference of 3% between groups. |
|
Self-removed catheters |
Number of self-removed catheters. |
A relative difference of 25% between groups (RR ≤ 0.80 or RR ≥ 1.25). |
|
Medical adverse events |
hypotension, bradycardia, respiratory depression, need for controlled mechanical ventilation, side effects, arrhythmias, pneumonia |
A relative difference of 25% between groups (RR ≤ 0.80 or RR ≥ 1.25). |
|
Quality of life |
Patient satisfaction |
Difference of 10% for continuous outcome measures, 1 point on the Likert scale, or 25% difference for dichotomous outcomes. |
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until June 22nd, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 691 hits. Studies were selected based on the following criteria:
- Describing adult patients at the intensive care unit (ICU) with hypo- or hyperactive delirium;
- Describing pharmacological agents: Alpha-2 agonists (dexmedetomidine, clonidine), , classical antipsychotics (haloperidol);
- Study design: randomized controlled trials (RCTs) or systematic reviews (SRs) of RCTs with a detailed description of included studies, a risk-of-bias judgement; a detailed description of the literature search strategy and included a meta-analysis;
- Articles published in English or Dutch;
- Describing at least one of the following outcome measures: delirium duration, length of ICU stay, mortality, medical adverse events, quality of life;
- At least 20 patients included in the study.
A total of 26 systematic reviews were initially selected based on title and abstract screening. After reading the full text, 25 systematic reviews were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review was included. Additionally, 17 RCTs were selected based on title and abstract screening. After reading the full text, all RCTs were excluded (see the table with reasons for exclusion under the tab Methods).
Results
One systematic review was included in the analysis of the literature, including four RCTs on intravenous drug treatment, assessing the use of haloperidol, ziprasidone and dexmedetomidine. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Andersen-Ranberg, N. C., Poulsen, L. M., Perner, A., Wetterslev, J., Estrup, S., Hästbacka, J., Morgan, M., Citerio, G., Caballero, J., Lange, T., Kjær, M. N., Ebdrup, B. H., Engstrøm, J., Olsen, M. H., Oxenbøll Collet, M., Mortensen, C. B., Weber, S. O., Andreasen, A. S., Bestle, M. H., Uslu, B., … AID-ICU Trial Group (2022). Haloperidol for the Treatment of Delirium in ICU Patients. The New England journal of medicine, 387(26), 2425–2435. https://doi.org/10.1056/NEJMoa2211868
- Andersen-Ranberg, N. C., Poulsen, L. M., Perner, A., Hästbacka, J., Morgan, M., Citerio, G., Collet, M. O., Weber, S. O., Andreasen, A. S., Bestle, M., Uslu, B., Pedersen, H. S., Nielsen, L. G., Damgaard, K., Jensen, T. B., Sommer, T., Dey, N., Mathiesen, O., & Granholm, A. (2023). Haloperidol vs. placebo for the treatment of delirium in ICU patients: a pre-planned, secondary Bayesian analysis of the AID-ICU trial. Intensive care medicine, 49(4), 411–420. https://doi.org/10.1007/s00134-023-07024-9
- Burry, L., Hutton, B., Williamson, D. R., Mehta, S., Adhikari, N. K., Cheng, W., Ely, E. W., Egerod, I., Fergusson, D. A., & Rose, L. (2019). Pharmacological interventions for the treatment of delirium in critically ill adults. The Cochrane database of systematic reviews, 9(9), CD011749. https://doi.org/10.1002/14651858.CD011749.pub2
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 26-06-2024
Laatst geautoriseerd : 26-06-2024
Geplande herbeoordeling : 01-01-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die op de intensive care worden behandeld.
Werkgroep
- dr. T.H. (Thomas) Ottens, intensivist, NVIC
- drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
- dr. K.S. (Koen) Simons, internist-Intensivist, NVIC
- D. (Daphne) Bolman, patiëntvertegenwoordiger, FCIC en IC Connect
- Dr. R. (Roel) van Oorsouw, fysiotherapeut/onderzoeker, KNGF/NVZF
- D.L.J. (David) Moolenaar, internist-intensivist, NIV
- dr. M.C.W. (Meta) van der Woude, anesthesioloog-intensivist, NVA
- dr. R.J. (Robert Jan) Osse, psychiater, NVVP
- Prof.dr. M. (Mark) van den Boogaard, senior verpleegkundig onderzoeker, V&VN IC
- dr. B.E. (Liesbeth) Bosma, ziekenhuisapotheker, NVZA
- drs. N.M.S. (Nienke) Golüke, klinisch geriater, NVKG
Met ondersteuning van:
- dr. M.M.J. (Machteld) van Rooijen, adviseur, Kennisinstituut van Medisch Specialisten
- dr. L.M.P. (Linda) Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- drs. F. (Florien) Ham, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
dr. T.H. (Thomas) Ottens |
Intensivist, Staflid Intensive Care HagaZiekenhuis |
- Lid Geneesmiddelcommissie HagaZiekenhuis - Plaatsvervangend opleider intensive care HagaZiekenhuis - Freelance arts bij evenementen, MAI medische diensten (nieuw 0-uren verband, nog nooit ingezet) - Voormalig lid tijdelijk COVID-19 expert panel, Gilead Sciences Nederland |
Mijn partner is betrokken bij onderzoeksprojecten "Muziek als Medicijn" van het Erasmus MC. Dit project omvat meerdere studies naar muziekinterventies tegen angst, stress, pijn en delirium rondom operaties en ernstige ziekten.
Ik ontvang een bijdrage voor een wetenschappelijk onderzoeksproject "EARLY DELTA trial" van Prolira B.V. Zij leveren onder andere een delirium-monitor "DeltaScan". |
Exclusie betrokkenheid bij een uitgangsvraag over de deltascan. |
|
drs. N.C. (Niels) Gritters van den Oever |
intensivist 1,0 fte Treant Zorggroep medisch manager IC, vakgroephoofd IC, lid stafbestuur (vacatievergoeding) |
- Chief Medical Officer Landelijk Coördinatiecentrum Patiënten Spreiding (vacatievergoeding) - lid commissie Acute Tekorten Geneesmiddelen (ATG en ATG+) deel van Landelijk Coördinatiecentrum Geneesmiddelen (vergadervergoeding) |
Geen. |
Geen actie. |
|
dr. K.S. (Koen) Simons |
internist-intensivist (betaald) Jeroen Bosch Ziekenhuis |
- Lid van diverse commissies in het ziekenhuis (o.a. donatiecommissie als voorzitter, reanimatiecommissie), (onbetaald) - co-promotor promovendus (onbetaald) - FCCS instructeur (betaald) - Lid PSA richtlijn, subrichtlijn Sedatie en Analgesie op de IC (betaald) |
In het verleden tot 2018 contact gehad met Philips research in het kader van onderzoek naar effecten van licht en geluid op de IC; toen gebruik gemaakt van apparatuur en expertise van onderzoekers Philips Geen betaald adviseurschap Geen directe financiële belangen in een bedrijf of aandelen Geen eigenaar van lopend patent of product.
Als lokale P.I./ subinvestigator betrokken bij meerdere sponsor-driven en investigator driven onderzoeken, waaronder 1) REMAP-CAP studie (studie naar effect verschillende soorten behandeling bij community acquired pneumonie. Financiering door overheid); MONITOR-IC studie (studie: studie naar lange termijnuitkomsten van IC patienten; financiering door overheid/ ziekenhuis (radboudumc)); 3) REVIVAL studie (studie naar effect van medicament op nierschade bij IC patienten; financiering door bedrijf) 4) OSCAR studie (studie naar effect van anti-GM-CSF ( Otilimab) op verloop COVID 19 ; financiering door Glaxo Smith Kline). |
Geen actie. |
|
D. (Daphne) Bolman |
Vrijwillig bestuurslid |
Geen. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie. |
|
Dr. R. (Roel) van Oorsouw |
Fysiotherapeut/ onderzoeker Radboudumc |
- Lid KNGF ethiekcommissie - Lid ethiekcommissie Radboudumc |
Geen. |
Geen actie. |
|
D.L.J. (David) Moolenaar |
Internist-intensivist |
Geen. |
Geen. |
Geen actie. |
|
dr. M.C.W. (Meta) van der Woude |
Anesthesioloog-intensivist, medisch specialist patiëntveiligheid - Zuyderland MC 0,4 FTE, betaald" |
- Medisch adviseur Triage voor letselschade incidenteel, betaald - Werkt mee aan een voorlichtingsfilm over delirium en de deltascan, onbetaald",
|
Deelname als Investigator bij extern gefinancierd onderzoek: 1) MONITOR-IC (Studie onder andere onder supervisie via het Radboud. Doel is om patiënten na ontslag langdurig te vervolgen na ontslag IC, zie https://monitor-ic.nl. (financiering ZonMW). Enkel betrokkenheid bij een deel van de studie die de COVID patiënten uit de eerste golf betrof, daarna niet meer); 2) CoDaP studie (Corona Data driven interventions & data Platform binnen de euregio data verzamelen van Covid patiënten en analyseren, gefinancierd door INTERREG en Europese Unie); 3) studie naar de CoLab score, testen van bundel laboratorium parameters waarmee je kunt bepalen of iemand met COVID veilig uit de isolatie gehaald kan worden in het ziekenhuis. Ik ben hierbij patiëntvertegenwoordiger. (financiering ZonMW); 4) NeNesCo studie (mede onderzoeker bij studie naar neurologische outcome na eerste COVID golf. Financiering ZonMw).
Ben gevraagd voor voorlichtingsfilm over delier door firma Prolira. Dit is zonder vergoeding. |
Exclusie betrokkenheid bij een uitgangsvraag over de deltascan. |
|
dr. R.J. (Robert Jan) Osse |
Psychiater, staflid, Erasmus MC, afdeling psychiatrie |
- Raad van toezicht ISTDP-house (psychotherapeutische behandeling en dagbehandeling). - Voorzitter, In sociorum salutem, (medisch genootschap sinds 1840). - Voorzitter werkgroep vrijheidsbeperkende interventies (VBI), Erasmus MC. - Voorzitter Stichting Jos Schaap-Feering (fonds voor onderzoek naar bipolaire stoornissen) - Participatie aan Euridice-trial (onderzoek naar haloperidol op delirium in IC) en aan de MUSIC-Trail (onderzoek naar effecten van Muziek op delirium) - Participatie aan onderzoek door verpleegkundig specialisten (o.a. naar VBI)" |
- Echtgenote is eigenaar van Calandschoen, tevens consultant-adviseur in eigen praktijk en is werkzaam bij Filosofische school Nederland, (allen zonder directe relatie of belangen met zaken uit de medische of farmaceutische wereld). - Eerder participatie aan richtlijn delirium bij volwassenen. - Eerste auteur bij hoofdstukken over delirium in handboek Spoedeisende psychiatrie en handboek Psychiatrie in het ziekenhuis.
|
Geen actie. |
|
dr. M. (Mark) van den Boogaard |
Senior onderzoeker intensive care Radboudumc |
Onbezoldigde functies: - Bestuurslid European Delirium Association - Adviseur Network for lnvestigation of Delirium: Unifying Scientists (NIDUS) - Organisator IC-café regio Nijmegen & Omstreken - Lid werkgroep Longterm Outcome and ICU Delirium van de European Society of lntensive Care Medicine - Lid richtlijn Nazorg en revalidatie IC-patiënten |
Gemeld maar niet van belang in het kader van deze richtlijn: ZonMw subsidies: - programma GGG [2013]: Prevention of ICU delirium and delirium-related outcome with haloperidol; a multicentre randomized controlled trial - programma DO [2015]: The impact of nUrsing DEliRium Preventive lnterventions in the lntensive Care Unit (UNDERPIN-ICU)
ZIN subsidie: - programma Gebruiken van uitkomsteninformatie bij Samen beslissen [2018]: Samen beslissen op de IC: het gebruik van (patiëntgerapporteerde) uitkomst informatie bij gezamenIijke besluitvorming over IC-opname en behandelkeuzes op de IC |
Geen actie. |
|
dr. B.E. (Liesbeth) Bosma |
Ziekenhuisapotheker Haga ziekenhuis |
Voorzitter HiX gebruikersgroep antistolling, onbezoldigd. |
Mijn partner werkt bij Astra Zeneca, maar heeft niets van doen met PADIS of IC. |
Geen actie. |
|
drs. N.M.S. (Nienke) Golüke |
Klinisch geriater ziekenhuis Gelderse Vallei |
Geen. |
Geen. |
Geen actie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van IC-Connect voor de werkgroep. IC-Connect heeft een achterbanraadpleging gedaan om het patiëntenperspectief in kaart te brengen. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen bij elke module. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging IC-Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Medicatie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. |
Implementatie
Inleiding
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn LTH en PCS in de chronische fase. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het toepassen en naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
• per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
• de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
• randvoorwaarden om de aanbeveling te kunnen implementeren;
• mogelijk barrières om de aanbeveling te kunnen implementeren;
• mogelijke acties om de implementatie van de aanbeveling te bevorderen;
• verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”. Bij elke module is onderstaande tabel opgenomen.
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
|
|
|
|
|
|
|
|
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de (participerende) wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij komend jaar direct geïmplementeerd moeten worden en dat per 2023 dus iedereen aan deze aanbevelingen dient te voldoen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die op de intensive care worden behandeld. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (NVIC, 2010]) op noodzaak tot revisie. Tevens zijn de volgende partijen uitgenodigd om knelpunten aan te dragen via een schriftelijke knelpunteninventarisatie: Inspectie Gezondheidszorg en Jeugd, Nederlandse Federatie van Universitair Medisch Centra, Nederlands Huisartsen Genootschap, Nederlandse Vereniging van Ziekenhuizen, Patiëntenfederatie Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen, Nederlandse Associate Physician Assistants, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, Vereniging Innovatieve Geneesmiddelen, Nederlandse Vereniging voor Intensive Care, Nederlandse Vereniging voor Anesthesiologie, Nederlandse Vereniging van Ziekenhuisapothekers, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Neurologie, Nederlandse Vereniging voor Psychiatrie, Verpleegkundigen en Verzorgenden Nederland-afdeling intensive care, Koninklijk Nederlands Genootschap voor Fysiotherapie, Stichting Family and Patient Centered Intensive Care. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kennislacunes
Tijdens de ontwikkeling van de richtlijn ‘PADIS’ is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.