Gecombineerde Leefstijl Interventie (GLI)
Uitgangsvraag
Wat is de toegevoegde waarde van het op maat combineren van de componenten voeding, beweging en ondersteuning bij gedragsverandering in de behandeling van volwassenen met overgewicht (in combinatie met een vergrote buikomvang en/of comorbiditeit) of obesitas, ten opzichte van de focus op één of twee van deze drie componenten?
Subvraag
Hoe lang moet een gecombineerde leefstijl interventie aangeboden worden, om gedragsverandering te realiseren bij volwassenen met overgewicht of obesitas?
Aanbeveling
- Adviseer een gecombineerde leefstijlinterventie (GLI) indien gedragsinterventie naar een gezondere leefstijl geïndiceerd is met als doel om een gezonder gewicht te bereiken. Het gaat dan o.a. om gezondere eet-, beweeg-, slaap- en ontspanningspatronen. Een GLI wordt pas ingezet na een volledige diagnostische fase en als onderdeel van de totale behandeling van de cliënt/patiënt met obesitas (vanaf obesitas klasse/graad I in combinatie met vergrote buikomvang en/of comorbiditeit) of met overgewicht in combinatie met een vergrote buikomvang en/of comorbiditeit (zie ook module ‘Gepersonaliseerde zorg’).
- Voer een GLI bij voorkeur minimaal een jaar uit met een interventie- en onderhoudsfase. Richt het programma zo in dat de bijeenkomsten in het begin elkaar kort opvolgen (interventiefase) en dat er tijdens de onderhoudsfase meer tijd tussen zit.
- Leg waar mogelijk, de regie bij de cliënt/patiënt zelf neer, zodat de gekozen stappen aansluiten bij de behoeften en leefsituatie. Laat de cliënt/patiënt zicht krijgen op eigen gezondheidsbevorderende en gezondheidsbelemmerende vaardigheden.
- Stimuleer de cliënt/patiënt om zijn/haar sociale omgeving te betrekken bij de uitvoering van de GLI.
- Verwijs de cliënt/patiënt (terug) naar de huisarts of naar paramedische danwel (psycho)sociale hulp indien er vermoeden is op medische, paramedische en/of (psycho)sociale problematiek. De eerste stap in een optimale behandeling van obesitas en overgewicht is goede diagnostiek (zie module ‘Diagnostiek’ en ‘Gepersonaliseerde zorg’).
- Verwijs patiënten met laaggeletterdheid, of andere specifieke problemen naar een GLI die op deze doelgroep gericht is.
Verwachtingsmanagement
Zorg ervoor dat de cliënt/patiënt reële verwachtingen heeft van het behandelplan. Zowel voor de potentiële deelnemer als voor de hulp-/zorgverlener is een reële verwachting van de effecten van het behandelplan van belang. Geef uitleg over obesitas als chronische ziekte en de uitkomstmaten die verder reiken dan alleen gewichtsafname (zie module ‘Uitkomstmaten’).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De bewijskracht voor een GLI, ten opzichte van één of twee losse componenten, is beperkt. Een beperkt aantal studies hebben een GLI vergeleken met één of twee losse componenten, waarbij ook de inhoud van de behandeling verschillend was. De bewijskracht is daarom beoordeeld als zeer laag. Sinds ruim een decennium wordt een GLI gezien als gouden standaard (Seidell, 2010), waardoor er weinig studies meer uitgevoerd zijn die de effectiviteit onderzoeken van een behandeling die zich richt op slechts één of twee componenten van een GLI. Dit is een van de verklaringen dat maar weinig studies voldeden aan de zoekcriteria van deze module.
De ervaring leert dat het combineren van de componenten versterkend werkt voor veel deelnemers. Als ze met bijvoorbeeld beweging aan de slag gaan, is het makkelijker om ook gezonde voedingskeuzes te maken. Tevens is leefstijl een samenhang van de verschillende leefstijlgedragingen en hebben de verschillende gedragingen invloed op elkaar. Een effectieve GLI dient alle drie de componenten te bevatten: voeding, beweging en gedragsverandering (Sodlerlund, 2009; Jensen, 2014). Dit maakt dat het combineren van GLI-componenten noodzakelijk is en dat het belangrijk is om naar het individu als geheel te kijken. De Beweegrichtlijnen en richtlijnen Goede Voeding vormen hierbij de leidraad van een GLI om toe te werken naar een gezond gedrag. Ook leefstijlthema’s zoals slaap en stress moeten aan bod komen (Bos, 2019). Diverse onderzoeken laten het belang van slaap en stress zien op de ontwikkeling en het behoud van overgewicht en obesitas (Bos, 2019; Nedeltcheva, 2014). Het thema stress is met name belangrijk voor mensen met een lage SEP, die vaker meer stress ervaren (Moore, 2012). Mensen die in ploegendiensten werken hebben vaker last van slaapstoornissen (Bos, 2019). Slaaptekort heeft invloed op de voedselkeuzes en het gevoel van honger en verzadiging (Bos, 2020); zie ook module ‘Diagnostiek’.
De behandelaar dient oog te hebben voor alle leefstijlelementen en te kijken naar de oorzaken van de (ongezonde) patronen (zie module ‘Diagnostiek’). Het is belangrijk dat voordat een GLI als behandeling wordt ingezet, eerst een goede diagnose is gedaan. Pas dan kan besloten worden of en op welk moment deze interventie ingezet wordt in de totale behandeling van overgewicht en obesitas. De behandelaar van de persoon met overgewicht of obesitas maakt de samenhang van de onderliggende belemmeringen met de deelnemer bespreekbaar. Indien een behandeling wel nodig is – als er sprake is van overgewicht in combinatie met comorbiditeit of als obesitas aanwezig is -of wanneer er sprake is van een eet-, gedrag- beweeg- of slaapstoornis, dan is het noodzakelijk om de deelnemer naar de juiste zorg- hulpverlener door te verwijzen.
Deelnemers moeten leren hun gedrag blijvend aan te passen. Het is essentieel om hen veerkracht te leren opbouwen, door te ervaren hoe het is om terug te vallen en hoe je de draad daarna weer goed kan oppakken. Door zelf de regie te nemen, is de kans groter dat de deelnemer meer intrinsiek gemotiveerd raakt om gezonder te leven en dit ook vol te houden. Waar nodig dient echter gedeelde regie te zijn.
Maak in een GLI tevens sociale steun bespreekbaar, zodat de gezonde gedragsverandering makkelijker gaat en beter vol te houden is (Bos, 2019). Hierbij gaat het om zowel sociale steun van familieleden en vrienden als van de andere GLI-deelnemers. Deelnemers ervaren steun aan elkaar en herkenning zich in elkaars ervaringen. Begeleid het groepsproces zodanig zodat de onderlinge band versterkt wordt.
Voor het uitvoeren van een GLI is het belangrijk dat de deelnemers en coach dezelfde taal spreken en elkaar begrijpen en dat er rekening wordt gehouden met de voorkeuren en mogelijkheden van de cliënt/patiënt. Wanneer deelnemers de taal onvoldoende beheersen of als er sprake is van een verstandelijke beperking, kan een GLI niet goed worden uitgevoerd. Extra aandacht moet er zijn voor mensen met een lage sociaal-economische status (Della, 2020), mensen met laaggeletterdheid (Stichting Lezen en Schrijven, 2019), mensen met lage gezondheidsvaardigheden, mensen met een migratieachtergrond en mensen met een laag IQ. Alvorens door te verwijzen naar een GLI, dient eerst te worden nagegaan welke onderliggende en instandhoudende factoren van overgewicht spelen bij de cliënt/patiënt. Mensen met een BMI ≥35 kg/m2 en mensen met een psychiatrische achtergrond hebben mogelijk een intensievere, meer individuele aanpak nodig wegens de complexiteit, bijvoorbeeld een gespecialiseerde GLI. Bij vermoeden van een eetstoornis is het raadzaam terug te verwijzen naar de huisarts voor andere hulpverlening. Op dit moment worden er steeds meer doelgroep-specifieke GLI-programma’s aangeboden. Dit heeft als voordeel dat het programma aangepast kan worden op de subdoelgroep, bijvoorbeeld in een andere taal. Door het vormen van zowel doelgroep-specifieke als algemene groepen, kan er een goede klik ontstaan tussen mensen uit verschillende lagen van de samenleving die anders niet elkaar gevonden hadden. Hiermee wordt een inclusieve samenleving gestimuleerd, wat kan bijdragen aan het verkleinen van gezondheidsverschillen.
Duur van een GLI
Er zijn geen studies gevonden die primair hebben onderzocht hoe lang een GLI aangeboden dient te worden om gedragsverandering te realiseren bij volwassenen met overgewicht of obesitas. Meerdere studies beschrijven dat de duur van een GLI van minimaal een jaar het meest effectief is. Indien de duur van een GLI wordt afgezet tegen de proportionele afname in gewicht in de geïncludeerde studies wordt eenzelfde trend zichtbaar.
|
Studie |
Duur van een GLI |
GLI - % gewichtsverlies |
|
Bertz (2012) |
3 maanden 12 maanden |
8,2% 8,7% |
|
Rejeski (2011) |
6 maanden 18 maanden |
8,5% 7,7% |
|
Skender (1996) |
3 maanden 12 maanden 24 maanden |
6,4% 8,8% 2,2% (t.o.v. 12 maanden) |
|
Villareal (2011) |
6 maanden 12 maanden |
7,7% 9,0% |
|
Wadden (1997) |
24 weken 48 weken |
17,6% 16,5% |
Onderzoek laat zien dat hoe langer een GLI duurt en des te meer bijeenkomsten het bevat, de effecten groter zullen zijn (de Vries, 2018). Deelnemers worden tijdens het eerste jaar in de behandelfase bewust van hun eigen (ongezonde) gedrag en leren hoe ze stappen kunnen zetten richting het gezonde gedrag. Het tweede jaar is veelal ingericht als de onderhoudsfase, waarin men kan leren van de terugvalervaringen (Bos, 2019).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Een van de redenen van deelnemers die aan een GLI starten, is dat ze beter in hun vel willen zitten. Andere redenen die vaak genoemd worden zijn: afvallen, gezonder worden, professionele begeleiding, een betere conditie krijgen, meer gaan bewegen, geen/minder medicijnen gebruiken en de combinatie tussen beweging en voeding (Berendsen, 2015; Van Rinsum, 2018a).
Redenen om niet aan een GLI te starten komt in sommige gevallen door dat ze andere persoonlijke uitdagingen hebben die bij voorkeur eerst aangepakt moeten worden, of het feit dat het om een groepsinterventie gaat. Deze personen willen niet in een groep zitten, bijvoorbeeld omdat ze niet hun persoonlijke verhaal met anderen willen delen. Andere redenen om niet deel te nemen zijn: geen interesse in het programma (bijvoorbeeld omdat ze onvoldoende motivatie om zijn of haar gedrag te veranderen of al een gezonde leefstijl hebben, of dat het niet belangrijk is), te druk (waaronder het hebben van andere prioriteiten), fysieke of mentale problemen, of niet voldoen aan de inclusiecriteria (Berendsen, 2015; Duijzer, 2014; Van Rinsum, 2018a). Echter zijn er ook veel personen die het juist prettig vinden om een GLI in groepsverband te volgen. Indien men andere prioriteiten heeft, kan het zijn dat diegene nog niet klaar is om zijn/haar leefstijlgedrag te willen veranderen. Er is hiervoor dan geen ruimte of hun intrinsieke motivatie is nog niet hoog genoeg om aan hun leefstijl te gaan werken.
Deelnemers, die nu wel met een GLI zijn gestart, geven soms aan dat ze de periode van twee jaar als prettig ervaren. Dit voelt voor hen dan als een steuntje in de rug voor een langere periode en fijn dat ze er de tijd voor kunnen nemen, waardoor er minder druk op ligt. In deze periode kunnen de deelnemers veerkracht leren opbouwen door van de terugval-momenten te leren om weer overeind te komen. Het huidige uitvalpercentage wordt geschat op 10-15%, waarbij veelal persoonlijke omstandigheden en verminderde motivatie een rol spelen . Dit bevestigt de keuze voor een periode van twee jaar.
Kosten (middelenbeslag)
Een volledige GLI met de drie componenten is effectiever en dus waarschijnlijk op langere termijn doelmatiger. De hypothese is dat dit op lange termijn een vermindering van zorgkosten oplevert, vanwege het feit dat gezondere mensen minder zorgconsumptie veroorzaken. Er hebben echter alleen een paar studies onderzoek gedaan naar de zorgkosten van GLI-deelnemers (Van Giessen, 2018). Momenteel loopt er een onderzoek naar de kosteneffectiviteit van een GLI. Tot die tijd kan er nog geen uitspraak worden gedaan met betrekking tot kosteneffectiviteit.
Er zijn nog geen resultaten bekend van Nederlandse onderzoeken naar de maatschappelijke impact van een GLI. De ervaring leert dat GLI-deelnemers zich fitter voelen en meer energie ervaren. Dit zou kunnen leiden dat de deelnemers meer kunnen bijdragen aan de samenleving in de vorm van werk of vrijwilligerswerk, wat gunstige effecten heeft op de maatschappelijke kosten. Een GLI is een voorbeeld van de verplaatsing van Ziekte en Zorg (ZZ) naar Gezondheid en Gedrag (GG).
Aanvaardbaarheid, haalbaarheid en implementatie
De procesevaluaties van de verschillende GLI programma’s laten zien dat ze haalbaar zijn. De interventies dragen bij aan een gezonder gedrag en de deelnemers en zorgverleners waren bij alle interventies erg tevreden (Berendsen, 2015; Van Dongen, 2016; Los, 2017; Van Rinsum, 2018b).
Deze genoemde processtudies zijn ondertussen achterhaald, vanwege het feit dat deze GLI-programma’s nu in de basisverzekering vergoed worden. Hierdoor kunnen de GLI-programma’s landelijk verspreid worden en komen er andere belemmerende en succesvolle factoren bij kijken. Het RIVM volgt de ontwikkeling van de GLI-programma’s die vergoed worden. In 2021 is het GLI register gestart (RIVM, 2021). In dit register zullen verschillende uitkomsten van de deelnemers gerapporteerd worden, zoals gewicht en kwaliteit van leven.
Mensen met een hoger opleidingsniveau zijn over het algemeen sneller geneigd om aan interventies mee te doen dan mensen met een lage SEP of een migratieachtergrond (Bos, 2019). Doordat GLI-programma’s nu ook vergoed worden vanuit de basisverzekering zonder eigen risico is het voor mensen uit lagere klassen toegankelijker geworden om deel te nemen. Wat voor invloed dit heeft op de gezondheidsgelijkheid is nog niet bekend. Alle GLI-programma’s hebben resultaten bijgehouden voor de resultaatmeting vanuit het RIVM. Het GLI-register werd geïmplementeerd in 2021. Een GLI gericht op mensen met een lage SEP verkleint de kans op sociaal-economische gezondheidsverschillen in Nederland (Bos, 2019). Indien een GLI meer gericht is op de belevingswereld en mogelijkheden van mensen met een hoge SEP kan dit de verschillen juist vergroten. Door het vormen van subgroepen gericht op de specifieke doelgroepen kunnen gezondheidsverschillen gelijk worden getrokken, doordat de subgroepen meer gezondheidsvaardigheden aanleren.
Een belemmering voor leefstijlcoaches en de verwijzers is dat de digitale verwijsstructuur niet overal goed is geregeld, waardoor er extra administratieve lasten zijn. Doordat niet alle zorgverzekeraars het maximumtarief hanteren, zijn de kosten een barrière voor de professionals. Daarbij geven de coaches aan dat het maximumtarief te laag is en dat ze niet altijd een goedkope locatie ter beschikking hebben. De opstartfase werd veelal niet vergoed door zorgverzekeraars.
Het aantal patiënten dat deelneemt aan een basis GLI programma is in één jaar tijd (2021) exponentieel gestegen. Het merendeel van de deelnemers is 50 jaar of ouder zonder comorbiditeit (RIVM, 2021). Verwijzers (met name huisartsen) weten een basis GLI programma steeds beter te vinden. Het is noodzakelijk dat de leefstijlcoach goed contact heeft en onderhoudt met andere professionals in het sociale en zorgnetwerk (zie module ‘Organisatie van zorg’). Het wordt dringend aanbevolen om vanuit de GLI begeleider contact te leggen met de buurtsportcoach of beweegconsulent in de gemeente. Het is bevorderlijk voor een GLI wanneer er al een sterk en goed functionerend netwerk is in dezelfde regio. Indien extra zorg nodig is ten aanzien van andere factoren zoals voeding, beweegbeperkingen, psychische, sociale of medische aspecten dient de patiënt, aanvullend op een GLI, naar de juiste hulp-/zorgverlener toegeleid te worden.
Het gemeentelijke domein faciliteert naar sport – of beweegaanbod in de wijk. Maar ook om de locatie waar een GLI wordt uitgevoerd te faciliteren. Het is een voorwaarde om een centrale en makkelijk bereikbare locatie te hebben om de drempel tot deelname zo laag mogelijk te houden.
Aanvullend is het een voorwaarde dat zorgverzekeraars het mogelijk maken voor deelnemers om gratis deel te nemen en voor uitvoerders om het met zo min mogelijk administratieve lasten te kunnen declareren. Wanneer zorggroepen een GLI inkopen en contracten met zorgverzekeraars hierover afsluiten, dan wordt de ketenzorgstructuur versterkt en lopen de declaraties en verwijzingen via het systeem van de zorggroep (Van Rinsum, 2019). Op die manier hoeft een GLI-uitvoerder niet zelf aparte afspraken te maken met elke zorgverzekeraar. Een voordeel is dat in 2020 en 2021 een volgbeleid gold voor zorgverzekeraars. Dit houdt in dat er alleen met de preferente zorgverzekeraar in de regio een contract afgesloten hoeft te worden en dat de overige zorgverzekeraars de gemaakte afspraken moeten volgen. Om een GLI duurzaam te willen blijven aanbieden dient het wel rendabel te zijn voor de uitvoerder van een GLI. Uit de praktijk komen signalen dat dit niet altijd mogelijk is.
Het programma dient qua inhoud goed aan te sluiten bij het niveau van de deelnemers en indien mogelijk aangepast te worden binnen de kaders van het programma (Bos, 2019). Het vormen van subgroepen kan hierbij helpen, mits het programma past bij de behoeften, wensen, belevingswereld, drijfveren en taal van de deelnemers. Wanneer het programma goed aansluit bij de fase van motivatie, levensfase, conditie, kennisniveau en problematieken van de deelnemers, dan is de kans op betere resultaten groter.
Nazorg
Het is belangrijk dat de deelnemers na het afronden nog terug gezien worden, bijvoorbeeld met een jaarlijkse controle bij de huisarts, om de patiënten niet uit het oog te verliezen en tijdig in te grijpen wanneer er sprake is van een terugval. Obesitas is een chronische ziekte, waarbij altijd een vorm van monitoring of begeleiding nodig blijft. Aandacht voor eventuele mogelijkheden van e-health gebaseerde ondersteuning hierbij in de toekomst is nodig.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Een GLI wordt momenteel gezien als geëigende aanpak voor de behandeling van overgewicht en obesitas. Uit de literatuurstudie blijkt dat een GLI mogelijk effectiever is in vergelijking met één of twee losse componenten. De bewijskracht hiervoor is zeer laag. De ervaring leert dat het combineren van de componenten versterkend werkt voor veel deelnemers. De Beweegrichtlijnen en richtlijnen Goede Voeding vormen hierbij de leidraad van een GLI om toe te werken naar een gezond gedrag. De effectiviteit op de lange termijn (>2 jaar) van de Nederlandse GLI programma’s is nog niet bekend. Er zijn geen studies beschikbaar die een directe vergelijking hebben gemaakt in de effecten van de duur van een GLI. Onderzoek laat zien dat hoe langer een GLI duurt en des te meer bijeenkomsten deze bevat, de effecten groter zullen zijn (de Vries, 2018). Deelnemers worden tijdens het eerste jaar in de behandelfase bewust van hun eigen (ongezonde) gedrag en leren hoe ze stappen kunnen zetten richting het gezonde gedrag. Het tweede jaar is de onderhoudsfase, waarin men kan leren van de terugvalervaringen (Bos, 2019). Het is belangrijk dat de deelnemers daarna nog regelmatig terug gezien worden, bijvoorbeeld met een jaarlijkse controle bij de huisarts, om de patiënten niet uit het oog te verliezen en tijdig in te grijpen wanneer er sprake is van een terugval.
De aanbevelingen zijn tot stand gekomen door de gegevens uit de studies te combineren met de ervaringen vanuit de huidige praktijk van ondersteuning en zorg voor volwassenen met overgewicht of obesitas.
Onderbouwing
Achtergrond
Een gecombineerde leefstijl interventie (GLI) is een behandeling bestaande uit interventies gericht op de componenten voeding en beweging met aandacht voor gedragsverandering welke in samenhang worden aangeboden (Seidell, 2010; van der Meer, 2009). Een GLI bestaat uit drie componenten: voeding, bewegen en gedragsverandering en heeft tot doel om een gezonder gewicht en daarmee klinische gezondheidswinst te bereiken. Er zijn verschillende systematische reviews verschenen naar de effectiviteit van een GLI. Het is niet duidelijk of een GLI op lange termijn (> 1 jaar) effectiever is in vergelijking met één of twee losse componenten van een GLI.
Een GLI kan zowel individueel als in de vorm van een groepsbehandeling plaatsvinden, afhankelijk van wat past bij de patiënt.
Binnen een GLI kan in het kader van de stepped en matched care gevarieerd worden in de duur, frequentie, intensiteit en inhoud van de drie losse componenten voeding, beweging, gedragsverandering (zie modules ‘GLI versus één of twee losse componenten’ en ‘GLI op maat versus vast GLI-programma’ in het kinderdeel van de richtlijn).
Een gecombineerde leefstijlinterventie (GLI) kan daarom worden aangeboden in verschillende vormen:
- middels een vast programma, met een vaste vorm en inhoud. Dit zijn vaak groepsprogramma’s, gericht op alle componenten van een GLI (voeding, beweging en gedragsverandering). Deze kan in intensiteit varieren.
- middels een individuele (modulaire) vorm. Hierbij is de inzet op de componenten van een GLI meer flexibel en aangepast aan de behoefte, wensen en mogelijkheden van het individu. Dit kan gaan over inhoud, duur, frequentie en intensiteit.
Introduction
A combined lifestyle intervention (CLI) is a treatment consisting of interventions aimed at the components dietary advice, physical activity and psychological support for behavioural change, which are offered in conjunction (Seidell, 2010; van der Meer, 2009). A CLI consists of three components: nutrition, physical activity and behavioral change and aims at achieving a healthier weight and thus clinical health gains. Several systematic reviews have been published on the effectiveness of a CLI. It is unclear whether a CLI is more effective compared to one or two separate components of a CLI in the long term (> 1 year).
A CLI can take place individually or in the form of a group treatment, depending on the patient.
Within a CLI, according to stepped and matched care, the duration, frequency, intensity and content of the three separate components of nutrition, physical activity and behavioral change can vary (see modules 'GLI versus one or two separate components' and 'GLI on custom versus fixed GLI program' in the children's section of the guideline).
A combined lifestyle intervention (CLI) can therefore be offered in different forms:
- through a fixed program, with a fixed form and content. These are often group programs, aimed at all components of a CLI (nutrition, physical activity and behavior change). This program can vary in intensity.
- through a tailor-made program. The focus on the components of a CLI is more flexible and adapted to the needs, wishes and possibilities of the patient. This can be about content, duration, frequency and intensity.
Conclusies / Summary of Findings
|
Very low GRADE |
It is unclear what the effect is of a combined lifestyle intervention compared to a dietary plus behavioural intervention on weight loss at 12 months follow-up in patients with obesity and overweight.
Bronnen: Bertz, 2012; Skender, 1996; Villareal, 2011; Wadden, 1997. |
|
Low GRADE |
A combined lifestyle intervention may result in higher weight loss at 12 to 18 months follow-up compared with a physical activity plus behavioural intervention in patients with obesity and overweight.
Bronnen: Bertz, 2012; Rejeski, 2011; Skender, 1996. |
|
Very low GRADE |
It is unclear what the effect is of a combined lifestyle intervention compared to a physical activity intervention only on weight loss at 12 months follow-up in patients with obesity and overweight.
Bronnen: Villareal, 2011. |
|
Very low GRADE |
It is unclear what the effect is of a combined lifestyle intervention compared with a dietary plus behavioural intervention on quality of life at 12 months follow-up in patients with obesity and overweight.
Bronnen: Villareal, 2011. |
|
Very low GRADE |
It is unclear what the effect is of a combined lifestyle intervention compared with a physical activity intervention only on quality of life at 12 months follow-up in patients with obesity and overweight.
Bronnen: Villareal, 2011. |
Samenvatting literatuur
Description of studies
The systematic review of Johns (2014) is used for the syntheses of the literature. Johns (2014) aimed to examine the clinical effectiveness of CLI targeting weight loss in comparison to single component programs, using within study comparisons. Johns (2014) searched the electronic databases of the BIOSIS, the Cochrane Database of Systematic Reviews, CENTRAL, the Conference Proceedings Citation Index, the Database of Abstracts of Reviews and Effects, EMBASE, the Health Technology Assessment database, MEDLINE, PsycINFO, and Science Citation Index for dates between May 2009 and November 2012. Studies that met all the following criteria were included: 1) randomized and quasi-randomized controlled trials; 2) studies that recruited adults (aged ≥18 years) classified as overweight or obese (people with a BMI ≥25 kg/m2 and ≥30 kg/m2, respectively, or a BMI ≥23 kg/m2 in Asian populations). In total, eight trials involving 1022 participants were included (Bertz, 2012; Foster-Schubert, 2012; Rejeski, 2011; Skender, 1996; Villareal, 2011; Vissers, 2010; Wadden, 1988; Wadden, 1997). The number of participants in each study ranged from 59 to 352, with a mean of 128 participants per study. The mean age of study participants ranged from 32 to 70 years. The majority of participants were woman (median 86%; range= 49% to 100%). The mean Body Mass Index (BMI) ranged from 29.2 to 37.3 kg/m2. Length of follow-up ranged from three to eighteen months from baseline. Four studies compared a CLI with a diet-only arm and presented data at three months (Bertz, 2012; Skender, 1996, Vissers, 2010; Wadden, 1988). One study compared a CLI with a diet-only arm and presented data at six months follow-up (Wadden, 1997). Seven studies compared a CLI with a diet-only arm and presented data at twelve months follow-up (Bertz, 2012; Foster-Schubert, 2012; Skender, 1996; Villareal; 2011; Vissers, 2010; Wadden, 1988; Wadden, 1997). Five studies compared a CLI with a physical activity-only arm and presented data at three to six months follow-up (Bertz, 2012; Foster-Schubert, 2012; Rejeski, 2011; Skender, 1996; Villareal, 2011). Five studies compared a CLI with a physical activity-only arm and presented data at twelve to eighteen months follow-up (Bertz, 2012; Foster-Schubert, 2012; Rejeski, 2011; Skender, 1996; Villareal, 2011). Five of the eight trials in the study of Johns (2014) were included in this review (Bertz, 2012; Rejeski, 2011; Skender, 1996, Villareal, 2011; Wadden, 1997). The following outcome measures were included: mean weight loss at twelve months follow-up, mean weight loss at twelve to eighteen months follow-up, and quality of life at twelve months follow-up. The individual study characteristics of the included studies are described below.
Bertz (2012) conducted a RCT investigating the effect of a combined dietary and physical exercise behaviour modification treatment compared with dietary intervention only, physical activity only or usual care in lactating woman measured at the end of treatment and at one year follow-up. Participants were randomly assigned to either the combined dietary and physical exercise group (n=16), dietary group (N=15), exercise group (N=16) or control group (N=15). The duration of the intervention was three months. All participants received individual behaviour modification counselling, except for the control group. Counselling consisted of one-and-a-half hour individual behaviour modification at the start of the intervention and one hour at a follow-up home visit after six weeks of the intervention. Participants in the combined group received five hours of individual behaviour counselling. This included biweekly contact with cell phone text messages to report body weight in the dietary group, number of brisk walks in the physical activity group, and both body weight and number of brisk walks in the combined group. During the nine-month period after the intervention, the women were instructed to live their lives as they themselves chose. The women were contacted once after six months from baseline and asked about their health status and whether they still intended to attend the one-year follow-up. A total of 68 woman were randomized to one of the interventions. Of these, 62 women completed the intervention period, and 57 women remained to complete the one-year follow-up. The mean (SD) age was 33.9 (4.5) years in the combined group, 33.7 (4.2) years in the dietary group, 33.2 (3.7) years in the physical exercise group, and 32.2 (4.6) years in the control group.
Rejeski (2011) conducted a RCT investigating the effects of a physical activity and weight loss intervention on 18-month change in mobility among older adults with obesity or overweight in poor cardiovascular health. Participants were randomly assigned to either the physical activity group (N=97), successful aging education control group (N= 93), or combined dietary weight loss and physical activity group (N= 98). The physical activity intervention involved two phases: a six-month intensive phase involving counselling sessions in a mix of three group sessions and one individual session per month. Each group session started with a 30- to 45-minute period of walking followed by an interactive, group-mediated, behavioural-focused session. The combined dietary weight loss and physical activity intervention involved a physical activity program in conjunction with dietary weight loss, using the same conceptual model as physical activity. The first segment reviewed participants’ progress from the previous session. The second segment involved a group-mediated session that focused on skill training related to cognitive behavioural self-management skills, nutritional training, and topics in exercise science. Patients in the successful aging education intervention were taught how to actively “take charge” of their health. 261 participants had follow-up visits at 12 months and 237 participants had follow-up visits at 18 months. The mean (SD) age was 66.8 (4.6) years in the combined group, 67.2 (5.1) years in the physical activity group, and 67.2 (4.8) years in the successful aging education group.
Villareal (2011) conducted a RCT investigating the effects of combined physical activity and dietary weight loss on physical function compared to physical activity or dietary weight loss only in patients with obese or overweight. Participants were randomly assigned to either the physical activity group, dietary group, combined dietary and physical activity group, or control group. The duration of the intervention was one year. The dietary weight loss intervention consisted of a prescribed, balanced diet that provided an energy deficit of 500 to 750 kcal per day from their daily energy requirement. Participants in the dietary group met weekly as a group with a dietitian for adjustments of their caloric intake and for behavioural therapy. The physical activity intervention consisted of three group exercise-training sessions per week. The control group did not receive advice to change their diet or activity habits and were prohibited from participating in any weight-loss or exercise program. The combined group received a combination of both physical activity and dietary weight loss interventions with behavioural therapy as described before. A total of 107 participants were randomized to one of the four interventions. Of these, 93 participants completed follow-up visits at 12 months. The mean (SD) age was 70.0 (4.0) years in the combined group, 70.0 (4.0) years in the physical activity group, 70.0 (4.0) years in the dietary group, and 69.0 (4.0) years in the control group.
Wadden (1997) conducted a RCT investigating changes in body composition, resting energy expenditure, appetite, and mood among woman with obesity. Participants were randomly assigned to either a diet-only intervention (N=29), diet plus aerobic training intervention (N=31), diet plus strength training intervention (N=31), or diet combined with aerobic and strength training intervention (N=29). All participants received the same cognitive-behavioural weight loss program. The duration of the intervention was 48 weeks. All participants were prescribed the same diet during the 48-week program. They were asked to maintain their usual food intake during the first week. During weeks two to 17, participants were prescribed a diet of approximately 900-925 kcal/day. By week 20, participants decreased their consumption to approximately 1250 kcal/day. From weeks 22-48, participants were instructed to consume a self-selected diet of approximately 1500 kcal/day. All participants in the exercise group were provided three supervised training sessions per week for the first 28 weeks and two workouts per week during weeks 29-48. Twenty-one participants dropped out of the study due to scheduling conflicts, disruptive life events, or dissatisfaction with treatment. The mean (SD) age in the diet-only group was 41.0 (8.8) years, 40.8 (7.9) in the diet plus aerobic training group, 40.0 (9.1) in the diet plus strength training group, and 42.8 (8.3) in the combined group.
Skender (1996) conducted a RCT investigating the effects of a combination of diet and exercise compared to diet-only or exercise-only interventions in men and woman with who were at least 14 kilogram overweighed (according to height-weight tables). Participants were randomly assigned to either a diet-only intervention (N=42), exercise-only intervention (N=43), or a combination of diet and exercise (aerobic plus strength) (N=42). The duration of the intervention was one year and the follow-up period was two years. All participants received the same behavioural modification techniques. The dietary intervention was a low-cholesterol eating plan adjusted to produce a kg/week loss of weight. Contracts to reward behaviour change, stress management, stimulus control, goal setting, and maintenance techniques as applied to dietary behaviour modification were taught or used during treatment. The exercise component involved training in walking and a home-based program of up to five exercise periods per week. There were 12 weekly instructional sessions, followed by three bi-weekly and eight monthly meetings. The sessions were led by registered dietitians who were trained and experienced in behaviour modification. Self-monitoring, contracts to reward behaviour change, stimulus control, goal setting, and maintenance techniques as applied to exercise modification were also used. The combination of diet and exercise group spent approximately 60% of their time to strength training and 40% to aerobic activity. Eighty-six of the 127 participants completed the one-year treatment program and 61 participants completed the follow-up at two years after enrolment. The mean (SD) age of the three groups was not reported.
Results
The included studies described the effect of a CLI compared with 1) a dietary plus behavioural intervention; 2) a physical activity plus behavioural intervention; or 3) a physical activity intervention only. None of the studies compared a CLI to an intervention aimed at a dietary intervention only. Secondly, no studies were included that investigated the most effective duration of the CLI.
Weight loss
CLI versus a dietary plus behavioural intervention at 12 months follow-up
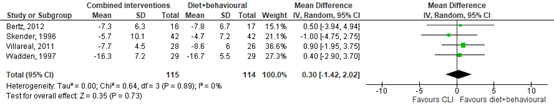
Four studies described the effect of CLI compared with a dietary plus behavioural intervention on mean weight loss at 12 months follow-up (Bertz, 2012; Skender, 1996; Villareal, 2011; Wadden, 1997). The pooled mean difference in weight loss between CLI and a dietary plus behavioural intervention is MD= 0.30 kg (95% CI= -1.42 to 2.02 kg). The difference in weight loss is not considered a clinically (for the patient) important difference (see figure 1).
Figure 6.1 CLI versus a dietary plus behavioural intervention, mean weight loss at 12 months
CLI versus a physical activity intervention only at 12 months follow-up
One study described the effect of CLI compared with a physical activity intervention only on mean weight loss at 12 to 18 months follow-up (Villareal, 2011). The mean (SD) weight loss in the CLI group was -7.7 (4.5) kg. The mean (SD) weight loss in the physical activity only group was -0.4 (3.3) kg. (MD= -7.30 (95% CI= -9.39 to -5.21 kg), in favour of the CLI. The difference in weight loss is considered as a clinically (for the patient) important difference.
CLI versus a physical activity plus behavioural intervention at 12-18 months follow-up
Three studies described the effect of CLI compared with a physical activity plus behavioural intervention on mean weight loss at 12 to 18 months follow-up (Bertz, 2012; Rejeski, 2011; Skender, 1996). The pooled mean difference in weight loss between CLI and a physical activity plus behavioural intervention is MD= -5.13 kg (95% CI= -6.72 to -3.54 kg), in favour of the CLI. The difference in weight loss is considered as a clinically (for the patient) important difference
(see figure 6.2).
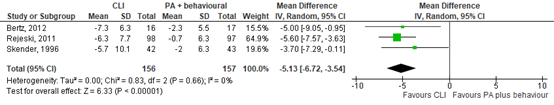
Figure 6.2 CLI versus a physical activity plus behavioural intervention, mean weight loss at 12 to 18 months
Quality of life
CLI versus a dietary plus behavioural intervention at 12 months follow-up
One study described the effect of CLI compared with a dietary plus behavioural intervention on quality of life at 12 months follow-up (Villareal, 2011). The mean (SD) SF-36 score improved with 8.6 (9.3) points in the CLI group. The mean (SD) SF-36 score improved with 8.4 (10.1) points in the dietary plus behavioural group (MD= 0.20 points (95% CI= -4.99 to 5.39 points). The mean increase of the SF-36 score is in favour of the CLI. However, the difference in quality of life is not considered as a clinically (for the patient) important difference.
CLI versus a single physical activity intervention only at 12 months follow-up
One study described the effect of CLI compared with a physical activity intervention only on quality of life at 12 months follow-up (Villareal, 2011). The mean (SD) SF-36 score improved with 8.6 (9.3) points in the CLI group. The mean (SD) SF-36 score improved with 5.7 (8.0) points in the physical activity only group (MD= 2.90 points (95% CI= -1.72 to 7.52 points). The mean increase of the SF-36 score is in favour of the CLI. However, the difference in quality of life is not considered as a clinically (for the patient) important difference.
Duration of the CLI
There are no studies available investigating different durations of a CLI.
Level of evidence of the literature
- CLI versus a dietary plus behavioural intervention: The level of evidence regarding the outcome measure weight loss at 12 months follow-up comes from randomized controlled trials and therefore starts high. The level of evidence was downgraded by three levels because of the small number of patients (imprecision), heterogeneity in the study results (inconsistency), and the possibility of inadequate concealment of allocation in the studies (risk of bias). The level of evidence was VERY LOW.
- CLI versus a physical activity intervention only: The level of evidence regarding the outcome measure weight loss at 12 months follow-up comes from a randomized controlled trial and therefore starts high. The level of evidence was downgraded by three levels because the conclusions were based on one single study (imprecision), the small number of patients (imprecision), and the possibility of inadequate concealment of allocation in the studies (risk of bias). The level of evidence was VERY LOW.
- CLI versus a physical activity plus behavioural intervention: The level of evidence regarding the outcome measure weight loss at 12 to 18 months follow-up comes from randomized controlled trials and therefore starts high. The level of evidence was downgraded by three levels because of the small number of patients (imprecision) and the possibility of inadequate concealment of allocation in the studies (risk of bias). The level of evidence was VERY LOW.
- CLI versus a dietary plus behavioural intervention: The level of evidence regarding the outcome measure quality of life at 12 months follow-up comes from a randomized controlled trial and therefore starts high. The level of evidence was downgraded by three levels because the conclusions were based on one single study (imprecision), the small number of patients (imprecision), and the possibility of inadequate concealment of allocation in the studies (risk of bias). The level of evidence was VERY LOW.
- CLI versus a physical activity intervention only: The level of evidence regarding the outcome measure quality of life at 12 months comes from a randomized controlled trial and therefore starts high. The level of evidence was downgraded by three levels because the conclusions were based on one single study (imprecision), the small number of patients (imprecision), and the possibility of inadequate concealment of allocation in the studies (risk of bias). The level of evidence was VERY LOW.
None of the studies compared a CLI to an intervention aimed at: 1) exclusively dietary intake; 2) exclusively behavioural intervention; 3) the combination of dietary intake and physical activity.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)desirable effects of a CLI compared to one of the components (diet/physical activity/psychological support for behavioural change) in adults (> 18 years) with obesity or overweight with comorbidities?
Sub-question: What is the most effective duration of a CLI?
P (Patients): Patients with obesity or overweight with comorbidities.
I (Intervention): Combined lifestyle intervention (CLI).
C: (Control): Diet, physical activity or psychological support for behavioural change.
O: (Outcome): (Long term, >1 year) change in weight and quality of life.
Relevant outcome measures
The guideline development group considered weight change and quality of life as a critical outcome measures for decision making.
A priori, the working group did not define the other outcome measures listed above, but used the studies’ definitions.
The guideline development group defined a 5% weight loss (or an absolute weight loss of three kilograms) and [a 10-point improvement on the Short Form 36 in] quality of life as a clinically (for the patient) important difference (Brigden, 2018).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 1 July 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 278 hits. First, systematic reviews were selected comparing CLI’s to an intervention with one or two CLI-components. Studies measuring outcomes ≥ 1 year after the start of the study were included. 16 studies were initially selected based on title and abstract screening. After reading the full text, 15 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included. The search strategy of this systematic review (Johns, 2014) was complete up on November 2012.
Secondly, 679 RCTs were selected which were published from 2012 onwards. Studies measuring outcomes ≥ 1 year after the start of the study were included. 13 studies were initially selected based on title and abstract screening. After reading the full text, 13 studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included.
Results
One systematic review was included about the effect of a CLI in adults with obesity or overweight and comorbidities (Johns, 2014). Out of this systematic review, we extracted the data of the individual RCTs which investigated the added value of a CLI compared to one or two elements on the long term (≥ 1 year).
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Berendsen BA, Kremers SP, Savelberg HH, Schaper NC, Hendriks MR. The implementation and sustainability of a combined lifestyle intervention in primary care: mixed method process evaluation. BMC Family Practice. 2015;16(1):37.
- Bertz F, Brekke HK, Ellegård L, Rasmussen KM, Wennergren M, Winkvist A. Diet and exercise weight-loss trial in lactating overweight and obese women. Am J Clin Nutr. 2012 Oct;96(4):698-705. doi: 10.3945/ajcn.112.040196. Epub 2012 Sep 5. PMID: 22952179.
- Boon M, Van Rossum L. VET belangrijk. Feiten en fabels over voeding, vetverbranding en verborgen dikmakers. Amsterdam: Ambo|Anthos; 2020.
- Bos V, Van Dale D, Leenaars K. Werkzame elementen van gecombineerde leefstijlinterventies. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu (RIVM); 2019.
- De Vries M, De Weijer T. Nieuw in het basispakket: De Gecombineerde Leefstijl Interventie. De Eerstelijns, 2018, 11-13.
- Dellas V, Verbaan CL, Collard D, Beune E, Wagemakers D. Werkzame elementen van een integrale aanpak van overgewicht en obesitas voor kwetsbare groepen: een exploratieve studie onder professionals en mensen met een lage sociaal-economische status en mensen met een migratieachtergrond. Mulier Instituut, Wageningen University and Research, Amsterdam AMC, 2020.
- Duijzer G, Haveman-Nies A, Jansen SC, Ter Beek J, Hiddink GJ, Feskens EJM. Feasibility and potential impact of the adapted SLIM diabetes prevention intervention in a Dutch real-life setting: the SLIMMER pilot study. Patient Education and Counseling 2014;97:101.
- Jensen, M. D., Ryan, D. H., Apovian, C. M., Ard, J. D., Comuzzie, A. G., Donato, K. A., ... & Yanovski, S. Z. (2014). 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Journal of the American college of cardiology, 63(25 Part B), 2985-3023.
- Johns DJ, Hartmann-Boyce J, Jebb SA, Aveyard P, Group BWMR. (2014). Diet or exercise interventions vs combined behavioral weight management programs: a systematic review and meta-analysis of direct comparisons. Journal of the Academy of Nutrition and Dietetics, 114(10), 1557-1568.
- Los M, Van Hal M. Procesevaluatie Samen Sportief in Beweging. 2017.
- Moore, C. J., & Cunningham, S. A. (2012). Social position, psychological stress, and obesity: a systematic review. Journal of the Academy of Nutrition and Dietetics, 112(4), 518-526.
- Partnerschap Overgewicht Nederland. 2021. Stappenplan aanpak overgewicht en obesitas bij volwassenen. https://www.partnerschapovergewicht.nl/stappenplan-aanpak-overgewicht-en-obesitas/. Geraadpleegd op 3 maart 2021.
- Pottjegort B, Winter T. 2020. Gecombineerde Leefstijl Interventie: wat werkt, wat niet? https://www.skipr.nl/blog/gecombineerde-leefstijl-interventie-gli-wat-werkt-wat-niet/. Geraadpleegd op 2 maart 2021.
- Raaijmakers LGM, Helmink JHM, Hamers FJM, Kremers SPJ. Inhoudelijke monitor lokale netwerken BeweegKuur/GLI. Universiteit Maastricht, 2012
- Rejeski WJ, Brubaker PH, Goff DC Jr, Bearon LB, McClelland JW, Perri MG, Ambrosius WT. Translating weight loss and physical activity programs into the community to preserve mobility in older, obese adults in poor cardiovascular health. Arch Intern Med. 2011 May 23;171(10):880-6. doi: 10.1001/archinternmed.2010.522. Epub 2011 Jan 24. PMID: 21263080; PMCID: PMC4425192.
- RIVM. Verslag bijeenkomst gecombineerde leefstijlinterventie 14 oktober 2019. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu (RIVM); 2019.
- RIVM. Gecombineerde leefstijlinterventie 2020: ontwikkeling geremd door COVID-19? Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu (RIVM); 2020.
- Söderlund, A., Fischer, A., & Johansson, T. (2009). Physical activity, diet and behaviour modification in the treatment of overweight and obese adults: a systematic review. Perspectives in public health, 129(3), 132-142.
- Skender ML, Goodrick GK, Del Junco DJ, Reeves RS, Darnell L, Gotto AM, Foreyt JP. Comparison of 2-year weight loss trends in behavioral treatments of obesity: diet, exercise, and combination interventions. J Am Diet Assoc. 1996 Apr;96(4):342-6. doi: 10.1016/S0002-8223(96)00096-X. PMID: 8598434.
- Stichting Lezen en Schrijven. 2019. Voel je goed! helpt gezondheidsverschillen te verkleinen. https://www.lezenenschrijven.nl/sites/default/files/2020-08/201901_factsheet_Onderzoeksoplegger_Voeljegoed%21_web.pdf. Geraadpleegd op 11 maart 2021.
- Van der Meer FM, Ligtenberg G, Staal PA. Preventie bij overgewicht en obesitas: de gecombineerde leefstijlinterventie. Diemen: College voor Zorgverzekeringen; 2009.
- Van Dongen EJ, Duijzer G, Jansen SC, Ter Beek J, Huijg JM, Leerlooijer JN, et al. Process evaluation of a randomised controlled trial of a diabetes prevention intervention in Dutch primary health care: the SLIMMER study. Public Health Nutrition. 2016;19(16):3027-3038.
- Van Giessen A, De Wit GA, Wendel-Vos W, Feenstra TL. Budget impact analyse van gecombineerde leefstijlinterventie (GLI). Raming van het benodigde budget bij opname van de GLI in de basisverzekering. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu (RIVM); 2018.
- Van Rinsum CE, Gerards SMPL, Rutten GM, Van de Goor LAM, Kremers SPJ. Coaching op Leefstijl (CooL): Eindrapportage van een implementatie- en monitoringstudie. Maastricht: Maastricht University; 2018a.
- Van Rinsum C, Gerards S, Rutten G, Van de Goor I, Kremers S. Coaching op Leefstijl (CooL) interventie: de leefstijlcoach als spin in het web? Tijdschrift voor Gezondheidswetenschappen. 2018b;96(5):189-193.
- Van Rinsum C, Janssens A-M. 2019. Leefstijlcoach kan hulp van zorggroep goed gebruiken. https://blcn.nl/leefstijlcoach-kan-hulp-van-zorggroep-goed-gebruiken/fbclid=IwAR1RGJ3J4nG3P7ppleWt0Wf0cGG65a6WJ98xsU3JBqZY8_V8pIYurqT99gI. Geraadpleegd op 3 maart 2021.
- RIVM. Gecombineerde leefstijlinterventie 2021: verdubbeling aantal deelnemers. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu (RIVM); 2021.
- Villareal DT, Chode S, Parimi N, Sinacore DR, Hilton T, Armamento-Villareal R, Napoli N, Qualls C, Shah K. Weight loss, exercise, or both and physical function in obese older adults. N Engl J Med. 2011 Mar 31;364(13):1218-29. doi: 10.1056/NEJMoa1008234. PMID: 21449785; PMCID: PMC3114602.
- Vissers, D., Verrijken, A., Mertens, I., Van Gils, C., Van de Sompel, A., Truijen, S., & Van Gaal, L. (2010). Effect of long-term whole body vibration training on visceral adipose tissue: a preliminary report. Obesity facts, 3(2), 93-100.
- Wadden TA, Vogt RA, Andersen RE, Bartlett SJ, Foster GD, Kuehnel RH, Wilk J, Weinstock R, Buckenmeyer P, Berkowitz RI, Steen SN. Exercise in the treatment of obesity: effects of four interventions on body composition, resting energy expenditure, appetite, and mood. J Consult Clin Psychol. 1997 Apr;65(2):269-77. doi: 10.1037//0022-006x.65.2.269. PMID: 9086690.
- Zorgverzekeraars Nederland. 2019. https://www.zn.nl/338067458/Nieuwsbericht?newsitemid=4297228288. Geraadpleegd op 3 maart 2021.
Evidence tabellen
Evidencetabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
|
Johns, 2014
|
SR and meta-analysis RCTs
Literature search up to November 2012
A: Bertz, 2012 B: Foster-Schubert, 2012 C: Rejeski, 2011 D: Skender, 1996 E: Villareal, 2011 F: Vissers, 2010 G: Wadden, 1988 H: Wadden 1997
Country: A: Sweden B: USA C: USA D: USA E: USA F: Belgium G: USA H: USA
Source of funding and conflicts of interest: The work on which this article is based was funded by the UK National Institute for Health and Care Excellence (NICE) to support the development of NICE Guidance on Managing Overweight and Obese Adults–Lifestyle Weight Management Services. The opinions expressed are those of the authors and do not represent either NICE's position on these matters or constitute NICE guidance. Funding was also provided by the UK Medical Research Council (grant no. U105960389 Nutrition and Health). P. Aveyard is funded by The UK Centre for Tobacco and Alcohol Studies, a UKCRC Public Health Research Centre of Excellence. Funding from British Heart Foundation, Cancer Research UK, Economic and Social Research Council, Medical Research Council and the Department of Health, under the auspices of the UK Clinical Research Collaboration, is gratefully acknowledged.
Conflict of interest P. Aveyard and S. Jebb are investigators on two trials funded by the National Prevention Research Initiative of the UK Medical Research Council. The treatments in these trials are provided free to the public by three commercial companies that advise a combination of diet and exercise for weight loss; these are Weight Watchers, Rosemary Conley, and Slimming World. S. Jebb was also an investigator on a trial with received funding from Weight Watchers International. No potential conflict of interest was reported by the other authors. |
Inclusion criteria SR: - Adults >18 yrs. - BMI >25 and > 30 or BMI >23 kg/m2 in Asian populations.
Exclusion criteria SR:
Important patient characteristics at baseline:
Total N A: 68 patients B: 439 patients C: 288 patients D: 127 patients E: 107 patients F: 79 patients G: 59 patients H: 120 patients
Sex A: M= 0; F= 68 B: M= 0; F= 439 C: M= 95; F= 193 D: M= 95; F= 193 E: M= 65; F= 62 F: M= 40; F= 67 G: M= not reported; F= not reported H: M= 9; F= 50
BMI (SD) in kg/m2: Diet (D); Physical Activity (PA); D + PA; control: A: D= 30.0 (2.6); PA= 30.4 (3.1); D + PA= 29.2 (2.2); Control= 30.2 (3.4)
B: D= 31.0 (3.9) PA= 30.7 (3.7) D + PA= 31.0 (4.3) Control= 30.7 (3.9)
C: PA= 32.8 (3.9) D + PA= 33.1 (4.1) Control= 32.6 (3.5)
D: BMI not reported
E: D= 37.2 (4.5) PA= 36.9 (5.4) D + PA= 37.2 (5.4) Control= 37.3 (4.7)
F: D= 32.9 (3.1) D + PA= 33.1 (3.4) D + vibration= 33.19 (4.7) Control= 30.8 (3.4
G: BMI not reported
H: D= 36.4 (5.5) D + combined PA= 35.3 (4.4) D + strength PA= 36.5 (6.0) D + aerobic PA= 37.2 (5.1)
|
Describe intervention:
A: 1. Calorie restriction (deficit of 500 kcal/d). COMBINED WITH 2. Brisk walking (moderate intensity), supervised twice, and recommended 4 d/wk, with length of each session incremental to 45 min
B: 1. Reduced-calorie and low-fat (1,200-2,000 kcal/d based on baseline weight) COMBINED WITH 2. Recommended and supervised moderate to high intensity PA, 45 min 5 d/wk.
C: 1. Reduced-calorie diet (1,200-1,500 kcal/d if baseline weight <113.4 kg, 1,500-1,800 kcal/d if ≥113.4 kg) COMBINED WITH 2. Recommended and supervised, moderate intensity PA, at least 5 d/wk, 30-45 min per session
D: 1. “Controlled energy intake” diet, calories not reported, 30% fat, 50% carbohydrate, 20% protein, using Help Your Heart Eating Plan COMBINED WITH 2. Recommended and supervised brisk walking (“vigorous” but not “strenuous”), gradual to 45 min or more 3 to 5 times/wk.
E: 1. Calorie restriction of 500-750 kcal/d (determined by resting energy expenditure×1.7) COMBINED WITH 2. Supervised activity sessions (3/wk) of 90 min, including moderate- to high- intensity PA (gradual increase to 70%-80% of peak heart rate).
F: 1. Hypocaloric diet calculated on an individual level using: (resting metabolic rate×1.3)–600 kcal/d COMBINED WITH 2.1 Aerobic interval training+general muscle strengthening exercise OR 2.2 Whole body vibration – exercises chosen to train all major muscle groups with machine frequency increasing from 30-35 and finally 40 Hz
G: 1. Energy-restricted diet, including very-low-energy component. Month 1 1,000-1,200 kcal/d, Months 2 and 3 400-500 kcal/d, Month 4 “refeeding,” Months 5 and 6 1,000-1,200 kcal/d COMBINED WITH 2. Recommended moderate PA (walking and using stairs), frequency not reported.
H: 1. Calorie-restricted liquid replacement diet − Wk 2-17: Prescribed diet of 925 kcal/d − Wk 18-22: Decreased liquid diet and increased consumption of conventional foods (Wk 18: 1,053 kcal/d; Wk 19: 1,150 kcal/d; Wk 20: 1,250 kcal/d) − Wk 22 on: Self-selected diet of 1,500 kcal/d with 12%-15% energy from protein; 55%-60% from carbohydrate, and 25%-30% from fat COMBINED WITH 2.1 Supervised step aerobics classes OR 2.2 Resistance training OR 2.3 Combined (60% aerobic and 40% resistance as above) |
Describe control:
A: Intervention A1 OR A2. B: Intervention B1 OR B2. C: Intervention C1 OR C2. D: Intervention D1 OR D2. E: Intervention E1 OR E2. F: Intervention F1 OR F2.1 OR F 2.2. G: Intervention G1 OR G2. H: Intervention H1 OR H2.1 OR H2.2 OR H2.3.
|
End-point of follow-up:
A: 3, 6, 12, 18 months B: 3, 12 months C: 6, 12 months D: 3, 12 months E: 12 months F: 3, 12 months G: 3, 12 months H: 3, 12 months
|
Combined interventions versus diet only
Weight loss at 3 to 6 months Mean difference (SD) [95% CI]:
A: Combined (N=16): -6.9 (2.82) Diet-only (N=17): -7.33 (4.8) MD= 0.43 (95% CI= -2.24 to 3.10)
B: Not reported
C: Not reported
D: Combined (N=42): -4.2 (5.8) Diet-only (N=42): -4.7 (4.9) MD= 0.50 (95%CI= -1.80 to 2.80)
E: Not reported
F: Comb (fitness) (N=20): -5.0 (3.7) Comb (vibration) (N=20): -5.5 (4.3) Diet-only (fitness) (N=10): -3.2 (2.4) Diet-only (vib) (N=10): -3.2 (2.4) MD(fit)= -1.80 (95%CI= -4.00 to 0.40) MD(vib)= -2.0 (95%CI= -4.70 to 0.10)
G: Comb (VLED) (N=23): -8.5 (5.2) Comb (No VLED (N=18): -12.6 (8.0) Diet-only (VLED) )N=9): -11.0 (6.2) Diet-only (No VLED (N=9): -11.0 (6.2) MD(VLED)= 2.50 (95%CI= -2.07 to 7.07) MD(No VLED)= -1.60 (95% CI= -7.08 to 3.88)
H: Comb(strength) (N=29): -15.7 (8.4) Comb(aerobic) (N=30): -15.7 (7.6) Comb (strength+aerobic) (N=27): -15.2 (8.1) Diet-only (strength) (N=9): -15.5 (6.8) Diet-only(aerobic) (N=9): -15.5 (6.8) Diet-only(str.+aer.) (N=9): -15.5 (6.8) MD(strength)= -0.20 (95% CI= -5.59 to 5.19) MD(aerobic)= -0.20 (95% CI= -5.41 to 5.01) MD(str.+aer)= 0.30 (95% CI= -5.09 to 5.69
Pooled effect (random effects model): MD= -0.62 (95% CI= -1.67 to 0.44) favoring the combined interventions Heterogeneity (I2): 0%
Weight loss at 12 months
Mean difference (SD) [95% CI]:
A: Combined (N=16): -7.3 (6.3) Diet-only (N=17): -7.8 (6.7) MD= 0.50 (95% CI= -3.94 to 4.94)
B: Combined (N=117): -8.9 (5.5) Diet-only (N=118): -7.1 (6.3) MD= -1.80 (95% CI= -3.31 to 0.29)
C: Not reported
D: Combined (N=42): -5.7 (10.1) Diet-only (N=42): -4.7 (7.2) MD= -1.00 (95% CI= -4.75 to 2.75)
E: Not reported
F: Comb (fitness) (N=20): -6.3 (6.4) Comb (vibration) (N=20): -7.2 (6.9) Diet-only (fitness) (N=10): -2.6 (4.2) Diet-only (vib) (N=10): -2.6 (4.2) MD(fit)= -3.70 (95%CI= -7.53 to 0.13) MD(vib)= -4.60 (95%CI= -8.59 to -0.61)
G: Comb (VLED) (N=23): -9.5 (9.8) Comb (No VLED (N=18): -8.4 (7.0) Diet-only (VLED) )N=9): -3.9 (6.9) Diet-only (No VLED (N=9): -3.9 (6.9) MD(VLED)= -5.60 (95%CI= -11.63 to 0.43) MD(No VLED)= -4.50 (95% CI= -10.05 to 1.05)
H: Comb(strength) (N=24): -13.3 (11.0) Comb(aerobic) (N=28): -12.4 (9.2) Comb (strength+aerobic) (N=23): -12.1 (10.2) Diet-only (strength) (N=8): -11.9 (7.9) Diet-only(aerobic) (N=8): -11.9 (7.9) Diet-only(str.+aer.) (N=8): -11.9 (7.9) MD(strength)= -1.40 (95% CI= -8.42 to 5.62) MD(aerobic)= -0.50 (95% CI= -6.95 to 5.95) MD(str.+aer)= -0.20 (95% CI= -7.08 to 6.68)
Pooled effect (random effects model): MD= -1.72 (95% CI= -2.80 to -0.64) favoring the combined interventions Heterogeneity (I2): 3%
Combined interventions versus exercise-only
Weight loss at 3 to 6 months Mean difference (SD) [95% CI]:
A: Combined (N=16): -7.3 (6.3) Exerc-only (N=17): -2.3 (5.5) MD= -5.00 (95% CI= -9.05 to -0.95)
B: Combined (N=117): -8.9 (5.5) Exerc-only (N=117): -2.0 (6.1) MD= -6.90 (95% CI= -8.39 to -5.41)
C: Combined (N=98): -6.3 (7.7) Exerc-only (N=97): -0.7 (6.3) MD= -5.60 (95% CI= -7.57 to -3.63)
D: Combined (N=42): -5.7 (10.1) Exerc-only (N=43): -2.0 (6.3) MD= -3.70 (95% CI= -7.29 to -0.11)
E: Combined (N=28): -7.7 (4.5) Exerc-only (N=26): -0.4 (3.3) MD= -7.30 (95% CI= -9.39 to -5.21)
F: Not reported G: Not reported H: Not reported
Pooled effect (random effects model): MD= -6.29 (95% CI= -7.33 to -5.26) favoring the combined interventions Heterogeneity (I2): 9%
Weight loss at 12 to 18 months Mean difference (SD) [95% CI]:
A: Combined (N=16): -7.3 (6.3) Exerc-only (N=17): -2.3 (5.5) MD= -5.00 (95% CI= -9.05 to -0.95)
B: Combined (N=117): -8.9 (5.5) Exerc-only (N=117): -2.0 (6.1) MD= -6.90 (95% CI= -8.39 to -5.41)
C: Combined (N=98): -6.3 (7.7) Exerc-only (N=97): -0.7 (6.3) MD= -5.60 (95% CI= -7.57 to -3.63)
D: Combined (N=42): -5.7 (10.1) Exerc-only (N=43): -2.0 (6.3) MD= -3.70 (95% CI= -7.29 to -0.11)
E: Combined (N=28): -7.7 (4.5) Exerc-only (N=26): -0.4 (3.3) MD= -7.30 (95% CI= -9.39 to -5.21)
F: Not reported G: Not reported H: Not reported
Pooled effect (random effects model): MD= -6.29 (95% CI= -7.33 to -5.26) favoring the combined interventions Heterogeneity (I2): 9%
|
Quality assessment
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Johns, 2014 |
Yes |
Yes
We searched BIOSIS, the Cochrane Database of Systematic Reviews, CENTRAL, the Conference Proceedings Citation Index, the Database of Abstracts of Reviews and Effects, EMBASE, the Health Technology Assessment database, MEDLINE, PsycINFO, and Science Citation Index for dates between May 2009 and November 2012 for randomized and quasirandomized controlled trials.
|
Yes
The search retrieved 2,210 references in total. Full text was retrieved and screened for 207 references. Of these, 199 were excluded, with the most common reasons being “not a randomized control trial” and a “lack of a single component arm.” Eight unique studies comparing a combined BWMP with either a diet or physical activity only intervention were identified. |
Yes
The eight included studies represented 1,022 participants. The number of participants in each study ranged from 59 to 352, with a mean of 128 participants per study. One study was conducted in Sweden, one in Belgium, and six in the United States. The mean age of study participants ranged from 32 to 70 years and, as is common in weight loss studies, the majority of participants were women (median 86%; range=49% to 100%). The mean BMI ranged from 29.2 kg/m2 to 37.3 kg/m2. Seven studies reported weight change at 12 months from baseline and one at 18 months.
|
Not applicable |
Yes |
Yes
Pooled results are presented as mean differences (in kilograms) with 95% CIs, and the I2 statistic is used to present statistical heterogeneity. |
Unclear |
Yes |
Systematic reviews
RCT’s
|
Study reference
(first author, publication year)
|
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Bertz, 2012 |
68 women were randomly assigned to the following 4 intervention groups in a 2 3 2 factorial design
Exact method of randomization was not described.
|
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unclear |
|
Foster-Schubert, 2012 |
The random assignment was generated by a computerized program, stratified according to BMI (<30 kg/m2 or ≥30 kg/m2) and participants’ self-reported race/ethnicity (non-Hispanic White, Black, or other). In addition, to achieve a proportionally smaller number of women assigned to the control group, a permuted blocks randomization with blocks of 4 was used, wherein the control assignment was randomly eliminated from each block with a probability of approximately 1 in 4.
|
Unlikely |
Unclear |
Unlikely
Baseline and 12-month weight and adiposity measures were obtained by staff blinded to participants’ intervention assignment.
|
Unlikely
All study measures were obtained by trained study personnel who were blinded to the participants’ randomization status.
|
Unlikely |
Unlikely
Follow-up >90% |
Unlikely
All analyses were based on the assigned intervention at the time of randomization regardless of adherence (ie, intention-to-treat), with a conservative no-change-from-baseline imputation made for the missing values.
|
|
Rejeski, 2011 |
Each participant was randomized to treatment using a permuted block randomization scheme with stratification by wave
|
Unclear |
Unclear |
Unclear |
Unclear |
Likely |
Unclear |
Unlikely
Intention-to-treat analysis |
|
Skender, 1996 |
Subjects were assigned randomly to three treatment conditions.
Exact method of randomization was not described. |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Likely
Of the 127 usbjects who were randomly assigned to the three treatment conditions, 86 remained wit hthe treatment program throughout its 1-year duration. 61 subjects returned for follow-up at 2 years. |
Unclear |
|
Vissers, 2010 |
Patients were randomized into 3 intervention groups that were matched for BMI category and gender.
Exact method of randomization was not described.
|
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unclear |
|
Villareal, 2011 |
Participants were randomly assigned, with stratification according to sex, to one of four groups: a control group, a group that participated in a weight-management program (diet group), a group that received exercise training (exercise group), and a group that received both weight-management instruction and exercise training (diet–exercise group).
Exact method of randomization was not described
|
Unclear |
Unclear |
Unclear |
Unlikely
The personnel who conducted the assessments were not aware of the group assignments.
|
Unlikely |
Unlikely
Fourteen participants discontinued the intervention and were included in the intention-to-treat analyses (13 provided follow-up data at 6 months and 1 at approximately 12 months).
|
Unlikely
Intention-to-treat analyses were performed with the use of SAS software.
|
|
Wadden 1988 |
Subjects were randomly assigned to one of three conditions
Exact method of randomization was not described. |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely
2 patients in the behaviour therapy group and 2 patients in the combined treatment group were lost to follow up and 1 patient, with a 3-year follow-up weightloss of 40 kg, was excluded because she had undergone a gastric bypass 18 months after treatment. She had maintained a loss of 31 kg at the time of the operation. |
Unclear |
|
Wadden 1997 |
Participants were randomly assigned to the four conditions previously described.
Exact method of randomization was not described. |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely
Dropouts were retained in the analyses of the data until the tim e of their attrition.
|
Unclear |
Exclusietabel
Systematic reviews
|
Auteur en jaartal |
Redenen van exclusie |
|
Sweet, 2010 |
More recent studies available |
|
Loveman, 2011 |
Wrong control intervention |
|
Kirk, 2012 |
Wrong design |
|
Gallagher, 2013 |
Wrong population |
|
Hartmann-Boyce, 2014 |
Wrong control intervention |
|
Booth, 2014 |
Wrong control intervention |
|
Stephens, 2014 |
Wrong intervention |
|
Aguiar, 2014 |
Wrong population |
|
Dombrowski, 2014 |
Wrong interventions |
|
Weerasekara, 2016 |
Wrong population |
|
Hassen, 2016 |
Wrong population |
|
Azar, 2017 |
Wrong population |
|
Khachatoorian, 2018 |
Wrong outcomes |
|
Murray, 2018 |
Wrong interventions |
|
Martenstyn, 2020 |
Wrong population |
|
Brandt, 2020 |
Wrong population |
RCT’s
|
Auteur en jaartal |
Redenen van exclusie |
|
Scott, 2013 |
Intervention < 1 year |
|
Salinardi, 2013 |
Wrong control intervention |
|
Beavers, 2014 |
Wrong population |
|
Bouchonville, 2014 |
Wrong intervention |
|
Weiss, 2016 |
Lack of behavioural intervention |
|
Blos, 2017 |
Intervention < 1 year |
|
Rejeski, 2017 |
Wrong comparison of interventions |
|
Mai, 2018 |
Wrong control intervention |
|
Kaikkonen, 2019 |
Intervention < 1 year |
|
Weimann, 2019 |
No comparison with single interventions |
|
Mason, 2019 |
Wrong intervention |
|
Pavic, 2019 |
Wrong comparison of interventions |
|
Langston, 2020 |
Wrong populations |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-07-2023
Beoordeeld op geldigheid : 07-07-2023
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2027 bepalen Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam, of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden. De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
Het Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam (C4O/VU) zijn respectievelijk regiehouder van het volwassenendeel en het kinderdeel en van de richtlijn. Daarnaast zijn ze eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van hun deel van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd door de Vrije Universiteit Amsterdam en het Ministerie van Volksgezondheid, Welzijn en Sport. De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is bij te dragen aan de verbetering van de ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Deze richtlijn is volgens Medische Specialistische Richtlijnen 2.0 tot stand gekomen, waarin de huidige stand van wetenschappelijke kennis en praktijkervaring aangaande het onderwerp is meegenomen.
De obesitasrichtlijn is ontwikkeld in samenwerking met veel partijen (zie samenstelling werkgroepen en klankbordgroepen) en is bedoeld voor de verschillende bij de ondersteuning en zorg voor obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit betrokken beroepsgroepen.
Deze richtlijn gaat over de diagnostiek en behandeling van volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Het betreft hier zorggerelateerde preventie (VWS, 2021).
Deze richtlijn richt zich op de beste diagnostiek, ondersteuning en zorg voor volwassene en kinderen met obesitas, gebaseerd op de meest recente literatuur en expert-/practice-based adviezen. Daarnaast is deze richtlijn relevant voor de geïndiceerde preventie (VWS, 2021) van obesitas bij volwassenen en kinderen. Dit betreft volwassenen en kinderen met overgewicht zonder risicofactoren en/of comorbiditeit.
Hierbij moet worden opgemerkt dat het gezondheidsrisico van overgewicht en obesitas wordt bepaald aan de hand van de BMI in combinatie met wel of geen aanwezigheid van risicofactoren en/of comorbiditeit. De BMI is ingedeeld in categorieën. Echter, de afkappunten van die categorieën zijn niet voor alle groepen precies hetzelfde. De mate van vervetting van het lichaam bij een bepaalde BMI is afhankelijk van het geslacht (vrouwen hebben een hoger vetpercentage dan mannen), de leeftijd (oudere mensen hebben een hoger vetpercentage dan jongere) en de etniciteit (mensen uit Azië hebben een hoger vetpercentage dan Europeanen). Daarnaast kunnen mensen met een grote spiermassa zoals sporters en mensen die zwaar lichamelijk werk doen een lager gezondheidsrisico hebben dan van hun BMI afgeleid kan worden met de bestaande afkappunten. Dit is de reden dat naast de BMI ook de buikomvang van groot belang is bij de bepaling van het gezondheidsrisico bij volwassenen met overgewicht of obesitas (Wharton, 2020).
Doelgroep
Deze richtlijn is primair bedoeld voor de beroepsgroepen die betrokken zijn bij de diagnostiek, ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de ondersteuning en zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. E.F.C. (Liesbeth) Van Rossum, PON, voorzitter
- W. (Wytse) Brongers, KNGF
- S.A. (Sione) Brugman, BLCN – tot februari 2023
- I. (Inge) Out, BLCN – vanaf februari 2023
- B. (Bernadette) Deenen, NVD
- K. (Karen) De Leest, KNMP
- Dr. K. (Karen) Freijer, PON
- E. (Ellen) Govers, NVD
- M. (Marc) Huls, NHG
- F. (Francoise) Langens, huisarts – tot februari 2021
- R.S.L. (Ronald) Liem, NVvH
- Dr. M. (Mattijs) Out, NIV
- E.M.J.N. (Evelyn) Sloots-Jongen, NIP
- N. (Nicolette) Slot, VvOCM
- I. (Inez) van den Anker, Stichting Over Gewicht (patiëntenorganisatie)
- J. (Jacqui) van Kemenade – van Vught, NHG
Klankbordgroep
- I.R.M. (Jurriaan) Blekemolen, NVAB
- Dr. G.J. (Gert-Jan) Braunstahl, NVALT
- D.O.A. (Darie) Daemers, KNOV
- D. (Dorenda) Dijken, NVOG
- S. (Sander) Galjaard, NVOG
- Prof. dr. A. (Annemieke) Hoek, NVOG
- M.M. (Maarten) Hoogbergen, NVPC
- Y.F.C. (Yvo) Kortmann, NVMDL
- P. (Patricia) Lottman, BLCN
- N. (Nienke) van der Putten, Hartstichting
- Dr. G.A.H. (Edgar) van Mil, NVK
- Dr. T.M. (Tessa) van Elten, Voedingscentrum
- Dr. M.E. (Janneke) Wittekoek, NVvC
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. B. (Bart) Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Overzicht van de belangen van werkgroepleden
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Rossum (voorzitter) |
Internist-endocrinoloog/ hoogleraar Gezond Gewicht en biologisch stressonderzoek in het Erasmus MC |
-Voorzitter Partnerschap Overgewicht Nederland – onbetaald (met in dat kader extra werkzaamheden zoals: *vertegenwoordiger PON bij de tafel Overgewicht voor het Nationaal Preventie Akkoord (onbetaald ) *adviseur keten/netwerkaanpak overgewicht bij volwassenen (tijdelijk betaald) en *lid commissie onderwijs leefstijl en overgewicht in de basiscurricula van zorgprofessionals (onbetaald) -Voorzitter Nationaal Obesitas Symposium – betaald -Bestuurslid stichting STRESS-NL (platform Nederlandse stress onderzoekers)– onbetaald -Lid Koninklijke Hollandsche Maatschappij der Wetenschappen – onbetaald -Lid OPEN Policy working group European Association of the Study of Obesity (sinds Dec 2022) – onbetaald -Lid Voedingsbeleidadviesteam Erasmus MC – onbetaald -Lid Hogeschoolraad – onbetaald -Deelnemer netwerk NL2025 – onbetaald - Jurylid Heineken Award commissie - betaald - Lid voedingsbeleidcommissie Erasmus MC – onbetaald -Spreker /dagvoorzitter bij multipele (inter)nationale en regionale (wetenschappelijke) congressen, webinars, podcasts, media, en nascholingen voor zorgprofessionals. beleidsmakers of algemeen publiek : oa voor Langerhans symposia, Dutch Obesity Academy, Dutch Diabetes Academy, NVE Academy, E-wise, KOEL, SCEM, ASCEND, European Association of the Study of Obesity, International Medical Press, Food First Network, Obesitas Platform, overgewicht.tv, Breedenburg, Het Grote Obesitas Debat, POLITICO Health Care summit EU, European Commission, Diabetes Genootschap Zuid Nederland, Vereniging Arts en Leefstijl, Internistendagen – deels onbetaald en deels betaald (zonder belangenverstrengeling of bemoeienis over wetenschappelijke inhoud door commerciele partijen in geval van betaling).
Afgeronde nevenfuncties: Lid van diverse commissies en wetenschappelijke besturen (onbetaald) |
- In 2019 boek gepubliceerd met co-auteur Mariëtte Boon ""VET belangrijk: feiten en fabels over voeding, vetverbranding en verborgen dikmakers"". Inkomsten naar uitgever Ambo Anthos en boekwinkels en een klein deel naar de auteurs (Mariette Boon en Obesity Science). In 2020 is het boek internationaal gepubliceerd. - Elisabeth Fonds (ondergebracht bij Erasmus MC Trustfonds) financiert de ontwikkeling van de online diagnostische ObesEcare tool om oorzaken overgewicht op te sporen. Het Elisabeth Fonds is een maatschappelijk / charitatief fonds en heeft geen winstoogmerk. - Firma Rhythm financiert een internationale multicenter trial voor een nieuw geneesmiddel (setmelanotide) voor patiënten met een zeldzame vorm van genetische obesitas. - Bezoek aan internationale Masterclass: ''leading the change in the management of Obesity & T2D'', gesponsord door Johnson & Johnson, 2017 (geen honorarium ontvangen) - Actieve bijdrage aan de ontwikkeling van een gespecialiseerde leefstijlinterventie in het Erasmus MC en bij de ontwikkeling van een diagnostische (online) ondersteuningstool voor mensen met overgewicht of obesitas (ook in het Erasmus MC).
|
Geen |
|
Brongers |
Manager fysiotherapie, fysiotherapeut en leefstijlcoach (GLI aantekening). Werkgever: Leidsche Rijn Julius Gezondheidscentra |
Geen |
Geen |
Geen |
|
Brugman |
Zelfstandig Leefstijlcoach |
Bestuurslid BLCN, deel betaald |
Geen |
Geen |
|
De Leest |
Apotheker GHC de Roerdomp Nieuwegein 24 uur Apotheker Geneesmiddel Informatie Centrum KNMP 10 uur |
onbetaald redactie Vascazine/vrijwilliger Vasculitis Vereniging |
Geen |
Geen |
|
Freijer |
Algemeen manager Partnerschap Overgewicht Nederland (PON) ondergebracht bij Erasmus MC te Rotterdam |
- Voorzitter van ISPOR Special Interest Group (SIG) Nutrition Economics. Werkzaamheden: het nieuw opgezette gebied binnen het bestaande gebied van gezondheidseconomie en daarbuiten vergroten.
- Eigenaar van eenmanszaak met naam Freijer4Food & Health Care Activiteitenomschrijving: Geven van lezingen op gebied van voeding; ontwikkelen van kennis/kunde omtrent voedingseconomie (Nutrition Economics); Schrijver/publicist van (wetenschappelijke) artikelen; geven van workshops op bovengenoemd gebied; projectmatig begeleiden van (commerciële) onderzoeken; consultancy op gebied van voeding. |
Geen |
Geen |
|
Govers |
Voorzitter van het NVD netwerk Obesitas (Kenniscentrum Diëtisten Overgewicht en Obesitas; www.KDOO.nl) Dit is een niet betaalde functie |
Vice-voorzitter van de ESDN Obesity van the European Federation of Associations of Dietitians. Een niet betaalde functie |
Geen |
Geen |
|
Langens |
Huisarts |
Ontwikkelen e-learnings/ webinar ( CME-online/accredidact/medonline): betaald Preventieconsult: medische begeleiding bij overgewicht/leefstijl : betaald Huisartsen Eemland: bevorderen wijkgericht werken: betaald Fieldlab obesitas Amersfoort: onbetaald |
Geen |
Geen |
|
Liem |
Gastro-intestinaal en traumachirurg
Groene Hart Ziekenhuis (GHZ) in Gouda (60%) Alrijne Ziekenhuis in Leiderdorp/Alphen ad Rijn (10%) Nederlandse Obesitas Kliniek West in Den Haag (20%) Keizer Kliniek in Voorschoten (10%) |
- Hoofd afdeling chirurgie in GHZ - Voormalig voorzitter Dutch Society for Metabolic and Bariatric Surgery - Lid Auditcommissie (Ned Ver v Heelkunde) - Lid Landelijke Commissie Chirurgische Complicatie Registratie (Ned Ver v Heelkunde) - Clinical Audit Board Audit voor de Behandeling van Obesitas van DICA - Lid Registry Committee of the Internationale Federation for the Surgery of Obesity and Metabolic Disorders - Lid Multi-National Advisory Group of IFSO-European Chapter
Al deze nevenfuncties zijn onbetaald |
Nederlandse Obesitas Kliniek. De chirurgische behandeling van obesitas en obesitas gerelateerde metabole ziekten maakt onderdeel uit van het behandel spectrum. Als ervaren bariatrisch en metabool chirurg maak ik derhalve ondereel uit van deze commissie. De uiteindelijke richtlijn heeft invloed op de positionering van deze behandeling in het behandel spectrum. Voor de chirurgische behandeling zelf, is in 2020 een herziene richtlijn gepubliceerd door de NVVH en het Kennisinstituut. Hiernaar zal worden verwezen in deze Zorgstandaard. Ik heb een beperkt belang in NOK West in Den Haag.
Ik ben daarnaast regelmatig een gevraagde spreker op (internationale) bijeenkomsten en congressen, soms gefaciliteerd door Johnson & Johnson Institute, Medtronic, Gore en Olympus. Daar staat soms een tijdvergoeding tegenover, conform Europese regelgeving. |
Geen |
|
Out |
Internist-vasculair geneeskunde (MST Enschede, fulltime) |
Klinisch Netwerk Obesitas (commissie NVE, lid) |
Van januari t/m juni 2020 heb ik één dag per week onbetaald verlof om de mogelijkheden te exploreren van het opzetten van een leefstijicentrum (bijvoorbeeld als anderhalvelijns centrum, al dan niet in naam van/in samenwerking met het MST). - Deelname aan deze richtlijncommissie kan mijn naam/reputatie als leefstijlarts versterken |
Geen |
|
Out-Hoiting |
Eigenaar Mijn leefstijl op recept
Vice-voorzitter BLCN (deel betaald, deel vrijwillig) |
Geen |
In mijn bedrijf maak ik oa producten voor GLI coaches. Deze coaches hebben belang bij een goed obesitasbeleid waarbij de GLI blijft bestaan. ik ben zelf geen GLI coach meer. |
Geen |
|
Sloots-Jongen |
Klinisch psycholoog bij Maasstad Ziekenhuis |
Geen |
Geen |
Geen |
|
Slot |
VvOCM Nicolette Slot eigen praktijk voor oefentherapie, wandeltrainer en leefstijlcoach |
Oefentherapeut Mensendieck - betaald leefstijlcoach - betaald wandeltrainer - betaald voorzitter Drunens Wandelfestival - niet betaald voorzitter Avond4daagse Drunen - niet betaald |
Geen |
Geen |
|
Van den Anker |
Freelance opdracht HR bij WijzijnMeo (bedrijfsnaam Blue Wolf) Bestuurslid NSOG (Nederlandse stichtijng over gewicht) - Patiëntenorganisatie (onbezoldigd) |
Bestuurslid Pon (onbezoldigd) |
Als bestuurslid van de patiëntenorganisatie voor mensen die leven met obesitas kan de richtlijn ter uitleg en informatie gebruikt worden voor de patiënten |
Geen |
|
Van Kemenade |
Waarnemend huisarts (huisartspraktijk Biesbosch Made) |
Auteur Consult HZG (huisartszorggroep Breda) betaald per uur bij werkzaamheden Creeeren scholingen/presentaties op het gebied Diabetes/leefstijl. Betaald per scholing/presentatie |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenverenigingen in de werkgroepen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Gecombineerde Leefstijl Interventie (GLI) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. Er wordt gestreefd naar passende zorg, waarbij per patiënt wordt bekeken of een intensievere behandeling nodig is. Dit leidt uiteindelijk tot reductie van kosten. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroep en de adviseurs knelpunten in de zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Tevens zijn er knelpunten aangedragen door AJN Jeugdartsen Nederland, Beroepsvereniging Gewichtsconsulenten Nederland, Beroepsvereniging Leefstijl Coaches Nederland, Care for Obesity (VU Amsterdam), Inspectie voor de Gezondheidszorg en Jeugd, Jongeren op Gezond Gewicht, GGD Har voor Brabant, Amsterdamse Aanpak Gezond Gewicht (GGD Amsterdam), Koninklijk Nederlands Genootschap voor Fysiotherapie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Koninklijke Nederlandse Maatschappij ter bevordering van de Tandheelkunde, Landelijke Verenging Medische Psychologie, Landelijke Huisartsen Vereniging, Nederlandse Associatie Physician Assistants, Nederlands Centrum Jeugdgezondheid, Nederlandse Diabetes Federatie, Nederlands Huisartsen Genootschap, Nederlandse Internisten Vereniging, Nederlands Jeugdinstituut, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging van Diëtisten, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging van Maag-Darm-Leverartsen, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Nederlandse Vereniging voor Cardiologie, Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging voor Plastische Chirurgie, Partnerschap Overgewicht Nederland, Pharos, Stichting over gewicht, Vereniging Gehandicaptenzorg Nederland, Voedingscentrum, Vereniging Vertrouwensartsen Kindermishandeling, Vereniging van Oefentherapeuten Cesar en Mensendieck, Zorginstituut Nederland en Zelfstandige Klinieken Nederland via een Invitational conference. Een verslag van de Invitational conference is opgenomen in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroepen besproken waarna de werkgroepen de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerden de werkgroepen ten minste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Gezien de hoge mate van uitval en terugval en daarmee het teruglopen van het percentage succesvolle resultaten na verloop van tijd zijn korte-termijn leefstijlinterventies weinig informatief voor de klinische praktijk. Vanwege het belang van een duurzaam effect zijn bij de selectie van de literatuur daarom alleen studies met een minimale duur van 2 jaar geïncludeerd bij de kinderrichtlijn (Reinehr, 2009).
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk die meegewogen dienen te worden, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.htMl Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H., Brożek J., Guyatt G., et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Reinehr, T., Widhalm, K., l'Allemand, D., Wiegand, S., Wabitsch, M., Holl, R. W., & APV‐Wiss Study Group and German Competence Net Obesity. (2009). Two‐year follow‐up in 21,784 overweight children and adolescents with lifestyle intervention. Obesity, 17(6), 1196-1199.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Wharton, S., Lau, D. C., Vallis, M., Sharma, A. M., Biertho, L., Campbell-Scherer, D., ... & Boyling, E. (2020). Obesity in adults: a clinical practice guideline. CMAJ, 192(31), E875-E891.
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp *Overweight/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. (342542) 2 exp "Weight Reduction Programs"/ or 'weight loss program*'.ti,ab,kf. or 'weight reduction program*'.ti,ab,kf. or ((lifestyle or 'life style') adj2 (program* or intervention* or therap*)).ti,ab,kf. (14595) 3 exp exercise/ or exp sports/ or exercise*.ti,ab,kf. or sport*.ti,ab,kf. or training.ti,ab,kf. or 'physical activit*'.ti,ab,kf. (898608) 4 exp diet/ or exp "diet therapy"/ or diet*.ti,ab,kf. or 'nutritional intervention*'.ti,ab,kf. or (calori* adj2 restriction).ti,ab,kf. (691933) 5 exp psychotherapy/ or ((behavio$r* or cogniti*) adj3 (therap* or training* or psychotherap* or modification* or treatment*)).ti,ab,kf. or cbt.ti,ab,kf. (232081) 6 1 and (2 or (3 and 4 and 5)) (9149) 7 (exp *exercise/ or exp *sports/ or exercise*.ti. or sport*.ti. or training.ti. or 'physical activit*'.ti.) and (exp *diet/ or exp *"diet therapy"/ or diet*.ti. or 'nutritional intervention*'.ti. or (calori* adj2 restriction).ti.) (10271) 8 1 and 7 (3708) 9 6 or 8 (12217) 10 Patient Care Team/ or combin*.ti,ab,kf. or multidisciplinary.ti,ab,kf. or 'multi component'.ti,ab,kf. or multicomponent.ti,ab,kf. or multiple.ti,ab,kf. or interdisciplinary.ti,ab,kf. (3111263) 11 9 and 10 (2916) 12 limit 11 to (english language and yr="2010 -Current") (2053) 13 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (457802) 14 12 and 13 (217) |
Zoekverantwoording
