Effectiviteit medicatie
Uitgangsvraag
Wat is de effectiviteit van medicatie in aanvulling op een gecombineerde leefstijlinterventie, in de behandeling van volwassenen met obesitas of overgewicht in combinatie met een vergrote buikomvang en/of comorbiditeit?
Aanbeveling
- Overweeg gewichtsreducerende medicatie toe te voegen aan een gecombineerde leefstijlinterventie bij mensen met obesitas (BMI ≥30 kg/m2) of overgewicht (BMI ≥27 kg/m2) in combinatie met een vergrote buikomvang en/of co-morbiditeit (zie voor concrete adviezen tabel 13.1). Maak een keuze op basis van effectiviteit, prijs en comorbiditeit (zie module ‘Gepersonaliseerde zorg’). Overweeg een GLP1-analoog bij patiënten met Diabetes Mellitus type 2.
- Houd rekening met de contra-indicaties en potentiële bijwerkingen bij de keuze van een gewichtsreducerend medicijn.
- Stop met orlistat, liraglutide, naltrexon/bupropion (gewichtsreducerende medicatie) als het gewichtsverlies na 12 weken gebruik van de maximaal verdraagbare dosis kleiner is dan 5%, conform de indicatiestelling in de bijbehorende SmPC.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn in Nederland meerdere medicijnen geregistreerd voor behandeling van overgewicht bij volwassenen: orlistat, liraglutide, semaglutide en naltrexon/bupropion. Deze zijn alle vier meegenomen in de analyse. Alle geïncludeerde studies hebben de medicatie vergeleken met placebo, doorgaans in combinatie met een intensieve gecombineerde leefstijlinterventie. De kwaliteit van het bewijs voor de cruciale uitkomstmaat gewicht is beoordeeld als redelijk, door inconsistentie in de studieresultaten, en risico of bias in de studieopzet. Uit de literatuuranalyse blijkt dat het gebruik van medicatie naast een GLI een hoger gewichtsverlies geeft na een jaar. In de geraadpleegde literatuur bij orlistat ligt het gemiddelde gewichtsverlies ten opzichte van placebo rond de 2,5 kg, bij naltrexon/bupropion en liraglutide 3 mg rond de 5 kg, bij de semaglutide 2,4 mg rond de 12 kg. Er zijn geen goede trials waarbij de middelen onderling zijn vergeleken. Op basis van deze literatuur lijkt semaglutide het meest effectief. Het is op basis van deze literatuur niet mogelijk om een keuze te maken tussen liraglutide en naltrexon/bupropion, of een inschatting te maken bij welke patiënt welk middel het beste zou kunnen werken.
Studies met betrekking tot liraglutide en semaglutide zijn uitgevoerd in een homogene groep. Uit deze studies kunnen we opmaken dat het middel niet bij iedereen even effectief werkt. Het behaalde gewichtsverlies kan variëren van zeer weinig tot een afname van meer dan 10% van het uitgangsgewicht. Als er na 12 weken behandeling in de onderhoudsdosering geen 5% gewichtsverlies is opgetreden wordt aanbevolen de behandeling stop te zetten. Het is voor liraglutide niet duidelijk wat de effecten zijn na de periode van het eerste jaar. Voor liraglutide zijn in een lagere dosis wel lange termijn data (3 jaar) beschikbaar bij patiënten met prediabtes, waaruit blijkt dat behaald gewichtsverlies met de daar gebruikte dosis behouden blijft. In de studies met betrekking tot liraglutide blijkt het gewichtsverlies vooral in het eerste half jaar plaats te vinden, daarna is er gemiddeld weer geringe gewichtstoename te zien. Ook bij semaglutide blijkt het gewichtsverlies vooral in het eerste half jaar plaats te vinden, bij gebruik tot 68 weken neemt het gewicht nog iets verder af.
Wat betreft comorbiditeiten laten de orlistat, liraglutide, semaglutide en naltrexon/buproprion verschillende effecten zien, maar deze verschillen zijn klein. In de praktijk kan een keuze gemaakt worden op basis van comorbiditeit, zoals een GLP1-analoog bij mensen met Diabetes Mellitus type 2 (voor de behandeling van Diabetes Mellitus type 2 zijn verschillende GLP1-analogen geregistreerd). Met betrekking tot naltrexon/bupropion is er nog weinig ervaring bij mensen met andere psychiatrische problemen, dus het gebruik in deze groep kan risicovol zijn. Bupropion moet worden vermeden bij tachycardie en/of Brugada syndroom omdat het kan leiden tot een afwijkend ECG, bij een verhoogd risico op convulsies en bij ernstige levercirrose. Naltrexon/bupropion kan bloeddrukverhogend werken en is daarom gecontraïndiceerd bij ongecontroleerdev hypertensie. Naltrexon/bupropion kent verschillende interacties. Gelijktijdige toediening van MAO-remmers is gecontraïndiceerd Het gaat het analgetische effect van opioïden tegen. Naltrexon/bupropion is daarom niet geschikt voor mensen die opioïden gebruiken. De blootstelling aan geneesmiddelen die worden gemetaboliseerd door CYP2D6 kan toenemen. Wees voorzichtig bij gelijktijdig gebruik van geneesmiddelen die CYP2D6 induceren en/of bij gelijktijdig gebruik van geneesmiddelen die CYP2D6 kunnen remmen. Met orlistat is voorzichtigheid geboden bij mensen met volume depletie en het wordt afgeraden bij chronisch malabsorptiesyndroom en cholestase. Orlistat vermindert de absorptie van thyreomimetica.
Overige
Een middel is niet meegenomen in de analyse, maar dient wel vermeld te worden. Metformine is geassocieerd met gewichtsverlies, maar dan vooral bij patiënten met diabetes of pre-diabetes. Een systemische review toonde aan dat metformine in de meeste studies leidde tot een significantie gewichtsreductie ten opzichte van placebo. Deze afname was in de meeste gevallen minder dan gezien bij liraglutide en naltrexon/bupropion. Een bijkomend voordeel van metformine bij patiënten met pre-diabetes is dat het beschermt tegen progressie naar Diabetes Mellitus type 2. Hoewel metformine niet geregistreerd is voor gebruik als middel tegen obesitas valt het te overwegen om te gebruiken bij patiënten met een vorm van insulineresistentie/pre-diabetes. Ook bij PCOS zijn gunstige effecten beschreven (maar dit valt buiten deze richtlijn).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Liraglutide en semaglutide veroorzaken bij meer dan 10% misselijkheid en diarree, maar dat neemt af binnen enkele dagen of weken. Verder is pancreatitis gemeld als ernstige zeldzame bijwerking. Ook Naltrexon/bupropion veroorzaakt bij meer dan 10% van de mensen maagdarm klachten. Daarnaast kan het tot klachten leiden als slapeloosheid, angst en nervositeit. Als ernstige zeldzame bijwerking zijn convulsies gemeld bij bupropion. Orlistat geeft ook bij meer dan 10% van de mensen maagdarmstoornissen, waaronder olieachtige spotting uit het rectum. Ernstige hepatitis is gemeld als ernstige zeldzame bijwerking.
Bupropion kan leiden tot (toename van) slapeloosheid. Om deze reden wordt bij andere indicaties aangeraden het in de ochtend in te nemen. Naltrexon/bupropion dient echter tweemaal daags ingenomen te worden. Ook liraglutide kan slapeloosheid veroorzaken, maar dit is vooral tijdens de eerste 3 maanden van de behandeling.
Alleen van liraglutide en semaglutide is er enig bewijs dat de kwaliteit van leven beter is in combinatie met een GLI, vergeleken met alleen een GLI.
Liraglutide en semaglutide worden subcutaan toegediend, terwijl naltrexon/bupropion en orlistat oraal worden ingenomen.
Tot slot is de richtlijncommissie zich er terdege van bewust dat voorschrijven van medicatie bij de behandeling van obesitas genuanceerd ligt. Enerzijds zal de voorschrijver moeten overwegen dat uit de beschikbare onderzoeken blijkt dat toevoeging van medicatie aan een GLI toegevoegde waarde kan hebben in de behandeling van obesitas. Anderzijds is het niet wenselijk dat medicatie ingezet wordt als ‘monotherapie’ bij de behandeling van obesitas. Dit vraagt om een weloverwogen professionele overweging ten aanzien van de meerwaarde van toevoeging van gewichtsreducerende medicatie in de totale behandeling van obesitas.
Kosten (middelenbeslag)
Met betrekking tot de kosten van de verschillende medicatie is er een duidelijk verschil waarneembaar. In de standaarddoseringen bij deze indicatie ligt de inkoopprijs (februari 2021) exclusief btw van liraglutide rond de 7 euro per dag, van naltrexon/bupropion rond de 3,50 euro per dag en van de Orlistat rond de 2 euro per dag. Van de semaglutide zijn de kosten nog niet bekend. De daadwerkelijke kosten zullen afwijken vanwege de bijkomende kosten met betrekking tot de btw en een aflevertarief. Bij de behandeling van obesitas met liraglutide of semaglutide bij mensen met diabetes, zullen de middelen zowel helpen voor gewichtsverlies als voor de behandeling van de diabetes. Hierdoor kan de behandeling van de diabetes goedkoper uitkomen.
Aanvaardbaarheid, haalbaarheid en implementatie
Het effect van medicatie als aanvulling op GLI is onder andere afhankelijk van therapietrouw. In studies met betrekking tot liraglutide wordt een correlatie waargenomen tussen adherence aan het aantal geplande contactmomenten met de begeleiding van een GLI en het behaalde gewichtsverlies. Dit pleit ervoor om de behandeling niet te starten of voort te zetten als er geen begeleide GLI gevolgd kan worden. Bij mensen bij wie de leefstijl al zodanig is dat er geen verbetering meer te verwachten is met een GLI, kan ook zonder GLI gewichtsreducerende medicatie overwogen worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Overweeg toevoegen van medicatie aan een GLI bij mensen met obesitas of ernstig overgewicht in combinatie met een vergrote buikomvang en/of comorbiditeit. Orlistat, liraglutide, semaglutide en naltrexon/bupropion helpen, wanneer gecombineerd met een GLI, om meer gewicht te verliezen en het is waarschijnlijk goed mogelijk om na relatief korte tijd te beoordelen of de middelen effectief zijn. Voor orlistat, liraglutide en naltrexon/bupropion geldt dat gestopt dient te worden met deze gewichtsreducerende medicatie als het gewichtsverlies na 12 weken gebruik van de maximaal verdraagbare dosis kleiner is dan 5%. Indien er minder dan 5% gewichtsafname is bereikt maar wel duidelijke verbeteringen zijn opgetreden in de lichaamssamenstelling (afname vetmassa en toename spiermassa) en (bijvoorbeeld cardiometabole) comorbiditeiten, overweeg om de proefperiode met medicatie enkele maanden te verlengen.
Maak een keuze op basis van effectiviteit, prijs en comorbiditeit.
Semaglutide, liraglutide en naltrexon/bupropion zijn effectiever dan Orlistat. In de geïncludeerde studies staan geen vergelijkende onderzoeken tussen liraglutide en semaglutide. Uit onderzoek ten opzichte van placebo lijkt semaglutide effectiever dan liraglutide. Met betrekking tot prijs per dagelijks aanbevolen dosis zijn de bedragen hoog en de verschillen groot. Er zijn voor liraglutide, naltrexon/bupropion en orlistat geen gegevens over gebruik gedurende meer dan 1 jaar bij deze indicatie, maar bij patiënten met prediabetes lijkt het gewichtsverlies met liraglutide gedurende een langere periode te blijven. Voor semaglutide is de werking gedurende 68 weken aangetoond. Op dit moment is er nog te weinig literatuur beschikbaar om op te maken in welke situaties deze middelen het beste ingezet zouden kunnen worden. Wel kan een keuze gemaakt worden op basis van contra-indicaties. Vooral bij een risico op convulsies en bij psychiatrische of verslavingsproblematiek lijkt naltrexon/bupropion geen goede keuze.
Onderbouwing
Achtergrond
Er zijn in Nederland vermoedelijk heel wat mensen die in aanmerking kunnen komen voor gewichtsreducerende medicatie, omdat leefstijlaanpassingen bij hen onvoldoende effect hebben. Velen zullen voor aanvullende behandelingen in aanmerking komen, zoals farmacotherapie of metabole chirurgie. Desondanks wordt deze medicatie maar zeer beperkt voorgeschreven. Er is onduidelijkheid over welke patiënten het meest gebaat zijn bij medicatie, wat het beste moment is om te starten, kosteneffectiviteit en lange termijneffecten.
Introduction
There are probably quite a few people in the Netherlands who would qualify for weight-reducing medication, because lifestyle changes have insufficient effect on them. Many patients are eligible for additional treatments, such as pharmacotherapy or bariatric surgery. Nevertheless, this medication is only prescribed to a very limited extent. There is uncertainty about which patients would benefit from weight-reducing medication, the best time to start medication use, cost-effectiveness, and long-term effects.
Conclusies / Summary of Findings
|
Moderate GRADE |
Weight loss
It is likely that liraglutide, orlistat, and naltrexon-bupropion result in larger weight loss at 52 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Singh, 2020; Khera, 2016, Chao, 2019; Wadden, 2020 |
|
Moderate GRADE |
It is likely that semaglutide results in a larger weight loss at 68 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Zhong, 2022; Davies, 2021 |
|
Low GRADE |
It is likely that liraglutide, orlistat and naltrexon-bupropion may result in larger reduction in waist circumference at 52 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Khera, 2018 |
|
Moderate GRADE |
It is likely that semaglutide results in a larger reduction in waist circumference at 68 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Zhong, 2022; Davies, 2021 |
|
Very Low GRADE |
Health-related quality of life
It is unclear what the effect is of liraglutide on health-related quality of life at 52 weeks of follow-up compared to intensive behavioural therapy alone, in adults with obesity or overweight.
Sources: Chao, 2019 |
|
Very low GRADE |
Weight-related quality of life
It is unclear what the effect is of liraglutide on improving weight-related quality of life at 52 weeks of follow-up compared to intensive behavioural therapy alone, in adults with obesity or overweight.
Sources: Chao, 2019 |
|
low GRADE |
Semaglutide may improve weight-related quality of life at 68 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Davies, 2021 |
|
Moderate GRADE |
Comorbidities
Liraglutide and orlistat result in a larger reduction of glucose at 52 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Khera, 2018; Wadden, 2020 |
|
Low GRADE |
Liraglutide may result in a larger reduction of Hb1Ac at 52 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Khera, 2018; Wadden, 2020 |
|
Moderate GRADE |
Semaglutide likely reduces glucose and Hb1Ac at 68 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Zhong, 2022; Davies, 2021 |
|
Low GRADE |
Semaglutide may result in a larger reduction of Hb1Ac at 52 weeks follow-up compared to placebo, in adults with obesity or overweight.
Sources: Khera, 2018; Wadden, 2020 |
|
Low GRADE |
Orlistat may result in a larger reduction of LDL-cholesterol at 52 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Khera, 2018; Wadden, 2020 |
|
Low GRADE |
Semaglutide may result in a larger reduction of LDL-cholesterol at 68 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Zhong, 2022; Davies, 2021 |
|
Moderate GRADE |
It is likely that naltrexon-bupropion results in larger increase of HDL-cholesterol at 52 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Khera, 2018; Wadden, 2020 |
|
Low GRADE |
Orlistat and liraglutide may result in a larger reduction of systolic blood pressure at 52 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Khera, 2018; Wadden, 2020 |
|
Low GRADE |
It is likely that orlistat and liraglutide may result in a larger reduction of diastolic blood pressure at 52 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Khera, 2018; Wadden, 2020 |
|
Moderate GRADE |
It is likely that semaglutide may result in a larger reduction of systolic and diastolic blood pressure at 68 weeks follow-up compared to placebo, in adults with obesity or overweight
Sources: Zhong, 2022; Davies, 2021 |
Samenvatting literatuur
Description of studies
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Khera (2016) compares weight loss among drug treatments for obesity and covers literature until March 2016. Khera (2016) includes 28 RCTs comparing orlistat (16 trials), lorcaserin (3 trials), naltrexon-bupropion (4 trials), phentermine-topiramate (2 trials), liraglutide (2 trial) against placebo. One three-group trial was included comparing liraglutide and orlistat against placebo. The study size of the included trials varied from 220 to 3.731 participants. The outcomes were the proportion of participants achieving at least 5% weight loss from baseline, and the proportion of participants with at least 10% weight loss and change in weight from baseline. The median of the average age of study participants was 45,9 years (range of average age, 40.0–59.8 years) and 74% of participants were women (range, 45%–92%). The median of average body mass index (BMI) of patients was 36.1 kg/m2 (range, 32.6–42.0) and the median of average baseline weight was 100.5kg (range, 95.3–115.8kg). The risk of bias of individual studies was assessed using the Cochrane Risk of Bias assessment tool. Overall, studies were considered to be at high risk of bias, with attrition rates of 30% to 45% in all trials (see Figure 2; Khera, 2016). This literature analysis only focuses on the effect of orlistat, naltrexon- bupropion, and liraglutide as drug treatment for obesity, since use of phentermine-topiramate and lorcaserin is not approved in the Netherlands. Specific baseline characteristics for these trials are included in the evidence table.
Singh (2020) compares weight loss among drug treatments for obesity using a and covers literature until September 2019. Singh (2020) includes 31 RCTs comparing orlistat (17 trials), lorcaserin (4 trials), naltrexon-bupropion (4 trials), phentermine-topiramate (2 trials), liraglutide (4 trial) against placebo. The study size of the included trials varied from 45 to 12,000 participants. The outcome was a reduction in body weight (in kilograms) compared to a placebo at the end of 1-year follow-up. The risk of bias in individual studies was assessed in the context of the outcome using the Cochrane Risk of Bias assessment tool on seven domains that include – random sequence generation, allocation concealment, blinding of participants and personnel, blinding of outcome assessment, incomplete outcome data, selective reporting, and other bias. Overall, studies were considered to be at high risk of bias, due to incomplete data as a result of attrition bias (see Table S1; Singh, 2020). Specific baseline characteristics for orlistat, naltrexon-bupropion, and liraglutide are included in the evidence table.
Khera (2018) compares the effect of weight loss medication on cardiovascular risk profiles in adults with obesity using a systematic review and network meta-analysis and covers literature until February 2017. Khera (2018) includes 28 RCTs comparing orlistat (16 trials), lorcaserin (3 trials), naltrexon-bupropion (4 trials), phentermine-topiramate (2 trials), liraglutide (2 trials) against placebo. One three-group trial was included comparing liraglutide and orlistat against placebo. The study size of the included trials varies from 220 to 3.731 participants. Outcomes were assessed at one year of follow-up. The outcomes were defined a priori and included: glucose profile – fasting blood glucose (mg/dL) and/or HbA1c; markers of lipoprotein metabolism – low-density lipoprotein (LDL)-cholesterol (mg/dL), high-density lipoprotein(HDL)-cholesterol (mg/dL); systolic and diastolic blood pressure (mmHg); and central adiposity, assessed using waist circumference (cm). The median age of study participants across studies was 46 years (range 41–60) and 77% (range 45–90) were women. The median baseline BMI was 36.1 kg/m2 (range 32.7–42.0). The baseline median fasting blood glucose was 105,6 mg/dL (interquartile range [IQR, 94.6–161.5) and hemoglobin A1c was 7,9% (IQR, 5.7–8.1). The median baseline LDL-cholesterol was 122.7mg/dL (IQR, 112.9–137.2) and HDL-cholesterol was 46.4mg/dL (IQR, 45.5–51.3); median 34.5% (IQR, 10.3–52.5) participants had dyslipidemia. Median average systolic blood pressure was 127.5mmHg (IQR, 121.9–135.8) and diastolic blood pressure was 79.1mmHg (IQR, 77.5–84.2) at baseline; median 23% (IQR, 17–36) participants had hypertension at baseline. Waist circumference was 110cm (IQR, 109–115) at baseline. The risk of bias of individual studies was assessed using the Cochrane Risk of Bias assessment tool. Overall, studies were considered to be at high risk of bias, with attrition rates of 30% to 45% in all trials (See table 8; Khera, 2018). Specific baseline characteristics for orlistat, naltrexon-bupropion and liraglutide are included in the evidence table.
Chao (2019) conducted a single-site, open-label, parallel-group design RCT on the effect of liraglutide combined with intensive behavioural therapy (IBT) on weight loss and quality of life compared to a multicomponent group and a IBT alone group (IBT combined with placebo). The RCT by Chao (2019) is of moderate quality (see table of quality assessment) and was commercially sponsored by Novo Nordisk. Chao (2019) included adults aged 21-70 years; body mass index (BMI) of 30-55 kg/m2; and prior lifetime weight-loss effort with diet and exercise (n=150). All participants received 21 sessions of IBT and were instructed to engage in low-to-moderate intensity physical activity 5 days per week, gradually. Participants who weighed <113.6 kg were prescribed a diet of 1200- 1499 kcal/day, while those ≥113.6 kg received 1500-1800 kcal/day. Outcomes include weight loss, health-related quality of life, and weight-related quality of life. The 150 participants included 67 (44.7%) individuals who identified as black and 119 (79.3%) women. The total sample had a mean age of 47.6 (SD=11.8) years, a weight of 108.4 (SD=17.5) kg, and a BMI of 38.4 kg/m2 (SD=4.9). Baseline scores did not differ significantly among treatment groups. At baseline, 28% of the sample had class I obesity, 36.0% had class II and 36% had class III.
Wadden (2020) conducted a 56-week, randomized, double-blind, placebo-controlled, two-armed, multicenter phase 3b trial. The primary objective of the trial was to compare the effect of liraglutide 3.0 mg versus placebo, as an adjunct to standard-based IBT, on weight loss in individuals with obesity. The RCT by Wadden (2020) is of moderate quality (see table of quality assessment) and was commercially sponsored by Novo Nordisk. Wadden (2020) included adults aged ≥ 18 years, with stable body weight and BMI ≥30 kg/m2 (n=282). Participants were randomized to treatment with liraglutide combined with IBT (liraglutide-IBT; n=142) or a placebo combined with IBT (placebo-IBT; n=140). The primary outcomes were change in body weight (percent) from baseline to week 56 and the proportion of participants who lost ≥ 5% of baseline body weight. Secondary outcomes included the proportion of participants who lost > 10% or > 15% of baseline body weight at week 56. Of the 142 participants included in the liraglutide-IBT arm 78.9% of individuals were identified as white and 16.2% were male. The liraglutide-IBT arm had a mean age of 45.4 (SD=11.6) years, the weight of 108.5 kg (SD=22.1), and a BMI of 39.3 kg/m2 (SD=6.8). Of the 140 participants included in the placebo-IBT arm 82.1% of individuals were identified as white and 17.1% were male. The placebo-IBT arm had a mean age of 49.0 (SD=11.2) years, the weight of 106.7 kg (SD=22.0), and a BMI of 38.7 kg/m2 (SD=7.2). Baseline scores did not differ significantly among treatment groups.
Semaglutide vs placebo
Zhong (2022) conducted a systematic review and meta-analysis assessing the efficacy and safety of once-weekly semaglutide among adults with overweight or obesity. Zhong (2022) covers the literature until July 2021. Literature searches were conducted in MEDLINE, EMBASE, and Cochrane Central Register of Controlled Trials. Zhong (2022) included randomized controlled trials which enrolled adults (≥18 years old) with a body-mass index of 27 kg/m2 or higher and without diabetes and compared once-weekly semaglutide and placebo. In total, 4 studies were included. All included studies were randomized double-blind trials that compared the treatment effect of once-weekly subcutaneous semaglutide 2.4 mg with placebo in patients with overweight or obesity. Article quality of individual studies was assessed using the Cochrane Collaboration’s Risk of Bias tool. The primary outcomes were the percentage change and absolute change in body weight from baseline. Secondary outcomes included achievement of categorical weight loss targets (at least 5, 10, 15, or 20%) and change from baseline in waist circumference, body-mass index, glycated hemoglobin (HbA1c), fasting plasma glucose (FPG), systolic and diastolic blood pressure, physical functioning score on the 36-item Short-form Health Survey (SF-36), the SF-36 physical and mental component summary scores, and lipid profiles (total cholesterol, high-density lipoprotein (HDL), low-density lipoprotein (LDL), and triglycerides).
Davies (2021) conducted an double-blind, double-dummy, phase 3, superiority study evaluating the efficacy and safety of once a week subcutaneous semaglutide 2.4 mg versus semaglutide 1.0 mg (the dose approved for diabetes treatment) and placebo for bodyweight management in adults with overweight or obesity. Included were adults (≥18 years old) with a body-mass index of 27 kg/m2 or higher that reported at least one unsuccessful dietary effort to lose weight and who were diagnosed with diabetes at least 180 days before screening. Patients were randomly assigned (1:1:1) to semaglutide 2.4 mg, semaglutide 1.0 mg, or placebo. In total, 404 patients were allocated to the semaglutide 2.4 mg group (mean age 55 ± 11 years; mean BMI 35.9 ± 6.4 kg/m2; 55.2% female), 403 were allocated to the semaglutide 1.0 mg group (mean age 56 ± 10 years; mean BMI 35.3 ± 5.9 kg/m2; 50.4% female) and 403 were allocated to the placebo group (mean age 55 ± 11.0 years; mean BMI 35.3 ± 6.4 kg/m2; 47.1% female). Patients received semaglutide 2.4 mg or semaglutide 1.0 mg or placebo once a week for 68 weeks, plus a lifestyle intervention, followed by 7 weeks without treatment. Semaglutide was started at 0,25 mg per week and escalated in a fixed-dose regimen every 4 weeks until the target dose was reached. The lifestyle intervention involved counselling on diet (500 kcal per day reduction relative to the estimated total daily energy expenditure calculated at time of random allocation) and physical activity (150 min per week). Outcomes (semaglutide 2.4 mg vs placebo), were percentage change in bodyweight from baseline to week 68 and loss of at least 5% of baseline weight at week 68 (semaglutide 2,4 mg vs placebo), proportions of patients achieving bodyweight reductions of at least 10% or 15% at week 68, change from baseline to week 68 in waist circumference, change from baseline to week 68 in HbA1c, systolic and diastolic blood pressure, SF-36v2 physical functioning score, and IWQOL-Lite-CT physical function score.
Results
Weight loss
Orlistat, liraglutide, naltrexon-bupropion vs placebo
In the direct pairwise meta-analysis by Khera (2016), weight loss compared with placebo at one year (52+4weeks) resulted in a mean difference (MD) of MD=2.6 kg (95% CI 2.3 to 2.9) with orlistat, MD=5.0 kg (95% CI 4.4 to 5.5 kg) with naltrexon-bupropion, and MD=5.2kg (95% CI 4.9 to 5.6) with liraglutide (see Figure 8.1).
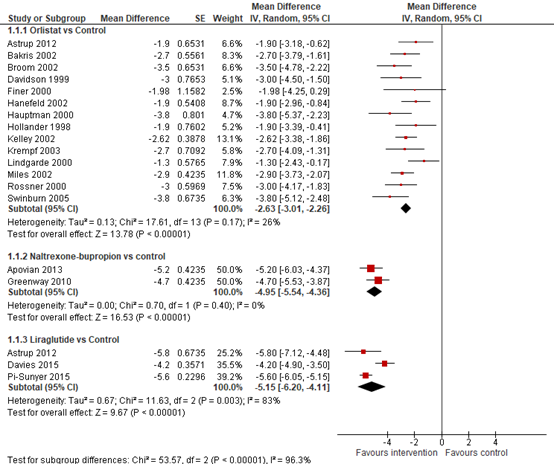
Figure 8.1 Forrest plot showing the effect of orlistat, naltrexon-bupropion, and liraglutide on weight in comparison to placebo. Mean differences, random-effects model (Khera, 2016).
In a direct meta-analysis by Khera (2016), all agents were associated with higher odds of achieving clinically relevant weight loss. Odds of achieving 5% weight loss from baseline compared with placebo at one year (52+4weeks) were OR=2.69 (95% CI 2.31to 3.12) for orlistat, OR=3.90 (95% CI 2.43 to 6.26) for naltrexon-bupropion, and OR=5.19 (95% CI 2.95 to 9.15) for liraglutide (See Figure 8.2). All agents were also associated with higher odds of at least 10% weight loss from baseline compared with placebo at one year (52+4weeks) with OR=2.41 (95% CI 2.05 to 2.83) for orlistat, OR=4.11 (95% CI 2.22 to 7.63) for naltrexon-bupropion, and OR=4.57 (95% CI 2.43 to 8.58) for liraglutide (See Figure 8.3).
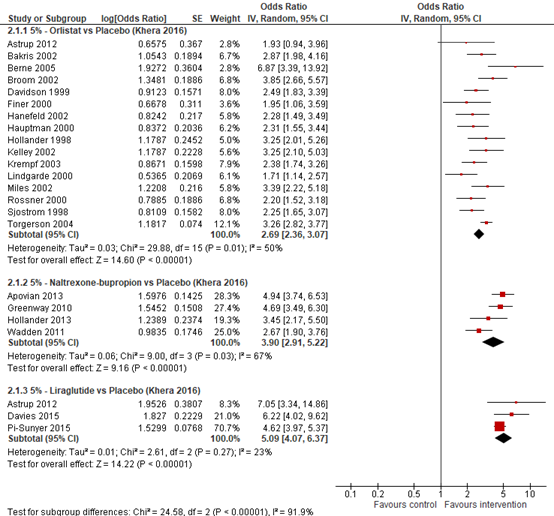
Figure 8.2 Forrest plot showing the odds of patients achieving 5% weight loss using orlistat, naltrexon and liraglutide in comparison to placebo. Odds ratio, random effects model (Khera, 2016).
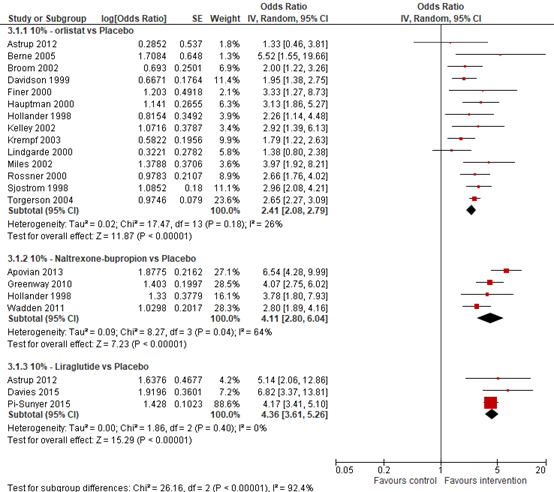
Figure 8.3. Forrest plot showing the odds of patients achieving 10% weight loss using naltrexon-bupropion in comparison to placebo. Odds ratio, random effects model (Khera, 2016).
Network meta-analysis demonstrated that significantly more patients treated with liraglutide (OR=2.06; 95% CI 1.51 to 2.96) and naltrexon-bupropion (OR=1.47; 95% CI 1.09 to 1.96) had achieved at least 5% weight loss compared. More patients treated with liraglutide also achieved 5% weight loss compared to naltrexon-bupropion (OR=1.4; 95% CI 0.96 to 2.18), but this difference was not statistically significant (Figure 8.4)
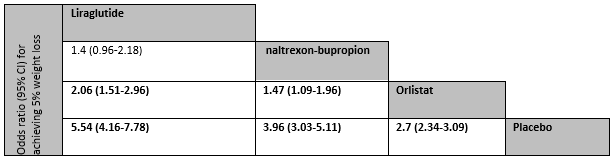
Fig 8.4. Comparing the proportion achieving 5% weight loss in network meta-analysis. Odds ratios for comparisons are in the cell in common between the column-defining and row-defining treatment. (Khera, 2016)
In the meta-analysis by Singh (2020) significant reduction in body weight compared to baseline was observed for orlistat (mean difference, MD=−3.07Kg; 95% CI −3.76 to −2.37), naltrexon-bupropion (MD=−4.39Kg; 95% CI −5.05 to −3.72) and liraglutide (MD=−5.25Kg; 95% CI −6.17 to −4.32), compared to placebo (See Figure 8.5).
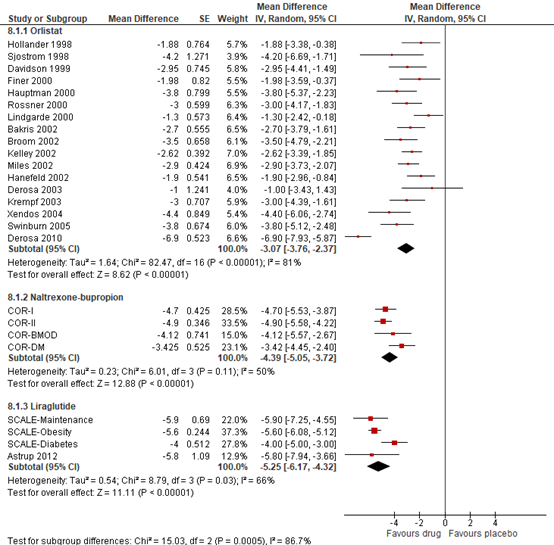
Figure 8.5 Forrest plot showing the effect of orlistat, naltrexon-bupropion, and liraglutide on weight in comparison to placebo. Mean differences, random-effects model (Singh, 2020).
Chao (2019) reported that weight loss in the IBT liraglutide (11.5%; SD=1.3%; P=0.005) and multicomponent (11.8%; SD=1.3%; P=0.003) groups were significantly greater compared to IBT alone (6.1; SD=1.3%). At week 52, 44% of participants in IBT-alone, 70% in IBT-liraglutide and 74% in multicomponent achieved clinically relevant weight loss of ≥5% of initial weight; 26%, 46%, and 52% of these participants, respectively, lost ≥10% of initial weight.
Wadden (2020) estimated mean weight change at week 56 was −7.5% for liraglutide-IBT and −4.0% for placebo-IBT. The estimated mean difference (MD) between groups was MD=−3.4%; (95% CI −5.3% to −1.6%). A higher proportion of 61.5% of participants achieved clinically relevant weight loss of ≥ 5% at 56 weeks with liraglutide-IBT compared to 38.8% of participants with placebo-IBT (OR 2.5%; 95% CI 1.5% to 4.1%). The proportions who lost > 10% were 30.5% (liraglutide-IBT) and 19.8% (placebo-IBT), and the proportions who lost > 15% were 18.1% (liraglutide-IBT) and 8.9% (placebo-IBT).
Semaglutide vs placebo
Two studies reported on the effect of 2.4 mg semaglutide on the percentage change from baseline in bodyweight compared to placebo (Zhong, 2022; Davies, 2021). One study was published after the systematic review by Zhong (2022) and was used to update the meta-analysis.
Zhong (2022) included 3 RCTs (3375 patients) comparing 2.4 mg semaglutide with placebo that reported on the percentage change from baseline in bodyweight. The pooled mean difference (MD) was -12.57% (95% CI -14.80 to -10.35; Figure 6) in favour of semaglutide. In addition, Zhong included 4 RCTs (3345 patients) comparing 2.4 mg semaglutide with placebo that reported on the absolute change from baseline in bodyweight. The pooled mean difference (MD) was -11.90% (95% CI -13.24 to -10.56; Figure 6) in favour of semaglutide
Davies (2021) found an mean weight loss of -9.64% + 8.04% in the semaglutide group compared to -3.42% + 8.03% in the placebo group. The MD was -6.22% (95% -7.33 to -5.11; Figure 8.6).
In summary, there were 4 RCTs (4252 patients) comparing 2.4 mg semaglutide with placebo that reported the percentage change from baseline in bodyweight. The pooled MD was -10.94% (95% CI -14.67 to -7.21; Figure 6) in favour of semaglutide. This is a clinically relevant difference. 4 RCTs (3345 patients) reported absolute change from baseline in bodyweight.
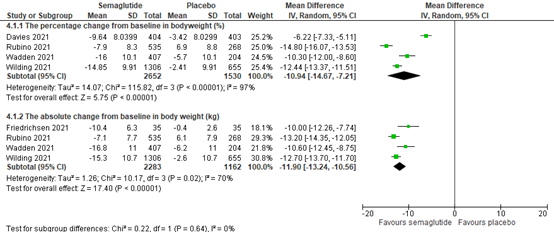
Figure 8.6 Forrest plot showing the effect of semaglutide on absolute weight change from baseline in comparison to placebo. Mean differences, random-effects model.
In addition, two studies reported on the effect of 2.4 mg semaglutide on achieving clinically relevant weight loss of 5% and 10% from baseline compared to placebo (Zhong, 2022; Davies, 2021). One study was published after the systematic review by Zhong (2022) and was used to update the meta-analysis.
Zhong (2022) included 3 RCTs (3121 patients) and found that semaglutide was associated with achieving clinically relevant weight loss of 5% (RR=2.11; 95% CI 1.59 to 2.78) and 10% (RR=3.98; 95% CI 2.58 to 6.13) from baseline compared with placebo (See Figure 7).
Davies (2021) found that semaglutide was associated with achieving clinically relevant weight loss of 5% (RR=8.35; 95% CI 5.92 to 11.77) and 10% (RR=5.53; 95% CI 3.88 to 7.89; figure 7) from baseline compared to placebo.
In summary, there were 4 RCTs (3885 patients) that reported achieving 5% and 10% weight loss compared to baseline. They found 2098/2493 events in the semaglutide group compared to 422/1392 in the placebo group of patients achieving 5% weight loss. The RR was 2.88 (95% CI 1.85 to 4.46; Figure 7) in favour of semaglutide. Moreover, they found 1707/2493 events in the semaglutide group and 202/1392 in the placebo group of patients achieving 10% weigh loss. The RR was 4.29 (95% CI 3.00 to 6.12; Figure 8.7) in favour of semaglutide.
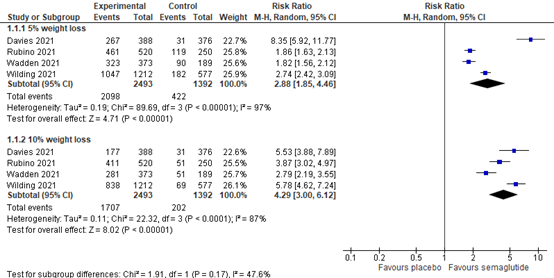
Figure 8.7 Forrest plot showing the effect semaglutide on achieving 5% and 10% weight loss from baseline in comparison to placebo. Risk Ratio, random-effects model.
Quality of life
Health-related quality of life
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Chao (2019) used the SF-36 short form health survey to assess health-related quality of life in participants treated with IBT combined with liraglutide (IBT-liraglutide), multicomponent IBT combined with liraglutide (multicomponent) and IBT combined with placebo (IBT-alone). The SF-36 scale creates two summary measures: (1) a physical component summary and (2) a mental component summary, as well as eight subscales. Scores are transformed using a 0 to 100 scale, with higher scores indicating better health related quality of life. Changes from baseline ≥3.8 points on the SF-36 physical component summary score or ≥4.6 points on the SF-36 mental component summary score are considered clinically relevant. From baseline to week 50, compared to IBT-alone, IBT-liraglutide had significantly greater improvements in bodily pain and mental health, while multicomponent had significantly greater improvements in mental component summary, bodily pain, social functioning, role emotion and mental health (see table 8.1). At week 52, 50% of participants in IBT-alone, 34% in IBT-liraglutide and 48% in multicomponent had clinically relevant improvements in the PCS score; 32%, 42% and 44% of these participants, respectively, reported clinically relevant improvements on the mental components summary score. There were no statistically significant differences between groups in the percent of participants with clinically relevant improvements in physical- or mental component scores.
Table 8.1 Estimated mean (±SE) changes in health-related quality of life at 52 weeks, as measured from randomization, in the intention-to-treat population (N = 150)
|
|
|
|
|
P-value |
|
|
|
IBT-alone (N=50) |
IBT+liraglutide (N=50) |
Multicomponent N=50) |
IBT-liraglutide vs IBT alone |
Multicomp. Vs IBT alone |
|
Physical component summary |
|||||
|
Week 52 |
+4.4 (SE=1.0) |
+2.1 (SE=1.0) |
+3.4 (SE=1.0) |
0.11 |
0.41 |
|
Mental component summary |
|||||
|
Week 52 |
+0.8 (SE=1.3) |
+4.5 (SE=1.3) |
+6.4 (SE=1.3) |
0.48 |
0.003 |
|
Physical functioning |
|||||
|
Week 52 |
+8.2 (SE=2.9) |
+10.3 (SE=2.9) |
+7.9 (SE=3.0) |
0.60 |
0.95 |
|
Role physical |
|||||
|
Week 52 |
+5.8 (SE=4.7) |
+6.8 (SE=4.6) |
+16.0 (SE=4.7) |
0.88 |
0.12 |
|
Bodily pain |
|||||
|
Week 52 |
+11.1 (SE=2.9) |
−1.2 (SE=2.9) |
+4.0 (SE=2.9) |
0.003 |
0.09 |
|
General health |
|||||
|
Week 52 |
+5.4 (SE=2.2) |
+10.1 (SE=2.2) |
+8.8 (SE=2.2) |
0.13 |
0.28 |
|
Vitality |
|||||
|
Week 52 |
+14.2 (SE=2.9) |
+11.0 (SE=2.8) |
+15.6 (SE=2.8) |
0.43 |
0.71 |
|
Social functioning |
|||||
|
Week 52 |
+5.2 (SE=3.5) |
+6.8 (SE=3.4) |
+17.4 (SE=3.4) |
0.75 |
0.01 |
|
Role emotion |
|||||
|
Week 52 |
−0.9 (SE=4.9) |
+9.3 (SE=4.9) |
+16.2 (SE=4.9) |
0.14 |
0.01 |
|
Mental health |
|||||
|
Week 52 |
+0.9 (SE=2.6) |
+9.6 (SE=2.6) |
+8.0 (SE=2.6) |
0.02 |
0.05 |
Values shown are means (±SE). For each variable, the three treatment groups were compared using pair-wise comparisons. Abbreviations: IBT, intensive behavioural therapy.
Weight-related quality of life
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Chao (2019) used the 31-item impact of weight quality of life-Lite scale to assess weight-related quality of life among participants in the IBT-liraglutide, multicomponent, and IBT-alone arms. Scores range from 0 to 100, with 0 representing the worst quality of life and 100 representing the best. A change of 7.7 to 12 points on the total score represents a clinically relevant change. From baseline to week 52, compared to IBT-alone, IBT-liraglutide significantly had significantly greater improvements in public distress, while multicomponent had significantly greater improvements in total score, and public distress (see Table 2). At week 52, 44.4% of IBT-alone, 64.4% of IBT-liraglutide, and 65.2% of multicomponent participants achieved clinically relevant improvements in weight-related quality of life (as measured by the total score). After covariate adjustment, compared to participants in IBT-alone, the odds of achieving clinically relevant improvements in total weight-related quality of life were significantly greater for individuals in IBT-liraglutide (adjusted odds ratio (OR) = 2.4; 95% CI 1.02 to 5.8; P = 0.046) and in multicomponent (adjusted OR = 2.4; 95% CI 1.01 to 5.6; P = 0.047).
Table 8.9 Estimated mean (±SE) changes in weight-related quality of life at 52 weeks, as measured from randomization, in the intention-to-treat population (N = 150)
|
|
|
|
|
P-value |
|
|
|
IBT-alone (N=50) |
IBT+liraglutide (N=50) |
Multicomponent N=50) |
IBT-liraglutide vs IBT alone |
Multicomp. Vs IBT alone |
|
Total score |
|||||
|
Week 52 |
+12.3 (SE=2.1) |
+15.8 (SE=2.1) |
+19.4 (SE=2.1) |
0.24 |
0.02 |
|
Physical function |
|||||
|
Week 52 |
+14.4 (SE=2.5) |
+17.4 (SE=2.5) |
+18.6 (SE=2.5) |
0.40 |
0.24 |
|
Self-esteem |
|||||
|
Week 52 |
+16.1 (SE=3.4) |
+22.0 (SE=3.4) |
+25.4 (SE=3.4) |
0.22 |
0.05 |
|
Sexual life |
|||||
|
Week 52 |
+14.1 (SE=3.3) |
+12.0 (SE=3.3) |
+22.1 (SE=3.3) |
0.65 |
0.09 |
|
Public distress |
|||||
|
Week 52 |
+3.2 (SE=2.7) |
+10.9 (SE=2.7) |
+14.8 (SE=2.7) |
0.04 |
0.03 |
|
Work |
|||||
|
Week 52 |
+9.7 (SE=2.5) |
+9.3 (SE=2.5) |
+14.5 (SE=2.5) |
0.91 |
0.18 |
Values shown are means (±SE). For each variable, the three treatment groups were compared using pair-wise comparisons. Abbreviations: IBT, intensive behavioural therapy.
Semaglutide vs placebo
Davies (2021) used the 31-item impact of weight quality of life-Lite scale to assess weight-related quality of life among participants in the semaglutide 2.4 mg and placebo group. Scores range from 0 to 100, with 0 representing the worst quality of life and 100 representing the best quality of life. They found that the semaglutide group showed a change from baseline to week 68 of 10.1 + 19.7 compared to 5.3 + 21.3 for the placebo group. The MD was 4.80 (95% CI 1.89 to 7.71) in favour of the semaglutide group, but this difference was not clinically relevant.
Comorbidities
Effects on blood glucose profile
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Using meta-analysis to compare different agents to placebo, Khera (2018) found that liraglutide was associated with a moderate reduction in fasting blood glucose compared to placebo (mean difference, MD=-15.6mg/dL; 95% CI −23.7 to −7.6; SMD=−0.72) followed by orlistat (MD=−8.0mg/dl; 95% CI −12.2 to −3.7; SMD=−0.23). None of these differences were, however, considered clinically relevant. Naltrexon/bupropion was not associated with a significant or clinically relevant decline in fasting blood glucose compared to placebo (MD=-2.8 mg/dL; 95% CI -10.1 to 4.4; SMD=-0.13).
Khera (2018) observed moderate reduction for HbA1c with liraglutide compared to placebo (MD=−0.5%; 95% CI −0.9 to −0.2; SMD, −0.54) followed by orlistat (MD=−0.4%; 95% CI −0.6 to −0.2; SMD, −0.38). Only liraglutide resulted in a clinically relevant decline. Naltrexon/bupropion was not associated with a significant or clinically relevant decline in HbA1c compared to placebo (MD=-0.5%; 95% CI -1.1, 0.1; SMD=-0.33).
Wadden (2020) found a significant but not a clinically relevant difference in reduction of fasting blood glucose between liraglutide-ITD and placebo-ITD at 56 weeks (MD=−0.23 mmol/L; 95% CI −0.36 to −0.11). Wadden (2020) also found a significant and clinically relevant difference in reduction of HbA1c (MD−0.10%; 95% CI −0.2 to −0.04).
Semaglutide vs placebo
Zhong (2022) included 3 RCTs (3375 patients) and found that compared with placebo, once-weekly semaglutide significantly reduced HbA1c (MD –0.25%, 95% CI –0.31 to –0.19), but this was not a clinically relevant difference. Moreover, the reduction of fasting plasma glucose was greater in patients who received once-weekly semaglutide than in patients who received placebo (MD –7.40 mg/dL, 95% CI –8.40 to –6.41), but this was also not a clinically relevant difference.
Davies (2021) found that the semaglutide group showed a change in HbA1c from baseline to week 68 of -1.6% + 1.95% compared to -0.4% + 1.93% for the placebo group. The MD was -1.20 % (95% CI -1.48 to -0.92) in favour of the semaglutide group. This is a clinically relevant difference.
Effects on cholesterol profile
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Using direct meta-analysis to compare different agents to placebo, Khera (2018) found that orlistat was associated with a significant and clinically relevant reduction in LDL-cholesterol compared to placebo (MD=−8.7mg/dl; 95% CI −10.7 to −6.7; SMD=−0.27). Liraglutide (MD=-3.6; 95% CI -7.8 to 0.6; SMD=-0.11) and naltrexon/bupropion (MD= -1.86; 95% CI -4.87 to 1.16; SMD=-0.09) was not associated with a significant or clinically relevant reduction in LDL-cholesterol compared to placebo. For HDL-cholesterol compared to placebo, naltrexon-bupropion (MD=2.5mg/dL; 95% CI 1.2 to 3.8; SMD 0.40) was associated with increase in HDL-cholesterol at 1 year follow-up. In contrast, orlistat was associated with decline in HDL-cholesterol (MD=−1.1mg/dL; 95% CI −1.9 to −0.4; SMD, −0.11) compared to placebo, but this decline was not clinically relevant.
Wadden (2020) found no significant difference in LDL-cholesterol between liraglutide-ITD and placebo-ITD at 56 weeks (MD=−0.07; 95% CI −0.21 to 0.06) and in HDL-cholesterol (MD=0.02; 95% CI −0.02 to 0.07).
Semaglutide vs placebo
Zhong (2022) included 2 RCTs (1414 patients) and found that semaglutide reduced the MD in percentage of total cholesterol by -5.93% (95% CI -4.34 to -7.51) when compared with placebo. In addition, compared with placebo, the reduction in the MD in percentage of LDL was -6.55% (95% CI -4.19 to -8.92), but semaglutide showed a neutral effect on the percentage of HDL with a MD of 0.54% (95% CI -1.46 to 2.53)
Davies (2021) found no significant or clinically relevant difference between the semaglutide and placebo group at 68 weeks to baseline ratio of total cholesterol (MD=0.99; 95% CI 0.96 to 1.02), HDL-cholesterol (MD=1.03; 95% CI 1.00 to 1.05) and in LDL-cholesterol (MD=1.00; 95% CI 0.96 to 1.05).
Effects on blood pressure
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Using direct meta-analysis to compare different agents to placebo, Khera (2018) found that liraglutide (MD= -2.8mmHg; 95% CI −4.3 to −1.2; SMD, −0.24) and orlistat (MD= -1.7mm Hg; 95% CI −2.4 to −0.9; SMD, −0.19) were associated with modest reductions in systolic blood pressure, but these reductions were not considered clinically relevant. No reduction was observed for naltrexon/bupropion (MD=1.1; 95% CI -0.7 to 2.8, SMD=0.05). Similar changes were seen in diastolic blood pressure with modest reductions observed for liraglutide (MD=-0.83; 95% CI -1.7 to 0.0, SMD=-0.08) and orlistat (MD=-1.6; 95% CI -2.0 to -1.1, SMD=-0.71), but these reductions were also not considered clinically relevant. No reduction was observed for naltrexon/bupropion (MD=0.1; 95% CI -0.6 to 0.7; SMD=0.01).
Wadden (2020) found no significant or clinically relevant difference in systolic blood pressure between liraglutide-ITD and placebo-ITD at 56 weeks (MD−2.2; 95% CI −4.9 to 0.5) and in diastolic blood pressure (MD=−0.2; 95% CI −2.12 to 1.8).
Semaglutide vs placebo
Zhong (2022) included 3 RCTs (3375 patients) and found that once-weekly semaglutide resulted in a significant and clinically relevant reduced systolic blood pressure with a MD of -4.62 mm Hg (95% CI -5.57 to -3.66) when compared with placebo, and the decrease of diastolic blood pressure was also more significant but not clinically relevant in the once-weekly semaglutide group with a MD of -1.82 mm Hg (95% CI -2.94 to -0.70) when compared with placebo.
Davies (2021) found that the semaglutide group showed a change in systolic blood pressure from baseline to week 68 of -3.9 mm Hg + 13.8 mm Hg compared to -0.5 mm Hg + 15.5 mm Hg for the placebo group. The MD was -3.40 mm Hg (95% CI -5.48 to -1.32) in favour of the semaglutide group. In addition, diastolic blood pressure showed showed a change in diastolic blood pressure from baseline to week 68 of -1.6 mm Hg + 7.9 mm Hg compared to -0.9 mm Hg + 9.7 mm Hg for the placebo group. The MD was -0.70 mm Hg (95% CI -1.95 to 0.55) in favour of the semaglutide group.
Effects on waist circumference
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Using direct meta-analysis to compare different agents to placebo, Khera (2018) found that all agents were associated with a decrease in waist circumference liraglutide by 4cm (95% CI −5.0, −3.3; SMD=−0.63), naltrexon-bupropion 3.5cm (95% CI −4.4 to −2.6; SMD=−0.37 and orlistat by 2.3cm (95% CI −2.8 to −1.7; SMD=−0.26). Only liraglutide and naltrexon-bupropion were also associated with clinically relevant decrease of at least 3cm.
Wadden (2020) showed that waist circumference decreased significantly more in liraglutide-IBT than in the placebo-IBT participants (MD=−2.7 cm; 95% CI −4.7 to −0.8), but this difference was not considered clinically relevant.
Semaglutide vs placebo
Zhong (2022) included 3 RCTs (3375 patients) and fount that compared with placebo, once-weekly semaglutide was associated with a MD reduction in waist circumference of –9.34 cm (95% CI –10.00 to –8.68).
Davies (2020) found that the semaglutide group showed a change from baseline to week 68 of -9.4 cm + 7.9 cm compared to -4.5 cm + 7.8 cm for the placebo group. The MD was -4.90 cm (95% CI -6.01 to -2.79) in favour of the semaglutide group.
Adverse events
Orlistat, liraglutide, naltrexon-bupropion vs placebo
Wadden (2020) reported that Liraglutide 3.0 mg combined with IBT was generally well tolerated. The most frequent adverse events were gastrointestinal (71% with liraglutide-IBT vs. 49% with placebo-IBT), The incidence of nausea was greater with liraglutide-IBT (47.9%) than with placebo-IBT (17.9%). Three acute gallstone disease events occurred with liraglutide-IBT and two with placebo-IBT. No events of pancreatitis were observed in the study. The proportion of participants with reported serious adverse events was 4.2% (seven events in six participants) in liraglutide-IBT and 1.4% (two events in two participants) with placebo-IBT. There were no deaths.
Non of de included assessed the association between adverse events and other weight loss medication (orlistat and naltrexon-bupropion) in treating obesity or overweight in adults.
Semaglutide vs placebo.
Zhong (2022) found no significant differences in the risk of hypoglycemic events, acute pancreatitis, acute renal failure, malignant neoplasms, and all-cause death between once-weekly semaglutide and placebo. However, nausea (RR=2.60; 95% CI 2.25 to 2.99), vomiting RR(=3.35; 95% 2.65 to 4.24), diarrhoea (RR=1.92; 95% CI 1.61 to 2.29), and constipation (RR=1.91; 95% CI 1.34 to 2.72) were reported more frequently with once-weekly semaglutide than with placebo.
Davies (2021) found that 353/503 (87.6%) of patients reported adverse events in the semaglutide 2.4 mg group compared to 309/402 (76.9%) patients in the placebo group. The RR was 1.14 (95% CI 1.07 to 1.22) in favour of placebo.
Cost effectiveness
No studies assessed the cost effectiveness of weight loss medication on treating obesity or overweight in adults.
Level of evidence of the literature
Orlistat, liraglutide, naltrexon-bupropion vs placebo
The level of evidence of RCTs comparing orlistat, liraglutide and/or naltrexon-bupropion vs placebo starts high. The level of evidence regarding the outcome measure weight loss was downgraded by one level because of study limitations (risk of bias due to high attrition rates for all trials).
The level of evidence regarding quality of life were downgraded to very low because of risk of bias and serious imprecision. There was high risk of bias since blinding of the trials was unclear or not possible and only one study reported on quality of life with large standard errors of effect size (imprecision).
The level of evidence regarding the outcome measure comorbidities was downgraded moderate because of study limitations (risk of bias due to high attrition rates for all trials). It was downgraded to low for HbA1c, LDL-cholesterol and blood pressure outcomes because of conflicting results (inconsistency).
Semaglutide vs Placebo
The level of evidence of RCTs comparing semaglutide vs placebo starts high. The level of evidence regarding the outcome measure weight loss was downgraded by one level to moderate because of inconsistency (due to considerable heterogeneity among the included RCTs, possibly attributable to the variation in sample sizes, baseline characteristics of patient populations, and trial durations).
The level of evidence regarding quality of life was downgraded with two levels to low because of serious imprecision (95% confidence intervals crossing the border for clinical relevance).
The level of evidence regarding the outcome measure HbA1c, blood pressure, and waist circumference were downgraded to moderate. The level of evidence for the outcome measure HbA1 was downgraded because of conflicting results (inconsistency). The level of evidence for blood pressure and waist circumference was downgraded because the 95% confidence interval crossed the border for clinical relevance (imprecision).
The level of evidence regarding the outcome measure glucose and cholesterol was downgraded to low because of conflicting results (inconsistency) and the 95% confidence interval crossing the border for clinical relevance, and only one study reporting on the outcome with a low number of events (imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of pharmaceutical treatment combined with behavioural or lifestyle intervention compared to placebo in treating overweight with comorbidities or obesity in adults?
P: Adults with obesity (BMI ≥30 kg/m2) and adults with overweight (BMI ≥25 kg/m2) with comorbidities.
I: Weight loss medication (orlistat, naltrexon/bupropion, liraglitude 3 mg, semaglutide).
C: Placebo.
O: Weight loss, maintaining the quality of life, comorbidities (glucose/diabetes), adverse events, cost-effectiveness.
Relevant outcome measures
The working group considered weight as a crucial outcome measure for decision making; and comorbidities and quality of life as important outcome measures for decision making.
The working group defined the outcome measure comorbidities as follows: diabetes-related parameters (HbA1c, glucose) and cardiovascular risk factors (HDL cholesterol, LDL cholesterol, systolic blood pressure, diastolic blood pressure)
The working group defined the following outcomes as a minimal clinically (patient) important difference.
- Weight loss: 5% (Khera, 2016).
- Quality of Life: changes from baseline ≥ 3.8 points on the SF-36 physical component summary score or ≥ 4.6 points on the SF-36 mental component summary score (Chao 2019).
- Weight related quality of life: A change of 7.7 to 12 points on the total score (Chao 2019).
- Comorbidities
- Cardiovascular risk factors: SBP: 3 mmHg; DBP: 2 mmHg; LDL: 0.13 mmol/L (5 mg/dL) 5% reduction; and HDL: 0.05 mmol/L (2 mg/dL) or a 5% increase
- Glucose: 1 mmol/L (18 mg/dL).
- HbA1c: 0.5%
- Waist circumference: 3 cm
Search and select (Methods)
Three different literature searches were performed. At first we searched for systematic reviews and after this we performed an additional search to supplement the selected review(s) with RCT’s that were published after the search date of the selected review(s). Finally, during development of this module we learned that semaglutide was approved as weight loss medication for the treatment of obesity and updated our search to include it.
Search 1: Systematic reviews (SR)
- The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from the 1st of January 2005 until the 27th of June 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 382 hits. Studies were selected based on the following criteria: systematic reviews (SR) investigating the effect of pharmacological treatments for obesity on weight loss and cardiovascular risk in adults with obesity and overweight compared to adults with obesity and overweight receiving placebo. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, 12 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included (Khera, 2016; Khera, 2018; Singh; 2020).
Search 2: Randomized controlled trials (RCTs)
- The search strategy of the systematic review (Singh, 2020) was complete up on 30 September 2019. Therefore, we performed an additional search on RCTs in the databases Medline (via OVID) and Embase (via Embase.com) with relevant search terms between 1st of January 2019 until and the 22nd of July 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 184 hits. Studies were selected based on the following criteria: RCTs investigating the effect of pharmacological treatments for obesity on weight loss and cardiovascular risk in adults with obesity and overweight compared to adults with obesity and overweight receiving a placebo. Four studies were initially selected based on title and abstract screening. After reading the full text, two studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included (Chao, 2019; Wadden, 2020).
Search 3: Semaglutide
- The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from the 1st of January 2005 until the 7th of February 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 59 hits. Studies were selected based on the following criteria: SRs and RCTs investigating the effect of semaglutide as treatment for obesity on weight loss and cardiovascular risk in adults with obesity and overweight compared to adults with obesity and overweight receiving placebo. 12 studies were initially selected based on title and abstract screening. After reading the full text, 10 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 2 studies were included Zhong, 2022; Davies, 2021).
Results
7 studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Acosta, A., Camilleri, M., Abu Dayyeh, B., Calderon, G., Gonzalez, D., McRae, A., & Clark, M. M. (2021). Selection of Antiobesity Medications Based on Phenotypes Enhances Weight Loss: A Pragmatic Trial in an Obesity Clinic. Obesity, 29(4), 662-671.
- Chao, A. M., Wadden, T. A., Walsh, O. A., Gruber, K. A., Alamuddin, N., Berkowitz, R. I., & Tronieri, J. S. (2019). Changes in health?related quality of life with intensive behavioural therapy combined with liraglutide 3.0 mg per day. Clinical Obesity, 9(6), e12340.
- Iepsen, E. W., Zhang, J., Thomsen, H. S., Hansen, E. L., Hollensted, M., Madsbad, S., ... & Torekov, S. S. (2018). Patients with obesity caused by melanocortin-4 receptor mutations can be treated with a glucagon-like peptide-1 receptor agonist. Cell metabolism, 28(1), 23-32.
- Khera, R., Murad, M. H., Chandar, A. K., Dulai, P. S., Wang, Z., Prokop, L. J., ... & Singh, S. (2016). Association of pharmacological treatments for obesity with weight loss and adverse events: a systematic review and meta-analysis. Jama, 315(22), 2424-2434.
- Khera, R., Pandey, A., Chandar, A. K., Murad, M. H., Prokop, L. J., Neeland, I. J., ... & Singh, S. (2018). Effects of weight-loss medications on cardiometabolic risk profiles: a systematic review and network meta-analysis. Gastroenterology, 154(5), 1309-1319.
- Kleinendorst, L., Massink, M. P., Cooiman, M. I., Savas, M., van der Baan-Slootweg, O. H., Roelants, R. J., ... & van Haelst, M. M. (2018). Genetic obesity: next-generation sequencing results of 1230 patients with obesity. Journal of medical genetics, 55(9), 578-586.
- Singh, A. K., & Singh, R. (2020). Pharmacotherapy in obesity: a systematic review and meta-analysis of randomized controlled trials of anti-obesity drugs. Expert Review of Clinical Pharmacology, 13(1), 53-64.
- Wadden, T. A., Tronieri, J. S., Sugimoto, D., Lund, M. T., Auerbach, P., Jensen, C., & Rubino, D. (2020). Liraglutide 3.0 mg and intensive behavioral therapy (IBT) for obesity in primary care: the SCALE IBT randomized controlled trial. Obesity, 28(3), 529-536.
- Welling, M. S., de Groot, C. J., Kleinendorst, L., van der Voorn, B., Burgerhart, J. S., van der Valk, E. S., & van Rossum, E. F. (2021). Effects of Glucagon-Like-Peptide-1 Analogue Treatment in Genetic Obesity. Journal of the Endocrine Society, 5(Supplement_1), A33-A34.
- Wilding, J. P., Batterham, R. L., Calanna, S., Davies, M., Van Gaal, L. F., Lingvay, I., & Kushner, R. F. (2021). Once-weekly semaglutide in adults with overweight or obesity. New England Journal of Medicine.
Evidence tabellen
Evidence tables
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effect of pharmaceutical treatment combined with behavioural or lifestyle intervention compared to placebo in treating overweight and comorbidities or obesity in adults?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control ©
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Khera, 2016
|
SR and meta-analysis of RCTs
Literature search up to March 2016
Study design: RCT parallel group design (all included RCTs)
Setting and Country: Not reported
Source of funding and conflicts of interest: Not reported for the individual studies |
Inclusion criteria SR: Treatment period >1 year; comparison with placebo; obese (BMI ≥30 kg/m2) or overweight (BMI ≥27 kg/m2) adults ( ≥18 years)
28 included studies
Important patient characteristics at baseline: See table eTable 1; Khera (2016) for baseline characteristics of the individual RCTs
|
Describe intervention - Orlistat (120 mg 3 times daily) - Naltrexon-bupropion (32 mg/ 360mg twice daily) - Liraglutide (3 mg subcutaneous injection daily)
|
Describe control - Placebo |
End-point of follow-up -52 weeks
For how many participants were no complete outcome data available? (intervention/control) See table eTable 1; Khera (2016) for number of participants with complete outcome data in the intervention and control group.
|
Outcome 5% weight loss Effect medication on achieving 5% weight loss; odds ratio(OR) [95% CI]: See eFigure 3A, Khera (2016) for the outcome for each individual RCT Pooled effect orlistat vs placebo (random effects model): OR=2.69; (95% CI=[2.36, 3.07]) favouring orlistat Heterogeneity (I2): 49.7% Pooled effect naltrexon-bupropion vs placebo (random effects model): OR=3.90; (95% CI=[2.91, 5.22]) favouring naltrexon-bupropion Heterogeneity (I2): 66.7%
Pooled effect liraglutide vs placebo (random effects model): OR=5.09; (95% CI=[4.07, 6.37]) favouring liraglutide Heterogeneity (I2): 23.3% Outcome 10% weight loss Effect medication on achieving 10% weight loss; odds ratio(OR) [95% CI]: See eFigure 3B, Khera (2016) for the outcome for each individual RCT Pooled effect orlistat vs placebo (random effects model): OR=2.41; (95% CI=[2.08, 2.78]) favouring orlistat Heterogeneity (I2): 26.2% Pooled effect naltrexon-bupropion vs placebo (random effects model): OR=4.11; (95% CI=[2.80, 6.05]) favouring naltrexon-bupropion Heterogeneity (I2): 64.1% Pooled effect liraglutide vs placebo (random effects model): OR=4.36; (95% CI=[3.61, 5.26]) favouring liraglutide
Heterogeneity (I2): 0% Outcome weight loss in Kg Effect medication on weight loss (in Kg); mean difference [95% CI]: See eFigure 3C, Khera (2016) for the outcome for each individual RCT Pooled effect orlistat vs placebo (random effects model): MD=-2.63; (95% CI=[-2.94, -2.32]) favouring orlistat Heterogeneity (I2): 26.3% Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-4.95; (95% CI=[-5.54, -4.36]) favouring naltrexon-bupropion Heterogeneity (I2): 0% Pooled effect liraglutide vs placebo (random effects model): MD=-5.24; (95% CI=[-5.60, -4.87]) favouring liraglutide Heterogeneity (I2): 82.8%
|
Facultative: The authors conclude that among overweight or obese adults, orlistat, Naltrexon-bupropion, and liraglutide, compared with placebo, were each associated with achieving at least 5% weight loss at 52 weeks. Liraglutide was associated with the highest odds of achieving at least 5%weight loss
|
|
Khera, 2018 |
SR and meta-analysis of RCTs
Literature search up to February 2017
Study design: RCT parallel group design (all included RCTs)
Setting and Country: See table eTable 1; Khera (2018) for country of the individual RCTs
Source of funding and conflicts of interest: Not reported for the individual studies |
Inclusion criteria SR: Treatment period >1 year; comparison with placebo; obese (BMI ≥30 kg/m2) or overweight (BMI ≥27 kg/m2) adults ( ≥18 years)
28 included studies
Important patient characteristics at baseline: See table eTable 1; Khera (2018) for baseline characteristics of the individual RCTs
|
Describe intervention - Orlistat (120 mg 3 times daily) - naltrexon-bupropion (32 mg/ 360mg twice daily) - Liraglutide (3 mg subcutaneous injection daily)
|
Describe control - Placebo |
End-point of follow-up -52 weeks
For how many participants were no complete outcome data available? (intervention/control) See table eTable 1; Khera (2018) for number of participants with complete outcome data in the intervention and control group.
|
Outcome fasting blood glucose Effect medication on blood glucose; mean difference [95% CI]: See eFigure 1, Khera (2016) for the outcome for each individual RCT
Pooled effect orlistat vs placebo (random effects model): MD=-5.71; (95% CI=[-7.84, -3.59]) favouring orlistat
Heterogeneity (I2): 93.1%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-1.74; (95% CI=[-2.71, -0.77]) favouring naltrexon-bupropion
Heterogeneity (I2): 0%
Pooled effect liraglutide vs placebo (random effects model): MD=-15.78; (95% CI=[-28.06, -3.50]) favouring liraglutide
Heterogeneity (I2): 97.2%
Outcome hemaglobin A1c Effect medication on hemaglobin A1C; mean difference [95% CI]: See eFigure 2, Khera (2016) for the outcome for each individual RCT
Pooled effect orlistat vs placebo (random effects model): MD=-0.35; (95% CI=[-0.48, -0.22]) favouring orlistat
Heterogeneity (I2): 59.5%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-0.50; (95% CI=[-0.78, -0.22]) favouring naltrexon-bupropion
Heterogeneity (I2): 0%
Pooled effect liraglutide vs placebo (random effects model): MD=-0.50; (95% CI=[-0.91, -0.09]) favouring liraglutide
Heterogeneity (I2): 98.0%
Outcome LDL Effect medication on LDL; mean difference [95% CI]: See eFigure 3, Khera (2016) for the outcome for each individual RCT
pooled effect orlistat vs placebo (random effects model): MD=-9,21; (95% CI=[-12.02, -6.40]) favouring orlistat
Heterogeneity (I2): 78.8%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-1.72; (95% CI=[-4.24, 0.80]) favouring naltrexon-bupropion
Heterogeneity (I2): 62.2%
Pooled effect liraglutide vs placebo (random effects model): MD=-2.35; (95% CI=[-3.74, -0.97]) favouring liraglutide
Heterogeneity (I2): 0%
Outcome HDL Effect medication on HDL; mean difference [95% CI]: See eFigure 4, Khera (2016) for the outcome for each individual RCT
pooled effect orlistat vs placebo (random effects model): MD=-1.10; (95% CI=[-1.73, -0.46]) favouring orlistat
Heterogeneity (I2): 66.4%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=2.72; (95% CI=[0.08, 5.37]) favouring placebo
Heterogeneity (I2): 96.1%
Pooled effect liraglutide vs placebo (random effects model): MD=0.88; (95% CI=[0.44, 1.33]) favouring placebo
Heterogeneity (I2): 0%
Outcome systolic blood pressure Effect medication on systolic blood pressure; mean difference [95% CI]: See eFigure 5, Khera (2016) for the outcome for each individual RCT
pooled effect orlistat vs placebo (random effects model): MD=-1.59; (95% CI=[-2.33, -0.86]) favouring orlistat
Heterogeneity (I2): 26.6%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=0.42; (95% CI=[-1.27, 2.10]).
Heterogeneity (I2): 84.5%
Pooled effect liraglutide vs placebo (random effects model): MD=-2.69; (95% CI=[-3.46, -1.91]) favouring liraglutide
Heterogeneity (I2): 0%
Outcome diastolic blood pressure Effect medication on diastolic blood pressure; mean difference [95% CI]: See eFigure 6, Khera (2016) for the outcome for each individual RCT
pooled effect orlistat vs placebo (random effects model): MD=-1.35; (95% CI=[-1.93, -0.77]) favouring orlistat
Heterogeneity (I2): 31.7%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=0.04; (95% CI=[-0.89, 0.96])
Heterogeneity (I2): 72.1%
Pooled effect liraglutide vs placebo (random effects model): MD=-0.73; (95% CI=[-1.28, -0.19]) favouring liraglutide
Heterogeneity (I2): 0%
Outcome waist circumference Effect medication on waist circumference; mean difference [95% CI]: See eFigure 7, Khera (2016) for the outcome for each individual RCT
pooled effect orlistat vs placebo (random effects model): MD=-2.28; (95% CI=[-2.89, -1.68]) favouring orlistat
Heterogeneity (I2): 42.9%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-3.44; (95% CI=[-4.47, -2.41]) favouring naltrexon-bupropion
Heterogeneity (I2): 58.9%
Pooled effect liraglutide vs placebo (random effects model): MD=-4.11; (95% CI=[-4.78, -3.45]) favouring liraglutide
Heterogeneity (I2): 41.5% |
Facultative: The authors conclude that orlistat, naltrexon-bupropion, and liraglutide, compared with placebo, appear to have minimal to modest effects on cardiometabolic risk profile of obese and overweight adults even after a year of drug therapy. |
|
Singh, 2020 |
SR and meta-analysis of RCTs
Literature search up to September 2019
Study design: A-D double blind RCT
Study design: RCT parallel group design (all included RCTs)
Setting and Country: Not reported
Source of funding and conflicts of interest: Not reported for the individual studies |
Inclusion criteria SR: Phase 3 RCTs; placebo control group; duration ≥1 year. Comparison with placebo; obese (BMI ≥30 kg/m2) or overweight (BMI ≥27 kg/m2) adults ( ≥18 years)
31 included studies
Important patient characteristics at baseline: Partially reported for studies except orlistat. See Table 2; Singh (2020)
|
Describe intervention - Orlistat (120 mg 3 times daily) - naltrexon-bupropion (32 mg/ 360mg twice daily) - Liraglutide (3 mg subcutaneous injection daily)
|
Describe control - Placebo |
End-point of follow-up -52 weeks
For how many participants were no complete outcome data available? See table Table 2; Singh (2020) for number of participants with complete outcome data except for orlistat.
|
Outcome weight loss in Kg Effect medication on weight loss (in Kg); mean difference [95% CI]: See Figure 1, 4 and 5; Singh (2020) for the outcome for each individual RCT
Pooled effect orlistat vs placebo (random effects model): MD=-3.066; (95% CI=[-3.763, -2.369]) favouring orlistat
Heterogeneity (I2): 80.56%
Pooled effect naltrexon-bupropion vs placebo (random effects model): MD=-4.386; (95% CI=[-5.053, -3.718]) favouring naltrexon-bupropion
Heterogeneity (I2): 50.11%
Pooled effect liraglutide vs placebo (random effects model): MD=-5.246; (95% CI=[-6,172, -4.321]) favouring liraglutide
Heterogeneity (I2): 65.8%
|
The authors conclude that among overweight or obese adults, orlistat, naltrexon-bupropion, and liraglutide, compared with placebo, were each associated with achieving a significant reduction of body weight
|
|
Zhong, 2022 |
SR and meta-analysis of RCTs
Literature search up to September 2019
A: Friedrichsen, 2021 B: Rubino, 2021 C: Wadden, 2021 D: Wilding, 2021
Study design: RCT parallel group design (all included RCTs)
Setting and Country: Outpatient clinics in multiple countries
Study design: A-D double blind RCT
Source of funding and conflicts of interest: Not reported for the individual studies |
Inclusion criteria SR: (1) enrolled participants were adults (≥18 years old) with a body-mass index of 27 kg/m2 or higher and without diabetes; (2) comparison of once-weekly semaglutide and placebo; (3) study design limited to RCTs; (4) outcomes of interest included data that were directly related to body weight change; (5) treatment duration lasted at least 20 weeks
Important patient characteristics at baseline: See supplementary table 1 (Zhong, 2022)
|
Describe intervention A-D: Once-weekly semaglutide 2.4 mg
|
Describe control A-D: Once-weekly Placebo
|
End-point of follow-up A: 20 weeks C-D: 68 weeks
For how many participants were no complete outcome data available? Not reported for the individual studies
|
Outcome
Weight loss change (%) MD= -12.57% (95% CI -14.80 to -10.35) facvuring semaglutide
Weight loss change (kg) MD=-11.90 (95%CI -13.24 to-10.56) favouring semaglutide
Physical functioning score MD=1.75, 95% CI 0.91 to 2.58 favouring semaglutide
Physical component score MD=1.24, 95% CI 0.27–2.22 favouring semaglutide
Mental component score MD=2.90, 95% CI 1.54–4.26 favouring semaglutide
Glucose MD=–7.40 mg/dL, 95% CI –8.40 to –6.41 favouring semaglutide
Hb1Ac (%) MD=–0.25%, 95% CI –0.31 to –0.19 favouring semaglutide.
Total cholesterol Md=5.93% (95% CI 4.34 to 7.51) favouring semaglutide
LDL-cholesterol MD=6.55% (95% CI 4.19 to 8.92) favouring semaglutide
Triglycerides MD=18.34%, 95% CI –23.23 to –13.45) favouring semaglutide
Systolic bp MD=–4.62 mm Hg (95% CI –5.57 to –3.66) facouring semaglutide
Diastolic bp –1.82 mm Hg (95% CI –2.94 to –0.70) favouring semaglutide
Waist circumference (cm) MD=–9.34 cm (95% CI –10.00 to –8.68) favouring semaglutide |
The authors conclude that meta-analysis showed beneficial treatment effects of once-weekly ubcutaneous semaglutide 2.4 mg for adults with overweight or obesity on a comprehensive array of body weight-related efficacy endpoints |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: What is the effect of pharmaceutical treatment combined with behavioural or lifestyle intervention compared to placebo in treating overweight and comorbidities or obesity in adults?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control © 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Chao, 2019 |
Type of study: Parallel group Randomized control trial
Setting and country: Single center, USA
Funding and conflicts of interest: Commercial, study is funded by Novo Nordisk and authors are on the advisory board of Novo Nordisk or receive grant money from Novo Nordisk |
Inclusion criteria: Aage 21-70 years; body mass index (BMI) of 30-55 kg/m2; and prior lifetime weight-loss effort with diet and exercise
Exclusion criteria: types 1 or 2 diabetes; personal or family history of medullary thyroid cancer or multiple endocrine neoplasia syndrome type 2; bariatric surgery; renal, hepatic or recent cardiovascular disease (CVD); medications that substantially affect body weight; current major depression, suicidal ideation or history of suicide attempts; pregnancy/ lactation; or weight loss ≥4.5 kg in the past 3 months
N total at baseline: Liraglutide-ITD: n=50 Multicomponent: n=50 ITD-placebo: n=50
Important prognostic factors2:
age ± SD: 47.6 ± 11.8
Sex (%) 119 (79.3%)
BMI ± SD 38.4 ± 4.9
Weight, kg ± SD 108.4 ± 17.5
Groups comparable at baseline? Yes
|
Describe intervention:
All participants had 21 sessions of IBT, delivered by a physician, nurse practitioner or registered dietitian.Participants who weighed <113.6 kg were prescribed a diet of 1200- 1499 kcal/day (while those ≥113.6 kg received 1500-1800 kcal/day). Engage in low-to-moderate intensity physical activity 5 days per week, gradually building to ≥225 minutes/week. Intervention group also received 3.0mg/day liraglutide
|
Describe control:
IBT program without liraglutide
|
Length of follow-up: 52 weeks
Loss-to-follow-up; n (%): No loss to follow-up mentioned
Incomplete outcome data: No incomplete data
|
Outcome measures and effect size at 52 weeks:
I= IBT-alone L= IBT-Liraglutide M=Multicomponent
HRQoL IBT-alone (week 52) Mean ± SE; ; (P-value compared to IBT-Alone)
Physical component summary ± SD I: +4.4 ± 1.0 L: +2.1 ± 1.0; (P=0.11) M: +3.4 ± 1.0; (P=0.48)
Mental component summary ± SD I: +0.8 ± 1.3 L: +4.5 ± 1.3; (P=0.048) M: +6.4 ± 1.3; (P=0.003)
Physical functioning ± SD I: 79.9 ± 17.8 L: +10.3 ± 2.9; (P=0.60) M : +7.9 ± 3.0; (P=0.95)
Role physical ± SD I: +5.8 ± 4.7 L: +6.8 ± 4.6; (P=0.88) M: +16.0 ± 4.7; (P=0.12)
Bodily pain ± SD I: +11.1 ± 2.9 L: −1.2 ± 2.9; (P=0.003) M:+4.0 ± 2.9; (P=0.09)
General health ± SD I: +5.4 ± 2.2 L: +10.1 ± 2.2; (P=0.13) M: +8.8 ± 2.2; (P=0.28)
Vitality ± SD I: +14.2 ± 2.9 L: +11.0 ± 2.8; (P=0.43) M: +15.6 ± 2.8; (P=0.71)
Social functioning ± SD I: +5.2 ± 3.5 L: +6.8 ± 3.4; (P=0.75) M: +17.4 ± 3.4; P=0.01)
Role emotional ± SD I: −0.9 ± 4.9 L: +9.3 ± 4.9; (P=0.14) M: +16.2 ± 4.9; (P=0.01)
Mental health ± SD I:+0.9 ± 2.6 L: +9.6 ± 2.6; (P=0.02) M: +8.0 ± 2.6; (P=0.05)
Weight-related QoL (week 52): Mean ± SE; (P-value compared to IBT-Alone)
Total score ± SD I: +12.3 ± 2.1 L: +15.8 ± 2.1; (P=0.24) M: +19.4 ± 2.1; (P=0.02)
Physical function ± SD I:+14.4 ± 2.5 L: +17.4 ± 2.5; (P=0.40) M: +18.6 ± 2.5; (P=0.24)
Self-esteem ± SD I: +16.1 ± 3.4 L: +22.0 ± 3.4; (P=0.22) M: +22.0 ± 3.4; (P=0.05)
Sexual life± SD I: +14.1 ± 3.3 L: +14.1 ± 3.3; (P=0.65) M: +12.0 ± 3.3; (P=0.09)
Public distress ± SD I: +3.2 ± 2.7 L: +3.2 ± 2.7; (P=0.04) M: +10.9 ± 2.7; (P=0.03)
Work ± SD I: +9.7 ± 2.5 L: +9.7 ± 2.5; (P=0.91) M: +9.3 ± 2.5; (P=0.18) |
The authors conclude that Independent of treatment group, greater categorical weight loss was associated with greater improvements in several domains of both general and weight related QoL. The addition of liraglutide to IBT appeared to improve aspects of both general HRQoL and weight-related QoL
RoB Participants were randomly assigned to interventions, in equal numbers, using a computer-generated algorithm, operated by the study statistician (JST). Randomization used varying block sizes (i.e., 3, 6, or 9).
|
|
Wadden, 2020 |
Type of study: Parallel group Randomized control trial
Setting and country: Multicenter USA
Funding and conflicts of interest: Commercial, study is funded by Novo Nordisk and authors are on the advisory board of Novo Nordisk or receive grant money from Novo Nordisk |
Inclusion criteria: ≥ 18 years, with stable body weight (maximum 5-kg self-reported weight change within 90 days before screening) and BMI ≥ 30 kg/m2
Exclusion criteria: Glycated hemoglobin (HbA1c) ≥ 6.5%, type 1 or 2 diabetes, use of medications (in the past 90 days) known to induce significant weight loss or gain, inadequately treated hypertension, pregnancy or breastfeeding, history of cardiovascular disease, severe congestive heart failure, second-degree or greater heart block, medullary thyroid carcinoma, multiple endocrine neoplasia type 2, pancreatitis, major depressive disorder within the past 2 years, history of suicide attempt, or malignancy within the past 5 years
N total at baseline: Liraglutide-IBT: n=142 Placebo: n=140
Important prognostic factors2: Liraglutide-IBT/ Placebo-IBT
age ± SD: 45.4 ± 11.6/49.0 ± 11.2
Sex (%) 23 (16.2)/24 (17.1)
BMI ± SD 39.3 ± 6.8/38.7 ± 7.2
Weight, kg ± SD 108.5 ± 22.1/106.7 ± 22.0
Groups comparable at baseline? Yes
|
Describe intervention:
3.0 mg liraglutide daily included the same IBT as the control group.
|
Describe control:
Participants who weighed <91 kg (< 200 lb) at randomization were prescribed 1,200 kcal/d; the caloric prescription for those who weighed 91 to 136 kg (200-300 lb) was calculated by body weight (pounds) × 6 (kilocalories per pound), and participants who weighed >136 kg (> 300 lb) were prescribed 1,800 kcal/d. 100 min/wk of moderate-intensity physical activity increasing by 25 minutes every 4 weeks, with an ultimate goal of 250 min/wk. |
Length of follow-up:
56 weeks
Loss-to-follow-up; %: Liraglutide-IBT; 1% placebo-IBT; 7%
Incomplete outcome data: No incomplete data
|
Outcome measures and effect size at 56 weeks:
Waist circumference (cm) Mean difference; (95% CI) −2.7 (−4.7 to −0.8)
HbA1c (%) 3.1 (−12.7 to 18.9)
Fasting plasma glucose (mmol/L) −0.10 (−0.2 to −0.04)
SBP (mmHg) −2.2 (−4.9 to 0.5)
DBP (mmHg) −0.2 (−2.12 to 1.8)
LDL cholesterol (mmol/L) −0.07 (−0.21 to 0.06)
HDL cholesterol (mmol/L) 0.02 (−0.02 to 0.07)
|
The authors conclude that in a primary care setting, Centers for Medicare and Medicaid Services–based IBT produced clinically relevant weight loss at 56 weeks, enhanced by the addition of liraglutide 3.0 mg higher quality of life. :
RoB Individuals were randomized centrally, using an interactive voice/Web response system, to either liraglutide 3.0 mg or placebo (1:1) as an adjunct to IBT |
|
Davies, 2021 |
Type of study: double-blind, double-dummy, phase 3, superiority study
Setting and country: Outpatient clinics, Europe, North America, South America, the Middle East, South Africa, and Asia
Funding and conflicts of interest: Commercial, study is funded by Novo Nordisk
Authors declared conflicts of interest.
|
Inclusion criteria: ≥ 18 years, at least one unsuccessful dietary effort to lose weight, had a body-mass index of at least 27 kg/m², HbA1c of 7–10% (53–86 mmol/mol), and had been diagnosed with type 2 diabetes at least 180 days before screening and BMI ≥30 kg/m2
Exclusion criteria: self-reported changes in bodyweight of more than 5 kg within 90 days before screening, and previous or planned (ie, set to occur during the trial period) obesity treatment with surgery or a weight-loss device.
N total at baseline: Semaglutide 2.4 mg: n=403 Placebo: n=402
Important prognostic factors2: Semaglutide/ Placebo
age ± SD: 55 ± 11/55 ± 11
female (%) 223 (55.2)/190 (47.1)
BMI ± SD 35.9 ± 6.4/35.9 ± 6.5
Weight, kg ± SD 99.9 ± 22.5/100.5 ± 20.9
Waist circumference, cm ± SD 114.5 + 14.3/ 114.6 + 141
Groups comparable at baseline? Yes
|
Describe intervention:
2.4 mg semaglutide once a week for 68 weeks
|
Describe control:
Placebo once a week for 68 weeks |
Length of follow-up:
68 weeks
Loss-to-follow-up; %: Semaglutide; 3% Placebo: 5%
Incomplete outcome data: No incomplete data
|
Outcome measures and effect size at 68 weeks:
Weight loss (%), Mean difference; (95% CI) Semaglutide: 9.64% + 8.04% Placebo: -3.42% + 8.03 MD=-6.22% (95% -7.33 to -5.11)
Physical functioning score, MD (95% CI) Semaglutide: 2.5 + 7.8 Placebo: 1.0 + 1.7 MD=-1.50 (95% CI 0.39 to 2.61)
Weight related Qol; MD (95% CI) Semaglutide: 10.1 + 19.7 Placebo: 5.3 + 21.3 MD=-4.80 (95% CI 1.89 to 7.71)
HbA1c (%; 95% CI) Semaglutide:-1.6% cm + 1.95% Placebo:-0.4% cm + 1.93% MD= -1.20 %(95% CI -1.48 to -0.92)
SBP (mmHg) Semaglutide: -3.9 mm Hg + 13.8 mm Placebo: -0.5 mm Hg + 15.5 mm MD=-3.40 mm Hg (95% CI -5.48 to -1.32)
DBP (mmHg) Semaglutide: -1.6 mm Hg + 7.9 mm Hg Placebo: -0.9 mm Hg + 9.7 mm Hg MD=-0.70 mm Hg (95% CI -1.95 to 0.55)
Total cholesterol (mmol/L) MD=0.99 (95% CI 0.96 to 1.02)
LDL cholesterol (mmol/L) MD=1.00 (95% CI 0.96 to 1.05)
HDL cholesterol (mmol/L) MD=1.03 (95% CI 1.00 to 1.05)
Waist circumference (cm) Semaglutide: -9.4 cm + 7.9 cm Placebo: -4.5 cm + 7.8 cm MD=-4.90 (95% CI -6.01 to -3.79) |
The authors conclude that adults with overweight (body-mass index ≥27 kg/m²) or obesity and type 2 diabetes, once a week semaglutide 2·4 mg as adjunct to lifestyle intervention led to a clinically meaningful bodyweight loss that was 6·2% greater than with placebo
RoB Random allocation (1:1:1) to semaglutide 2·4 mg, semaglutide 1·0 mg, or placebo was done by the clinical research organisation (Parexel) using an interactive online response system that allocated dispensing unit numbers for each patient, with the trial product dispensed by the site investigator or study coordinator at the trial site visits. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for systematic reviews of RCTs and observational studies.
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Khera, 2016 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Khera 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Singh, 2020 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Zhong, 2022 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the effect of pharmaceutical treatment combined with behavioural or lifestyle intervention compared to placebo in treating overweight and comorbidities or obesity in adults?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Chao, 2019 |
Participants were randomly assigned to interventions, in equal numbers, using a computer-generated algorithm, operated by the study statistician. Randomization used varying block sizes |
Likely
Open-label trial |
Likely
Open-label trial |
Likely
Open-label trial |
Likely
Open-label trial |
Unlikely
Trial registered NCT02911818 |
Unclear
Numbers of lost to follow-up are not clearly stated.
|
Unlikely
ITT analysis was performed. |
|
Wadden, 2020 |
Individuals were randomized centrally, using an interactive voice/Web response system, to either liraglutide 3.0 mg or placebo (1:1) as an adjunct to IBT |
Unlikely
randomized, double-blind, placebo-controlled trial |
Unlikely
randomized, double-blind, placebo-controlled trial |
Unlikely
randomized, double-blind, placebo-controlled trial |
Unlikely
randomized, double-blind, placebo-controlled trial |
Unlikely
Trial registered NCT02963935 |
Unlikely
A high proportion of participants completed the trial (99% in the liraglutide-IBT and 93% in the placebo-IBT arm) |
Unlikely
To estimate the intervention effect, a treatment policy estimand (primary estimand using the intention-to-treat [ITT] principle) was defined for each efficacy end point, |
|
Davies, 2021 |
Random allocation (1:1:1) to semaglutide 2·4 mg, emaglutide 1·0 mg, or placebo was done by the clinical research organisation (Parexel) using an interactive online response system that allocated dispensing unit numbers for each patient, with the trial product dispensed by the site investigator or study coordinator at the trial site visits. |
Unlikely
randomized, double-blind, placebo-controlled trial |
Unlikely
study used a double-blind, double dummy design in which patients received the active drug or placebo subcutaneously (two injections once a week: active product plus placebo or placebo plus placebo). For both doses of semaglutide, the active products and corresponding placebo products were visually identical to maintain masking of patients and site staff. |
Unlikely
study used a double-blind, doubledummy design in which patients received the active drug or placebo subcutaneously (two injections once a week: active product plus placebo or placebo plus placebo). For both doses of semaglutide, the active products and corresponding placebo products were visually identical to maintain masking of patients and site staff. |
Unlikely
The people analysing the data were masked to group assignment until breaking the masking at database lock. |
Unlikely
Trial registered NCT03552757. |
Unlikely,
Numbers lost to follow-up are equal among all treatment groups. |
Unlikely
Efficacy outcomes were assessed using intention-to-treat analysis |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Le Blanc, 2011 |
Singh, 2020 is a more recent systematic review |
|
Monami, 2012 |
Singh, 2020 is a more recent systematic review |
|
Vilsboll, 2012 |
Singh, 2020 is a more recent systematic review |
|
Drombowski, 2014 |
Singh, 2020 is a more recent systematic review |
|
Yanovski, 2014 |
Singh, 2020 is a more recent systematic review |
|
Peirson, 2014 |
Singh, 2020 is a more recent systematic review |
|
Zhang, 2015 |
Singh, 2020 is a more recent systematic review |
|
Dong, 2017 |
Singh, 2020 is a more recent systematic review |
|
Onakpoya, 2020 |
Singh, 2020 is a more recent systematic review |
|
Caixas, 2014 |
Narrative review |
|
Yeffiofof, 2011 |
P does not meet PICO |
|
Plock, 2017 |
Follow-up duration to short |
|
Miras, 2019 |
P does not meet PICO |
|
Mikhail, 2019 |
O does not meet PICO |
|
Bradley, 2021 |
Zhong, 2022 is a more recent systematic review |
|
He, 2021 |
Zhong, 2022 is a more recent systematic review |
|
Philips, 2021 |
Zhong, 2022 is a more recent systematic review |
|
Shi, 2022 |
Zhong, 2022 is a more recent systematic review |
|
Vosoughi, 2021 |
Zhong, 2022 is a more recent systematic review |
|
Updike, 2021 |
Zhong, 2022 is a more recent systematic review |
|
Blundell, 2018 |
O does not meet PICO |
|
Lau, 2021 |
Wrong publication type (letter) |
|
Rubino, 2022 |
C does not meet PICO |
|
Wharton, 2022 |
O does not meet PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-07-2023
Beoordeeld op geldigheid : 07-07-2023
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2027 bepalen Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam, of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden. De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
Het Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam (C4O/VU) zijn respectievelijk regiehouder van het volwassenendeel en het kinderdeel en van de richtlijn. Daarnaast zijn ze eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van hun deel van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd door de Vrije Universiteit Amsterdam en het Ministerie van Volksgezondheid, Welzijn en Sport. De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is bij te dragen aan de verbetering van de ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Deze richtlijn is volgens Medische Specialistische Richtlijnen 2.0 tot stand gekomen, waarin de huidige stand van wetenschappelijke kennis en praktijkervaring aangaande het onderwerp is meegenomen.
De obesitasrichtlijn is ontwikkeld in samenwerking met veel partijen (zie samenstelling werkgroepen en klankbordgroepen) en is bedoeld voor de verschillende bij de ondersteuning en zorg voor obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit betrokken beroepsgroepen.
Deze richtlijn gaat over de diagnostiek en behandeling van volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Het betreft hier zorggerelateerde preventie (VWS, 2021).
Deze richtlijn richt zich op de beste diagnostiek, ondersteuning en zorg voor volwassene en kinderen met obesitas, gebaseerd op de meest recente literatuur en expert-/practice-based adviezen. Daarnaast is deze richtlijn relevant voor de geïndiceerde preventie (VWS, 2021) van obesitas bij volwassenen en kinderen. Dit betreft volwassenen en kinderen met overgewicht zonder risicofactoren en/of comorbiditeit.
Hierbij moet worden opgemerkt dat het gezondheidsrisico van overgewicht en obesitas wordt bepaald aan de hand van de BMI in combinatie met wel of geen aanwezigheid van risicofactoren en/of comorbiditeit. De BMI is ingedeeld in categorieën. Echter, de afkappunten van die categorieën zijn niet voor alle groepen precies hetzelfde. De mate van vervetting van het lichaam bij een bepaalde BMI is afhankelijk van het geslacht (vrouwen hebben een hoger vetpercentage dan mannen), de leeftijd (oudere mensen hebben een hoger vetpercentage dan jongere) en de etniciteit (mensen uit Azië hebben een hoger vetpercentage dan Europeanen). Daarnaast kunnen mensen met een grote spiermassa zoals sporters en mensen die zwaar lichamelijk werk doen een lager gezondheidsrisico hebben dan van hun BMI afgeleid kan worden met de bestaande afkappunten. Dit is de reden dat naast de BMI ook de buikomvang van groot belang is bij de bepaling van het gezondheidsrisico bij volwassenen met overgewicht of obesitas (Wharton, 2020).
Doelgroep
Deze richtlijn is primair bedoeld voor de beroepsgroepen die betrokken zijn bij de diagnostiek, ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de ondersteuning en zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. E.F.C. (Liesbeth) Van Rossum, PON, voorzitter
- W. (Wytse) Brongers, KNGF
- S.A. (Sione) Brugman, BLCN – tot februari 2023
- I. (Inge) Out, BLCN – vanaf februari 2023
- B. (Bernadette) Deenen, NVD
- K. (Karen) De Leest, KNMP
- Dr. K. (Karen) Freijer, PON
- E. (Ellen) Govers, NVD
- M. (Marc) Huls, NHG
- F. (Francoise) Langens, huisarts – tot februari 2021
- R.S.L. (Ronald) Liem, NVvH
- Dr. M. (Mattijs) Out, NIV
- E.M.J.N. (Evelyn) Sloots-Jongen, NIP
- N. (Nicolette) Slot, VvOCM
- I. (Inez) van den Anker, Stichting Over Gewicht (patiëntenorganisatie)
- J. (Jacqui) van Kemenade – van Vught, NHG
Klankbordgroep
- I.R.M. (Jurriaan) Blekemolen, NVAB
- Dr. G.J. (Gert-Jan) Braunstahl, NVALT
- D.O.A. (Darie) Daemers, KNOV
- D. (Dorenda) Dijken, NVOG
- S. (Sander) Galjaard, NVOG
- Prof. dr. A. (Annemieke) Hoek, NVOG
- M.M. (Maarten) Hoogbergen, NVPC
- Y.F.C. (Yvo) Kortmann, NVMDL
- P. (Patricia) Lottman, BLCN
- N. (Nienke) van der Putten, Hartstichting
- Dr. G.A.H. (Edgar) van Mil, NVK
- Dr. T.M. (Tessa) van Elten, Voedingscentrum
- Dr. M.E. (Janneke) Wittekoek, NVvC
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. B. (Bart) Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Overzicht van de belangen van werkgroepleden
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Rossum (voorzitter) |
Internist-endocrinoloog/ hoogleraar Gezond Gewicht en biologisch stressonderzoek in het Erasmus MC |
-Voorzitter Partnerschap Overgewicht Nederland – onbetaald (met in dat kader extra werkzaamheden zoals: *vertegenwoordiger PON bij de tafel Overgewicht voor het Nationaal Preventie Akkoord (onbetaald ) *adviseur keten/netwerkaanpak overgewicht bij volwassenen (tijdelijk betaald) en *lid commissie onderwijs leefstijl en overgewicht in de basiscurricula van zorgprofessionals (onbetaald) -Voorzitter Nationaal Obesitas Symposium – betaald -Bestuurslid stichting STRESS-NL (platform Nederlandse stress onderzoekers)– onbetaald -Lid Koninklijke Hollandsche Maatschappij der Wetenschappen – onbetaald -Lid OPEN Policy working group European Association of the Study of Obesity (sinds Dec 2022) – onbetaald -Lid Voedingsbeleidadviesteam Erasmus MC – onbetaald -Lid Hogeschoolraad – onbetaald -Deelnemer netwerk NL2025 – onbetaald - Jurylid Heineken Award commissie - betaald - Lid voedingsbeleidcommissie Erasmus MC – onbetaald -Spreker /dagvoorzitter bij multipele (inter)nationale en regionale (wetenschappelijke) congressen, webinars, podcasts, media, en nascholingen voor zorgprofessionals. beleidsmakers of algemeen publiek : oa voor Langerhans symposia, Dutch Obesity Academy, Dutch Diabetes Academy, NVE Academy, E-wise, KOEL, SCEM, ASCEND, European Association of the Study of Obesity, International Medical Press, Food First Network, Obesitas Platform, overgewicht.tv, Breedenburg, Het Grote Obesitas Debat, POLITICO Health Care summit EU, European Commission, Diabetes Genootschap Zuid Nederland, Vereniging Arts en Leefstijl, Internistendagen – deels onbetaald en deels betaald (zonder belangenverstrengeling of bemoeienis over wetenschappelijke inhoud door commerciele partijen in geval van betaling).
Afgeronde nevenfuncties: Lid van diverse commissies en wetenschappelijke besturen (onbetaald) |
- In 2019 boek gepubliceerd met co-auteur Mariëtte Boon ""VET belangrijk: feiten en fabels over voeding, vetverbranding en verborgen dikmakers"". Inkomsten naar uitgever Ambo Anthos en boekwinkels en een klein deel naar de auteurs (Mariette Boon en Obesity Science). In 2020 is het boek internationaal gepubliceerd. - Elisabeth Fonds (ondergebracht bij Erasmus MC Trustfonds) financiert de ontwikkeling van de online diagnostische ObesEcare tool om oorzaken overgewicht op te sporen. Het Elisabeth Fonds is een maatschappelijk / charitatief fonds en heeft geen winstoogmerk. - Firma Rhythm financiert een internationale multicenter trial voor een nieuw geneesmiddel (setmelanotide) voor patiënten met een zeldzame vorm van genetische obesitas. - Bezoek aan internationale Masterclass: ''leading the change in the management of Obesity & T2D'', gesponsord door Johnson & Johnson, 2017 (geen honorarium ontvangen) - Actieve bijdrage aan de ontwikkeling van een gespecialiseerde leefstijlinterventie in het Erasmus MC en bij de ontwikkeling van een diagnostische (online) ondersteuningstool voor mensen met overgewicht of obesitas (ook in het Erasmus MC).
|
Geen |
|
Brongers |
Manager fysiotherapie, fysiotherapeut en leefstijlcoach (GLI aantekening). Werkgever: Leidsche Rijn Julius Gezondheidscentra |
Geen |
Geen |
Geen |
|
Brugman |
Zelfstandig Leefstijlcoach |
Bestuurslid BLCN, deel betaald |
Geen |
Geen |
|
De Leest |
Apotheker GHC de Roerdomp Nieuwegein 24 uur Apotheker Geneesmiddel Informatie Centrum KNMP 10 uur |
onbetaald redactie Vascazine/vrijwilliger Vasculitis Vereniging |
Geen |
Geen |
|
Freijer |
Algemeen manager Partnerschap Overgewicht Nederland (PON) ondergebracht bij Erasmus MC te Rotterdam |
- Voorzitter van ISPOR Special Interest Group (SIG) Nutrition Economics. Werkzaamheden: het nieuw opgezette gebied binnen het bestaande gebied van gezondheidseconomie en daarbuiten vergroten.
- Eigenaar van eenmanszaak met naam Freijer4Food & Health Care Activiteitenomschrijving: Geven van lezingen op gebied van voeding; ontwikkelen van kennis/kunde omtrent voedingseconomie (Nutrition Economics); Schrijver/publicist van (wetenschappelijke) artikelen; geven van workshops op bovengenoemd gebied; projectmatig begeleiden van (commerciële) onderzoeken; consultancy op gebied van voeding. |
Geen |
Geen |
|
Govers |
Voorzitter van het NVD netwerk Obesitas (Kenniscentrum Diëtisten Overgewicht en Obesitas; www.KDOO.nl) Dit is een niet betaalde functie |
Vice-voorzitter van de ESDN Obesity van the European Federation of Associations of Dietitians. Een niet betaalde functie |
Geen |
Geen |
|
Langens |
Huisarts |
Ontwikkelen e-learnings/ webinar ( CME-online/accredidact/medonline): betaald Preventieconsult: medische begeleiding bij overgewicht/leefstijl : betaald Huisartsen Eemland: bevorderen wijkgericht werken: betaald Fieldlab obesitas Amersfoort: onbetaald |
Geen |
Geen |
|
Liem |
Gastro-intestinaal en traumachirurg
Groene Hart Ziekenhuis (GHZ) in Gouda (60%) Alrijne Ziekenhuis in Leiderdorp/Alphen ad Rijn (10%) Nederlandse Obesitas Kliniek West in Den Haag (20%) Keizer Kliniek in Voorschoten (10%) |
- Hoofd afdeling chirurgie in GHZ - Voormalig voorzitter Dutch Society for Metabolic and Bariatric Surgery - Lid Auditcommissie (Ned Ver v Heelkunde) - Lid Landelijke Commissie Chirurgische Complicatie Registratie (Ned Ver v Heelkunde) - Clinical Audit Board Audit voor de Behandeling van Obesitas van DICA - Lid Registry Committee of the Internationale Federation for the Surgery of Obesity and Metabolic Disorders - Lid Multi-National Advisory Group of IFSO-European Chapter
Al deze nevenfuncties zijn onbetaald |
Nederlandse Obesitas Kliniek. De chirurgische behandeling van obesitas en obesitas gerelateerde metabole ziekten maakt onderdeel uit van het behandel spectrum. Als ervaren bariatrisch en metabool chirurg maak ik derhalve ondereel uit van deze commissie. De uiteindelijke richtlijn heeft invloed op de positionering van deze behandeling in het behandel spectrum. Voor de chirurgische behandeling zelf, is in 2020 een herziene richtlijn gepubliceerd door de NVVH en het Kennisinstituut. Hiernaar zal worden verwezen in deze Zorgstandaard. Ik heb een beperkt belang in NOK West in Den Haag.
Ik ben daarnaast regelmatig een gevraagde spreker op (internationale) bijeenkomsten en congressen, soms gefaciliteerd door Johnson & Johnson Institute, Medtronic, Gore en Olympus. Daar staat soms een tijdvergoeding tegenover, conform Europese regelgeving. |
Geen |
|
Out |
Internist-vasculair geneeskunde (MST Enschede, fulltime) |
Klinisch Netwerk Obesitas (commissie NVE, lid) |
Van januari t/m juni 2020 heb ik één dag per week onbetaald verlof om de mogelijkheden te exploreren van het opzetten van een leefstijicentrum (bijvoorbeeld als anderhalvelijns centrum, al dan niet in naam van/in samenwerking met het MST). - Deelname aan deze richtlijncommissie kan mijn naam/reputatie als leefstijlarts versterken |
Geen |
|
Out-Hoiting |
Eigenaar Mijn leefstijl op recept
Vice-voorzitter BLCN (deel betaald, deel vrijwillig) |
Geen |
In mijn bedrijf maak ik oa producten voor GLI coaches. Deze coaches hebben belang bij een goed obesitasbeleid waarbij de GLI blijft bestaan. ik ben zelf geen GLI coach meer. |
Geen |
|
Sloots-Jongen |
Klinisch psycholoog bij Maasstad Ziekenhuis |
Geen |
Geen |
Geen |
|
Slot |
VvOCM Nicolette Slot eigen praktijk voor oefentherapie, wandeltrainer en leefstijlcoach |
Oefentherapeut Mensendieck - betaald leefstijlcoach - betaald wandeltrainer - betaald voorzitter Drunens Wandelfestival - niet betaald voorzitter Avond4daagse Drunen - niet betaald |
Geen |
Geen |
|
Van den Anker |
Freelance opdracht HR bij WijzijnMeo (bedrijfsnaam Blue Wolf) Bestuurslid NSOG (Nederlandse stichtijng over gewicht) - Patiëntenorganisatie (onbezoldigd) |
Bestuurslid Pon (onbezoldigd) |
Als bestuurslid van de patiëntenorganisatie voor mensen die leven met obesitas kan de richtlijn ter uitleg en informatie gebruikt worden voor de patiënten |
Geen |
|
Van Kemenade |
Waarnemend huisarts (huisartspraktijk Biesbosch Made) |
Auteur Consult HZG (huisartszorggroep Breda) betaald per uur bij werkzaamheden Creeeren scholingen/presentaties op het gebied Diabetes/leefstijl. Betaald per scholing/presentatie |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenverenigingen in de werkgroepen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Effectiviteit medicatie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, en het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroep en de adviseurs knelpunten in de zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Tevens zijn er knelpunten aangedragen door AJN Jeugdartsen Nederland, Beroepsvereniging Gewichtsconsulenten Nederland, Beroepsvereniging Leefstijl Coaches Nederland, Care for Obesity (VU Amsterdam), Inspectie voor de Gezondheidszorg en Jeugd, Jongeren op Gezond Gewicht, GGD Har voor Brabant, Amsterdamse Aanpak Gezond Gewicht (GGD Amsterdam), Koninklijk Nederlands Genootschap voor Fysiotherapie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Koninklijke Nederlandse Maatschappij ter bevordering van de Tandheelkunde, Landelijke Verenging Medische Psychologie, Landelijke Huisartsen Vereniging, Nederlandse Associatie Physician Assistants, Nederlands Centrum Jeugdgezondheid, Nederlandse Diabetes Federatie, Nederlands Huisartsen Genootschap, Nederlandse Internisten Vereniging, Nederlands Jeugdinstituut, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging van Diëtisten, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging van Maag-Darm-Leverartsen, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Nederlandse Vereniging voor Cardiologie, Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging voor Plastische Chirurgie, Partnerschap Overgewicht Nederland, Pharos, Stichting over gewicht, Vereniging Gehandicaptenzorg Nederland, Voedingscentrum, Vereniging Vertrouwensartsen Kindermishandeling, Vereniging van Oefentherapeuten Cesar en Mensendieck, Zorginstituut Nederland en Zelfstandige Klinieken Nederland via een Invitational conference. Een verslag van de Invitational conference is opgenomen in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroepen besproken waarna de werkgroepen de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerden de werkgroepen ten minste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Gezien de hoge mate van uitval en terugval en daarmee het teruglopen van het percentage succesvolle resultaten na verloop van tijd zijn korte-termijn leefstijlinterventies weinig informatief voor de klinische praktijk. Vanwege het belang van een duurzaam effect zijn bij de selectie van de literatuur daarom alleen studies met een minimale duur van 2 jaar geïncludeerd bij de kinderrichtlijn (Reinehr, 2009).
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk die meegewogen dienen te worden, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.htMl Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H., Brożek J., Guyatt G., et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Reinehr, T., Widhalm, K., l'Allemand, D., Wiegand, S., Wabitsch, M., Holl, R. W., & APV‐Wiss Study Group and German Competence Net Obesity. (2009). Two‐year follow‐up in 21,784 overweight children and adolescents with lifestyle intervention. Obesity, 17(6), 1196-1199.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Wharton, S., Lau, D. C., Vallis, M., Sharma, A. M., Biertho, L., Campbell-Scherer, D., ... & Boyling, E. (2020). Obesity in adults: a clinical practice guideline. CMAJ, 192(31), E875-E891.
Zoekverantwoording
Literature search strategy
|
Richtlijn: Diagnostiek en behandeling van obesitas bij volwassenen |
|
|
Uitgangsvraag: Wat is de effectiviteit van medicatie naast de GLI, in de behandeling van volwassenen met overgewicht en comorbiditeiten of obesitas? |
|
|
Database(s): Embase, Medline |
Datum: 22-7-2020 |
|
Periode: 2000 – juli 2020 |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen:
|
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
281 |
292 |
382 |
|
RCT |
|
|
|
|
Totaal |
|
|
|
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp *Overweight/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. (341905) 2 exp *Anti-Obesity Agents/ or (('anti obesit*' or 'anti obese*' or 'weight loss' or 'weight reduction' or antiobesit* or antiobese*) adj3 (drug* or agent* or medication)).ti,ab,kf. (11281) 3 exp *Orlistat/ or tetrahydrolipstatin.ti,ab,kf. or orlistat.ti,ab,kf. or xenical.ti,ab,kf. (1844) 4 exp *Naltrexone/ or 'naltrexone'.ti,ab,kf. (8213) 5 exp *Bupropion/ or 'amfebutamone'.ti,ab,kf. or 'bupropin'.ti,ab,kf. or 'bupropion'.ti,ab,kf. or 'buproprion'.ti,ab,kf. (4598) 6 exp *Liraglutide/ and ("3" or 'three' or "3.0").ti,ab. and (mg or milligram*).ti,ab. (160) 7 (('liraglutide' adj3 ("3" or "'three'or 3.0") adj3 (mg or milligram*)) or "liraglutide 3.0mg").ti,ab. (33) 8 exp *Glucagon-Like Peptide 1/ or 'semaglutide'.ti,ab,kf. (4741) 9 1 and (2 or 3 or 4 or 5 or 6 or 7 or 8) (7238) 10 limit 9 to (english language and yr="2000 -Current") (5875) 11 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (456631) 12 10 and 11 (292) |
|
Richtlijn: Diagnostiek en behandeling van obesitas bij volwassenen |
|
|
Uitgangsvraag: Wat is de effectiviteit van medicatie naast de GLI, in de behandeling van volwassenen met overgewicht en comorbiditeiten of obesitas? |
|
|
Database(s): Embase, Medline |
Datum: 13-10-2020 |
|
Periode: vanaf 2019 |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Dit is een aanvulling op de eerder uitgevoerde search op 22-7-2020. Er was toen voor SRs gezocht en er is besloten door de werkgroep om de review van Singh (2020) als uitgangspunt te nemen. In die review is gezocht tot september 2019, daarom zal er vanaf dan gezocht worden naar RCTs om de review aan te vullen tot heden.
|
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
281 |
292 |
382 |
|
RCT vanaf 2019 |
128 |
132 |
184 |
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp *Overweight/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. (367380) 2 exp *Anti-Obesity Agents/ or (('anti obesit*' or 'anti obese*' or 'weight loss' or 'weight reduction' or antiobesit* or antiobese*) adj3 (drug* or agent* or medication)).ti,ab,kf. (11556) 3 exp *Orlistat/ or tetrahydrolipstatin.ti,ab,kf. or orlistat.ti,ab,kf. or xenical.ti,ab,kf. (1976) 4 exp *Naltrexone/ or 'naltrexone'.ti,ab,kf. (8477) 5 exp *Bupropion/ or 'amfebutamone'.ti,ab,kf. or 'bupropin'.ti,ab,kf. or 'bupropion'.ti,ab,kf. or 'buproprion'.ti,ab,kf. (4873) 6 exp *Liraglutide/ and ("3" or 'three' or "3.0").ti,ab. and (mg or milligram*).ti,ab. (165) 7 (('liraglutide' adj3 ("3" or "'three'or 3.0") adj3 (mg or milligram*)) or "liraglutide 3.0mg").ti,ab. (33) 8 exp *Glucagon-Like Peptide 1/ or 'semaglutide'.ti,ab,kf. (4925) 9 1 and (2 or 3 or 4 or 5 or 6 or 7 or 8) (7527) 10 limit 9 to (english language and yr="2019 -Current") (742) 11 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (509670) 12 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2121685) 13 10 and 11 (49) 14 (10 and 12) not 13 (132) |
Algemene informatie
|
Richtlijn: Diagnostiek en behandeling van obesitas bij volwassenen |
|
|
Uitgangsvraag: Wat is de effectiviteit van medicatie naast de GLI, in de behandeling van volwassenen met overgewicht en comorbiditeiten of obesitas? |
|
|
Database(s): Embase, Medline |
Datum: 07-02-2022 |
|
Periode: vanaf 2014 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Dit is een aanvulling op de eerder uitgevoerde searches op 22-7-2020 en 13-10-2020. Er is een update gedaan voor het middel Semaglutide.
|
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
281 |
292 |
382 |
|
RCT vanaf 2019 |
128 |
132 |
184 |
|
SR en RCT -update Semaglutide vanaf 2014 |
70 |
43 |
59 |
Zoekverantwoording
Embase
|
No. |
Query |
Results |
|
#8 |
#6 OR #7 |
70 |
|
#7 |
#3 AND #5 NOT #6 |
27 |
|
#6 |
#3 AND #4 |
43 |
|
#5 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1872167 |
|
#4 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#3 |
#1 AND #2 AND ([english]/lim OR [dutch]/lim) AND [2014-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
246 |
|
#2 |
'semaglutide'/exp OR 'glucagon like peptide 1 [7-37] [8 (2 amino 2 methylpropanoic acid) 26 [6 n [18 [n (17 carboxyheptadecanoyl) gamma glutamyl] 10 oxo 3, 6, 12, 15 tetraoxa 9, 18 diazaoctadecanoyl] lysine] 34 arginine]':ti,ab,kw OR 'nn 9535':ti,ab,kw OR 'nn 9924':ti,ab,kw OR 'nn9535':ti,ab,kw OR 'nn9924':ti,ab,kw OR 'nnc 0113 0217':ti,ab,kw OR 'nnc01130217':ti,ab,kw OR 'og 217 sc':ti,ab,kw OR 'og 217sc':ti,ab,kw OR 'og217sc':ti,ab,kw OR 'ozempic':ti,ab,kw OR 'rybelsus':ti,ab,kw OR 'semaglutide':ti,ab,kw OR 'wegovy':ti,ab,kw |
2167 |
|
#1 |
'obesity'/exp/mj OR obese*:ti,ab,kw OR obesit*:ti,ab,kw OR overweight*:ti,ab,kw OR 'over weight*':ti,ab,kw |
592076 |
Medline
|
# |
Searches |
Results |
|
1 |
exp *Overweight/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. |
385789 |
|
2 |
'semaglutide'.ti,ab,kf. |
681 |
|
3 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1350003 |
|
4 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
545862 |
|
5 |
1 and 2 |
149 |
|
6 |
limit 5 to ((english language or dutch) and yr="2014 -Current") |
143 |
|
7 |
4 and 6 |
20 |
|
8 |
(6 and 3) not 7 |
23 |
|
9 |
7 or 8 |
43 |
