Identificatie causale geneesmiddel
Uitgangsvraag
Hoe kun je het causale geneesmiddel tijdens een vertraagde cutane geneesmiddelenreactie identificeren?
Aanbeveling
Zorg voor een volledig medicatieoverzicht inclusief zelfzorgmedicatie en medicatie die gestaakt is (tot enkele weken na het laatst gestaakte geneesmiddel).
Bepaal eerst het type geneesmiddelenreactie als uitgangspunt voor de causaliteitsbepaling, omdat dit bepalend is voor het tijdsinterval waarbinnen gezocht moet worden naar het meest verdachte geneesmiddel.
Bepaal het causale middel of de causale middelen door het aantal verdachte middelen binnen de tijdsrelatie te rangschikken op mate van verdenking.
Overwegingen
Kwaliteit van het bewijs
Voor deze uitgangsvraag is niet systematisch naar literatuur gezocht en is er geen GRADE-analyse verricht.
Professioneel perspectief
Voor de identificatie van het causale geneesmiddel worden vier stappen onderscheiden en nader toegelicht
- Volledig medicatie overzicht, met informatie over start en eventuele tussentijdse stopperiodes, dosisveranderingen, verandering van productsamenstelling, in relatie tot klachtenbeloop (ontstaan, verergering of verbetering)
- Klinische differentiatie van type geneesmiddelenreactie
- Tijdsrelatie tussen start specifieke geneesmiddel en start van klinische klachten (index dag)
- Type geneesmiddel (mate van verdenking; notoriteit)
Door combinaties en afwegen van deze 4 aspecten wordt een causaliteitsprioritering van alle op de index-dag (dag 1 van de reactie) gebruikte of recent (tot weken geleden) gestopte geneesmiddelen opgesteld.
1. Volledig medicatie overzicht
Bij sommige type IV reacties kan het uitlokkend medicament variabel van dagen tot maanden later klachten uitlokken. Bovendien kunnen klachten ook worden uitgelokt door medicatie/supplementen die zonder recept te verkrijgen zijn. Om deze reden is het belangrijk om niet alleen de actuele receptuurmedicatie te evalueren, maar alle door patiënt gebruikte medicatie in dit verdachte tijdsbestek met startdatum en (indien van toepassing) stopdatum mee te nemen, inclusief reeds gestopte medicatie.
Een volledig medicatie overzicht bestaat uit de volgende items
- Alle medicatie van alle apotheken waar patiënt medicatie haalt, die afgeleverd is tijdens het verdachte tijdsbestek. Vraag bij voorkeur een uitdraai op zodat geen medicatie over het hoofd wordt gezien
- Alle zelfzorgmedicatie die patiënt binnen het verdachte tijdsbestek heeft genomen
2. Klinische differentiatie van type geneesmiddelenreactie
De identificatie van het causale geneesmiddel start met de correcte klinische diagnose waarbij het type geneesmiddelenreactie klinisch en eventueel middels aanvullend onderzoek (bloedonderzoek, histologie) vastgesteld moet worden (zie hoofdstuk overzicht geneesmiddelenreacties).
Ook is het van belang om rekening te houden met een bredere differentiaal diagnose waarin diagnosen anders dan een geneesmiddelenreacties overwogen dienen te worden.
3. Tijdsrelatie (Chronologie)
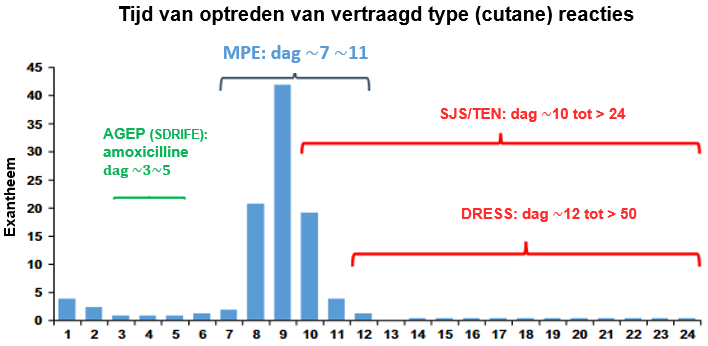
De tijdsrelatie tussen de start van een geneesmiddel en de manifestatie van een specifieke geneesmiddelenreactie verschilt afhankelijk van het type reactie. Zie ook Figuur 5 (vertaald en geadapteerd uit Pichler, 2019). De klinische diagnose bepaalt dus in welke tijdsperiode gezocht moet worden naar potentiële causale geneesmiddelen. Als het gaat om meerdere middelen, kan op basis van chronologie en het profiel van het geneesmiddel (wel of geen bekende uitlokker van het betreffende ziektebeeld) een lijst opgesteld worden van hoge tot lage verdenking. Een overzicht van de tijdsrelatie tussen de inname van een geneesmiddel en het ontstaan van een geneesmiddelenreactie is te vinden in Tabel 6.
Hierbij dient men er wel van bewust te zijn dat de tijdsrelatie tot optreden van eerste klachten bij een niet gesensibiliseerde patiënt langer is dan bij een reeds gesensibiliseerde patiënt. In geval van bijvoorbeeld MPE is de latentie fase bij een de novo reactie 5 tot 7 dagen terwijl dit bij een bestaande sensibilisatie ca 6 uur tot 2 dagen is.
Figuur 5 Manifestatie van enkele vertraagd type geneesmiddelenreacties. Het staafdiagram geeft het optreden van MPE weer bij vrouwen na toediening van gemifloxacine, waarbij de y-as de hevigheid van het exantheem weergeeft. AGEP kan al na 3-4 dagen optreden; MPE na <7-12 dagen, niet zelden na het staken van de therapie; SJS/TEN en DRESS treden vaak na een langer tijdsinterval op (naar Pichler, 2019).
4. Type geneesmiddel (mate van verdenking; notoriteit)
Hoewel in principe elk geneesmiddel elke reactie kan veroorzaken, hebben de diverse geneesmiddelgroepen vaak wel een eigen profiel: MPE wordt vaak door (bèta-lactam) antibiotica veroorzaakt, terwijl cardiovasculaire middelen hier nauwelijks om bekend staan. Allopurinol en carbamazepine zijn beruchte veroorzakers van TEN, terwijl bijvoorbeeld macrolide antibiotica zelden beschreven zijn als oorzaak (zie ook Sassolas, 2010). Daarentegen zijn er ook middelen die diverse reacties kunnen uitlokken: bijvoorbeeld cotrimoxazol is een middel dat zowel TEN, als DRESS als MPE kan veroorzaken. In de literatuur (zie referentie lijst) is een overzicht te vinden van welke middelen bekend staan als oorzaak van specifieke geneesmiddelenreacties. Een kort overzicht is te vinden in onderstaande Tabel 6.
Bij nieuwe geneesmiddelen of middelen die zelden reacties geven, bijvoorbeeld omdat ze niet vaak worden voorgeschreven, is het raadzaam om in de literatuur na te gaan of het verdachte middel wellicht inmiddels in een of meerdere casereport(s) beschreven is als veroorzaker van het desbetreffende beeld. Andere belangrijke bronnen hierbij zijn “Systemic Drugs” van Anton C. de Groot, Litt’s “Drug eruption and reaction database” en de website van het Farmacotherapeutisch Kompas en het Lareb.
Causaliteit prioritering
Het staken van het veroorzakend geneesmiddel is naast behandeling van het huidbeeld de beste manier om de reactie te stoppen. Een beoordeling van het klinische effect verschilt per huidbeeld. Bij (milde) maculopapuleuze exanthemen kunnen reeds binnen dagen verbeteringen gezien worden, terwijl bij lichenoïde afwijkingen soms maanden nodig zijn. Zeker zo belangrijk is het niet onnodig staken van voor de patiënt noodzakelijke medicatie. Om deze reden wordt op basis van reeds genoemde 4 factoren een causaliteitsprioriteringslijst vastgesteld met potentiële causale geneesmiddelen, van meer naar minder waarschijnlijk, waarbij zoals eerder genoemd het belangrijk is om ook reeds gestaakte en zelfzorgmedicatie mee te nemen. Afhankelijk van het type reactie en de tijdsrelatie kunnen geneesmiddelen stijgen of dalen op deze lijst op basis van hun bekende vermogen de reactie uit te lokken. Met andere woorden, een bekend causaal geneesmiddel voor dat type dat gestart is buiten het tijdsinterval, zal dalen op de causaliteitslijst, terwijl een minder bekend causaal geneesmiddel dat gestart is binnen het verdachte tijdsinterval, zal stijgen.
Voor SJS/TEN is hiervoor een specifieke score ontwikkeld en gevalideerd, de zogenaamde ALDEN score. Bij deze methode wordt door middel van extra variabelen een score berekend specifiek voor SJS/TEN waarmee de waarschijnlijkheid van causaliteit van een bepaald middel geprioriteerd kan worden (Sassolas, 2010).
Tabel 6 Tijdsintervallen en meest voorkomende uitlokkers afhankelijk van het type geneesmiddelenreactie. N.B.: de tijdsrelaties zijn relatief; hier worden de bekendste middelen benoemd; gebruik van een van deze middelen sluit een ander causaal geneesmiddel niet uit.
|
Type geneesmiddelenreactie |
Typische tijdsinterval tussen inname en huidreactie |
Beruchte geneesmiddelen |
|
Urticaria/angio-oedeema, anafylaxie |
Typisch binnen 1 uur na start geneesmiddel |
Penicillinen Cefalosporinen NSAID’s |
|
SJS/TEN |
4 – 28 dagen na start geneesmiddelb |
Allopurinol Enkele anti-epileptica zoals fenobarbital en carbamazepine Antibacteriële sulfonamiden Nevirapine Oxicams (NSAID’s) |
|
AGEP |
1 – 12 dagen na start geneesmiddelc |
Bèta-lactamantibiotica Macroliden Diltiazem Terbinafine (Hydroxy-)Chloroquine NSAID’s |
|
Vasculitis |
7 – 21 dagen na start geneesmiddel |
Bèta-lactamantibiotica NSAID’s Antibacteriële sulfonamiden |
|
DRESS |
2 – 12 weken na start geneesmiddel |
Enkele anti-epileptica Allopurinol Dapson Antibacteriële sulfonamiden Vancomycine |
|
SDRIFEd |
Tot 7 dagen |
Bèta-lactamantibiotica |
|
MPE |
4 – 14 dagen na start geneesmiddele |
Antibiotica Anti-epileptica Allopurinol NSAID’s |
|
FDE |
30 min tot 8 uur na start geneesmiddel |
Antibacteriële sulfonamiden NSAID’s, waaronder metamizol Barbituraten Tetracyclinen Carbamazepine |
|
Systemische fotoallergische reacties |
Dagen tot jaren |
NSAID’s Promethazine Chloorpromazine |
|
Geneesmiddeleninduceerde Lineaire IgA dermatose |
1- 14 dagen |
Antibiotica (vancomycine, rifampicine, metronidazol, cefalosporinen) Lithium Diclofenac en piroxicam Furosemide ACE-remmers (captopril) |
|
Geneesmiddel geïnduceerde LE |
Weken tot 8-12 maanden |
Hydrochloorthiazide Protonpompremmers Terbinafine ACE-remmers Bètablokkers Calciumantagonisten TNF-alfa-blokkers Leflunomide Bupropion |
|
Geneesmiddel geïnduceerde Morbus Sweet |
5 dagen tot 2 maanden |
GM-CSF Retinoïden Vaccins Minocycline Azathioprine |
|
Interstitiële granulomateuze geneesmiddelreactie |
Enkele weken tot maanden |
Anakinra Ganciclovir Furosemide TNF-alfa-blokkers (adalimumab) ACE-remmers Bètablokkers Calciumantagonisten Anti-epileptica Antidepressiva |
|
Geneesmiddel geïnduceerde psoriatiforme reacties |
Enkele weken tot maanden |
Lithium Sorafenib Bètablokkers Antimalariamiddelen TNF-alfa-blokkers |
|
Geneesmiddel geïnduceerde lichenoïde reacties |
Enkele weken tot maanden |
Lithium Bètablokkers Antimalariamiddelen Methyldopa Sorafenib Biologicals |
|
Geneesmiddel geïnduceerde pseudolymfomateuze reacties |
Enkele weken tot maanden |
Carbamazepine Fenytoïne ACE-remmers |
|
Acneïforme erupties geneesmiddel geinduceerd |
7-14 dagen |
EGFR-blokkers |
- ACE (angiotensine-converting enzyme) remmers induceren specifiek angio-oedeem in een latere tijdsrelatie tot maanden-jaren na start van de behandeling en is niet geassocieerd met urticaria.
- Soms langer in geval van allopurinol.
- Meestal 1-2 dagen in geval van antibiotica, vaak 7-12 dagen in geval van andere medicatie.
- Systemische reactivering van allergische contact dermatitis.
- Tijdsinterval in terugkerende reacties zijn vaak korter vergeleken met de eerste reactie. In maculopapuleuze geneesmiddelenreacties is de reactie die typisch wordt gezien na 1–4 dagen niet onderzocht in AGEP, SJS, TEN en DRESS.
Overige factoren die van invloed zijn bij het bepalen van causaliteit
- Genetische factoren (met name HLA types) kunnen predisponeren voor specifieke geneesmiddelen reacties geïnduceerd door specifieke geneesmiddelen. Zo is screening op het HLA-B*5701-allel vereist voorafgaand aan het voorschrijven van abacavir in verband met een sterk verhoogde kans op ernstige overgevoeligheidsreacties. Voorspellende genetische analysen voor bijvoorbeeld HLA-B*1502 om het risico op carbamazepine-geïnduceerd SJS/TEN in te schatten is in Europa niet zinvol, terwijl dat in Taiwan een effectieve strategie is. Wel is het belangrijk om bewust te zijn van deze achtergrond bij het beoordelen van patiënten met een specifieke migratieachtergrond. Meer informatie is te vinden in recente overzichtsartikelen (Chu, 2023).
- Fototoxische en fotoallergische huidreacties kunnen door een breed spectrum aan lokale en systemische geneesmiddelen geïnduceerd worden, waarbij fototoxische reacties vaker voorkomen dan fotoallergische. Het is belangrijk om bij de diagnose van een foto-dermatose ook te denken aan een mogelijke causaliteit van een geneesmiddel.
Onderbouwing
Achtergrond
In de acute fase van een mogelijke type IV allergische reactie is het van belang om het causale geneesmiddel zo goed mogelijk te identificeren, dan wel sterk verdachte van niet/minder verdachte geneesmiddelen te onderscheiden. Hierop volgt meestal de beslissing om het (meest waarschijnlijke) causale medicament te staken en eventueel te vervangen door een geschikt alternatief. In sommige gevallen kan het, bij onduidelijkheid betreffende de causaliteit of reeds langer bestaande klachten, nodig zijn meerdere geneesmiddelen te stoppen. In enkele gevallen is er een indicatie voor het bewust continueren van een geneesmiddel (zie hoofdstuk Doorbehandelen met verdacht geneesmiddel (treating through)).
In alle gevallen is het van groot belang om zo veel mogelijk duidelijkheid te hebben welk geneesmiddel de reactie (meest waarschijnlijk) heeft veroorzaakt.
Zoeken en selecteren
Voor deze vraag is niet naar wetenschappelijke literatuur gezocht. Binnen de GRADE-methodiek is het systematisch literatuuronderzoek gebaseerd op vergelijkend onderzoek, veelal gerandomiseerd onderzoek. Het is niet aannemelijk dat onze uitgangsvraag met dit type onderzoek beantwoord kan worden, of dat dergelijk onderzoek in dit kader is verricht. Bij de uitwerking van deze uitgangsvraag werd gebruik gemaakt van verschillende overzichtsartikelen en boeken die in de referentielijst worden vermeld.
Referenties
- - Abrams EM, Khan DA. Diagnosing and managing drug allergy. CMAJ. 2018 Apr 30;190(17):E532-E538. doi: 10.1503/cmaj.171315.
- - Brockow, Knut, et al. "EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity." Allergy 74.1 (2019): 14-27.
- - Chu MT, Chang WC, Pao SC, Hung SI. Delayed Drug Hypersensitivity Reactions: Molecular Recognition, Genetic Susceptibility, and Immune Mediators. Biomedicines. 2023 Jan 10;11(1):177.
- - French L.E. (2012). Adverse cutaneous Drug Eruptions. Chemical Immunology and Allergy. ISSN 1660-2242.
- - Groot, de AC. Monographs in Contact Allergy Volume 4. Systemic Drugs. Boca Raton. CRC Press. 2022. ISDN 978-0-367-43649-0.
- - Litts Drug Eruption & Reaction Database. CRC Press Taylor & Francis Group. 2022. Beschikbaar via: https://www.drugeruptiondata.com.
- - Pichler WJ. Immune pathomechanism and classification of drug hypersensitivity. Allergy. 2019 Aug;74(8):1457-1471. doi: 10.1111/all.13765. Epub 2019 Apr 29. PMID: 30843233.
- Sassolas B, Haddad C, Mockenhaupt M, Dunant A, Liss Y, Bork K, Haustein UF, Vieluf D, Roujeau JC, Le Louet H. ALDEN, an algorithm for assessment of drug causality in Stevens-Johnson Syndrome and toxic epidermal necrolysis: comparison with case-control analysis. Clin Pharmacol Ther. 2010 Jul;88(1):60-8.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-08-2023
Beoordeeld op geldigheid : 05-06-2023
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Behandeling cutane geneesmiddelenreacties |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Aanleiding
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie is de richtlijn “management van de acute fase van vertraagd type overgevoeligheidsreacties op geneesmiddelen” ontwikkeld. Voor dit onderwerp was nog geen richtlijn beschikbaar, terwijl het een belangrijk onderwerp is voor zowel patiënt als zorgverlener. Beoogd is een evidence-based richtlijn te ontwikkelen waarin staat welke diagnostiek er plaats moet vinden indien een behandelaar vermoedt dat er een reactie op een geneesmiddel is opgetreden, en men het van belang acht de oorzakelijke factor op te sporen. Het is belangrijk voor de patiënt te weten welk geneesmiddel beter vermeden kan worden. Daarnaast moet men voorkómen dat de patiënt onnodig essentiële geneesmiddelen wordt onthouden.
Afbakening onderwerp
In deze richtlijn worden adviezen gegeven ten aanzien van de diagnostiek en behandeling van acute fase van vertraagd type geneesmiddelenreacties en dient als leidraad voor de dermatoloog en andere zorgprofessionals die hiermee in aanraking komen. De werkgroep heeft gekozen om drug reaction with eosinophilia and systemic symptoms (DRESS), acute gegeneraliseerde exanthemateuze pustulose (AGEP) en maculopapuleus exantheem (MPE) verder uit te werken in deze richtlijn, omdat het hier de meest voorkomende geneesmiddelenreacties betreft.
Definities
In de titel van deze richtlijn is ervoor gekozen de meest correcte benaming van het type reactie te gebruiken dat in deze richtlijn besproken wordt. De benaming ‘vertraagd type geneesmiddelenreactie’ is echter ook gebruikelijk. Omdat deze term beter werkbaar is, wordt in deze richtlijn vaak voor deze benaming gekozen.
De WHO definieert een bijwerking als een reactie op een geneesmiddel die schadelijk en onbedoeld is en die ontstaat bij gebruikelijke doseringen (WHO, 2002). Zowel allergische als niet-allergische mechanismen kunnen ten grondslag liggen aan geneesmiddelenreacties. Allergische reacties ontstaan pas nadat sensibilisatie is opgetreden. De reacties worden bij een eerste blootstelling meestal pas manifest 7-21 dagen na de start van het geneesmiddel. De reactie kan van milde ernst zijn, zoals een lichte huiduitslag, maar kunnen ook ernstige levensbedreigende reacties veroorzaken die niet alleen tot de huid beperkt zijn. Huidafwijkingen veroorzaakt door geneesmiddelen (geneesmiddelenerupties) kunnen zich onder andere uiten als erytheem (roodheid), papels, pustels, pruritus en als levensbedreigende situaties, zoals toxische epidermale necrolyse (TEN) of DRESS. Als algemene benaming van huiduitslag wordt vaak de term exantheem gebruikt: een plotseling, voorbijgaande, uitgebreide huiduitslag die meestal wordt veroorzaakt door een infectie of door de inname van een geneesmiddel. Exacte gegevens over de incidentie van geneesmiddelenerupties ontbreken, zeer waarschijnlijk ten gevolge van onderrapportage. Onderzoeken naar de prevalentie van bijwerkingen onder patiënten die in het ziekenhuis zijn of worden opgenomen, komen uit op 10-20% van de opgenomen patiënten; 1-20% van hen heeft een huidreactie. Bij oudere patiënten wordt vaker een geneesmiddeleneruptie gediagnosticeerd dan bij jongere, hetgeen waarschijnlijk het toenemend medicijngebruik bij het stijgen van de leeftijd reflecteert (Beijer, 2002).
In deze richtlijn staan vertraagd type overgevoeligheidsreacties op geneesmiddelen centraal. Dit kunnen geneesmiddelen op recept zijn, maar ook vrij verkrijgbare geneesmiddelen en supplementen. In deze richtlijn wordt de overkoepelende term geneesmiddelen gebruikt.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten in de acute fase van een vertraagd type geneesmiddelenreactie. Er wordt een overzicht gegeven van de geneesmiddelenreacties, de verschillende huidreacties, hun reactietype en de relevante differentiaal diagnoses. Daarnaast wordt er gekeken naar het effect van onterecht labelen en de plaats van aanvullend onderzoek in de acute fase.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: dermatologen, pathologen, medisch microbiologen, kinderartsen, apothekers, internisten, (kinder)allergologen, verpleegkundig specialisten, physician assistants, huidtherapeuten, dermatologieverpleegkundigen en diegenen die voor deze beroepen in opleiding zijn. Voor huisartsen geldt dat zij primair gebruik maken van NHG-richtlijnen. Als deze richtlijnen voor hen ontoereikend blijken te zijn, kunnen zij gebruik maken van deze richtlijn. Voor patiënten werd informatie op thuisarts.nl en een patiëntenfolder ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden.
|
Vereniging |
|
|
Dr. H. Röckmann (voorzitter) |
NVDV |
|
Prof. dr. T. Rustemeyer |
NVDV |
|
Dr. A.J. Oosting |
NVDV |
|
Drs. M. ter Avest |
NVZA |
|
Drs. G.H.P.R. Slabbers |
NVK |
|
Dr. G.F.H. Diercks |
NVVP |
|
Drs. Z. Tempels-Pavlica |
NIV |
|
Dr. I. Terreehorst |
NIV |
|
Dr. A.A.J.M. van der Ven |
NIV |
|
Prof. dr. R. Aarnoutse |
NVZA |
|
Drs. M.H.E. Vos |
Arts-onderzoeker NVDV |
|
Drs. Z. Çiftçi |
Arts-onderzoeker NVDV |
|
Drs. D.M. van Loon |
Arts-onderzoeker NVDV |
|
Drs. M. Stolting |
Arts-onderzoeker NVDV |
|
Drs. E. van Veen |
Arts-onderzoeker NVDV |
|
Drs. A.C. de Waal |
Arts-onderzoeker NVDV |
|
Ondersteuning werkgroep |
Vereniging |
|
Dr. W.A. van Enst |
Klinisch epidemioloog NVDV |
Tabel 1 Overzicht betrokken partijen
|
Overzicht betrokken partijen* |
Zitting neming in werkgroep |
Knelpunten analyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
X |
X |
X |
X |
|
|
Nederlandse Internisten Vereniging (NIV) |
X |
X |
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor Medische Microbiologie (NVMM) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor Klinische Geriatrie (NVKG) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor ZiekenhuisApothekers (NVZA) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Pathologie (NVVP) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Klinische Farmacologie (NVKFB) |
|
|
X |
|
|
|
Vereniging van Specialisten Ouderengeneeskunde (Verenso) |
|
|
X |
|
|
|
Overige organisaties |
|
|
|
|
|
|
Nederlandse Vereniging Huidtherapeuten (NVH) |
|
|
X |
|
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
|
|
X |
|
|
|
Stichting Werkgroep Antibiotica Beleid (SWAB) |
|
X |
X |
|
|
|
Patiëntenverenigingen |
|||||
|
Huid Nederland (HN) |
|
|
X |
X |
|
|
Patiëntenfederatie Nederland |
|
|
X |
X |
|
|
Stakeholders |
|||||
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
X |
|
Geen respons |
|
Zelfstandige klinieken Nederland (ZKN) |
|
|
X |
|
Geen deelname |
|
Zorgverzekeraars Nederland (ZN) |
|
|
X |
|
Geen deelname |
|
Zorginstituut Nederland (ZiN) |
|
|
X |
|
Geen deelname |
|
Vereniging Innovatieve Geneesmiddelen (VIG) |
|
|
X |
|
Geen deelname |
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
Geen deelname |
*alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
|
Dr. H. (Heike) Röckmann (voorzitter) |
Dermatoloog UMC Utrecht |
* Klinische adviesraad Lareb (onbezoldigd) |
Geen |
Nee |
Geen |
Geen |
Geen |
3-9-2020 |
|
Prof. Dr. T. (Thomas) Rustemeyer |
Dermatoloog Amsterdam UMC, locatie VUMC |
Geen |
nvt |
nvt |
nvt |
nvt |
nvt |
7-9-2020 |
|
Dr. A.J. (Bert) Oosting |
Dermatoloog Spaarne Gasthuis |
* Docent bij Uconsultancy, onderwijs doktersassistenten * Adviesraad Uconsultancy |
Geen |
Geen |
Geen |
Geen |
Geen |
2-9-2020 |
|
Drs. M. (Mendy) ter Avest |
Ziekenhuisapotheker in opleiding in het RadbouUMC/CWZ en PhD student in het RadboudUMC |
Geen |
nvt |
Nee |
Nee |
Nee |
Nee |
2-9-2020 |
|
Drs. G.H.P.R. (Gordon) Slabbers |
Kinderarts Ziekenhuis Bernhoven Uden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
7-9-2020 |
|
Dr. M.B. (Miquel) Ekkelenkamp |
Arts-microbioloog UMC Utrecht |
Lid SWAB-ledenraad (onbetaald) |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
26-8-2020 |
|
Drs. Z. (Zana) Tempels-Pavlica |
Internist-allergoloog Diakonessenhuis |
* Lid commissie accreditatie en visitatie van NVvAKI (onbetaald) |
Geen |
Nee |
Geen |
Voornaamste belang is landelijk een duidelijk beleid opstellen. Mijn ziekenhuis zal daar ook van profiteren net als alle andere ziekenhuizen in NL. In mijn ziekenhuis wordt geneesmiddelen diagnostiek reeds volop gedaan dus er is geen marketing winst. |
Nee |
28-8-2020 |
|
Dr. I. (Ingrid) Terreehorst |
* Internist-allergoloog en staflid KNO bij AmsterdamUMC, 0,8FTE |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
3-9-2020 |
|
Dr. A.A.J.M. (Annick) van de Ven |
Internist-allergoloog-immunoloog UMC Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet voor zover bekend |
31-8-2020 |
|
Drs. M (Marit) Stolting |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
30-09-2021 |
|
Drs. A.C. (Ayla) de Waal |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
21-10-2022 |
|
Drs. D.M. (Diederik) van Loon |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
21-10-2022 |
|
Drs. Z. (Zekeriya) Çiftçi |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet getekend; uit dienst oktober 2021 |
|
Drs. E. (Esther) van Veen |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet getekend; uit dienst april 2022 |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door de bespreking van de waarden en voorkeuren voor de patiënt in de modules over behandeling. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Huid Nederland.
Implementatie
In de verschillende fasen van de ontwikkeling van de richtlijn is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. Het volledige implementatieplan is opgenomen in dit bijlagedocument.
Werkwijze
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden. Hierbij zijn leden van de volgende verenigingen aanwezig geweest: NVDV, NVZA, NVK, NVMM, NIV, NVGK, NVVP en SWAB. Tevens werden de volgende verenigingen/instanties uitgenodigd, maar zijn niet aanwezig geweest: NHG (knelpunten wel aangedragen), NVKFB, Nederlandse Vereniging van Ziekenhuizen (NVZ), Zorginstituut Nederland (ZiN), Inspectie Gezondheidszorg en Jeugd (IGJ), Verenso, V&VN, Huid Nederland (HN) en de Nederlandse Federatie van Universitair Medische Centra (NFU).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in Bijlage 4: Tabellen en figuren
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE
|
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie
Bijlage 10: Kennislacunes).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Referenties
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
- Beijer HJ, de Blaey CJ. Hospitalisations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci. 2002 Apr;24(2):46-54.
- Safety of Medicines. A guide to detecting and reporting adverse drug reactions. World Health Organization. Geneva. 2002. p.5.