Doorbehandelen met verdacht geneesmiddel (treating through)
Uitgangsvraag
Wanneer kan ervoor gekozen worden om door te behandelen met het verdachte geneesmiddel in de exanthemateuze fase (treating through-beleid) bij een vertraagd type IV cutane geneesmiddelenreactie ?
Subvragen:
- Wat zijn gunstige indicatoren met betrekking tot reactie en behandeling voor een succesvolle treating through-behandeling?
- Wat zijn indicaties en contra-indicaties voor een treating through-beleid?
Aanbeveling
Kies na een bewezen geneesmiddelexantheem bij voorkeur voor een gelijkwaardig, niet kruisreagerend, alternatief geneesmiddel.
Overweeg het doorbehandelen met het verdachte geneesmiddel (treating through),
- Bij sterke behandelindicatie en geen gelijkwaardig alternatief voorhanden.
- Met zorgvuldige afweging van risico en baten (uitsluiten van contra-indicaties),
- en altijd in nauwe afstemming met de hoofdbehandelaar
Licht de patiënt voor start van de treating throughbehandeling voor over de alternatieven en eventuele risico’s en documenteer dit in het dossier. Evalueer tijdens de treating through-behandeling nauw de klinische klachten en overweeg laboratoriummonitoring (zie hoofdstuk aanvullende diagnostiek).
Stop treating through bij (onacceptabele) verergering van het huidbeeld of bij aanwijzingen voor progressie met orgaanbetrokkenheid zonder evidente andere verklaring.
Overwegingen
Wanneer dient overwogen te worden om voor een treating through-principe te kiezen?
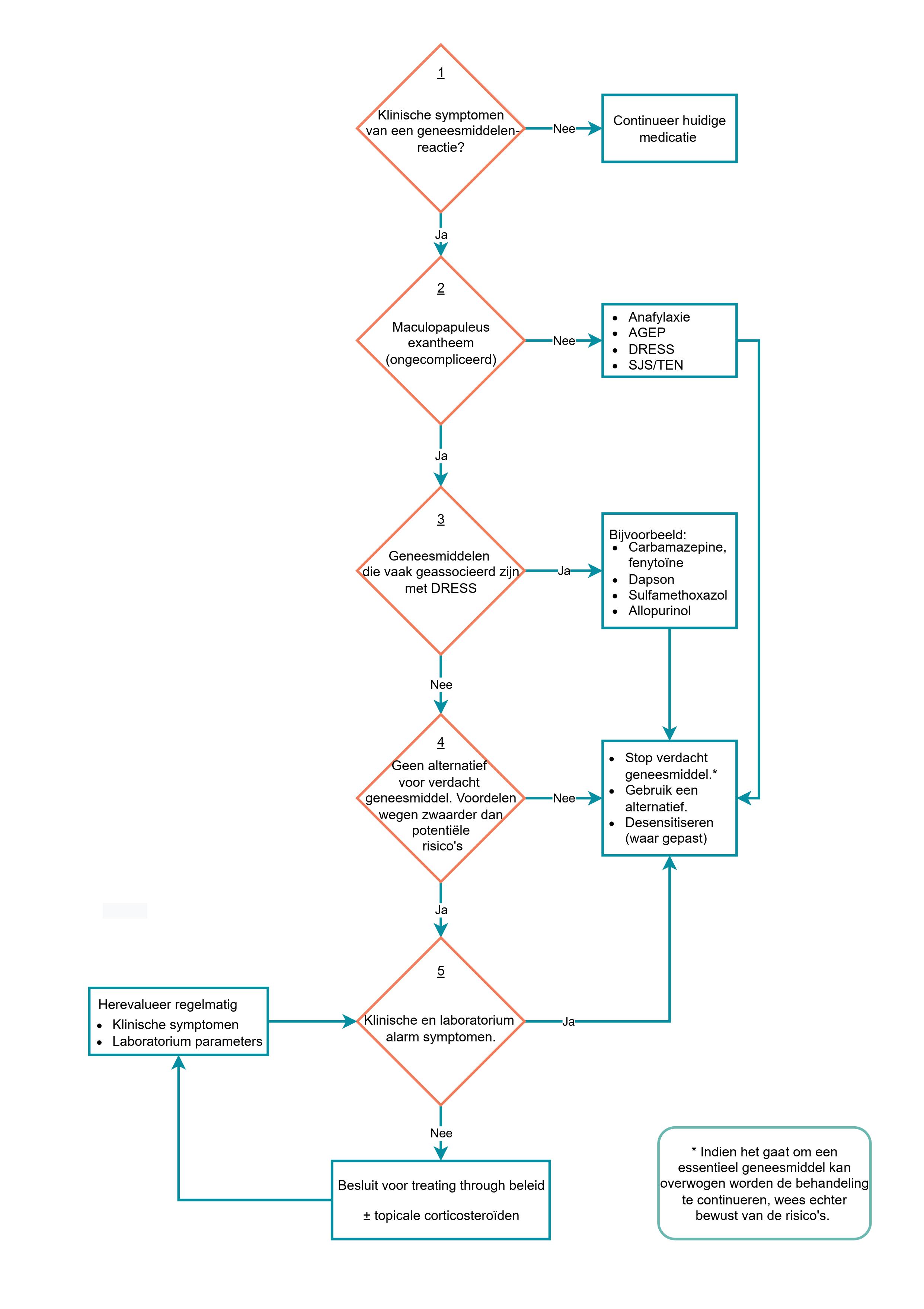
Het is de huidige standaard om het verdachte medicament, dat als oorzaak van de geneesmiddelenreactie wordt gezien, te staken. Er kunnen echter gegronde redenen zijn om de behandeling met eenzelfde medicament te continueren, wanneer de voordelen van het continueren groter zijn dan de verwachte risico’s. Dit betreft met name (ernstige) aandoeningen met een dwingende behandelindicatie waarbij het aantal medicamenteuze opties beperkt is, of indien deze middelen sterk aan elkaar verwant zijn en dus een groot risico op kruisreactie bestaat. Hierbij dienen de volgende punten geëvalueerd te worden, zie ook Figuur 6.
- Is er een zeer sterke behandelindicatie met het betreffende geneesmiddel? Is dit geneesmiddel de eerste keus behandeling of zijn er (vrijwel) gelijkwaardige alternatieven beschikbaar?
- Is een geneesmiddelenreactie de meest waarschijnlijke diagnose en zijn ernstigere type IV reacties of andere ernstige geneesmiddelen reacties met orgaanbetrokkenheid voldoende uitgesloten?
- Zijn er nog andere absolute of relatieve contra-indicaties waar rekening mee gehouden dient te worden?
- Is de follow-up en monitoring bij starten van treating through gewaarborgd?
- Hoe wordt een ’treating through‘ behandeling uitgevoerd?
Ad 1. Is er een zeer sterke behandelindicatie voor het betreffende geneesmiddel?
Er dient een sterke behandelindicatie voor het betreffende geneesmiddel te bestaan. Indien er een gelijkwaardige of vrijwel gelijkwaardige alternatieve behandeling bestaat, verdient dit de voorkeur boven herintroductie (al dan niet via treating through of desensitisatie) van het verdachte geneesmiddel. Dit dient beoordeeld te worden door de betreffende hoofdbehandelaar van de patiënt, al dan niet in overleg met aangrenzende specialismen (bijvoorbeeld een apotheker, allergoloog/allergiespecialist, medisch microbioloog of infectioloog).
Ad 2. Is een geneesmiddelenreactie de meest waarschijnlijke diagnose en zijn ernstige type IV reacties of andere ernstige geneesmiddelen reacties met orgaanbetrokkenheid voldoende uitgesloten?
Het is belangrijk om zo veel mogelijk zekerheid omtrent de diagnose van geneesmiddelenreactie te verkrijgen. Hierbij zijn van belang:
- Causaliteit:
- Is het betreffend middel de meest waarschijnlijke oorzaak van de reactie, rekening houdend met klinische presentatie en tijdsrelatie tussen het toedienen en ontstaan van afwijkingen.
- Zijn er nog andere potentieel verdachte middelen of andere potentiële verklaringen (zoals viraal exantheem).
- Ernst van de reactie:
- Betreft het inderdaad een mild/ matige type IV reactie zoals een maculopapuleus exantheem of Fixed Drug Eruption, en is een ernstige, potentieel levensbedreigende, reactie voldoende uitgesloten.
Algemene risico-batenanalyse voor de individuele patiënt:
Het risico bestaat dat de betreffende reactie zich zal herhalen, met een mogelijk ernstiger beloop dan verwacht. De kans op een ernstig beloop moet vooraf zo goed mogelijk worden ingeschat en worden afgewogen tegen de baten die de patiënt(e) naar verwachting zal hebben door behandeling met het betreffende middel. Een belangrijke afweging is of de patiënt(e) door de behandeling met het betreffende middel een groot risico loopt of juist een groter risico door het vermijden hiervan. Hiervoor is gezamenlijke afweging / afstemming met de hoofdbehandelaar essentieel.
Zorgvuldige anamnese, lichamelijk onderzoek en eventueel laboratoriumonderzoek (zie hoofdstuk overzicht geneesmiddelenreacties) ter uitsluiting van een ernstige geneesmiddelenreactie (severe cutaneous adverse reaction [SCAR]) of uitgangsbevindingen voor later vergelijk indien nodig.
Ad 3. Zijn er nog andere absolute of relatieve contra-indicaties waar rekening mee gehouden dient te worden?
Een overzicht van alarmsymptomen en contra-indicaties is te vinden in Tabel 7. Bij de risicoanalyse dient meegenomen te worden of er aanvullende risicofactoren zijn zoals een slechte algemene gezondheid of co-morbiditeit, welke invloed heeft op het beloop en andere mogelijke risicofactoren. Er dient rekening te worden gehouden met dat ernstige type IV reacties in een vroeg stadium sterk kunnen lijken op mildere huidbeelden zoals een maculopapuleus exantheem. Indien het geneesmiddel al in een zeer vroeg stadium gestaakt is, is het daarom niet met 100% zekerheid uit te sluiten dat het geen beginstadium van een SCAR betrof, ook al is dit scenario zeldzaam. Extra waakzaamheid is geboden bij geneesmiddelen met een duidelijk verhoogd risico op een SCAR zoals de medicamenten genoemd in Tabel 8 bij relatieve contra-indicaties.
Tabel 7 Overzicht alarmsymptomen en contra-indicaties
|
Klinische alarmsymptomen als mogelijke contra-indicatie voor “doorbehandelen met het verdachte geneesmiddel” (treating through) |
(Potentiële) indicatie voor: |
|
Algehele malaise, nieuw ontstaan bij huidbeeld |
DRESS; AGEP; SJS/TEN |
|
Gegeneraliseerde lymfadenopathie, nieuw ontstaan bij huidbeeld |
DRESS |
|
Koorts, niet goed verklaard door andere oorzaken als infectie |
DRESS; AGEP |
|
Afwijkende laboratoriumwaarden (i.e. nier- en leverfunctiestoornissen, afwijkend bloedbeeld, verhoogde inflammatie parameters) |
DRESS; AGEP; SJS/TEN |
|
Faciaal oedeem en/of ernstige betrokkenheid gelaat |
DRESS |
|
Erythrodermie |
DRESS of ernstig MPE |
|
Atypische target of laesies |
SJS/TEN |
|
Pijnlijke huid |
SJS/TEN |
|
Mucosale betrokkenheid |
SJS/TEN |
|
Bulleuze laesies |
SJS/TEN |
|
Hemorragische en/of necrotische laesies |
Vasculitis |
|
Ernstige pustulose |
DRESS; AGEP |
Tabel 8 Contra-indicaties voor het doorbehandelen met een verdacht geneesmiddel (treating through-beleid) bij geneesmiddelen exanthemen (geadapteerd uit Absmaier, 2017)
|
|
|
|
Absolute contra-indicaties |
Ernstige of levensbedreigende geneesmiddelenexanthemen (SJS/TEN, DRESS), cutane of systemische vasculitis. |
|
Relatieve contra-indicaties |
|
|
Specifieke medicamenten met een verhoogd risico op ernstige huidreacties |
|
Ad 4. Is de follow-up en monitoring bij starten van treating through gewaarborgd?
Treating through-beleid vraagt om goede afstemming met de hoofdbehandelaar en patiënt(e) omtrent het noodzakelijke monitoring. Hoewel klinische behandeling frequente monitoring en beoordeling makkelijker maakt, is bij milde reacties en goede patiëntinstructie poliklinische behandeling vaak ook goed mogelijk. Patiënt en omgeving dienen op de hoogte te zijn wanneer zij contact op moeten nemen en met wie.
Algemene adviezen t.a.v. beoordeling:
Vooraf dient de patiënt(e) heel goed geïnformeerd te worden over de afweging, alternatieven en de eventuele risico’s van een treating through-beleid en een duidelijk informed consent te geven, met documentatie in het dossier.
Follow-up/ monitoring:
- De klachten dienen voor de patiënt(e) te allen tijde draaglijk te zijn, en de afweging om een ’treating through’ behandeling wel of niet voort te zetten dient samen met de patiënt(e) en hoofdbehandelaar te worden afgewogen.
- Let bij klinische beoordeling op:
- Uitbreiding van huidklachten, inclusief verergering van jeuk en/of pijn.
- Alarmsymptomen (zie Tabel 7)
- Labonderzoek: eosinofielen, nierfunctie, leverenzymen (zie ook hoofdstuk aanvullende diagnostiek) ter uitsluiting van orgaanbetrokkenheid. Frequentie van klinische beoordeling en laboratoriummonitoring hangt sterk af van de individuele situatie en het beloop. De klinische patient(e) wordt bij voorkeur dagelijks beoordeeld; wanneer het huidbeeld afneemt, kan de frequentie verminderd worden.
Ad 5. Hoe wordt een treating through-behandeling uitgevoerd?
Treating through-beleid kan worden overwogen op moment dat een patiënt(e): A) een klinische reactie heeft tijdens behandeling met het betreffende middel of B) een recidief reactie sterk te verwachten is op basis van een eerdere reactie dan wel een eerder bewezen allergie.
In het geval van een (A) klinische reactie tijdens behandeling met het betreffende middel kan, afhankelijk van de ernst, overwogen worden met lokale of lage dosis systemische corticosteroïden te behandelen naast antihistaminica. Afhankelijk van het effect hierop en het beloop, wordt de behandeling aangepast en het voortzetten of stoppen van de behandeling afgewogen.
In het geval dat een reactie sterk te verwachten is (B) op basis van een eerdere reactie dan wel een eerder bewezen allergie, kan overwogen worden vooraf te starten met premedicatie/ paraplu met topicale corticosteroïden (klasse II/III zijn vaak voldoende) en/of niet-sederende antihistaminica, dan wel een expectatief beleid en pas te behandelen bij optreden van de eerste (milde) klachten. Het specifieke beleid is zeer afhankelijk van de ernst van de reactie en eventuele eerdere ervaringen van de patiënt(e) en kan dus zeer variëren. Vaak is het verantwoord en zinvol om aanvankelijk geen premedicatie te geven en de initiële fase af te wachten, waarna pas behandeling gestart wordt indien de eerste symptomen zich voordoen. Dit conservatieve beleid is aan te raden bij een eerdere reactie die lang geleden (>5 jaar), bij milde reacties of indien er enige twijfel over de eerdere diagnose geneesmiddelallergie bestaat.
Wanneer dient er gestopt te worden met treating through-behandeling en wat zijn de alternatieven?
Stopcriteria:
- De patiënt(e) wenst te stoppen met de behandeling
- Labafwijkingen of klinische symptomen verdacht voor SCAR (alarmsymptomen; zie Tabel 7)
- Uitbreiding van matig tot ernstige klachten (ook indien geen SCAR)
Het stoppen van de behandeling dient goed te worden afgestemd met de patiënt en hoofdbehandelaar. Als alternatief kan overwogen worden om een desensitisatie uit te voeren in een centrum met ervaring met deze behandeling.
Figuur 6 Algoritme dat de belangrijkste stappen samenvat die leiden tot de beslissing om wel of niet door te behandelen in het geval van een ongecompliceerde maculopapuleus exantheem dat in relatie staat tot de toediening van een medicijn (bijv. antibioticum). Huidreacties geïnduceerd door biologicals of immunotherapie zijn geëxcludeerd. Figuur mede o.b.v. Trubiano, 2021.
Onderbouwing
Achtergrond
Na het optreden van een geneesmiddelenreactie wordt in het algemeen het causale middel gestopt, waarna wel of niet wordt overgaan op een alternatief geneesmiddel. In de praktijk kan dit echter problematisch worden wanneer er geen geschikt alternatief voor handen is, terwijl wel een sterke behandelindicatie bestaat. In dergelijke situaties is een treating through -principe te overwegen. Onder het treating through-principe wordt het doorbehandelen met een geneesmiddel verstaan, ondanks het optreden van een (relatief milde) huidreactie verdacht voor een type IV cutane geneesmiddelenreactie, óf het introduceren van een geneesmiddel waarbij verwacht wordt dat er een geneesmiddelenreactie op zal treden, welke met treating through-strategie benaderd zal worden. Het doel van deze module is te identificeren wat de indicaties en contra-indicaties zijn voor een treating through-beleid. Hierbij wordt rekening gehouden met eventuele indicatoren op het gebied van reactie, patiëntkenmerken en behandeling welke een succesvolle treating through-behandeling kunnen voorspellen.
Zoeken en selecteren
Voor deze vraag is niet naar wetenschappelijke literatuur gezocht. Binnen de GRADE-methodiek is het systematisch literatuuronderzoek gebaseerd op vergelijkend onderzoek, veelal gerandomiseerd onderzoek. Het is niet aannemelijk dat onze uitgangsvraag met dit type onderzoek beantwoord kan worden, of dat dergelijk onderzoek in dit kader is verricht.
Voor de uitwerking is gebruik gemaakt van enkele losse ondersteunende artikelen; Putterman (1990), Trautman (2017), Scherer (2013), Absmaier (2017), Hashimoto (2021) en Trubiano (2021).
Putterman (1990) beschrijft een man met Aids en een Pneumocystis carinii pneumonie, welke 10 dagen na start cotrimoxazol een maculopapuleus exantheem (MPE) met koorts ontwikkelt. Cotrimoxazol werd gecontinueerd met toevoeging van 3dd chlorpheniramine. Post aut propter namen koorts en MPE geleidelijk af en kon cotrimoxazol profylaxe gecontinueerd worden.
Trautman (2017) onderzocht of doorbehandelen mogelijk is bij patiënten met een ernstige wekedelen infectie welke een MPE op antibiotische behandeling hadden ontwikkeld. In deze retrospectieve analyse werden 18 patiënten geïncludeerd die waren opgenomen wegens een ernstige cellulitis waarvoor indicatie tot antibiotische behandeling, maar binnen 2-10 dagen na start van antibiotica een klassiek MPE zonder alarmsymptomen hadden ontwikkeld. Na risicoafweging werd het antibioticum gecontinueerd en patiënten nauwkeurig gemonitord. MPE werd behandeld met topicale steroïden en ter ondersteuning werden antihistaminica gegeven.
Twee (11%) patiënten ontwikkelden een significante leverenzymstijging, waarop antibiotica gestaakt werden. Eén patiënt kreeg een tijdelijke opvlamming van MPE onder clindamycine, terwijl de cellulitis verder verbeterde, zodat ervoor gekozen werd clindamycine te staken.
In de overige patiënten (n=15; 83,3%) nam het MPE geleidelijk af, ondanks continueren antibiotische behandeling. In 5 patiënten was er een tijdelijke, milde leverenzymstijging. Ten tijde van ontslag waren 8 (44%) patiënten volledig symptoomvrij, 7 (39%) hadden nog milde cutane restlaesies en in de overige 3 patiënten (17%) was het huidbeeld duidelijk verbeterd. Deze uitkomsten werden ook gezien in de patiënten die hun antibioticum hadden moeten staken.
De retrospectieve studie van Hashimoto (2021) beschreef 51 patiënten met een cutane geneesmiddelenreactie bij gebruik van immuun checkpoint inhibitors (ICI) waarvan 38 patiënten (74,5%) met een MPE, 2 patiënten met erythema multiforme (3,9%), 3 patiënten met lichenoide reactie ( 5,9%), 3 patiënten met een psoriasiforme reaction (5,9%), 2 patiënten met bullous pemphigoid (5,9%), 1 patiënt met een scleroderma-like reactie (2,0%), en 1 patiënt met Stevens–Johnson syndrome (2,0%). De patiënten werden onderverdeeld in klasse (1-4) ernst van de reactie volgens de Common Terminology Criteria of Adverse Events (CTCAE), waarbij een graad 1 rash <10% van het lichaamsoppervlak betreft, graad 2 10-30% met of zonder beperkingen in activities of daily living (ADL) of >30% zonder beperkingen in ADL, graad 3 >30% met matige tot ernstige beperkingen in ADL, en graad 4 een levensbedreigende situatie betreft waarbij urgente interventie nodig is. 7/51 patiënten (13,7%) moesten de ICI tijdelijk onderbreken en 7/51 (13,7%) moesten helemaal stoppen met de ICI in verband met de huidreactie (allen een ernst van klasse II of III). 3 dan wel 9 patiënten zijn tijdelijk of permanent gestopt met de behandeling voor een andere reden. 25 patiënten, allemaal met een rash graad 1-2, zijn dus primair doorbehandeld en 10 patiënten, rash 1-3, na een stopperiode herstart. De gestarte therapie en uitkomst werd gerapporteerd per klasse therapie intensiteit en niet per type huidbeeld. Van de patiënten die doorbehandeld werden zijn 22 patiënten behandeld met topicale corticosteroïden of systemische antihistaminica. 3 patiënten kregen systemische steroïden (<0,4 mg/kg prednisolon) en/of topicale steroïden. Behalve bij een patiënt met bulleous pemphigoid, onduidelijk of de ICI behandeling hier gestopt werd, verbeterde het huidbeeld bij alle patiënten onder de gekozen therapie.
De uitkomst van de patiënten met herstart van ICI na een stopperiode is niet duidelijk te achterhalen.
Overige artikelen van Absmaier (2017) en Scherer (2013) vatten expert opinion over de classificatie van geneesmiddelenreacties en suggesties wanneer te stoppen, door te behandelen of te desensitiseren samen.
Er zijn geen artikelen die de situatie van het treating through-principe bij kinderen belichten; er worden dan ook geen specifieke aanbevelingen voor kinderen in deze module gedaan.
Referenties
- - Absmaier, M., T. Biedermann, and K. Brockow. "Triggers of exanthematous drug eruptions: Stop intake, treat through or desensitization?." Der Hautarzt; Zeitschrift fur Dermatologie, Venerologie, und verwandte Gebiete 68.1 (2017): 29-35.
- - Hashimoto H, Ito T, Ichiki T, Yamada Y, Oda Y, Furue M. The Clinical and Histopathological Features of Cutaneous Immune-Related Adverse Events and Their Outcomes. J Clin Med. 2021 Feb 12;10(4):728.
- - Putterman, C, Rahav G, Shalit M, Rubinow A. "treating through" hypersensitivity to co-trimoxazole in AIDS patients. Lancet 1990 Jul 7;336(8706):52.
- - Scherer K, Brockow K, Aberer W, Gooi JH, Demoly P, Romano A, Schnyder B, Whitaker P, Cernadas JS, Bircher AJ; ENDA, the European Network on Drug Allergy and the EAACI Drug Allergy Interest Group. Desensitization in delayed drug hypersensitivity reactions -- an EAACI position paper of the Drug Allergy Interest Group. Allergy. 2013 Jul;68(7):844-52.
- - Trautmann, Axel, et al. "treating through decision and follow-up in antibiotic therapy-associated exanthemas." The Journal of Allergy and Clinical Immunology: In Practice 5.6 (2017): 1650-1656.
- Trubiano JA, Soria A, Torres MJ, Trautmann A. Treating Through Drug-Associated Exanthems in Drug Allergy Management: Current Evidence and Clinical Aspects. J Allergy Clin Immunol Pract. 2021 Aug;9(8):2984-2993.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-08-2023
Beoordeeld op geldigheid : 05-06-2023
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Behandeling cutane geneesmiddelenreacties |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Aanleiding
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie is de richtlijn “management van de acute fase van vertraagd type overgevoeligheidsreacties op geneesmiddelen” ontwikkeld. Voor dit onderwerp was nog geen richtlijn beschikbaar, terwijl het een belangrijk onderwerp is voor zowel patiënt als zorgverlener. Beoogd is een evidence-based richtlijn te ontwikkelen waarin staat welke diagnostiek er plaats moet vinden indien een behandelaar vermoedt dat er een reactie op een geneesmiddel is opgetreden, en men het van belang acht de oorzakelijke factor op te sporen. Het is belangrijk voor de patiënt te weten welk geneesmiddel beter vermeden kan worden. Daarnaast moet men voorkómen dat de patiënt onnodig essentiële geneesmiddelen wordt onthouden.
Afbakening onderwerp
In deze richtlijn worden adviezen gegeven ten aanzien van de diagnostiek en behandeling van acute fase van vertraagd type geneesmiddelenreacties en dient als leidraad voor de dermatoloog en andere zorgprofessionals die hiermee in aanraking komen. De werkgroep heeft gekozen om drug reaction with eosinophilia and systemic symptoms (DRESS), acute gegeneraliseerde exanthemateuze pustulose (AGEP) en maculopapuleus exantheem (MPE) verder uit te werken in deze richtlijn, omdat het hier de meest voorkomende geneesmiddelenreacties betreft.
Definities
In de titel van deze richtlijn is ervoor gekozen de meest correcte benaming van het type reactie te gebruiken dat in deze richtlijn besproken wordt. De benaming ‘vertraagd type geneesmiddelenreactie’ is echter ook gebruikelijk. Omdat deze term beter werkbaar is, wordt in deze richtlijn vaak voor deze benaming gekozen.
De WHO definieert een bijwerking als een reactie op een geneesmiddel die schadelijk en onbedoeld is en die ontstaat bij gebruikelijke doseringen (WHO, 2002). Zowel allergische als niet-allergische mechanismen kunnen ten grondslag liggen aan geneesmiddelenreacties. Allergische reacties ontstaan pas nadat sensibilisatie is opgetreden. De reacties worden bij een eerste blootstelling meestal pas manifest 7-21 dagen na de start van het geneesmiddel. De reactie kan van milde ernst zijn, zoals een lichte huiduitslag, maar kunnen ook ernstige levensbedreigende reacties veroorzaken die niet alleen tot de huid beperkt zijn. Huidafwijkingen veroorzaakt door geneesmiddelen (geneesmiddelenerupties) kunnen zich onder andere uiten als erytheem (roodheid), papels, pustels, pruritus en als levensbedreigende situaties, zoals toxische epidermale necrolyse (TEN) of DRESS. Als algemene benaming van huiduitslag wordt vaak de term exantheem gebruikt: een plotseling, voorbijgaande, uitgebreide huiduitslag die meestal wordt veroorzaakt door een infectie of door de inname van een geneesmiddel. Exacte gegevens over de incidentie van geneesmiddelenerupties ontbreken, zeer waarschijnlijk ten gevolge van onderrapportage. Onderzoeken naar de prevalentie van bijwerkingen onder patiënten die in het ziekenhuis zijn of worden opgenomen, komen uit op 10-20% van de opgenomen patiënten; 1-20% van hen heeft een huidreactie. Bij oudere patiënten wordt vaker een geneesmiddeleneruptie gediagnosticeerd dan bij jongere, hetgeen waarschijnlijk het toenemend medicijngebruik bij het stijgen van de leeftijd reflecteert (Beijer, 2002).
In deze richtlijn staan vertraagd type overgevoeligheidsreacties op geneesmiddelen centraal. Dit kunnen geneesmiddelen op recept zijn, maar ook vrij verkrijgbare geneesmiddelen en supplementen. In deze richtlijn wordt de overkoepelende term geneesmiddelen gebruikt.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten in de acute fase van een vertraagd type geneesmiddelenreactie. Er wordt een overzicht gegeven van de geneesmiddelenreacties, de verschillende huidreacties, hun reactietype en de relevante differentiaal diagnoses. Daarnaast wordt er gekeken naar het effect van onterecht labelen en de plaats van aanvullend onderzoek in de acute fase.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: dermatologen, pathologen, medisch microbiologen, kinderartsen, apothekers, internisten, (kinder)allergologen, verpleegkundig specialisten, physician assistants, huidtherapeuten, dermatologieverpleegkundigen en diegenen die voor deze beroepen in opleiding zijn. Voor huisartsen geldt dat zij primair gebruik maken van NHG-richtlijnen. Als deze richtlijnen voor hen ontoereikend blijken te zijn, kunnen zij gebruik maken van deze richtlijn. Voor patiënten werd informatie op thuisarts.nl en een patiëntenfolder ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden.
|
Vereniging |
|
|
Dr. H. Röckmann (voorzitter) |
NVDV |
|
Prof. dr. T. Rustemeyer |
NVDV |
|
Dr. A.J. Oosting |
NVDV |
|
Drs. M. ter Avest |
NVZA |
|
Drs. G.H.P.R. Slabbers |
NVK |
|
Dr. G.F.H. Diercks |
NVVP |
|
Drs. Z. Tempels-Pavlica |
NIV |
|
Dr. I. Terreehorst |
NIV |
|
Dr. A.A.J.M. van der Ven |
NIV |
|
Prof. dr. R. Aarnoutse |
NVZA |
|
Drs. M.H.E. Vos |
Arts-onderzoeker NVDV |
|
Drs. Z. Çiftçi |
Arts-onderzoeker NVDV |
|
Drs. D.M. van Loon |
Arts-onderzoeker NVDV |
|
Drs. M. Stolting |
Arts-onderzoeker NVDV |
|
Drs. E. van Veen |
Arts-onderzoeker NVDV |
|
Drs. A.C. de Waal |
Arts-onderzoeker NVDV |
|
Ondersteuning werkgroep |
Vereniging |
|
Dr. W.A. van Enst |
Klinisch epidemioloog NVDV |
Tabel 1 Overzicht betrokken partijen
|
Overzicht betrokken partijen* |
Zitting neming in werkgroep |
Knelpunten analyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
X |
X |
X |
X |
|
|
Nederlandse Internisten Vereniging (NIV) |
X |
X |
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor Medische Microbiologie (NVMM) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor Klinische Geriatrie (NVKG) |
|
X |
X |
|
|
|
Nederlandse Vereniging voor ZiekenhuisApothekers (NVZA) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Pathologie (NVVP) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Klinische Farmacologie (NVKFB) |
|
|
X |
|
|
|
Vereniging van Specialisten Ouderengeneeskunde (Verenso) |
|
|
X |
|
|
|
Overige organisaties |
|
|
|
|
|
|
Nederlandse Vereniging Huidtherapeuten (NVH) |
|
|
X |
|
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
|
|
X |
|
|
|
Stichting Werkgroep Antibiotica Beleid (SWAB) |
|
X |
X |
|
|
|
Patiëntenverenigingen |
|||||
|
Huid Nederland (HN) |
|
|
X |
X |
|
|
Patiëntenfederatie Nederland |
|
|
X |
X |
|
|
Stakeholders |
|||||
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
X |
|
Geen respons |
|
Zelfstandige klinieken Nederland (ZKN) |
|
|
X |
|
Geen deelname |
|
Zorgverzekeraars Nederland (ZN) |
|
|
X |
|
Geen deelname |
|
Zorginstituut Nederland (ZiN) |
|
|
X |
|
Geen deelname |
|
Vereniging Innovatieve Geneesmiddelen (VIG) |
|
|
X |
|
Geen deelname |
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
Geen deelname |
*alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
|
Dr. H. (Heike) Röckmann (voorzitter) |
Dermatoloog UMC Utrecht |
* Klinische adviesraad Lareb (onbezoldigd) |
Geen |
Nee |
Geen |
Geen |
Geen |
3-9-2020 |
|
Prof. Dr. T. (Thomas) Rustemeyer |
Dermatoloog Amsterdam UMC, locatie VUMC |
Geen |
nvt |
nvt |
nvt |
nvt |
nvt |
7-9-2020 |
|
Dr. A.J. (Bert) Oosting |
Dermatoloog Spaarne Gasthuis |
* Docent bij Uconsultancy, onderwijs doktersassistenten * Adviesraad Uconsultancy |
Geen |
Geen |
Geen |
Geen |
Geen |
2-9-2020 |
|
Drs. M. (Mendy) ter Avest |
Ziekenhuisapotheker in opleiding in het RadbouUMC/CWZ en PhD student in het RadboudUMC |
Geen |
nvt |
Nee |
Nee |
Nee |
Nee |
2-9-2020 |
|
Drs. G.H.P.R. (Gordon) Slabbers |
Kinderarts Ziekenhuis Bernhoven Uden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
7-9-2020 |
|
Dr. M.B. (Miquel) Ekkelenkamp |
Arts-microbioloog UMC Utrecht |
Lid SWAB-ledenraad (onbetaald) |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
26-8-2020 |
|
Drs. Z. (Zana) Tempels-Pavlica |
Internist-allergoloog Diakonessenhuis |
* Lid commissie accreditatie en visitatie van NVvAKI (onbetaald) |
Geen |
Nee |
Geen |
Voornaamste belang is landelijk een duidelijk beleid opstellen. Mijn ziekenhuis zal daar ook van profiteren net als alle andere ziekenhuizen in NL. In mijn ziekenhuis wordt geneesmiddelen diagnostiek reeds volop gedaan dus er is geen marketing winst. |
Nee |
28-8-2020 |
|
Dr. I. (Ingrid) Terreehorst |
* Internist-allergoloog en staflid KNO bij AmsterdamUMC, 0,8FTE |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
3-9-2020 |
|
Dr. A.A.J.M. (Annick) van de Ven |
Internist-allergoloog-immunoloog UMC Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet voor zover bekend |
31-8-2020 |
|
Drs. M (Marit) Stolting |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
30-09-2021 |
|
Drs. A.C. (Ayla) de Waal |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
21-10-2022 |
|
Drs. D.M. (Diederik) van Loon |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
21-10-2022 |
|
Drs. Z. (Zekeriya) Çiftçi |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet getekend; uit dienst oktober 2021 |
|
Drs. E. (Esther) van Veen |
Arts-onderzoeker NVDV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Niet getekend; uit dienst april 2022 |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door de bespreking van de waarden en voorkeuren voor de patiënt in de modules over behandeling. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Huid Nederland.
Implementatie
In de verschillende fasen van de ontwikkeling van de richtlijn is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. Het volledige implementatieplan is opgenomen in dit bijlagedocument.
Werkwijze
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden. Hierbij zijn leden van de volgende verenigingen aanwezig geweest: NVDV, NVZA, NVK, NVMM, NIV, NVGK, NVVP en SWAB. Tevens werden de volgende verenigingen/instanties uitgenodigd, maar zijn niet aanwezig geweest: NHG (knelpunten wel aangedragen), NVKFB, Nederlandse Vereniging van Ziekenhuizen (NVZ), Zorginstituut Nederland (ZiN), Inspectie Gezondheidszorg en Jeugd (IGJ), Verenso, V&VN, Huid Nederland (HN) en de Nederlandse Federatie van Universitair Medische Centra (NFU).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in Bijlage 4: Tabellen en figuren
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE
|
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie
Bijlage 10: Kennislacunes).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Referenties
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
- Beijer HJ, de Blaey CJ. Hospitalisations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci. 2002 Apr;24(2):46-54.
- Safety of Medicines. A guide to detecting and reporting adverse drug reactions. World Health Organization. Geneva. 2002. p.5.