Medicatie voor fractuurpreventie bij glucocorticoïden
Uitgangsvraag
Wanneer en welke medicatie ter preventie van fracturen is bij gebruik van glucocorticoïden geïndiceerd?
Aanbeveling
Streef bij de behandeling van alle glucocorticoïden naar:
- een zo kort mogelijke behandeling met een zo laag mogelijke dosis glucocorticoïden;
- voldoende calcium (minimaal 1000 tot 1200 mg per dag) en vitamine D (800 IE per dag);
- gezonde voeding;
- Voldoende lichaamsbeweging;
- stoppen met roken;
- geen of matig alcohol gebruik; en
- een optimale behandeling van de onderliggende aandoening, zo nodig ook door gebruik van andere immunosuppressiva.
Start bij patiënten ≥ 50 jaar, die naar verwachting langer dan 3 maanden prednison > 7,5 mg per dag zullen gebruiken, direct met medicatie ter preventie van fracturen, onafhankelijk van aanvullende risicofactoren en/of diagnostiek
Start bij patiënten 40 tot 50 jaar, die naar verwachting langer dan 3 maanden prednison > 7,5 mg per dag zullen gebruiken direct met medicatie ter preventie van fracturen in aanwezigheid van:
- een recente (< 2 jaar) niet-wervelfractuur;en/of
- klinische wervelfractuur, bevestigd met beeldvorming op DXA (VFA) of röntgenfoto (minimaal graad 2, ≥ 25% hoogteverlies).
Start bij patiënten 40 tot 50 jaar, zonder recente niet-wervelfractuur of klinische wervelfractuur, die naar verwachting langer dan 3 maanden prednison > 7,5 mg per dag zullen gebruiken met medicatie ter preventie van fracturen indien bij aanvullende diagnostiek met DXA/VFA blijkt:
- T-score £ -2,0 in lumbale wervelkolom en/of heup; en/of
- wervelfractuur op DXA (VFA) of röntgenfoto TWK en LWK (minimaal graad 2, ≥ 25% hoogteverlies).
Start bij patiënten ≥ 40 jaar die naar verwachting langer dan 3 maanden prednison ≥ 2,5 mg en < 7,5 mg prednison per dag zullen gebruiken, met medicatie ter preventie van fracturen in aanwezigheid van afwijkingen op DXA/VFA:
- T-score ≤ -2,0 in lumbale wervelkolom en/of heup; en/of
- wervelfractuur op DXA (VFA) of röntgenfoto TWK of LWK (minimaal graad 2, ≥ 25% hoogteverlies).
Schrijf als eerste keuze orale bisfosfonaten (alendroninezuur of risedroninezuur) voor aan patiënten met glucocorticoïden gebruik en een verhoogd risico op fracturen.
Schrijf als tweede keuze denosumab, teriparatide, of zoledroninezuur of denosumab voor bij patiënten met glucocorticoïden gebruik en een verhoogd risico op fracturen:
- die orale bisfosfonaten niet verdragen;
- met een contra-indicatie voor orale bisfosfonaten.
Overweeg tweede keuze denosuamb, teriparatide, of zoledroninezuur bij patiënten met GC gebruik en een verhoogd risico op fracturen met:
- een slechte therapietrouw; of
- een nieuwe fractuur na tenminste 1 jaar therapie.
Overweeg direct te starten met parenterale medicatie (denosumab, teriparatide of zoledroninezuur) bij:
- patiënten van 50 jaar en ouder; en
- die behandeld worden met ≥ 7,5 mg prednison per dag gedurende 3 maanden; en
- die een zeer hoog fractuurrisico hebben, bijvoorbeeld in geval van één of meerdere risicofactoren:
- leeftijd ≥ 75 jaar;
- een recente (< 2 jaar) niet-wervelfractuur;
- een wervelfractuur graad 2, bevestigd met beeldvorming (minimaal ≥ 25% hoogteverlies)
- een lage T-score (≤ -2.0) in heup en/of wervelkolom;
- hoge dosis glucocorticoïden (≥ 15 mg per dag gedurende tenminste 3 maanden); of
- een ernstige activiteit van de onderliggende ziekte.
Continueer de medicatie voor fractuurpreventie na het stoppen met glucocorticoïden indien bij een nieuwe DXA/VFA sprake is van:
- een T-score ≤ -2,5 in lumbale wervelkolom en/of heup; of
- een incidente of prevalente wervelfractuur (graad 2 of hoger, ≥ 25% hoogteverlies); of
- een recente (< 2 jaar) niet-wervelfractuur.
Stop ook de medicatie voor fractuurpreventie na het stoppen met glucocorticoïden indien bij een nieuwe DXA/VFA sprake is van:
- een T-score > -2,5; en
- geen wervelfractuur; en
- geen recente niet-wervelfractuur
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Fractuurreductie is de belangrijkste uitkomstmaat bij osteoporose. Het gebruik van glucocorticoïden (GC) gaat gepaard met een verhoogd fractuurrisico, maar in studies met (medicatie)interventie bij GC is een toename van BMD vaak de belangrijkste uitkomstmaat. In vergelijking met studies bij postmenopauzale vrouwen zijn er bij studies bij GC belangrijke verschillen: minder patiënten (globaal 10x zo weinig als bij postmenopauzale osteoporose), en de observatieduur van de studies is veel korter, meestal slechts 1 tot 2 jaar, versus meestal 3 tot 5 jaar bij studies bij postmenopauzale osteoporose. Tenslotte zijn de recente GIOP-studies niet versus placebo, maar versus een actieve comparator, meestal alendroninezuur of risedroninezuur.
Vanwege bovengenoemde 3 redenen, is het ook voor zeer potente medicatie niet mogelijk om fractuurreductie aan te tonen.
Daarom wordt een toename van BMD bij GC-gebruikers versus een actieve comparator in combinatie met fractuurreductie versus placebo in fase 3 studies bij postmenopauzale vrouwen, vaak voldoende geacht voor registratie.
Het toegenomen fractuurrisico tijdens GC-behandeling is dosis-afhankelijk en is zelfs toegenomen bij lage doseringen prednison (2,5 tot 7,5 mg per dag) (van Staa, 2000a; van Staa, 2005). Alhoewel de cumulatieve dosering van GCs sterk geassocieerd is met verlies aan BMD, is de relatie met fracturen zwakker dan met de dagdosering GC (van Staa, 2000b). Het relatieve risico op heupfracturen is toegenomen en dosis-afhankelijk: niet verhoogd bij prednison < 2,5 mg, 1,77 (95% c.i. 1,55 tot 2,02) bij een dagdosering van 2,5 tot 7,5 mg, en 2,27 (95% c.i. 1,94 tot 2,66) bij een dosering van 7,5 mg prednison per dag of meer (van Staa, 2000). De gerapporteerde incidentie van niet-wervel fracturen was gemiddeld 4.5 per 100 persoonsjaren, en hoger bij een hogere dagdosering en hogere leeftijd (van Staa 2000)
Vooral het relatieve risico op wervelfracturen is verhoogd tijdens GC-therapie, variërend van 1,55 (1,20 tot 2,01) bij patiënten die minder dan 2,5 mg prednison per dag nemen tot 5,18 (4,25 tot 6,31) in de groep die 7,5 mg prednison per dag of meer gebruikt (Van Staa, 2000a).
De gerapporteerde 1-jaars incidentie van radiologische wervelfracturen was 16.1%, en hoger bij een hogere dosering, lagere BMD en hogere leeftijd (van Staa, 2003)
In een meta-analyse van 42,500 mannen en vrouwen uit 7 prospectieve cohortstudies, eerder en huidig GC-gebruik was geassocieerd met een toegenomen fractuurrisico voor alle leeftijden van 50 jaar en hoger: het relatieve risico op een fractuur varieerde van 1,98 op de leeftijd van 50, tot 1,66 op 85-jarige leeftijd; voor heupfracturen het relatieve risico varieerde met de leeftijd van 4,42 tot 2,48 (Kanis, 2004).
Voor de individuele patiënt is behalve het relatieve risico, ook het absolute risico van belang: met behulp van de FRAX-score kan hier een indruk van worden verkregen van het tien-jaar risico op een “”major fracture”” (pols, bovenarm, heup, wervel) of op een heupfractuur. Hoewel deze methode ook nadelen heeft, zo worden wervelfracturen en valevents niet gescoord, kan deze methode kan een zinvolle aanvulling zijn in een gesprek met de patiënt (“shared decision making”) omtrent het wel of niet starten met medicatie: hiermee krijgt de patiënt meer de regie over zijn/haar eigen behandeling.
Ook het gebruik van GC is een risicofactor bij FRAX, er wordt een onderscheid gemaakt tussen wel of niet gebruikers van GC. Omdat het fractuurrisico dosisafhankelijk is, is later een aanvulling gekomen: het risico kan 15% hoger worden ingeschat op “”major fractures”” en 20% op heupfracturen bij doseringen meer dan 7,5 mg prednison per dag of meer, en 35% lager op “major fractures” en 20% op heupfracturen bij doseringen van 2,5 mg prednison per dag of minder.
De implementatie van het gebruik van medicatie ter preventie van fracturen bij GC-gebruikers is suboptimaal: in de wereldwijde GLOW-studie, een onderzoek in 17 sites in 10 landen in Europa, Noord- Amerika en Australië kreeg slechts 42% van de GC-gebruikers medicatie ter preventie van fracturen (Silverman 2015). In het Zinnige Zorg project in Nederland bleek dat slechts 27% van de patiënten die meer dan 7,5 mg prednison per dag gedurende tenminste 3 maanden gebruikten ook medicatie voor fractuurpreventie werd voorgeschreven (Zorginstituut Nederland, 2020).
Er is literatuuronderzoek verricht: in een netwerk meta-analyse (Ding, 2020) bij GC-gebruikers werden reducties in wervelfracturen versus placebo gevonden voor teriparatide (HR: 0,11, 95% c.i. 0,03 tot 0,47), risedroninezuur (HR: 0,33, 95% c.i. 0,19 tot 0,58), en denosumab (HR: 0,21, 95% c.i. 0,09 tot 0,49), en geen significante reducties bij zoledroninezuur, alendroninezuur en ibandronaat. Voor niet-wervelfracturen en heupfracturen werden geen klinische verschillen gevonden bij alle bovengenoemde medicamenten.
De belangrijke uitkomstmaat verandering in botmineraaldichtheid werd beschreven in drie studies met actieve vergelijkingen (Reid, 2009; Saag, 2009; Saag, 2019). De 1-jaar durende studie van Reid (2009) vergeleek zoledroninezuur met risedroninezuur en rapporteerde dat zoledroninezuur non-inferieur en ook superieur was in toename van BMD, zowel in de lumbale wervelkolom als in de heup.
Saag (2009) vergeleek in een 3-jaar durende studie teriparatide met alendroninezuur en rapporteerde dat bij teriparatide de BMD in de lumbale wervelkolom, femurhals en totale heup meer stegen dan bij alendroninezuur.
Verder blijkt er ook een klinisch relevante reductie te zijn in het optreden van wervelfracturen bij gebruik van teriparatide vergeleken met alendroninezuur in deze studie.
De recente studie van Saag (2019) vergeleek denosumab met risedroninezuur: in een 2-jaar durende studie werd een grotere toename in de BMD van de lumbale wervelkolom en totale heup gevonden bij gebruik van denosumab dan bij risedroninezuur. Bij het staken van denosumab kan een sterke stijging van de botafbraak tot boven de uitgangswaarde ontstaan, en een verhoogde kans op (multipele) wervelfracturen. Dit komt uitgebreider aan bod in modules “Behandeling met medicatie voor fractuurpreventie”.
Alendroninezuur (70 mg 1x per week in tabletvorm of drank) en risedroninezuur (35 mg 1x per week, tablet) worden vaak beschouwd als middel van eerste keuze bij GIOP ter preventie van fracturen, vanwege de bewezen effectiviteit (toename van BMD versus placebo, en in geval van risedroninezuur, ook reductie van wervelfracturen), de ervaring en relatieve veiligheid van beide middelen, en de lage kostprijs.
Denosumab (2x per jaar 60 mg sc), teriparatide (dagelijks 20 mcgram sc) en zoledroninezuur (5mg iv 1x per jaar) worden tweedekeus middelen genoemd vanwege hun therapeutische meerwaarde die is aangetoond in (bovengenoemde) directe vergelijkingen met alendroninezuur of risedroninezuur. Er is echter geen duidelijke voorkeur voor één van de drie medicaties uit de tweede lijn; er zijn geen vergelijkende studies tussen teriparatide, zoledroninezuur en denosumab verricht. Behandeling met denosumab en zoledroninezuur kan ook in de eerste lijn worden voorgeschreven, teriparatide kan alleen in de tweede lijn worden voorgeschreven.
Romosozumab is nog onvoldoende onderzocht en niet geregistreerd als medicatie voor fractuurpreventie bij GC-gebruikers.
Daarnaast zijn er ook andere overwegingen die kunnen bijdragen aan de keuze tussen verschillende medicaties, bijvoorbeeld contra-indicaties, mogelijke bijwerkingen, individuele voorkeuren van patiënten en de kosten.
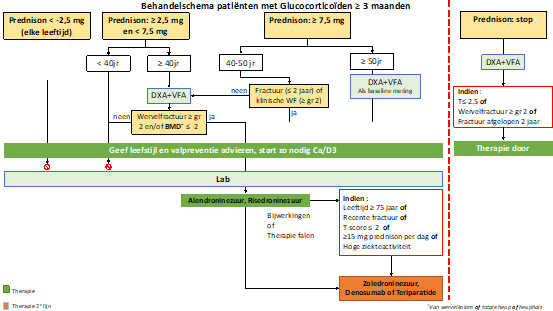
Prednison ≥ 7,5 mg per dag:
Bij het starten van medicatie ter preventie van fracturen tijdens gebruik van glucocorticoïden (GC) wordt een onderscheid gemaakt tussen “”High-risk”” en “Low-Risk””” patiënten. Patiënten met GC-gebruik hebben een hoog risico op fracturen als zij naar verwachting langer dan 3 maanden prednison ≥ 7,5 mg per dag zullen gebruiken voor hun onderliggende aandoening. Meestal is er dan ook activiteit van de onderliggende aandoening, die ook een negatief effect op de botsterkte heeft. Er is een directe behandelindicatie, dus ook zonder aanvullende risicofactoren en/of diagnostiek bij leeftijd boven de 50 jaar (mannen en vrouwen), maar ook bij patiënten van 40 tot 50 jaar, in combinatie met:
-
- recente (< 2 jaar) niet-wervelfractuur;
- en/of klinische wervelfractuur, bevestigd op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%).
Overigens wordt wel geadviseerd om ook een DXA/VFA te maken, als uitgangswaarde die bij de follow-up van belang kan zijn.
Daarnaast zal een beperkt deel van de patiënten tussen 40 en 50 jaar ook in aanmerking komen voor therapie, indien er een aanvullende DXA/VFA wordt gemaakt en waarbij alsnog een behandelingsindicatie blijkt:
-
- DXA met T -score £ -2,0 in lumbale wervelkolom en/of heup.
- (radiologische) wervelfractuur op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%).
- Het is van belang om op te merken dat er bij GIOP vaak ook comorbiditeit is (de onderliggende ziekte) en een verlaagde fractuurdrempel, oftewel een verhoogd fractuurrisico: dit kan een reden zijn voor de ervaren medicus practicus om bij GIOP-patiënten op individuele basis bij een sterk verhoogd fractuurrisico direct te kiezen voor een start met een tweedelijnsmiddel, bijvoorbeeld bij meer dan 3 maanden ≥ 7,5 mg prednison per dag, bij iemand met een of meer aanvullende risicofactoren: leeftijd ≥ 75 jaar.
- Recente niet-wervelfractuur (< 2 jaar).
- Een wervelfractuur graad 2, bevestigd met beeldvorming (minimaal ≥ 25% hoogteverlies) T-score ≤ -2 in lumbale wervelkolom en/of heup.
- ≥ 15 mg prednison per dag.
- Of hoge ziekteactiviteit.
- Dan kan direct gekozen worden voor tweedekeustherapie: denosumab teriparatide of zoledroninezuur, en niet voor initieel een oraal bisfosfonaat (Raterman, 2019)
Prednison ≥ 2,5 mg en < 7,5 mg per dag:
Uit een grote studie van Staa (2000) met 244.000 GC users en 244.000 controles, is gebleken dat het risico op botbreuken al (licht) verhoogd is bij gebruik van ≥ 2,5 mg prednison per dag.
Voor patiënten met een dagdosering van prednison tussen ≥ 2,5 en < 7,5 mg per dag gedurende tenminste 3 maanden is het risico op fracturen lager dan bij gebruik van ≥ 7,5 mg per dag: bij patiënten van 40 jaar en ouder met een dagdosering van prednison ≥ 2,5 en <7,5 mg per dag is eerst aanvullend een DXA/VFA nodig voor het beoordelen van het fractuurrisico. Dit is verhoogd indien bij aanvullend onderzoek blijkt dat:
-
- DXA met T-score £ -2,0 in lumbale wervelkolom en/of heup.
- (radiologische) wervelfractuur op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%). Vanwege het prednisongebruik en genoemde afwijkingen bij lichamelijk onderzoek is er indicatie voor medicatie ter preventie van fracturen.
Patiënten jonger dan 40 jaar en met een prednisondagdosering ≥ 2,5 mg per dag en < 7,5 mg per dag, hebben vanwege hun lage leeftijd en vanwege de lage prednison dosering geen nadere diagnostiek en/of behandeling nodig.
Wat te doen bij de patiënten die niet aan de criteria voldoen voor medicatie voor fractuurpreventie: niet starten met medicatie voor fractuurpreventie is een voor de hand liggende optie, maar samen met de patiënt een FRAX-berekening maken op het 10-jaars risico op een heupfractuur of een “major osteoporotic fracture” (heup, pols, bovenarm en wervel) kan zinvol zijn, de zogenaamde “shared-decision making”. Het voordeel is dat het de patiënt inzicht geeft in het fractuurrisico, en op grond daarvan kan aangeven of hij/zij een behandeling met medicatie ter preventie van fracturen wil (of niet): de patiënt krijgt meer de regie van zijn/haar behandeling. Een nadeel is dat er geen consensus is over de drempelwaarde waarboven medicatie voor fractuurpreventie geïndiceerd is. Wellicht is hierbij de Amerikaanse ACR 2017 richtlijn nuttig: daar wordt gesteld dat een 10-jaars risico op een heupfractuur van > 3% en/of een risico van > 20% op een” major osteoporotic fracture “een indicatie voor medicatie voor fractuurpreventie kan zijn.
Prednison < 2,5 mg per dag;
Indien patiënten minder dan 2,5 mg prednison per dag gebruiken, ongeacht de leeftijd, wordt dit zonder bijkomende risicofactoren beschouwd als een”” normaal”” fractuurrisico. Dus alleen als er andere risicofactoren dan GC (geslacht, BMI, immobiliteit) (zie module “Identificatie voor aanvullend onderzoek naar fractuurrisico”) een rol spelen, kan er indicatie zijn voor nadere diagnostiek en/of therapie.
Bij premenopauzale vrouwen en jonge mannen (< 50 jaar) is er weinig tot geen bewijs met betrekking tot effectiviteit van medicatie ter preventie van fracturen, maar ook met betrekking tot veiligheid ten opzichte van de foetus. In algemene zin kan gesteld worden dat het absolute fractuurrisico in deze specifieke populatie laag is, waarmee de noodzaak tot behandelen minder aanwezig is. In individuele gevallen is er sprake van een hoog risico (bijvoorbeeld bij voorgeschiedenis van multipele fracturen en/of extreem lage Z-scores), waarbij de ACR-GIOP richtlijn 2017 dan wel de ECTS-richtlijn richtlijn premenopauzale vrouwen (Pepe et al) een handvat zou kunnen zijn, zolang er nog geen betere bewijskracht van effectiviteit en veiligheid in deze specifieke populatie is.
In het geval van langdurig chronisch prednison gebruik (bijvoorbeeld langer dan 10 jaar GC gebruik) dient naast het doel en voordeel van verhogen van de fractuurdrempel bij prednison gebruik door middel van medicatie ter preventie van fracturen middels (oraal) bisfosfonaat of denosumab het potentiële risico op zeldzame maar wel ernstige bijwerkingen van atypische femurfracturen en osteonecrose van de kaak meegewogen worden. Hierover zijn weinig data, behalve dat bekend is dat de kans op atypische femurfracturen verder afneemt naarmate langer is gestopt met botafbraak-remmende medicatie. Hier moeten arts en patiënt een individuele afweging maken (“shared-decison-making”)
Het is gebruikelijk om de medicatie voor fractuurpreventie, meestal een bisfosfonaat, te continueren het GC-gebruik. Een simpele vuistregel over een follow-up DXA/VFA gedurende het GC-gebruik is er niet, het eventuele botverlies hangt ook af van de dosering prednison en de ernst van de onderliggende aandoening. Terwijl bij postmenopauzale osteoporose en bisfosfonaten na 3 jaar een herhaalde DXA/VFA kan worden verricht, zou dit voor GC-gebruikers al na 2 jaar kunnen.
Een ander belangrijk punt is wat te doen bij afbouwen van en stoppen met de GC. Dan dient opnieuw een DXA/VFA gemaakt te worden.
Als bij evaluatie blijkt dat ook zonder GC er nog een verhoogd fractuurrisico is, wordt geadviseerd om de medicatie ter preventie van fracturen te continueren: dit kan het geval zijn bij een T-score ≤ -2,5 in lumbale wervelkolom en/of heup, of een incidente of prevalente wervelfractuur (graad 2 of hoger, ≥ 25% hoogteverlies), of een recente niet-wervelfractuur (< 2 jaar geleden).
De medicatie ter preventie van fracturen kan gestopt worden bij GC-gebruikers die geen T-score ≤ -2,5 hebben, geen wervelfractuur en geen recente niet-wervelfractuur.
Van teriparatide en vooral van denosumab is bekend dat het staken gepaard kan gaan met een reboundeffect: verhoogde botturnover, verlaagde BMD en meer kans op wervelfracturen. Na staken met deze middelen is continueren van therapie met een (andere) botafbraakremmende medicatie nodig (zie de module “Behandelstrategieën met medicatie voor fractuurpreventie op lange termijn”).
Aanvullend onderzoek naar botkwaliteit met TBS (Trabecular Bone Score) of HRpQCT hebben wel waarde in wetenschappelijk onderzoek, maar (nog) niet in de dagelijkse patiëntenzorg.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten die glucocorticoïden (GC) gebruiken zijn primair in behandeling voor die specifieke (ernstige) aandoening. Het sterk verhoogd risico op versneld botverlies komt daar nu als onplezierige verrassing nog bovenop inclusief het advies voor aanvullende medicatie.
Er is behoefte aan heldere uitleg over het verhoogde risico op fracturen, maar vooral ook over de mogelijke gevolgen van die fracturen. Ofwel de risico’s op immobiliteit en verlies van onafhankelijkheid door heupfracturen en /of (meerdere) wervelfracturen, want daar gaat het om.
Doordat de medicamenteuze behandeling van de osteoporose geen behandeling is voor de primaire ziekte is gebruiksgemak waarschijnlijk een belangrijk onderdeel voor de afweging, welke medicatie te adviseren. Onnodige extra belasting van de patiënt kan daarmee verzacht worden.
In de voorgestelde behandeling zal zeker extra aandacht moeten zijn voor de leefstijlonderdelen, waarbij rekening gehouden moet worden met de beperkingen die de primaire aandoening mogelijk met zich mee kan brengen. Verwijs zo nodig naar een gekwalificeerde paramedicus.
Ook voor de primaire aandoening kunnen deze leefstijladviezen een aanvullend positief effect hebben. Zo ontstaat een dubbele motivatie voor dit onderdeel van de therapie en zal het gevoel van stapelen van behandelingen verminderen.
Aandacht voor mogelijke bijwerkingen
Medicatie voor fractuurpreventie heeft structureel te maken met veel aandacht en misverstanden voor de toch zeldzame mogelijke bijwerkingen. (Het middel is erger dan de kwaal) Voor veel patiënten een reden om maar niet te starten of toch maar te stoppen als ze thuis de bijsluiter lezen of internet raadplegen. Een heldere uitleg vooraf over de zeldzame, maar veel besproken bijwerkingen zoals kaaknecrose en maag/darm problemen kan de drempel effectief verlagen. Geef in ieder geval duidelijk aan dat er meerdere mogelijkheden voor medicatie zijn en dat in overleg kan worden overgestapt op een ander middel indien er zich toch bijwerkingen voordoen. Maak afspraken over met wie de patiënt contact kan opnemen bij het ervaren van mogelijke bijwerkingen. Volg dit desnoods actief op bij twijfel of de medicatie wel genomen zal worden. Informeer de huisarts over de voorgeschreven medicatie.
Aanvullende informatie
Verwijs voor aanvullende informatie naar de website van de patiëntenvereniging.
Kosten (middelenbeslag)
De middelen van eerste keuze zijn de orale bisfosfonaten, die effectief en relatief veilig zijn, waarmee jarenlange ervaring is en die goedkoop zijn. De tweedekeus middelen (denosumab, teriparatide en zoledroninezuur) hebben een hogere kostprijs dan orale bisfosfonaten (vooral teriparatide), maar alle drie hebben in studies superioriteit aangetoond ten opzichte van orale bisfosfonaten. Tweedekeus middelen kunnen na orale bisfosfonaten worden ingezet in geval van bijwerkingen, contra-indicaties, slechte therapietrouw en/of falen op therapie, en als initiële therapie bij GC-patiënten met een sterk verhoogd risico op osteoporose.
Aanvaardbaarheid, haalbaarheid en implementatie
De kennis dat het fractuurrisico verhoogd is tijdens gebruik van GC is wijd verspreid, zowel bij (para)medici als bij patiënten. Er zijn effectieve middelen van eerste keuze beschikbaar, de orale bisfosfonaten, die relatief veilig zijn, goedkoop en waarmee veel ervaring is.
De aanvaardbaarheid en haalbaarheid lijken dus goed, maar uit onderzoek blijkt dat de implementatie bij GC-patiënten nationaal en internationaal achterblijft (Zinnige Zorg, Glow-studie). In het Zinnige Zorg project bleek dat in Nederland na 3 maanden behandeling met meer dan 7,5 mg prednison per dag slechts 27% botsparende medicatie gebruikt werd, na 2 jaar was dat slechts 35% (Zorginstituut Nederland, 2020).
Bij de implementatie spelen facilitators en barrières een rol: een barrière is dat het in de praktijk moeilijk is om in de acute fase van diagnostiek en start van de behandeling met GC ook nog te starten met medicatie ter preventie van fracturen. Maar ook polyfarmacie bij ouderen en onduidelijkheid wie moet voorschrijven, de huisarts of de specialist, kunnen meespelen.
Een andere reden voor het suboptimaal inzetten van medicatie ter preventie van fracturen zijn belangrijke verschillen in de internationale richtlijnen (ACR 2010/2017, EULAR, IOF/ECTS, NOF), in de dosering GC, de leeftijd, de T-score en het wel of niet gebruik van FRAX waarbij gestart dient te worden met medicatie ter preventie van fracturen. Een facilitator is dat er wel overeenstemming is dat orale bisfosfonaten eerste keuze middelen zijn, en dat teriparatide, zoledroninezuur en denosumab tweede keuze middelen zijn, en ook dat in hoogrisico-patiënten direct gestart kan worden met medicatie voor fractuurpreventie.
Daarnaast zijn sommige richtlijnen erg complex, bijvoorbeeld die van de ACR 2017: dat laatste belemmert de implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Medicatie ter preventie van fracturen kan geïndiceerd bij patiënten met GC-gebruik, daarnaast zijn leefstijl maatregelen ook van belang, omdat deze maatregelen bijdragen aan botsterkte, en omdat alle medicatie ter preventie van fracturen onderzocht is met adequate calcium en vitamine D therapie.
Hierbij geldt dat:
- De effecten van GC op het bot dosis-afhankelijk zijn.
- GC de intestinale calcium absorptie remmen en intestinale calciumexcretie stimuleren; de calcium-behoefte uit dieet en supplementen is minstens 1000-1200 mg per dag.
- De blootstelling aan zonlicht bij zieke patiënten met GC verminderd kan zijn.
- Goede voeding, met ook voldoende magnesium, vitamine K, eiwit essentieel zijn voor het bot.
- Gebruik van GC en de onderliggende ziekte kunnen leiden tot spierzwakte en een verhoogde valkans.
- Gebruik van andere immunosuppressiva zoals azathioprine, MTX en MMF, de mogelijkheid bieden om de prednison dosering te verlagen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Patiënten met GC gebruik hebben een verhoogd risico op fracturen als zij naar verwachting langer dan 3 maanden prednison > 7,5 mg per dag zullen gebruiken voor hun onderliggende aandoening. Er is een directe behandelingsindicatie, dus ook zonder BMD-meting, bij leeftijd boven de 50 jaar (mannen en vrouwen), of tussen 40 en 50 jaar, in combinatie met:
-
- recente (< 2 jaar) niet-wervelfractuur;
- en/of klinische wervelfractuur, bevestigd op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%).
Hiermee kan dus bij alle 50-plussers die tenminste 3 maanden prednison ≥ 7,5 mg per dag gebruiken direct gestart worden starten met medicatie ter preventie van fracturen, onafhankelijk van de uitslag van de BMD-meting. Mogelijk kan dit direct starten met medicatie ter preventie van fracturen de treatment-gap verminderen; het sluit ook aan bij internationale richtlijnen van IOF/ECTS en NOF. Overigens wordt wel geadviseerd om een DXA/VFA te maken, als uitgangswaarde die bij de follow-up van belang kan zijn. Daarnaast zal een beperkt deel van de patiënten tussen 40 en 50 jaar ook direct in aanmerking komen voor therapie, in geval van een recente (< 2 jaar) niet-wervelfractuur en/of klinische wervelfractuur.
Uit de bovenbeschreven literatuuranalyse is gebleken dat er effectieve medicamenten beschikbaar zijn die het risico op wervelfracturen reduceren (risedroninezuur, denosumab, zoledroninezuur).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Patiënten met glucocorticoïden gebruik van 50 jaar en ouder die naar verwachting langer dan 3 maanden prednison > 2,5 mg per dag zullen gebruiken voor hun onderliggende aandoening, hebben een licht verhoogd risico op fracturen.
Bij hen is er geen indicatie voor direct starten met medicatie voor fractuurpreventie, eerst dient aanvullend onderzoek plaats te vinden. Hun risico op fracturen wordt hoger indien bij aanvullend onderzoek blijkt dat:
- DXA met T -score £ -2.0 in lumbale wervelkolom en/of heup;
- wervelfractuur op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%)
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Van risedroninezuur, zoledroninezuur en teriparatide is reductie van wervelfracturen aangetoond tijdens GC-gebruik. Risedroninezuur is daarmee eerste keus, omdat het effectief en relatief veilig is, er jarenlange ervaring mee is, en omdat het goedkoop is.
De werkgroep vindt dat alendroninezuur ook eerste keus is: het werkingsmechanisme komt overeen met dat van risedroninezuur, de resultaten bij veel grotere studies met postmenopauzale vrouwen en mannen zijn vergelijkbaar of beter dan van risedroninezuur, en alendroninezuur krijgt in nationale en in internationale richtlijnen dezelfde plaats als risedroninezuur.
Denosumab, zoledroninezuur en teriparatide zijn geen eerste keus, vanwege de hogere kostprijs.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Denosumab, teriparatide, en zoledroninezuur zijn in head to head studies superieur gebleken aan orale bisfosfonaten, door een grotere toename in BMD, en bij teriparatide ook door een reductie in wervelfracturen. Deze middelen hebben echter ook een hogere kostprijs: ze kunnen ingezet worden als tweede keuze therapie, bij patiënten waarbij behandeling met orale bisfosfonaten niet mogelijk is, bijvoorbeeld bij patiënten die orale bisfosfonaten niet verdragen en/of een contra-indicatie hebben voor orale bisfosfonaten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Bij suboptimale therapietrouw dient eerst de reden van therapie-ontrouw geëvalueerd te worden, is er gebrek aan inzicht in en motivatie voor medicamenteuze therapie of zijn er andere redenen? Afhankelijk hiervan kan een tweede keuze therapie overwogen worden.
Ook bij een fractuur tijdens tenminste 1 jaar therapie met alendroninezuur of risedroninezuur, dient eerst geëvalueerd te worden of er sprake is van een fractuur onder adequate therapie, of suboptimale therapie of werkzaamheid, of een adequaat trauma (zie module “Behandelstrategieën met medicatie voor fractuurpreventie op lange termijn”. Afhankelijk hiervan kan een tweede keuze therapie overwogen worden.
Teriparatide, denosumab en zoledroninezuur zijn in head to head studies superieur gebleken aan orale bisfosfonaten, door een grotere toename in BMD, en bij teriparatide ook door een reductie in wervelfracturen. Deze middelen hebben echter ook een hogere kostprijs. Het kan overwogen worden om deze medicatie in te zetten als tweede keuze therapie, bij patiënten die een slechte therapietrouw hebben, of bij patiënten met een nieuwe fractuur na tenminste 1 jaar therapie met orale bisfosfonaten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Een klein aantal glucocorticoïden patiënten heeft een sterk verhoogd risico op een grote BMD-daling en op fracturen, vanwege een hoge dosis GC (initieel > 0,5 mg per kilogram lichaamsgewicht) en een heftige ziekteactiviteit. Starten met orale bisfosfonaten is hier suboptimaal en direct starten met tweedelijns parenterale therapie is te prefereren.
Het betreft patiënten van 50 jaar en ouder (mannen of vrouwen).
In combinatie met minimaal twee van de drie volgende risicofactoren:
- recente (< 2 jaar) niet-wervelfractuur;
- wervelfractuur, bevestigd op DXA (VFA) of röntgenfoto (minimaal graad 2, hoogteverlies ≥ 25%);
- een lage T-score (≤ -2,0) in heup en/of wervelkolom.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Een ander belangrijk punt is wat te doen bij afbouwen van en stoppen met de glucocorticoïden. Osteoporose-medicatie dient gecontinueerd te worden gedurende de hele periode van GC gebruik; indien glucocorticoïden volledig is afgebouwd dient risico-evaluatie te volgen (DXA/VFA) en aan de hand daarvan bepaald te worden of er nog steeds een indicatie is voor therapie.
Als bij evaluatie blijkt dat ook zonder GC er nog een verhoogd fractuurrisico is, wordt geadviseerd om de medicatie ter preventie van fracturen te continueren: dit kan het geval zijn bij een T-score ≤ -2,5 in lumbale wervelkolom en/of heup, of een incidente of prevalente wervelfractuur (graad 2 of hoger, ≥ 25% hoogteverlies), of een recente (< 2 jaar) niet-wervelfractuur.
De medicatie ter preventie van fracturen kan gestopt worden bij glucocorticoïden gebruikers die geen T-score ≤ -2,5 hebben, geen wervelfractuur en geen recente niet-wervelfractuur.
Onderbouwing
Achtergrond
Patiënten die glucocorticoïden (GC) gebruiken hebben een verhoogd risico op fracturen, vooral bij langdurig gebruik van hogere doseringen. GC hebben een negatieve invloed op de botsterkte, en de drempelwaarde voor het optreden van fracturen is daardoor verlaagd. Glucocorticoïd-geïnduceerde osteoporose (GIOP) is de meest frequente vorm van secundaire osteoporose. Bij alle GC-gebruikers zijn algemene maatregelen ter preventie van GC-geassocieerde fracturen van belang: voldoende calcium en vitamine D, lichaamsbeweging, stoppen met roken en beperken alcohol gebruik, maar ook het zo kort mogelijk voorschrijven van GC in zo laag mogelijke dosis, en de optimale behandeling van de onderliggende ziekte, eventueel met gebruik van andere immunosuppressiva als comedicatie. In de eerdere multidisciplinaire richtlijn “Osteoporose en Fractuurpreventierichtlijn” werd gesteld dat medicatie ter preventie van fracturen geïndiceerd is bij patiënten met ≥ 7,5 mg prednison gedurende tenminste 3 maanden.
Uit het rapport van Zichtbare Zorg (2020) bleek dat dat er in Nederland slechts ongeveer 27% van de GC-gebruikers van ≥ 7,5 mg prednison gedurende tenminste 3 maanden beschermd wordt met medicatie ter preventie van fracturen, en dat er een substantieel verschil is in het voorschrijven van medicatie ter preventie van fracturen tussen verschillende specialismen, variërend van 23% tot 65%. Er is dus sprake van onderbehandeling, en deze onderbehandeling van GC-patiënten is opgenomen in het verbetersignalement van het Zinnige Zorg Project (Zorginstituut Nederland, 2020).
Deze module gaat in op de vraag bij welke patiënten die GC gebruiken het risico op fracturen dermate hoog is dat gebruik van medicatie voor fractuurpreventie is geïndiceerd. Daarnaast gaat deze module in op de vraag welke medicatie voor deze patiënten de voorkeur heeft.
Conclusies / Summary of Findings
Vertebral Fractures
Placebo
|
Moderate GRADE |
The following therapies probably reduce the risk of new/incident vertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoids:
Sources: (Ding, 2020) |
|
Moderate GRADE |
Alendronate probably results in little to no difference in risk of vertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
Low GRADE |
Ibandronate may result in little to no difference in risk of vertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
Very low GRADE |
The evidence is very uncertain about the effect of zoledronate on the risk of vertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
Nonvertebral Fractures
Placebo
|
Moderate GRADE |
Alendronate probably results in little to no difference in risk of nonvertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
Low GRADE |
Ibandronate may result in little to no difference in risk of nonvertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
Very low GRADE |
The evidence is very uncertain about the effect of teriparatide, risedronate and denosumab on the risk of nonvertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
- GRADE |
It is unknown whether zoledronate decreases the risk of new/incident nonvertebral fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
Hip Fractures
Placebo
|
Low GRADE |
Risedronate, ibandronate and alendronate may result in little to no difference in risk of hip fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
Very low GRADE |
The evidence is very uncertain about the effect of teriparatide on the risk of hip fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Ding, 2020) |
|
- GRADE |
It is unknown whether zoledronate or denosumab decrease the risk of new/incident hip fractures compared to placebo in patients who are using long-term (> 3 months) glucocorticoid. |
Changes in BMD
Active comparators
|
High GRADE |
Denosumab increases the BMD in lumbar spine and total hip compared to risedronate in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Saag, 2019) |
|
Moderate GRADE |
Teriparatide probably increases the BMD in lumbar spine, femoral neck and total hip compared to alendronate in patients who are using long-term (> 3 months) glucocorticoid.
Sources: (Saag, 2009) |
|
Low GRADE |
Zoledronate may result in little to no difference in changes of BMD in lumbar spine and femoral neck compared to risedronate in patients who are using long-term (> 3 months) glucocorticoid, respectively.
Sources: (Reid, 2009) |
|
Low GRADE |
Denosumab may result in little to no difference in changes of BMD in femoral neck compared to risedronate in patients who are using long-term (> 3 months) glucocorticoids.
Sources: (Saag, 2019) |
|
- GRADE |
It is unknown whether zoledronate increases the BMD in total hip compared to risedronate in patients who are using long-term (> 3 months) glucocorticoid. |
Samenvatting literatuur
Description of studies
Ding (2020) carried out a network meta-analysis to assess the comparative clinical efficacy of first line and second-line agents in preventing glucocorticoid-induced (GI) fractures measured as vertebral fractures, nonvertebral fractures, and hip fractures. The pharmacological agents of interest were denosumab (60 mg/6 months, subcutaneous), teriparatide (20 μg/day, subcutaneous), alendronate (5 or 10 mg/day or 35 or 70 mg/week, oral), risedronate (5 mg/day or 35 mg/week, oral), ibandronate (150 mg/month, oral, or 2 mg/3 months, intravenous), and zoledronate (5 mg/year, intravenous). Trials eligible for inclusion in this meta-analysis were (i) double-blind and not double-blind RCTs lasting for at least 12 months; (ii) trials that enrolled patients with GIOP or patients beginning or continuing long-term (at least 3 months) GC treatment; (iii) trials that compared an active agent of interest with placebo or another active agent; and (iv) trials that measured at least 1 of the primary outcomes of interest. “Starters” are patients using GC treatment who are starting osteoporosis drugs within 3 months of initiating GCs (id est, primary prevention), while “chronic users” are patients continuing long-term GC treatment who are starting osteoporosis drugs beyond 3 months of initiating GCs (id est, secondary prevention). Papers were excluded if (i) the identical data were reanalyzed; (ii) the study subjects were treated with inhaled GCs; or (iii) studies focused on children and adolescents.
A systematic search was done in PubMed, Embase, and the Cochrane Central Register of Controlled Trials for English language papers published from the date of database inception to August 14, 2018, without sample size restrictions. Additionally, Google Scholar and prior systematic reviews in this field were used to search for more relevant articles. When a second search was performed on March 5, 2019, an additional paper was included according to inclusion criteria, which added an updated relevant statistical analysis.
The searches initially yielded 746 records, of which 22 papers from 19 unique trials met the preplanned criteria and were used for quantitative synthesis. Mean age, with the average value of 57.9 years, ranged from 44 years to 66 years. The proportion of women, with the average value of 65.9%, ranged from 0% to 100%.
In addition to Ding (2020), three randomized controlled trials were included on active comparisons measuring changes in BMD. Reid (2009) performed a multicenter, double-blind, double-dummy, randomized controlled trial to assess whether one intravenous infusion of zoledronic acid was non-inferior to daily oral risedronate for prevention and treatment of glucocorticoid-induced osteoporosis. Men and women aged 18 to 85 years were eligible for inclusion in the study if they were receiving at least 7.5 mg oral prednisolone daily (or equivalent) and were expected to receive glucocorticoids for at least another 12 months. Major exclusion criteria were previous treatment with bisphosphonates or other drugs that affect the skeleton (except in accordance with a predefined washout schedule), serum 25-hydroxyvitamin D concentration of less than 30 nmol/L, recent history of cancer or parathyroid disease, and renal impairment (calculated creatinine clearance of less than 30 mL/min or proteinuria). The treatment subgroup consisted of those treated for more than 3 months (272 patients on zoledronic acid and 273 on risedronate). Overall, 94% (n=511 patients) completed the study. The percentage of women in the zoledronic acid and risedronate group was 68% (n=185) and 67% (n=183), respectively. In total, 14% (n=77) of patients had one or more fractures at baseline.
Saag (2009) performed a randomized controlled trial to compare the bone anabolic drug teriparatide (20 µg/day) with the antiresorptive drug alendronate (10 mg/day) for treating glucocorticoid-induced osteoporosis. Ambulatory men and women were eligible for enrollment if they were at least 21 years of age and had taken prednisone or its equivalent at a dosage of ≥ 5 mg/day for ≥ 3 months prior to screening. Subjects were randomly assigned to receive injectable teriparatide (20 g/day) plus oral placebo or oral alendronate (10 mg/day) plus injectable placebo. Supplements of calcium (1,000 mg/day) and vitamin D (800 IU/day) were provided. Of the 712 subjects who were screened, 428 were randomized and received treatment. A total of 150 (70%) of the subjects receiving teriparatide and 144 (67%) of the subjects receiving alendronate entered the 18-month continuation phase, and 123 (57%) of the subjects receiving teriparatide and 118 (55%) of the subjects receiving alendronate completed the 36-month trial. The age range of the subjects was 22 to 89 years.
Saag (2019) performed a randomized controlled trial to compare the effects of denosumab versus risedronate on BMD. Participants in the study were men and women ≥ 18 years old who were receiving glucocorticoid therapy (prednisone or its equivalent) at a dose of ≥7.5 mg for ≥ 3 months before screening. A total of 364 patients (186 of 253 treated with denosumab and 178 of 252 treated with risedronate) completed the 24-month study. The mean age in the Risedronate and Denosumab group was 61.3 ± 11.1 and 61.5 ± 11.6 years, respectively. The number of female patients in the Risedronate and Denosumab group was 185 (73.4%) and 185 (73.1%), respectively.
Results
Fractures (vertebral, non- vertebral and hip fractures) - critical outcome
The results for preventing fractures of active agents compared to placebo in the network meta-analysis of Ding (2020) are presented in table 1. Statistically significant results are in bold.
Table 1 Effect on fractures of active agents compared to placebo
|
Zoledronate |
Teriparatide |
Risedronate |
Ibandronate |
Denosumab |
Alendronate |
|
Vertebral Fractures |
|||||
|
0.56 (0.12,2.57) |
0.11 (0.03,0.47) |
0.33 (0.19,0.58) |
0.33 (0.10,1.12) |
0.21 (0.09,0.49) |
0.44 (0.18,1.08) |
|
Nonvertebral Fractures |
|||||
|
- |
0.50 (0.19,1.31) |
1.04 (0.51,2.12) |
0.43 (0.06,3.02) |
1.45 (0.55,3.80) |
0.51 (0.24,1.08) |
|
Hip Fractures |
|||||
|
- |
0.12 (0.00,10.54) |
0.34 (0.01,8.16) |
0.51 (0.04,6.00) |
- |
0.57 (0.07,4.55) |
Numbers in the table represent relative risk (95% confidence interval)
Changes in BMD - important outcome
The results for changes in BMD of zoledronate versus risedronate after 12 months (Reid, 2009), of teriparatide versus alendronate after 36 months (Saag, 2009) and of denosumab versus risedronate after 24 months (Saag, 2019) are presented in table 2. Significant results are in bold.
Table 2 Effect on changes in BMD in direct comparisons (active comparators)
|
Zoledronate versus Risedronate |
Teriparatide versus. Alendronate |
Denosumab versus. Risedronate |
|
Lumbar spine BMD |
||
|
1.36 (95% CI, 0.67-2.05) |
4,7% (95% CI not reported, P< 0.001) |
3.2 (95% CI, 2.0-4.3) |
|
Femoral neck BMD |
||
|
1.06 (95% CI, 0.32-1.79) |
2,9% (95% CI not reported, P< 0.001) |
1.8 (95% CI, 0.7-2.9) |
|
Total hip BMD |
||
|
- |
2,5% (95% CI not reported, P< 0.001) |
2.5 (95% CI, 1.7-3.2) |
Numbers in the table represent mean differences between comparators (95% CI)
Level of evidence
Fractures- critical outcome
See table 3 for the quality of evidence of results on fractures for active agents compared to placebo as assessed by Ding (2020).
Table 3 Level of evidence of results on fractures for active agents compared to placebo
|
Therapy |
Level of evidence |
Reason for downgrading |
|
Vertebral fractures |
|
|
|
Zoledronate |
Very low |
Imprecision (two levels) and indirectness |
|
Teriparatide |
Moderate |
Indirectness |
|
Risedronate |
Moderate |
Risk of bias |
|
Ibandronate |
Low |
Imprecision (two levels) |
|
Denosumab |
Moderate |
Indirectness |
|
Alendronate |
Moderate |
Imprecision |
|
Nonvertebral fractures |
|
|
|
Zoledronate |
No grade |
- |
|
Teriparatide |
Very low |
Imprecision (two levels) and indirectness |
|
Risedronate |
Very low |
Imprecision (two levels) and risk of bias |
|
Ibandronate |
Low |
Imprecision (two levels) |
|
Denosumab |
Very low |
Imprecision (two levels) and indirectness |
|
Alendronate |
Moderate |
Imprecision |
|
Hip fractures |
|
|
|
Zoledronate |
No grade |
- |
|
Teriparatide |
Very low |
Imprecision (two levels) and indirectness |
|
Risedronate |
Low |
Imprecision (two levels) |
|
Ibandronate |
Low |
Imprecision (two levels) |
|
Denosumab |
No grade |
- |
|
Alendronate |
Low |
Imprecision (two levels) |
Changes in BMD - important outcome
See table 4 for the level of evidence of results on changes in BMD for active comparators
Table 4 Level of evidence of results on changes in BMD for active comparators
|
Comparison |
Level of evidence |
Reason for downgrading |
|
Lumbar spine BMD |
||
|
Zoledronic acid versus Risedronate |
Low |
Imprecision (two levels) |
|
Teriparatide versus Alendronate |
Moderate |
Absence of the 95% confidence interval (imprecision) |
|
Denosumab versus Risedronate |
High |
- |
|
Femoral neck BMD |
||
|
Zoledronic acid versus Risedronate |
Low |
Imprecision (two levels) |
|
Teriparatide versus Alendronate |
Moderate |
Absence of the 95% confidence interval (imprecision) |
|
Denosumab versus Risedronate |
Low |
Imprecision (two levels) |
|
Total hip BMD |
||
|
Zoledronic acid versus Risedronate |
No grade |
- |
|
Teriparatide versus Alendronate |
Moderate |
Absence of the 95% confidence interval (imprecision) |
|
Denosumab versus Risedronate |
High |
- |
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
“Which anti-osteoporosis medication is most effective in patients who are using glucocorticoid for long-term?”
P: patients who are using glucocorticoid long-term (> 3 months);
I: treatment with anti-osteoporosis medication;
C: other therapies or placebo;
O: fractures (hip, non-vertebral and vertebral fractures) and changes in BMD.
Relevant outcome measures
The guideline development group considered fractures (hip, non-vertebral and vertebral fractures) as a critical outcome measure for decision making and changes in BMD as an important outcome measure for decision making. The outcome measure changes in BMD were only considered for active comparisons, due to limited evidence for these comparisons on the effect on fractures.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group used the GRADE standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes and 10% for continuous variables.
Search and select (Methods)
The databases Pubmed and Embase were searched with relevant search terms until February 25th, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 217 hits. Studies were selected based on the following criteria: randomized controlled trials of anti-osteoporosis medication in patients using glucocorticoid long-term (> 3 months). 13 studies were initially selected based on title and abstract screening. After reading the full text, 9 studies were excluded (see the table with reasons for exclusion under the tab Methods) and four studies were included.
Results
Four studies were included in the analysis of the literature, one network meta-analysis on the outcome of fractures (Ding, 2020) and three randomized controlled trials for active comparisons, measuring changes in BMD. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Buckley L, Guyatt G, Fink HA, Cannon M, Grossman J, Hansen KE et al. 2017 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Rheumatol. 2017;69(8):1521-37. doi:10.1002/art.40137.
- Compston J, Cooper A, Cooper C, Gittoes N, Gregson C, Harvey N et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2017;12(1):43. doi:10.1007/s11657-017-0324-5.
- Ding, L., Hu, J., Wang, D., Liu, Q., Mo, Y., Tan, X., & Wen, F. (2020). Efficacy and Safety of First-and Second-Line Drugs to Prevent Glucocorticoid-Induced Fractures: Network Meta-Analysis. The Journal of Clinical Endocrinology & Metabolism, 105(1), dgz023.
- Grossman JM, Gordon R, Ranganath VK, Deal C, Caplan L, Chen W et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken). 2010;62(11):1515-26. doi:10.1002/acr.20295.
- Hoes JN, Jacobs JW, Boers M, Boumpas D, Buttgereit F, Caeyers N et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis. 2007;66(12):1560-7. doi:10.1136/ard.2007.072157.
- Kanis JA, Johansson H, Oden A, Johnell O, de Laet C, Melton IL et al. A meta-analysis of prior corticosteroid use and fracture risk. J Bone Miner Res. 2004;19(6):893-9. doi:10.1359/JBMR.040134.
- Lekamwasam S, Adachi JD, Agnusdei D, Bilezikian J, Boonen S, Borgstrom F et al. A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis. Osteoporos Int. 2012;23(9):2257-76. doi:10.1007/s00198-012-1958-1.
- Raterman HG, Bultink IEM, Lems WF. Current Treatments and New Developments in the Management of Glucocorticoid-induced Osteoporosis. Drugs. 2019;79(10):1065-87. doi:10.1007/s40265-019-01145-6.
- Reid, D. M., Devogelaer, J. P., Saag, K., Roux, C., Lau, C. S., Reginster, J. Y., ... & Mesenbrink, P. (2009). Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. The Lancet, 373(9671), 1253-1263.
- Saag, K. G., Pannacciulli, N., Geusens, P., Adachi, J. D., Messina, O. D., Morales‐Torres, J., ... & Lems, W. F. (2019). Denosumab versus risedronate in glucocorticoid‐induced osteoporosis: final results of a twenty‐four–month randomized, double‐blind, double‐dummy trial. Arthritis & Rheumatology, 71(7), 1174-1184.
- Saag KG, Pannacciulli N, Geusens P, Adachi JD, Messina OD, Morales-Torres J et al. Denosumab versus risedronate in glucocorticoid-induced osteoporosis: final results of a 24-month randomized, double-blind, double-dummy trial. Arthritis Rheumatol. 2019. doi:10.1002/art.40874.
- Saag, K. G., Zanchetta, J. R., Devogelaer, J. P., Adler, R. A., Eastell, R., See, K., ... & Warner, M. R. (2009). Effects of teriparatide versus alendronate for treating glucocorticoid‐induced osteoporosis: Thirty‐six–month results of a randomized, double‐blind, controlled trial. Arthritis & Rheumatism: Official Journal of the American College of Rheumatology, 60(11), 3346-3355.
- Silverman S, Curtis J, Saag K, et al. International management of bone health in GC-exposed individuals in the observational GLOW-study. Ost Int 2015; 26: (1): 419-20.
- Van Staa, T. P., Laan, R. F., Barton, I. P., Cohen, S., Reid, D. M., & Cooper, C. (2003). Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis & Rheumatism, 48(11), 3224-3229.
- Van Staa TP van, Leufkens HG, Abenhaim L, et al Oral corticosteroids and fracture risk; relationship to daily and cumulative dosis J Rheumatology 2000;39: 1383-9.
- Van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res. 2000;15(6):993-1000. doi:10.1359/jbmr.2000a.15.6.993.
- van Staa TP, Geusens P, Pols HA, de Laet C, Leufkens HG, Cooper C. A simple score for estimating the long-term risk of fracture in patients using oral glucocorticoids. QJM. 2005;98(3):191-8. doi:10.1093/qjmed/hci029.
- van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses.
- Zorginstituut Nederland. Verbetersignalement Osteoporose. 2020.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Ding, 2020
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to March 2019
A: Saag, 2018 B: Saag, 2019 C: Iseri, 2018 D: Saag, 2007 E: Saag, 2009 F: Glüer, 2013 G: Takeuchi, 2016 H: de Nijs, 2006 I:Lems, 2006 J: Saag, 1998 K: Adachi, 2001 L: Stoch, 2009 M: Tee, 2012 N: Cohen, 1999 O: Reid, 2000 P: Hakala, 2012 Q: Li, 2010 R: Reid, 2009 S: Reid, 2001 T: Wallach, 2000 U: Shin, 2017 V: Fahrleitner-Pammer, 2009
Study design: RCT
Setting and Country: multicentre, Europe, Latin America, Asia, and North America
Source of funding and conflicts of interest: The authors have nothing to disclose.
|
Inclusion criteria SR: - double-blind and not double-blind RCTs lasting at least 12 months - trials that enrolled patients with GIOP or patients beginning or continuing long-term (at least 3 months) GC treatment -trials that compared an active agent of interest with placebo or another active agent - trials that measured at least 1 of the primary outcomes of interest
Exclusion criteria SR: - the identical data were reanalyzed - the study subjects were treated with inhaled GCs - studies focused on children and adolescents
22 studies included
Important patient characteristics at baseline: N, mean age See article by Ding et al. (2020)
Groups comparable at baseline? Yes |
Describe intervention:
A: Denosumab, 60 mg/6 mo, sc B: Denosumab, 60 mg/6 mo, sc C: Denosumab, 60 mg/6 mo, sc D: Teriparatide, 20 μg/d, sc E:Teriparatide, 20 μg/d, sc F: Teriparatide, 20 μg/d, sc G: Denosumab, 60 mg/6 mo, sc H: Alendronate, 10 mg/d, oral I: Alendronate, 5 mg/d, oral J: Alendronate, 5 or 10mg/d, oral K:Alendronate, 5 or 10mg/d, oral L: Alendronate, 70 mg/w, oral M:Alendronate, 10 mg/d, oral N: Risedronate, 5 mg/d, oral O: Risedronate, 5 mg/d, oral P: Ibandronate, 150 mg/mo, oral Q: Ibandronate, 150 mg/mo, oral R: Zoledronate, 5 mg/yr, iv S: Risedronate, 5 mg/d, oral T: Risedronate, 5 mg/d, oral U: Ibandronate, 150 mg/mo, oral V: Ibandronate, 2 mg/3 mo, iv
|
Describe control:
A: Risedronate, 5 mg/d, oral B: Risedronate, 5 mg/d, oral C: Alendronate, 35 mg/w, oral D: Alendronate, 10 mg/d, oral E: Alendronate, 10 mg/d, oral F: Risedronate, 35 mg/w, oral G: Placebo H: Placebo I:Placebo J: Placebo K: Placebo L: Placebo M: Placebo N: Placebo O: Placebo P: Placebo Q: Placebo R: Risedronate, 5 mg/d, oral S: Placebo T: Placebo U: Placebo V: Placebo
|
End-point of follow-up:
A: 12 months B: 24 months C: 12 months D: 18 months E: 36 months F: 18 months G: 12 months H: 18 months I: 12 months J: 12 months K: 24 months L: 12 months M: 12 months N: 12 months O: 12 months P: 12 months Q: 12 months R: 12 months S: 12 months T: 12 months U: 12 months V: 12 months
For how many participants were no complete outcome data available? Not reported
|
1. Changes in BMD Not reported
2. Vertebral fractures See article by Ding et al. (2020)
3. Nonvertebral fractures See article by Ding et al. (2020)
4. Hip fractures See article by Ding et al. (2020)
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Reid, 2009 |
Type of study: a multicentre, double-blind, double-dummy, randomised controlled tria
Setting and country: Multicentre, Australia, Belgium, Czech Republic, Estonia, Finland, France, Hong Kong, Hungary, Israel, Lithuania, Poland, Romania, Spain, Switzerland, UK, and USA
Funding and conflicts of interest: DMR has received consulting, advisory board, lecture fees, and any combination of the three from Pfi zer, Novartis, Roche, Amgen, GlaxoSmithKline, and AstraZeneca; has received grant support from Roche, Novartis, and TMRI Scotland; and has equity ownership or stock options in AstraZeneca and GlaxoSmithKline. J-PD has received consulting or advisory board fees from Novartis; lecture fees from Merck, Sharpe & Dohme, Procter & Gamble, Servier, and Roche; and grant support from Schering-Plough, Abbott, Amgen, Novartis, Servier, Merck, Sharpe & Dohme, Procter & Gamble, and Fonds National de Recherche Scientifi que Médicale Belge. KS has received consulting or advisory board fees from Eli Lilly & Co, Merck, Novartis, Amgen, Roche, Procter & Gamble, and Aventis; lecture fees from Merck and Novartis; and grant support from Aventis, Eli Lilly & Co, Novartis, Amgen, Roche, TAP, and GlaxoSmithKline. CR has received consulting, advisory board, or lecture fees from Merck, Sharpe & Dohme, Servier, Novartis, Roche, Alliance, Amgen, and Nycomed. C-SL has received consulting or advisory board fees from Novartis, Merck, Sharpe & Dohme, Aventis, and Centocor; and lecture fees from Aspreva, Merck, and Sharpe & Dohme. J-YR has received consulting, advisory board, or lecture fees, or a combination of the three from Servier, Novartis, Negma, Lilly, Wyeth, Amgen, GlaxoSmithKline, Roche, Merckle, Nycomed, NPS, Theramex, UCB, Merck, Sharpe & Dohme, Rottapharm, IBSA, Genevrier, Teijin, Teva, Ebewee Pharma, Zodiac, Analis, Theramex, Nycomed, and Novo Nordisk; and grant support from Bristol Myers Squibb, Merck, Sharpe & Dohme, Rottapharm, Teva, Lilly, Novartis, Roche, GlaxoSmithKline, Amgen, and Servier. PP, AF, TF, and PM are employees of Novartis and own stock in Novartis. FH was an employee of Novartis during the study. PS received consulting or advisory board fees from Merck, Sanofi - Aventis, Servier, and Novartis; lecture fees from Roche; and grant support from the Australian National Health and Medical Research Council. Funding: Novartis Pharma. |
Inclusion criteria: -Men and women aged 18–85 years - receiving at least 7·5 mg oral prednisolone daily (or equivalent) - expected to receive glucocorticoids for at least another 12 months
Exclusion criteria: previous treatment with bisphosphonates or other drugs that aff ect the skeleton (except in accordance with a predefi ned washout schedule), serum 25-hydroxyvitamin D concentration of less than 30 nmol/L, recent history of cancer or parathyroid disease, and renal impairment (calculated creatinine clearance19 of less than 30 mL/min or proteinuria).
N total at baseline: Intervention: 272 Control: 273
Important prognostic factors2: For example age ± SD: I: 53.2 ± 14 C: 52.7 ± 13.7
Sex: I: 32% M C: 33% M
Menopausal women I: 64% C: 64%
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test): 5 mg zoledronic acid as one 100 mL intravenous infusion over 15–20 min on day 1 and daily oral placebo
|
Describe control (treatment/procedure/test): 5 mg oral risedronate daily and one intravenous infusion of placebo on day 1
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 3 (1%) Reasons adverse events
Control: 3 (1%) Reasons adverse events
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Changes BMD, least square mean (SE): Lumbar spine I: 4.06% (0.28) C: 2.71% (0.28) Mean difference: 1.36% (95% CI 0.67 – 2.05)
Femoral neck I: 1.45 % (0.31) C: 0.39% (0.31) Mean difference: 1.06 (95% CI 0.32 – 1.79)
2. Fractures Not reported |
Industry sponsored trial
Authors conclusion: A single 5 mg intravenous infusion of zoledronic acid is non-inferior, possibly more eff ective, and more acceptable to patients than is 5 mg of oral risedronate daily for prevention and treatment of bone loss that is associated with glucocorticoid use. |
|
Saag, 2009 |
Type of study: Randomized, Double-Blind, Controlled Trial
Setting and country: Multicentre
Funding and conflicts of interest: grant support from AstraZeneca, |
Inclusion criteria: Ambulatory men and women at least 21 years of age and had taken prednisone or its equivalent at a dosage of ≥5 mg/day for ≥3 months prior to screening. Subjects were required to have a lumbar spine, femoral neck, or total hip BMD T score of 2 or of 1 plus a prevalent low trauma or atraumatic fracture, as assessed by the investigator
Exclusion criteria: -
N total at baseline: Intervention: 214 Control: 214
Important prognostic factors2: For example age ± SD: I: 56.1 ± 13.4 C: 57.3 ± 14.0
Sex: I: 80% F C: 81% F
White: I: 71% C: 69%
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test): Injectable teriparatide (20 g/day) plus oral placebo
|
Describe control (treatment/procedure/test): oral alendronate (10 mg/day) plus injectable placebo
|
Length of follow-up: 36 months
Loss-to-follow-up: Intervention: 91 (42.5%) Reasons: Adverse event: 30 Decided to withdraw: 29 Died: 9 Lost to follow-up: 4 Protocol violation: 3 Withdrawn by sponsor: 6 Entry criteria unmet: 1 Other reason: 2 Withdrawn by physician: 5 Significant lab value: 2
Control: 96 (44.9%) Reasons: Adverse event: 18 Decided to withdraw: 42 Died: 15 Lost to follow-up: 13 Protocol violation: 4 Withdrawn by sponsor: 1 Entry criteria unmet: 2 Other reason: 1
Incomplete outcome data: Not reported |
Outcome measures and effect size (include 95%CI and p-value if available):
1. Changes BMD, least square mean (SE): Lumbar spine I: 11% C: 5.3% Mean difference: 4.7%%
Femoral neck I: 6.3% C: 3.4 % Mean difference: 12.9%
Total hip I: 5.2% C: 2.7% Mean difference: 2.9%
2. Fractures Not reported |
Authors conclusion: Our findings indicate that subjects with glucocorticoid-induced OP treated with teriparatide for 36 months had greater increases in BMD and fewer new vertebral fractures than subjects treated with alendronate. |
|
Saag, 2019 |
Type of study: Randomized, Double-Blind, Double-Dummy Trial
Setting and country: Multicentre
Funding and conflicts of interest: Amgen Inc. funded the study and participated in the study design. The authors collected the data, interpreted the results, and had the final decision to submit the manuscript for publication. Medical writing assistance was provided by Lisa Humphries (Amgen Inc.) and Jonathan Latham (PharmaScribe, LLC, on behalf of Amgen Inc.). |
Inclusion criteria: men and women ≥18 years old who were receiving glucocorticoid therapy (prednisone or its equivalent) at a dose of ≥7.5 mg for <3 months (glucocorticoid-initiating) or ≥3 months (glucocorticoid-continuing) before screening.
Exclusion criteria: -
N total at baseline: Intervention: 253 Control: 252
Important prognostic factors2: For example age ± SD: I: 61.5 ± 11.6 C: 61.3 ± 11.1
Sex: I: 73.1% F C: 73.4% f
Race, no (%): White I: 230 (90.9) C: 223 (88.5)
Asian: I: 6 (2.4) C: 12 (4.8)
Black or African America: I: 4 (1.6) C: 4 (1.6)
Other: I: 13 (5.1) C: 13 (5.2)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test): subcutaneous denosumab 60 mg Q6M and oral placebo (for risedronate) QD for 24 months,
|
Describe control (treatment/procedure/test): oral risedronate 5 mg QD (the dosing regimen approved for the treatment and prevention of glucocorticoid-induced osteoporosis) and subcutaneous placebo (for denosumab) Q6M |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: 67 (26.5%) Reasons: withdrawal of consent : 13.6% Adverse events: 4.8%
Control: 74 (29.4%) Reasons withdrawal of consent : 12.3% Adverse events: 4.0%
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Changes BMD, least square mean (SE): Lumbar spine Mean difference: 3.2% (95% CI 2.0 – 4.3%)
Femoral neck Mean difference: 1.8% (95% CI 0.7 – 2.9%)
Total hip Mean difference: 2.5% (95% CI 1.7 – 3.2%)
2. Fractures Not reported |
Authors conclusion: Denosumab was superior to risedronate in terms of increases in spine and hip BMD through month 24, and the safety profile was similar between treatment groups. Denosumab may offer a new osteoporosis treatment option for glucocorticoid-treated patients. |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Reid, 2009 |
Randomisation to a drug group was done with an interactive voice response system (IVRS). |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Saag, 2009 |
Block randomization, stratified according to sex, investigative site, and previous use of bisphosphonates, was used to assign subjects to treatment in an approximate 1:1 ratio. |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Saag, 2019 |
The sponsor’s Global Randomization and Blinding Group, which was independent of the study team, prepared the randomization before study initiation using a computer-generated schedule |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Ding, 2020 |
Yes |
Yes |
No |
Yes |
Not applicable |
Yes |
Yes |
Yes |
No |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Yanbeiy, 2019 |
Ding (2020) was most recent network meta-analyse |
|
Wang, 2019 |
Ding (2020) was most recent network meta-analyse |
|
Wang, 2018 |
Ding (2020) was most recent network meta-analyse |
|
Zhao, 2016 |
Ding (2020) was most recent network meta-analyse |
|
Kan, 2016 |
Ding (2020) was most recent network meta-analyse |
|
Amiche, 2016 |
Ding (2020) was most recent network meta-analyse |
|
Allen, 2016 |
Ding (2020) was most recent network meta-analyse |
|
Saag, 2016 |
Subpopulation analyses of Saag (2009) |
|
Saag, 2018 |
Same study as Saag (2019) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 08-08-2022
Geldigheid en Onderhoud
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling medicatie Glucocorticoïden |
NIV |
2021 |
3 |
Jaarlijks |
NIV |
|
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Verenso heeft een verklaring van geen bezwaar afgegeven.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werk- en klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met osteoporose en een verhoogd fractuurrisico.
Werkgroep
- Prof. dr. J.P.W. van den Bergh, internist-endocrinoloog, VieCuri Medisch Centrum, Venlo & Maastricht Universitair Medisch Centrum, Maastricht (voorzitter), NIV
- Dr. N.M. Appelman-Dijkstra, internist-endocrinoloog, Leids Universitair Medisch Centrum, Leiden, NIV
- Prof. dr. M.C. Zillikens, internist-endocrinoloog, Erasmus Medisch Centrum, Rotterdam, NIV
- Prof. dr. W.F. Lems, reumatoloog, Amsterdam Universitair Medisch Centrum en Reade, Amsterdam, NVR
- Prof. dr. P.P.M.M. Geusens, reumatoloog, Maastricht Universitair Medisch Centrum, Maastricht, NVR
- Dr. H.C. Willems, klinisch geriater, Amsterdam Universitair Medisch Centrum, Amsterdam, NVKG
- Dr. G. de Klerk, traumachirurg, Admiraal de Ruyter Ziekenhuis, Goes, NVvT
- Dr. P.J.M. Elders, professor in de huisartsengeneeskunde, Huisartsenpraktijk De Grote Rivieren, Amsterdam, NHG
- Dr. L.W.F. Maartens, huisarts, Huisartsencentrum Parklaan-Maartens, Eindhoven, NHG
- Dr. T. Wiersma, huisarts en senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht, NHG
- Drs. M.M. van Oostwaard, verpleegkundig specialist, VieCuri Medisch Centrum, Venlo, V&VN
- H.J.G. van den Broek, patiëntvertegenwoordiger Osteoporose Vereniging, Den Haag, Osteoporose Vereniging
Klankbordgroep:
- Dr. H.G. Raterman, reumatoloog, Noordwest Ziekenhuisgroep, Den Helder, NVR
- Prof. dr. F. de Vries, professor in de klinische farmacie en epidemiologie, Maastricht Universitair Medisch Centrum, Maastricht, NVZA
- Drs. M. van der Steen, openbaar apotheker, Apotheek Veldhuizen, Ede, KNMP
- Dr. P. van den Berg, verpleegkundig specialist fracturen en osteoporose, Reinier de Graaf, Delft, V&VN
- Dr. E. Smulders, hoofddocent geriatrie fysiotherapie Radboud Universitair Medisch Centrum, Nijmegen, KNGF
- Dr. L. den Boeft, geriatriefysiotherapeut, praktijk 43, Naarden, KNGF
- M. Alcazar, klinisch diëtist, Amstelring, Amsterdam, NVD
- C.J.M. van Santen, oefentherapeut, Praktijk voor Houding en Beweging, Den Haag, VVOCM
- Drs. M.H. de Jong, Sportarts, Annatommie mc Amsterdam-Amstelveen, Amstelveen, VSG
- Drs. W. Jager, gynaecoloog, St. Jans Gasthuis Weert, Weert, NVOG
- E.H.G. Oei, radioloog, Erasmus Medisch Centrum, Rotterdam, NVVR
- Dr. S.H. van Helden, traumachirurg, Isala, Zwolle, NVT
- M.G.C. Ligthart, bedrijfsarts, ADXpert, Ridderkerk, NVAB
- Dr. P.M. van Roermund, orthopeed, Universitair Medisch Centrum Utrecht, Utrecht, NOV
- A.M.W.M. van Dam, patiëntvertegenwoordiger Osteoporose Vereniging, Den Haag, Osteoporose Vereniging
- Dr. H.J.J. Verhaar, internist, Universitair Medisch Centrum Utrecht, Utrecht, NIV
- Dr. R.L. van Bezooijen, specialist Ouderengeneeskunde, Florence, Rijswijk, Verenso
- Drs. G. Zemack, revalidatiearts, Revalidatiecentrum Libra, Eindhoven, VRA
- Drs. S.E.C. Pichardo, MKA-chirurg, Leids Universitair Medisch Centrum, Leiden, VRA
- Drs. M.R.J. ten Broek, nucleair Geneeskundige, Reinier de Graaf Groep, IJsselland ziekenhuis, NVNG
Met ondersteuning van
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. K. Venhorst, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Het kennisinstituut in haar rol als methodologisch ondersteuner, de NIV als initiërende wetenschappelijke vereniging en de richtlijncommissie zijn zich bewust van de belangen die spelen binnen de werkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase zullen de in de werkgroep vertegenwoordigde verenigingen middels de uitnodigingsbrief voor het aanleveren van commentaar erop alert worden gemaakt dat er belangen spelen binnen de richtlijnwerkgroep. Zij zullen worden verzocht om hier bij het aanleveren van commentaar kritisch op te zijn en erover na te denken om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Bergh |
Werkzaam in VieCuri MC Noord Limburg Hoogleraar botkwaliteit en metabole botaandoeningen, Maastricht UMC 0,2 FTE Hoogleraar Endocrinologie Uhasselt België, 0,05 FTE |
Bestuurslid Stichting IWO (Interdisciplinaire werkgroep osteoporose), onbetaald behoudens onkostenvergoeding Voorzitter planning en Financiering OOR Zuid Oost Nederland, onbetaald Lid dagelijks bestuur OOR Zuid Oost Nederland, onbetaald Lid werkgroep Zinnige Zorg Osteoporose - Zorglnstituut onbetaald Lid werkgroep Kwaliteitsindicator Osteoporose, onbetaald |
Vergoeding voordrachten en advisoryboards: Amgen, UCB, Eli Lilly, Sanofi
Onderzoek gefinancierd (via de afdeling, niet via ondergetekende) door Amgen, Eli Lilly, Apotheekzorg, Stichting de Weijerhorst, NWO, Novo Nordisk Fonden
Bestuurslid van stichting IWO en bestuurslid van de NVE BoNe werkgroep |
Geen |
|
Appelman-Dijkstra |
Internist Leids Universitair Medisch Centrum |
non-paid member scientific board van Active Life, (onbetaald) voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling alsmede secretaris van de NVE BoNe werkgroep (onbetaald), lid sectie Endocrinologie NIV (onbetaald behoudens reiskostenvergoeding) |
Geparticipeerd in de fase 3 studie naar Romosozumab in postmenopauzale osteoporose (afgerond in 2016/2017). 2015 Researchdonatie van Amgen ten behoeve van ontwikkeling Nederlandse ziekte specifieke vragenlijst voor hyperparathyrodie 2019 UCB ISSS gesponsorde studie naar de uitkomsten van Sclerostin deficiëntie bij mensen met de ziekte van Buchem
Niet van toepassing behoudens voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling alsmede secretaris van de NVE BoNe werkgroep |
Geen |
|
Zillikens |
Internist Erasmus MC Rotterdam. Hoogleraar complexe en zeldzame botaandoeningen. |
Voorzitter BotNetwerk van de Nederlandse Vereniging voor Endocrinologie (NVE), onbetaald Voormalig voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling, onbetaald Bestuurslid European Calcified Tissue Society (ECTS), onbetaald. |
Geparticipeerd in de fase 3 studie naar Romosozumab bij postmenopauzale osteoporose (afgerond in 2016/2017)
participatie in de klankbordgroep richtlijn Mastocytose. |
Geen |
|
Lems |
Reumatoloog in Amsterdam UMC/lokatiehoofd in Vumc (0,8 FTE) Reumatoloog in Reade (0,2 FTE) |
Hoofdredacteur Ned. Tijdschrift Reumatologie (betaald) Secretaris IWO (betaald) Wetenschappelijk secretaris NVR (betaald) Adviesraden/Speakers fees: Amgen, Eli Lilly, UCB, Pfizer, Curaphar (betaald) |
Sponsoring, aan de afdeling, niet aan ondergetekende, van wetenschappelijk onderzoek: Amgen, Eli Lilly, Pfizer |
Geen |
|
Geusens |
Emeritus hoogleraar reumatologie, MUMC & UHasselt, België Lopend onderzoek: Promotor voor S Bours Co-promotor voor P vd Berg Begeleiding bij diverse nog steeds lopende promoties aan MUMC en Uhaaselt |
Lid commissie terugbetaling geneesmiddelen, RIZIV, BE (onbezoldigd) Parttime Reumatoloog, ReumaClinic, BE (bezoldigd volgens RIZIV0 |
Pfizer, Abbott/Abbvie, Janssen, Celgene, Lilly, Amgen, MSD, UCB, Will, Roche, BMS, Novartis, Sanofi |
Geen |
|
Willems |
Klinisch geriater en internist bij AmsterdamUMC, (0,8 FTE) |
Voorzitter werkgroep Leading the Change bij stichting Zorgevaluatie Nederland (0,05FTE) betaald |
Speekersfee voor AMGEN, Lilly, UCB geparticipeerd in advisary boards van Amgen en UCB. |
Geen |
|
De Klerk |
Traumachirurg, Admiraal de Ruyter Ziekenhuis |
Instructeur Advanced Trauma Life Support, betaald Lid van de Taskforce 2 heupfractuur van de NVT, betaald |
2018 Presentatie op BOT Cursus Delft, speakersfee, enkele betaalde cursussen over osteosynthese van Synthes (Ankle Trauma en Hip fragility fractures), Smith and Nephew (TSF), Promotion Medical (IBRA Seminar & Workshop "Trauma and Reconstruction of the Upper Limb, Amsterdam), deelnemer osteoporose symposium betaald door Lilly Bij intellectuele belangen: 2017 Proefschrift: Identification and treatment in fracture patients |
Geen |
|
Elders |
0,6 FTE: Universitair Hoofd Docent onderzoeksgroep Diabetes, Overgewicht, leefstijl en Osteoporose bij de afdeling huisartsgeneeskunde en ouderengeneeskunde, UMC Amsterdam, locatie Vumc 0,2 FTE waarnemend huisarts te Amsterdam |
Expert-arts diabetes zorg voor de zorggroep CHAGZ te Amsterdam (betaald) Lid van de vaste Kamercommissie bevolkingsonderzoek van de gezondheidsraad (vacatiegeld) Lid van de gezondheidsraad (vacatiegeld) Lid van de werkgroep deprescibing van het kennisinstituut (vacatiegeld) Lid werkgroep Osteoporose Zorg Instituut Nederland (vacatiegeld) Lid van de transmurale werkgroep Diabeteszorg Amsterdam (vacatiegeld) Docent Huisartsgeneeskunde Diabetes en Osteoporose gerelateerd onderwerpen voor diverse organisaties, waaronder ook instellingen die subsidies van de farmaceutische industrie ontvangen. Het betreft nascholing die door mij zelf zonder bemoeienis van buitenaf worden samengesteld (betaald) Lid van de Diabetes Huisartsen groep (DIHAG) van het NHG (onbetaald) |
Geen |
Geen |
|
Maartens |
Huisarts 0,6 FTE Zelfstandig, Eindhoven |
Kader-arts osteoporose, Diagnostiek voor U Eindhoven. Op consultatie-basis Beoordeling DXA aanvragen Zuid Oost Brabant. Betaalde functie |
Geen |
Geen |
|
Wiersma |
senior wetenschappelijk medewerker NHG |
Geen |
Geen |
Geen |
|
Van Oostwaard
|
Verpleegkundig specialist Promovendus Centrum voor Metabole Botaandoeningen VieCuri Medisch Centrum |
Onbetaald: PhD traject Universiteit Maastricht (Prof. J van den Bergh) Voorzitter Netwerk V&VN VS Osteoporose
|
Beperkt honorarium: Adviseurschap UCB (adviesraad VS-PA) In verleden betaling voor een congresreis en voordrachten: Amgen (of via congresbureau ondersteund door Amgen) |
Geen |
|
Van den Broek |
Voorzitter Osteoporose Vereniging (vrijwilliger, onbezoldigd) DGA Consultec BV (Eigen holding, houder pensioenrechten) |
DGA Consultec BV (Eigen holding, houder pensioenrechten) deels betaald. Bestuurslid Energiek Heusden (energiecoöperatie, onbezoldigd) |
De osteoporose vereniging heeft geen extern gefinancierd onderzoek, dus niet van toepassing. Zij ontvangt subsidie, sponsoring en donatie voor het organiseren van verenigingsactiviteiten van VWS, ReumaNederland, contributie en bedrijven (waaronder Farma) |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en de Osteoporose Vereniging voor de Invitational conference en afvaardiging van de Osteoporose Vereniging in de werkgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en de Osteoporose Vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Implementatie
Richtlijn osteoporose en fractuurpreventie: implementatieplan
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn osteoporose en fractuurpreventie.
Voor het implementatieplan voor de richtlijn verwijst de richtlijnwerkgroep naar de implementatiefase van het zorginstituut: https://www.zorginstituutnederland.nl/werkagenda/stofwisseling-en-hormoonhuishouding/zinnige-zorg---osteoporose-implementatiefase
Voor het opstellen van dit plan is een verdere inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Algemeen: implementatie van de aanbevelingen bij de richtlijn osteoporose en fracuurpreventie
Voor een uitgebreide bespreking van de randvoorwaarden en verantwoordelijke partijen ten aanzien van de aanbevelingen van deze richtlijn verwijst de richtlijnwerkgroep naar de module ‘organisatie van zorg’.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met osteoporose en verhoogd fractuurrisico. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (Nederlandse Internisten Vereniging, 2011) op noodzaak tot revisie.
Tevens zijn er knelpunten aangedragen door de V&VN, NVKG, KNGF, NHG, KNMP, Verenso, NVR, Osteoporose Vereniging, NVD, IGJ en NVMKA via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
PubMed
|
Search |
Query |
Results |
|
#6 |
Search: #4 AND #5 |
52 |
|
#8 |
Search: #6 AND #7 |
7 |
|
#7 |
Search: ("Meta-Analysis as Topic"(Mesh) OR “Meta-Analysis”(Publication Type) OR metaanaly*(tiab) OR metanaly*(tiab) OR meta-analy*(tiab) OR meta synthes*(tiab) OR metasynthes*(tiab) OR meta ethnograph*(tiab) OR metaethnograph*(tiab) OR meta summar*(tiab) OR metasummar*(tiab) OR meta-aggregation(tiab) OR metareview(tiab) OR meta-review(tiab) OR overview of reviews(tiab) OR ((systematic*(ti) OR scoping(ti) OR umbrella(ti) OR meta-narrative(ti) OR metanarrative(ti) OR evidence based(ti)) AND (review*(ti) OR overview*(ti))) OR ((evidence(ti) OR narrative(ti) OR metanarrative(ti) OR qualitative(ti)) AND synthesis(ti)) OR systematic review(pt) OR prisma(tiab) OR preferred reporting items(tiab) OR quadas*(tiab) OR systematic review*(tiab) OR systematic literature(tiab) OR structured literature search(tiab) OR systematic overview*(tiab) OR scoping review*(tiab) OR umbrella review*(tiab) OR mapping review*(tiab) OR systematic mapping(tiab) OR evidence synthes*(tiab) OR narrative synthesis(tiab) OR metanarrative synthesis(tiab) OR research synthesis(tiab) OR qualitative synthesis(tiab) OR realist synthesis(tiab) OR realist review(tiab) OR realist evaluation(tiab) OR systematic qualitative review(tiab) OR mixed studies review(tiab) OR mixed methods synthesis(tiab) OR mixed research synthesis(tiab) OR quantitative literature review(tiab) OR systematic evidence review(tiab) OR evidence-based review(tiab) OR comprehensive literature search(tiab) OR integrated review*(tiab) OR integrated literature review(tiab) OR integrative review*(tiab) OR integrative literature review*(tiab) OR structured literature review*(tiab) OR systematic search and review(tiab) OR meta-narrative review*(tiab) OR metanarrative review(tiab) OR systematic narrative review(tiab) OR systemic review(tiab) OR systematized review(tiab) OR systematic research synthesis(tiab) OR bibliographic*(tiab) OR hand-search*(tiab) OR handsearch*(tiab) OR manual search*(tiab) OR searched manually(tiab) OR manually searched(tiab) OR journal database*(tiab) OR review authors independently(tiab) OR reviewers independently(tiab) OR independent reviewers(tiab) OR independent review authors(tiab) OR electronic database search*(tiab) OR (study selection(tiab) AND data extraction(tiab)) OR (selection criteria(tiab) AND data collection(tiab)) OR (selection criteria(tiab) AND data analysis(tiab)) OR (evidence acquisition(tiab) AND evidence synthesis(tiab)) OR (pubmed(tiab) AND embase(tiab)) OR (medline(tiab) AND embase(tiab)) OR (pubmed(tiab) AND cochrane(tiab)) OR (medline(tiab) AND cochrane(tiab)) OR (embase(tiab) AND cochrane(tiab)) OR (pubmed(tiab) AND psycinfo(tiab)) OR (medline(tiab) AND psycinfo(tiab)) OR (embase(tiab) AND psycinfo(tiab)) OR (cochrane(tiab) AND psycinfo(tiab)) OR (pubmed(tiab) AND web of science(tiab)) OR (medline(tiab) AND web of science(tiab)) OR (embase(tiab) AND web of science(tiab)) OR (psycinfo(tiab) AND web of science(tiab)) OR (cochrane(tiab) AND web of science(tiab)) OR ((literature(ti) OR qualitative(ti) OR quantitative(ti) OR integrated(ti) OR integrative(tiab) OR rapid(ti) OR short(ti) OR critical*(ti) OR mixed stud*(ti) OR mixed method*(ti) OR focused(ti) OR focussed(ti) OR structured(ti) OR comparative(ti) OR comparitive(ti) OR evidence(ti) OR comprehensive(ti) OR realist(ti)) AND (review*(ti) OR overview*(ti)) AND (literature search(tiab) OR structured search(tiab) OR electronic search(tiab) OR search strategy(tiab) OR gray literature(tiab) OR grey literature(tiab) OR Review criteria(tiab) OR eligibility criteria(tiab) OR inclusion criteria(tiab) OR exclusion criteria(tiab) OR predetermined criteria(tiab) OR included studies(tiab) OR identified studies(tiab) OR (systematic search(tiab) AND literature(tiab)) OR strength of evidence(tiab) OR citation*(tiab) OR references(tiab) OR database search*(tiab) OR electronic database*(tiab) OR data base search*(tiab) OR electronic data-base*(tiab) OR search criteria(tiab) OR study selection(tiab) OR data extraction(tiab) OR methodological quality(tiab) OR methodological characteristics(tiab) OR methodologic quality(tiab) OR methodologic characteristics(tiab))) OR ((literature review(tiab) OR literature search*(tiab)) AND (structured search(tiab) OR electronic search(tiab) OR Search strategy(tiab) OR gray literature(tiab) OR grey literature(tiab) OR review criteria(tiab) OR eligibility criteria(tiab) OR inclusion criteria(tiab) OR exclusion criteria(tiab) OR predetermined criteria(tiab) OR included studies(tiab) OR identified studies(tiab) OR (systematic search(tiab) AND literature(tiab)) OR strength of evidence(tiab) OR citation*(tiab) OR references(tiab) OR database search*(tiab) OR electronic database*(tiab) OR data base search*(tiab) OR electronic data-base*(tiab) OR search criteria(tiab) OR study selection(tiab) OR data extraction(tiab) OR methodological quality(tiab) OR methodological characteristics(tiab) OR methodologic quality(tiab) OR methodologic characteristics(tiab)))) NOT ("Comment" (Publication Type) OR "Letter" (Publication Type)) NOT (“Animals”(Mesh) NOT “Humans”(Mesh)) |
334,135 |
|
#5 |
Search: ((random*(tiab) AND (controlled(tiab) OR control(tiab) OR placebo(tiab) OR versus(tiab) OR versus(tiab) OR group(tiab) OR groups(tiab) OR comparison(tiab) OR compared(tiab) OR arm(tiab) OR arms(tiab) OR crossover(tiab) OR cross-over(tiab)) AND (trial(tiab) OR study(tiab))) OR ((single(tiab) OR double(tiab) OR triple(tiab)) AND (masked(tiab) OR blind*(tiab)))) |
717,130 |
|
#4 |
Search: #1 AND #2 Filters: from 2016 - 2020 |
791 |
|
#3 |
Search: #1 AND #2 |
7,833 |
|
#2 |
Search: "Glucocorticoids" (Pharmacological Action) OR "Glucocorticoids"(Mesh) OR glucocorticoid*(tiab) OR glucocorticosteroid*(tiab) OR glucocortoid*(tiab) OR glycocorticoid*(tiab) OR glycocorticosteroid*(tiab) OR glucocorticoidsteroid*(tiab) OR predniso*(tiab) |
247,802 |
|
#1 |
Search: "Diphosphonates"(Mesh) OR biphosphonate*(tiab) OR bisphosphonate*(tiab) OR diphosphonate*(tiab) OR diphosphonic acid derivative*(tiab) OR bisphosphonic acid derivative*(tiab) OR alenato(tiab) OR alend(tiab) OR alendronate(tiab) OR alendronic acid(tiab) OR alendros(tiab) OR alovell(tiab) OR arendal(tiab) OR bifemelan(tiab) OR bifosa(tiab) OR binosto(tiab) OR bonapex(tiab) OR defixal(tiab) OR dronal(tiab) OR endronax(tiab) OR eucalen(tiab) OR fixopan(tiab) OR fosalan(tiab) OR fosamax(tiab) OR fosmin(tiab) OR fosval(tiab) OR marvil(tiab) OR maxibone(tiab) OR mk217(tiab) OR neobon(tiab) OR oncalst(tiab) OR onclast(tiab) OR osdron(tiab) OR osdronat(tiab) OR oseotenk(tiab) OR osficar(tiab) OR oslene(tiab) OR osteofar(tiab) OR osteofos(tiab) OR osteopor(tiab) OR osteosan(tiab) OR osteovan(tiab) OR osticalcin(tiab) OR porosal(tiab) OR teiroc(tiab) OR tibolene(tiab) OR voroste(tiab) OR mk0217(tiab) OR acrel(tiab) OR actonel(tiab) OR atelvia(tiab) OR benet(tiab) OR ne 58095(tiab) OR ne58095(tiab) OR optinate(tiab) OR ribastamin(tiab) OR risedronate(tiab) OR risedronic acid(tiab) OR bm 210955(tiab) OR bm210955(tiab) OR bondenza(tiab) OR bondronat(tiab) OR boniva(tiab) OR bonviva(tiab) OR destara(tiab) OR iasibon(tiab) OR ibandronate(tiab) OR ibandronic acid(tiab) OR r 484(tiab) OR r484(tiab) OR aclasta(tiab) OR cgp 42446(tiab) OR cgp 42446a(tiab) OR cgp42446(tiab) OR cgp42446a(tiab) OR orazol(tiab) OR reclast(tiab) OR “zol 446”(tiab) OR zol446(tiab) OR zoledronate(tiab) OR zoledronic acid(tiab) OR zomera(tiab) OR zometa(tiab) OR "Raloxifene Hydrochloride"(Mesh) OR "raloxifene diphosphate" (Supplementary Concept) OR bonmax(tiab) OR celvista(tiab) OR evista(tiab) OR keoxifene(tiab) OR loxar(tiab) OR loxifen(tiab) OR “ly 139481”(tiab) OR “ly 156758”(tiab) OR “ly139481”(tiab) OR ly156758(tiab) OR optruma(tiab) OR raloxifene(tiab) OR raxeto(tiab) OR "Parathyroid Hormone"(Mesh) OR bonsity(tiab) OR chs 13340(tiab) OR chs13340(tiab) OR forsteo(tiab) OR forteo(tiab) OR “ly 333334”(tiab) OR ly333334(tiab) OR movymia(tiab) OR parathar(tiab) OR “parathyroid hormone*”(tiab) OR “sun e3001”(tiab) OR sune3001(tiab) OR teriparatide(tiab) OR terrosa(tiab) OR parathormone(tiab) OR "Denosumab"(Mesh) OR “amg 162”(tiab) OR amg162(tiab) OR amgiva(tiab) OR denosumab(tiab) OR prolia(tiab) OR xgeva(tiab) OR "Estrogen Replacement Therapy"(Mesh) OR oestrogen(tiab) OR "Estrogens"(Mesh) OR "Estrogens" (Pharmacological Action) OR estrogen(tiab) OR "bazedoxifene" (Supplementary Concept) OR bazedoxifene(tiab) OR conbriza(tiab) OR “tse 424”(tiab) OR tse424(tiab) OR viviant(tiab) OR “way 140424”(tiab) OR way140424(tiab) OR "tibolone" (Supplementary Concept) OR boltin(tiab) OR livial(tiab) OR liviel(tiab) OR liviella(tiab) OR “org od”(tiab) OR tibocina(tiab) OR tibofem(tiab) OR tibolon(tiab) OR tibolone(tiab) OR xyvion(tiab) OR dequest(tiab) OR dequest 2010(tiab) OR diadronel(tiab) OR didrocal(tiab) OR didronal(tiab) OR didronat(tiab) OR didronate(tiab) OR didronel(tiab) OR difosfen(tiab) OR dinol(tiab) OR diphos(tiab) OR diphosphonate(tiab) OR “disodium ethane 1 hydroxyldiphosphonate”(tiab) OR “disodium ethanehydroxydiphosphonate”(tiab) OR “disodium etidronate”(tiab) OR dronate-os(tiab) OR “editronic acid”(tiab) OR ehdp(tiab) OR ethylenehydroxydiphosphonate(tiab) OR etibon(tiab) OR etidron(tiab) OR etidronate(tiab) OR “etidronic acid”(tiab) OR hedp(tiab) OR hydroxyethylenediphosphonate(tiab) OR osteotop(tiab) OR osteum(tiab) OR ostopor(tiab) OR turpinal(tiab) OR xidiphone(tiab) OR xydiphone(tiab) OR xydiphonum(tiab) OR pamidronate(tiab) OR pamidronic acid(tiab) OR residronate/exp OR residronate(tiab) OR zolendronate(tiab) OR "romosozumab" (Supplementary Concept) OR “amg 785”(tiab) OR amg785(tiab) OR “cdp 7851”(tiab) OR cdp7851(tiab) OR evenity(tiab) OR romosozumab(tiab) |
|
Embase
|
No. |
Query |
Results |
|
#13 |
#9 AND #12 |
51 |
|
#12 |
('meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
479290 |
|
#11 |
#6 NOT #10 |
316 |
|
#10 |
#5 AND #9 |
166 |
|
#9 |
#8 AND (2016-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
791 |
|
#8 |
#2 AND #7 |
15565 |
|
#7 |
'glucocorticoid'/exp/mj OR 'glucocorticoid':ti,ab,kw OR 'glucocorticosteroid':ti,ab,kw OR 'glucocortoid':ti,ab,kw OR 'glycocorticoid':ti,ab,kw OR 'glycocorticosteroid':ti,ab,kw OR 'glucocorticoidsteroid':ti,ab,kw OR predniso*:ti,ab,kw |
344953 |
|
#6 |
#4 AND #5 |
482 |
|
#5 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2353886 |
|
#4 |
#3 AND (2016-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3087 |
|
#3 |
#1 AND #2 |
36740 |
|
#2 |
'bisphosphonic acid derivative'/exp OR 'biphosphonate*':ti,ab,tn,dn,kw OR 'bisphosphonate*':ti,ab,tn,dn,kw OR 'diphosphonate*':ti,ab,tn,dn,kw OR 'diphosphonic acid derivative*':ti,ab,tn,dn,kw OR 'bisphosphonic acid derivative*':ti,ab,tn,dn,kw OR 'alendronic acid'/exp OR 'alenato':ti,ab,tn,dn,kw OR 'alend':ti,ab,tn,dn,kw OR 'alendronate':ti,ab,tn,dn,kw OR 'alendronic acid':ti,ab,tn,dn,kw OR 'alendros':ti,ab,tn,dn,kw OR 'alovell':ti,ab,tn,dn,kw OR 'arendal':ti,ab,tn,dn,kw OR 'bifemelan':ti,ab,tn,dn,kw OR 'bifosa':ti,ab,tn,dn,kw OR 'binosto':ti,ab,tn,dn,kw OR 'bonapex':ti,ab,tn,dn,kw OR 'defixal':ti,ab,tn,dn,kw OR 'dronal':ti,ab,tn,dn,kw OR 'endronax':ti,ab,tn,dn,kw OR 'eucalen':ti,ab,tn,dn,kw OR 'fixopan':ti,ab,tn,dn,kw OR 'fosalan':ti,ab,tn,dn,kw OR 'fosamax':ti,ab,tn,dn,kw OR 'fosmin':ti,ab,tn,dn,kw OR 'fosval':ti,ab,tn,dn,kw OR 'marvil':ti,ab,tn,dn,kw OR 'maxibone':ti,ab,tn,dn,kw OR 'mk217':ti,ab,tn,dn,kw OR 'neobon':ti,ab,tn,dn,kw OR 'oncalst':ti,ab,tn,dn,kw OR 'onclast':ti,ab,tn,dn,kw OR 'osdron':ti,ab,tn,dn,kw OR 'osdronat':ti,ab,tn,dn,kw OR 'oseotenk':ti,ab,tn,dn,kw OR 'osficar':ti,ab,tn,dn,kw OR 'oslene':ti,ab,tn,dn,kw OR 'osteofar':ti,ab,tn,dn,kw OR 'osteofos':ti,ab,tn,dn,kw OR 'osteopor':ti,ab,tn,dn,kw OR 'osteosan':ti,ab,tn,dn,kw OR 'osteovan':ti,ab,tn,dn,kw OR 'osticalcin':ti,ab,tn,dn,kw OR 'porosal':ti,ab,tn,dn,kw OR 'teiroc':ti,ab,tn,dn,kw OR 'tibolene':ti,ab,tn,dn,kw OR 'voroste':ti,ab,tn,dn,kw OR 'mk0217':ti,ab,tn,dn,kw OR 'risedronic acid'/exp OR 'acrel':ti,ab,kw OR 'actonel':ti,ab,kw OR 'atelvia':ti,ab,kw OR 'benet':ti,ab,kw OR 'ne 58095':ti,ab,kw OR 'ne58095':ti,ab,kw OR 'optinate':ti,ab,kw OR 'ribastamin':ti,ab,kw OR 'risedronate':ti,ab,kw OR 'risedronic acid':ti,ab,kw OR 'ibandronic acid'/exp OR 'bm 210955':ti,ab,kw OR 'bm210955':ti,ab,kw OR 'bondenza':ti,ab,kw OR 'bondronat':ti,ab,kw OR 'boniva':ti,ab,kw OR 'bonviva':ti,ab,kw OR 'destara':ti,ab,kw OR 'iasibon':ti,ab,kw OR 'ibandronate':ti,ab,kw OR 'ibandronic acid':ti,ab,kw OR 'r 484':ti,ab,kw OR 'r484':ti,ab,kw OR 'zoledronic acid'/exp OR 'aclasta':ti,ab,kw OR 'cgp 42446':ti,ab,kw OR 'cgp 42446a':ti,ab,kw OR 'cgp42446':ti,ab,kw OR 'cgp42446a':ti,ab,kw OR 'orazol':ti,ab,kw OR 'reclast':ti,ab,kw OR 'zol 446':ti,ab,kw OR 'zol446':ti,ab,kw OR 'zoledronate':ti,ab,kw OR 'zoledronic acid':ti,ab,kw OR 'zomera':ti,ab,kw OR 'zometa':ti,ab,kw OR 'parathyroid hormone(1-34)'/exp OR 'bonsity':ti,ab,kw OR 'chs 13340':ti,ab,kw OR 'chs13340':ti,ab,kw OR 'forsteo':ti,ab,kw OR 'forteo':ti,ab,kw OR 'ly 333334':ti,ab,kw OR 'ly333334':ti,ab,kw OR 'movymia':ti,ab,kw OR 'parathar':ti,ab,kw OR 'parathyroid hormone 1 34':ti,ab,kw OR 'pth (1-34)':ti,ab,kw OR 'sun e3001':ti,ab,kw OR 'sune3001':ti,ab,kw OR 'teriparatide':ti,ab,kw OR 'terrosa':ti,ab,kw OR 'parathormone 1 34':ti,ab,kw OR 'denosumab'/exp OR 'amg 162':ti,ab,kw OR 'amg162':ti,ab,kw OR 'amgiva':ti,ab,kw OR 'denosumab':ti,ab,kw OR 'prolia':ti,ab,kw OR 'xgeva':ti,ab,kw OR 'estrogen therapy'/exp OR oestrogen:ti,ab,kw OR 'estrogen'/exp OR estrogen:ti,ab,kw OR 'parathyroid hormone derivative'/exp OR 'parathormone analog':ti,ab,kw OR 'parathormone derivative':ti,ab,kw OR 'parathyroid hormone analog':ti,ab,kw OR 'parathyroid hormone derivative':ti,ab,kw OR 'pth derivative':ti,ab,kw OR 'bazedoxifene'/exp OR 'bazedoxifene':ti,ab,kw OR 'conbriza':ti,ab,kw OR 'tse 424':ti,ab,kw OR 'tse424':ti,ab,kw OR 'viviant':ti,ab,kw OR 'way 140424':ti,ab,kw OR 'way140424':ti,ab,kw OR 'tibolone'/exp OR 'boltin':ti,ab,kw OR 'livial':ti,ab,kw OR 'liviel':ti,ab,kw OR 'liviella':ti,ab,kw OR 'org od 14':ti,ab,kw OR 'org od14':ti,ab,kw OR 'tibocina':ti,ab,kw OR 'tibofem':ti,ab,kw OR 'tibolon':ti,ab,kw OR 'tibolone':ti,ab,kw OR 'xyvion':ti,ab,kw OR 'etidronic acid'/exp OR 'dequest':ti,ab,kw OR 'dequest 2010':ti,ab,kw OR 'diadronel':ti,ab,kw OR 'didrocal':ti,ab,kw OR 'didronal':ti,ab,kw OR 'didronat':ti,ab,kw OR 'didronate':ti,ab,kw OR 'didronel':ti,ab,kw OR 'difosfen':ti,ab,kw OR 'dinol':ti,ab,kw OR 'diphos':ti,ab,kw OR 'diphosphonate':ti,ab,kw OR 'disodium ethane 1 hydroxyldiphosphonate':ti,ab,kw OR 'disodium ethanehydroxydiphosphonate':ti,ab,kw OR 'disodium etidronate':ti,ab,kw OR 'dronate-os':ti,ab,kw OR 'editronic acid':ti,ab,kw OR 'ehdp':ti,ab,kw OR 'ethane hydroxy diphosphonate':ti,ab,kw OR 'ethanehydroxy diphosphonate':ti,ab,kw OR 'ethanehydroxydiphosphonate disodium':ti,ab,kw OR 'ethylenehydroxydiphosphonate':ti,ab,kw OR 'etibon':ti,ab,kw OR 'etidron':ti,ab,kw OR 'etidronate':ti,ab,kw OR 'etidronic acid':ti,ab,kw OR 'hedp':ti,ab,kw OR 'hydroxyethyl diphosphonate':ti,ab,kw OR 'hydroxyethylenediphosphonate':ti,ab,kw OR 'hydroxyethylenediphosphonate potassium':ti,ab,kw OR 'hydroxyethylenediphosphonic acid':ti,ab,kw OR 'hydroxyethylidenediphosphonic acid':ti,ab,kw OR 'osteotop':ti,ab,kw OR 'osteum':ti,ab,kw OR 'ostopor':ti,ab,kw OR 'sodium diphosphonate':ti,ab,kw OR 'turpinal':ti,ab,kw OR 'xidiphone':ti,ab,kw OR 'xydiphone':ti,ab,kw OR 'xydiphonum':ti,ab,kw OR pamidronate:ti,ab,kw OR 'pamidronic acid':ti,ab,kw OR 'residronate'/exp OR residronate:ti,ab,kw OR 'zolendronate'/exp OR zolendronate:ti,ab,kw OR 'raloxifene'/exp OR 'bonmax':ti,ab,kw OR 'celvista':ti,ab,kw OR 'evista':ti,ab,kw OR 'keoxifene':ti,ab,kw OR 'keoxifene hydrochloride':ti,ab,kw OR 'loxar':ti,ab,kw OR 'loxifen':ti,ab,kw OR 'ly 139481':ti,ab,kw OR 'ly 156758':ti,ab,kw OR 'ly139481':ti,ab,kw OR 'ly156758':ti,ab,kw OR 'optruma':ti,ab,kw OR 'raloxifene':ti,ab,kw OR 'raxeto':ti,ab,kw OR 'romosozumab'/exp OR 'amg 785':ti,ab,kw OR 'amg785':ti,ab,kw OR 'cdp 7851':ti,ab,kw OR 'cdp7851':ti,ab,kw OR 'evenity':ti,ab,kw OR 'romosozumab':ti,ab,kw OR 'sclerostin ab':ti,ab,kw |
486690 |
|
#1 |
'glucocorticoid'/exp OR 'glucocorticoid':ti,ab,kw OR 'glucocorticosteroid':ti,ab,kw OR 'glucocortoid':ti,ab,kw OR 'glycocorticoid':ti,ab,kw OR 'glycocorticosteroid':ti,ab,kw OR 'glucocorticoidsteroid':ti,ab,kw OR predniso*:ti,ab,kw |
768494 |
