Behandeling met vitamine K2 en magnesium
Uitgangsvraag
Wat is de plaats van vitamine K2 en magnesium bij patiënten met een verhoogd fractuurrisico?
Aanbeveling
Schrijf geen magnesium en vitamine K (1 en 2) supplementen voor aan patiënten met een verhoogd fractuurrisico om het risico op fracturen te verminderen.
Adviseer patiënten met een verhoogd fractuurrisico gezonde en gevarieerde voeding met voldoende zuivel, groente, noten en fruit.
- Indien dit niet haalbaar is, verwijs dan naar een diëtist voor passende aanvullingen.
Overwegingen
Magnesium
De literatuuranalyse liet zien dat er geen gerandomiseerde studies gedaan zijn naar het effect van magnesiumsuppletie op botmineraaldichtheid of fracturen bij mensen met een verhoogd fractuurrisico.
Na calcium en kalium is magnesium het meest voorkomende mineraal in het menselijke lichaam (Erem, Atfi, 2019). Het is essentieel voor heel veel cellulaire processen. Mg speelt een rol in de proliferatie en de overleving van een cel. Het heeft een functie bij zenuwactiviteit en spiercontracties. De serumconcentratie van magnesium wordt zeer nauw gereguleerd door gastro-intestinale absorptie, uitwisseling met bot en renale excretie en terugresorptie, waarbij het skelet de belangrijkste reservoirfunctie heeft. Bij zowel de absorptie als de activatie van vitamine D speelt magnesium vermoedelijk een rol.
Ook is magnesium mogelijk betrokken bij de mineralisatie van het skelet. Er zijn een aantal aanwijzingen waardoor het onderzoeken van de relatie tussen magnesium en fracturen rationeel is. Magnesium in de voeding was positief geassocieerd met ultrasound metingen van de hiel van jonge meisjes en suppletie gaf een toename van BMD van de heup in deze groep. Magnesium inname was ook geassocieerd met BMD in atletische zwemmers (Matias, Santos, 2012). Ook bij ouderen is er in een aantal studies een associatie gevonden tussen lage magnesium spiegels en lagere botmineraaldichtheid (Saito, Tabata, 2004; Song, Li, 2007). Dit vormt mogelijk de verklaring dat magnesiumsupplementen als heilzaam voor de botgezondheid worden aanbevolen en mensen vragen hebben omtrent de werkzaamheid ervan. In de Women Health Initiative studie werd echter een hogere incidentie van polsfracturen gezien bij de vrouwen in de hoogste quintiel van magnesium inname (Nieves 2013). In een systematische meta-analyse werd een kleine significante associatie gevonden met het BMD van de heup, maar geen significante associatie met de BMD van de wervels en geen significante associatie met fracturen (Farsinejad-Marj, Saneei, 2016).
Er is magnesium terug te vinden in het drinkwater en het mineraal is ruim aanwezig in groente, noten en fruit. Volgens de gezondheidsraad is een inname van 300mg (vrouwen) tot 350mg (mannen) per dag voldoende om natuurlijk verlies te compenseren (Gezondheidsraad, 2019). De maximale veilige suppletie is 250 mg per dag (EFSA, 2006).
Tabel 3 Risicofactoren voor een magnesiumdeficiëntie in de algemene bevolking
- Ondervoeding (o.a. alcoholisme).
- Nierinsufficiëntie met dieetbeperkingen.
- Malabsorptie.
- Langdurige diarree.
- Langdurig gebruik protonpompremmers
De gemiddeld magnesium inname in Nederland is voldoende. Het is echter niet helemaal duidelijk of de magnesiuminname bij iedereen wel voldoende is(RIVM) 2016). Bij een gezond voedingspatroon komen tekorten in de algemene bevolking echter nauwelijks voor, behalve bij risicofactoren zoals eerder vermeld in tabel 9.3 (Topf and Murray, 2003; Doornebal, 2009). Naast ongezonde voeding is er gepostuleerd dat het risico op magnesiumdeficiëntie is toegenomen doordat het magnesiumgehalte in groente en fruit door intensievere agricultuur gedaald is (Worthington, 2001).
Normale magnesiumspiegels sluiten een matige (meer intracellulaire) magnesiumdeficiëntie niet uit (Doornebal, 2009). Daar is een magnesium retentietest voor nodig (Cohen, 2000). Gezien het ontbreken van bewijs en het feit dat de kans op een magnesiumdeficiëntie bij een gezonde voeding erg onwaarschijnlijk is, lijkt het de werkgroep niet aangewezen om naast het advies om gezonde voeding te eten ook magnesium supplementen te adviseren aan mensen met een verhoogd fractuurrisico.
Vitamine K
Vitamine K is een vet oplosbaar vitamine (Palermo, Tuccinardi, 2017). Het is onder te verdelen in vitamine K1 (phylloquinone of phyronadione) en vitamine K2. Tevens bestaat er een synthetisch analoog Vitamine K3 (menadione) dat wateroplosbaar is en in de lever wordt omgezet naar vitamine K2. Vitamine K1 komt voor in veel plantaardige producten en natuurlijke oliën. Vitamine K2 (menaquinone) bestaat uit een groep stoffen van verschillende chemische samenstelling. De chemische formule van K2 is MK-n, de n kan variëren van 2 tot 14 en refereert aan het aantal isoprenoïde ketens. MK-4 is de dominante vorm van vitamine K in het lichaam en wordt gevonden in vis, lever, melk, groente en eieren. Zowel vitamine K1 als vitamine K3 worden in het menselijk lichaam omgezet naar MK-4. Vitamine K2 als MK 10 tot 13 worden door anaerobe bacteriën gemaakt en opgenomen. Vitamine K1 wordt in de lever opgeslagen. Andere organen (hersenen, pancreas, genitaliën) slaan MK-4 op. Supplementen kunnen zowel vitamine K1 als vitamine K2 bevatten. Dit staat aangegeven op het etiket.
Vitamine K heeft een rol in veel verschillende biologische processen. Het kreeg zijn naam als vitamine van belang voor de bloedstolling (coagulation betekent coagulatie in het Deens). Ook speelt het een rol bij het stimuleren van botformatie, het reguleren van bot mineralisatie en het onderdrukken van botafbraak (Akbari and Rasouli-Ghahroudi, 2018). In diverse studies zijn er associaties tussen vitamine K status en BMD en fracturen gevonden. Ook zijn er suppletiestudies met onder andere vitamine K. Dit is de aanleiding dat verschillende aanbieders van voedingssupplementen claimen dat vitamine K suppletie goed is voor het skelet.
In een meta-analyse van placebogecontroleerde studies werd geen toename van BMD of een afname in de kans op een wervelfractuur gezien in de interventiegroepen die vitamine K gesuppleerd werden. Met de kans op alle fracturen samen als eindmaat, werd een statistisch net significante daling van fracturen gezien met een breed betrouwbaarheidsinterval (0,74 (95%BI 0,56 tot 0,97) dat klinisch wel relevant zou kunnen zijn. In de analyse waarin alleen de studies met een lage kans op selectiebias werd meegenomen verloor het effect zijn statistische significantie 0,76 (95%BI 0,58 tot 1,01). Aangezien in de meta-analyse ook niet is voorgesorteerd op de aanwezigheid van vitamine K deficiëntie, is het mogelijk dat vitamine K gebrek een risicofactor voor fracturen is en dat sommige mensen baat zouden kunnen hebben van suppletie met vitamine K. Een evaluatie van fracturen bij mensen die wel of niet coumarine derivaten gebruiken zou hierbij mogelijk aanvullende informatie kunnen verstrekken.
Tabel 4 Risicofactoren voor een vitamine K deficiëntie (Johnson, 2020)
- Ondervoeding.
- Malabsorptie.
- Levercirrose.
- Langdurig antibioticagebruik.
- Gebruik van coumarinederivaten .
Volgens de RIVM is de vitamine K inname in Nederland gemiddeld adequaat en is het risico op vitamine K gebrek bij volwassenen laag (RIVM, 2016). Risicofactoren voor vitamine K gebrek staan in tabel 9.4. De klinische manifestatie van vitamine K gebrek is een toegenomen bloedingsneiging. Vitamine K gebrek kan ook worden vastgesteld met een bepaling van de serumconcentratie van vitamine K1. Deze meting is niet helemaal betrouwbaar omdat de andere vitamine K bestanddelen niet mee gemeten worden. De werking van coumarinederivaten, kan beïnvloed worden door vitamine K. Wanneer iemand deze medicatie gebruikt en daarnaast extra vitamine K binnenkrijgt (bijvoorbeeld door middel van suppletie) kan dit negatieve gevolgen hebben. Zowel vitamine K1 als vitamine K2 kunnen de werking van de antistollingsmiddelen beïnvloeden. Uit onderzoek bleek dat vitamine K1 in een dosering van minder dan 150 µg per dag geen invloed had op de antistolling. In de meeste multivitaminen of andere supplementen vinden we deze dosering niet. Vitamine K2 heeft daarentegen al invloed op de antistolling met een dosering van 10 µg of meer 2. Het advies is daarom om vitamine K2 niet te gebruiken bij het slikken van antistollingsmiddelen en suppletie van vitamine K te beperken tot vitamine K1. De maximale veilige suppletie van vitamine K bij mensen die geen coumarinederivaten gebruiken is niet bekend. Gezien de afwezigheid van een relatie met botmineraaldichtheid, de lage kwaliteit van de meta-analyse en de geringe kans op een vitamine K deficiëntie als men gezonde voeding gebruikt, lijkt het de werkgroep niet aangewezen om vitamine K supplementen op grote algemene schaal te adviseren, maar meer aandacht te hebben voor een gezonde voeding in het algemeen.
Onderbouwing
Achtergrond
In de praktijk worden er door patiënten vaak voedings- en suppletie gerelateerde vragen gesteld. Dit betreft, naast calcium en vitamine-D, vragen over het belang van vitamine K of magnesium in relatie tot de botsterkte en of men magnesium- of vitamine K supplementen moet innemen ter preventie van fracturen. Dat deze vragen in de bevolking spelen, werd ook door de patiëntenvereniging bevestigd. Dit vormde een aanleiding om een systematisch literatuuronderzoek in hoeverre magnesium- of vitamine K suppletie een verbetering geeft van BMD of een vermindering van het fractuurrisico geeft bij mensen met een verhoogd fractuurrisico.
Conclusies / Summary of Findings
Magnesium
|
- GRADE |
The fracture risk and change in bone mineral density (BMD) of treatment with magnesium in comparison with no treatment, placebo or calcium and vitamin D is unknown. None of the identified studies reported the outcome measures fracture prevalence or change in BMD. |
Vitamin K2
Clinical fracture
|
Low GRADE |
Treatment with vitamin K2 may result in a decrease in clinical fractures compared to placebo in patients with primary osteoporosis, osteopenia or high risk of fractures.
Sources: (Mott, 2020) |
Vertebral fracture
|
Low GRADE |
Treatment with vitamin K2 may result in little to no difference in vertebral fractures compared to placebo in patients with primary osteoporosis, osteopenia or high risk of fractures.
Sources: (Mott, 2020) |
Bone mineral density
|
Low GRADE |
Treatment with vitamin K2 may result in little to no difference in bone mineral density (BMD) compared to placebo in patients with primary osteoporosis, osteopenia or high risk of fractures.
Sources: (Mott, 2019; Yuanyang, 2019; Zhang, 2020; Rønn 2020) |
Samenvatting literatuur
Description of studies
Magnesium
No studies were identified that compared magnesium with no treatment, placebo or calcium and vitamin D in patients with primary osteoporosis, osteopenia or high risk of fractures.
Vitamin K2
Mott (1019, 2020) performed a systematic review and meta-analysis on the effects of oral vitamin K on bone mineral density and fractures in adults and updated it in 2020 by removing one study about which concerns were raised (Mott, Bradley, 2019; Mott, Bradley, 2020). Studies were eligible for inclusion if they fulfilled the following criteria: (1) adults (defined as over 18 years of age), (2) intervention: oral vitamin K supplement of any form or dosage administered for at least 6 months (min 25 weeks), (3) control: no treatment, treatment as usual, placebo, calcium, vitamin D, hormone replacement therapies, bisphosphonates, (4) Outcomes: any fracture outcome and/or BMD after 6 months, (5) Study design: randomized controlled trial. The following electronic databases were searched: MEDLINE, EMBASE, Cochrane Central Register of Controlled Trials, CINAHL, clinicaltrials.gov, WHO-ICTRP up till the 22nd of January 2018. A total of 36 studies were included and had a total of 11,112 participant with follow-up ranging from 6 to 48 months. Twenty-four of the trials included postmenopausal women with or without osteoporosis, three included patients with cirrhosis, two included patients with chronic glomerular nephritis, and of the remaining trials, two were in healthy populations and five were in patient populations. Meta-analyses were undertaken for both total clinical fractures and vertebral fractures for all trials including osteoporotic or postmenopausal women.
Yuanyuang (2019) performed a randomized trial to investigate the influence of vitamin K2 on bone mineral density, bone metabolism and serum tissue protease K (cathepsin K) in female patients with osteoporosis. Osteoporotic patients (210 cases) who visited the Affiliated hospital of Nanjing University of Chinese Medicine from January 2017 to January 2018, and who satisfied the inclusion requirements were used as study subjects. (Yuanyang, Runlin, 2019). The inclusion criteria were reduction of dual-energy X-ray bone density equal or higher than 2.5 standard difference. In addition, the subjects were excluded when they met the following exclusion criteria: (1) Patients with osteomalacia, calcium and vitamin D deficiency and renal tubular acidosis;(2) patients with primary and secondary hyperthyroidism; (3) patients with bone metastasis of malignant tumor; (4) multiple myeloma patients; (5) patients who had spinal hemangioma; (6) patients with suppurative myelitis; (7) patients with motor disease, chronic medical diseases and endocrine diseases caused by secondary osteoporosis, and (8) patients on estrogen, heparin, corticosteroids, bisphosphonates and other drugs related to osteoporosis. A total of 210 cases were randomly assigned to vitamin K2 group, strontium renate group and blank control group. The selected patients were 50 to 80 years old, with a mean age of 64.07 ± 9.63 years. All 210 patients completed follow-up after 6 months of drug treatment.
Zhang (2020) performed a randomized controlled trial to assess the effects of VK2 supplementation on bone health in two doses in a monotherapy way, and simultaneously compared with in combination with calcium and vitamin D3 in middle-aged and elderly population in China. (Zhang, Liu et al. 2020) The primary outcome was BMD at the lumbar spine (L1–L4), femoral neck and total hip. Healthy community-dwelling men and postmenopausal women aged 50 and 75 years were recruited in November 2018 from the Harbin Cohort Study on Diet, Nutrition and Chronic Non-communicable Diseases (HDNNCDS). Inclusion criteria were T-scores of the lumbar spine (L1–L4) and (or) hip lower than − 1.0, body mass index (BMI) between 18 and 30 kg/m2 . They were excluded if they had taken vitamin D, calcium, vitamin K, calcitonin, diphosphonate for osteoporosis in the past 6 months; vitamin K antagonists within the 1 year, such as warfarin; estrogen or other hormone therapy in past 1 years; history of chronic diseases of kidney, liver, lung, or pancreas; hyperthyroidism, hyperparathyroidism, osteomalacia; history of malignant tumors. A total of 295 participants completed the study and were divided into four groups. The VK2-1 group, and VK2-2 group received vitamin K2 (MK-7) 50 µg/day and 90 µg/day, respectively. The VK2DCa group received vitamin K2 (MK-7) 90 µg/day in combination with calcium 500 µg/day and vitamin D3 10 µg/day. The placebo group was set as a control group receiving placebo. The average age was 59.78±6.60 years, and BMI of subjects was 24.08±3.27 kg/m2. T-scores of the lumbar spine and total hip were - 1.62±1.3 and − 1.06±0.96, respectively. In this study, women constituted 64.73% of all subjects, mean menopausal age was 50.32±3.84 years, and mean years since menopausal of female subjects was 10.19±6.26 years.
Rønn (2020) conducted a randomized placebo-controlled, double-blinded clinical trial of MK-7 or placebo daily for 3 years in postmenopausal women with osteopenia (Ronn, Harslof et al. 2021). The primary outcome was BMD change in total hip, femoral neck and spine. Inclusion criteria were postmenopausal status defined as at least 2 years past the last menstrual period, age between 60 and 80 years, and osteopenia (T-score of hip or lumbar spine ≤ −1, but > −2.5). Exclusion criteria were smoking, diseases, or use of medication which affect bone metabolism, intake of vitamin K supplements or vitamin K antagonists, or vitamin D insufficiency (s-25-OH vitamin D <50nmol/L). One hundred and forty-eight women were included, and 119 completed the trial (MK-7: 62, placebo: 57). The participants had a mean age of 67.3 ± 4.4 years; there were no differences between the two groups in age, years since menopause, baseline BMD, or vitamin D status; however, there were small but significant differences in the bone turnover markers CTX and P1NP, suggesting a slightly higher bone turnover in the placebo group at baseline.
Results
Magnesium
No studies were identified that compared magnesium with no treatment, placebo or calcium and vitamin D in patients with primary osteoporosis, osteopenia or high risk of fractures.
Vitamin K2
1. Fractures
Mott (2019, 2020) reported that the odds of any clinical fracture were lower for vitamin K compared to controls to 0.74 (95%CI 0.56 to 0.97). Restricting the analysis to low risk of bias trials reduced the OR to 0.76 (95%CI, 0.58 to 1.01). There was no difference in vertebral fractures between the groups (OR 0.96, 95%CI 0.83 to 1.11).
Figure 1 Meta-analysis of Peto odds ratio of any clinical fracture outcomes for trials including osteoporotic or postmenopausal participants
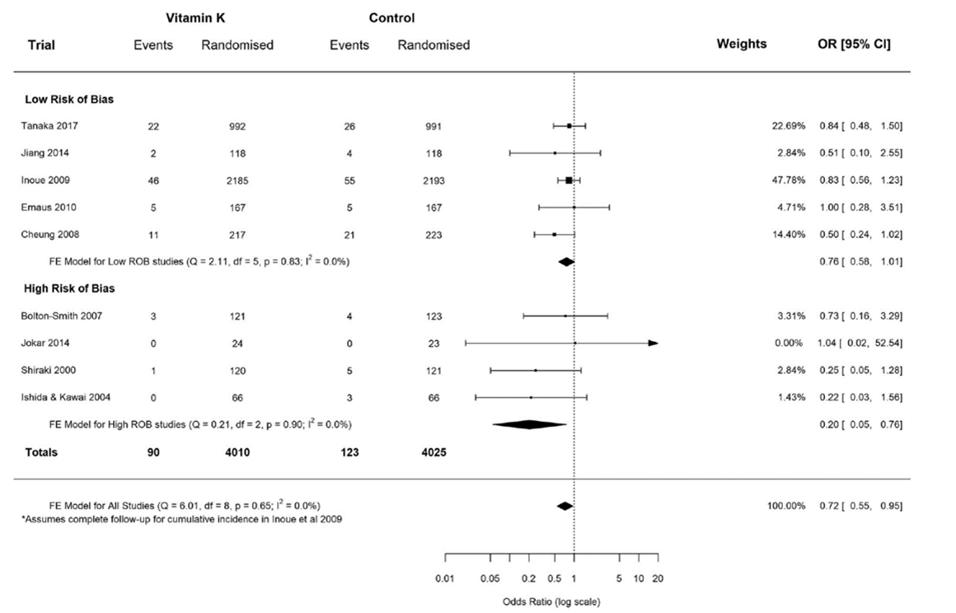
Figure 2 Meta-analysis of Peto odds ration of any vertebral fracture outcomes for trials including osteoporotic or postmenopausal participants
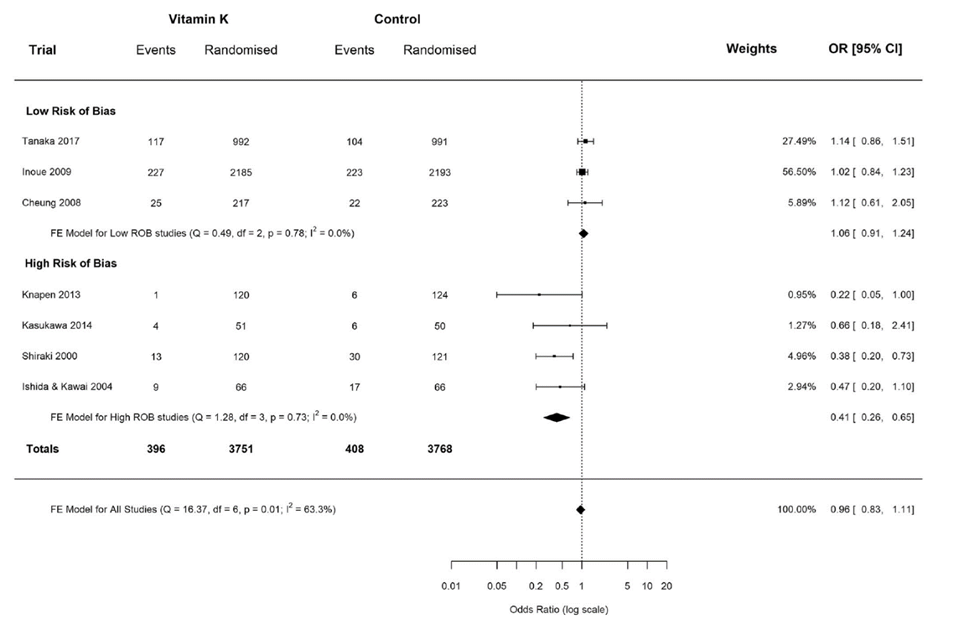
2. BMD
Mott (2020) reported for BMD of the radius at 12 months and mean difference of 0.58 (95% CI -1.24 to 0.08). The difference was not clinically relevant.
In addition, a mean difference of 0.00 (95% CI -0.85 to 0.85) was reported for the BMD of the radius at 24 months. The difference was not clinically relevant.
Yuanyang (2019) reported a mean difference of 0.11 g/cm2 (95% CI 0.07 to 0.15) in lumbar vertebrae BMD in favor of the vitamin K2 group. For femoral neck BMD a mean difference of 0.10 g/cm2 (95% CI 0.07 to 0.13) in favor of the vitamin K2 group was reported. For greater trochanter BMD a mean difference of 0.11 g/cm2 (95% CI 0.07 to 0.15) in favor of the vitamin K2 group was reported. Lastly, for total BMD a mean difference of 0.09 g/cm2 (95% CI 0.05 to 0.13) in favor of the vitamin K2 group was reported.
Zhang (2020) reported a mean change in lumbar spine BMD of -0.003 g/cm2 (95% CI -0.011 to 0.004), -0.004 g/cm2 (95% CI -0.014 to 0.005), 0.002 g/cm2 (95% CI -0.005 to 0.009) and -0.006 g/cm2 (95% CI -0.017 to 0.004) in the VK2-1 group, VK2-2 group, VK2DCa group and control group, respectively.
In addition, a mean change in femoral neck BMD of -0.007 g/cm2 (95% CI -0.018 to 0.003), -0.003 g/cm2 (95% CI -0.018 to 0.011), -0.003 g/cm2 (95% CI -0.012 to 0.005) and -0.015 g/cm2 (95% CI -0.031 to 0.001) was reported in the VK2-1 group, VK2-2 group, VK2DCa group and control group, respectively.
Furthermore, a mean change in total hip BMD of -0.006 g/cm2 (95% CI -0.017 to 0.005), -0.001 g/cm2 (95% CI -0.01 to 0.007), -0.002 g/cm2 (95% CI -0.013 to 0.008) and -0.006 g/cm2 (95% CI -0.02 to 0.007) was reported in the VK2-1 group, VK2-2 group, VK2DCa group and control group, respectively.
Rønn (2020) reported an absolute change in total hip BMD of -0.012 g/cm2 (SD: 0.020) for the MK7 group and -0.018 g/cm2 (SD: 0.021) for the placebo group. For femoral neck an absolute change was reported of - 0.010 g/cm2 (SD: 0.023) and -0.008 g/cm2 (SD: 0.033) for the MK7 and placebo group, respectively. Lastly, for spine BMD an absolute change was reported of - 0.016 g/cm2 (SD: 0.034) and - 0.009 g/cm2 (SD: 0.027) for the MK7 and placebo group, respectively. The difference between the groups is minimum.
Level of evidence of the literature
Magnesium
The level of evidence could not be assessed because no studies were identified that compared magnesium with no treatment, placebo or calcium and vitamin D in patients with primary osteoporosis, osteopenia or high risk of fractures.
Vitamin K2
The level of evidence regarding the outcome measure “fractures” comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels because of study limitations (risk of bias) and imprecision. Resulting in a level of evidence of low.
The level of evidence regarding the outcome measure “BMD” comes from randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels because of study limitations (risk of bias) and overlapping of the confidence interval with the limits of clinical decision making (imprecision). Resulting in a level of evidence of low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of nutritional interventions (vitamin K2 or magnesium) on fractures in patients with an increased fracture risk?
P: patients with primary osteoporosis or osteopenia or high risk of fractures;
I: vitamin K2 or magnesium;
C: no treatment, placebo, treatment with only calcium and vitamin D;
O: fracture prevalence (hip, non-vertebral and vertebral fractures), bone mineral density (BMD).
Relevant outcome measures
The guideline development group considered both fractures and BMD as a critical outcome measure for decision making; A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group used the GRADE standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes and 10% for continuous variables.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October 29th, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in a total of 132 hits for systematic reviews and 35 hits for randomized trials, of which 29 hits for magnesium. Studies were selected based on the following criteria: systematic reviews including randomized controlled trials or randomized controlled trials investigating the use of vitamin K2 or magnesium in patients with primary osteoporosis, osteopenia or with high risk of fractures. 21 studies were initially selected based on title and abstract screening. After reading the full text, 17 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 4 studies were included.
Results
Four studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Akbari, S. and A. A. Rasouli-Ghahroudi (2018). "Vitamin K and Bone Metabolism: A Review of the Latest Evidence in Preclinical Studies." Biomed Res Int 2018: 4629383.
- Doornebal J, B. R., Brouwer RM (2009). "Een onbekende maar potentieel ernstige bijwerking van protonpompremmers: hypomagnesiëmie." NTvG 153.
- EFSA (2006). " Tolerable Upper Intake Levels for Vitamins and Minerals - Scientific Committee on Food/Scientific Panel on Dietetic Products, Nutrition, Allergies, 2006,
- Erem, S., A. Atfi and M. S. Razzaque (2019). "Anabolic effects of vitamin D and magnesium in aging bone." J Steroid Biochem Mol Biol 193: 105400.
- Farsinejad-Marj, M., P. Saneei and A. Esmaillzadeh (2016). "Dietary magnesium intake, bone mineral density and risk of fracture: a systematic review and meta-analysis." Osteoporos Int 27(4): 1389-1399.
- Johnson, L. E. (2020, november). Vitamin K Deficiency. MSD Manual Professional Version. https://www.msdmanuals.com/professional/nutritional-disorders/vitamin-deficiency-dependency-and-toxicity/vitamin-k-deficiency
https://www.wateetnederland.nl/resultaten/vitamines-en-mineralen/inname/magnesium).
- Matias, C. N., D. A. Santos, C. P. Monteiro, A. M. Vasco, F. Baptista, L. B. Sardinha, M. J. Laires and A. M. Silva (2012). "Magnesium intake mediates the association between bone mineral density and lean soft tissue in elite swimmers." Magnes Res 25(3): 120-125.
- Mott, A., Bradley, T., Wright, K., Cockayne, E. S., Shearer, M. J., Adamson, J., ... & Torgerson, D. J. (2019). Effect of vitamin K on bone mineral density and fractures in adults: an updated systematic review and meta-analysis of randomised controlled trials. Osteoporosis International, 1-17.
- Mott, A., Bradley, T., Wright, K., Cockayne, E. S., Shearer, M. J., Adamson, J., ... & Torgerson, D. J. (2020). Correction to Effect of vitamin K on bone mineral density and fractures in adults: an updated systematic review and meta-analysis of randomised controlled trials. Osteoporosis International: a Journal Established as Result of Cooperation Between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA.
- Nieves, J. W. (2013). "Skeletal effects of nutrients and nutraceuticals, beyond calcium and vitamin D." Osteoporos Int 24(3): 771-786.
- Palermo, A., D. Tuccinardi, L. D'Onofrio, M. Watanabe, D. Maggi, A. R. Maurizi, V. Greto, R. Buzzetti, N. Napoli, P. Pozzilli and S. Manfrini (2017). "Vitamin K and osteoporosis: Myth or reality?" Metabolism 70: 57-71.
- (RIVM), R. v. V. (2016). "Inname van Nutrienten door de Nederlandse Bevolking. Resultaten van VCP 2007020010 samen met NEVO-2013."
- Rønn, S. H., Harsløf, T., Oei, L., Pedersen, S. B., & Langdahl, B. L. (2020). The effect of vitamin MK-7 on bone mineral density and microarchitecture in postmenopausal women with osteopenia, a 3-year randomized, placebo-controlled clinical trial. Osteoporosis International, 1-7
- Saito, N., N. Tabata, S. Saito, Y. Andou, Y. Onaga, A. Iwamitsu, M. Sakamoto, T. Hori, H. Sayama and T. Kawakita (2004). "Bone mineral density, serum albumin and serum magnesium." J Am Coll Nutr 23(6): 701S-703S.
- Song, Y., T. Y. Li, R. M. van Dam, J. E. Manson and F. B. Hu (2007). "Magnesium intake and plasma concentrations of markers of systemic inflammation and endothelial dysfunction in women." Am J Clin Nutr 85(4): 1068-1074.
- Topf, J. M. and P. T. Murray (2003). "Hypomagnesemia and hypermagnesemia." Rev Endocr Metab Disord 4(2): 195-206.
- Worthington, V. (2001). "Nutritional quality of organic versus conventional fruits, vegetables, and grains." J Altern Complement Med 7(2): 161-173.
- Yuanyang, G., Runlin, X., Bo, X., Donghua, F., & Jun, M. (2019). Effect of vitamin K2 on bone mineral density and serum cathepsin K in female osteoporosis patients. Tropical journal of pharmaceutical research, 18(1), 181-185.
- Zhang, Y., Liu, Z., Duan, L., Ji, Y., Yang, S., Zhang, Y., ... & Li, Y. (2020). Effect of Low-Dose Vitamin K2 Supplementation on Bone Mineral Density in Middle-Aged and Elderly Chinese: A Randomized Controlled Study. Calcified Tissue International, 1-10.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Mott, 2019
(individual study characteristics deduced from Mott, 2019)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs Literature search up to January/2018
A: Binkley 2009 B: Bolton-Smith 2007 C: Booth et al. 2008 D: Braam 2003 (a) E: Braam 2003 (b) F: Cheung et al. 2008 G: Emaus et al. 2010 H: Forli et al. 2010 I: Gleeson 2004 J: Hampson (ongoing) K: Hirao et al. 2008 L: Holden et al. (ongoing) M: Hozuki et al. 2010 N: Inoue et al. 2009 O: Inoue et al. 2014 P: Ishida and Kawai 2004 Q: Iwamoto et al. 1999 R: Je et al. 2011 S: Jiang et al. 2014 T: Jokar et al. 2016 U: Kanellakis/Moschonis et al. 2011/12 V: Kasukawa et al. 2014 W: Knapen et al. 2013 X: Knapen et al. 2007 Y: Koitaya et al. 2014 Z: Nishiguchi 2001 AA: O’Connor et al. 2014 AB: Purswosunu et al. 2006 AC: Ronn et al. 2016 AD: Sasaki 2005 AE: Shiomi 2005 AF: Shiraki 2000 AG: Shiraki and Itabashi 2009 AH: Somekawa 1999 AI: Tanaka et al. 2017 AJ: Ushiroyama 2001 AK: Volpe et al. 2008 AL: Yuko 2014
Study design: RCT
Setting and Country: Multicentre, America, UK, The Netherlands, Canada, Norway, Japan, Korea, China, Iran, Greece, Ireland, Indonesia, Denmark
Source of funding and conflicts of interest: There was no funding for this systematic review. No conflicts of interest were reported |
Inclusion criteria SR: (1) Population: adults (defined as over 18 years of age) (2) Intervention: oral vitamin K supplement of any form or dosage administered for at least 6 months (min 25 weeks) (3) Control: no treatment, treatment as usual, placebo, calcium, vitamin D, hormone replacement therapies, bisphosphonates (4) Outcomes: any fracture outcome and/or BMD after 6 months (5) Study design: randomised controlled trial
Exclusion criteria SR: Studies that have been questioned with respect to their scientific integrity were excluded.
38 studies included
Important patient characteristics at baseline: See table 1 of article
Groups comparable at baseline? Yes |
Describe intervention: See table 1 of article
|
Describe control: See table 1 of article
|
End-point of follow-up: See table 1 of article
For how many participants were no complete outcome data available? Not reported
|
1. Total Clinical Fractures, Overall odds ratio (OR): 0.74 (95% CI 0.56 to 0.97)
2. Total Vertebral Fractures, OR 0.98 (95% CI 0.85 – 1.14)
3. Bone mineral density (BMD) of the radius at 12 months, mean difference: 0.58 (95% CI -1.24 to 0.08)
4. BMD of the radius at 24 months, mean difference: 0.00 (95% CI -0.85 to 0.85)
|
Authors conclusion: For post-menopausal or osteoporotic patients, there is no evidence that vitamin K affects bone mineral density or vertebral fractures; it may reduce clinical fractures; however, the evidence is insufficient to confirm this. There are too few trials to draw conclusions for other patient groups. |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Rønn, 2020 |
Type of study: Randomized controlled trial
Setting and country: single centre, Denmark
Funding and conflicts of interest: This work received financial supported from Orkla Health, which also supplied vitamin MK-7, placebo tablets, calcium, and vitamin D. The study was supported by Aase and Ejnar Danielsens Foundation, the Danish Osteoporosis Society, the Family Hede Nielsens Foundation, the Department of Endocrinology at Aarhus University Hospital Research Foundation, and the Central Denmark Region Research Foundation. |
Inclusion criteria: postmenopausal status defined as at least 2 years past the last menstrual period, age between 60 and 80 years, and osteopenia (T-score of hip or lumbar spine ≤−1, but >−2.5).
Exclusion criteria: smoking, diseases, or use of medication which affect bone metabolism, intake of vitamin K supplements or vitamin K antagonists, or vitamin D insufficiency (s-25-OH vitamin D <50nmol/L).
N total at baseline: I: 75 C: 73
Important prognostic factors2: Age (years) ± SD: I: 67.4 ± 4.4 C: 67.1 ± 4.4
BMD hip (g/cm2) ± SD: I: 0.784 ± 0.074 C: 0.781 ± 0.067
BMD femoral neck (g/cm2) ± SD: I: 0.660 ± 0.080 C: 0.655 ± 0.069
BMD spine (g/cm2) ± SD: I: 0.872 ± 0.059 C: 1.280 ± 0.073
Groups comparable at baseline? Yes |
Describe intervention:
375 μg MK-7 daily. All received supplementation with calcium (800 mg) and vitamin D (38 μg) daily. |
Describe control:
Placebo. All received supplementation with calcium (800 mg) and vitamin D (38 μg) daily. |
Length of follow-up: 3 years
Loss-to-follow-up: I: 13 (17.3%) Reasons: Discontinued intervention due to own choice:2 Declined to participate: 7 Discontinued intervention due to disease: 4
C: 16 (21.9%) Reasons: Discontinued intervention due to own choice:2 Declined to participate: 10 Discontinued intervention due to disease: 4
Incomplete outcome data: I: N=2 for hip BMD N=1 for spine BMD N=5 for HRpQCT radius
C: N=2 for HRpQCT radius |
Outcome measures and effect size (include 95%CI and p-value if available):
1. Change in total hip BMD (g/cm2) ± SD: I: − 0.012 ± 0.020 C: − 0.018 ± 0.021
2. Change in femoral neck BMD (g/cm2) ± SD: I: − 0.010 ± 0.023 C: − 0.008 ± 0.033
3. Change in spine BMD (g/cm2) ± SD: I: − 0.016 ± 0.034 C: − 0.009 ± 0.027
|
Authors conclusion: Treatment with MK-7 375 μg daily as an add-on to calcium and vitamin D increased carboxylation of osteocalcin. However, treatment of postmenopausal women with osteopenia for 3 years did not affect biochemical markers of bone turnover, bone mineral density, or bone microarchitecture. |
|
Zhang, 2020 |
Type of study: Randomized controlled trial
Setting and country: single centre, China
Funding and conflicts of interest: This study was funded by the Applied Technology Research and Development Plan of Heilongjiang Province (GA18C005).
No conflicts of interest. |
Inclusion criteria: T-scores of the lumbar spine (L1–L4) and (or) hip lower than − 1.0, body mass index (BMI) between 18 and 30 kg/m2.
Exclusion criteria: if they had taken vitamin D, calcium, vitamin K, calcitonin, diphosphonate for osteoporosis in the past 6 months; vitamin K antagonists within the 1 year, such as warfarin; estrogen or other hormone therapy in past 1 years; history of chronic diseases of kidney, liver, lung, or pancreas; hyperthyroidism, hyperparathyroidism, osteomalacia; history of malignant tumors.
N total at baseline: VK2-1: 84 VK2-2: 78 VK2DCa: 84 Control: 65
Important prognostic factors2: Age ± SD: VK2-1: 58.96±6.04 VK2-2: 60.83±5.65 VK2DCa: 60.48±6.69 Control: 59.70±6.84
Female (male) (%): VK2-1: 65.8 (34.2) VK2-2: 64.9 (35.1) VK2DCa: 65.9 (34.1) Control: 62.3 (37.7)
Groups comparable at baseline? Yes
|
Describe intervention:
VK2-1 group: vitamin K2 (MK-7) 50 µg/day VK2-2 group : vitamin K2 (MK-7) 90 µg/day VK2DCa group: vitamin K2 (MK-7) 90 µg/day in combination with calcium 500 µg/day and vitamin D3 10 µg/day.
|
Describe control:
Placebo
|
Length of follow-up: 12 months
Loss-to-follow-up: K2-1: 3 (3.6%) Reason not reported
VK2-2: 2 (2.6%) Reason not reported
VK2DCa: 2 (2.4%) Reason not reported
Control: 1 (1.5%) Reason not reported
Incomplete outcome data: VK2-1: 5 (6%) Reasons: Lost to follow-up (n=3) Violated study protocol (n=2)
VK2-2: 4 (5.1%) Reasons: Lost to follow-up (n=2) Violated study protocol (n=2)
VK2DCa: 3 (3.6%) Reasons: Lost to follow-up (n=2) Violated study protocol (n=1)
Control: 4 (6.2%) Reasons: Lost to follow-up (n=1) Violated study protocol (n=3)
|
Outcome measures and effect size (include 95%CI and p-value if available):
1.Change in lumbar spine BMD (g/cm2), mean (95% CI): VK2-1: −0.003 (−0.011, 0.004) VK2-2: −0.004 (−0.014, 0.005) VK2DCa: 0.002 (−0.005, 0.009) Control: −0.006 (−0.017, 0.004)
2. Change in femoral neck BMD (g/cm2), mean (95% CI): VK2-1: −0.007 (−0.018, 0.003) VK2-2: −0.003 (−0.018, 0.011) VK2DCa: −0.003 (−0.012, 0.005) Control: −0.015 (−0.031, 0.001)
3. Change I total hip BMD (g/cm2), mean (95% CI): VK2-1: −0.006 (−0.017, 0.005) VK2-2: −0.001 (−0.01, 0.007) VK2DCa: −0.002 (−0.013, 0.008) Control: −0.006 (−0.02, 0.007) |
Authors conclusion: At the endpoint, the bone loss of femoral neck was signifcantly lower in postmenopausal women in the two 90 µg groups (treatment×time, p=0.006) compared with placebo, but no efects in men. Serum biomarkers cOC/ucOC ratio increased in the intervention groups (treatment×time, p<0.001). VK2 supplementation in dose of 90 µg/day performed a signifcant efect on reducing bone loss in postmenopausal women, but in combination with calcium and vitamin D3 brought no additional efects. |
|
Yuanyang, 2019 |
Type of study: Randomized controlled trial
Setting and country: single centre, China
Funding and conflicts of interest: Funding not reported
No conflict of interest associated with this work. |
Inclusion criteria: The recommended diagnostic criterion for OP was reduction of dual-energy X-ray bone density equal or higher than 2.5 standard difference
Exclusion criteria: (1) Patients with osteomalacia, calcium and vitamin D deficiency and renal tubular acidosis; (2) patients with primary and secondary hyperthyroidism; (3) patients with bone metastasis of malignant tumor; (4) multiple myeloma patients; (5) patients who had spinal hemangioma; (6) patients with suppurative myelitis; (7) patients with motor disease, chronic medical diseases and endocrine diseases caused by secondary osteoporosis, and (8) patients on estrogen, heparin, corticosteroids, bisphosphonates and other drugs related to osteoporosis.
N total at baseline: Intervention, VitK2: 70 Intervention, strontium: 70 Control: 70
Important prognostic factors2 (not specified per group): age ± SD: 64.07 ± 9.63
Mean age at menopause ± SD: 48.69 ± 7.39
Groups comparable at baseline? unknown
|
Describe intervention (treatment/procedure/test):
The vitamin K2 group was given Gulikang capsule (Fuji Capsule Co., Ltd. Shibakawa Plant) treatment 3 times a day (15mg each time) and one piece of calcium carbonate D3 chewable tablet
Patients in the strontium ranelate group were orally administered 2 g of strontium ranelate (France Servier), daily.
|
Describe control (treatment/procedure/test):
One piece of calcium carbonate D3 chewable tablet
|
Length of follow-up: 6 months
Loss-to-follow-up: None
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. BMD Lumbar vertebrae, before treatment, mean ± SD: VK2: 0.74 ± 0.07 Strontium: 0.77 ± 0.08 Control: 0.78 ± 0.07
2. BMD Lumbar vertebrae, after treatment, mean ± SD: VK2: 0.87 ± 0.12 Strontium: 0.91 ± 0.10 Control: 0.76 ± 0.09
3. BMD femoral neck, before treatment, mean ± SD: VK2: 0.72 ± 0.09 Strontium: 0.70 ± 0.10 Control: 0.72 ± 0.08
4. BMD femoral neck, after treatment, mean ± SD: VK2: 0.79 ± 0.10 Strontium: 0.84 ± 0.12 Control: 0.69 ± 0.09 5. BMD greater trochanter before treatment, mean ± SD: VK2: 0.54 ± 0.10 Strontium: 0.56 ± 0.12 Control: 0.54 ± 0.12
6. BMD greater trochanter, after treatment, mean ± SD: VK2: 0.63 ± 0.11 Strontium: 0.65 ± 0.13 Control: 0.52 ± 0.13
7. BMD total hip, before treatment, mean ± SD: VK2: 0.77 ± 0.15 Strontium: 0.75 ± 0.13 Control: 0.78 ± 0.13
8. BMD total hip, after treatment, mean ± SD: VK2: 0.81 ± 0.13 Strontium: 0.84 ± 0.15 Control: 0.72 ± 0.12 |
Authors conclusion: Appropriate vitamin K2 treatment improves BMD in the hip and waist of women with osteoporosis by promoting osteogenic activity, and by reducing osteoclast activity and cathepsin K expression. |
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mott, 2019 |
Yes |
Yes |
No |
Yes |
Not applicable |
Yes |
Yes |
Yes |
No |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Yuanyang, 2019 |
Not described |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Zhang, 2020 |
Block randomization with software-generated random numbers |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Rønn, 2020 |
Randomization was performed by the hospital pharmacy in blocks of 10 participants (five in each group). |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Farsinejad-Marj, 2016 |
Wrong study population |
|
Huang, 2015 |
Studies were also included in the systematic review by Mott (2019) |
|
Fang, 2012 |
Studies were also included in the systematic review by Mott (2019) |
|
Su, 2019 |
Studies were also included in the systematic review by Mott (2019) |
|
Iwamoto, 2009 |
Studies were also included in the systematic review by Mott (2019) |
|
Iwamoto, 2013 |
Article was withdrawn |
|
Cockayne, 2006, |
Studies were also included in the systematic review by Mott (2019) |
|
Aydin, 2010 |
Did not match the defined PICO |
|
Braam, 2003 |
Did not match the defined PICO |
|
Cheng, 2019 |
Article did not describe a randomized controlled trial |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-09-2022
Beoordeeld op geldigheid : 08-08-2022
Geldigheid en Onderhoud
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling van vitamine K2 en magnesium |
NIV |
2021 |
3 |
Jaarlijks |
NIV |
|
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Verenso heeft een verklaring van geen bezwaar afgegeven.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werk- en klankbordgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met osteoporose en een verhoogd fractuurrisico.
Werkgroep
- Prof. dr. J.P.W. van den Bergh, internist-endocrinoloog, VieCuri Medisch Centrum, Venlo & Maastricht Universitair Medisch Centrum, Maastricht (voorzitter), NIV
- Dr. N.M. Appelman-Dijkstra, internist-endocrinoloog, Leids Universitair Medisch Centrum, Leiden, NIV
- Prof. dr. M.C. Zillikens, internist-endocrinoloog, Erasmus Medisch Centrum, Rotterdam, NIV
- Prof. dr. W.F. Lems, reumatoloog, Amsterdam Universitair Medisch Centrum en Reade, Amsterdam, NVR
- Prof. dr. P.P.M.M. Geusens, reumatoloog, Maastricht Universitair Medisch Centrum, Maastricht, NVR
- Dr. H.C. Willems, klinisch geriater, Amsterdam Universitair Medisch Centrum, Amsterdam, NVKG
- Dr. G. de Klerk, traumachirurg, Admiraal de Ruyter Ziekenhuis, Goes, NVvT
- Dr. P.J.M. Elders, professor in de huisartsengeneeskunde, Huisartsenpraktijk De Grote Rivieren, Amsterdam, NHG
- Dr. L.W.F. Maartens, huisarts, Huisartsencentrum Parklaan-Maartens, Eindhoven, NHG
- Dr. T. Wiersma, huisarts en senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht, NHG
- Drs. M.M. van Oostwaard, verpleegkundig specialist, VieCuri Medisch Centrum, Venlo, V&VN
- H.J.G. van den Broek, patiëntvertegenwoordiger Osteoporose Vereniging, Den Haag, Osteoporose Vereniging
Klankbordgroep:
- Dr. H.G. Raterman, reumatoloog, Noordwest Ziekenhuisgroep, Den Helder, NVR
- Prof. dr. F. de Vries, professor in de klinische farmacie en epidemiologie, Maastricht Universitair Medisch Centrum, Maastricht, NVZA
- Drs. M. van der Steen, openbaar apotheker, Apotheek Veldhuizen, Ede, KNMP
- Dr. P. van den Berg, verpleegkundig specialist fracturen en osteoporose, Reinier de Graaf, Delft, V&VN
- Dr. E. Smulders, hoofddocent geriatrie fysiotherapie Radboud Universitair Medisch Centrum, Nijmegen, KNGF
- Dr. L. den Boeft, geriatriefysiotherapeut, praktijk 43, Naarden, KNGF
- M. Alcazar, klinisch diëtist, Amstelring, Amsterdam, NVD
- C.J.M. van Santen, oefentherapeut, Praktijk voor Houding en Beweging, Den Haag, VVOCM
- Drs. M.H. de Jong, Sportarts, Annatommie mc Amsterdam-Amstelveen, Amstelveen, VSG
- Drs. W. Jager, gynaecoloog, St. Jans Gasthuis Weert, Weert, NVOG
- E.H.G. Oei, radioloog, Erasmus Medisch Centrum, Rotterdam, NVVR
- Dr. S.H. van Helden, traumachirurg, Isala, Zwolle, NVT
- M.G.C. Ligthart, bedrijfsarts, ADXpert, Ridderkerk, NVAB
- Dr. P.M. van Roermund, orthopeed, Universitair Medisch Centrum Utrecht, Utrecht, NOV
- A.M.W.M. van Dam, patiëntvertegenwoordiger Osteoporose Vereniging, Den Haag, Osteoporose Vereniging
- Dr. H.J.J. Verhaar, internist, Universitair Medisch Centrum Utrecht, Utrecht, NIV
- Dr. R.L. van Bezooijen, specialist Ouderengeneeskunde, Florence, Rijswijk, Verenso
- Drs. G. Zemack, revalidatiearts, Revalidatiecentrum Libra, Eindhoven, VRA
- Drs. S.E.C. Pichardo, MKA-chirurg, Leids Universitair Medisch Centrum, Leiden, VRA
- Drs. M.R.J. ten Broek, nucleair Geneeskundige, Reinier de Graaf Groep, IJsselland ziekenhuis, NVNG
Met ondersteuning van
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. K. Venhorst, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Het kennisinstituut in haar rol als methodologisch ondersteuner, de NIV als initiërende wetenschappelijke vereniging en de richtlijncommissie zijn zich bewust van de belangen die spelen binnen de werkgroep, maar het werd toch noodzakelijk geacht om de betreffende inhoudelijk experts op dit gebied bij de richtlijn te betrekken. Tijdens de commentaarfase zullen de in de werkgroep vertegenwoordigde verenigingen middels de uitnodigingsbrief voor het aanleveren van commentaar erop alert worden gemaakt dat er belangen spelen binnen de richtlijnwerkgroep. Zij zullen worden verzocht om hier bij het aanleveren van commentaar kritisch op te zijn en erover na te denken om experts, vrij van belangen, expliciet te verzoeken om de richtlijn te beoordelen.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Bergh |
Werkzaam in VieCuri MC Noord Limburg Hoogleraar botkwaliteit en metabole botaandoeningen, Maastricht UMC 0,2 FTE Hoogleraar Endocrinologie Uhasselt België, 0,05 FTE |
Bestuurslid Stichting IWO (Interdisciplinaire werkgroep osteoporose), onbetaald behoudens onkostenvergoeding Voorzitter planning en Financiering OOR Zuid Oost Nederland, onbetaald Lid dagelijks bestuur OOR Zuid Oost Nederland, onbetaald Lid werkgroep Zinnige Zorg Osteoporose - Zorglnstituut onbetaald Lid werkgroep Kwaliteitsindicator Osteoporose, onbetaald |
Vergoeding voordrachten en advisoryboards: Amgen, UCB, Eli Lilly, Sanofi
Onderzoek gefinancierd (via de afdeling, niet via ondergetekende) door Amgen, Eli Lilly, Apotheekzorg, Stichting de Weijerhorst, NWO, Novo Nordisk Fonden
Bestuurslid van stichting IWO en bestuurslid van de NVE BoNe werkgroep |
Geen |
|
Appelman-Dijkstra |
Internist Leids Universitair Medisch Centrum |
non-paid member scientific board van Active Life, (onbetaald) voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling alsmede secretaris van de NVE BoNe werkgroep (onbetaald), lid sectie Endocrinologie NIV (onbetaald behoudens reiskostenvergoeding) |
Geparticipeerd in de fase 3 studie naar Romosozumab in postmenopauzale osteoporose (afgerond in 2016/2017). 2015 Researchdonatie van Amgen ten behoeve van ontwikkeling Nederlandse ziekte specifieke vragenlijst voor hyperparathyrodie 2019 UCB ISSS gesponsorde studie naar de uitkomsten van Sclerostin deficiëntie bij mensen met de ziekte van Buchem
Niet van toepassing behoudens voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling alsmede secretaris van de NVE BoNe werkgroep |
Geen |
|
Zillikens |
Internist Erasmus MC Rotterdam. Hoogleraar complexe en zeldzame botaandoeningen. |
Voorzitter BotNetwerk van de Nederlandse Vereniging voor Endocrinologie (NVE), onbetaald Voormalig voorzitter van de Nederlandse Vereniging voor Calcium en Botstofwisseling, onbetaald Bestuurslid European Calcified Tissue Society (ECTS), onbetaald. |
Geparticipeerd in de fase 3 studie naar Romosozumab bij postmenopauzale osteoporose (afgerond in 2016/2017)
participatie in de klankbordgroep richtlijn Mastocytose. |
Geen |
|
Lems |
Reumatoloog in Amsterdam UMC/lokatiehoofd in Vumc (0,8 FTE) Reumatoloog in Reade (0,2 FTE) |
Hoofdredacteur Ned. Tijdschrift Reumatologie (betaald) Secretaris IWO (betaald) Wetenschappelijk secretaris NVR (betaald) Adviesraden/Speakers fees: Amgen, Eli Lilly, UCB, Pfizer, Curaphar (betaald) |
Sponsoring, aan de afdeling, niet aan ondergetekende, van wetenschappelijk onderzoek: Amgen, Eli Lilly, Pfizer |
Geen |
|
Geusens |
Emeritus hoogleraar reumatologie, MUMC & UHasselt, België Lopend onderzoek: Promotor voor S Bours Co-promotor voor P vd Berg Begeleiding bij diverse nog steeds lopende promoties aan MUMC en Uhaaselt |
Lid commissie terugbetaling geneesmiddelen, RIZIV, BE (onbezoldigd) Parttime Reumatoloog, ReumaClinic, BE (bezoldigd volgens RIZIV0 |
Pfizer, Abbott/Abbvie, Janssen, Celgene, Lilly, Amgen, MSD, UCB, Will, Roche, BMS, Novartis, Sanofi |
Geen |
|
Willems |
Klinisch geriater en internist bij AmsterdamUMC, (0,8 FTE) |
Voorzitter werkgroep Leading the Change bij stichting Zorgevaluatie Nederland (0,05FTE) betaald |
Speekersfee voor AMGEN, Lilly, UCB geparticipeerd in advisary boards van Amgen en UCB. |
Geen |
|
De Klerk |
Traumachirurg, Admiraal de Ruyter Ziekenhuis |
Instructeur Advanced Trauma Life Support, betaald Lid van de Taskforce 2 heupfractuur van de NVT, betaald |
2018 Presentatie op BOT Cursus Delft, speakersfee, enkele betaalde cursussen over osteosynthese van Synthes (Ankle Trauma en Hip fragility fractures), Smith and Nephew (TSF), Promotion Medical (IBRA Seminar & Workshop "Trauma and Reconstruction of the Upper Limb, Amsterdam), deelnemer osteoporose symposium betaald door Lilly Bij intellectuele belangen: 2017 Proefschrift: Identification and treatment in fracture patients |
Geen |
|
Elders |
0,6 FTE: Universitair Hoofd Docent onderzoeksgroep Diabetes, Overgewicht, leefstijl en Osteoporose bij de afdeling huisartsgeneeskunde en ouderengeneeskunde, UMC Amsterdam, locatie Vumc 0,2 FTE waarnemend huisarts te Amsterdam |
Expert-arts diabetes zorg voor de zorggroep CHAGZ te Amsterdam (betaald) Lid van de vaste Kamercommissie bevolkingsonderzoek van de gezondheidsraad (vacatiegeld) Lid van de gezondheidsraad (vacatiegeld) Lid van de werkgroep deprescibing van het kennisinstituut (vacatiegeld) Lid werkgroep Osteoporose Zorg Instituut Nederland (vacatiegeld) Lid van de transmurale werkgroep Diabeteszorg Amsterdam (vacatiegeld) Docent Huisartsgeneeskunde Diabetes en Osteoporose gerelateerd onderwerpen voor diverse organisaties, waaronder ook instellingen die subsidies van de farmaceutische industrie ontvangen. Het betreft nascholing die door mij zelf zonder bemoeienis van buitenaf worden samengesteld (betaald) Lid van de Diabetes Huisartsen groep (DIHAG) van het NHG (onbetaald) |
Geen |
Geen |
|
Maartens |
Huisarts 0,6 FTE Zelfstandig, Eindhoven |
Kader-arts osteoporose, Diagnostiek voor U Eindhoven. Op consultatie-basis Beoordeling DXA aanvragen Zuid Oost Brabant. Betaalde functie |
Geen |
Geen |
|
Wiersma |
senior wetenschappelijk medewerker NHG |
Geen |
Geen |
Geen |
|
Van Oostwaard
|
Verpleegkundig specialist Promovendus Centrum voor Metabole Botaandoeningen VieCuri Medisch Centrum |
Onbetaald: PhD traject Universiteit Maastricht (Prof. J van den Bergh) Voorzitter Netwerk V&VN VS Osteoporose
|
Beperkt honorarium: Adviseurschap UCB (adviesraad VS-PA) In verleden betaling voor een congresreis en voordrachten: Amgen (of via congresbureau ondersteund door Amgen) |
Geen |
|
Van den Broek |
Voorzitter Osteoporose Vereniging (vrijwilliger, onbezoldigd) DGA Consultec BV (Eigen holding, houder pensioenrechten) |
DGA Consultec BV (Eigen holding, houder pensioenrechten) deels betaald. Bestuurslid Energiek Heusden (energiecoöperatie, onbezoldigd) |
De osteoporose vereniging heeft geen extern gefinancierd onderzoek, dus niet van toepassing. Zij ontvangt subsidie, sponsoring en donatie voor het organiseren van verenigingsactiviteiten van VWS, ReumaNederland, contributie en bedrijven (waaronder Farma) |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en de Osteoporose Vereniging voor de Invitational conference en afvaardiging van de Osteoporose Vereniging in de werkgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en de Osteoporose Vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Implementatie
Richtlijn osteoporose en fractuurpreventie: implementatieplan
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn osteoporose en fractuurpreventie.
Voor het implementatieplan voor de richtlijn verwijst de richtlijnwerkgroep naar de implementatiefase van het zorginstituut: https://www.zorginstituutnederland.nl/werkagenda/stofwisseling-en-hormoonhuishouding/zinnige-zorg---osteoporose-implementatiefase
Voor het opstellen van dit plan is een verdere inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Algemeen: implementatie van de aanbevelingen bij de richtlijn osteoporose en fracuurpreventie
Voor een uitgebreide bespreking van de randvoorwaarden en verantwoordelijke partijen ten aanzien van de aanbevelingen van deze richtlijn verwijst de richtlijnwerkgroep naar de module ‘organisatie van zorg’.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met osteoporose en verhoogd fractuurrisico. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (Nederlandse Internisten Vereniging, 2011) op noodzaak tot revisie.
Tevens zijn er knelpunten aangedragen door de V&VN, NVKG, KNGF, NHG, KNMP, Verenso, NVR, Osteoporose Vereniging, NVD, IGJ en NVMKA via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Systematic reviews
|
Database |
Zoektermen |
||||||||||||||||||
|
Embase
|
|
||||||||||||||||||
|
Medline (OVID)
|
1 exp Osteoporosis/ or osteoporos*.ti,ab,kf. or osteopeni*.ti,ab,kf. or ((exp Risk/ or exp Risk Factors/) and fracture*.ti,ab,kf.) or (risk* adj2 fracture*).ti,ab,kf. (109092) 2 exp Magnesium/ or 'magnesium'.ti,ab,kf. or 'romag'.ti,ab,kf. or exp Vitamin K 2/ or menaquinon*.ti,ab,kf. or 'vitamin k'.ti,ab,kf. (121363) 3 1 and 2 (1379) 4 limit 3 to english language (1147) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (442170) 6 4 and 5 (45) |
Randomized controlled trials
|
Database |
Zoektermen |
|||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Osteoporosis/ or osteoporos*.ti,ab,kf. or osteopeni*.ti,ab,kf. or ((exp Risk/ or exp Risk Factors/) and fracture*.ti,ab,kf.) or (risk* adj2 fracture*).ti,ab,kf. (111395) 2 exp Magnesium/ or 'magnesium'.ti,ab,kf. or 'romag'.ti,ab,kf. (101913) 3 exp Vitamin K 2/ or menaquinon*.ti,ab,kf. or 'vitamin k'.ti,ab,kf. (21432) 4 1 and 2 (780) 5 1 and 3 (657) 6 limit 4 to (english language and yr="2000 -Current") (427) 7 limit 5 to (english language and yr="2018 -Current") (92) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2024174) 9 6 and 8 (62) 10 7 and 8 (17) |
