Debridement
Uitgangsvraag
Binnen welke termijn dient het debridement te worden uitgevoerd na een open (Gustilo I – III) crurisfractuur, om complicaties en vooral infecties te voorkomen?
Aanbeveling
Voer het initiële debridement, als de conditie van de patiënt het toelaat, zo snel mogelijk na het initiële trauma uit met een multidisciplinair team (zie module organisatie van zorg).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is voor de module debridement literatuuronderzoek verricht naar het effect van een vroeg debridement (behandeling binnen zes uur na het trauma) versus een laat debridement (behandeling meer dan zes uur na het trauma) na een open (Gustilo I – III) crurisfractuur. Infectie werd gedefinieerd als cruciale uitkomstmaat. Heropname in het ziekenhuis (of heroperatie), algemene dagelijkse levensverrichtingen (ADL), terugkeer naar werk en mobiliteit werden als belangrijke uitkomstmaten gedefinieerd.
Voor de cruciale uitkomstmaat infectie werden er geen klinisch relevante verschillen gevonden in het aantal infecties na een debridement binnen zes uur of later dan zes uur na het trauma bij patiënten met een open onderbeenfractuur. Door het observationele design van de geïncludeerde studies en beperkingen in de onderzoeksopzet, met name het gebrek aan correctie voor confounders, is de bewijskracht hiervoor zeer laag. Dit wil zeggen dat de literatuur erg onzeker is over het effect van een vroeg debridement op het aantal infecties ten opzichte van een laat debridement. Er kon geen uitspraak worden gedaan over het belang van de uitkomsten heropname in het ziekenhuis (of heroperatie), algemene dagelijkse levensverrichtingen (ADL), terugkeer naar werk en mobiliteit, omdat geen van de geïncludeerde studies informatie rapporteerde over deze uitkomsten.
De Friedrichse gedachte stamt uit 1898, toen er uit onderzoek bleek dat cavia’s met een open fractuur gezond bleven wanneer deze binnen zes uur een debridement kregen (Friedrich, 1896). Sindsdien wordt dit als de “zes uur regel” gebruikt bij het debrideren of sluiten van open wonden. Hierbij wordt verondersteld dat kans op infectie het kleinst is bij sluiting ‘per primam intentionem’. De huidige richtlijn probeert een verband te leggen tussen deze snellere wondverzorging en de definitieve behandeling van een open crurisfractuur. Een overtuigend voordeel wordt er niet gevonden, bij een lage bewijskracht. De systematische literatuuranalyse laat zien dat er geen bewijs is voor de optimale timing. Het contrast tussen een vroeg en laat debridement is klein, met zelfs een overlap (6-8 uur).
Mogelijk is hier sprake van een kennislacune; ondanks het feit dat de conclusie van de huidige richtlijn voor meerdere fracturen zeer relevant is, is het aantal gerandomiseerde studies hierover, beperkt. Zelfs de enige redelijk recente gerandomiseerde studie (Norbert, 2016) laat geen overtuigende reductie van het aantal postoperatieve wondinfecties zien. De laatste decennia zijn de mogelijkheden voor het behandelen van open wonden aanzienlijk verbeterd; buiten de negatieve druktherapie hebben uitgebreide transplantaties/transposities door de plastisch chirurg ertoe geleid dat genezing per secundam intentionem positief eindigt, zonder wondinfecties. Een prospectief gerandomiseerde studie bij open fracturen is lastig uit te voeren.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De belangrijkste doelen voor een patiënt die wordt behandeld in verband met een open crurisfractuur zijn een zo goed mogelijke functionele uitkomst en kwaliteit van leven. In uitzonderingsgevallen wordt gekozen voor een primaire amputatie, maar bij de meeste patiënten zal worden gestreefd naar behoud van het onderbeen. Daartoe is zowel een fixatie van de fractuur met behulp van pen of plaat, als reconstructie van de weke delen noodzakelijk. Het doel is een zo spoedig mogelijke bedekking van de fractuur met zo min mogelijk complicaties. In een enkel geval is het mogelijk de huid na een adequaat debridement te sluiten, maar meestal zal dit niet mogelijk zijn. In afwachting van een definitieve reconstructie, dient de fractuur tijdelijk bedekt te worden. Er kan gekozen worden voor een tijdelijke reconstructie door middel van een externe fixateur. Daarvoor kan de wondverzorging vereenvoudigd worden en kan gebruikt gemaakt worden van natte gazen of negatieve druktherapie. Bij de definitieve reconstructie kan volledige wondbedekking en sluiting nagestreefd worden, waarbij gebruik kan worden gemaakt van vrije of gesteelde spierlappen, in samenwerking met de plastisch chirurg. Informeer de patiënt over de behandelopties en betrek de patiënt bij de besluiten omtrent de behandelkeuze.
Kosten (middelenbeslag)
Idealiter wordt een debridement en (tijdelijke) fixatie van de open crurisfractuur op korte termijn uitgevoerd. Gedurende het interval tussen de zgn. indexoperatie en de definitieve fixatie zal de patiënt meestal behandeld worden in het ziekenhuis. Een tweede en zo mogelijk definitieve fixatie zal goed gepland en uitgevoerd moeten worden tijdens deze hospitalisatie. Hoe korter de hospitalisatie, des te lager de kosten. Mits het risico op een wondinfectie laag blijft.
Aanvaardbaarheid, haalbaarheid en implementatie
Een multidisciplinaire benadering met de juiste ervaring van het gehele team tijdens de hospitalisatie lijkt onmisbaar en de zes-uur regel lijkt daar tegenover minder zwaar te wegen. Er zijn uiteraard indicaties om zo snel mogelijk chirurgisch in te grijpen. Forse contaminatie, acuut compartimentsyndroom, avasculair ledemaat en polytrauma patiënten zijn een absolute indicatie tot spoed interventie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Alles in ogenschouw nemend, samen met de bestaande literatuur die wordt gegradeerd als zeer laag lijkt het logisch het initiële debridement te verrichten binnen een zo kort mogelijke tijd met een ervaren multidisciplinair team (deze samenstelling is beschreven en toegelicht in de module organisatie van zorg). Wat een zo kort mogelijke tijd is, staat ter discussie. Het lijkt logisch dat dit de tijd is die nodig is om een (gespecialiseerd) multidisciplinair team te mobiliseren wat soms langer dan zes uur zou kunnen zijn.
Deze bevindingen worden bevestigd door de publicatie van de International Lower Limb Collaborative (Berner, 2022), waarin geen statistische relatie werd gevonden tussen het tijdstip van debridement en preventie van infectie, non-union of amputatie. Behalve wanneer dit werd uitgesteld langer dan 72 uur. Deze conclusie werd getrokken op basis van een retrospectieve search in zestien landen bij 2.694 patiënten.
Onderbouwing
Achtergrond
De huidige opinie is dat open fracturen binnen zes uur hun eerste debridement moeten ondergaan. In de ideale situatie wordt deze eerste operatie (indexoperatie) bij voorkeur door een multidisciplinair team gedaan: traumachirurg of orthopedisch chirurg, een plastisch chirurg en bij vasculair trauma een vaatchirurg. Deze ideale omstandigheden zijn niet altijd mogelijk (bijv. multitrauma) of zijn lastig te organiseren (tijdstip van trauma). Zou er derhalve ruimte bestaan om het debridement eventueel later te kunnen verrichten met een multidisciplinair team?
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of early debridement (within six hours) on infections when compared to late debridement (later than six hours) in patients with open fractures in the lower limbs.
Sources: Kamat (2011); Konbaz (2019); Li (2020); Nobert (2016); Schenker (2012) (Bednar (1993), Sungaran (2007) and Tripuraneni (2008) were included in Schenker (2012) and described in the literature summary) |
|
No GRADE |
Due to a lack of relevant literature, it was not possible to draw any conclusion with regards to the outcomes rehospitalization (or re-surgery), activities of daily living (ADL), return to work, and mobility for the comparison of early debridement (within six hours) compared with late debridement (later than six hours) in patients with open fractures in the lower limbs.
Sources: - |
Samenvatting literatuur
Description of studies
Systematic review(s)
The systematic review of Schenker (2012) evaluated the association between time to initial operative debridement of open fractures and development of infectious complications. Schenker (2012) searched the electronic databases of Medline, Embase, and Cochrane until December 3, 2010) for randomized controlled trials, quasi-randomized controlled trials, and cohort studies (both prospective and retrospective). In total, Schenker (2012) included sixteen studies. Of these, only three of the sixteen studies matched the PICO of the present guideline, and these three were included in this literature analysis (Bednar, 1993; Sungaran, 2007; Tripuraneni, 2008). The mentioned studies were retrospective cohort studies and included a combined total of 451 patients. Bednar (1993) investigated the difference between early debridement (within six hours after the event) versus late debridement (within 24 hours after the event) in 75 patients (mean age 34 years) with 82 open limb fractures. Sungaran (2007) investigated if delayed treatment (six hours after the event) resulted in more infections, when compared to early treatment (within six hours after the event), in 161 patients (mean age not reported) with open tibia fractures with or without open ankle fractures. Tripuraneni (2008) investigated the effect of delayed initial treatment (later than six hours after the event) on infections compared with early treatment (within six hours after the event) in 206 patients (mean age 39 years) with 215 open tibia fractures. The length of follow-up varied from ten to eighteen months. The assessment of the risk of bias was not reported. The reported outcome in the study was infection.
Observational studies
The retrospective study of Kamat (2011) investigated the effect of early debridement (within six hours) compared with late surgical debridement (later than six hours) in patients with open fractures of the tibia. In total, 103 patients were included, of which 62 patients underwent early surgical debridement and 41 patients underwent late surgical debridement. The mean (SD) age of both groups was not reported. Kamat (2011) included patients with Gustilo-classification I, II, and III. The maximum length of follow-up was ten days. Information regarding the statistical analysis was not reported. The reported outcome in the study was infection.
The prospective cohort study of Nobert (2016) investigated the effect of early surgical debridement (within six hours) compared with late surgical debridement (six hours or more than six hours after the event) in patients with long open bone fractures. In total, 143 patients were included, of which 63 patients underwent early debridement and 80 patients underwent late debridement. The mean (SD) age of the early debridement group was 32 (23 - 41) years, compared to 35 (27 - 42) years in the late debridement group. The study included patients with Gustilo-classification I, II, IIIA, IIIB, and IIIC. The maximum length of follow-up was 30 days. Information regarding the statistical analysis was not reported. The reported outcome in the study was infection.
The retrospective study of Konbaz (2018) investigated the effect of early surgical debridement (within six hours) compared with late surgical debridement (later than six hours) in patients with open tibia fractures. In total, 113 patients were included. Sixty-five patients underwent early surgical debridement, while 48 patients underwent late surgical debridement. The mean (SD) age of the early debridement group was 33.06 years (3.26), compared to 31.44 years (+ 1.19) in the late debridement group. The study included patients with Gustilo-classification I, II, IIIA, IIIB, and IIIC. The minimum length of follow-up was one year or until the fracture healed, or an infection developed. Information regarding the statistical analysis was not reported. The reported outcome in the study was infection.
The retrospective study of Li (2020) investigated the relationship between surgical debridement within six hours with surgical debridement with debridement later than six hours, on occurrence of perioperative infections in patients with open tibial fractures. Li (2020) included 215 patients. Of these, 65 patients underwent first debridement within six hours and 150 patients underwent first debridement six hours or more than six hours after the event. The mean (SD) age of the study population was 48.5 (3.6) years and 117 (54%) patients were males. The study included patients with Gustilo-classification I, II, IIIA, IIIB, and IIIC. The maximum length of follow-up was ten weeks, or more. Single-factor and multi-factor analyses were performed using binary logistic regression analysis. The reported outcome in the study was infection.
Results
- Infection
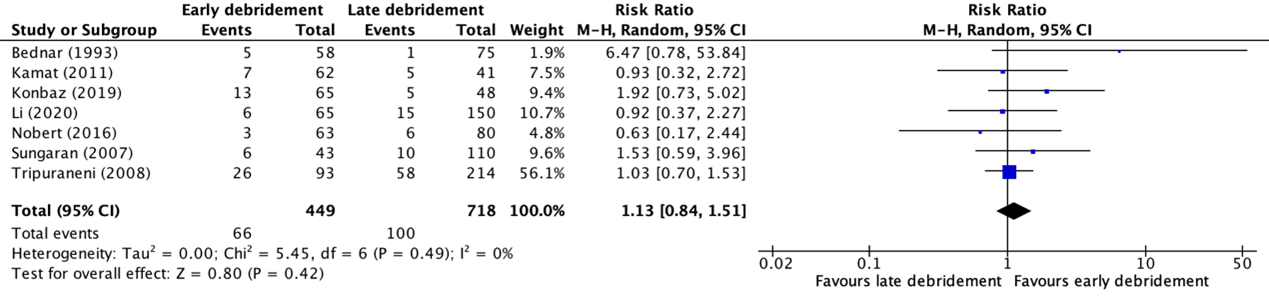
The outcome infection was reported in three studies, retrieved from the systematic review of Schenker (2012) (Bednar, 1993; Sungaran, 2007; Tripuraneni, 2008) and in four additional studies published after the publication date of Schenker (2012) (Kamat, 2011; Konbaz, 2019; Li, 2020; Nobert, 2016). The results were pooled in a meta-analysis. The pooled number of infections in the early debridement group was 66/449 (14.7%), compared to 100/718 (13.9%) in the late debridement group. This resulted in a pooled relative risk ratio (RR) of 1.13 (95% CI 0.84 to 1.51), in favor of the early debridement group (figure 1). This was not considered as a clinically relevant difference.
Figure 1. Forest plot showing the comparison between early debridement (within six hours) to late debridement (later than six hours) for infection. Pooled risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
- Rehospitalization (or re-surgery)
None of the included studies reported information regarding the predefined outcome rehospitalization (or re-surgery) in patients with open fractures in the lower limbs.
- Activities of daily living (ADL)
None of the included studies reported information regarding the predefined outcome activities of daily living (ADL) in patients with open fractures in the lower limbs.
- Return to work
None of the included studies reported information regarding the predefined outcome return to work in patients with open fractures in the lower limbs.
- Mobility
None of the included studies reported information regarding the predefined outcome mobility in patients with open fractures in the lower limbs.
Level of evidence of the literature
- Infection
The level of evidence regarding the outcome infection was derived from observational studies and therefore started low. The level of evidence was downgraded because of a lack of correction of confounding (risk of bias), heterogeneity in the study results (inconsistency), and the wide confidence interval crossing the boundaries of clinical relevance (imprecision). The level of evidence was considered as very low.
- Rehospitalization (or re-surgery)
Because of a lack of data, it was not possible to grade the literature for the outcome rehospitalization (or re-surgery) in patients with open fractures in the lower limbs.
- Activities of daily living (ADL)
Because of a lack of data, it was not possible to grade the literature for the outcome activities of daily living (ADL) in patients with open fractures in the lower limbs.
- Return to work
Because of a lack of data, it was not possible to grade the literature for the outcome return to work in patients with open fractures in the lower limbs.
- Mobility
Because of a lack of data, it was not possible to grade the literature for the outcome mobility in patients with open fractures in the lower limbs.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: Is surgical debridement within six hours following trauma mandatory?
P: patients with open fractures in the lower part of the lower limb (all Gustilo classifications)
I: early debridement (within six hours)
C: late debridement (later than six hours)
O: infections, rehospitalization (or re-surgery), activities of daily living (ADL), return to work, and mobility.
Relevant outcome measures
The guideline development group considered infections, rehospitalization (or re-surgery) as critical outcome measures and activities of daily living (ADL), return to work, and mobility as important outcome measures for decision making.
The working group defined a threshold of 10% for continuous outcomes and a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal, clinically important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2010 until May 20, 2022. The detailed search strategy is depicted under the Methods tab. The systematic literature search resulted in 391 hits. Studies were selected based on the following criteria: systematic reviews, randomized controlled trials (RCTs), and observational studies that investigated the timing of debridement, important to prevent complications, specifically infections. Nine studies were initially selected based on title and abstract screening. After reading the full text, four studies were excluded (see the table with reasons for exclusion under the Methods tab), and five studies were included.
Results
Five studies, one systematic review and four cohort studies, were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bednar DA, Parikh J. Effect of time delay from injury to primary management on the incidence of deep infection after open fractures of the lower extremities caused by blunt trauma in adults. J Orthop Trauma. 1993;7:532-5
- Berner JE, Chan JKK, Gardiner MD, Navia A, Tejos R, Ortiz-Llorens M, Ortega-Briones A, Rakhorst HA, Nanchahal J, Jain A; INTELLECT Collaborative. International Lower Limb Collaborative (INTELLECT) study: a multicentre, international retrospective audit of lower extremity open fractures. Br J Surg. 2022 Aug 16;109(9):792-795. doi: 10.1093/bjs/znac105. PMID: 35470389.
- Friedrich, P.L. Die aseptische Versorgung frischer Wunden, unter Mittheilung von Thier-Versuchen über die Auskeimungszeit von Infectionserregern in frischen Wunden.
- Kamat AS. Infection rates in open fractures of the tibia: is the 6-hour rule fact or fiction? Adv Orthop. 2011;2011:943495. doi: 10.4061/2011/943495. Epub 2011 Oct 27. PMID: 22111008; PMCID: PMC3205596.
- Konbaz FM, Alassiri SS, Al Eissa SI, Taha WS, Al Helal FH, Al Jehani RM. Does delay in surgical debridement increase the risk of infection in open tibia fractures in Saudi patients? A retrospective cohort study. J Clin Orthop Trauma. 2019 Mar-Apr;10(2):305-309. doi: 10.1016/j.jcot.2018.02.012. Epub 2018 Feb 23. PMID: 30828199; PMCID: PMC6382948.
- Li J, Wang Q, Lu Y, Feng Q, He X, Li Md Z, Zhang K. Relationship Between Time to Surgical Debridement and the Incidence of Infection in Patients with Open Tibial Fractures. Orthop Surg. 2020 Apr;12(2):524-532. doi: 10.1111/os.12653. Epub 2020 Mar 22. PMID: 32202051; PMCID: PMC7189037.
- Nobert N, Moremi N, Seni J, Dass RM, Ngayomela IH, Mshana SE, Gilyoma JM. The effect of early versus delayed surgical debridement on the outcome of open long bone fractures at Bugando Medical Centre, Mwanza, Tanzania. J Trauma Manag Outcomes. 2016 Jul 4;10:6. doi: 10.1186/s13032-016-0036-7. PMID: 28053658; PMCID: PMC5207093.
- Schenker ML, Yannascoli S, Baldwin KD, et al. Does timing to operative debridement affect infectious complications in open long-bone fractures? A systematic review. J Bone Joint Surg Am. 2012 20;94(12):1057-64.
- Sungaran J, Harris I, MouradM. The effect of time to theatre on infection rate for open tibia fractures. ANZ J Surg. 2007;77:886-8.
Evidence tabellen
Research question: Binnen welke termijn dient het debridement te worden uitgevoerd na een open (Gustilo I – III) crurisfractuur, om complicaties en vooral infecties te voorkomen?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Schenker, 2012
|
SR and meta-analysis of RCTs, quasi-randomized controlled trials, cohort studies
Literature search up to December 2010
A: Tripuraneni, 2008 B: Sungaran, 2007 C: Bednar, 1993
Study design: A: Cohort (retrospective) B: Cohort (retrospective) C: Cohort (retrospective)
Setting and Country: A: Level-I trauma center, USA B: Tertiary referral trauma centre, Australia C: University hospital and trauma referral center, Canada
Source of funding: A: Unknown B: Unknown C: Unknown
|
Inclusion criteria SR:
Exclusion criteria SR:
16 studies included; additional inclusion criteria were: open fractures in the leg of type II or III. A total of six studies were included and described.
Important patient characteristics at baseline:
N, mean age A: 215 fractures in 206 patients, mean 39 yrs B: 161 patients; Not reported C: 91 fractures in 84 patients; mean 34 yrs (range 16-63)
% Male: A: Not reported B: Not reported C: 72 ((96)
Groups comparable at baseline?
A: Not reported B: Not reported C: Not reported |
Early debridement between: A: 0-6 hrs B: 0-6 hrs C: 0-6 hrs
|
Late debridement between: A: 6 – >24 hrs B: 6 – 24 hrs C: 7-24 hrs
|
End-point of follow-up: A: Mean 10 months (range 2 weeks to 52 months) B: Not reported C: Mean 18 months (range 6 to 38 months)
For how many participants were no complete outcome data available? (intervention/control) A: Unknown B: Unknown C: 0 (0%)
|
Comparison: Early vs late
Outcome measure-1 Defined as infection
I: n/N; C: n/N Effect measure: RR (95% CI)
A (within 3 months after injury): I: 26/93; C: 58/214 Unadjusted OR: 1.04 (0.61-1.80)
B: I: 6/43; C: 10/110 Unadjusted OR: 1.62 (0.55-4.77)
C: I: 5/58; C: 1/75 Unadjusted OR: 6.98 (0.79-61.50)
C: (more than 6 weeks after injury): I: 2/20; C: 2/43 Unadjusted OR: 2.28 (0.30-17.46)
Pooled effect (random effects model model) early vs late debridement: OR 1.23 (95% CI 0.62 to 2.46)
Heterogeneity: p=0.162
Outcome measure-2 Defined as rehospitalisation or -surgery
None of the studies reported data on this outcome.
Outcome measure-3 Defined as ADL, return to work or mobility
None of the studies reported data on this outcome.
Outcome measure-4 Defined as complications or pain
None of the studies reported data on this outcome.
|
Authors’ conclusion: The data did not indicate an association between delayed debridement and higher infection rates when all infections were considered, or when only more severe open fracture injuries were considered.
Level of evidence: GRADE Outcome measure 1: Infection VERY LOW
Outcome measure 2: Rehospitalisation or -surgery VERY LOW
The level of evidence was downgraded from LOW to VERY low, because of no adjustment for confounders (Risk of Bias) and small number of infection in studies (Imprecision).
Comment: E: Study undertook analyse per 1 hour blocks to check the time delay from injury until debridement and the risk of infections
Subgroup analysis 0-6 hrs vs >6hrs
Not possible |
Evidence table for single studies
Research question: Binnen welke termijn dient het debridement te worden uitgevoerd na een open (Gustilo I – III) crurisfractuur, om complicaties en vooral infecties te voorkomen?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Li (2020) |
Type of study: Retrospective study.
Setting and country: Emergency department.
Funding and conflicts of interest: This study was supported by the Key Social Development Projects of Shaanxi Science and Technology Administration (2016SF-340). Each author certifies that he has no commercial or any other associations that might pose a conflict of interest in connection with the submitted article.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 65 Control: N = 150 Total: N = 215
Important prognostic factors2: age ± SD: 48.5 (3.6)
Sex: Males: N = 117 Females: N = 98
Gustilo-I: N=62 Gustilo-II: N=98 Gustilo-IIIA: N=26 Gustilo-IIIB: N=25 Gustilo-IIIC: N=4
Groups comparable at baseline? Yes. |
Describe intervention (treatment/procedure/test): Length from injury to first debridement <6 hours.
|
Describe control (treatment/procedure/test): length from injury to first debridement >6 hours.
|
Length of follow-up: More than 10 weeks.
Loss-to-follow-up: None.
|
Outcome measures Infections, n/N (%) I: 6/65 (9.2%) C: 15/150 (10%)
|
Author’s conclusion: This study is a single-center retrospective study with certain biases. The doctors on duty who perform emergency debridement after admission are uneven in age, and all sur- geries are not performed by the same group of doctors, which causes some interference with the analysis results. The study sample size is small, and there may be bias in the sta- tistical analysis results; the research results need to be further confirmed by multi-center large-sample studies.
|
|
Nobert (2016) |
Type of study: Prospective cohort study.
Setting and country: Emergency department of Bugando Medcial Centre.
Funding and conflicts of interest: The authors declare that they have no competing interests.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 63 Control: N = 80 Total: N = 143
Important prognostic factors2: age ± SD: I: 32 (23 to 41) C: 35 (27 to 42)
Sex: I: 40/63 (63.5%) M C: 49/80 (61.2%) M
Groups comparable at baseline? Yes. |
Describe intervention (treatment/procedure/test): Early debridement (within 6 hours)
|
Describe control (treatment/procedure/test): Late debridement (later than 6 hours). |
Length of follow-up: 30 days.
Loss-to-follow-up: None.
|
Outcome measures Infections, n/N (%) I: 3/63 (4.8%) C: 6/80 (7.5%)
Length of hospital stay, median (IQR) I: 6 (5 to 10) days. C: 7 (6 to 11.5) days.
|
Author’s conclusion: Open long bone fracture injuries are common at BMC, with majority of these injuries being attributed to RTA. The risk of developing SSI was low at BMC and com- parable to many other countries; with Pseudomonas aeruginosa being commonly implicated causative agent. Despite the fact that there was no statistical significant difference between early versus delayed debrided groups on SSI and LOS stays; the need for prompt sur- gical intervention in both groups should be an enduring focus to maintain these favorable outcomes. In the light of this, a long term prospective cohort study with a larger sample size would be of interest to further delineate the predictors of outcome among patients with open long bone fractures as well as the role of bacterial species for effective antimicrobial policy formulation.
|
|
Kamat (2011) |
Type of study: Retrospective study.
Setting and country: Hospitals in the Wellington region of New Zealand.
Funding and conflicts of interest: No funding was received in the undertaking of this research, nor are there any conflict on interests.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 62 Control: N = 41 Total: N = 103
Important prognostic factors2: age ± SD: Not reported.
Sex: Not reported.
Gustilo-I: N = 49 Gustilo-II: N = 32 Gustilo-III: N = 22
Groups comparable at baseline? Not reported. |
Describe intervention (treatment/procedure/test): Surgical debridement within 6 hours.
|
Describe control (treatment/procedure/test): Surgical debridement after 6 hours.
|
Length of follow-up: 10 days.
Loss-to-follow-up: None.
|
Outcome measures Infection, n/N (%) I: 7/62 (11.3%) C: 5/41 (12.2%)
|
Author’s conclusion: There is no significant difference in timing of surgery. Initial basic interventions may play more of a role in limiting the risk of infection.
|
|
Konbaz (2019) |
Type of study: Retrospective cohort study.
Setting and country: Hospital setting.
Funding and conflicts of interest: This research did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors. The author and co-authors do not have any conflicts of interest to disclose.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 65 Control: N = 48 Total: N = 113
Important prognostic factors2: age ± SD: 31.70 years (range 18 to 70)
Sex: Males: N = 109 Females: N = 4
Gustilo-I: N = 13 Gustilo-II: N = 45 Gustilo-IIIA: N = 20 Gustilo-IIIB: N = 28 Gustilo-IIIC: N = 7
Groups comparable at baseline? Not reported. |
Describe intervention (treatment/procedure/test): Surgical debridement within 6 hours.
|
Describe control (treatment/procedure/test): Surgical debridement after 6 hours. |
Length of follow-up: One year.
Loss-to-follow-up: None.
|
Outcome measures Infection, n/N (%) I: 13/65 (20%) C: 5/48 (10.4%) |
Author’s conclusion: This study showed no significant evidence to support the 6-h rule, but it did demonstrate a significant relationship between the Gustilo stage and infection, as well as an increased infection rate if external fixation was used or if the wound was left open during the initial I&D. We believe that more studies are required to identify the relationship between infection and the delay in I&D; a meta- analysis of the currently available data may provide an answer to this question.
|
Quality assessment for single studies and the studies retrieved from the systematic review of Schenker (2012)
Research question: Binnen welke termijn dient het debridement te worden uitgevoerd na een open (Gustilo I – III) crurisfractuur, om complicaties en vooral infecties te voorkomen?
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? |
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Bednar (1993) |
Probably yes
|
Definitely yes
|
Probably yes |
No information
|
Probably no |
Probably yes |
Probably yes |
No information |
Some concerns |
|
Sungaran (2007) |
Probably yes
|
Definitely yes
|
Probably yes |
No information
|
Probably no
|
Probably yes
|
Probably yes
|
No information
|
Some concerns
|
|
Tripuraneni (2008) |
Definitely yes |
Definitely yes
|
Probably yes
|
Probably yes
|
Probably no |
Probably yes
|
Probably yes
|
No information
|
Some concerns |
|
Li (2020)
|
Probably yes
|
Definitely yes
|
Probably yes
|
No information |
No information
|
Probably yes
|
Probably yes |
No information |
Some concerns
|
|
Nobert (2016)
|
Definitely yes |
Definitely yes
|
Probably yes |
No information
|
No information |
Probably yes
|
Probably yes
|
No information
|
Some concerns
|
|
Kamat (2011)
|
Probably yes
|
Definitely yes |
Probably yes
|
No information |
No information |
Probably yes |
No information
|
No information
|
Some concerns
|
|
Konbaz (2019)
|
Definitely yes |
Definitely yes
|
Probably yes
|
No information
|
No information
|
Probably yes
|
No information
|
No information
|
Some concerns
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Al-Hilli (2010) |
Wrong study population. |
|
Arti (2012) |
Wrong study population. |
|
Fernandes (2015) |
Wrong outcomes. |
|
Johal (2021) |
Wrong study population. |
|
Pollak (2010) |
Wrong comparison of interventions. |
|
Reuss (2007) |
Wrong comparison of interventions. |
|
Kindsfater (1995) |
Wrong comparison of interventions. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-04-2024
Beoordeeld op geldigheid : 02-10-2023
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met een letsel na een ongeval.
Deze module is herzien binnen het cluster letsel na ongeval. Het cluster letsel na ongeval bestaat uit twaalf richtlijnen. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. De samenstelling van de clusterstuur- en expertisegroep is als volgt:
Clusterstuurgroep
- Dhr. dr. M.F. Termaat, chirurg, Leids Universitair Medisch Centrum, Leiden; NVvH (voorzitter)
- Dhr. drs. H. Amghar, radioloog, Saxenburgh Medisch Centrum, Hardenberg; NVvR
- Mevr. E.C. Cingir – Doganer, junior projectmanager, Stichting Kind en Ziekenhuis, Utrecht
- Dhr. dr. G.J. van Geffen, anesthesioloog, Radboudumc, Nijmegen; NVA
- Dhr. drs. R.P.T.C.G. Groetelaers, chirurg, Maxima Medisch Centrum, Eindhoven; NVvH
- Dhr. dr. T. de Jong, plastisch chirurg, Radboudumc, Nijmegen; NVPC
- Dhr. dr. J. van Oldenrijk, orthopedisch chirurg, Erasmus MC, Rotterdam; NOV
- Dhr. prof. dr. V.A. de Ridder, chirurg, Wilhelmina Kinderziekenhuis, Utrecht; NVvH
- Dhr. dr. J.P.H.J. Rutges, orthopedisch chirurg, Erasmus MC, Rotterdam; NOV
- Mevr. A. Swinkels, junior projectmanager en beleidsmedewerker, Stichting Kind & Ziekenhuis, Utrecht (vervanger van mevr. Doganer tijdens zwangerschapsverlof)
- Mevr. drs. P.V. ter Wengel, neurochirurg, Haaglandenmc, Den Haag; NVvN
- Dhr. drs. H.H. Wijnen, klinisch geriater, Rijnstate, Arnhem; NVKG
- Mevr. dr. S. Woltz, chirurg, Spaarne Gasthuis, Haarlem; NVvH
- Dhr. dr. G. Zemack, revalidatiearts, Libra Revalidatie & Audiologie, Eindhoven; VRA
- Dhr. prof. dr. J.N. Doornberg, orthopedisch chirurg, Universitair Medisch Centrum Groningen, Groningen; NOV (tot november 2021)
- Mevr. R. Uitzinger, junior projectmanager, Stichting Kind en Ziekenhuis, Utrecht (tot juni 2022)
- Mevr. dr. D. Vos, chirurg, Amphia Ziekenhuis, Breda; NVvH (tot januari 2022)
- Dhr. dr. B.P. Vierhout, chirurg, Wilhelmina Ziekenhuis Assen, Assen; NVvH (tot februari 2023)
Clusterexpertisegroep
- Dhr. dr. J. Alexandridis, SEH-arts KNMG; NVSHA
- Dhr. drs. B.F.M. Blok, uroloog, ErasmusMC, Rotterdam; NVU
- Dhr. drs. G.P.G. Boots, bedrijfsarts; NVAB
- Dhr. H.J.G. van den Broek, voorzitter, Osteoporose Vereniging, Haarlem
- Mevr. drs. N.N. Cheung, arts-microbioloog, HAGA ziekenhuis, Den Haag; NVMM
- Dhr. dr. J. Deunk, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Mevr. dr. J.A.M.C. Dirks, arts-microbioloog, Maastricht Universitair Medisch Centrum; NVMM
- Mevr. drs. M.H.G. Dremmen, radioloog, Erasmus MC, Rotterdam; NVvR
- Dhr. dr. A.W.J.M. Glaudemans, nucleair geneeskundige, Universitair Medisch Centrum Groningen, Groningen; NVNG
- Mevr. drs. M. Hartog, AIOS Klinische Geriatrie, Eramsus MC, Rotterdam; NVKG
- Mevr. K.D. den Hertog, gipsverbandmeester, Alrijne Ziekenhuis, Leiden; VGN
- Dhr. dr. D.J. Hofstee, orthopedisch chirurg, Noordwest Ziekenhuisgroep, Alkmaar; NOV
- Mevr. G. Hoitinga, verpleegkundige, Amsterdam UMC, Amsterdam; NVSHV
- Dhr. dr. H.R. Holtslag, revalidatiearts, Amsterdam UMC, Amsterdam; VRA
- Dhr. dr. J. Hoogendoorn, chirurg, Haaglanden MC, den Haag; NVvH
- Dhr. M.J.M. Hospers, ambulance verpleegkundige, V&VN, Utrecht
- Dhr. D.J.W. Hulsen, klinisch fysicus, Jeroen Bosch Ziekenhuis, ‘s Hertogenbosch; NVKF
- Dhr. drs. D. van Iersel, radioloog, VieCuri Medisch Centrum, Venlo; NVvR
- Dhr. T. Jonkergouw, adviseur patiëntenbelangen, Patiëntenfederatie Nederland, Utrecht
- Mevr. V. Kleijn-Vis, physician assistant (trauma)chirurgie, Francisus Gasthuis & Vlietland, Rotterdam; NAPA
- Mevr. S.K. Koster †, handtherapeut, Alrijne Ziekenhuis, Leiden; NVHT
- Dhr. dr. N.D. Kruyt, neuroloog, Leids Universitair Medisch Centrum, Leiden; NVN
- Dhr. dr. C. van der Leij, radioloog, Maastricht Universitair Medisch Centrum, Maastricht; NVvR
- Dhr. dr. M.P.A. van Meer, arts-microbioloog, Rijnstate, Arnhem; NVMM
- Mevr. dr. B.L. van Meer, sportarts, St Antonius Ziekenhuis, Nieuwegein; VSG
- Dhr. dr. B. van Minnen, kaakchirurg, Universitair Medisch Centrum Groningen, Groningen; NVMKA
- Dhr. dr. F.C. Öner, orthopedisch chirurg, Universitair Medisch Centrum Utrecht, Utrecht; NOV
- Dhr. F. Penninx, Dwarslaesie Organisatie Nederland, Nijkerk
- Dhr. dr. M.C.G. van der Poll, chirurg-intensivist, Maastricht Universitair Medisch Centrum, Maastricht; NVIC
- Dhr. dr. H. Rakhorst, plastisch chirurg, Medisch Spectrum Twente, Enschede; NVPC
- Mevr. drs. M.J. Scheerder, radioloog, Amsterdam UMC, Amsterdam; NVvR
- Dhr. drs. H. Scheper, internist, Leids Universitair Medisch Centrum, Leiden; NIV
- Dhr. drs. J. van Schuppen, radioloog, Amsterdam UMC, Amsterdam; NVvR
- Dhr. R.R. Smit Duijzentkunst, bestuurslid, Korter maar Krachtig, Enschede
- Dhr. I. Spin, medior medewerker kwaliteit, KNGF, Amersfoort
- Dhr. drs. R.S. de Wijn, plastisch chirurg, Spaarne Gasthuis, Haarlem; NVPC
- Dhr. drs. M.J. Elzinga, chirurg, Medisch Centrum Leeuwaarden, Leeuwarden; NVvH (tot november 2022)
Met ondersteuning van
- M. Griekspoor, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur en teamleider, Kennisinstituut van de Federatie Medisch Specialisten
- A.L.J. Kortlever – van der spek, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
Tabel 1. Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Termaat (voorzitter) |
|
|
Geen
|
Geen restricties |
|
Amghar |
|
Geen |
Geen
|
Geen restricties |
|
Doganer |
|
Geen |
Geen
|
Geen restricties |
|
van Geffen |
|
Geen |
Geen
|
Geen restricties |
|
Groetelaers |
|
|
Geen
|
Geen restricties |
|
de Jong |
|
|
Geen |
Geen restricties |
|
van Oldenrijk |
|
|
Geen
|
Geen restricties |
|
de Ridder |
|
(Alle genoemde nevenwerkzaamheden zijn onbetaald.)
|
Geen
|
Geen restricties |
|
Rutges |
|
|
Extern gefinancierd onderzoek:
Organiseren van AO spine events in Nederland. |
Geen restricties |
|
Swinkels |
|
Geen |
Geen
|
Geen restricties |
|
Ter Wengel |
|
|
Persoonlijke financiële belangen:
Persoonlijke relaties:
Extern gefinancierd onderzoek:
|
Geen restricties; geen relatie tussen extern gefinancierd onderzoek en de te herziene modules |
|
Wijnen |
|
Geen |
Overige belangen:
|
Geen restricties; er is geen relatie tussen het bedrijf en de te herziene modules. |
|
Woltz |
|
|
Geen
|
Geen restricties |
|
Zemack |
|
|
Geen
|
Geen restricties |
|
Doornberg (per november 2021 gestopt)
|
|
Geen |
Geen
|
Geen restricties |
|
Uitzinger (per juni 2021 gestopt) |
|
Geen |
Geen
|
Geen restricties |
|
Vierhout (per februari 2023 gestopt) |
|
|
Extern gefinancierd onderzoek:
|
Geen restricties; geen relatie tussen extern gefinancierd onderzoek en de te herziene modules. |
|
Vos (per januari 2022 gestopt) |
|
|
Geen |
Geen restricties |
Richtlijn Open onderbeenfractuur:
- Module ‘Debridement’
- Module ‘Weke delenletsel bij open onderbeenfractuur’
- Module ‘Timing weke delen behandeling bij open onderbeenfractuur’
(Vanuit de stuurgroep waren dhr. Vierhout en dhr. de Jong betrokken om het perspectief van de stuurgroep te vertegenwoordigen.)
Tabel 3. Gemelde (neven)functies en belangen expertisegroep modules richtlijn Open onderbeenfractuur
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Alexandridis |
|
|
Geen |
Geen restricties |
|
Hartog |
|
|
Geen |
Geen restricties |
|
Hofstee |
|
Geen |
Geen |
Geen restricties |
|
Holtslag |
|
|
Geen |
Geen restricties |
|
Hoogendoorn |
|
Geen |
Geen |
Geen restricties |
|
van Meer |
|
Geen |
Geen |
Geen restricties |
|
Rakhorst |
|
|
Intellectuele belangen en reputatie:
|
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de participatie van Stichting Kind en Ziekenhuis in de stuurgroep en diverse organisaties in de expertisegroep (zie samenstelling van de stuur- en expertisegroep). De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens te commentaar voorgelegd aan alle patiëntenorganisaties in de stuur- en expertisegroep. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Tabel 4. Uitkomsten kwalitatieve raming
|
Module |
Uitkomst raming |
Toelichting |
|
Module ‘Debridement’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten). De aanbevelingen zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module ‘Weke delenletsel bij open onderbeenfractuur’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten). De aanbevelingen zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module ‘Timing weke delen behandeling bij open onderbeenfractuur’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten). De aanbevelingen zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (april, 2021) inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd, zie onderstaande tabel.
Tabel 5. Partijen need-for-update.
|
Partijen need-for-update |
||
|
Nederlands Huisartsen Genootschap |
Nederlandse Vereniging voor Handchirurgie |
Patiëntenvereniging Complex Regionaal Pijn Syndroom
|
|
Revalidatie Nederland |
Ambulancezorg Nederland
|
Inspectie Gezondheidszorg en Jeugd
|
|
Nederlandse Vereniging voor Kindergeneeskunde
|
Nederlands Vereniging van Rugpatiënten de ‘Wervelkolom’
|
Nederlandse Federatie van Universitair Medische Centra
|
|
Nederlandse Vereniging van Ziekenhuizen |
Samenwerkende Topklinische Ziekenhuizen
|
Zorginstituut Nederland |
|
Zelfstandige Klinieken Nederland |
Zorgverzekeraars Nederland
|
Vereniging van Specialisten Ouderengeneeskunde
|
|
Ergotherapie Nederland |
Nederlands Instituut van Psychologen |
Nederlandse Wetenschappelijke Vereniging voor Seksuologie |
|
Nederlandse Vereniging van Diëtisten |
Nederlandse Vereniging voor Arthroscopie
|
Nederlandse Vereniging voor Reumatologie |
|
Nederlandse Vereniging van Ziekenhuisapothekers |
Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose |
Nederlandse Vereniging van Anesthesiemedewerkers |
|
Reumafonds |
ReumaZorg Nederland |
|
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die uit de need-for-update naar voren kwamen zijn besproken en geprioriteerd door leden van de stuur- en expertisegroep.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd zo nodig gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Hultcrantz, 2017; Schünemann, 2013).
Tabel 6. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 7. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd ter commentaar voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd voorgelegd ter autorisatie aan de partijen die beschreven staan onder het kopje geldigheid en onderhoud (zie verantwoording).
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Richtlijn: Open onderbeenfracturen |
|
|
Uitgangsvraag: Wanneer dient het debridement te worden uitgevoerd om complicaties en met name infecties te voorkomen? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 20-05-2022 |
|
Periode: >2010 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Laura Boerboom |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen open onderbeenfractuur (in het blauw) en debridement (in het groen).
à De twee genoemde sleutelartikelen (Helbig (2018) en Gustilo (1990)) zitten niet in de zoekopbrengst. Het artikel van Helbig (2018) valt eruit op studiedesign (het studiedesign wordt niet beschreven in het abstract), en het artikel van Gustilo (1990) valt eruit op publicatiejaar.
à Resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 20-05-2022 met relevante zoektermen gezocht vanaf 2010 naar systematische reviews, RCT’s en observationele studies over wanneer het debridement dient te worden uitgevoerd om complicaties en met name infecties te voorkomen. De literatuurzoekactie leverde 391 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
28 |
30 |
35 |
|
RCTs |
31 |
58 |
39 |
|
Observationele studies |
268 |
206 |
317 |
|
Totaal |
327 |
294 |
391 |
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Fractures, Open/ or ((open or 'long-bone' or tibia* or 'lower limb') adj3 fracture*).ti,ab,kf. (23895) 2 exp *Debridement/ or debridement.ti,ab,kf. (30075) 3 1 and 2 (1354) 4 limit 3 to yr="2010-Current" (781) 5 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (565356) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2258460) 7 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5156497) 8 4 and 5 (30) – SRs 9 (4 and 6) not 8 (58) - RCTs 10 (4 and 7) not 8 not 9 (206) – Observationele studies 11 8 or 9 or 10 (294) |