IUI+MOH versus IVF bij onverklaarde subfertiliteit
Uitgangsvraag
Aanbeveling
Behandel vrouwen met onverklaarde subfertiliteit < 38 jaar en een spontane zwangerschapskans kleiner dan 30% primair met IUI+MOH.
Voor behandeling van vrouwen van 38 jaar of ouder met onverklaarde subfertiliteit: zie module IVF bij vrouwen vanaf 38 jaar (link toevoegen).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het is niet aangetoond dat vrouwen met onverklaarde subfertiliteit met IUI+MOH een andere kans op een levendgeboren kind of een meerlingzwangerschap hebben dan met IVF. De werkgroep adviseert IUI+MOH als primaire behandeling voor vrouwen met onverklaarde subfertiliteit en een lage prognose op een spontane zwangerschap. De drie onderzoeken hebben alleen vrouwen met onverklaarde subfertiliteit jonger dan 38 jaar geïncludeerd.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het doel vanuit medisch oogpunt van behandeling van vrouwen met onverklaarde subfertiliteit en een lage prognose op een spontane zwangerschap is de kans op een doorgaande zwangerschap of levendgeboren kind te vergroten en daarmee niet het aantal meerlingen te vergroten. Hoewel veel vrouwen de nadelen van meerlingzwangerschappen herkennen, is vanuit het oogpunt van de patiënt niet altijd negatief als er een meerlingzwangerschap ontstaat. Hier zijn soms de verlangens van de patiënt strijdig met het streven van de arts. In de bestaande literatuur hebben we aanwijzingen dat IUI+MOH en IVF voor deze vrouwen dezelfde zwangerschapskansen geeft. Daarbij geen verschil in meerling risico tussen de twee behandelingen. IVF is meer invasief dan IUI+MOH.
Kosten (middelenbeslag)
Aangaande de kosteneffectiviteit, is het niet kosteneffectief om vrouwen met een subfertiliteit en een lage prognose op een spontane zwangerschap primair te behandelen met IVF.
De kosten van IVF zijn hoger dan IUI-MOH met dezelfde zwangerschapskansen. Of IVF kosteneffectief is, is afhankelijk van hoeveel de samenleving bereid is om te betalen voor een extra gezond kind.
Haalbaarheid en implementatie
Niet van toepassing.
Onderbouwing
Achtergrond
Bij onverklaarde subfertiliteit en een lage spontane kans op zwangerschap, < 30% volgens het model van Hunault (Hunault, 2005), wordt gestart met Intra-Uteriene Inseminatie + milde ovariële hyperstimulatie (IUI+MOH). Uit de studie van Bensdorp blijkt namelijk dat de kans op zwangerschap bij deze groep in 6 cycli groter is dan de kans op zwangerschap bij een langer expectatief beleid (Bensdorp, 2015). De vraag is of de kans op zwangerschap hoger is als meteen zou worden gestart met IVF en wat de kosteneffectiviteit is.
Conclusies / Summary of Findings
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in het krijgen van een levendgeboren kind bij behandeling met IUI+MOH in vergelijking met IVF bij vrouwen met onverklaarde subfertiliteit.
Bronnen: (Pandian, 2015; Nandi, 2017) |
|
Laag GRADE |
IVF lijkt te resulteren in meer klinische zwangerschappen in vergelijking met IUI+MOH bij vrouwen met onverklaarde subfertiliteit.
Bronnen: (Pandian, 2015; Nandi, 2017) |
|
Laag GRADE |
IVF is niet kosteneffectief in vergelijking met IUI+MOH bij vrouwen met onverklaarde subfertiliteit.
Bronnen: (Tjon-Kon-Fat, 2015; Nandi, 2017) |
|
Laag GRADE |
Er lijkt geen verschil te zijn in het aantal meerlingen bij behandeling met IUI+MOH in vergelijking met IVF bij vrouwen met onverklaarde subfertiliteit.
Bronnen: (Pandian, 2015; Nandi, 2017) |
Samenvatting literatuur
Beschrijving studies
Pandian (2015) verrichtte een systematische review naar de effectiviteit en veiligheid van IVF vergeleken met verschillende behandelingen, waaronder IUI met milde ovariële hyperstimulatie. In mei 2015 werd gezocht naar RCT’s naar het effect van in vitrofertilisatie (IVF) versus afwachtend beleid, alleen IUI of IUI met milde ovariële hyperstimulatie bij koppels met onverklaarde subfertiliteit of minimale endometriose met subfertiliteit. De spontane zwangerschapskans wordt niet beschreven. Er werd gezocht in Medline, Embase, CENTRAL, PsychoInfo, Evidence-based medicine (EBM) Reviews en CINAHL. Primaire uitkomstmaten was levendgeboorte, secundaire uitkomstmaten waren onder andere zwangerschap en meerlingzwangerschap. Zwangerschap werd gedefinieerd als klinische zwangerschap, waarbij er sprake was van foetale hartactiviteit op de echo (geen termijn benoemd). Er werden acht studies geïncludeerd, waarvan vijf RCT’s met in totaal 480 vrouwen die IVF vergeleken met IUI met MOH (stimulatie in 4 studies met gonadotropines en in 1 studie met clomifeen). Voor zowel IVF als de IUI behandeling varieerde het aantal cycli tussen 1 en 6. Besloten werd om de studie van Reindollar (2010), geïncludeerd in de meta-analyse van Pandian (2015), in de nieuwe meta-analyse niet mee te nemen, omdat in deze studie beide groepen IUI + MOH (clomifeencitraat) ondergingen voordat ze gerandomiseerd werden naar de IUI of IVF-groep.
Nandi (2017) verrichtte een RCT in een enkel perifeer ziekenhuis in de UK waarbij een 3 cyclus IUI behandeling met milde ovariële hyperstimulatie met gonadotropines vergeleken werd met 1 cyclus IVF. Er werden 101 koppels gerandomiseerd naar de IUI+MOH-groep (mediane leeftijd vrouwen 32, IQR 30 tot 35) en 106 koppels naar de IVF-groep (mediaan leeftijd vrouwen 32,5, IQR 30 tot 35). Koppels hadden een primaire of secundaire subfertiliteit met een duur van minimaal 1 jaar.
Tjon-Kon-Fat (2015) verrichtte een economische evaluatie van de RCT van Bensdorp (2015), welke werd geïncludeerd in de systematische review van Pandian (2015). In deze RCT werden 2 verschillende IVF-behandelingen vergeleken met IUI met MOH. Vrouwen met een leeftijd tussen 18 en 38 jaar werden geïncludeerd, die een spontane zwangerschapskans van minder dan 30% hadden op basis van het model van Hunault. In totaal werden 102 vrouwen gerandomiseerd naar 3 cycli IVF-SET (terugplaatsing van enkel embryo), 194 vrouwen naar IVF-MNC (milde gestimuleerde of gemodificeerde natuurlijke cyclus) en 207 vrouwen naar de IUI+MOH.
Resultaten
1. Levendgeborenen
De resultaten van Nandi (2017) werden toegevoegd aan de meta-analyses van Pandian (2015). Er werden subgroep analyses gedaan voor MOH met gonadotropines en clomifeencitraat.
Er was geen statistisch significant verschil in het aantal levendgeborenen tussen de IUI+MOH en IVF-groep (gepoold RR 1,21; 95% BI 0,98 tot 1,49) (figuur 1). Ook in de subgroep analyses was er geen statistisch significant verschil in het aantal levendgeborenen, namelijk een gepoold relatief risico (RR) in 5 studies van 1,11 (95% BI 0,95 tot 1,30) voor gonadotropines en een RR in 1 studie van 2,04 (95% BI 0,96 tot 4,34) voor clomifeencitraat.
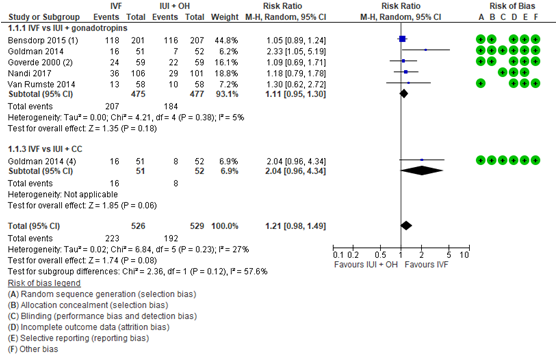
Figuur 1 Aantal levendgeborenen vergelijking IVF versus IUI+MOH
2. Doorgaande zwangerschappen
Doorgaande zwangerschappen werd in de systematische review van Pandian (2015) gedefinieerd als het aantal klinische zwangerschappen. Klinische zwangerschap werd daarbij gedefinieerd als verschijnen van foetale hartactiviteit op de echo, waarbij geen termijn benoemd.
In de groep die behandeld werd met IVF was er een statistisch significant en klinisch relevant verschil in het aantal klinische zwangerschappen, het gepoolde relatief risico was 1,58 ten gunste van IVF (95% BI 1,05 tot 2,36) (figuur 2). In de subgroep analyses voor clomifeencitraat was er, gebaseerd op 1 studie, een significant en klinisch relevant verschil in het relatief risico op klinische zwangerschappen van 2,83 (95%% BI 1,47 tot 5,46) in het voordeel van IVF. In de subgroep analyse voor gonadotropines was er geen verschil in het aantal klinische zwangerschappen (RR 1,37; 95% BI 0,95 tot 1,98).
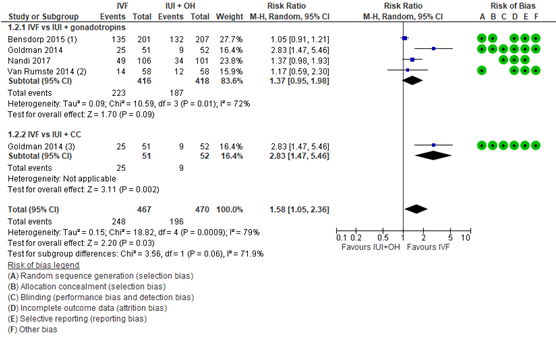
Figuur 2 Aantal klinische zwangerschappen vergelijking IVF versus IUI+MOH
3. Kosteneffectiviteit
In Pandian (2015) werden kosten of kosteneffectiviteit niet als uitkomstmaat gerapporteerd. In de publicatie van Tjon-Kon-Fat (2015) wordt echter een kosteneffectiviteitsanalyse gedaan op een RCT (Bensdorp, 2015) geïncludeerd in Pandian. De kosteneffectiviteitsanalyse werd gedaan vanuit een gezondheidszorg perspectief, met de focus op directe medische kosten tijdens de behandeling. De gemiddelde kosten 12 maanden na randomisatie waren voor IVF-SET €7187 en voor IUI+MOH €5070. Het gemiddelde kostenverschil tussen deze behandelingen werd geschat op €2117 (95% BI 2519 tot 3754), in het voordeel van IUI+MOH. De incrementele kosteneffectiviteit ratio (ICER), de ratio tussen de verschillen in kosten en de verschillen in effect tussen de 2 behandelingen, was €43.375. Dit is een inschatting van de additionele kosten die nodig zijn om 1 extra gezond kind in de IVF-SET groep te verwezenlijken, vergeleken met de IUI+MOH groep. De kosteneffectiviteit hangt af van de bereidheid om te betalen (willingness-to-pay). Als men bereid is om €60.000 te betalen voor een extra gezond kind, dan is er 62% kans dat IVF kosteneffectief is, maar als men bereid is €135.000 te betalen dan is er 81% kans dat IVF kosteneffectief is. Tjon-Kon-Fat concludeert dat er geen bewijs is om IVF als eerstelijnsbehandeling aan te raden bij koppels met onverklaarde subfertiliteit.
Nandi (2017) deed geen volledige kosteneffectiviteitsanalyse, maar maakte een vergelijking van de kosten van de twee behandelingen. De per-protocol analyse werd gebruikt om de kosten per levendgeborene te berekenen. De kostenratio van IUI/IVF (1:1.3) was hoger voor 1 cyclus van IVF vergeleken met 3 cycli van IUI. De kosten per levendgeborene was gemiddeld £8.167 (omgerekend €9174) in de IUI+MOH groep en gemiddeld £10.560 (omgerekend €11.863) in de IVF-groep. Bij de interpretatie hiervan moet wel rekening gehouden worden met het feit dat deze studie in de UK werd uitgevoerd en daar mogelijk andere tarieven gelden dan in Nederland, waardoor deze bedragen niet zomaar geëxtrapoleerd kunnen worden naar de Nederlandse situatie.
4. Meerlingen
Er was geen statistisch significant verschil in het aantal meerlingen tussen de IUI+MOH en IVF groep (gepoold RR 0,81; 95% BI 0,52 tot 1,26) (figuur 3). Ook in de subgroep analyses voor gonadotropines (RR 0,79; 95% BI 0,50 tot 1,26) en clomifeencitraat (RR 1,02; 95% BI 0,22 tot 4,82) waren er geen verschillen tussen IUI+MOH en IVF.
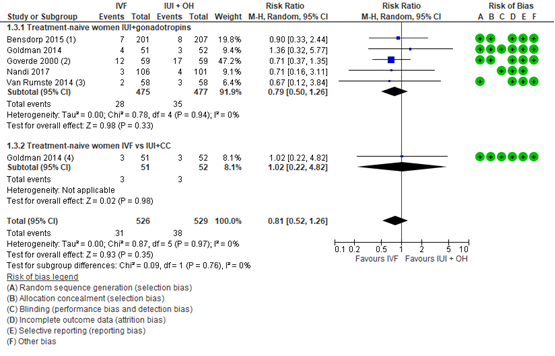
Figuur 3 Aantal meerlingen vergelijking IVF versus IUI+MOH
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat levendgeborenen is met 1 niveau verlaagd omdat het betrouwbaarheidsinterval de grens voor geen verschil tussen de interventies en de bovengrens voor klinische besluitvorming overschrijdt (imprecisie).
De bewijskracht voor de uitkomstmaat doorgaande zwangerschappen, gedefinieerd als klinische zwangerschappen, is met 2 niveaus verlaagd vanwege de surrogaatuitkomst en omdat de betrouwbaarheidsintervallen nauwelijks overlappen en de waarde van I2 hoog is (indirectheid).
De bewijskracht voor de uitkomstmaat kosteneffectiviteit is met 2 niveaus verlaagd omdat het gebaseerd is op 1 enkele Nederlandse studie en de effectschatting het nuleffect overlapt (imprecisie).
De bewijskracht voor de uitkomstmaat aantal meerlingen is met 2 niveaus verlaagd omdat het betrouwbaarheidsinterval beide grenzen voor klinische besluitvorming overschrijdt (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de waarde van IUI met milde ovariële hyperstimulatie in vergelijking tot IVF bij vrouwen met onverklaarde subfertiliteit en een spontane zwangerschapskans kleiner dan 30% ten aanzien van de kans op een levendgeborene of doorgaande zwangerschap, de kosteneffectiviteit en het percentage meerlingen?
P: vrouwen met onverklaarde subfertiliteit en een spontane zwangerschapskans kleiner dan 30%;
I: Intra-Uteriene Inseminatie (IUI) met milde ovariële hyperstimulatie (MOH);
C: In vitro fertilisatie (IVF);
O: kans op levendgeborene of doorgaande zwangerschap, kosteneffectiviteit, meerlingen.
Relevante uitkomstmaten
De werkgroep achtte de kans op een levendgeborene een voor de besluitvorming cruciale uitkomstmaat. De werkgroep realiseerde zich dat deze uitkomstmaat zelden gerapporteerd wordt vanwege de benodigde follow-up duur van minimaal 9 maanden en definieerde daarom doorgaande zwangerschap als alternatieve cruciale uitkomstmaat bij afwezigheid van levendgeborenen als uitkomstmaat. Kosteneffectiviteit en meerlingen werden gedefinieerd als voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- Doorgaande zwangerschap: een intacte intra uteriene zwangerschap bij tenminste 12 weken zwangerschapsduur.
- Meerlingzwangerschap: tenminste 2 foetussen, intra uterien, met foetale hartactie bij tenminste 12 weken zwangerschapsduur.
De werkgroep definieerde een verschil van 5% in kans op levendgeborenen en doorgaande zwangerschap na een afgeronde therapie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley)) is op 14 februari 2019 met relevante zoektermen gezocht naar systematische reviews, RCT’s en ander vergelijkend onderzoek voor drie uitgangsvragen (IUI+MOH versus IVF, IUI versus expectatief beleid en optimale aantal IUI behandeling). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde in totaal 344 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews of RCT’s naar de effectiviteit van IUI+MOH in vergelijking met IVF bij vrouwen met onverklaarde subfertiliteit en een spontane zwangerschapskans kleiner dan 30%. Op basis van titel en abstract werden in eerste instantie 28 studies voorgeselecteerd voor de uitgangsvraag over IUI+MOH versus IVF. Na raadpleging van de volledige tekst, werden vervolgens 25 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies definitief geselecteerd.
Resultaten
Drie onderzoeken zijn opgenomen in de literatuuranalyse, waarvan één systematische review (Pandian, 2015) één aanvullende RCT (Nandi, 2017) en een kosteneffectiviteitsanalyse (Tjon-Kon-Fat, 2015). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bensdorp, A. J., Tjon-Kon-Fat, R. I., Bossuyt, P. M. M., Koks, C. A. M., Oosterhuis, G. J. E., Hoek, A., ... & Van Golde, R. (2015). Prevention of multiple pregnancies in couples with unexplained or mild male subfertility: randomised controlled trial of in vitro fertilisation with single embryo transfer or in vitro fertilisation in modified natural cycle compared with intrauterine insemination with controlled ovarian hyperstimulation. Bmj, 350.
- Hunault, C. C., Laven, J. S., van Rooij, I. A., Eijkemans, M. J., te Velde, E. R., & Habbema, J. D. F. (2005). Prospective validation of two models predicting pregnancy leading to live birth among untreated subfertile couples. Human Reproduction, 20(6), 1636-1641.
- Nandi, A., Bhide, P., Hooper, R., Gudi, A., Shah, A., Khan, K., & Homburg, R. (2017). Intrauterine insemination with gonadotropin stimulation or in vitro fertilization for the treatment of unexplained subfertility: a randomized controlled trial. Fertility and sterility, 107(6), 1329-1335.
- Pandian, Z., Gibreel, A., & Bhattacharya, S. (2015). In vitro fertilisation for unexplained subfertility. Cochrane Database of Systematic Reviews, (11).
- Tjon-Kon-Fat, R. I., Bensdorp, A. J., Bossuyt, P. M. M., Koks, C., Oosterhuis, G. J. E., Hoek, A., ... & Van Golde, R. (2015). Is IVF—served two different ways - more cost-effective than IUI with controlled ovarian hyperstimulation?. Human reproduction, 30(10), 2331-2339.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Pandian, 2015 |
SR and meta-analysis of RCTs
Literature search up to May 2015
A: Goverde, 2000 B: Reindollar, 2010 C: Goldman, 2014 D: Van Rumste, 2014 E: Bensdorp, 2015
Study design: RCT (parallel group)
Setting and Country: A: not reported B: not reported C: not reported D: multicentre E: Multicentre, The Netherlands
Source of funding: non-commercial
|
Inclusion criteria SR: RCT’s among couples with unexplained infertility or with minimal endometriosis with subfertility or mild male factor subfertility who have been trying to conceive for one year or longer, IVF, IVF versus expectant management, IVF versus IUI alone, IVF versus IUI plus ovarian stimulation with gonadotropins or clomiphene or letrozole.
Exclusion criteria SR:
5 studies included for IVF versus IUI+OH
Important patient characteristics at baseline:
N, age range A: 181 women (87 IVF, 86 IUI+SO), age NR B: 503 women, 21-39 yrs C: 154 women, 38-43 yrs D: 116 women, ,18-38 yrs E: 602 women, 18-38 yrs
Groups comparable at baseline? |
A: IVF B: conventional pathway involving clomiphene citrate plus intrauterine insemination (CC + IUI) followed by IUI + gonadotropins and then IVF C: IVF D: 1 cycle IVF-eSET, followed by 1 cryocycle E1: IVF-SET, 3 cycles E2: IVF, 6 cycles
|
A1: IUI A2: IUI + ovarian stimulation B: accelerated pathway (CC + IUI followed by 6 cycles of IVF C1: IUI + CC C2: IUI + FSH D: 1 cycle IVF-eSET, followed by 3 cylces of IUI-ovarian stimulation E: IUI-COH, 6 cycles |
End-point of follow-up: A: 6 cycles B: not reported C: not reported D: 4 months E: 12 months
For how many participants were no complete outcome data available? (intervention/control) A: 39/87 (45%) / 19/86 (22%) B: 0 C: 0 D: not reported E: 0
|
1. Pregnancy Defined as live birth rate (LBR)
Effect measure: RR (95% CI): A: 1.09 (0.69 to 1.71) C: 2.33 (1.05 to 5.19) D: 1.30 (0.62 to 2.72) E: 1.05 (0.89 to 1.24)
Pooled effect (random effects model): 1.27 (95% CI 0.95 to 1.70) favoring IVF Heterogeneity (I2): 41%
Defined as clinical pregnancy rate (CPR)
Effect measure: RR (95% CI): C: 2.83 (1.47 to 5.46) D: 1.17 (0.59 to 2.30) E: 1.05 (0.91 to 1.21)
Pooled effect (random effects model): 1.70 (95% CI 0.92 to 3.15) favoring IVF Heterogeneity (I2): 83%
2. Costeffectiveness Not reported
3. Multiple pregnancy Effect measure: RR (95% CI): A: 0.71 (037 to 1.35) C: 1.36 (0.32 to 5.77) D: 0.67 (0.12 to 3.84) E: 0.90 (0.33 to 2.44)
Pooled effect (random effects model): 0.82 (95% CI 0.52 to 1.30) favoring IVF Heterogeneity (I2): 0%
|
Brief description of author’s conclusion: in women who are treatment-naive there is no conclusive evidence of a difference in live birth rates between IVF and IUI + gonadotropins or between IVF and IUI + clomiphene.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: 1. Pregnancy: Defined as LBR: MODERATE Due to serious imprecision (the confidence interval is compatible with no difference between the interventions or with meaningful benefit from IVF).
3. Multiple pregnancy: MODERATE Due to serious imprecision (the confidence interval is compatible with no difference between the interventions or with meaningful benefit in either arm).
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Nandi, 2017 |
Type of study: parallel group RCT
Setting: tertiary referral unit
Country: UK
Source of funding: not reported |
Inclusion criteria: couples with primary or secondary subfertility of ≥1 year. Female partner: 23-37 year, BMI 19-30, regular menstrual cycle of 21-35 days, day 2 FSH <10 IU/L, confirmed bilateral tubes. Male partner: normal semen parameters.
Exclusion criteria: known uterine anomaly, physical disability, having difficulty in achieving vaginal intercourse, couples using donor sperm or previous fertility treatment like IUI of IVF. Confirmed endometriosis of grade II-IV. Self-funded patients.
N total at baseline: Intervention: 101 Control: 106
Important prognostic factors2: Age median (IQR): I: 32 (30-35) yrs C: 32.5 (30-35) yrs
Groups comparable at baseline? yes |
3 cycles of intrauterine insemination (IUI) + controlled ovarian hyperstimulation (COH) with gonadotropins. Daily SC injections of 75 IU FSH, starting from days 2-5 of the menstrual cycle onwards.
|
1 cycle of IVF
|
Length of follow-up: until the end of the time horizon
Loss-to-follow-up: 0 |
1. Pregnancy Defined as live birth rate (LBR)
Effect measure: RR (95% CI): IUI+OH: 29/101 IVF: 36/106 RR 1.18 (0.79 to 1.78)
Defined as clinical pregnancy rate (CPR) IUI+OH: 34/101 IVF: 49/106 RR 1.37 (0.98 to 1.93)
2. Costeffectiveness Cost per live birth IUI+OH: £8167 IVF: £10560
3. Multiple pregnancy IUI+OH: 4/101 IVF: 3/106 RR 0.71 (0.16 to 3.11)
|
|
|
Tjon-Kon-Fat, 2015 |
Type of study: economic evaluation of multicentre RCT
Setting: 17 centres
Country: The Netherlands
Source of funding: non-commercial |
Inclusion criteria: couples with unexplained or mild male subfertility, age of female 18 to 38 years, unfavourable prognosis for natural conception (probability of natural conception within next 12 months >30% calculated with synthesis model of Hunault.
Exclusion criteria: none
N total at baseline: Intervention 1: 201 Intervention 2: 194 Control: 2-7
Important prognostic factors2: Age ± SD: I1: 33 ± 3.39 yrs I2: 33 ± 3.50 C: 34 ± 3.67 yrs
Groups comparable at baseline? yes
|
I1: 3 cycles of IVF-SET plus subsequent frozen embryo transfers I2: 6 cycles of IVF-MNC
|
6 cycles of IUI-COH, according to local protocol with either clomiphene citrate or FSH
|
Length of follow-up: 12 months
Loss-to-follow-up: 6 I1: 2 I2: 3 C: 1
|
1. Pregnancy Defined as live birth
Effect measure: RR (95% CI): IVF-SET: 118/201 IUI-COH: 116/207 RR 1.05 (0.89 to 1.24)
Defined as ongoing pregnancy
Effect measure: RR (95% CI): IVF-SET: 121/201 IUI-COH: 119/207 RR 1.05 (0.89 to 1.23)
2. Costeffectiveness IVF-SET: €7187 IUI-COH: €5070 Mean cost difference: €2117 (95% CI 2519 to 3754)
ICER IVF-SET versus IUI-COH: €43375
3. Multiple pregnancy IVF-SET: 7/201 IUI-COH: 8/207 RR 1.05 (0.91 to 1.21) |
COH = controlled ovarian hyperstimulation MNC = modified natural cycle SET = single embryo transfer |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal. pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Pandian, 2015 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Nandi, 2017 |
Method of randomisation not described in detail: balanced randomization (1:1). Allocation concealment was achieved by using individual, consecutively numbered opaque envelopes |
Unlikely, it appears that patients and investigators cannot foresee assignment |
Unlikely, blinding was not possible due to nature of the intervention, but this is unlikely to affect the outcome of the trial, as the outcome was objective. |
Unlikely, blinding was not possible due to nature of the intervention, but this is unlikely to affect the outcome of the trial, as the outcome was objective. |
Unlikely, not described, but this is unlikely to affect the outcome of the trial, as the outcome was objective. |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematische reviews |
|
|
Gunn 2016 |
Enige studie geïncludeerd voor IUI+gonadotropin versus IVF (Goverde, 2000) ook in Cochrane review Pandian |
|
Tjon-Kon-Fat 2017 |
Protocol for cochrane review |
|
Tjon-Kon-Fat 2016 |
Opinion article |
|
van den Boogaard 2014 |
Secondary analysis of individual patient data. |
|
Nardelli 2014 |
examined the impact of procedural characteristics on the safety or effectiveness of IVF/ICSI |
|
Pandian 2013 |
summary of a meta-analysis recently published in the Cochrane Library (Pandian et al., 2012). |
|
Van den Boogaard 2012 |
study protocol of van den Boogaard 2014 |
|
Pandian 2012 |
Updated by Pandian in 2015 |
|
Verhulst 2006 |
No comparison with IVF |
|
Pandian 2005 |
Updated by Pandian in 2015 |
|
Pandian 2003 |
Updated by Pandian in 2015 |
|
Pandian 2002 |
Updated by Pandian in 2015 |
|
Bhattacharya 2010 |
Very broad question. Only Pandian 2009 included for IUI versus IVF |
|
Mogelijke RCT's |
|
|
Van Rumste 2014 |
Explorative study about costs of IVF and IUI |
|
Goldman 2014 |
Included in Pandian 2015 |
|
Elzeiny 2014 |
Included in Pandian 2015 |
|
Custers 2011 |
Included in Pandian 2015 |
|
Reindollar 2010 |
Included in Pandian 2015 |
|
Bensdorp 2009 |
Study protocol of INeS study |
|
NAME 2006 |
No primary research |
|
NAME 2004 |
summary of treatment for unexplained infertility, no systematic search |
|
Homburg 2003 |
No primary research |
|
Bensdorp 2015 |
Included in Pandian 2015 |
|
Mogelijke diverse designs |
|
|
Wister 2012 |
Retrospective analysis of women who underwent treatment |
|
Roya 2010 |
Couples with unexplained and mild male factor infertility. No randomization (patients could choose treatment) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 13-08-2020
Beoordeeld op geldigheid : 13-08-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Regiehouder(s)[1] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijnmodule[2] |
Frequentie van beoordeling op actualiteit[3] |
Wie houdt er toezicht op actualiteit[4] |
Relevante factoren voor wijzigingen in aanbeveling[5] |
|
NVOG |
2020 |
2025 |
5 jaar |
NVOG |
Nieuwe evidence beschikbaar |
De andere aan deze richtlijnmodule deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
[1] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[2] Maximaal na vijf jaar
[3] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[4] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[5] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De richtlijn is ontwikkeld in samenwerking met de V&VN (Verpleegkundigen & Verzorgenden Nederland).
Samenstelling werkgroep
Werkgroep
- Dr. H.R. (Harold) Verhoeve, gynaecoloog, werkzaam in het OLVG te Amsterdam, NVOG (voorzitter)
- Dr. G.J.E. (Jur) Oosterhuis, gynaecoloog, werkzaam in het St. Antonius ziekenhuis te Utrecht, NVOG
- Dr. G. (Gijs) Teklenburg, gynaecoloog, werkzaam in het Isala ziekenhuis te Zwolle, NVOG
- Dr. A. (Astrid) Cantineau, gynaecoloog, werkzaam in het UMCG te Groningen, NVOG
- Dr. A.M. (Anna) Musters, gynaecoloog, werkzaam in het Meander MC te Amersfoort, NVOG
- Dr. M.J. (Marleen) Nahuis, gynaecoloog, werkzaam bij Noordwest Ziekenhuisgroep, NVOG
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, werkzaam in het Reinier de Graaf Gasthuis te Delft, NVKC
- Dr. K.A. (Kimiko) Kleiman-Broeze, fertiliteitsarts, werkzaam in het Flevoziekenhuis te Almere, VVF (Vereniging voor Fertiliteitsartsen)
- J. (Jose) Knijnenburg, Freya
Klankbordgroep
- Dr. J. (Jannie) van Echten-Arends, klinisch embryoloog, werkzaam bij het UMCG te Groningen, KLEM (Vereniging voor Klinische Embryologie)
- Dr. K.C. (Koen Cornelis) van Zomeren, klinisch embryoloog i.o., werkzaam bij het UMCG te Groningen, KLEM (Vereniging voor Klinische Embryologie)
- Mw. C. (Corina) van Houtum-van Mol, fertiliteitsverpleegkundige, werkzaam in het ETZ te Tilburg, V&VN-VOG
Met ondersteuning van
- Dr. I.M. Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Verhoeve* |
Gynaecoloog, OLVG |
Geen |
Lid adviesraad Ferring BV. |
Geen actie. Medicamenten van genoemd bedrijf vallen buiten scope van de modules (IUI). Betrokkene participeert vanwege specifieke expertise op het gebied van voortplantingsgeneeskunde. |
|
Horst |
Klinisch chemicus |
Geen |
Geen |
Geen actie |
|
Cantineau |
Gynaecoloog subspecilialist voortplantingsgeneeskunde 1.0 fte werkzaam in umcg |
Associate editor Human reproduction onbetaald |
Geen |
Geen actie |
|
Teklenburg |
Gynaecoloog subspecilialist voortplantingsgeneeskunde 1.0 fte werkzaam in Isala Zwolle |
Geen |
Mede-ontwikkelaar zwanger worden app |
Geen actie |
|
Knijnenburg |
Directeur - Freya, vereniging voor mensen met vruchtbaarheidsproblemen - 80% |
nee |
Dienstverband bij de patiëntenvereniging op het gebied van de richtlijn. Deelname vanuit patiëntenperspectief aan: Directeur bij patiëntenorganisatie. De patiëntenvereniging ontvangt sponsoring van enkele bedrijven; dit is reeds publiek bekend |
Geen actie, gezien patiëntvertegenwoordiging niet meeschrijft aan teksten. |
|
Broeze |
Fertiliteitsarts Flevoziekenhuis Almere |
Geen |
Geen |
Geen actie |
|
Echten-Arends |
Klinisch Embryoloog Voortplantingsgeneeskunde bij het Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie |
|
Zomeren |
Klinisch Embryoloog i.o. Voortplantingsgeneeskunde bij het Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie |
|
Houtum |
Fertiliteitsverpleegkundige ETZ, Tilburg |
Algemeen bestuurslid V&VN-VOG, vacatiegeld |
Geen |
Geen actie |
|
Musters |
Gynaecoloog Meander MC |
Voortgangstoetscommissie |
Geen |
Geen actie |
|
Oosterhuis |
Gynaecoloog en subspecialist voortplantingsgeneeskunde St. Antonius ziekenhuis Utrecht |
Secretaris en penningmeester Stichting Automatisering Fertiliteit (onbetaald) |
Lid adviesraad Merck |
De belangen zijn besproken. Betrokkene participeert vanwege specifieke expertise op het gebied van voortplantingsgeneeskunde. In de modules worden geen merknamen genoemd. |
|
Nahuis |
Gynaecoloog Noordwest ziekenhuisgroep Alkmaar |
Geen |
Geen |
Geen actie |
*Voorzitter werkgroep
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vertegenwoordigers van de Vereniging voor Fertiliteitsartsen en Freya af te vaardigen in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de modules in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is er een schriftelijke knelpunteninventarisatie gedaan in oktober 2018.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze modules is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptmodules werden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Little johns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/werkwijze/richtlijnen_3_0.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – februari 2019
|
1 (exp Infertility/ and unexplained. ti, ab, kw.) or ((subfertil* or infertil*) adj4 unexplained). ti, ab, kw. (2461) 2 (exp Insemination, Artificial/ and (intrauterine or 'intra uterine'). ti, ab, kw.) or ('intrauterine insemination*' or 'intra uterine insemination*' or iui). ti, ab, kw. (3059) 3 1 and 2 (449) 4 limit 3 to (english language and yr="2000 -Current") (296) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (383498) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1822802) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3116211) 8 4 and 5 (39) 9 4 and 6 (162) 10 4 and 7 (164) 11 8 or 9 or 10 (250)
= 250 (249 uniek) |
344 |
|
Embase (Elsevier) |
('intrauterine insemination'/exp OR 'intrauterine insemination*’: ab, ti OR 'intra uterine insemination*’: ab, ti OR iui: ab, ti)
AND ('unexplained infertility'/exp OR ((unexplained NEAR/4 (infertil* OR subfertil*)): ab, ti))
AND (english)/lim AND (2000-2019)/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 301 (297 uniek) |
