Postoperatieve oefentherapie HNP
Uitgangsvraag
Wat is de waarde van postoperatieve oefentherapie na een chirurgische ingreep voor HNP?
Aanbeveling
Verwijzing voor oefentherapie direct na de operatie van een HNP hoeft in de meeste gevallen niet plaats te vinden.
Verwijzing valt te overwegen bij patiënten die na zes weken nog klachten hebben of nog niet op hun oude niveau functioneren en bij patiënten met bewegingsarmoede of -angst.
Researchaanbeveling
Onderzoek naar de waarde van bewegingstherapie na een operatie vanwege HNP is aan te bevelen. Hierbij moet zorggedragen worden voor uniforme definitie van de soort behandeling.
Overwegingen
Onderzoek naar de fysiotherapeutische begeleiding na een operatie kent een grote diversiteit. Dit heeft te maken met niet eenduidige definities van behandelvormen en bemoeilijkt de interpretatie van dit onderzoek. Tezamen met de kleine aantallen patiënten leidt de grote heterogeniteit tot conclusies van lage tot zeer lage bewijskracht waarbij de klinisch relevantie ontbreekt. Het is van belang om de patiëntvoorkeuren mee te nemen in het bespreken van specifieke vormen van oefeningen en oefentherapie. De werkgroep acht het van belang dat patiënten kort na de operatie informatie ontvangen over welke oefeningen en bewegingen men mag uitvoeren.
De werkgroep is op de hoogte van een in Nederland uitgevoerde RCT naar oefentherapie na een HNP operatie. Deze studie is inmiddels gepubliceerd (Oosterhuis, 2017), echter was het niet meer mogelijk om de resultaten te verwerken in de literatuuranalyse. De werkgroep heeft ervoor gekozen de studie in de overwegingen te beschrijven en beveelt aan om tijdens een eventuele herziening van deze module de studie van Oosterhuis, als sleutelpublicatie aan te merken en mee te nemen in de literatuuranalyse. De conclusie van deze studie, waarin tevens een economische evaluatie is uitgevoerd, was dat verwijzing naar vroege oefentherapie na een HNP operatie niet effectiever en niet kosten-effectiever was dan geen verwijzing.
Onderbouwing
Achtergrond
De waarde van oefentherapie na een chirurgische ingreep voor HNP is niet duidelijk. Was het vroeger min of meer gestandaardiseerd beleid vanuit gewoonte, tegenwoordig wordt een groter áppel gedaan op de zelfbeoordeling door en motivatie van de patiënt. Een duidelijk onderzoek die de meerwaarde van de postoperatieve therapie of juist het weglaten daarvan is niet voorhanden. Door het ontbreken van eenduidig bewijs en daarmee adviezen ontstaat praktijkvariatie. Dit is een belangrijke reden waarom de werkgroep denkt hier specifieke aandacht te moeten hebben. De literatuur wordt op een tevoren geschetste wijze geanalyseerd en beoordeeld. Dit moet leiden tot eenduidige adviezen.
Conclusies / Summary of Findings
Vergelijking 1
1.1
Zeer laag GRADE |
Oefentherapie vanaf de dag na de operatie leidt niet tot klinisch relevant minder pijn op de korte termijn dan helemaal geen oefentherapie.
Bronnen (Ozkara, 2015; Ju, 2012) |
1.2
Zeer laag GRADE |
Oefentherapie vanaf de dag na de operatie leidt tot een klinisch relevant beter functioneren op de korte termijn dan helemaal geen oefentherapie.
Bronnen (Ozkara, 2015; Ju, 2012) |
1.3
Laag GRADE |
Patiënten die binnen vier tot zes weken na de operatie starten met oefentherapie hebben op de korte termijn niet klinisch relevant minder pijn dan patiënten die helemaal geen oefentherapie ondergaan.
Bronnen (Beneck, 2014; Dolan, 2000; Erdogmus, 2007, Filiz, 2005; McGregor, 2011; Yilmaz, 2003) |
1.4
Laag GRADE |
Patiënten die binnen vier tot zes weken na de operatie starten met oefentherapie op de korte termijn functioneren niet klinisch relevant beter dan patiënten die helemaal geen oefentherapie ondergaan.
Bronnen (Beneck, 2014; Erdogmus, 2007; Filiz, 2005; McGregor, 2011; Yilmaz, 2003) |
1.5
Laag GRADE |
Er lijkt geen verschil te zijn in functioneren op de lange termijn tussen patiënten die binnen vier tot zes weken na de operatie starten met oefentherapie en patiënten die die helemaal geen oefentherapie ondergaan.
Bronnen (Donaldson, 2006; Erdogmus, 2007; McGregor, 2011) |
Vergelijking 2
2.1
Zeer laag GRADE |
Er lijkt geen verschil te zijn in pijn op de korte termijn tussen patiënten die meteen na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Kjellby-Wendt, 1998; Scrimshaw, 2001) |
2.2
Zeer laag GRADE |
Er lijkt geen verschil te zijn in pijn op de lange termijn tussen patiënten die meteen na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Kjellby-Wendt, 1998; Scrimshaw, 2001) |
2.3
Zeer laag GRADE |
Er lijkt geen verschil te zijn in functioneren op de korte termijn tussen patiënten die meteen na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Scrimshaw, 2001) |
2.4
Zeer laag GRADE |
Er lijkt geen verschil te zijn in functioneren op de lange termijn tussen patiënten die meteen na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Scrimshaw, 2001) |
2.5
Zeer laag GRADE |
Er lijkt geen klinisch relevant verschil in de pijn op korte termijn (≤6 maanden) te zijn tussen hoog-intensieve oefentherapie en laag-intensieve oefentherapie te zijn na een HNP-operatie.
Bronnen (Filiz, 2005; Danielsen, 2000; Manniche, 1993a; Herbert, 2013) |
2.6
Zeer laag GRADE |
Er lijkt geen verschil te zijn in de pijn op lange termijn (>6 maanden) tussen hoog-intensieve oefentherapie en laag-intensieve oefentherapie na een HNP-operatie.
Bronnen (Danielsen, 2000; Manniche, 1993a) |
2.7
Zeer laag GRADE |
Er lijkt geen verschil te zijn in functioneren pijn op korte termijn (≤6 maanden) tussen hoog-intensieve oefentherapie en laag-intensieve oefentherapie na een HNP-operatie.
Bronnen (Filiz, 2005; Danielsen, 2000; Manniche, 1993a) |
2.8
Zeer laag GRADE |
Er lijkt geen verschil te zijn in functioneren op lange termijn (>6 maanden) tussen hoog-intensieve oefentherapie en laag-intensieve oefentherapie na een HNP-operatie.
Bronnen (Danielsen, 2000; Manniche, 1993a) |
2.9
Zeer laag GRADE |
Er lijkt geen klinisch relevant verschil te zijn in functioneren op de korte termijn tussen patiënten die 12 maanden na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Manniche, 1993b; Timm, 1994) |
2.10
Zeer laag GRADE |
Er lijkt geen klinisch relevant verschil te zijn in pijn op de korte termijn tussen patiënten die 12 maanden na de operatie hoog-intensieve oefentherapie hebben ondergaan en patiënten die usual care hebben ondergaan.
Bronnen (Manniche, 1993b) |
Vergelijking 3
3.1
Zeer laag GRADE |
Er lijkt geen verschil te zijn in pijn op de korte termijn tussen patiënten die gesuperviseerde oefentherapie hebben ondergaan en patiënten die ongesuperviseerde oefentherapie hebben ondergaan.
Bronnen (Filiz, 2005; Johannsen, 1994; Johannson, 2009; Yilmaz, 2003) |
3.2
Zeer laag GRADE |
Er lijkt geen verschil te zijn in functioneren op de korte termijn tussen patiënten die gesuperviseerde oefentherapie hebben ondergaan en patiënten die ongesuperviseerde oefentherapie hebben ondergaan.
Bronnen (Filiz, 2005; Johannsen, 1994; Johannson, 2009; Yilmaz, 2003) |
Samenvatting literatuur
Vergelijking 1: Leidt oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan geen oefentherapie (exercise versus no treatment).
Active rehabilitation that starts immediately postsurgery
Twee studies vergelijken het starten van een oefentherapiebehandeling direct na de operatieve ingreep met een groep patiënten die helemaal geen oefentherapie hebben gedaan. Een van deze studies (Ju, 2012) was reeds opgenomen in de Cochrane review van Oosterhuis uit 2014. De andere studie (Ozkara, 2015) werd gevonden in de aanvullende literatuursearch. De studie van Ju is een zeer kleine RCT met 14 patiënten met een gemiddelde leeftijd van 45 jaar. In de studie is gekeken naar de uitkomstmaten pijn en functionele status, beide gemeten middels een VAS. De andere studie (Ozkara, 2015) is eveneens een RCT, welke is uitgevoerd in Turkije. In totaal worden er 30 patiënten met een gemiddeld leeftijd van 46 jaar beschreven.
1.1
Uitkomstmaat Pijn op korte termijn:
Deze uitkomstmaat is beschreven in twee studies (Ozkara, 2015; Ju, 2012) en is gedefinieerd als pijn in het been of rug twaalf weken na de operatie gemeten op een VAS. Deze uitkomstmaat is beschreven bij 44 patiënten. In beide studies hadden de patiënten in de oefentherapiegroep minder pijn dan in de controlegroep. De resultaten werden gepoold, dit leidde tot een mean difference van -0,83 (95% CI -1,41 tot -0,25), met een zeer lage mate van heterogeniteit (I2 0%). Het statistisch significante verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn op korte termijn is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (-2, imprecisie) en beperkingen in de studieopzet. Het niveau van de bewijskracht komt uit op GRADE zeer laag.
1.2
Uitkomstmaat Functioneren:
Deze uitkomstmaat is beschreven in twee studies (Ozkara, 2015; Ju, 2012), echter verschilt de wijze waarop het functioneren is gemeten. In de RCT van Ozkara gebruikte men een ODI, in de studie van Ju is het functioneren gemeten middels een VAS. Ook deze uitkomstmaat is in totaal bij 44 patiënten gemeten. De resultaten van de studie zijn gepoold, maar vanwege het gebruikt van twee verschillende meetschalen is naar de standardized mean difference gekeken. Het gepoolde effect kwam uit op een standardized mean Difference -2,77 (95% CI -4,93 tot -0,60), met een grote mate van heterogeniteit (I2 74%). Voor de MCID bij een standardized Mean Difference is 0,5 aangehouden (voor puntschatter en BI). Het gevonden verschil is statistisch significant en tevens klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (-2, imprecisie) en beperkingen in de studieopzet. Het niveau van de bewijskracht komt uit op GRADE zeer laag.
Active rehabilitation that starts four to six weeks postsurgery
Er zijn zeven studies (Beneck, 2014; Donaldson, 2000; Dolan, 2000; Erdogmus, 2007, Filiz, 2005; McGregor, 2011; Yilmaz, 2003) die hebben gekeken naar het starten van oefentherapie binnen vier tot zes weken na de operatie en dit hebben vergeleken met een groep die geen oefentherapie heeft ondergaan. In totaal zijn er meer dan 400 patiënten beschreven.
1.3
Uitkomstmaat Pijn op de korte termijn:
Deze uitkomstmaat is in zes studies beschreven (Beneck, 2014; Dolan, 2000; Erdogmus, 2007, Filiz, 2005; McGregor, 2011; Yilmaz, 2003). In twee studies werden meerdere cohorten beschreven (Filiz, 2005; Yilmaz, 2003). De gemiddelde follow-up was drie maanden en in de studies zijn in totaal 349 patiënten beschreven. Vanwege een variatie in de gebruikte methoden om de pijn te meten is bij het poolen van de gegevens de standardized mean difference als effectmaat gebruikt. Het gepoolde effect was -0,83 (95% CI -1,36 tot -0,30) met een flinke mate van heterogeniteit (I2 79%) (tabel 1). Voor de MCID bij een standardized Mean Difference is 0,5 aangehouden (voor puntschatter en BI). Het gevonden verschil was niet klinisch relevant.
Tabel 1 Uitkomstmaat Pijn op de korte termijn
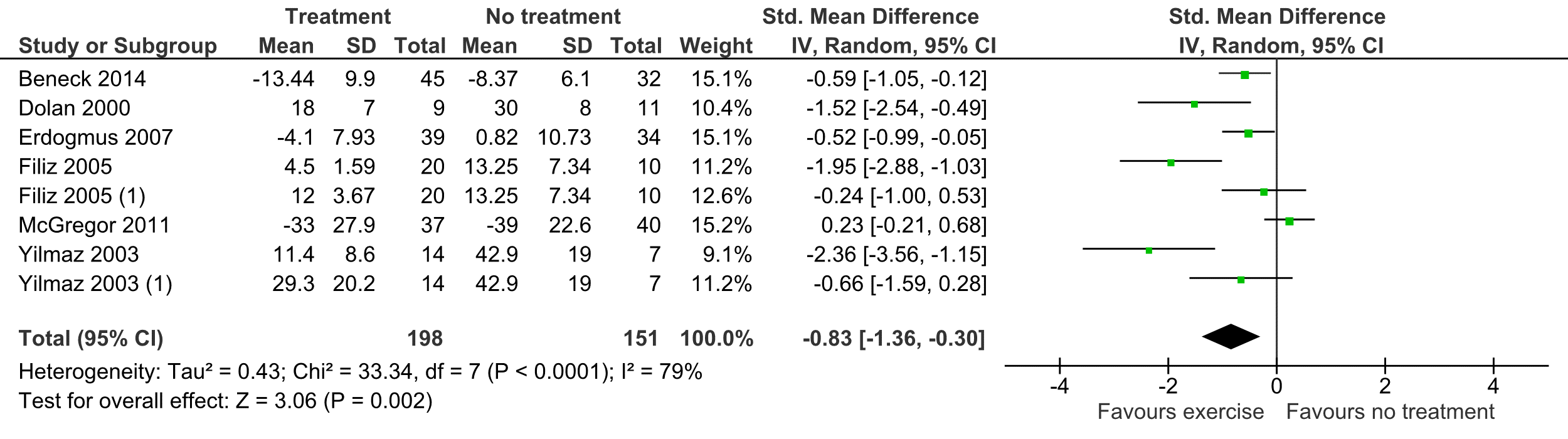
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn op de korte termijn is met twee niveaus verlaagd gezien de mate van heterogeniteit in de resultaten en het beperkte aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE laag.
1.4
Uitkomstmaat Functioneren op de korte termijn:
Deze uitkomstmaat is in vijf studies beschreven (Beneck, 2014; Erdogmus, 2007, Filiz, 2005; McGregor, 2011; Yilmaz, 2003). In twee studies werden meerdere cohorten beschreven (Filiz, 2005; Yilmaz, 2003). De gemiddelde follow-up was drie maanden en in totaal zijn er 329 patiënten beschreven in de studies. Vanwege een variatie in de gebruikte methoden om het functioneren te meten is bij het poolen van de gegevens de standardized mean difference als effectmaat gebruikt. Het gepoolde effect was -0,58 (95% CI -1,02 tot -0,15) met een flinke mate van heterogeniteit (I2 69%) (tabel 2). Voor de MCID bij een standardized mean Difference is 0,5 aangehouden (voor puntschatter en BI). Het gevonden verschil was niet klinisch relevant.
Tabel 2 Uitkomstmaat Functioneren op de korte termijn
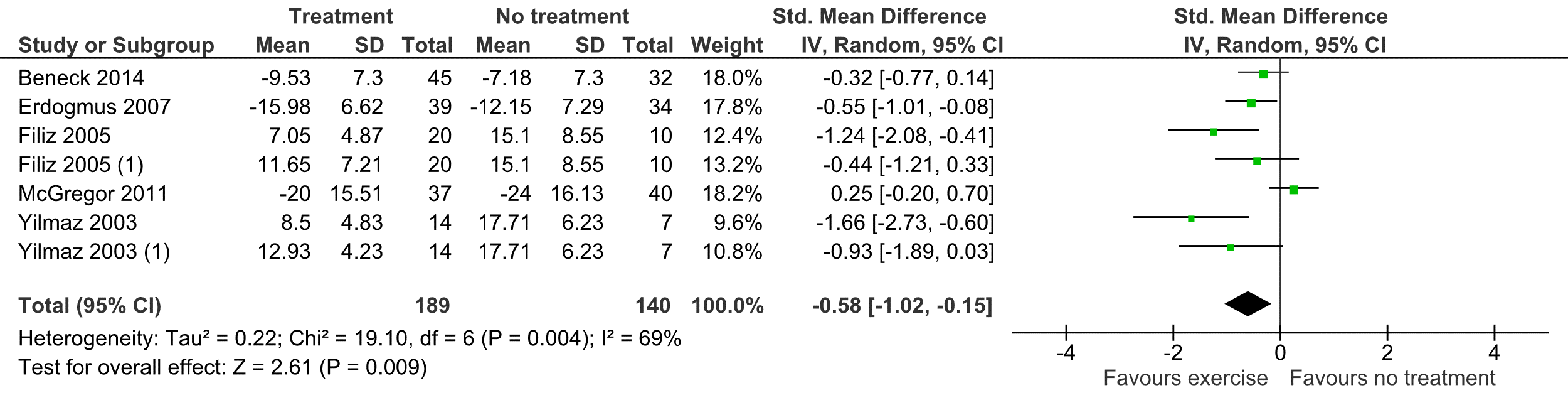
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de korte termijn is met twee niveaus verlaagd gezien de mate van heterogeniteit in de resultaten en het beperkte aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE laag.
1.5
Uitkomstmaat Functioneren op de lange termijn:
Deze uitkomstmaat is in drie studies beschreven (Donaldsen, 2006 Erdogmus, 2007, McGregor, 2011). De gemiddelde follow-up was twaalf maanden en in totaal zijn er 226 patiënten beschreven. Vanwege een variatie in de gebruikte methoden om de pijn te meten is bij het poolen van de gegevens de standardized mean difference als effectmaat gebruikt. Het gepoolde effect was -0,22 (95% CI -0,49 tot 0,04) met een geringe mate van heterogeniteit (I2 0%) (tabel 3). Het verschil is niet statistisch significant.
Tabel 3 Uitkomstmat Functioneren op de lange termijn
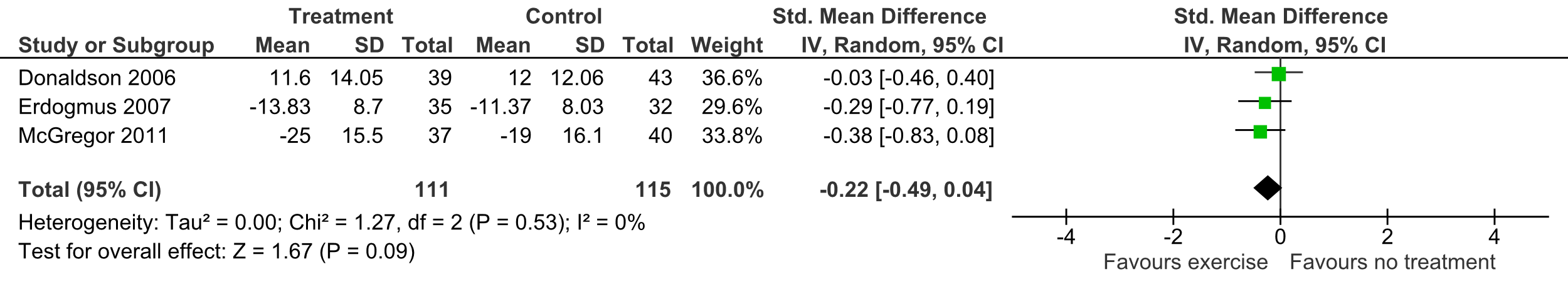
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de lange termijn is met twee niveaus verlaagd gezien de mate van heterogeniteit in de resultaten en het beperkte aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE laag.
Vergelijking 2: Leidt hoog-intensieve oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan laag-intensieve oefentherapie (high-intensity versus low-intensity exercise)
Active rehabilitation that starts immediately postsurgery
In de Cochrane systematische review van Oosterhuis (2014) zijn twee studies (Kjellby-Wendt, 1998; Scrimshaw, 2001) opgenomen die deze vergelijking beschreven. De aanvullende literatuursearch leverde geen extra studies op. In de studies zijn 119 patiënten beschreven en de follow-up betrof in beide studies twaalf maanden. De interventies verschillen die in de twee studies zijn toegepast. In het artikel van Kjellby-Wendt werden in de interventiegroep naast ‘usual care’ ook cardiovasculaire oefeningen gepromoot. In het artikel van Scrimshaw ontving de interventiegroep naast usual care ook nog actieve en passieve oefeningen voor neurologische mobilisatie.
2.1
Uitkomstmaat Pijn op de korte termijn:
Twee studies beschrijven deze uitkomstmaat (Kjellby-Wendt, 1998; Scrimshaw, 2001). In beide studies werd geen verschil in pijn op de korte termijn gevonden. De gegevens van de twee studies konden niet worden gepoold.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn op de korte termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet, het gebruik van verschillende interventies (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.2
Uitkomstmaat Pijn op de lange termijn:
Twee studies beschrijven deze uitkomstmaat (Kjellby-Wendt, 1998; Scrimshaw, 2001). In beide studies werd geen verschil in pijn op de lange termijn gevonden. De gegevens van de twee studies konden niet worden gepoold.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn op de lange termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet, het gebruik van verschillende interventies (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.3
Uitkomstmaat Functioneren op de korte termijn:
Een studie beschreef deze uitkomstmaat (Scrimshaw, 2001). Er bleek een mean difference van -4,5 (95% CI -16,09 tot 7,09) te zijn. Dit verschil was niet statistisch significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de lange termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.4
Uitkomstmaat Functioneren op de lange termijn:
Een studie beschreef deze uitkomstmaat (Scrimshaw, 2001). Er bleek een mean difference van -2,70 (95% CI -15,09 tot 9,69) te zijn. Dit verschil was niet statistisch significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn op de lange termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet, het gebruik van verschillende interventies (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
Active rehabilitation that starts four to six weeks postsurgery
In de Cochrane systematische review van Oosterhuis (2014) zijn drie studies (Filiz, 2005; Danielsen, 2000; Manniche, 1993a) opgenomen die deze vergelijking beschreven. De aanvullende literatuursearch leverde een extra studie op (Herbert, 2013). In de studies zijn 280 patiënten beschreven en de follow-up betrof maximaal twaalf maanden.
2.5
Uitkomstmaat Pijn op de korte termijn (≤6 maanden):
Deze uitkomstmaat is beschreven in vier studies (Filiz, 2005; Danielsen, 2000; Manniche, 1993a; Herbert, 2013). Pijn op de korte termijn was gedefinieerd als gemeten binnen zes maanden na operatie. De wijze waarop de pijn werd gemeten verschilde per studie, er is daarom een standardized mean difference berekend. Het gepoolde effect komt uit op -1,41 (95% CI -2,71 tot -0,11) met een zeer grote mate van heterogeniteit (I2 95%). (tabel 4) Voor de MCID bij een standardized Mean Difference is 0,5 aangehouden (voor puntschatter en BI). Het gevonden verschil was niet klinisch relevant.
Tabel 4 Uitkomstmaat Pijn op de korte termijn
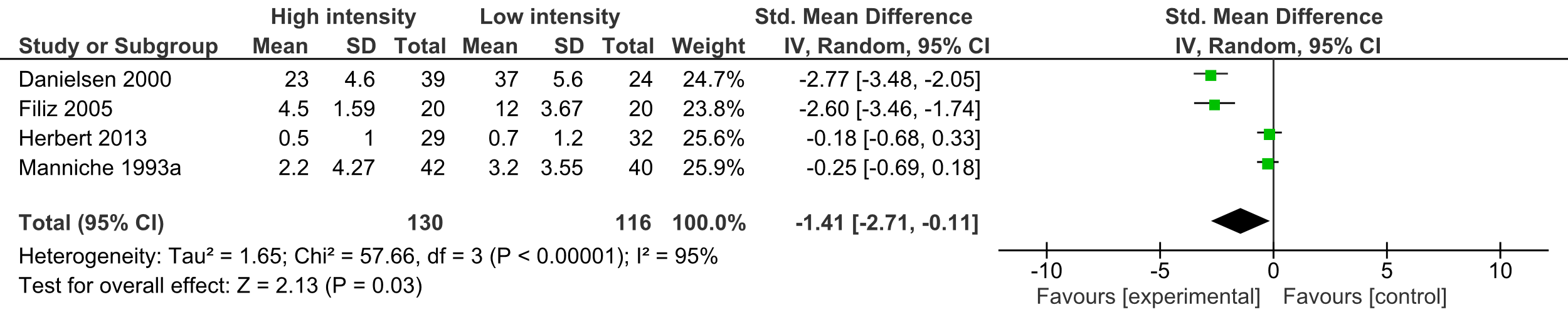
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn op de korte termijn (≤6 maanden) is met drie niveaus verlaagd gezien de tegenstrijdige resultaten (inconsistentie); de variatie in het meten van de uitkomstmaat (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.6
Uitkomstmaat Pijn op de lange termijn (>6 maanden):
Deze uitkomstmaat is beschreven in twee studies (Danielsen, 2000; Manniche, 1993a;). Pijn op de lange termijn was gedefinieerd als zes maanden of later na operatie gemeten. De wijze waarop en het moment dat de pijn werd gemeten verschilde per studie, er is daarom een standardized mean difference berekend. Het gepoolde effect komt uit op -0,29 (95% CI -0,62 tot 0,04) met een zeer lage mate van heterogeniteit (I2 0%). Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn op de lange termijn (>6 maanden) is met drie niveaus verlaagd gezien de variatie in de manier van meten van de uitkomstmaat (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.7
Uitkomstmaat Functioneren op de korte termijn (≤ 6 maanden):
Deze uitkomstmaat is beschreven in drie studies (Filiz, 2005; Danielsen, 2000; Manniche, 1993a). Functioneren op de korte termijn was gedefinieerd als gemeten binnen zes maanden na operatie. De wijze waarop de het functioneren werd gemeten verschilde per studie, er is daarom een standardized mean difference berekend. Het gepoolde effect komt uit op -0,47 (95% CI -1,03 tot 0,09) met een zeer hoge mate van heterogeniteit (I2 71%). Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de korte termijn (≤ 6 maanden) is met drie niveaus verlaagd gezien de tegenstrijdige resultaten (inconsistentie); de variatie in het meten van de uitkomstmaat (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.8
Uitkomstmaat Functioneren op de lange termijn (> 6 maanden):
Deze uitkomstmaat is beschreven in twee studies (Danielsen, 2000; Manniche, 1993a). Functioneren op de lange termijn was gedefinieerd als gemeten zes maanden of later na operatie. De wijze waarop de het functioneren werd gemeten verschilde per studie, er is daarom een standardized mean difference berekend. Het gepoolde effect komt uit op -0,32 (95% CI -0,65 tot 0,02) met een zeer lage mate van heterogeniteit (I2 0%). Dit verschil is niet statistisch significant en er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren op de lange termijn (>6 maanden) is met drie niveaus verlaagd gezien de variatie in de manier van meten van de uitkomstmaat (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
Active rehabilitation that starts longer than 12 months post-surgery
In de Cochrane systematische review van Oosterhuis (2014) zijn twee studies (Manniche, 1993b; Timm, 1994) opgenomen die deze vergelijking beschreven. De aanvullende literatuursearch leverde geen extra studies op. In de studies zijn 212 patiënten beschreven en de follow-up betrof in beide studies twaalf maanden.
2.9
Uitkomstmaat Functioneren op de korte termijn:
Twee studies beschreven deze uitkomstmaat (Manniche, 1993b; Timm, 1994), maar gebruikten verschillende meetinstrumenten. Een studie gebruikte een Roland-Morris Disability Questionnare (Timm, 1994) en vond een mean difference van 2,39 (95% CI 0,70 tot 4,08). In de andere studie werd een low back pain rating scale (Manniche, 1993b) gebruikt en werd een mean difference van -3,00 (95%CI -5,18 tot -0,82) gerapporteerd. Dit verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de korte termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet, het gebruik van verschillende interventies (indirectheid) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
2.10
Uitkomstmaat Pijn op de korte termijn:
Een studie beschreef deze uitkomstmaat (Manniche, 1993b), gemeten met de low back pain rating scale – onderdeel pijn (0-60). Er werd een mean difference van -7,00 (95% CI -11,5 tot -2,5) gevonden in het voordeel van de groep zonder hyperextension oefeningen (laag intensieve groep). Dit verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn op de korte termijn is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
Vergelijking 3: Leidt gesuperviseerde oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan ongesuperviseerde oefentherapie (supervised versus home exercise)
Active rehabilitation that starts immediately postsurgery
Er zijn in zowel de systematische Cochrane review als in de aanvullende literatuursearch geen studies gevonden die hebben gekeken naar het starten van gesuperviseerde oefentherapie direct na de operatie en dit vergeleken hebben met een groep patiënten die ongesuperviseerde oefentherapie hebben gedaan.
Active rehabilitation that starts four to six weeks postsurgery
In de Cochrane systematische review van Oosterhuis (2014) zijn vijf studies (Choi, 2005; Filiz, 2005; Johannsen, 1994; Johannson, 2009; Yilmaz, 2003) opgenomen die deze vergelijking beschreven. De aanvullende literatuursearch leverde geen extra studies op. In de studies zijn 229 patiënten beschreven en de follow-up varieerden van twee tot twaalf maanden.
3.1
Uitkomstmaat Pijn op de korte termijn:
Deze uitkomstmaat is beschreven in vier studies (Filiz, 2005; Johannsen, 1994; Johannson, 2009; Yilmaz, 2003) en bevatten in totaal 154 patiënten met een gemiddelde follow-up van drie maanden. De uitkomstmaat is gedefinieerd als pijn, gemeten via een VAS of een five-point scale. Vanwege het gebruik van verschillende meetinstrumenten is er een Standardized Mean Difference berekend. Het gepoolde effect kwam uit op -0,76 (95% CI -2,04 tot 0,53) met een hoge mate van heterogeniteit (I2 92%) (tabel 5).
Tabel 5 Uitkomstmaat Pijn op de korte termijn
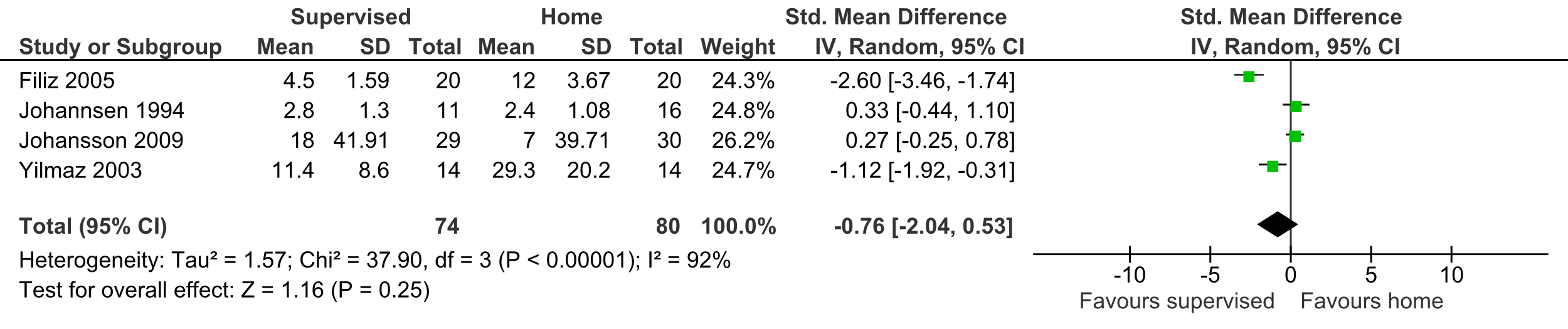
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn op de korte termijn is met drie niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
3.2
Uitkomstmaat Functioneren op de korte termijn:
Deze uitkomstmaat is beschreven in vier studies (Filiz, 2005; Johannsen, 1994; Johannson, 2009; Yilmaz, 2003) en bevatten in totaal 154 patiënten met een gemiddelde follow-up van drie maanden. De uitkomstmaat is gedefinieerd als functioneren, gemeten via een ODI of een 12-item scale. Vanwege het gebruik van verschillende meetinstrumenten is er een Standardized Mean Difference berekend. Het gepoolde effect kwam uit op -0,36 (95% CI -0,88 tot 0,15) met een aanzienlijke mate van heterogeniteit (I2 59%) (tabel 6).
Tabel 6 Uitkomstmaat Functioneren op de korte termijn
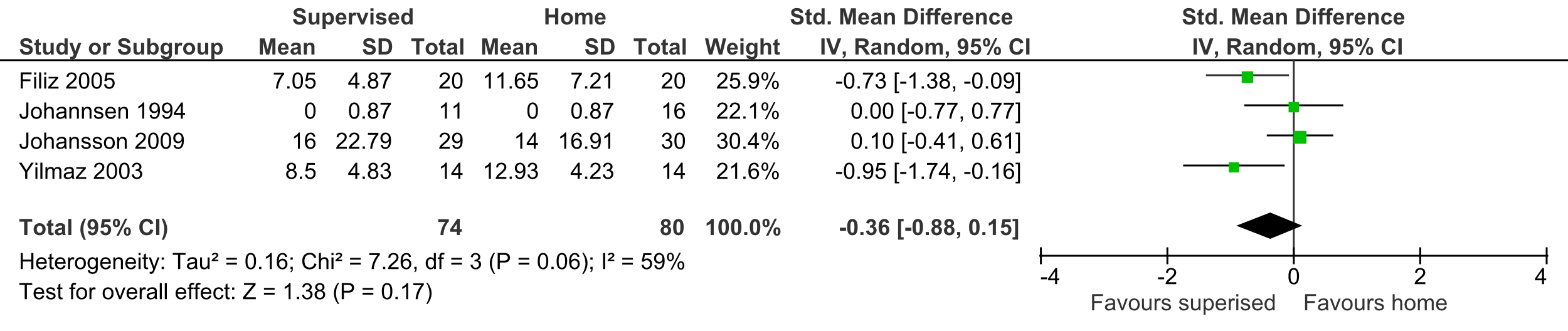
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren op de korte termijn is met drie niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE zeer laag.
Active rehabilitation that starts longer than 12 months post-surgery
Er zijn in zowel de systematische Cochrane review als in de aanvullende literatuursearch geen studies gevonden die hebben gekeken naar het starten van gesuperviseerde oefentherapie meer dan twaalf maanden na de operatie en dit vergeleken hebben met een groep patiënten die ongesuperviseerde oefentherapie hebben gedaan.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstellingen:
Vergelijking 1:
Leidt oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan geen oefentherapie (exercise versus no treatment)
Vergelijking 2:
Leidt hoog-intensieve oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan laag-intensieve oefentherapie (high-intensity versus low-intensity exercise)
Vergelijking 3:
Leidt gesuperviseerde oefentherapie tot betere postoperatieve uitkomsten na een HNP operatie dan ongesuperviseerde oefentherapie (supervised versus home exercise)
Relevante uitkomstmaten
De werkgroep achtte pijn, functioneren en hervatten arbeidsproces (return to work) voor de besluitvorming kritieke uitkomstmaten; en globale maat van verbetering (overall improvement, proportion of participants recovered) een voor de besluitvorming belangrijke uitkomstmaten.
De uitkomstmaten dienden bij voorkeur met behulp van de volgende meetinstrumenten bepaald te zijn, of werden als volgt gedefinieerd:
- Pijn: VAS beenpijn, Low Back Pain Rating Sccale (LBPRS).
- Functioneren: Oswestry disability index (ODI) of de Roland Morris Disability Index.
De werkgroep definieerde niet a priori de uitkomstmaat hervatten arbeidsproces en de uitkomstmaat globale maat van verbetering, maar hanteerde de in de studies gebruikte definities.
Voor het vaststellen van de Minimal clinically important difference (MCID) is gebruikt gemaakt van het artikel van Ostelo (2008), waar een 20% tot 30% verbetering ten opzichte van de baseline meting als minimaal klinisch relevant verschil wordt aangehouden (within-group change). Dit komt grofweg overeen met een verschil van 2 op de VAS schaal (0 tot 10), 2 op de NRS schaal (0 tot 10), 5 op de Roland Disability Questionnaire (0 tot 24) en 15 op de Oswestry Disability Questionnaire (0 tot 100). De werkgroep houdt dezelfde waarde aan als klinisch relevant verschil tussen de groepen (between-group change).
Voor de uitkomstmaat hervatten arbeidsproces is geen klinisch relevant verschil aangemerkt.
De grens van klinisch relevant verschil bij de LBPRS-pijn (0 tot 60) werd vastgesteld op 15. De grens van klinische relevantie bij LBPRS-functioneren (0 tot 30) werd vastgesteld op 4,5. Pas indien er bij een uitkomstmaat een statistisch significant verschil wordt gevonden worden er uitspraken over de klinische relevantie van dit verschil gedaan. Wanneer verschillende soorten uitkomstmaten zijn gepoold en een gestandaardiseerde mean difference is berekend wordt een verschil van 0,5 klinisch relevant geacht.
Zoeken en selecteren (Methode)
Het betreft een literatuurzoekactie gebaseerd op de Cochrane systematische review van Oosterhuis (2014). In de databases Medline (OVID), Cinahl (Ebsco) is met relevante zoektermen gezocht naar studies die revalidatie en/of oefentherapie na een chirurgische ingreep voor een HNP beschreven. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 108 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- studiedesign: RCT;
- full-tekst artikel beschikbaar in het Nederlands of Engels;
- gepubliceerd tussen 1-1-2013 en 1-9-2016;
- beschrijven van oefentherapieprogramma’s na HNP chirurgie;
- leeftijd patiëntenpopulatie 18-65 jaar;
- beschrijven van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie vijftien studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens twaalf studies geëxcludeerd (zie exclusietabel), en drie studies definitief geselecteerd. Uit de Cochrane review van Oosterhuis (2014) zijn 17 studies geschikt bevonden voor inclusie.
(Resultaten)
In totaal zijn er 20 onderzoeken opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De evidence-tabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Beneck GJ, Popovich JM Jr, Selkowitz DM, et al. Physical Therapy Clinical Research Network (PTClinResNet). Intensive, progressive exercise improves quality of life following lumbar microdiskectomy: a randomized controlled trial. Clin Rehabil. 2014;28(9):892-901.
- Choi G, Raiturker PP, Kim MJ, et al. The effect of early isolated lumbar extension exercise program for patients with herniated disc undergoing lumbar discectomy. Neurosurgery. 2005;57(4):764-72; discussion 764-72.
- Danielsen JM, Johnsen R, Kibsgaard SK, et al. Early aggressive exercise for postoperative rehabilitation after discectomy. Spine. 2000;25(8):101520.
- Donaldson BL, Shipton EA, Inglis G, et al. Comparison of usual surgical advice versus a nonaggravating six-month gym-based exercise rehabilitation program post-lumbar discectomy: results at one-year follow-up. The Spine Journal. 2006;6(4):35763.
- Erdogmus CB, Resch KL, Sabitzer R, et al. Physiotherapy-based rehabilitationfollowing disc herniation operation: results of a randomized clinical trial. Spine. 2007;32(19):20419.
- Filiz M, Cakmak A, Ozcan E. The effectiveness of exercise programmes after lumbar disc surgery. Clinical Rehabilitation. 2005;19:411.
- Filiz M, Cakmak A, Ozcan E. The effectiveness of exercise programmes after lumbar disc surgery. Clinical Rehabilitation. 2005;19:411.
- Hebert JJ, Fritz JM, Thackeray A, et al. Early multimodal rehabilitation following lumbar disc surgery: a randomised clinical trial comparing the effects of two exercise programmes on clinical outcome and lumbar multifidus muscle function. Br J Sports Med. 2015;49(2):100-6
- Johannsen F, Remvig L, Kryger P, et al. Supervised endurance exercise training compared to home training after ?rst lumbar diskectomy: a clinical trial. Clinical and Experimental Rheumatology. 1994;12(6):60914.
- Johansson AC, Linton SJ, Bergkvist L, t al. Clinic-based training in comparison to home-based training after ?rst-time lumbar disc surgery: a randomised controlled trial. European Spine Journal. 2009;18(3):398409.
- Ju S, Park G, Kim E. Effects of an exercise treatment program on lumbar extensor muscle strength and pain of rehabilitation patients recovering from lumbar disc herniation surgery. Journal of Physical Therapy Science. 2012;24(6):5158.
- Kjellby-Wendt G, Styf J. Early active training after lumbar discectomy. A prospective, randomized, and controlled study. Spine. 1999;23(21):234551.
- Manniche C, Skall HF, Braendholt L, et al. Clinical trial of postoperative dynamic back exercises after ?rst lumbar discectomy. Spine. 1993;18(1):927.
- Manniche C, Asmussen K, Lauritsen B, et al. Intensive dynamic back exercises with or without hyperextension in chronic back pain after surgery for lumbar disc protrusion. A clinical trial. Spine. 1993;18(5):5607.
- McGregor AH, Dore CJ, Morris TP, et al. ISSLS prize winner: function after spinal treatment, exercise and rehabilitation (FASTER): a factorial randomized trial to determine whether the functional outcome of spinal surgery can be improved. Spine. 2011;36(21):171120.
- Oosterhuis T, Costa LOP, Maher CG, et al. Rehabilitation after lumbar disc surgery. Cochrane Database of Systematic Reviews 2014, Issue 3. Art. No.: CD003007. DOI: 10.1002/14651858.CD003007.pub3. 2014.
- Oosterhuis T, Ostelo RW, van Dongen JM, et al. Early rehabilitation after lumbardisc surgery is not effective or cost-effective compared to no referral: a randomised trial and economic evaluation. J Physiother. 2017 Jul;63(3):144-153.
- Ostelo RW, Deyo RA, Stratford P, et al. Interpreting change scores for pain and functional status in low back pain: towards international consensus regarding minimal important change. Spine (Phila Pa 1976). 2008;1;33(1):90-4.Ozkara GO, Ozgen M, Ozkara E, et al. Effectiveness of physical therapy and rehabilitation programs starting immediately after lumbar disc surgery. Turk Neurosurg. 2015;25(3):372-9.
- Scrimshaw S, Maher C. Randomized controlled trial of neural mobilization after spinal surgery. Spine. 2001;26: 264752.
- Timm KE. A randomized-control study of active and passive treatments for chronic low back pain following L5 laminectomy. The Journal of Orthopaedic and Sports Physical Therapy. 1994;20(6):27686.
- Yilmaz F, Yilmaz A, Merdol F, et al. Ef?cacy of dynamic lumbar stabilization exercise in lumbar microdiscectomy. Journal of Rehabilitation Medicine 2003; 35:1637.
Evidence tabellen
SR
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Vergelijking 1
|
|||||||
|
Oosterhuis, 2014
[individual study characteristics deduced from [Oosterhuis, 2014]] |
SR and meta-analysis of [RCTs]
Literature search up to june 2013
Comparison 1: exercise vs. no treatment A: Ju, 2012 B: Dolan, 2000 C: Erdogmus, 2007 D: Filiz, 2005 E: McGregor, 2011 F: Yilmaz, 2003 G: Donaldson, 2006
Study design: RCT
Setting and Country: Netherlands
Source of funding: Not mentioned |
Inclusion criteria SR: - RCT - Patients between 18-65 yrs - First time surgery -
Exclusion criteria SR: -
22 studies included
Comparison 1: exercise vs. no treatment
Important patient characteristics at baseline:
N, mean age A: N=14 age 45,2 ± 3,96 B: N=20, age 18-60 C: N=120 age 41,8 ± 10,4 D: N=60 age 20-50 E: N=140 age 45 years F: N=42 age 22-60 G: N= 93 I: 41 (17 – 63) C: 42 (25-63)
Sex: A: N/A B: 90% M C: N/A D: N/A E: N/A F: 55% M
Groups comparable at baseline. |
Describe intervention:
Comparison 1: exercise vs. no treatment A: Medx lumbar extension programme B: Exercise programme C: physiotherapy-based rehabilitation D: intensive exercise programme E: Rehabilitation F: Dynamic lumbar stabilisation G: progressive training |
Describe control:
Comparison 1: exercise vs. no treatment A: No treatment B: No treatment C: No treatment D: No treatment E: Usual F: No treatment G: No treatment |
End-point of follow-up:
A: 3 months7 B: 12 months C: 12 months D: N/A E: 12 months F: N/A G: 36 months |
Comparison 1: exercise vs. no treatment
1.1 start immediately post-surgery Outcome measure-Pain on VAS (12 weeks)
Effect measure: mean difference [sd]: A: I: 4,35 (0,94) N=7 C: 5,8 (1,89) N=7
Mean difference -1,45 [-3,01 tot 0,11]
Outcome measure-functional status on VAS A: I: 2,28 (0,75) N=7 C: 6,27 (1,05) N=7
Mean difference -3,99 [-4,95 tot -3,03]
1.2 start four to six weeks post-surgery Outcome measure-Pain mean follow-up three months Std. mean. Diff. Effect measure: mean difference [sd]: B: I: 18 (7) N=9 C: 30 (8) N=11 C: I: -4,1 (7,93) N=39 C: 0,82 (10,73) N=34 D1: I: 4,5 (1,59) N=20 C: 13,25 (7,34) N=10 D2: I: 12 (3,67) N=20 C: 13,25 (7,34) N=10 E: I: -33 (27,9) N=37 C: -39 (22,6) N=40 F1: I: 11,4 (8,6) N=14 C: 42,9 (19) N=7 F2: I: 29,3 (20,2) N=7 C: 42,9 (19) N=7
Mean difference -0,90 [-1,55 tot -0,24]
With Beneck, 2014 included -0,83 [-1.36 tot -0.30]
Outcome measure-Functional status (post treatment) Std. mean. Diff. Effect measure: mean difference [sd]: C: I: -15,98 (6,62) N=39 C: -12,15 (7,29) N=34 D1: I: 7,05 (4,87) N=20 C: 15,1 (8,55) N=10 D2: I: 11,65 (7,21) N=20 C: 15,1 (8,55) N=10 E: I: -20 (15,51) N=37 C: -24 (16,13) N=40 F1: I: 8,5 (4,83) N=14 C: 17,71 (6,23) N=7 F2: I: 12,93 (4,23) N=7 C: 17,71 (6,23) N=7
Mean difference -0,67 [-1,22 tot -0,12]
Outcome measure-Functional status (long term) Std. mean. Diff. Effect measure: mean difference [sd]: C: I: -13,83 (8,7) N=35 C: -11,37 (8,03) N=32 E: I: -25 (15,5) N=37 C: -19 (16,1) N=40 G: 11,6 (14,05) N=39 C: 12 (12,06) N=43
Mean difference -0,22 [-0,49 tot –0,04] |
|
|
Vergelijking 2 |
|||||||
|
Oosterhuis, 2014
[individual study characteristics deduced from [Oosterhuis, 2014]] |
SR and meta-analysis of [RCTs]
Literature search up to june 2013
Comparison 2: high-intensity versus low-intensity exercise A: Kjellby-Wendt, 1998 B: Scrimshaw, 2001 C: Filiz, 2005 D: Danielsen, 2000 E: Manniche, 1993a Y:Manniche, 1993b Z: Timm, 1994
Study design: RCT
Setting and Country: Netherlands
Source of funding: Not mentioned |
Inclusion criteria SR: - RCT - Patients between 18-65 yrs - First time surgery
Exclusion criteria SR: Not mentioned
22 studies included
Comparison 2: high-intensity versus low-intensity exercise
Important patient characteristics at baseline:
N, mean age A: N=60 age (16 – 70) B: N=59, age 18-60 C: N=60 age 20-50 D: N=63 age 22-58 E: N=96 age 18-70 years Y: N=62 Z: N=200
Sex: A: N/A B: N/A C: N/A D: N/A E: N/A Y: 48% M Z: N/A
Groups comparable at baseline. |
Describe intervention:
Comparison 2: high-intensity versus low-intensity exercise A: promotion of cardiovascular exercises B: Std postop care + active and passive exercises for neural mobilisation C: intensive exercise programme D: High intensity E: Intensive exercises Y: Intensive dynamic exercise with hyperextension Z: I: Joint manipulation I2; cardiovascular (bicycle), isotonic trunk muscle training |
Describe control:
Comparison 2: high-intensity versus low-intensity exercise A: No promotion of cardiovascular exercises B: Standard postoperative care ONLY C: Advice home treatment D: low intensity E: mild mobilisation exercises Y: No hyperextension allowed Z: McKenzie under supervision |
End-point of follow-up:
A: 12 months B: 12 months C: N/A D: N/A E: 12 months Y: 12 months Z: 12 months |
Comparison 2: high-intensity versus low-intensity exercise
2.1 start immediately post-surgery Outcome measure-Pain short term (VAS)
Effect measure: mean difference [sd]: A: I: -3,8 (3,2) N=26 C: -3,5 (3,4) N=26 Mean difference -0,30 [-2,09 tot 1,49]
B: I: 33,4 (30,6) N=32 C: 26,6 (29,3) N=28 Mean difference 6,8 [-8,37 tot 21,97]
Outcome measure-Pain long term (VAS) A: I:-3,6 (3,2) N=26 C: -2,6 (4) N=26 Mean difference -1,00 [-2,97 tot 0,97]
B: I:25,7 (29,18) N=32 C: 33,4 (34,2) N=28 Mean difference -7,70 [-23,91 tot 8,51)
Outcome measure-Functional Status short term
Effect measure: mean difference [sd]: B: I: 30,4 (22,8) N=32 C: 34,9 (22,9) N=28 Mean difference -4,5 [-16,09 tot 7,09]
Outcome measure-Functional Status long term
Effect measure: mean difference [sd]: B: I: 27,2 (24,8) N=32 C: 29,9 (24,1) N=28 Mean difference -2,70 [-15,09 tot 9,69]
2.2 start four to six weeks post-surgery Outcome measure-Pain short term (< 6 months) Std. mean. Diff. Effect measure: mean difference [sd]: C: I: 4,5 (1,59) N=20 C: 12 (3,67) N=20 D: I: 23 (4,6) N=39 C: 37 (5,6) N=24 E: I: 2,2 (4,27) N=42 C: 3,2 (3,55) N=40 HERBERT: I: 0,5 (1,0) N=29 C: 0,7 (1,2) N=32
Standardized Mean difference -1.41 [-2,71 tot -0,11] I2=95%
2.2 start four to six weeks post-surgery Outcome measure-Pain long term (> 6 months) Std. mean. Diff. Effect measure: mean difference [sd]: D: I: 2,8 (2,87) N=39 C: 3,9 (3,87) N=24 E: I: 0,8 (5,3) N=42 C: 2,2 (5,48) N=40
Standardized Mean difference -0,29 [-0,62 tot 0,04] I2=0%
Outcome measure-Functioning short term (< 6 months) Std. mean. Diff. Effect measure: mean difference [sd]: C: I: 7,05 (4,87) N=20 C: 11,65 (7,21) N=20 D: I: 5,1 (1,25) N=39 C: 6,1 (1,25) N=24 E: I: 4,4 (3,45) N=42 C: 4,3 (4,3) N=40
Standardized Mean difference -0,47 [-1,03 tot 0,09] I2 71%
Outcome measure-Functioning long term Std. mean. Diff. Effect measure: mean difference [sd]: D: I: 5,3 (6,68) N=39 C: 6,3 (6,27) N=24 E: I: 4,2 (3,05) N=42 C: 6 (4,94) N=40
Standardized Mean difference -0,32 [-0,65 tot 0,02] I2 0%
2.3 start more than 12 months post-surgery Outcome measure-functioning RMDQ months Std. mean. Diff. Effect measure: mean difference [sd]: Z: I: -18.11 (3.61) N=50 C: -20,5 (4,93) N=50 Mean difference 2,39 [0,70 tot 4,08]
Outcome measure-functional status RMDQ Std. mean. Diff. Effect measure: mean difference [sd]: Y: I: 6 (3.66) N=21 C:9 (3.96) N=26 Mean difference -3,00 [-5,18 tot -0,82]
Outcome measure-pain short term LBPRS months Std. mean. Diff. Effect measure: mean difference [sd]: Y: I:5 (4,88) N=21 C: 12 (10,37) N=26 Mean difference -7,00 [-11,5 tot -2,50] |
|
|
Vergelijking 3 |
|||||||
|
Oosterhuis, 2014
[individual study characteristics deduced from [Oosterhuis, 2014]] |
SR and meta-analysis of [RCTs]
Literature search up to june 2013
Comparison 3: supervised versus home exercise A: Choi, 2005 B: Filiz, 2005 C: Johannsen, 1994 D: Johansson, 2009 E: Yilmaz, 2003
Study design: RCT
Setting and Country: Netherlands
Source of funding: Not mentioned |
Inclusion criteria SR: - RCT - Patients between 18-65 yrs - First time surgery
Exclusion criteria SR: - none mentioned
22 studies included
Comparison 3: supervised versus home exercise
Important patient characteristics at baseline:
N, mean age A: N=75 (35/40) age 46,09 B: N=60 (20/20) age 20-50 C: N=40 (20/20) age N/A D: N=59 (29/30) E: N=28 (14/14)
Groups comparable at baseline. |
Describe intervention:
Comparison 3: supervised versus home exercise A: Medx lumbar extension programme B: intensive exercise programme C: supervised group training D: clinic-based training E: stabilisation exercise under supervision |
Describe control:
Comparison 3: supervised versus home exercise A: Home-based exercise, B: exercise in home programme C: individual training at home D: Home-based training E: home programme |
End-point of follow-up:
A: 12 months B: 2 months C: 6 months D: 12 months E: 3 months |
Comparison 3: supervised versus home exercise
Pain short term mean (sd) A: I: 2,5 (0) N=35 C: 4,3 (0) N=40 B: I: 4,5 (1,59) N=20 C: 12 (3,67) N=20 C: I: 2,8 (1,3) N=11 C: 2,4 (1,08) N=16 D: I: 18 (41,91) N=29 C: 7 (39,71) N=30 E: I: 11,4 (8,6) N=14 C: 29,3 (20,2) N=14
Std. mean. Diff. -0,76 [-2,04 tot 0,53) I2=92%
Functioning short term mean (sd)
A: I: 24,6 (0) N=35 C: 30,6 (0) N=40 B: I: 7,05 (4,87) N=20 C: 11,65 (7,21) N=20 C: I: 0 (0,87) N=11 C: 0 (0,87) N=16 D: I: 16 (22,78) N=29 C: 14 (16,91) N=30 E: I: 8,5 (4,83) N=14 C: 12,93 (4,23) N=14
Std. mean. Diff. -0,36 [-0,88 tot 0,15) I2=59% |
|
RCT
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Comparison 1 Exercise vs. no treatment |
|||||||
|
Ozkara, 2015 |
Type of study: RCT
Setting: Single center
Country: Turkey
Source of funding: Not mentioned |
Inclusion criteria: - aged 18-60 - MRI verified unilateral disc herniation
Exclusion criteria: - sequestration of herniated disc - history of spinal surgery - history of spinal cord disease - postoperative neurological deficits.
N total at baseline: Intervention: 15 Control:15
Important prognostic factors2: age ± SD: I: 48,5 ± 11,9 C: 44,1 ± 8,9
Sex: I: 40% M C: 46,7% M
Groups comparable at baseline. |
Describe intervention (treatment/procedure/test):
Patients in each group were raised by the surgeon on post-operative day 1 and wound care was administered. They were then given instructions regarding lying, standing, sitting and walking by a physical therapy and rehabilitation specialist. No additional exercises were given to the control group
The treatment group was given a home-based exercise program starting on post-operative day 1. The home-based exercise program included pelvic tilt and abdominal exercises and isometric quadriceps strengthening and isometric thigh extensor strengthening exercises on post-operative day 1. Back stretching exercises, straight leg raise test, harmstring stretching, hip flexor stretching and isotonic quadriceps strengthening exercises were added after the first week. Passive and active low back extension exercises, low back muscle strengthening and mobilization exercises and isotonic hip extensor strengthening exercises were added after the sixth week. Two sets of each exercise were completed daily, three days a week, for 12 weeks. Exercises given in the first week were 10 repetitions and exercises given after the first week were started at 5 repetitions and increased as much as possible until a maximum of 10 repetitions were achieved. Exercises were demonstrated to the patients along with instructions |
Describe control (treatment/procedure/test):
Patients in each group were raised by the surgeon on post-operative day 1 and wound care was administered. They were then given instructions regarding lying, standing, sitting and walking by a physical therapy and rehabilitation specialist. No additional exercises were given to the control group |
Length of follow-up: 4 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned |
Outcome measures and effect size: VAS Pain (leg and or back) 6 weeks I: 1,07 ± 0,84 C:1,33 ± 0,92
VAS Pain (leg and or back) 12 weeks I: 0,67 ± 0,82 C:1,40 ± 0,83
P=0,024
Functioning (ODI) 6 weeks I: 14,8 ± 10,34 C:25,2 ± 11,83
P=0,0001
Functioning (ODI) 12 weeks I: 4,67 ± 4,94 C:17,3 ± 8,0
P=0,0001 |
|
|
Beneck, 2014 |
Type of study: RCT
Setting: Single center
Country: USA
Source of funding: This study was funded by a grant from the Foundation for Physical Therapy. Institutional Review Board of the University of Southern California. |
Inclusion criteria: - age 18 – 60 - first time single-level lumbar micro diskectomy Exclusion criteria:
N total at baseline: Intervention: 45 Control:32
Important prognostic factors2: age ± SD: I:39,2 ± 10,2 C:41,4 ±9,9
Sex: I: 58% M C: 50% M
Groups comparable at baseline.
|
Describe intervention (treatment/procedure/test):
Education comprised a one-hour “one-on-one” session with the intervention therapist that occurred after the pre-intervention testing session, four to six weeks after surgery. This educational session was tailored specifically for individuals who had undergone a lumbar microdiskectomy, to help them understand their back problem and how to care for their back. It was guided by an educational booklet that was created especially for this study. 15The exercise program 14 comprised back exten-sor strength and endurance training, accompanied by trunk and lower extremity exercise training, which were performed within the same sessions. It began within a few days of the education session, and occurred three times a week for 12 weeks. The program was systematic and individualized, thus accommodating participants of varying levels of fitness and symptoms, and allowing measurable progression of the workload over the 12-week training period. The back extensor strength and endurance training portion of the program was designed to load the back extensor muscles in a graded manner using a variable-angle Roman chair.
|
Describe control (treatment/procedure/test):
Education comprised a one-hour “one-on-one” session with the intervention therapist that occurred after the pre-intervention testing session, four to six weeks after surgery. This educational session was tailored specifically for individuals who had undergone a lumbar microdiskectomy, to help them understand their back problem and how to care for their back. It was guided by an educational booklet that was created especially for this study. 15 |
Length of follow-up: 2 months
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned |
Outcome measures and effect size (include 95%CI and p-value if available):
SF36 Bodily pain I: 13,44 10,5 tot 16,4 SD:9.9 C: 8,37 (6,2 tot 10,6) SD: 6.1
SF36 Physical functioning I: 9,53 (7,4 tot 11,7 SD:7.30 C: 7,18 (4,6 tot 9,7) SD: 7.30 |
|
|
Comparison 2 High intensity |
|||||||
|
Herbert, 2013 |
Type of study: RCT Setting: Single Center
Country: Australia
Source of funding: Orthopedic section of the American Physical Therapy Association |
Inclusion criteria: - age 18-60 years; - lumbar disc herniation confirmed with radiograph; Exclusion criteria: - prior lumbar surgery - more than one leve; - fusion - perioperatieve complication
N total at baseline: Intervention: 29 Control:32
Important prognostic factors2: age ± SD: I: 40,6 ± 10,2 C: 40,2 ± 8,8
Sex: I: 45% M C: 53% M
Groups comparable at baseline. |
Describe intervention (treatment/procedure/test):
SPEC: specific exercise protocol. Includes all components of GEN. In addition muscle exercisis. |
Describe control (treatment/procedure/test):
GEN: General trunk exercise protocol. Aerobic exercise, range of motion exercise and strengthening exercise. |
Length of follow-up: 6 months
Loss-to-follow-up: Not described
Incomplete outcome data: Not relevant for outcome measure. |
Outcome measures and effect size (include 95%CI and p-value if available):
2.2 start four to six weeks post-surgery Outcome measure-Pain short term (< 6 months) I: 0,5 (1,0) N=29 C: 0,7 (1,2) N=32 |
|
SR
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Oosterhuis,2014 |
yes |
yes |
yes |
unclear |
N/A |
yes |
yes |
no |
yes |
RCT
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ozkara, 2015 |
Sealed envelopes |
unlikely |
Unclear, not possible |
Unclear, not possible |
unlikely |
unlikely |
Unlikely |
unlikely |
|
Beneck, 2014 |
blocked randomization from a computer-generated list |
unlikely |
Unclear, not possible |
Unclear, not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Herbert, 2013 |
Random number generator |
unlikely |
Unclear, not possible |
Unclear, not possible |
Unlikely |
Unlikely |
Unlikely |
unlikely |
Selectietabel
|
Artikel-nr |
Auteur + jaartal |
In- / exclusie |
Toelichting |
|
1 |
Kim, 2016 |
Exclusie |
Interventie betreft niet een actieve behandeling, maar passieve technieken. Voldoet niet aan PICO. |
|
2 |
Rushton, 2015 |
Exclusie |
Vergelijking voldoet niet aan PICO. |
|
3 |
Ozkara, 2015 |
Inclusie |
|
|
4 |
Lee, 2015 |
Exclusie |
Conference proceeding. |
|
5 |
Hebert, 2015 |
Inclusie |
|
|
6 |
Gilmore, 2015 |
Exclusie |
Systematische review, bevatte geen recente studies die niet in de Cochrane review zijn opgenomen. |
|
7 |
Ebenbichler, 2015 |
Exclusie |
Voldoet niet aan PICO |
|
8 |
Tarnanen, 2014 |
Exclusie |
Beschrijft patiënten met Stenose, geen HNP. Voldoet niet aan PICO |
|
9 |
Schroter, 2014 |
Exclusie |
Duitstalig artikel |
|
10 |
Qvarfordh, 2014 |
Exclusie |
Kijkt alleen of patiënten direct na de ingreep van de PACU naar de General ward kunnen lopen. Niet relevant voor onze vraag. Voldoet niet aan PICO. |
|
11 |
Monticone, 2014 |
Exclusie |
Beschrijft patiënten met Stenose, geen HNP. Voldoet niet aan PICO |
|
12 |
Demir, 2014 |
Exclusie |
Vergelijking voldoet niet aan PICO. |
|
13 |
Beneck, 2014 |
Inclusie |
|
|
14 |
Oestergaard, 2013a |
Exclusie |
Beschrijft patiënten met Stenose, geen HNP. Voldoet niet aan PICO |
|
15 |
Oestergaard, 2013b |
Exclusie |
Beschrijft patiënten met Stenose, geen HNP. Voldoet niet aan PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-12-2017
Beoordeeld op geldigheid : 06-03-2018
Uiterlijk in 2022 bepaalt het bestuur van de NVvN of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). Deze overwegingen van de werkgroep zijn gebundeld en opgenomen in de Richtlijnendatabase onder aanverwante producten. Deze tekst geeft tevens aan welke modules naar verwachting voor de praktijk het meest onderhoudsintensief zijn en vormt daarmee een leidraad voor toekomstige modulaire herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen invloed gehad op de inhoud van de richtlijn.
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is duidelijkheid te verkrijgen over de effectiviteit van de verschillende operatieve behandelingen van een symptomatische lumbale hernia nuclei pulposi of een lumbaalspinaalstenose. Daarnaast is inzicht geven over het gewenste tijdstip van operatief ingrijpen en het postoperatieve beleid gewenst. Dit alles moet bijdragen aan een meer eenduidig beleid inzake deze ziektebeelden.
Doelgroep
Deze richtlijn is geschreven voor allen die betrokken zijn bij een symptomatische lumbale hernia nuclei pulposi of een lumbale kanaalstenose, die niet spontaan verbetert met of zonder conservatieve therapie, adequate pijnstilling of wanneer neurologisch symptomatologie zich ontwikkelt die een verder conservatief beleid niet rechtvaardigt. Dit betreffen zorgverleners maar ook patiënten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met symptomatische lumbale hernia nuclei pulposi of een lumbale kanaalstenose te maken hebben (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 20 maanden aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- prof. dr. R.H.M.A. Bartels, Neurochirurg, Radboudumc Nijmegen, voorzitter, NVvN
- dr. R. Dammers, Neurochirurg, Erasmus MC Rotterdam, NVvN
- dr. C.L.A.M. Vleggeert – Lankamp, Neurochirurg, LUMC Leiden, NVvN
- dr. S.M. van Gaalen, Orthopedisch chirurg, Diakonessenhuis Utrecht, NOV
- drs. J.J. Nieuwenhuis, Orthopedisch chirurg, VieCuri Medisch Centrum Venlo, NOV
- dr. R.H. Boerman, Neuroloog, Rijnstate Arnhem, NVN
- drs. E.J. Wouda, Neuroloog, OLVG Amsterdam en Zaans Medisch Centrum Zaandam, NVN
- drs. M.A.M.B. Terheggen, Anesthesioloog, Rijnstate Arnhem, NVA
- dr. P.R. Algra, Radioloog, Noordwest Ziekenhuisgroep Alkmaar, NVvR
- L. Voogt, Patiëntvertegenwoordiger, Nederlandse Vereniging van Rugpatiënten ‘De Wervelkolom’
- J. S. van der Kraan MSc, Patiëntvertegenwoordiger, Patiëntenfederatie Nederland
- prof. dr. R.W.J.G. Ostelo, Hoogleraar evidence-based fysiotherarpie, Vrije Universiteit Amsterdam, KNGF
Klankbordgroep
- drs. J. Schnieders, Revalidatiearts, OCA, Amsterdam en Winnock, Zeist, VRA
- dr. H.R. Schiphorst Preuper, Revalidatiearts, Universitair Medisch Centrum Groningen, VRA
- drs. A.F.E. Verburg, Huisarts, wetenschappelijk medewerker NHG
Met ondersteuning van
- A.A. Lamberts MSc, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. M.L. Molag, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroepleden |
||||||||
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Voogt |
Voorzitter NVVR "de Wervelkolom" |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bartels |
afdelingshoofd afdeling neurochirurgie. Hoogleraar Neurochirurgie |
Lid editorial board Acta neurochirurgica (onbetaald), European spine journal, int. Advisory board for neurosurgery. (onbetaald), Frontiers of Neurology (onbetaald) |
geen |
geen |
President van CSRS Europe/ Lid bestuur NVvN |
geen |
geen |
geen |
|
Wouda |
Neuroloog, Zaans Medisch Centrum |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Vleggeert-Lankamp |
Neurochirurg LUMC |
Reviewer voor Spine tijdschriften (onbetaald) |
geen |
geen |
Member of CSRS Europe Board |
National Health organisation sponsors a trial on treatment of cervical radiculopathy, and has been paying a trial on the treatment of spinal stenosis, BBraun sponsors a study after the surgical treatment of cervical discectomies. Medtronic sponsors a study after the surgical treatment of spondylolytic listhesis. Paradigm Spine sponsors a study after the surgical treatment of spinal stenosis. These are all investigator initiated trials. The payment is not made to my own account but to our research department. Lectures for physiotherapists, financed by the Dutch National Organisatie of physiotherapists, course for neurosurgical trainees on a BBraun sponsored course. The payment is not made to my own account but to our research department. |
geen |
geen |
|
Boerman |
Neuroloog, Rijnstate |
Werkgroep-voorzitter werkgroep Pijn NVN (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Dammers |
Neurochirurg Erasmus MC Rotterdam, Neurochirurg Admiraal de Ruyterziekenhuis Goes in het kader van de Maatschap neurochirurgie Rotterdam |
geen |
geen. |
geen. |
geen. |
geen. |
geen. |
geen. |
|
Van der Kraan |
Beleidsmedewerker Patiënten-federatie Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Gaalen |
Orthopedisch chirurg Diakonessenhuis Utrecht-Zeist. Vice opleider |
Consultant EIT (betaald), member of the scientific advisory board Safe orthopeadics (betaald) |
geen |
geen |
geen |
De maatschap orthopedie in het Diakonessenhuis heeft een wetenschappelijke stichting (Clinical Orthopaedic Research Foundation Midden-Nederland) die ten behoeve van wetenschappelijk onderzoek gelden ontvangt van een aantal orthopedische implantaat firma's: |
geen |
geen |
|
Terheggen |
Anesthesioloog / pijnspecialist, Rijnstate |
geen |
geen |
geen |
geen |
nvt |
geen |
geen |
|
Ostelo |
Hoogleraar Evidence Based Physiotherapie, VUmc |
geen |
geen |
geen |
geen |
Subsidies voor onderzoeksprojecten verworven bij: |
geen |
geen |
|
Nieuwenhuis |
1. Orthopedisch chirurg 5. Opleider Orthopedie |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Klankbordgroepleden |
||||||||
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Schiphorst - Preuper |
Revalidatiearts UMCG |
Voorzitter van de WPN (Werkgroep Pijnrevalidatie Nederland), bestuurslid van de PAiN (Pijnalliantie in Nederland) en redactielid NTPP (Nederlands Tijdschrift Pijn en Pijnbestrijding) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schnieders |
Revalidatiearts, OCA |
Werkzaam als revalidatie arts bij ZBC's: OCA en Winnock, lid van VRA (Ver. Voor Revalidatieartsen) en WPN (Werkgroep Pijn Nederland) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verburg |
Huisarts 0,4 fte |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van patiëntenorganisaties plaats te laten nemen in de werkgroep (NVVR ‘De Wervelkolom’ & Patiëntenfederatie Nederland). Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). Er is één module gewijd aan Shared Decision Making bij ongeïnstrumenteerde wervelkolomchirurgie en er is op basis van deze richtlijn patiënteninformatie ontwikkeld, die te vinden is op Thuisarts (https://www.thuisarts.nl/hernia-in-rug)”. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de betrokken patiëntenorganisaties.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is als aparte module opgenomen en zal later als aanverwant product worden toegevoegd. De werkgroep heeft een voorstel gedaan voor interne kwaliteitsindicatoren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende veldpartijen tijdens de invitational conference. Een verslag van deze bijeenkomst is opgenomen als bijlage 1.
De werkgroep stelde een long list met knelpunten op en prioriteerde de knelpunten op basis van:
- Klinische relevatie;
- De beschikbaarheid van evidence van hoge kwaliteit;
- De te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. De werkgroep meent dat het in de toekomst wenselijk is om zoveel mogelijk aan te sluiten bij initiatieven zoals ICHOM & PROMS om zoveel mogelijk gebruik te maken van universele uitkomstmaten.
Strategie voor zoeken en selecteren van literatuur
Er zijn twee oriënterende literatuursearches uitgevoerd (voor Stenose en HNP) naar bestaande buitenlandse richtlijnen, systematische reviews en literatuur over patiëntenvoorkeuren (patiëntenperspectief). De resultaten hiervan zijn beschreven in module 1.1 en module 1.2. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden in tweetallen de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose.
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen. Er is in deze richtlijn voor gekozen om bij elke uitkomstmaat de minimal clinically important difference te hanteren en deze te gebruiken bij het formuleren van de conclusies. De werkgroep heeft ervoor gekozen om niet de number needed to treat te berekenen.
Overwegingen
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep een voorstel gedaan voor een set interne kwaliteitsindicatoren. De conceptindicatoren zijn op het verzoek van de NVvN en NOV opgeleverd en zullen na het publiceren van de richtlijn verder doorontwikkeld worden. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;14;182(18):E839-42. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit.
Richtlijn voor Richtlijnen (herziene versie). Regieraad Kwaliteit van Zorg Beschikbaar via: www.zorginstituutnederland.nl. 2012.
Schünemann H, Brożek J, Guyatt G, et al. editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;17;336(7653):1106-10. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen Search gebaseerd op de Cochrane review Oosterhuis, 2014. P wel smaller |
Totaal |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
2013-sept. 2016 |
16 Intervertebral Disc/ or "Intervertebral-Disk-Displacement"/ or "Intervertebral-Disk-Chemolysis"/ or Radiculopathy/ (29667) 17 Hernia/ or Lumbar Vertebrae/ or Lumbosacral Region/ or lumb*.ti,ab. (127656) 18 16 and 17 (15346) 19 "Sciatica"/ or "Sciatic-Neuropathy"/ (6502) 20 ((radicul* adj5 syndrome?) or (herniat* adj1 dis??) or (herni* adj1 pulposi*) or (herni* adj1 lumb*)).ti,ab. (9046) 21 ((lumbar or vertebrae) and hernia* and (dis?? or prolapse?)).ti,ab. (6042) 22 (((lumbosacral or lumbar) adj5 radiculopathy) or radiculitis).ti,ab. (1744) 23 (((herniat* or lumb*) adj3 (dis?? or microdis* or discectom*)) or "radicular symptom*" or (lumb* adj3 radiculopathy) or "lumbar nerve root" or (disc* adj prolaps*)).ti,ab. (15605) 24 sciatica.ti,ab. (3746) 25 19 or 20 or 21 or 22 or 23 or 24 (23688) 26 18 or 25 (29268) 27 (laminectom* or Diskectom* or discectom* or microdiscectom*).ti,ab. or exp Diskectomy/ or Laminectomy/ or Decompression/ or decompress*.ti,ab. or (MED or MEDTrx).ti,ab. or sequester*.ti,ab. (83786) 28 surgery.fs. or (surg* or operati*).ti,ab. or Postoperative Period/ or (postoperative* or post-operative*).ti,ab. or Postoperative Care/ (2930859) 29 27 or 28 (2971044) 30 26 and 29 (15090) 31 "Lumbar Vertebrae"/su (13351) 32 30 or 31 (23981) 33 exp Physical Therapy Modalities/ or physiotherapy.mp. or exp Rehabilitation/ or rehabilitation.mp. or exp Exercise/ or exp Exercise Movement Techniques/ or exercise.mp. (611521) 34 32 and 33 (1298) 35 (exp "Clinical Trial"/ or randomized.ab,ti. or placebo.ab,ti. or randomly.ab,ti. or trial.ab,ti. or groups.ab,ti.) not (animals/ not humans/) (2186433) 36 34 and 35 (444) 37 limit 36 to yr="2013 -Current" (101) 38 limit 37 to ed=20130601-20131231 (13) 39 37 or 38 (101) – 92 uniek |
108 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
