Randvoorwaarden bij ondervoeding bij kinderen
Aanbeveling
Op basis van de expert-opinion van de werkgroep en de reeds jarenlange ervaring wat betreft screening en behandeling van ondervoeding kunnen een aantal randvoorwaarden geformuleerd worden waaraan voldaan moet worden om te komen tot een gestructureerde screening en behandeling. Het gebruik van elektronische medische dossiers vergemakkelijkt de collectie van data en interpretatie van voedingsparameters en verbetert daardoor voedingszorg.
Om kinderen met een risico op ondervoeding te kunnen herkennen dienen de volgende aspecten geëvalueerd te worden: recente voedingsinname, voedingsbehoefte en verliezen en ziekte gerelateerde factoren.
Gebruik bij opname in het ziekenhuis een standaard screeningsinstrument om het risico op ondervoeding vast te stellen, bij voorkeur het STRONGkids screeningsinstrument.
Zorg ervoor dat er aan de volgende randvoorwaarden is voldaan:
- Zorg voor een geïmplementeerd en uitgeschreven beleid met betrekking tot herkenning van kinderen met (risico op) ondervoeding en beschikken over behandelplannen en staf die dit kan uitvoeren.
- Bij alle patiënten dienen gewicht en lengte gemeten te worden bij opname.
- De gemeten waarden dienen in de goede groeicurve uitgezet te worden en geïnterpreteerd te worden in relatie met de klinische presentatie en eerdere metingen die gedaan zijn.
- Gebruik van elektronische medische dossiers voor collectie van data en interpretatie van voedingsparameters.
Onderbouwing
Achtergrond
Om tot een succesvol beleid te komen om de voedingstoestand te screenen is door Marino (2018) 10 stappen beschreven waaraan voldaan zou moeten worden:
- Bespreek de voedingstoestand in een multidisciplinaire ronde met alle betrokkenen in plaats van alleen een voedingsscore toe te kennen (Shaughnessy, 2016).
- Leg het beleid van screenen van de voedingstoestand schriftelijk vast wat gecommuniceerd is met de medische en verpleegkundige staf, zodat een vroege beoordeling kan worden gedaan en waarbij rekening wordt gehouden met de impact van de ziekte.
- Implementeer het beleid van screening op de voedingstoestand gebruik makende van een raamwerk waarin de kwaliteit verhoogd kan worden en om te laten zien wat de impact is op korte en lange termijn (plan, do, study, act cyclus (zie figuur 1) (Wooton, 2014).
- Zorg voor persoonlijke training met ‘standard operating procedures’ met betrekking tot vaardigheden om anthropometrie goed en volledig uit te voeren.
- Zorg dat er toegang is om gebruik te kunnen maken van ziekte-specifieke groeicurves die beschikbaar zijn in het elektronische patiëntendossier waarin afkapwaarden staan voor verhoogd risico.
- Ontwikkel een automatisch elektronisch verwijssysteem voor voedingsbeleid naar een diëtist of een gekwalificeerd voedingsexpert.
- Training van medisch/verpleegkundig personeel om een open gesprek te hebben met kinderen ouders/zorgverleners met betrekking tot ondervoeding en overvoeding.
- Informeer alle kinderen, ouders/zorgverleners over de voordelen van het bepalen van de voedingstoestand.
- Ontwikkel een cultuur waarin een beoordeling van overvoeding en ondervoeding door het hele team plaatsvindt (Marino, 2017).
- Zorg voor voedingsdoelen en een strategie voor als het voedingsdoel behaald is (Shaughnessy, 2016; Wootton, 2014; Thomas, 2016; Daskalou, 2016).
Het is bekend dat naast de moeilijkheden die direct gerelateerd zijn aan de ziekte of de ziektetoestand van de patiënt, er ziekenhuisfactoren zijn die een barrière vormen om adequaat de patiënt te screenen en te behandelen. Deze barrières kunnen verdeeld worden in verschillende categorieën:
- Patiënt gerelateerde factoren: geen eerdere data beschikbaar van groeigegevens en gastro-intestinale intolerantie. De JGZ meet regelmatig de lengte en het gewicht van kinderen tot 4 jaar en daarna vaak nog 2 keer in de basisschoolperiode. Deze gegevens kunnen met toestemming van ouders worden opgevraagd bij de JGZ.
- Barrières gerelateerd aan personeel: gebrek aan personeel en tijd om adequaat de metingen uit te voeren en de gegevens in te voeren en/of om een screeningsinstrument te implementeren, gebrek aan diëtisten en gebrek aan voedingsteams (Milani 2013; Chen, 2000).
- Organisatie gerelateerde en logistieke barrières: gebrek aan middelen, onduidelijke verantwoordelijkheden met betrekking tot voedingszorg, gebrek aan documentatie gewicht en lengte bij opname, gebrek aan toezicht op dagelijkse voedingsinname bij hoog risico of ondervoede patiënten tijdens opname, procedurele interrupties, te weinig anticipatie op bijwerkingen van medicamenten, slechte schatting van hoeveelheid energie en eiwit die nodig is welke leidt tot inadequaat voorschrijven van voeding (Bunting, 1997; O’Connor, 2004; Cummings, 2005).
- Barrières gerelateerd aan lokale middelen: gebrek aan apparatuur om te meten, geen beleid of protocol om op ondervoeding te screenen en ondervoeding te behandelen en om het beleid te vervolgen, beperkte mogelijkheid oom adequate voeding te verstrekken of om flexibel om te gaan met tijden van maaltijden (van der Kuip, 2004; Skolin, 2006; Keller, 2015; Kuperberg, 2008; Wadden, 2006).
- Gebrek aan automatisering/elektronische medische dossiers: geen integratie van groeicurves in het elektronisch patiënten dossier, geen automatische berekening van de SD-scores, geen automatische verwijzing naar diëtist bij risicopatiënten.
- Gebrek aan kennis: beperkte bewustwording en kennis medisch en verpleegkundige staf wat het belang is van voeding voor de patiënt door te weinig onderwijs en training (Kim, 2018; Martinez, 2012; Raman, 2009).
In een recente internationale survey bij 693 kinder-maag darm leverartsen en diëtisten waren de belangrijkste factoren die een barrière vormden om routinematig een evaluatie te verrichten van ziekte-gerelateerde ondervoeding: beperkte bewustzijn staf, gebrek aan tijd en gebrek aan lokale richtlijnen voor voeding (Huysentruyt, 2019).
Figuur 2 laat een algemeen algoritme zien voor screening, beoordeling en follow-up.
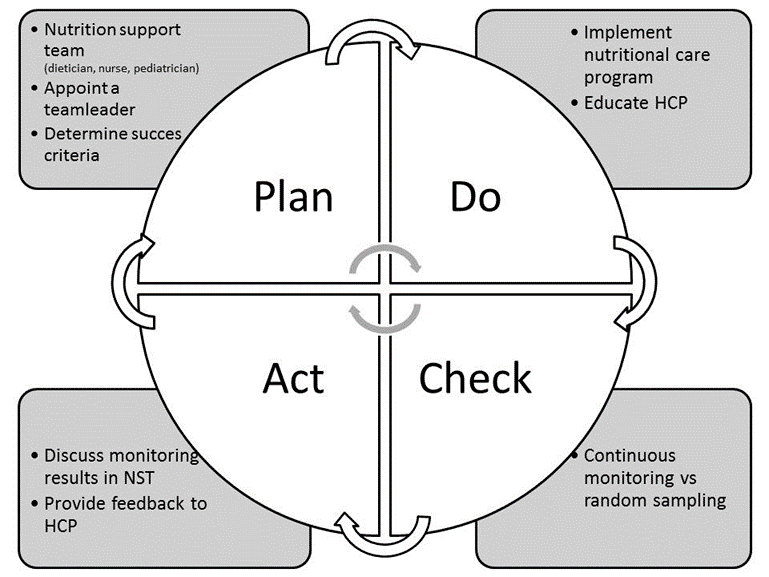
NST: nutrition support team; HCP: health care personnel
Figuur 1 Plan voor evaluatie en kwaliteitsverbetering (Hulst et al submitted)
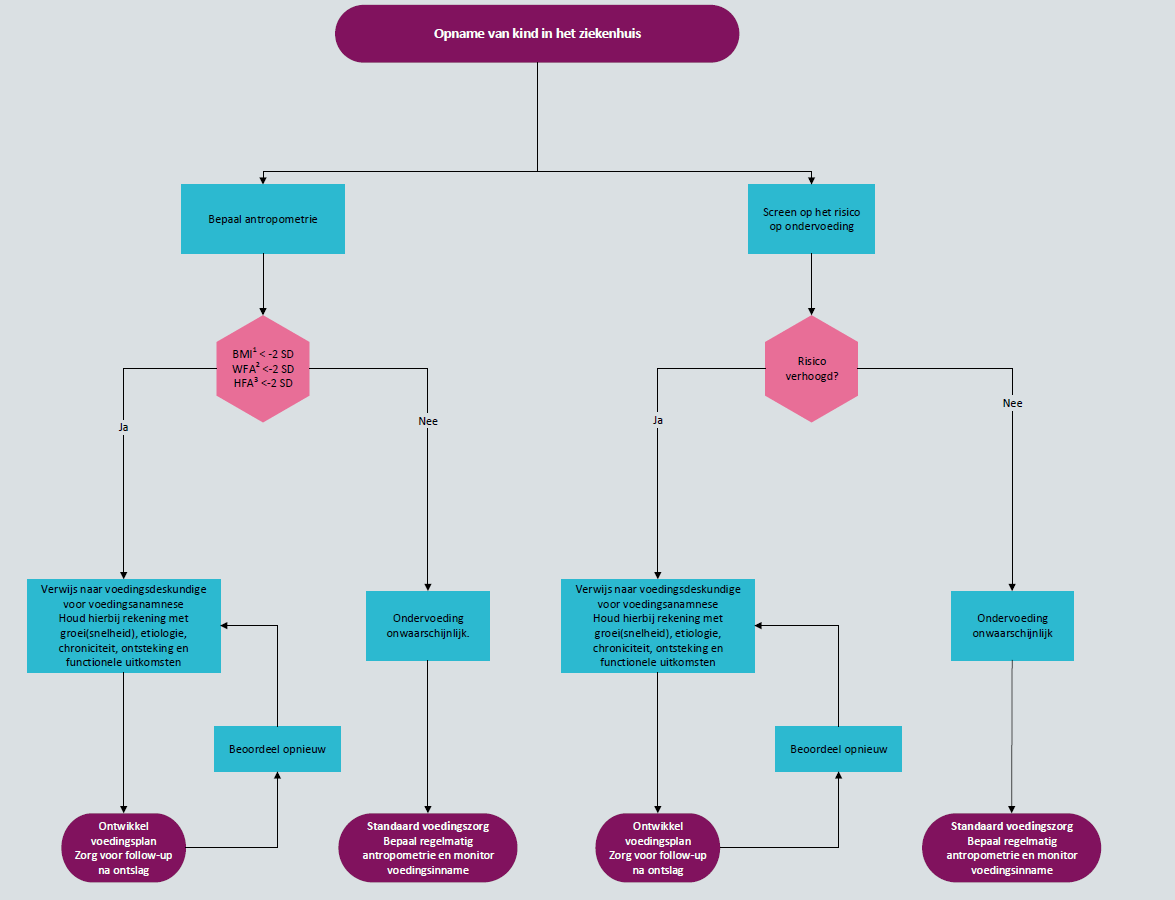

Figuur 2 Algoritme voor screenen, beoordelen en follow-up voedingstoestand
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-08-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Vereniging van Diëtisten
- Nederlandse Vereniging voor Logopedie en Foniatrie
Doel en doelgroep
Doel
Het op systematische wijze beschrijven van de stappen in het proces van screening op en behandeling van ondervoeding bij kinderen die in een ziekenhuis worden opgenomen.
Binnen deze richtlijn zal aandacht worden gegeven aan het tijdig signaleren en behandelen van ondervoeding. Doordat ondervoeding dankzij deze richtlijn sneller herkend zal kunnen worden, zal dit bijdragen aan de tijdigheid van de behandeling.
Doelgroep
Alle zorgverleners betrokken bij het voedingsbeleid van kinderen die opgenomen zijn in het ziekenhuis zoals kinderartsen, diëtisten, kinderverpleegkundigen en logopedisten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de voedingszorg voor kinderen opgenomen in het ziekenhuis.
Werkgroep
- Prof. dr. K.F.M. Joosten, kinderartsintensivist, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis, Rotterdam, NVK, voorzitter
- Dr. A. van den Berg, kinderarts-MDL, werkzaam in het Wilhelmina Kinderziekenhuis/UMCU, NVK
- Prof. dr. W.G. van Gemert, afdelingshoofd Kinderchirurgie, werkzaam in het Universitair Medisch Centrum, Maastricht, NVvH
- F.C. Sickinghe-Ledeboer, Preverbaal logopedist, afdeling Logopedie, werkzaam in OLVG, Amsterdam, NVLF
- Dr. S.C.A.T. Verbruggen, kinderartsintensivist, werkzaam in het Erasmus Medisch Centrum Sophia Kinderziekenhuis, Rotterdam, NVK
- Dr. W. Voskuijl, kinderarts Amsterdam UMC, Emma Kinderziekenhuis, NVK
- Dr. E.A.M Westerbeek, kinderarts, werkzaam in het Amstelland Ziekenhuis, NVK
- Ir. E. Winder Bakker, diëtist kindergeneeskunde, werkzaam in Noordwest Ziekenhuisgroep, locatie Alkmaar, NVD
Klankbordgroep
- Stichting Kind en Ziekenhuis
- J. Eiting, V&VN
- M. van Leeuwen, Vereniging Nee-Eten
Met ondersteuning van
- Dr. I.M. Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Joosten* |
Kinderartsintensivist, hoogleraar voeding en metabolisme van het zieke kind Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Beraadsgroep Gezondheidsraad voedingsadviezen zwangeren, onbetaald |
Beschrijvende studie gefinancierd door Nutricia naar gastric tolerance bij kinderen op de intensive care. Toelichting: de studie van Joosten betrof specifiek neonaten op de IC en niet de brede groep kinderen met ondervoeding in het ziekenhuis zoals beschreven in deze richtlijnmodules |
Geen actie, onderwerp en studiepopulatie vallen buiten de scope van de richtlijn |
|
Sickinghe |
• 0.7 fte Logopedist- coördinator afdeling Logopedie OLVG, locatie Oost (2006- heden) Ik ben als preverbaal logopedist werkzaam in het moeder -en kindcentrum (Annapaviljoen), nazorgpoli (Annapoli), de kinderafdeling, het klinisch en poliklinisch eetteam. In het Anna Paviljoen worden jaarlijks gemiddeld 60 post IC/HC kinderen opgenomen. Alle kinderen geboren onder 32 weken < 1500 gram en kinderen met voedingsproblemen door andere oorzaken worden door mij logopedisch begeleid bij het leren drinken. Poliklinisch vervolg ik de post IC/HC kinderen tot en met 1.5 jaar in de |
• Voorzitter (2016-heden) NOMAS (Neonatal Oral Motor Assessment) werkgroep voor preverbaal logopedisten werkzaam in ziekenhuizen met baby's van -3 tot+ 3 maanden oud (onbetaald) |
Geen |
Geen |
|
Van den Berg |
Kinderarts MDL in het WKZ/UMCU 0.8 fte |
Lid expertisegroep Voeding NVK, 4-jaarlijkse vergadering, onbetaald; onder andere bijdrage aan Werkboek voeding voor zieke kinderen, onderwijs op het gebied van voeding, ontwikkeling protocollen. |
Adviesraad Nutricia. Tweejaarlijkse bijeenkomst, waarbij oordeel gevraagd wordt over ontwikkeling van producten. Vergoeding voor aanwezigheid bij bijeenkomst. |
Van den Berg is niet als trekker betrokken bij de modules die gaan over voedingsbeleid of de behandeling van ondervoeding. |
|
van Gemert |
Afdelingshoofd Kinderchirurgie in MUMC+ |
Full time contract bij MUMC+ als afdelingshoofd kinderchirurgie |
Geen |
Geen |
|
Verbruggen |
Kinderarts Intensivist Erasmus MC Sophia Kinderziekenhuis Wetenschappelijk onderzoeker 'metabolisme en voeding van het kritiek zieke kind' |
Voorzitter ESPNIC Metabolism and Nutrition section - onbetaald |
Sophia Foundation Scientific Research (SSWO) ' Continuous versus Intermittent Nutrilion in pediatric Intesive care - ContInNuPIC' 2018 / €445,485, = , Nutricia research BV 'Clinical and mechanistic aspects of enteral insufficiency in paediatric intensive care' 2017 / €44,660, = , ESPEN Research Grant 2016 ' Long-term consequences of caloric restriction during the first week of pediatric critical illness' 2016 / €44,600,=, Sophia Foundation Scientific Research (SSWO) 'Neurocognitive outcome after critical illness: the role of phthalate exposure from medical devices - MEDIPLASTICS' 2016 / €135,855, = , AGIS zorginnovatie 'Long-term outcome of caloric restriction during the first week of
Speakers fee voor presentaties voor Nurtricia Advanced Medical Reseach en baxter |
Toelichting: het onderzoek van Verbruggen betrof specifiek kinderen op de IC en niet de brede groep kinderen met ondervoeding in het ziekenhuis. Daarnaast is Verbruggen niet betrokken bij de modules die gaan over voedingsbeleid of de behandeling van ondervoeding. |
|
Voskuijl |
Kinderarts EKZ. Klinisch senior onderzoeker Amsterdam Insitute for Global l health & developerment (AIGHD) |
PI Chain-network in Malawi --> Life leader in Malawi (nu onbetaald) https://chainnetwork.org/ |
Niet van toepassing, ik heb ervaring met behandeling van ernstige aandoening van de low resource setting. Het ondervoedings onderzoek in Malawi wordt door de Gates foundation betaald. |
Geen |
|
Westerbeek |
Kinderarts |
Lid expertisegroep voeding NVK |
Geen |
Geen |
|
Winder |
Diëtist kindergeneeskunde. Werkgever. Noordwest ziekenhulsgroep, locatie Alkmaar |
Lid Stuurgroep ondervoeding, sectie kinderen. Onbetaald. Lid DKTZ (netwerk Diëtisten Kindergeneeskunde Topklinische Ziekenhuizen) Onbetaald. |
Geen |
Geen |
|
Klankbordgroep |
|
|
|
|
|
Eiting |
Kinderverpleegkundige (24u/wk) medisch spectrum Twente, Enschede |
Lid OCP-netwerk afd. kinderverpleegkunde VVN (organisatie contactpersonen, landelijk overleg tussen verschillende instellingen waar kinderverpleegkundige zorg wordt geleverd), onbetaalde werkzaamheden |
Geen |
Geen |
|
Van Leeuwen |
Pedagogisch medewerker bij kindercentrum het Kickertje. |
Voorzitter van de vereniging Nee-eten. Dat is een onbetaalde functie. |
Mijn medewerking is adviserend en ik ben niet uit op intellectueel gewin of erkenning. |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patientorganisaties voor de Invitational conference. De verkregen input is besproken in de werkgroep en meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de voedingszorg voor kinderen opgenomen (geweest) in het ziekenhuis. Tevens zijn er knelpunten aangedragen via een schriftelijke knelpunteninventarisatie. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
