Methotrexaat bij off-labelgeneesmiddelen in de dermatologie
Uitgangsvraag
Wat is de veiligheid en werkzaamheid/effectiviteit van off-label behandeling met MTX bij patiënten met huidziekten?
Aanbeveling
Gezien het feit dat de bewijskracht met betrekking tot veiligheid laag is (zie hierboven 'Conclusie') blijft er onzekerheid over het exacte veiligheidsrisico bij het gebruik van MTX als een off-label voorgeschreven geneesmiddel. De werkgroep houdt rekening met deze onzekerheid bij het formuleren van aanbevelingen voor de afzonderlijke huidziekten. De zwakke aanbevelingen bij de verschillende ziektebeelden kunnen worden gelezen als een aanbeveling om MTX te overwegen.
Overwegingen
In vergelijking met de bijwerkingen van MTX die in de SmPC-tekst worden genoemd, lijkt het erop dat de bijwerkingen die in de geselecteerde studies zijn gemeld, zeer vergelijkbaar zijn.
Het profiel van bijwerkingen is zeer waarschijnlijk beïnvloed door gelijktijdig gebruik van andere medicatie. In veel van de geselecteerde studies werden de patiënten ook behandeld met systemische corticosteroïden, wat het optreden van een Cushing uiterlijk, striae en gewichtstoename verklaart.
In de geselecteerde studies werden 42 sterfgevallen gemeld, maar slechts 1 sterfgeval kon worden toegeschreven aan behandeling met MTX.
Onderbouwing
Achtergrond
Methotrexaat (MTX) is een foliumzuurantagonist die behoort tot de cytotoxische middelen, ook bekend als antimetabolieten. Het therapeutische effect is gebaseerd op competitieve remming van het enzym dihydrofolaat reductase (DHFR) en dus op remming van DNA-synthese. Het blijft onduidelijk of de werkzaamheid van MTX bij de behandeling van psoriasis, artritis psoriatica en chronische polyartritis het gevolg is van een ontstekingsremmend en/of immunosuppressief effect en in hoeverre de MTX-geïnduceerde verhoging van de extracellulaire adenosineconcentratie op ontstekingsplaatsen bijdraagt aan deze effecten.
MTX wordt alleen of, vaker, in combinatie met andere middelen, die de immuunrespons beïnvloeden, gebruikt als immunosuppressivum. Therapeutisch effect kan een corticosteroïd-spaarzaam effect includeren, waardoor de toxiciteit geassocieerd is met hoge dosering en langdurig gebruik van corticosteroïden wordt verminderd. MTX, in combinatie met corticosteroïden en/of andere geneesmiddelen en procedures, is in Nederland in licentie gegeven voor de behandeling van onder andere de volgende ziekten:
- Psoriasis
- Mycosis fungoides
- Ernstige reumatoïde artritis
- Acute lymfoblastische leukemie
- Osteosarcoma
- Non-Hodgkin lymfoom
- Burkitt lymfoom
- Gynaecologische tumoren (choriocarcinoom, chorioadenoma destruens, mola hydatidosa)
Samenvatting literatuur
Er werd een literatuuronderzoek uitgevoerd in Medline (1950- november 2019), EMBASE (1980- november 2019) en CENTRAL (november 2019). Als belangrijkste zoekstrategie werden 'methotrexaat' en synoniemen gebruikt in combinatie met alle huidziekten; bijvoorbeeld de zoekstrategie in Medline:
1. derm*.jn.
2. Methotrexate/
3. (methotrexate* or amethopterin* or mexate*).ab.
4. (methotrexate* or amethopterin* or mexate*).ti.
5. (methotrexate* or amethopterin* or mexate*).kw.
6. 2 or 3 or 4 or 5
7. 1 and 6
8. exp Skin Diseases/
9. 6 and 8
10. 7 or 9
11. limit 10 to (humans and (dutch or english or french or german))
Resultaten van het literatuuronderzoek
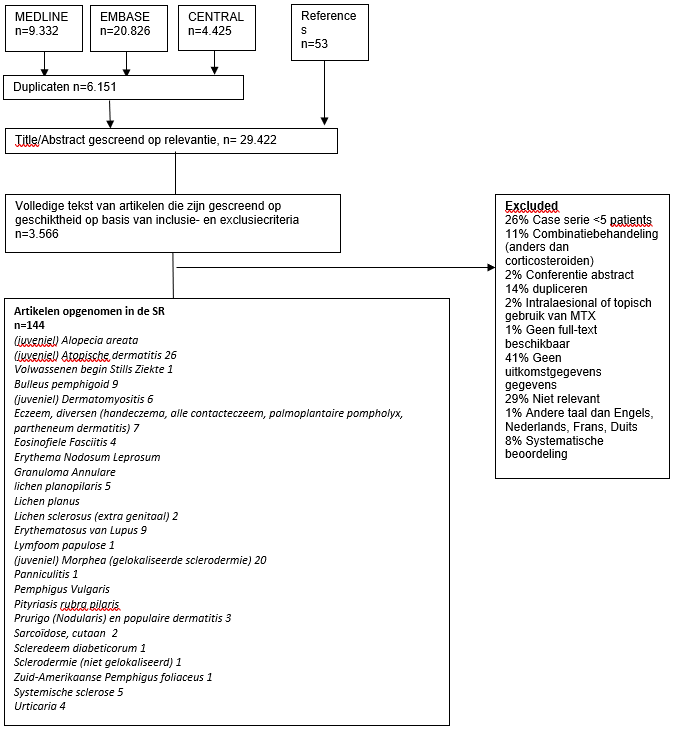
Figuur 1 geeft een overzicht van het selectieproces. Een eerste zoekopdracht heeft 34.583 artikelen opgehaald. Na het screenen van titel en abstract om in aanmerking te komen, werden 3.566 artikelen geselecteerd. Na het lezen van de volledige tekst werden 142 artikelen opgenomen.
Figuur 1. Stroomdiagram waarin het selectieproces voor studies met betrekking tot off-label behandeling met methotrexaat bij huidziekten wordt samengevat
Opmerking!
De tekst in deze sectie is gebaseerd op de samenvatting van de productkenmerken (SmPC) tekst van MTX tabletten 2.5 en 10 mg (laatste update april 2022) en MTX injectievloeistof 2.5 en 25 mg/ml (beide laatst bijgewerkt januari 2022) en 100 mg/ml (laatste update maart 2022) en 20 mg/ml (laatste update april 2022) geproduceerd bij Sandoz, online beschikbaar via http://www.cbg-meb.nl. Ook de richtlijn psoriasis 2017online beschikbaar via www.nvdv.nl) en de RIVM richtlijn vaccinatie bij immunosupressiva worden gebruikt. Indien niet anders vermeld, wordt de informatie verkregen uit deze referenties. Wijzigingen zijn weergegeven in een grijze vierkant. Het is raadzaam om de aanbevelingen in overweging te nemen bij het voorschrijven van MTX, maar de tekst is niet bedoeld als vervanging voor de volledige SmPC-tekst. De volledige en actuele Nederlandse SmPC tekst is beschikbaar op www.cbg-meb.nl.
Bewijs over de veiligheid o.b.v. RCT's
In totaal werden 12 RCT's opgenomen in deze richtlijn, waarin 415 patiënten werden toegewezen om MTX te gebruiken. De gebruikte dosering verschilde tussen de studies. Elf van de 12 RCT's hebben geen ernstige bijwerkingen gemeld (Bakhtiar, Carneiro, Islam, Naeini, Pope, Ruperto, Sharma, van den Hoogen, Zulian). Leducq et al. rapporteerden echter een ernstige bijwerking op een cerebrovasculaire beroerte en onstabiele angina pectoris.
Referenties
- SmPC text Methotrexate Sandoz 2.5mg tablet 31 July 2020: https://www.geneesmiddeleninformatiebank.nl/smpc/h120371_smpc.pdf
- Dutch Guideline Psoriasis: http://www.nvdv.nl/wp-content/uploads/2014/08/180605_definitieve-versie-richlijnherziening-psoriasis-2017.pdf
- Dutch Guideline Atopic Dermatitis: https://www.alii.care//engine/download/blob/alii/470/2021/1/NVDV_Richtlijn_Constitutioneel_Eczeem_update_2019_1.pdf?app=alii&class=74&id=2863&field=470
- Dutch Childrens formulary: www.kinderformularium.nl
- Dutch Farmacotherapeutical Compass: www.farmacotherapeutischekompas.nl
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-10-2023
Beoordeeld op geldigheid : 05-06-2023
Samenstelling werkgroep
|
Werkgroepleden – versie 2015 |
Vereniging |
|
J.G. (Jan Gerrit) van der Schroeff, MD, PhD |
Dermatoloog, voorzitter richtlijnwerkgroep |
|
J.J.E. (Jannes) van Everdingen, MD, PhD |
Director NVDV |
|
M. E. (Mandy) Schram, MD |
Dermatoloog |
|
P. (Pieter) van der Valk, MD, PhD |
Dermatoloog |
|
W.R. (William) Faber MD. PhD, FRCP |
Dermatoloog |
|
A. (Annemieke) Horikx, PharmD |
Apotheker KNMP |
|
E.P. (Eugène) van Puijenbroek, MD, PhD |
Klinisch farmacoloog Lareb |
|
R.I.F. (Rutger) van der Waal, MD, PhD |
Dermatoloog |
|
E.L. (Noortje) Swart PhD |
Klinisch farmacoloog |
|
Ph. I. (Phyllis) Spuls, MD, PhD |
Dermatoloog |
|
Werkgroepleden – versie 2023 |
Vereniging |
|
Ph. I. (Phyllis) Spuls, MD, PhD |
Dermatoloog, voorzitter richtlijnwerkgroep |
|
A.L. (Ly) Nguyen, MD |
Dermatoloog |
|
C. (Charlotte) Vrijman, MD, PhD |
Dermatoloog |
|
A.M. (Astrid) van Huizen, MD, PhD student |
Dermatoloog in opleiding, AMC |
|
J.J.E. (Jannes) van Everdingen, MD, PhD |
NVDV |
|
W.A. (Annefloor) van Enst, MD PhD |
Directeur NVDV |
|
Z. (Zekeriya) Çiftçi, MD |
Arts-onderzoeker NVDV |
|
M. (Marit) Stolting, MD |
Arts-onderzoeker NVDV |
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
|
M.E. Schram (voorzitter)
|
dermatoloog ZBC Multicare, dermatoloog Prescan |
n.v.t.
|
geen
|
geen
|
geen
|
geen |
geen
|
2-7-2021
|
|
R. van der Waal |
dermatoloog bij MSB Gooi en Eemland
|
Lid wetenschappelijke adviesraad Prelum uitgevers (o), Lid kernteam Track Cura, director of education (o), Initiatiefnemer Dermanet, leerplatform dermatologie (o), Voorzitter stichting orale pathologie (o). |
n.v.t. |
n.v.t.
|
n.v.t.
|
n.v.t. |
n.v.t. |
6-6-2021 |
|
A.L. Nguyen
|
dermatoloog LUMC
|
Lid domeingroep Dermatotherapie, lid werkgroep 'in het Kort' voor NTvDV. |
geen
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
4-6-2021
|
|
C. Vrijman |
dermatoloog vrij gevestigd ZGT |
lid domeingroep Pigment NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
7-6-2021 |
|
P. Spuls
|
hoogleraar dermatologie Amsterdam UMC
|
geen
|
A departmental independent research grant for TREAT NL registry Leopharma December 2019. Involved in performing clinical trials with many pharmaceutical industries that manufacture drugs used for the treatment of e.g. psoriasis and atopic dermatitis for which they get financial compensation paid to the department/hospital. Chief investigator of the systemic and phototherapy atopic eczema registry TREAT NL for adults and children. One of the main investigators of the SECURE-AD registry. |
n.v.t.
|
A departmental independent research grant for TREAT NL registry Leopharma December 2019. Involved in performing clinical trials with many pharmaceutical industries that manufacture drugs used for the treatment of e.g. psoriasis and atopic dermatitis for which they get financial compensation paid to the department/hospital. Chief investigator of the systemic and phototherapy atopic eczema registry TREAT NL for adults and children. One of the main investigators of the SECURE-AD registry. |
lid van adviescommissie blad Psoriasis van de Psoriasisvereniging Nederland
|
n.v.t.
|
21-8-2020
|
|
A. van Huizen
|
arts-onderzoeker dermatologie Amsterdam UMC |
n.v.t. |
n.v.t. |
n.v.t.
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
13-7-2021
|
|
Z. Çiftçi
|
arts-onderzoeker dermatologie NVDV |
n.v.t.
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
n.v.t.
|
08-07-2021 |
Werkwijze
Doel
Een richtlijn en de daaruit afgeleide documenten (bijv. patiënten informatie) geven aanbevelingen voor het juiste off-label gebruik van MTX in patiënten, kinderen en volwassenen, om zo de patiënten zorg te verbeteren.
Beoogde gebruikers
De richtlijn is bedoeld voor artsen, met name dermatologen, huisartsen en apothekers. Een tekst afgeleid van de richtlijn zal beschikbaar zijn voor patiënten.
Samenstelling van de werkgroep
Voor de ontwikkeling van de richtlijn is een werkgroep benoemd. De werkgroep bestond uit dermatologen, apothekers en een huisarts van Lareb (Nederlands Geneesmiddelenbewakingscentrum). Bij de samenstelling van de werkgroep werd rekening gehouden met de geografische spreiding van de leden en met een evenwichtige vertegenwoordiging van academische en niet-academische werkzame specialisten. De werkgroepleden hebben onafhankelijk gehandeld en er zijn geen belangenconflicten gemeld.
Methodologie van de werkgroep
Een richtlijn is een document met aanbevelingen ter ondersteuning van de patiëntenzorg in de dagelijkse praktijk. De richtlijn is gebaseerd op resultaten van het zoeken in wetenschappelijke literatuur en de daaropvolgende consensus van de werkgroep, gericht op het beslissen over de juiste medische interventie.
De werkgroep heeft een ontwerprichtlijn opgesteld. Een expertgroep heeft tijdens de voorbereidende fase een knelpuntanalyse gemaakt. De expertgroep stelde een lijst samen van geneesmiddelen, die vaak off-label worden gebruikt in de dermatologie. De vermelde geneesmiddelen werden geprioriteerd op basis van de frequentie van gebruik en het optreden van mogelijke ernstige bijwerkingen. De leden van de werkgroep hadden de gelegenheid wijzigingen in de lijst van geselecteerde geneesmiddelen voor te stellen. Ze kwamen overeen een richtlijn op te stellen over het off-label gebruik van de volgende 6 geselecteerde geneesmiddelen:
- azathioprine
- ciclosporine
- dapsone
- hydroxychloroquine
- methotrexaat
- sulfasalazine
De werkgroep was het erover eens dat de resultaten van effectiviteit en veiligheid cruciaal zijn voor de besluitvorming. De werkgroep begon met het opstellen van een ontwerprichtlijn voor azathioprine en besloot dat de toegepaste methoden zouden dienen als blauwdruk voor de ontwikkeling van een ontwerprichtlijn voor de andere 5 bovengenoemde geneesmiddelen. Nuttige literatuur werd gevonden door systematische zoekopdrachten en door het controleren van referenties (zie “Methodologie van literatuuronderzoek”). De werkgroepleden beoordeelden de relevante literatuur inhoudelijk en kwalitatief. Vervolgens trokken de werkgroepleden conclusies en deden zij aanbevelingen over off-label gebruik van de geselecteerde 6 geneesmiddelen. De definitieve versie van de richtlijn werd goedgekeurd door alle betrokken wetenschappelijke verenigingen.
Methodologie van literatuuronderzoek
Onderzoeksvraag
Voor elk geselecteerd geneesmiddel werd een onderzoeksvraag gesteld volgens PICO. PICO staat voor:
- Participants/populatie: populatie van patiënten met een huidziekte die wordt behandeld met een geneesmiddel dat niet is geregistreerd voor het gebruik van deze specifieke ziekte.
- Intervention: het geselecteerde geneesmiddel.
- Comparison: elke andere behandeling (bv. andere systemische therapie, placebo, interventie van de kwaliteit van leven), in geval van gebrek aan een controlegroep; geen andere behandeling.
- Outcome (uitkomstmaat): veiligheid en/of effectiviteit / werkzaamheid.
Zoekstrategie
Voor elk geselecteerd geneesmiddel werd een zoekopdracht uitgevoerd. Voor MTX werd dit gedaan in de databases Medline (door PubMed) van 1950-november 2019, EMBASE van 1980- november 2019 en CENTRAL tot november 2019. Literatuurspecialist Monique Wessels van de afdeling 'Kennisinstituut van de Federatie Medisch Specialisten ' ontwierp deze zoekstrategie. Ook referenties van opgenomen artikelen werden gescreend om in aanmerking te komen.
Selectie van artikelen
Alle artikelen met titel en samenvatting die verwijzen naar off-label behandeling met het betreffende geneesmiddel bij patiënten met huidziekten werden geselecteerd. Om de geschiktheid te bepalen, werd de volledige tekst van de geselecteerde artikelen gescreend op basis van de vooraf gedefinieerde inclusie- en exclusiecriteria. Gegevens over methodologische kwaliteit, studiekenmerken, effectiviteit / werkzaamheid en veiligheid werden geëxtraheerd aan de hand van een gegevensextractieformulier. Twee onafhankelijke onderzoekers voerden alle stadia van literatuurselectie en gegevensextractie uit. Meningsverschillen over studieselectie en data-extractie werden opgelost door discussie.
Inclusie- en exclusiecriteria
Met behulp van de volgende vooraf gedefinieerde inclusie- en exclusiecriteria werd de selectie van de artikelen uitgevoerd.
Inclusiecriteria:
- Het artikel gaat over het geselecteerde geneesmiddel
- Het geselecteerde geneesmiddel wordt gebruikt bij de behandeling van een huidziekte waarvoor dat specifieke geneesmiddel niet in Nederland is geregistreerd (tot november 2019).
Exclusiecriteria:
- Case reports met minder dan 5 patiënten*
- Gebrek aan gegevens over veiligheid en werkzaamheid/effectiviteit
- Artikelen betreffende andere behandeling dan systemische behandeling met het geselecteerde geneesmiddel
- Topisch of intralesionaal gebruik van het geneesmiddel
- Enquêtes op basis van vragenlijsten
- Conference abstracts
- Systematische reviews (zonder meta-analyse)
- Cutane bijwerkingen van MTX
- Dierproeven
- In vitro studies
- Dubbele publicaties
- Andere talen dan Engels, Frans, Duits en Nederlands
- Volledige tekst niet beschikbaar
* Tijdens de zoektocht naar de periode <2010 is een aselecte steekproef van de niet-geselecteerde artikelen genomen om te controleren of relevante bijwerkingen zijn gemist.
Methodologische kwaliteit
Gerandomiseerde gecontroleerde studies (RCT's) werden beoordeeld volgens het criteriasorteringssysteem dat is beschreven in het Cochrane Handbook voor systematische beoordelingen van interventies 6.1.0 (bijgewerkt in 2020). Om het risico van bias binnen opgenomen RCT's te beoordelen, werden de volgende parameters voor methodologische kwaliteit gebruikt; randomisatie methode, blindering (van deelnemers, onderzoekers en uitkomstbeoordeling), uitval van patiënten, aanwezigheid van selectieve uitkomstrapportage en andere potentiële bedreigingen voor de validiteit.
Studiekenmerken
Geëxtraheerde gegevens worden gepresenteerd in tabellen en met begeleidende tekst per ziekte op gestandaardiseerde wijze. Er werden gegevens verzameld over:
- Studieontwerp: gerandomiseerd, gecontroleerd, prospectief, retrospectief
- Behandeling onderzoeksarmen
- Ziekte van de proefpersonen: ernst, stadium, subtype, duur
- Eerdere geneesmiddelen
- Patiënten: aantal, geslacht, leeftijd, subgroepen
- Duur van de behandeling
- Duur van de follow-up
- Gelijktijdige medicatie
- Doseringsschema van het geselecteerde geneesmiddel
Werkzaamheid/effectiviteit
- Gebruikte uitkomstparameters: klinische beoordeling, globale beoordeling, meting van de kwaliteit van leven, laboratoriummarkers, begin van het effect, duur van de remissie, terugvalpercentage
- Ernstresultaten: het resultaat van de gebruikte uitkomstparameters. Verschillen tussen baseline en einde van de behandeling/studie en tussen behandelgroepen.
Veiligheid
Veiligheid is een belangrijk punt bij off-label gebruik van medicatie. Binnen de geselecteerde onderzoeken werd elke studie die (ernstige) bijwerkingen meldde meegenomen in de richtlijn.
Er werden gegevens verzameld over:
- Bijwerkingen: welke en hoeveel
- Ernstige bijwerkingen: welke en hoeveel
Een bijwerking werd gedefinieerd als een ongunstige en onbedoelde uitkomst, met inbegrip van een abnormale laboratoriumbevinding, symptoom of ziekte die verband houdt met het gebruik van een medische behandeling of procedure, ongeacht of deze wordt beschouwd als gerelateerd aan de medische behandeling of procedure die zich in de loop van het onderzoek heeft voorgedaan.
Een ernstige bijwerking werd gedefinieerd als elk ongewenst medisch voorval dat ziekenhuisopname of verlenging van een bestaande ziekenhuisopname vereiste, levensbedreigend was, resulteerde in aanhoudende of significante invaliditeit / abeidsongeschiktheid, een aangeboren afwijking / geboorteafwijking of in het onderzoek als zodanig gemeld of resulterend in overlijden.
Kwaliteit van het bewijs
Normaliter wordt de kwaliteit van het bewijs beoordeeld volgens de GRADE-methodiek. Echter, de GRADE-methodiek is toepasbaar bij vergelijkend onderzoek. In geval van off-label medicatie kan verwacht worden dat er met name in observationeel onderzoek is uitgevoerd, zoals een case-series of een case-report. Naast het feit dat het onderwerp off-label, zich minder goed leent voor gerandomiseerd gecontroleerd onderzoek (RCT) if de belangrijkste uitkomstmaat de veiligheid, terwijl een typische RCT wordt gepowered op de uitkomstmaat effectiviteit.
Om een richtlijn ook te kunnen baseren op het beschikbaar (obervationele) bewijs is gekozen om het studiedesign niet te limiteren tot vergelijkend onderzoek (RCT en CCT) waarmee de toepassing van GRADE niet meer mogelijk is.
Er is gekozen om per uitkomstmaat de potentiële beperkingen te beschrijven, maar geen niveau van bewijs te geven, aangezien dit bij niet vergelijkend onderzoek niet geduidt kan worden. Wel zijn soortgelijke principes gevolgd, waaronder per uitkomstmaat rekening te houden met de volgende factoren:
- Risico op bias
- Indirectheid van het bewijs
- Inconsistentie
- Onnauwkeurigheid
- Publicatie bias
De gebruikte zoekresultaten zijn up-to-date tot ten minste november 2019.
Het opstellen van de aanbevelingen
Voor de ontwikkeling van een aanbeveling zijn ook andere aspecten dan wetenschappelijk bewijs van belang, zoals: patiëntvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke gevolgen of kosten. Bekende bijwerkingen die in de samenvatting van de productkenmerken (SmPC) worden genoemd, zijn meegenomen, voor zover ze nog niet uit de wetenschappelijke literatuur zijn gedestilleerd.
Op basis van literatuur wordt de conclusie vertaald in de context van de dagelijkse praktijk en worden de voor- en nadelen van de verschillende behandelingen tegen elkaar afgewogen. De uiteindelijke geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen en kan worden geformuleerd als een zwakke of sterke aanbeveling tegen of ten gunste van een bepaalde therapie (zie kader hieronder). Het doel van deze procedure en de formulering van de richtlijn met behulp van dit formaat is het vergroten van de transparantie van de richtlijn. Het creëert ruimte voor een efficiënte discussie tijdens de vergaderingen van de werkgroep en bovendien verbetert het de duidelijkheid voor de gebruiker van de richtlijn.
|
Aanbeveling
|
Uitvoering en evaluatie
Tijdens de verschillende fasen van de ontwikkeling van de conceptrichtlijn wordt zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt via internet verspreid onder alle relevante beroepsgroepen, ziekenhuizen en poliklinieken en wordt ook besproken in diverse medische tijdschriften.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar wetenschappelijk en breed onderbouwde inzichten en aanbevelingen waaraan artsen moeten voldoen om kwalitatief goede medische zorg te kunnen bieden. Aangezien richtlijnen uitgaan van het omgaan met 'gemiddelde patiënten', kunnen artsen in individuele gevallen afwijken van de richtlijnen wanneer dat nodig is. Afwijking van de richtlijn - indien vereist door de situatie van de patiënt - is soms zelfs noodzakelijk. Opzettelijke afwijking van de richtlijn moet echter worden uitgelegd en gedocumenteerd in het medisch dossier en, indien nodig, met toestemming van de patiënt. Artikel 68 van de Geneesmiddelenwet van 2 maart 2009 luidt als volgt over off-label geneesmiddelenvoorschrift: 'Het voorschrijven van geneesmiddelen buiten de geregistreerde indicaties door het College ter Beoordeling van Geneesmiddelen is alleen toegestaan indien dit wordt ondersteund door richtlijnen en protocollen die door de beroepsgroep zijn ontwikkeld. Wanneer de richtlijnen en protocollen zich nog in de ontwikkelingsfase bevinden, is overleg tussen de behandelend arts en de apotheker noodzakelijk.' (Oorspronkelijke tekst: 'Het buiten de deur van het College geregistreerde indicaties voor het schrijven van geneesmiddelen is alleen geoorloofd wanneer over de beroepsgroep protocollen van standaarden worden ontwikkeld. Als de protocollen van standaarden nog in ontwikkeling zijn, is overleg tussen de behandelende kunsten en de apotheker noodzakelijk.' )
Autorisatie van de richtlijn
De richtlijn is goedgekeurd door:
- Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Huid Nederland (HN)
Onderhoud van de richtlijn
Een richtlijn kan alleen leidend zijn, als deze op een continue basis wordt onderhouden, met systematische en continue monitoring van medisch-wetenschappelijke literatuur en regelmatige bijdragen uit de klinische praktijk. In geval van belangrijke ontwikkelingen kan worden besloten dat de volledige werkgroep bijeenkomt om amendementen voor te stellen, die over de verschillende beroepsgroepen zullen worden verdeeld. Er wordt een herziening gepland wanneer er nieuwe gegevens beschikbaar zijn.
Referenties
- Search EMBASE, MEDLINE by OVID: www.ovid.com
- Search CENTRAL: http://cochranelibrary-wiley.com/cochranelibrary/search?searchRow.searchOptions.searchProducts=clinicalTrialsDoi
- Cochrane Handbook for systematic reviews of interventions 6.1.0: http://training.cochrane.org/handbook
- GRADE workinggroup: www.gradeworkinggroup.org
Article 68 of the Dutch Medicines Act of March 2nd 2009: http://wetten.overheid.nl/BWBR0021505/2018-01-01