Oesofaguscarcinoom - Incidentie
In de laatste twee decennia is de incidentie van het oesofaguscarcinoom fors toegenomen. In 1989 werd in Nederland 684 maal de diagnose oesofaguscarcinoom gesteld, terwijl deze ziekte in 2009 bij 1.900 patiënten werd vastgesteld (NKR cijfers).
Ook het leeftijdgestandaardiseerde aantal per 100.000 inwoners nam toe: van 4.6 tot 8.5. De stijging is voor het grootste deel toe te schrijven aan een toename van het adenocarcinoom bij mannen (figuur 1). Figuur 1. Leeftijdsgestandaardiseerd aantal nieuwe patiënten met oesofaguscarcinoom, per 100.000 inwoners, 1973-2008*).
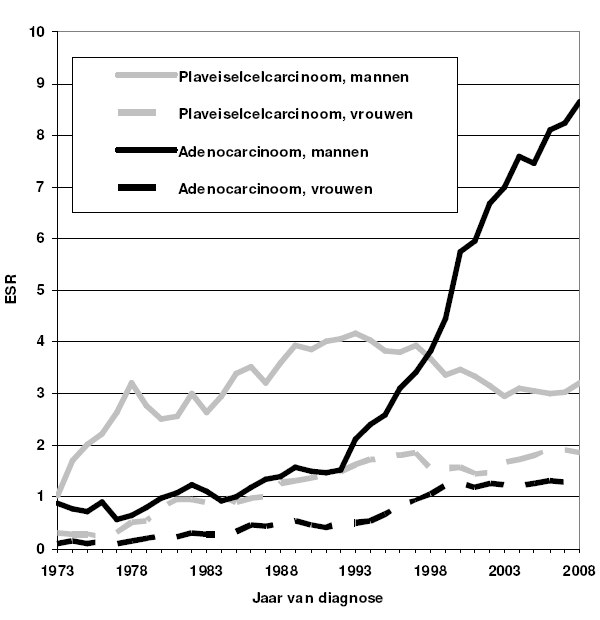
ESR = European Standardised Rate
(*)Omwille van de weergave van de trends in de jaren ‘70 en ‘80 van de vorige eeuw is in deze figuur gebruik gemaakt van gegevens van de reeds langer lopende Kankerregistratie van het Integraal Kankercentrum Zuid. De incidentie in deze regio is vergelijkbaar met de rest van Nederland, met een iets hogere incidentie in het Noordoosten en Zuidwesten van het land.
Wereldwijd is er een aanzienlijke spreiding in het voorkomen van het oesofaguscarcinoom. De ziekte kent een hoge incidentie in delen van China, Korea en Japan, maar ook in Zuid-Amerika (1). De hoge incidentie daar is echter te wijten aan het veelvuldig voorkomen van het plaveiselcelcarcinoom; de incidentie van het adenocarcinoom is lager dan in de Westerse wereld, waar het adenocarcinoom ten opzichte van het plaveiselcelcarcinoom in de meeste landen fors is toegenomen sinds de jaren '80 en '90 van de vorige eeuw. Binnen Europa is de incidentie van het oesofaguscarcinoom het laagst in Zuid-Europa, en het hoogst in West-Europa. De incidentie in Nederland is na Groot-Brittannië de hoogste in Europa (2).
De kans op het ontwikkelen van een oesofaguscarcinoom stijgt in Nederland richting anderhalve procent bij mannen en is ongeveer een half procent bij vrouwen (cijfersoverkanker.nl). Het oesofaguscarcinoom vormt bij mannen 2.7% van het totaal aantal maligniteiten, en heeft daarmee het maagcarcinoom verdrongen uit de top 10 van meest voorkomende maligniteiten. Bij vrouwen is dat percentage 1.1% (cijfersoverkanker.nl). De man-vrouw ratio met betrekking tot incidentie in Nederland nam toe tot 3.5, en is daarmee één van de hoogste van alle tumoren (na mesothelioom, Kaposisarcoom, glottis-, en blaascarcinoom). Het merendeel van de patiënten met een oesofaguscarcinoom is bij diagnose ouder dan 60 jaar (65-70%). Slechts 4% van de nieuwe patiënten is jonger dan 45 jaar. De ziekte openbaart zich bij vrouwen over het algemeen op latere leeftijd dan bij mannen: van de mannelijke nieuwe patiënten is 19% ouder dan 75 jaar, vergeleken met 38% bij vrouwen (cijfersoverkanker.nl). Oudere kankerpatiënten hebben naast kanker ook vaak andere, bijkomende ziektes (comorbiditeit). Patiënten met een oesofaguscarcinoom hebben over het algemeen méér comorbiditeit (72% van de mannelijke patiënten tussen 65 en 75 jaar) dan andere kankerpatiënten, met name cardiovasculaire aandoeningen komen relatief vaker voor bij patiënten met een oesofaguscarcinoom (36% van de mannelijke patiënten tussen 65 en 75 jaar) dan bij andere kankerpatiënten (3) (4).
Voor de inschatting van eventuele aanwezigheid van oesofaguscarcinoom kunnen de parameters leeftijd en geslacht hun waarde hebben in de beslissing een patiënt te verwijzen voor endoscopie, zie tabel - Leeftijdspecifieke incidentie van oesofaguscarcinoom (per 100.000 personen)
|
Leeftijd |
Mannen |
Vrouwen |
|
25-29 |
0 |
0 |
|
30-34 |
0,3 |
0,2 |
|
35-39 |
0,2 |
0,9 |
|
40-44 |
2,7 |
1,8 |
|
45-49 |
5,4 |
1,8 |
|
50-54 |
14,6 |
5,6 |
|
55-59 |
16,7 |
6,2 |
|
60-64 |
28,3 |
9,3 |
|
65-69 |
47,2 |
11,8 |
|
70-74 |
53,1 |
14,2 |
|
75-79 |
58,4 |
22,3 |
|
80-84 |
60,3 |
22,9 |
|
85+ |
62,3 |
27,1 |
Stadium bij diagnose Er deden zich sinds 1990 in Nederland geen grote verschuivingen in stadium bij diagnose voor; wel was er een afname van de proportie patiënten met een onbekend stadium van 25% naar 17%, en een toename van het aandeel patiënten met op afstand gemetastaseerde ziekte (van 30% naar 40%). Deze veranderingen hebben waarschijnlijk te maken met de verbeterde (beeldvormende) diagnostiek.
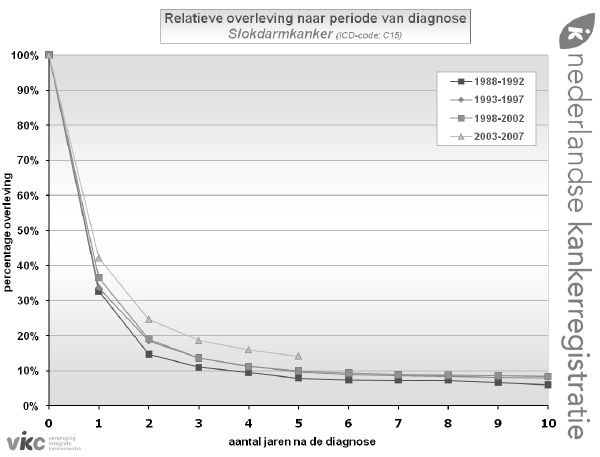
Overleving De vijfjaars relatieve overleving van patiënten met een oesofaguscarcinoom in Nederland is vergelijkbaar met het Europese gemiddelde, en nam toe van 8% in 1988-1992 tot 15% in 2003-2007 (figuur 2). Aangezien het oesofaguscarcinoom daarmee nog steeds een van de meest letale tumoren is, volgen de trends in mortaliteit die van de incidentie; Nederland heeft dan ook analoog aan de incidentie het hoogste mortaliteitscijfer in Europa na Groot-Brittannië (12 per 100.000 mannen en ruim 3 per 100.000 vrouwen) (2).
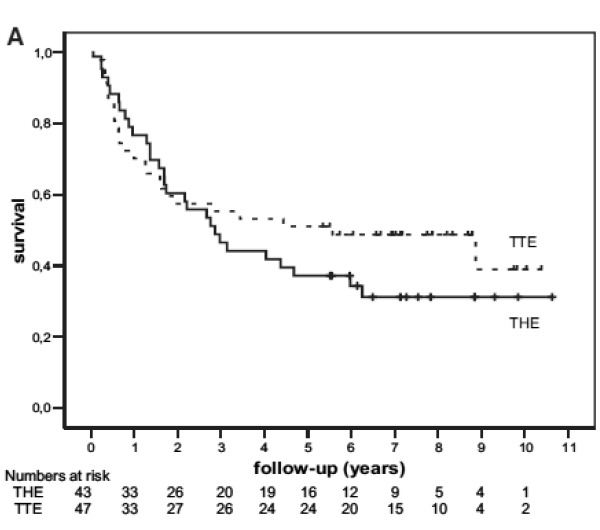
Bij in opzet curatief geopereerde patiënten met een adenocarcinoom van de distale oesofagus bedroeg de vijfjaarsoverleving 37%-51%, afhankelijk van de chirurgische benadering (HIVEX trial, transhiataal vs. transthoracaal, verschil niet significant) (figuur 3) (5).
Figuur 2. Relatieve overleving oesofaguscarcinoom in Nederland, 1988-2007, naar periode.
Figuur 3. Ruwe overleving van in opzet curatief geopereerd adenocarcinoom van de oesofagus; langetermijnresultaten van de Nederlandse HIVEX-trial, 1994-2000 (transhiataal (THE) vs. transthoracaal (TTE)) (5)
Onderbouwing
Samenvatting literatuur
In de laatste twee decennia is de incidentie van het oesofaguscarcinoom fors toegenomen. In 1989 werd in Nederland 684 maal de diagnose oesofaguscarcinoom gesteld, terwijl deze ziekte in 2009 bij 1.900 patiënten werd vastgesteld (cijfersoverkanker.nl).
Ook het leeftijdgestandaardiseerde aantal per 100.000 inwoners nam toe: van 4.6 tot 8.5. De stijging is voor het grootste deel toe te schrijven aan een toename van het adenocarcinoom bij mannen (figuur 1).
Figuur 1. Leeftijdsgestandaardiseerd aantal nieuwe patiënten met oesofaguscarcinoom, per 100.000 inwoners, 1973-2008*).

ESR = European Standardised Rate
(*)Omwille van de weergave van de trends in de jaren ‘70 en ‘80 van de vorige eeuw is in deze figuur gebruik gemaakt van gegevens van de reeds langer lopende Kankerregistratie van het Integraal Kankercentrum Zuid. De incidentie in deze regio is vergelijkbaar met de rest van Nederland, met een iets hogere incidentie in het Noordoosten en Zuidwesten van het land.
Wereldwijd is er een aanzienlijke spreiding in het voorkomen van het oesofaguscarcinoom. De ziekte kent een hoge incidentie in delen van China, Korea en Japan, maar ook in Zuid-Amerika (1). De hoge incidentie daar is echter te wijten aan het veelvuldig voorkomen van het plaveiselcelcarcinoom; de incidentie van het adenocarcinoom is lager dan in de Westerse wereld, waar het adenocarcinoom ten opzichte van het plaveiselcelcarcinoom in de meeste landen fors is toegenomen sinds de jaren '80 en '90 van de vorige eeuw. Binnen Europa is de incidentie van het oesofaguscarcinoom het laagst in Zuid-Europa, en het hoogst in West-Europa. De incidentie in Nederland is na Groot-Brittannië de hoogste in Europa (2).
De kans op het ontwikkelen van een oesofaguscarcinoom stijgt in Nederland richting anderhalve procent bij mannen en is ongeveer een half procent bij vrouwen (cijfersoverkanker.nl). Het oesofaguscarcinoom vormt bij mannen 2.7% van het totaal aantal maligniteiten, en heeft daarmee het maagcarcinoom verdrongen uit de top 10 van meest voorkomende maligniteiten. Bij vrouwen is dat percentage 1.1% (cijfersoverkanker.nl). De man-vrouw ratio met betrekking tot incidentie in Nederland nam toe tot 3.5, en is daarmee één van de hoogste van alle tumoren (na mesothelioom, Kaposisarcoom, glottis-, en blaascarcinoom). Het merendeel van de patiënten met een oesofaguscarcinoom is bij diagnose ouder dan 60 jaar (65-70%). Slechts 4% van de nieuwe patiënten is jonger dan 45 jaar. De ziekte openbaart zich bij vrouwen over het algemeen op latere leeftijd dan bij mannen: van de mannelijke nieuwe patiënten is 19% ouder dan 75 jaar, vergeleken met 38% bij vrouwen (cijfersoverkanker.nl).
Oudere kankerpatiënten hebben naast kanker ook vaak andere, bijkomende ziektes (comorbiditeit). Patiënten met een oesofaguscarcinoom hebben over het algemeen méér comorbiditeit (72% van de mannelijke patiënten tussen 65 en 75 jaar) dan andere kankerpatiënten, met name cardiovasculaire aandoeningen komen relatief vaker voor bij patiënten met een oesofaguscarcinoom (36% van de mannelijke patiënten tussen 65 en 75 jaar) dan bij andere kankerpatiënten (3) (4).
Voor de inschatting van eventuele aanwezigheid van oesofaguscarcinoom kunnen de parameters leeftijd en geslacht hun waarde hebben in de beslissing een patiënt te verwijzen voor endoscopie, zie tabel - Leeftijdspecifieke incidentie van oesofaguscarcinoom (per 100.000 personen)
|
Leeftijd |
Mannen |
Vrouwen |
|
25-29 |
0 |
0 |
|
30-34 |
0,3 |
0,2 |
|
35-39 |
0,2 |
0,9 |
|
40-44 |
2,7 |
1,8 |
|
45-49 |
5,4 |
1,8 |
|
50-54 |
14,6 |
5,6 |
|
55-59 |
16,7 |
6,2 |
|
60-64 |
28,3 |
9,3 |
|
65-69 |
47,2 |
11,8 |
|
70-74 |
53,1 |
14,2 |
|
75-79 |
58,4 |
22,3 |
|
80-84 |
60,3 |
22,9 |
|
85+ |
62,3 |
27,1 |
Stadium bij diagnose
Er deden zich sinds 1990 in Nederland geen grote verschuivingen in stadium bij diagnose voor; wel was er een afname van de proportie patiënten met een onbekend stadium van 25% naar 17%, en een toename van het aandeel patiënten met op afstand gemetastaseerde ziekte (van 30% naar 40%). Deze veranderingen hebben waarschijnlijk te maken met de verbeterde (beeldvormende) diagnostiek.
Overleving
De vijfjaars relatieve overleving van patiënten met een oesofaguscarcinoom in Nederland is vergelijkbaar met het Europese gemiddelde, en nam toe van 8% in 1988-1992 tot 15% in 2003-2007 (figuur 2). Aangezien het oesofaguscarcinoom daarmee nog steeds een van de meest letale tumoren is, volgen de trends in mortaliteit die van de incidentie; Nederland heeft dan ook analoog aan de incidentie het hoogste mortaliteitscijfer in Europa na Groot-Brittannië (12 per 100.000 mannen en ruim 3 per 100.000 vrouwen) (2).
Bij in opzet curatief geopereerde patiënten met een adenocarcinoom van de distale oesofagus bedroeg de vijfjaarsoverleving 37%-51%, afhankelijk van de chirurgische benadering (HIVEX trial, transhiataal vs. transthoracaal, verschil niet significant) (figuur 3) (5).
Figuur 2. Relatieve overleving oesofaguscarcinoom in Nederland, 1988-2007, naar periode.

Figuur 3. Ruwe overleving van in opzet curatief geopereerd adenocarcinoom van de oesofagus; langetermijnresultaten van de Nederlandse HIVEX-trial, 1994-2000 (transhiataal (THE) vs. transthoracaal (TTE)) (5)

Referenties
- 1 - Hongo M, Nagasaki Y, Shoji T. Epidemiology of esophageal cancer: Orient to Occident. Effects of chronology, geography and ethnicity. J Gastroenterol Hepatol. 2009;24:729-35.
- 2 - Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008. Eur J Cancer. 2010;46:765-81
- 3 - Janssen-Heijnen ML, Houterman S, Lemmens VE, Louwman MW, Maas HA, Coebergh JW. Prognostic impact of increasing age and co-morbidity in cancer patients: a population-based approach. Crit Rev Oncol Hematol. 2005;55:231-40.
- 4 - Koppert LB, Janssen-Heijnen ML, Louwman MW, Lemmens VE, Wijnhoven BP, Tilanus HW et al. Comparison of comorbidity prevalence in oesophageal and gastric carcinoma patients: a population-based study. Eur J Gastroenterol Hepatol. 2004;16:681-8).
- 5 - Omloo JM, Lagarde SM, Hulscher JB, Reitsma JB, Fockens P, van Dekken H, ten Kate FJ, Obertop H, Tilanus HW, van Lanschot JJ. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal oesophagus. Ann Surg. 2007;246:992-1001).
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-11-2010
Beoordeeld op geldigheid : 01-09-2024
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal vijf jaar na vaststelling) wordt vanuit het IKNL bewaakt. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zonodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Algemene gegevens
In de laatste twee decennia is de incidentie van het oesofaguscarcinoom fors toegenomen. In 1989 werd in Nederland 684 maal de diagnose oesofaguscarcinoom gesteld, terwijl deze ziekte in 2009 bij 1.900 patiënten werd vastgesteld. Ook het leeftijdgestandaardiseerde aantal per 100.000 inwoners nam toe: van 4.6 tot 8.5. De vijfjaars relatieve overleving van patiënten met een oesofaguscarcinoom in Nederland is vergelijkbaar met het Europese gemiddelde, en nam toe van 8% in 1988-1992 tot 15% in 2003-2007. Aangezien het oesofaguscarcinoom daarmee nog steeds een van de meest letale tumoren is, volgen de trends in mortaliteit die van de incidentie; Nederland heeft dan ook analoog aan de incidentie het hoogste mortaliteitscijfer in Europa na Groot-Brittannië.
De zorg voor patiënten met deze tumoren is in voortdurende ontwikkeling, waarbij centraliseren van de diagnostiek en behandeling van patiënten met oesofaguscarcinoom leidt tot betere uitkomsten van zorg. De Nederlandse Vereniging van Maag-Darm-Leverartsen heeft in 2010 met financiering door SKMS en met medefinanciering en onder begeleiding van de toenmalige Vereniging van Integrale Kankercentra (VIKC) - inmiddels Integraal Kankercentrum Nederland (IKNL) - de richtlijn voor de diagnostiek, behandeling, nazorg en follow-up van patiënten met een oesofaguscarcinoom gereviseerd.
Actuele richtlijnen zijn een hulpmiddel om al deze aspecten deze voortdurend verder te verbeteren. Bij goedkeuring (december 2010) van de gereviseerde richtlijn (versie 3.0) is daarom afgesproken deze richtlijn voortaan te onderhouden als ‘levende richtlijn’. Niet één grote revisie om de vier à vijf jaar, maar - zo nodig - tussentijdse revisies van enkele specifieke onderdelen. Zo’n eerste tussentijdse revisie startte begin 2012.
Na een inventarisatie van mogelijke aandachtspunten binnen de werkgroep, focuste deze revisie op een viertal onderdelen (modules) van de richtlijn: beeldvormend onderzoek (pre-operatieve diagnostiek en herstadiëring), resectievrije marge (onderdeel uit de paragraaf prognostische factoren, hoofdstuk pathologie), neoadjuvante behandelingen, spreiding en concentratie. Met uitzondering van de module resectievrije marge betrof het evidence based revisies. Deze modules zijn november 2014 goedgekeurd.
Update 2014
Bovenstaande verenigingen alsmede Verpleegkundigen & Verzorgenden Nederland (V&VN) hebben de gereviseerde onderdelen geautoriseerd. De NVvR heeft daarbij laten weten (zie ook Beeldvormend onderzoek, Pre-operatieve diagnostiek, Overige overwegingen 2012) het eens te zijn met de aanvullende literatuurbespreking, conclusies en aanbevelingen (2012), maar heeft tegelijkertijd kanttekeningen geplaatst bij de oorspronkelijke richtlijntekst uit 2010. Deze kanttekeningen hebben voor een belangrijk deel betrekking op de literatuurbespreking (2010) van - de rol van de - Endoscopische ultrasonografie (EUS) bij de pre-operatieve diagnostiek:
- Bij uitgebreide tumoren is EUS niet mogelijk doordat de tumor niet gepasseerd kan worden.
- Bij grote tumoren is de exacte uitbreiding in omgevende structuren niet zichtbaar voor EUS, gezien de beperkte penetratie (EUS niet beter dan CT)
- De complementaire waarde van beide onderzoeken (EUS en CT) geldt alleen voor de locoregionale situatie, maar zeker niet voor afstandsmetastasen. Zoals het hier omschreven wordt, vindt er een onderwaardering plaats van CT.
- De hier gesuggereerde work-up van afstandsmetastasen is geen reflectie van standaard dagelijkse praktijk. In sommige centra worden bijniermetastasen nooit middels EUS aangeprikt. Dit wordt altijd onder CT geleide gedaan. En hetzelfde geldt ook voor levermetastasen, altijd onder echogeleide. Alleen geheel perifeer in de linker leverkwab (segment 2/3) kunnen de metastasen opgepikt worden met EUS, maar de punctie wordt daarna middels echo verricht.
Overige kanttekeningen:
- Literatuurbespreking 2010 Fluordeoxyglucose-positron-emissietomografie (FDG-PET): in plaats van “conventionele work-up (met name EUS en CT)” is het beter te spreken van klassieke work-up.
- Literatuurbespreking 2010 Skeletscintigrafie: heeft skeletscintigrafie nog wel een plaats na PET-CT?
De kanttekeningen van de NVvR zijn aanleiding om de paragraaf beeldvormend onderzoek bij de eerstvolgende revisie van de richtlijn opnieuw te herzien.
Verenigingen die instemmen met de inhoud van de richtlijn
- NFK - Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS - voorheen Stichting Doorgang)
- Nederlands Huisartsen Genootschap (NHG)
Update 2014
Bij de revisie van 2014 heeft de NHG laten weten de revisies voor kennisgeving te hebben aangenomen: “Vanwege de beperkte relevantie voor de huisarts vinden wij het niet opportuun om een uitspraak te doen over instemming. Wel spreken wij het vertrouwen uit dat de werkgroep de juiste keuzes heeft gemaakt.
NFK/SPKS hebben ingestemd met de inhoud van de gereviseerde onderdelen.
Doel en doelgroep
Doelstelling
De nieuwe richtlijn bestaat uit gereviseerde en geactualiseerde tekst. Met 'gereviseerde' tekst bedoelen we nieuwe tekst op basis van Evidence Based literatuuronderzoek; 'geactualiseerde' tekst is de oude richtlijntekst die door de expert is herzien zonder dat er literatuuronderzoek is gedaan.
De revisie is gebaseerd op een inventarisatie van de belangrijkste knelpunten uit de praktijk. Deze knelpunten zijn de basis geweest voor uitgangsvragen die - op basis van evidence uit literatuuronderzoek - zijn beantwoord.
De uitgangsvragen gingen over:
- diagnostiek en stadiering
- neo-adjuvante behandeling
- chirurgische behandeling
- behandeling van niet operabel/resectabel oesofaguscarcinoom
- concentratie en spreiding en
- Follow-up; postoperatieve vitamine B12 suppletie. (Dit is de uitgangsvraag namens de patiëntenvereniging.)
Deze delen uit de richtlijn zijn dus Evidence Based gereviseerd; de resterende teksten zijn geactualiseerd.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met oesofaguscarcinoom, zoals chirurgen, radiotherapeuten, MDL artsen, medisch oncologen, huisartsen, oncologieverpleegkundigen, nurse-practioners, IKC-consulenten, pathologen, maatschappelijk werkers, psychologen, radiologen, nucleair-geneeskundigen en anesthesiologen.
Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met het KWF.
Samenstelling werkgroep
Organisatie
Integraal Kankercentrum Nederland (IKNL, voorheen VIKC)
Alle werkgroepleden zijn afgevaardigd namens wetenschappelijke verenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is rekening gehouden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines. De patiëntenvereniging NFK en de Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS - voorheen Stichting Doorgang) waren eveneens vertegenwoordigd.
Leden van de werkgroep
Prof.dr. P.D. Siersema, MDL arts, UMC Utrecht (voorzitter)
Dr. M.I. van Berge Henegouwen, chirurg, AMC Amsterdam
Prof. dr. W.F. Bühre, anesthesioloog, UMC Utrecht
Dr. H. M. Dullemen, gastro-enteroloog, UMCG Groningen
Dr. A. van der Gaast, internist-oncoloog, Erasmus MC Rotterdam
Mw. dr. M. Hage, patholoog, Pathan, Rotterdam
Prof. dr. R. van Hillegersberg, chirurg, UMC Utrecht
Dr. M. C.C.M. Hulshof, radiotherapeut, AMC Amsterdam
Dhr. G.J.B. Hurenkamp, huisarts, Julius Centrum Utrecht
Mw. M. Jager, regiovertegenwoordiger Stichting Voor Patiënten met Kanker aan het Spijsverteringkanaal (v.h. St. Doorgang), Utrecht
Prof. dr. E.J. van der Jagt, radioloog, UMCG Groningen
Prof. dr. F. J. W. ten Kate, patholoog, UMC Utrecht
Mw. J.H.F. Leemhuis, regiovertegenwoordiger, NFK, Utrecht
Dr. G.A.P Nieuwenhuijzen, chirurg, Catharina ziekenhuis Eindhoven
Prof. dr. J.Th. Plukker, chirurg, UMCG Groningen
Prof. dr. D.J. Richel, internist-oncoloog, AMC Amsterdam
Dhr. T. Rozema, radiotherapeut, Verbeeten Instituut Tilburg
Dhr. C.C.G. Schippers, verpleegkundige, nurse practitioner, UMC Utrecht
Dr. G. W. Sloof, nucleair geneeskundige, Groene Hart ziekenhuis Gouda
Dr. M. Sosef, chirurg, Atrium MC Heerlen
Mw. M. Spaander, MDL arts, Erasmus MC Rotterdam
Mw. dr. E. Verschuur, verpleegkundige, verplegingswetenschapper en onderzoeker-docent, HAN Hogeschool Nijmegen
Dr. M. Wouters, LUMC Leiden en NKI Amsterdam
Dr. B. P.L. Wijnhoven, chirurg, Erasmus MC Rotterdam
Betrokken experts-auteurs
Dr. J.J.G.H.M. Bergman, MDL-arts, AMC Amsterdam Dr. V.E.P.P. Lemmens, epidemioloog, afdeling Onderzoek IKZ Eindhoven
Procesbegeleiding
Mw. M.M. de Boer–Dennert, VIKC Utrecht
Mandaterende verenigingen
Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK)
Nederlandse Vereniging voor Anesthesiologie (NVA)
Nederlandse Internisten Vereeniging (NIV) / Nederlandse Vereniging voor Medische Oncologie (NVMO)
Nederlandse Vereniging voor Heelkunde (NVvH)
Nederlands Vereniging van Maag-Darm-Leverartsen (NVMDL)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
Nederlandse Vereniging voor Radiologie (NVvR)
Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO)
Leven met Kanker Beweging (voorheen NFK - Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS - voorheen Stichting Doorgang)
Verpleegkundigen en Verzorgenden Nederland (V&VN)
Afvaardiging
Nederlands Huisartsen Genootschap (NHG)
Belangenverklaringen
Aan alle werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin ze hun banden met de farmaceutische industrie aangeven bij de start van het richtlijntraject.
Methode ontwikkeling
Evidence based
Werkwijze
De werkgroep heeft gestemd over de aanbevelingen om de graad van consensus te kunnen aangeven en daarmee te voldoen aan de internationale AGREE criteria.
De werkgroep heeft van januari tot september 2010 aan de richtlijn gewerkt.
Bij de revisie van een richtlijn worden uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpunteninventarisatie, gehouden in het veld bij professionals en patiënten(vertegenwoordigers). De meest relevante knelpunten (bijlage Knelpuntenanalyse) worden uitgewerkt tot uitgangsvragen. Dit betreft, gezien de revisie, een beperkt aantal van vijf. Hieronder staan de geïnventariseerde knelpunten en uitgangsvragen.
De knelpunten
- de keuze welk diagnostisch traject (technieken en volgorde) gevolgd dient te worden bij de stadiëring van het oesofaguscarcinoom?
- wat de voorkeur is van neoadjuvante behandeling bij het oesofaguscarcinoom: chemotherapie of chemo-radiotherapie?
- welke chirurgische en niet chirurgische behandelopties er zijn voor resectabele oesofaguscarcinomen?
- welke operatieve techniek (transthoracaal, transhiataal, totale maag) geadviseerd wordt in welke situatie (bijv. lokatie en stadium) en bij welk type patiënt (conditie, leeftijd)?
- hoe perioperatieve naadlekkage en postoperatieve naadstricturen kunnen worden voorkomen en hoe stricturen kunnen worden behandeld?
- wat de incidentie is van vitamine B12 deficiëntie na de operatie?
- welke behandeling geadviseerd wordt bij patiënten met co-morbiditeit en/of op oudere leeftijd?
- welke behandeling geadviseerd wordt voor patiënten met een T4NxMx of TxN1M1 of recidief oesofaguscarcinoom?
- welke kwaliteitseisen gelden bij regionalisatie en centralisatie van patiënten met oesofaguscarcinoom?
De uitgangsvragen
- Is preoperatieve (neoadjuvante) behandeling zinvol bij het oesofaguscarcinoom? En zo ja, wat is de voorkeurs-neoadjuvante behandeling: chemotherapie of chemoradiotherapie?
- Welke chirurgische en niet chirurgische behandelopties zijn er voor resectabele oesofaguscarcinomen?
- Welke operatieve techniek (transthoracaal, transhiataal, totale maag) wordt geadviseerd in welke situatie (bijv. lokatie en stadium) en bij welk type patiënt (conditie, leeftijd)?
- Welke behandeling wordt geadviseerd bij patiënten met co-morbiditeit en/of oudere leeftijd?
- Wat is prevalentie B12 en is het zinvol om te suppleren?
- Welke behandeling wordt geadviseerd voor patiënten met een niet resectabel (T4 M1) of recidief oesofaguscarcinoom?
- Welke kwaliteitseisen gelden bij regionalisatie en centralisatie van patiënten met oesofaguscarcinoom?
- Er is tevens voor de up-date van de diagnostiek literuuronderzoek gedaan (2005-2010) naar de waarde van PET, CT en EUS bij patiënten met verdenking op oesofgauscarcinoom.
Door het combineren van knelpunten in de uitgangsvragen zijn alle knelpunten m.u.v. de perioperatieve naadlekkage (knelpunt 5) in dit revisie traject opgenomen.
Extra opmerking
Huidige en toekomstige studies waar de 7e editie TNM (UICC) wordt gebruikt zijn niet zonder meer te vergelijken met de oude studies waarin de 6e editie TNM werd toegepast.
Zoekverantwoording
De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek. De geselecteerde artikelen zijn door de schrijvende werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs, waarbij onderstaande indeling is gebruikt.
Indeling van methodologische kwaliteit van individuele studies
|
Voor artikelen betreffende interventie |
|
|
A1 |
Systematische reviews die tenminste enkele onderzoeken van A2-niveau betreffen, waarbij de resultaten van afzonderlijke onderzoeken consistent zijn. |
|
A2 |
Gerandomiseerd vergelijkend klinisch onderzoek van goede kwaliteit en met voldoende omvang en consistentie. |
|
B |
Gerandomiseerde klinische trials van matige kwaliteit of onvoldoende omvang of ander vergelijkend onderzoek (niet-gerandomiseerd: vergelijkend cohortonderzoek, patiënt-controle-onderzoek) |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
|
Voor artikelen betreffende diagnostiek |
|
|
A1 |
Onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische tests |
|
A2 |
Onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruik zijn gemaakt van tevoren gedefinieerde afkapwaarden en de resultaten van de test en de ‘gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multipele, diagnostische tests een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie |
|
B |
Vergelijking met een referentietest, beschrijving van de onderzochte test en populatie, maar niet de kenmerken die verder onder niveau A staan genoemd |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen, bijvoorbeeld de werkgroepleden |
Conclusie
Het wetenschappelijk materiaal is samengevat in een conclusie, waarbij het niveau van het meest
relevante bewijs is weergegeven. Hiervoor is onderstaande indeling gehanteerd:
|
Niveau van bewijs van de daarop gebaseerde conclusies |
|
|
1 |
1 systematische review (A1) of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
|
2 |
tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau A2, B of C |
|
4 |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
Overige overwegingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs ook andere aspecten van belang zoals het patiëntenperspectief, organisatorische aspecten en kosten. Deze worden besproken onder het kopje ‘overige overwegingen'.
Aanbeveling
De uiteindelijk geformuleerde aanbeveling is het resultaat van de wetenschappelijke conclusie, waarbij de overige overwegingen in acht worden genomen.
