Niet kleincellig longcarcinoom - TNM classificatie
Uitgangsvraag
Hoe dient het ziektestadium van niet-kleincellig longcarcinoom te worden geclassificeerd?
Aanbeveling
Gebruik de 8e editie van de TNM classificatie voor de vaststelling van het ziektestadium van niet-kleincellig longcarcinoom.
Gebruik een elastinekleuring bij de bepaling van pleurainvasie.
Overwegingen
De TNM classificatie en stadium indeling is gebaseerd op de prognostische betekenis van tumorkarakteristieken van patiënten met longkanker en niet op therapie. In de afgelopen jaren is de database van patiënten met longkanker uitgebreid, waarbij een meer evenredige inclusie van patiënten over de hele wereld heeft plaatsgevonden. Op basis van de huidige database met 94.708 patiënten (Rami-Porta, 2015 en Goldstraw, 2015) zijn de T en M factor opnieuw gedefinieerd en is een nieuwe verdeling gemaakt op geleide van overlevingscijfers. Dit is de 8e editie van de TNM classificatie. Onderstaand worden de veranderingen tussen de oudere en de meest recente TNM classificatie beschreven.
T-status
Naar aanleiding van de gebleken verschillen in overleving, wanneer er een onderscheid wordt gemaakt in tumor grootte per centimeter in plaats van per 2 centimeter (figuur 1), is de T status aangepast.
Het afkappunt van 3 cm scheidt T1 van T2. Tussen 0 en 5cm scheidt elke hele cm tumoren van aanzienlijk verschillende prognose (daarom beschreven als T1 a, b en c en T2 a, b). De prognose van tumoren > 5 cm maar ≤ 7 cm is gelijk aan T3 en die van > 7cm aan T4.
Bronchiale betrokkenheid op een afstand van minder dan 2 cm van de carina maar zonder carina ingroei hebben een T2 prognose, evenals tumoren met een totale of partiële atelectase/ poststenotische pneumonie (was eerder T3 in TNM7). Ingroei in het diafragma heeft nu een T4-prognose (was eerder T3). In TNM 8 wordt geen uitspraak meer vereist over betrokkenheid van de mediastinale pleura. Elke betrokkenheid van het mediastinale vet, ongeacht de betrokkenheid van vitale structuren, wordt gedefinieerd als T4 in TNM 8. Opgemerkt moet worden dat de TNM classificatie prognostische maar geen therapeutische implicaties heeft bijvoorbeeld met betrekking tot resectabiliteit. Thoraxwandinfiltratie inclusief pariëtale pleura en superior sulcus tumoren worden met T3 geclassificeerd. Infiltratie van het pariëtale pericard en de n. phrenicus, in nauwe anatomische relatie met de grens mediastinum/ long, worden nog als T3 gezien.
Figuur 1 Overzicht van pT1 t/m 4,N0,M0,R0 verschillen in prognose (Bron: Rami-Porta, 2016)
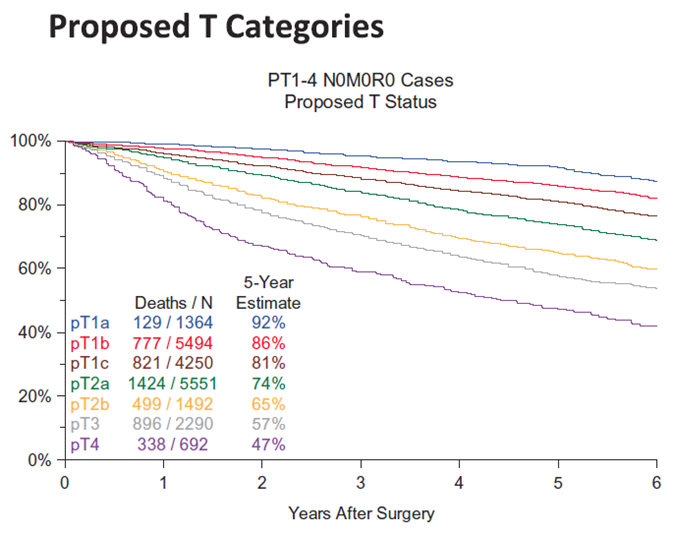
De tumorgrootte wordt bij de klinische stadiering gemeten in longsetting: de (maximale lengte), langste diameter in een van de drie richtingen (axiaal, sagitaal of coronaal) bepaalt het T stadium. In subsolide noduli bepaalt de lengte van de solide component in longsetting het klinisch T stadium.
Verder zijn er twee nieuwe T categorieën voor vroege vormen van adenocarcinomen geïntroduceerd. Ze beschrijven non-solide, alleen uit matglas bestaande noduli of semisolide noduli, welke uit een matglas en een solide componenten bestaan. Een adenocarcinoma in situ (TIS), meestal een matglas laesie, toont pathologisch alleen neoplastische cellen langs alveolaire structuren zonder tekenen van stromale vasculaire of pleurale invasie. Een minimaal invasief adenocarcinoom (MIA) toont pathologisch een tumor met beperkte invasieve groei (< 5mm) met predominant lepidische groei en op CT is er een matglaslaesie < 3cm met een solide component < 5mm (Travis, 2016). Er mag ook geen necrose zijn. TIS en MIA zijn door een zeer goede prognose gekarakteriseerd.
Voor patiënten met meerdere tumor noduli wordt de classificatie gebaseerd op de volgende vier patronen:
a) tumoren met verschillende morfologie, PET-aviditeit en histologie moeten afzonderlijk worden ingedeeld;
b) twee tumornoduli van hetzelfde tumortype zijn T3 als ze zich in dezelfde kwab bevinden, T4 als ze zich in dezelfde long bevinden en M1a als ze zich in beide longen bevinden;
c) multiple matglas laesies met dominant lepidische tumorgroei worden geclassificeerd op basis van de dominante laesie met een m voor multipliciteit;
d) een lepidisch groeiende “pneumonic-type” tumor wordt geclassificeerd (vergelijkbaar met b (zie boven)) als T3 indien beperkt tot één kwab, als T4 indien in twee eenzijdige kwabben en als M1a indien beide longen betrokken zijn (Detterbeck, 2016).
De indeling voor de T-status is beschreven in tabel 1
Tabel 1 Overzicht van T-status volgens 8e TNM classificatie. AIS: adenocarcinoma in situ. MIA: minimaal invasief adenocarcinoom. (Bron: Travis, 2016)
|
T-status |
Categorie |
|
AIS |
Tis |
|
MIA |
T1mi |
|
≤1cm |
T1a |
|
>1-2cm |
T1b |
|
>2-3cm |
T1c |
|
PL1/PL2 |
T2 |
|
>3-4cm |
T2a |
|
>4-5cm |
T2b |
|
PL3 |
T3 |
|
>5-7cm |
T3 |
|
>7cm |
T4 |
|
Bronchus <2cm |
T2 |
|
Totale atelectase |
T2 |
|
Diafragma mediastinum, grote vaten, trachea, oesophagus of wervellichaam ingroei |
T4 |
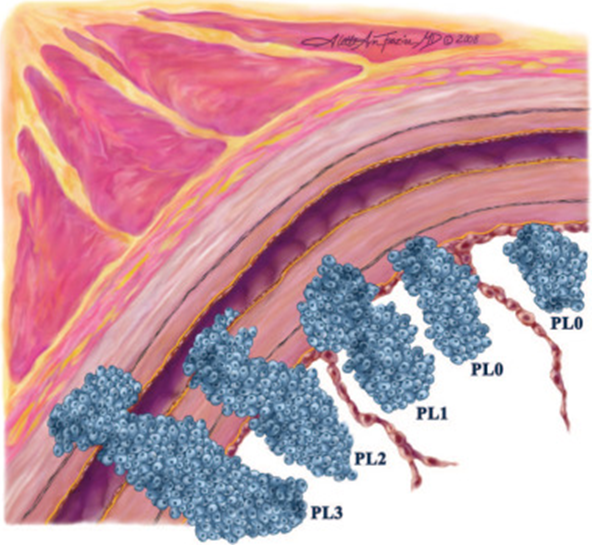
PL status
De PL status gaat over ingroei in de pleura. In figuur 2 wordt de verschillende mate van ingroei getoond. PL0 betekent geen ingroei in de pleura en verandert de T status niet. PL1 (doorgroei van de lamina elastica) en PL2 (ingroei tot aan het oppervlak van de viscerale pleura) worden T2 genoemd. Bij PL3 is er sprake van doorgroei in de thoraxwand en wordt het T3. Om onderscheid te kunnen maken tussen de pleurale status, wordt geadviseerd een elastine kleuring te gebruiken.
Figuur 2 Mate van ingroei in de pleura met PL status (Bron: Travis, 2008)
N-status
De N status is ongewijzigd ten opzichte van de 7e editie, waarbij N0 geen lymfeklierinvasie betekent, N1 intrapulmonale of hilaire lymfeklierinvasie, N2 ipsilateraal mediastinaal en N3 contralateraal mediastinaal en supraclaviculaire lymfeklier invasie (tabel 2).
In tegenstelling tot andere tumoren wordt nog steeds alleen het klierstation (anatomische locatie) maar niet de aantal van pathologische klieren beoordeeld.
De classificatie van de lymfeklierstations is, zoals in TNM 7, gebaseerd op de kaart van de Internationale Vereniging voor de studie van longkanker (IASLC) van 2009.
Anatomische grenzen, het best te beoordelen op CT in alle 3 richtingen (axiaal, coronaal and sagittaal) vormen de basis voor de juiste classificatie, om bijvoorbeeld tussen peribronchiaal hilair N1 en paratracheaal N2 klieren evenals tussen N2 en N3 aan de bovenste thoraxapertuur correct te onderscheiden (Rusch, 2009; El-Sharief, 2014). Een vergroting > 10mm in de kortste diameter wordt nog steeds als definitie voor een kliervergroting beschouwd.
Tabel 2 Overzicht N-status volgens 8e TNM classificatie (Bron: Asamura, 2015)
|
Nx |
lymfeklier betrokkenheid niet te verifiëren |
|
N0 |
Geen regionale klierbetrokkenheid |
|
N1 |
Kliermetastasen ipsilateraal peribronchiaal, hilair en/of intrapulmonaal |
|
N2 |
Kliermetastasen ipsilateraal mediastinaal of subcarinaal |
|
N3 |
Kliermetastasen contralateraal mediastinaal, hilair, scalenus of supraclalviculair |
M-status
De M-status beschrijft de plaats en mate van metastasering. Daarbij is een onderscheid gemaakt tussen intrathoracale metastasen, een enkele metastase op afstand en multipele metastasen. Bij intrathoracale metastasen wordt geen prognostisch verschil gezien tussen pleurale-/pericardiale nodules, contralaterale-/multipele intrapulmonale longnodules en pleura-/pericardvocht. In alle gevallen wordt dit M1a genoemd, zoals eerder ook in de 7e editie.
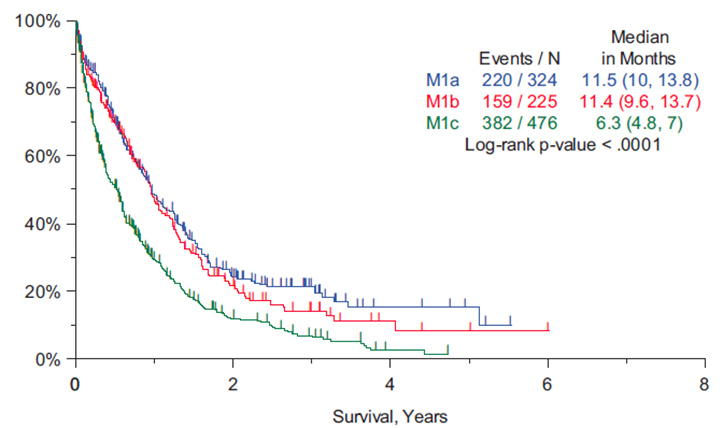
Er werd een duidelijk prognostisch verschil gezien tussen M1a, een oligometastase van 1 laesie in 1 orgaan, meerdere laesies in 1 orgaan en multipele metastasen. Dit heeft ervoor gezorgd dat een enkele metastase in 1 orgaan M1b genoemd wordt en meer metastasen M1c (tabel 3 en figuur 3) (Eberhardt, 2015)
Figuur 3 Overzicht van overleving bij onderscheid M status (Bron: Eberhardt, 2015)
Tabel 3 Overzicht M-status volgens 8e TNM classificatie (Bron: Eberhardt, 2015)
|
M0 |
|
Geen afstandsmetastasen |
|
M1 |
|
Afstandsmetastasen |
|
|
M1a |
Separate tumornoduli in contralaterale longkwab, pleurale of pericardiale nodules, maligne pleuravocht of pericardeffusie. |
|
|
M1b |
Solitaire extrathoracale metastase |
|
|
M1c |
Multipele extrathoracale metastasen in een of meer organen |
Stadium
Er is in de 8e editie van de TNM een onderverdeling gemaakt in stadiëring waarbij er verschuivingen zijn gezien in bijna alle stadia qua overleving. Er zijn verschillende toevoegingen gedaan. In stadium I is nu een onderscheid gemaakt tussen IA1, IA2 en IA3. In stadium III is stadium IIIC toegevoegd om een evenrediger verdeling te maken. Stadium IV is nu onderverdeeld in stadium IVA en IVB (zie tabel 4).
Tabel 4 Stadiering volgens TNM 8e classificatie. T: tumor, M: metastase. (Bron: Goldstraw, 2016)
|
|
|
N0 |
N1 |
N2 |
N3 |
|
T ≤1cm |
T1a |
IA1 |
IIB |
IIIA |
IIIB |
|
T >1-2cm |
T1b |
IA2 |
IIB |
IIIA |
IIIB |
|
T >2-3cm |
T1c |
IA3 |
IIB |
IIIA |
IIIB |
|
T >3-4cm |
T2a |
IB |
IIB |
IIIA |
IIIB |
|
T endobronchiaal locatie/atelectase 3-4cm |
T2a |
IB |
IIB |
IIIA |
IIIB |
|
T >4-5cm |
T2b |
IIA |
IIB |
IIIA |
IIIB |
|
T endobronchiaal locatie/atelectase 4-5cm |
T2b |
IIA |
IIB |
IIIA |
IIIB |
|
T >5-7cm |
T3 |
IIB |
IIIA |
IIIB |
IIIC |
|
T3 structuren |
T3 |
IIB |
IIIA |
IIIB |
IIIC |
|
T >7cm |
T4 |
IIIA |
IIIA |
IIIB |
IIIC |
|
T Diafragma ingroei |
T4 |
IIIA |
IIIA |
IIIB |
IIIC |
|
M intrathoracaal |
M1a |
IVA |
IVA |
IVA |
IVA |
|
M solitaire metastase |
M1b |
IVA |
IVA |
IVA |
IVA |
|
M multipele metastasen |
M1c |
IVB |
IVB |
IVB |
IVB |
Meerdere primaire tumoren
Indien er op de CT onderscheid gemaakt kan worden tussen verschillende tumoren, mogen deze onder voorwaarden beschouwd worden als 2 primaire tumoren. Een van de belangrijkste items is verschil in histologisch type. Daarnaast wordt dit ondersteund door verschil in groeisnelheid en verschillende biomarkers.
Mocht er sprake zijn van 2 verschillende tumoren, dan moet er voor elke tumor een aparte TNM classificatie opgesteld worden.
In het geval van multipele adenocarcinomen met lepidische groeiwijze of matglas afwijkingen, waarbij ten minste 1 afwijking bewezen carcinoom is, mag er één TNM classificatie worden gebruikt met de hoogste T met tussen haken het aantal nodi of bij multipelen een ‘m’. Voorbeelden zijn cT1a(2)N0M0 of cT1b(m)N0M0. (Detterbeck, 2016).
Tabel 5 Stadiering volgens 8e editie TNM (Bron: Goldstraw, 2016)
|
Occult carcinoma |
TX |
N0 |
M0 |
|
Stage 0 |
Tis |
N0 |
M0 |
|
Stage IA1 |
T1a(mi) |
N0 |
M0 |
|
|
T1a |
N0 |
M0 |
|
Stage IA2 |
T1b |
N0 |
M0 |
|
Stage IA3 |
T1c |
N0 |
M0 |
|
Stage IB |
T2a |
N0 |
M0 |
|
Stage IIA |
T2b |
N0 |
M0 |
|
Stage IIB |
T1a–c |
N1 |
M0 |
|
|
T2a |
N1 |
M0 |
|
|
T2b |
N1 |
M0 |
|
|
T3 |
N0 |
M0 |
|
Stage IIIA |
T1a–c |
N2 |
M0 |
|
|
T2a–b |
N2 |
M0 |
|
|
T3 |
N1 |
M0 |
|
|
T4 |
N0 |
M0 |
|
|
T4 |
N1 |
M0 |
|
Stage IIIB |
T1a–c |
N3 |
M0 |
|
|
T2a–b |
N3 |
M0 |
|
|
T3 |
N2 |
M0 |
|
|
T4 |
N2 |
M0 |
|
Stage IIIC |
T3 |
N3 |
M0 |
|
|
T4 |
N3 |
M0 |
|
Stage IVA |
Any T |
Any N |
M1a |
|
|
Any T |
Any N |
M1b |
|
Stage IVB |
Any T |
Any N |
M1c |
Onderbouwing
Achtergrond
De TNM classificatie en stadium indeling zijn aan verandering onderhevig, vanwege het beschikbaar komen van meer prognostische variabelen bij grotere patiënten aantallen. Sinds januari 2018 is er een nieuwe versie van de internationale TNM classificatie (8e) in gebruik genomen. Daarom onderstaand een uiteenzetting over wat dit betekent voor de dagelijkse praktijk.
Zoeken en selecteren
No systematic literature analysis was performed for this chapter. There was consensus in the working group that the 8th TNM classification should be used for cancer staging.
Referenties
- 1 - Asamura H, Chansky K, Crowley J, Goldstraw P, Rusch VW, Vansteenkiste JF, Watanabe H, Wu YL, Zielinski M, Ball D, Rami-Porta R; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Board Members, and Participating Institutions. (2015) The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the Revision of the N Descriptors in the Forthcoming 8th Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. Dec;10(12):1675-84.
- 2 - Detterbeck FC, Marom EM, Arenberg DA, Franklin WA, Nicholson AG, Travis WD, Girard N, Mazzone PJ, Donington JS, Tanoue LT, Rusch VW, Asamura H, Rami-Porta R; IASLC Staging and Prognostic Factors Committee; Advisory Boards; Multiple Pulmonary Sites Workgroup. (2016) The IASLC Lung Cancer Staging Project: Background Data and Proposals for the Application of TNM Staging Rules to Lung Cancer Presenting as Multiple Nodules with Ground Glass or Lepidic Features or a Pneumonic Type of Involvement in the Forthcoming Eighth Edition of the TNM Classification. J Thorac Oncol. May;11(5):666-680.
- 3 - Eberhardt WE, Mitchell A, Crowley J, Kondo H, Kim YT, Turrisi A 3rd, Goldstraw P, Rami-Porta R; International Association for Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Board Members, and Participating Institutions. (2015) The IASLC Lung Cancer Staging Project: Proposals for the Revision of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. Nov;10(11):1515-22.
- 4 - El-Sherief AH, Lau CT, Wu CC, Drake RL, Abbott GF, Rice TW. International association for the study of lung cancer (IASLC) lymph node map: radiologic review with CT illustration. Radiographics 2014;34: 1680-1691
- 5 - Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE, Nicholson AG, Groome P, Mitchell A, Bolejack V; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Boards, and Participating Institutions; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee Advisory Boards and Participating Institutions. (2016) The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. Jan;11(1):39-51.
- 6 - Rami-Porta R, Bolejack V, Giroux DJ, Chansky K, Crowley J, Asamura H, Goldstraw P; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Board Members and Participating Institutions. (2014) The IASLC lung cancer staging project: the new database to inform the eighth edition of the TNM classification of lung cancer. J Thorac Oncol. Nov;9(11):1618-24.
- 7 - Rusch VW, Asamura H, Watanabe H, Giroux DJ, Rami-Porta R, Goldstraw P; Members of IASLC Staging Committee. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol. 2009 May;4(5):568-77.
- 8 - Travis WD, Asamura H, Bankier AA, Beasley MB, Detterbeck F, Flieder DB, Goo JM, MacMahon H, Naidich D, Nicholson AG, Powell CA, Prokop M, Rami-Porta R, Rusch V, van Schil P, Yatabe Y; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee and Advisory Board Members. (2016) The IASLC Lung Cancer Staging Project: Proposals for Coding T Categories for Subsolid Nodules and Assessment of Tumor Size in Part-Solid Tumors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer. J Thorac Oncol. Aug;11(8):1204-1223.
- 9 - Travis WD, Brambilla E, Rami-Porta R, Vallières E, Tsuboi M, Rusch V, Goldstraw P; International Staging Committee. (2008) Visceral pleural invasion: pathologic criteria and use of elastic stains: proposal for the 7th edition of the TNM classification for lung cancer. J Thorac Oncol. Dec;3(12):1384-90.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
TNM |
NVALT |
2019 |
2024 |
Elke 5 jaar |
NVALT |
|
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. A.F.T.M. Verhagen, cardio-thoracaal chirurg Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in tabel met gemelde belangen in de bijlage. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingeleheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patiënten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van SMS (nivolumab) en Soehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Soehringer lngelheim) in 2016 financhiele support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor Astra Zeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. Financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut-oncoloog |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator).
Advisory board van Bristol-Myers-Squibb, Roche/ Genentech, Merck/ Pfizer, Astra-Zeneca, Celgene. (betaald aan Maastro clinic) |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen en Pathologie SSZOG/OZG in Winschoten (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (www.netwerk-path) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Novartis, BMS, BioRad, Amgen, BioCartis (honoraria komen op een rekening op UMCG)
Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) -Boehringer Ingelheim FGFR1 study / The NVALT-17 Study - Roche, Cobas / BMS (CA209-759) - |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
- |
getrouwd met praktijkhoudend huisarts |
- |
|
Hofstede |
adviseur richtlijnontwikkeling |
- |
|
- |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Consensus based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) kwam naar voren dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews.
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS - voor observationeel onderzoek.
- QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden bij de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
