Tweedelijnsbehandeling met immunotherapie bij NSCLC
Uitgangsvraag
Wat is de plaats van immunotherapie of een combinatie van immunotherapie en chemotherapie in de tweede lijn (secundaire of tertiaire behandeling) bij patiënten met stadium IIIB/C/IV NSCLC?
Aanbeveling
De volgende aanbevelingen gelden voor patiënten met niet-curatief te behandelen NSCLC, performance score 0-1, geen contra-indicaties voor immunotherapie en zonder moleculaire abberatie waar een doelgerichte therapie voor beschikbaar is (zie hiervoor module ‘Behandeling gemetastaseerd NSCLC met zeldzame mutatie’).
Overweeg behandeling met nivolumab, pembrolizumab of atezolizumab in de tweede lijn mits er geen contraindicaties zijn en bij een PD-L1 ≥50%.
Overweeg behandeling met nivolumab of atezolizumab in de tweede lijn mits er geen contraindicaties zijn en ongeacht PD-L1.
Er is geen direct bewijs verkregen voor de optimale behandeling van patiënten met een performance score 2. Deze patiënten zijn bij de registratie studies voor de immunotherapie versus docetaxel geëxcludeerd. Retrospectieve data laat zien dat immunotherapie bij deze groep patiënten een meerwaarde zou kunnen hebben, bijvoorbeeld bij patiënten die geen chemotherapie verdragen. Indien chemotherapie mogelijk is, verdient dat de voorkeur op basis van de huidige literatuur.
Overweeg bij patiënten met performance score 2 primair behandeling met chemotherapie of best supportive care na platinum doublet als eerste therapie.
De overleving en kwaliteit van leven bij patiënten die in aanmerking komen voor een tweedelijns behandeling is nog steeds beperkt, ondanks de recent gemaakte vooruitgang.
Bespreek met patiënten die in aanmerking komen voor tweedelijns behandeling ook de mogelijkheid van ondersteunende palliatieve zorg.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De optimale keuze voor een tweedelijns behandeling bij een stadium IV NSCLC patiënt is in hoge mate afhankelijk van tumor karakteristieken, de eerstelijns behandeling en de performance score van de patiënt. Ook is het belangrijk de te verwachten kwaliteit van leven mee te nemen in de afwegingen. De individuele onderzochte studies zijn bij subgroepen en in uiterst geselecteerde patiënten verricht. Het is daarom aan te bevelen een zekere mate van voorzichtigheid bij de interpretatie van de resultaten en prognoses te betrachten. Head-to-head studies tussen de verschillende recent ontwikkelde middelen en strategieën ontbreken tot op heden.
De beschikbare gerandomiseerde trials vertonen op verschillende vlakken tekortkomingen zoals boven vermeld. Hierdoor is er een aanzienlijk risico op bias en zijn de GRADE-scores voor bewijskracht van de studies naar beneden bijgesteld. Voor tweedelijnsbehandeling met pembrolizumab van patiënten met NSCLC en een PD-L1 TPS >50% is er een redelijke bewijskracht met een positief advies van de commissie Bom. Voor tweedelijns behandeling met nivolumab en atezolizumab van patiënten met NSCLC onafhankelijk van PD-L1 TPS is er een lage bewijskracht.
Patiënten met een performance score van 2 zijn uitgesloten van deelname aan de studies. Hierdoor is er voor deze groep patiënten op dit moment een zeer grote kennislacune ten aanzien van het kiezen van de optimale behandeling. Uit afgeleide data kan worden opgemaakt dat deze groep patiënten een verminderd effect laat zien op overleving, dit zijn echter alleen post hoc data, waarbij door de diverse registratiesystemen, vergoedingssystematieken, en deelname aan studies het scoren van een accurate performance in belangrijke mate kan hebben beïnvloed. Ook is hierin de mogelijk andere kwaliteit van leven bij het gebruik van immunotherapie in vergelijking met docetaxel niet voldoende meegenomen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten en hun belangenverenigingen geven aan graag te worden behandeld door experts op het gebied van longkanker, bijvoorbeeld door longarts-oncologen. Toegankelijkheid en nabijheid van goede longoncologische zorg voor patiënten in alle regio’s is belangrijk, zeker voor ouderen en patiënten in minder goede conditie.
Kosten (middelenbeslag)
Het prijsniveau in 2019 laat zien dat immunotherapeutica duurder zijn dan reguliere chemotherapie. Het prijsniveau is echter door prijsafspraken met de overheid niet inzichtelijk. Vanuit medisch, politieke en maatschappelijke hoek beschouwd echter is de huidige prijs van de nieuwe middelen acceptabel voor gebruik in de praktijk. Een lagere prijs van de immunotherapeutica zou echter voor de gehele maatschappij wenselijk zijn. Ook de patiëntenvereniging deelt deze mening.
Op basis van het CieBOM advies is voor de Pembrolizumab in de 2e lijn het advies deze pas in te zetten bij een PD-L1 waarde van 50% of meer.
Omdat een predictieve PD-L1 test voor het gebruik van dit middel noodzakelijk is, dienen de kosten hiervoor ook meegenomen te worden. De kosten hiervan zijn beduidend hoger dan diagnostische immuunhistochemie, maar veel lager dan van de immunotherapeutica. Deze test wordt uitgevoerd bij alle ervoor in aanmerking komende patiënten, dus een grotere groep dan die behandeld worden. Binnen het ‘geneesmiddelenbudget’ dient een deel gereserveerd worden voor predictieve testen. Vanuit medisch, politiek en maatschappelijk standpunt wordt het huidig prijsniveau van de predictieve test acceptabel geacht in verhouding tot de effectiviteit van de behandeling.
Aanvaardbaarheid voor de overige relevante stakeholders
Op dit moment gelden er aanvullende kwaliteitscriteria voor het gebruik van immunotherapie. Een hoge en goede kwaliteit is zeer wenselijk. Deze kunnen vanuit een (regionaal) netwerk worden geborgd. Vanuit het patiënten perspectief ten aanzien van de beschikbaarheid, en vanuit het maatschappelijk perspectief om minder te registeren valt het te overwegen om de aanvullende eisen met betrekking tot registratie en wetenschappelijk onderzoek voor het gebruik van een tweedelijns te versoepelen.
Haalbaarheid en implementatie
Beperkende factoren ten aanzien van de implementatie kunnen ziekenhuiskosten, vergoeding door zorgverzekeraars en verschuivende patiënten stromingen zijn. Tevens is de registratiedruk een belangrijke hindernis. Andere kwaliteitscriteria zijn wellicht een mogelijke beperking voor de implementatie, maar om een zo hoog mogelijke kwaliteit te kunnen garanderen is borging hiervan in regionale netwerken aan te bevelen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de beschikbare data, met een lage bewijskracht is er een voordeel voor patiënten die behandeld zijn met nivolumab, pembrolizumab en atezolizumab monotherapie in de tweede lijn ten opzichte van een behandeling met Docetaxel. De beschikbare data is kwetsbaar voor bias en uitsluitend verkregen in een zere fitte en geselecteerde populatie.
De beschikbare data laat zien date er minder treatment related adverse events zijn bij immunotherapie dan bij chemotherapie, de beschikbare data over de kwaliteit van leven is nog beperkter, deze laat echter een vergelijkbare (atezolizumab), of betere kwaliteit van leven zien (nivolumab) dan chemotherapie.
Onderbouwing
Achtergrond
De tweedelijns behandeling bij het niet kleincellig longcarcinoom is variabel. Het hangt erg af van welk medicament er als eerstelijnsbehandeling is gegeven, het type tumor en de conditie van de patiënt. Ook is de verwachting dat er in de tweedelijns behandeling door de snelle nieuwe ontwikkelingen in de toekomst veel innovatie zal zitten. Dit geldt voor patiënten met een performance score tussen de 0 tot 2. Voor minder fitte patiënten met een performance 3 tot 4 is de standaard een ondersteunende palliatieve behandeling zonder op de tumor gerichte systeem therapie.
Conclusies / Summary of Findings
Nivolumab versus chemotherapy
|
Low GRADE |
Nivolumab possibly results in a higher overall survival compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Horn, 2017; Huang, 2018; Vokes, 2018) |
|
Low GRADE |
Nivolumab possibly results in a higher, not clinically relevant, overall survival compared to chemotherapy in PD-L1 negative patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Horn, 2017; Huang, 2018; Vokes, 2018) |
|
Very low GRADE |
We are uncertain about the progression free survival of nivolumab compared with chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Horn, 2017; Huang, 2018; Vokes, 2018) |
|
Low GRADE |
Nivolumab possibly results in a higher response rate compared to chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Horn, 2017; Huang, 2018; Vokes, 2018) |
|
Low GRADE |
Nivolumab possibly results in a better, not clinically relevant, quality of life compared to chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Reck, 2017) |
|
Low GRADE |
Nivolumab resulted in less treatment-related adverse events compared with chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Horn, 2017; Huang, 2018; Vokes, 2018) |
Pembrolizumab versus chemotherapy
|
Moderate GRADE |
Pembrolizumab results in a higher chance of overall survival compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Huang, 2018) |
|
Moderate GRADE |
Pembrolizumab results in a higher chance of progression free survival compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Huang, 2018) |
|
Moderate GRADE |
Pembrolizumab results in an increased response rate compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Huang, 2018) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of pembrolizumab with chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (-) |
|
Low GRADE |
Pembrolizumab results in less treatment-related adverse events compared with chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Huang, 2018) |
Atezolizumab versus chemotherapy
|
Low GRADE |
Atezolizumab possibly results in a higher overall survival compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
Atezolizumab possibly results in a higher, not clinically relevant, overall survival compared to chemotherapy in PD-L1 negative patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
Atezolizumab possibly results in a higher progression free survival compared to chemotherapy in PD-L1 positive patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
The progression free survival of atezolizumab is possibly comparable with chemotherapy in PD-L1 negative patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
The progression free survival of atezolizumab is possibly comparable with chemotherapy in PD-L1 negative patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
The response rate of atezolizumab is possibly comparable with chemotherapy alone in patients with advanced non-small-cell lung cancer after first line chemotherapy.
Reference: (Fehrenbacher, 2018; Huang, 2018) |
|
Low GRADE |
The quality of life of atezolizumab is possibly comparable with chemotherapy alone in patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Bordoni, 2018) |
|
Low GRADE |
Atezolizumab resulted in less treatment-related adverse events compared with chemotherapy in patients with advanced non-small-cell lung cancer after first line chemotherapy.
References: (Fehrenbacher, 2018; Huang, 2018) |
|
- GRADE |
Because of a lack of data, it was not possible to compare immunotherapy with CTLA4-inhibitors and chemotherapy in patients with advanced non-small-cell lung cancer.
References: - |
Samenvatting literatuur
Description studies
A total of seven articles were considered suitable to be included in this literature summary comparing different therapies. These articles reported results of 5 different trials (CheckMate 017, CheckMate 057, Keynote 010, OAK, and POPLAR). Huang (2018) performed a meta-analysis using data of these trials. The POPLAR and OAK trials involved the anti-PD-L1 antibody (atezolizumab) versus the second-line chemotherapy docetaxel for previously treated advanced NSCLC, while anti-PD-L1 antibodies were involved in the CheckMate-017, CheckMate-057 (both nivolumab) and KEYNOTE-010 (pembrolizumab) trials. The minimum follow-up of the results described in Huang (2018) was 11 and 13.2 months for the CheckMate 017 and CheckMate 057, respectively. The median follow-up was 13.1 months in the KEYNOTE 010 trial, 14.8 months in the OAK trial and 14.8 months in the POPLAR trial.
In addition to the results reported in Huang (2018), the impact of immunotherapy and docetaxel on health related quality of life was reported in patients attending the CheckMate-017 (Reck, 2017), CheckMate-057 (Reck, 2018) and the OAK trials (Bordoni, 2018). Horn (2017) and Vokes (2018) provided respectively 2-years and 3-years results of the CheckMate-017 and CheckMate-057 trials. Fehrenbacher (2018) provided results of an additional 7 months follow-up of the OAK trial.
The included studies assessed the following immunotherapies; nivolumab (2 studies with a total of 854 patients), pembrolizumab (1 study with 1,034 patients) and atezolizumab (2 studies with a total of 1,137 patients). See table 1 and evidence tables for details of the studies. All studies included patients of multiple hospitals across different countries with and without sensitizing oncogene driver mutations.
Studies were funded by the pharmaceutical industry.
Table 1 Details of the included studies
|
Study |
Patients and previous treatments |
Intervention |
Control |
|
CheckMate-017 |
Stage IIIB or IV squamous-cell NSCLC who had disease recurrence after one prior platinum-containing regimen |
Nivolumab 3 mg/ kg IV q2w |
Docetaxel 75 mg/ m2 IV q3w |
|
CheckMate-057 |
Stage IIIB or IV, recurrent non-squamous NSCLC after radiation therapy or surgical resection and disease recurrence or progression during one prior platinum-based doublet chemotherapy regimen |
Nivolumab 3 mg/ kg IV q2w |
|
|
KEYNOTE-010 |
NSCLC patients, with progression, after two or more cycles of platinum-doublet chemotherapy and PD-L1 expression on at least 1% tumor cells |
a. Pembrolizumab 2 mg/ kg IV q3w b. Pembrolizumab 10 mg/ kg IV q3w |
|
|
OAK |
NSCLC patients who had received one to two previous cytotoxic chemotherapy regimens (one or more platinum based combination therapies) for stage IIIB or IV non-small-cell lung cancer |
Atezolizumab 1200mg IV q3w |
|
|
POPLAR |
Patients with NSCLC who progressed post-platinum chemotherapy |
Atezolizumab 1200mg IV q3w |
Results
1. Overall survival
All five trials comparing immunotherapy with chemotherapy reported overall survival (Huang, 2018), see figure 1. The pooled hazard ratio (HR) for death showed clinically relevant differences in overall survival for nivolumab (HR 0.67; 95% CI 0.55 to 0.82) compared to chemotherapy. The median overall survival was 12.2 months for nivolumab versus 9.4 months for docetaxel in the CheckMate 057 trial and 9.2 months to 6.0 months in the CheckMate 017 trial. The pembrolizumab pooled HR for death was 0.66 (95% CI 0.56 to 0.77) compared to chemotherapy. The median overall survival was 10.4 months in the pembrolizumab (2mg) group, 12.7 months in the pembrolizumab (10mg) group and 8.5 months in the docetaxel group.
The HR for atezolizumab showed improvement in overall survival for atezolizumab over docetaxel (HR 0.73; 95% CI 0.63 to 0.85). The median overall survival was 13.8 months for atezolizumab versus 9.6 months for docetaxel in the OAK trial and 12.6 versus 9.7 months in the POPLAR trial.
Figure 1 Overall survival immunotherapy versus chemotherapy
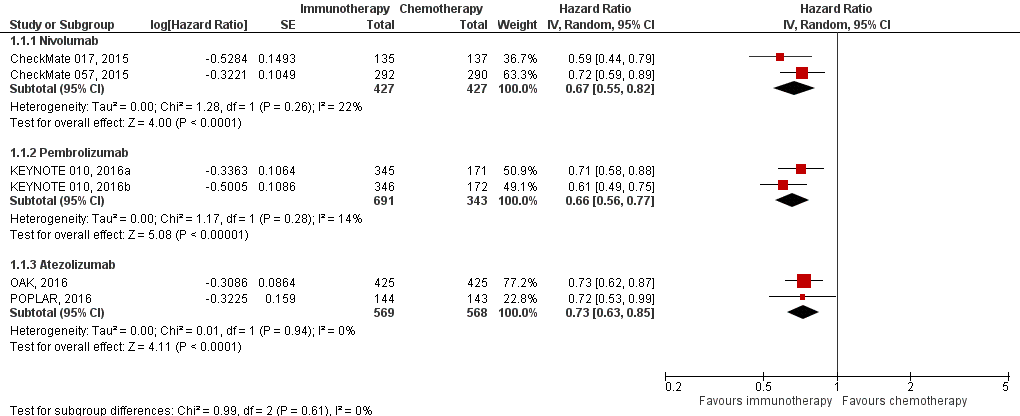
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Horn (2017) reported the 2-year outcomes of the CheckMate 017 and CheckMate 057 trials and found consistent survival rates at 1 and 2 years (pooled HR 0.72; 95% CI 0.62 to 0.84). Also after 3 years’ minimum follow-up, nivolumab continued to demonstrate an overall survival benefit versus docetaxel (pooled HR 0.70; 95% CI 0.61 to 0.81), with 17% of the patients still alive in the nivolumab groups versus 8% in the chemotherapy group (Vokes, 2018: CheckMate 017 and CheckMate 057). The pooled median overall survival was 11.1 months in the nivolumab group versus 8.1 months in the chemotherapy group.
Fehrenbacher (2018) reported an update of the OAK trial with an additional 7-months follow-up. The HR was consistent with the previous reported results (HR 0.75;95% CI 0.64 to 0.89). The median overall survival was 13.8 months in the atezolizumab group versus 9.6 months in the chemotherapy group.
Subgroups
The KEYNOTE-010 trial (pembrolizumab) included patients PD-L1 expression on at least 1% tumor cells, the other trials included patients regardless the PD-L1 expression (see figure 1). The KEYNOTE-010 trial did report overall survival for the PD-L1 subgroups 1-49% and ≥50%, the HRs for death were 0.76 (95% CI 0.60 to 0.96) and 0.53 (95% CI 0.40 to 0.70) respectively.
The pooled HR for death in PD-L1 positive patients showed clinically relevant differences in overall survival for both nivolumab (HR 0.63; 95% CI 0.48 to 0.81) and atezolizumab (HR 0.69; 95% CI 0.56 to 0.84) compared to chemotherapy (figure 2). The HRs for nivolumab and atezolizumab showed improvement in overall survival over docetaxel in PD-L1 negative patients, but the differences were not clinically relevant (HR 0.75; 95% CI 0.49 to 1.15 (nivolumab) and HR 0.81; 0.62 to 1.07 atezolizumab) (figure 3).
Figure 2 Overall survival immunotherapy versus chemotherapy PD-L1 positive
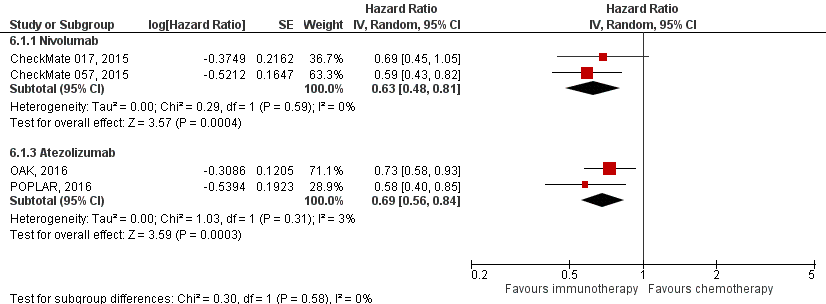
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Figure 3 Overall survival immunotherapy versus chemotherapy PD-L1 negative
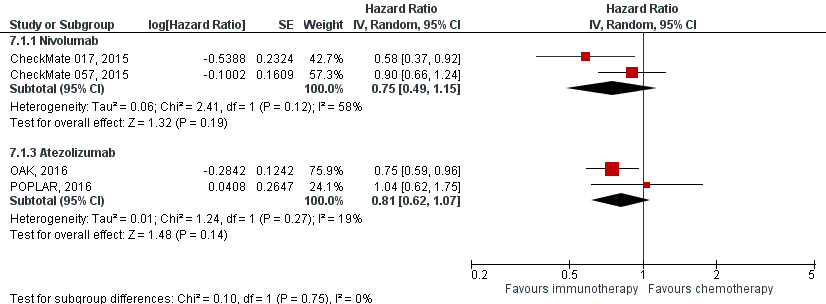
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
In addition, the trials performed subgroup analyses based on histology. The Checkmate 017 only included patients with squamous-cell NSCLC and the Checkmate 057 only included patients with non-squamous-cell NSCLC. The KEYNOTE 010 trial (pembrolizumab) reported a not clinically relevant HR for overall survival of HR 0.74 (95% CI 0.50 to 1.09) for patients with squamous-cell NSCLC and a clinically relevant HR of 0.63 (95% CI 0.50 to 0.79) for patients with adenocarcinoma. The POPLAR trial found improvement, although not clinically relevant, in survival with atezolizumab both in patients in the squamous subgroup and in patients in the non-squamous subgroup (HR 0.77, 95% CI 0.57 to 1.03 and HR 0.74, 95% CI 0.61 to 0.89, respectively). The OAK trial reported overall survival HRs favouring atezolizumab across patients with squamous (HR 0.73 (95% CI 0.54 to 0.98) and non-squamous disease (0.73 (95% CI 0.60 to 0.89), but these HRs were not clinically relevant.
2. Progression free survival
All five trials comparing immunotherapy with chemotherapy reported progression free survival (Huang, 2018), see figure 4.
The pooled hazard ratio for progression free survival showed a clinically relevant difference in progression free survival for patients receiving pembrolizumab, regardless of the dosages, compared to chemotherapy (pooled HR 0.59; 95% CI 0.48 to 0.72). The HR for progression free survival did not show clinically relevant differences for nivolumab (HR 0.77; 95% CI 0.52 to 1.14) and atezolizumab (HR 0.95; 95% CI 0.83 to 1.08) compared to docetaxel.
Figure 4 Progression free survival (HR for progression or death) immunotherapy versus chemotherapy
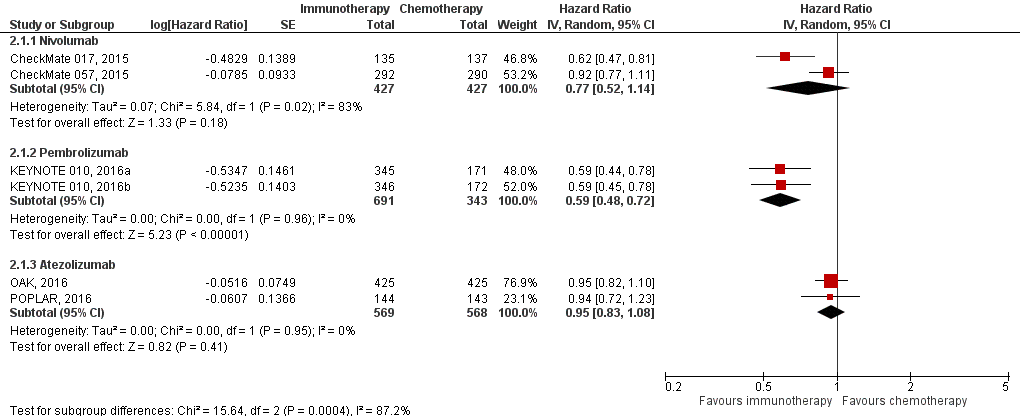
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Differences in progression free rates, which favoured nivolumab over docetaxel, were consistent at 1 and 2 years in patients (Horn, 2017: CheckMate 017 and CheckMate 057). At 3 years’ minimum follow-up the pooled progression free survival rates were 10% in the nivolumab group versus <1% in the chemotherapy group (Vokes, 2018: CheckMate 017 and CheckMate 057).
The HR of progression free survival in the OAK trial after an additional 7-months follow-up was consistent with the previous reported results (HR 0.75;95% CI 0.64 to 0.89) (Fehrenbacher, 2018).
Subgroups
The KEYNOTE-010 trial (pembrolizumab) included patients PD-L1 expression on at least 1% tumor cells (see figure 1), the other trials included patients regardless the PD-L1 expression. The KEYNOTE-010 trial did report progression free survival for the PD-L1 subgroups 1-49% and ≥50%, the HRs for progression free survival were 1.04 (95% CI 0.85 to 1.27) and 0.59 (95% CI 0.46 to 0.74) respectively.
The pooled HR for progression free survival in PD-L1 positive patients showed clinically relevant differences in progression free survival for nivolumab (HR 0.69; 95% CI 0.55 to 0.88), but not for atezolizumab (HR 0.89; 95% CI 0.75 to 1.06) compared to chemotherapy. The HRs for nivolumab and atezolizumab did not show improvement in progression free survival over docetaxel in PD-L1 negative patients (HR 0.90; 95% CI 0.50 to 1.61 and HR 1.03; 0.83 to 1.26, respectively).
In addition, the trials performed subgroup analyses based on histology. The Checkmate 017 only included patients with squamous-cell NSCLC and the Checkmate 057 only included patients with non-squamous-cell NSCLC. The KEYNOTE 010 trial (pembrolizumab) reported comparable progression free survival of HR 0.86 (95% CI 0.62 to 1.20) for patients with squamous-cell NSCLC and HR of 0.86 (95% CI 0.71 to 1.03) for patients with adenocarcinoma, both not clinically relevant.
3. Response rate
All five trials comparing immunotherapy with chemotherapy reported the overall response rate according to RECIST (Huang, 2018), see figure 5. Patients receiving nivolumab had a higher clinical response rate compared to patients receiving chemotherapy. the pooled response rate was 19.2% in the nivolumab group versus 11% in the chemotherapy group (RR 1.73; 95% CI 1.24 to 2.42). Also patients receiving pembrolizumab group had a higher clinical response rate compared to patients receiving chemotherapy, with a pooled response rate of 18.2% in the pembrolizumab group versus 9.3% in the chemotherapy group (RR 1.95; 95% CI 1.47 to 2.59). No difference were found between patients receiving atezolizumab or docetaxel. The response rate was 13.8% in the atezolizumab groups versus 13.7% in de chemotherapy group (RR 1.01; 95% CI 1.47 to 2.59).
Figure 5 Response rate immunotherapy versus chemotherapy
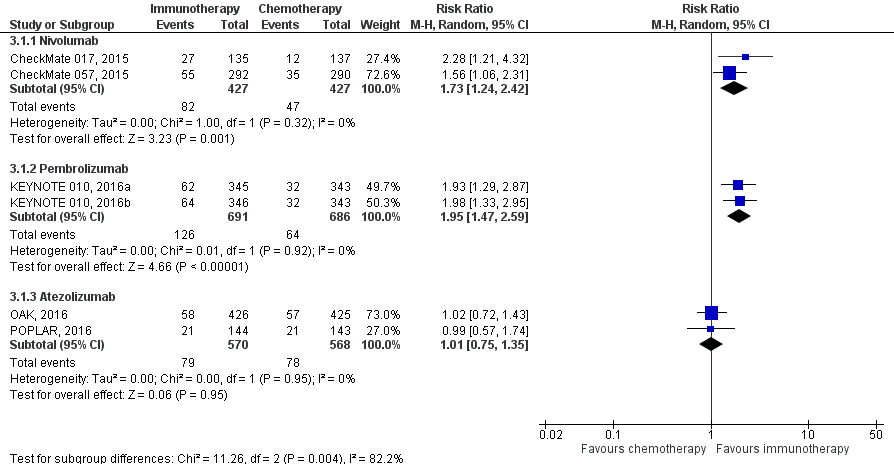
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
The objective response rates at 2 years (Horn, 2017) and 3 years (Vokes, 2018) did not change from those reported in the primary analyses (1-year of minimum follow-up) and were higher with nivolumab than with docetaxel. Also results of the OAK trial with an additional 7 months follow-up were consistent with those of the primary efficacy analysis (Fehrenbacher, 2018).
4. Quality of life
Three studies reported health related quality of life of patients receiving either immunotherapy or chemotherapy. Reck (2017) (CheckMate-017) and Reck (2018) (CheckMate-057) reported health related quality of life in patients receiving nivolumab or chemotherapy. Both studies used the European Quality of Life Five Dimensions (EQ-5D) questionnaires. The EQ-5D measures the utility index scores, ranging from 0 (worst health status) to 1 (best health status). For the EQ-5D VAS, patients rank their overall health status from 0 (worst imaginable) to 100 (best imaginable).
Reck (2017) found a difference in EQ-5D utility index scores mean change of 0.027 (95% CI -0.047 to 0.100), which was not a clinically relevant difference. The reported difference of 7.2 (95% CI 0.6 to 13.8) in mean change on the EQ-5D VAS was clinically relevant.
Reck (2018) observed improvements in HRQoL with nivolumab but not with docetaxel by the VAS (difference in mean change 5.9; 95% CI 2.2 to 9.7), but this was not a clinically relevant difference. The utility index indicated stable health status throughout treatment in both arms (difference in mean change 0.034; 95% CI -0.009 to 0.076).
Bordoni (2018) reported health related quality of life in patients receiving atezolizumab or chemotherapy (OAK trial) measured with the EORTC Quality-of-Life Core Questionnaire (QLQ-C30). The HR for time to deterioration in health-related quality of life was 0.94 (95% CI 0.72 to 1.24), favouring atezolizumab. The atezolizumab-treated patients reported numerically improved HRQoL from baseline starting at cycle 3 and continuing until cycle 13.
5. Safety (adverse events and toxicity)
All five trials comparing immunotherapy with chemotherapy reported treatment-related adverse events. Patients receiving nivolumab had a clinically relevant difference of 26% less adverse events (all grades) compared to patients with chemotherapy (RR 0.74; 95% CI 0.64 to 0.86). Patients receiving pembrolizumab had 20% less adverse events compared to patients with chemotherapy (RR 0.80; 95% CI 0.74 to 0.86) and patients receiving atezolizumab had 25% less adverse events compared to patients receiving chemotherapy (RR 0.75; 95% CI 0.71 to 0.80) (figure 6).
Figure 6 Treatment-related adverse events (any grade) immunotherapy versus chemotherapy
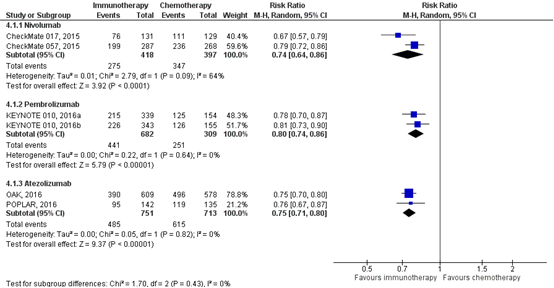
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
All immunotherapies resulted in clinically relevant less severe adverse events (grade 3,4, or 5) compared to chemotherapy (figure 7). Patients receiving nivolumab had 83% less serious adverse events compared to patients with chemotherapy (RR 0.17; 95% CI 0.11 to 0.25), patients receiving pembrolizumab had 59% less serious adverse events compared to patients with chemotherapy (RR 0.41; 95% CI 0.32 to 0.52) and patients receiving atezolizumab had 66% less serious adverse events compared to patients receiving chemotherapy (RR 0.34; 95% CI 0.28 to 0.41).
Figure 7 Treatment-related adverse events (grade ≥3) immunotherapy versus chemotherapy
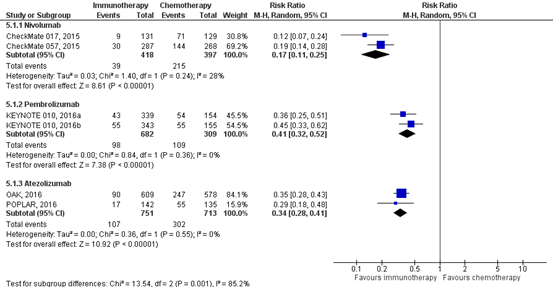
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Rates of the most frequently reported treatment-related AEs at two years (Horn, 2017) and three years (Vokes, 2018) in the CheckMate 017 and CheckMate 057 trials remained similar to those reported in the primary analyses (1 year). Atezolizumab continued to demonstrate a favorable safety profile after longer treatment exposure and follow-up (Fehrenbacher, 2018).
Level of evidence comparison immunotherapy versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
Nivolumab
The level of quality of evidence for the outcome overall survival, response rate and quality of life was downgraded with 2 levels from high to low because of imprecision of results (overlap with the border of clinical relevance).
The level of quality of evidence for the progression free survival was downgraded with 3 levels from high to very low because of inconsistency of results (variance of point estimates across studies) and imprecision of results (overlap with the border of clinical relevance).
The level of quality of evidence for the outcome safety was downgraded with 2 levels from high to low because of imprecision of results (small number of events).
Pembrolizumab
The level of quality of evidence for the outcome overall survival, progression free survival and response rate was downgraded with 1 level from high to moderate because of imprecision of results (overlap with the border of clinical relevance).
The level of quality of evidence for the outcome safety was downgraded with 2 levels from high to low because of limitations in the study design such lack of blinding (subjective outcomes) and imprecision of results (small number of events ).
As the included study did not report data on the quality of life, it was not possible to assess the level of evidence.
Atezolizumab
The level of quality of evidence for the outcome overall survival, progression free survival, response rate, quality of life and safety was downgraded with 2 levels from high to low because of unclear randomization method, unclear or no allocation concealment and lack of blinding, imprecision of results (total number of patients <2000 per group).
Zoeken en selecteren
To answer our clinical question a systematic literature analysis was performed for the following research questions and accompanying PICO:
What is the effectivity and safety of second-line immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors in patients with non–small-cell lung cancer stage IIIB/IV without sensitizing oncogene driver mutations compared to chemotherapy?
P (population) patients with non–small-cell lung cancer stage IIIB/IV with progression during or after chemotherapy and without sensitizing oncogene driver mutations;
I (intervention) immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors;
C (comparison) chemotherapy;
O (outcome) overall survival, progression free survival, response rate, quality of life, safety (adverse events and toxicity).
Relevant outcome measures
The working group considered overall survival a critical outcome measure for the decision making process; and progression free survival, response rate, quality of life, safety (adverse events and toxicity) important outcome measures for decision making.
The working group defined clinically relevant differences as follows:
Overall survival: >12 weeks or hazard ratio <0.7.
Progression free survival: >12 weeks or hazard ratio <0.7.
Adverse events and toxicity: lethal <5%, acute or severe <25%.
Response rate: No relevant difference available, however upon progression, until recently, single-agent chemotherapy was considered standard of care for patients with an adequate performance status, despite rendering responses in only 7.1 to .1% (Schvartsman, 2017).
Quality of life: The minimum important difference (MID) has been estimated to be a difference of 0.08 or more points for the EQ-5D utility index and seven or more points for the EQ-5D VAS (Pickard, 2007).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched from 1st of January 2005 up to September 2018 using relevant search terms for systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies (OBS). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 519 hits. Studies were selected based on the following criteria: systematic review or randomized trials including patients with non–small-cell lung cancer stage IIIB/IV with progression during or after chemotherapy and without sensitizing oncogene driver mutations and comparing immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors. 60 studies were initially selected based on title and abstract. After reading the full text, 53 studies were excluded (see the table with reasons for exclusion under the tab Methods), and seven articles were definitely included in the literature summary. Important study characteristics and results are depicted in the evidence tables. The assessment of the risk of bias is depicted in the risk of bias tables.
Referenties
- 1 - Horn L, Spigel DR, Vokes EE, Holgado E, Ready N, Steins M, Poddubskaya E, Borghaei H, Felip E, Paz-Ares L, Pluzanski A, Reckamp KL, Burgio MA, Kohlhäeufl M, Waterhouse D, Barlesi F, Antonia S, Arrieta O, Fayette J, Crinò L, Rizvi N, Reck M, Hellmann MD, Geese WJ, Li A, Blackwood-Chirchir A, Healey D, Brahmer J, Eberhardt WEE. Nivolumab Versus Docetaxel in Previously Treated Patients With Advanced Non-Small-Cell Lung Cancer: Two-Year Outcomes From Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol. 2017 Dec 10;35(35):3924-3933. doi: 10.1200/JCO.2017.74.3062. Epub 2017 Oct 12. PubMed PMID: 29023213; PubMed Central PMCID: PMC6075826.
- 2 - Reck M, Taylor F, Penrod JR, DeRosa M, Morrissey L, Dastani H, Orsini L, Gralla RJ. Impact of Nivolumab versus Docetaxel on Health-Related Quality of Life and Symptoms in Patients with Advanced Squamous Non-Small Cell Lung Cancer: Results from the CheckMate 017 Study. J Thorac Oncol. 2018 Feb;13(2):194-204. doi: 10.1016/j.jtho.2017.10.029. Epub 2017 Nov 10. PubMed PMID: 29129758.
- 3 - Bordoni R, Ciardiello F, von Pawel J, Cortinovis D, Karagiannis T, Ballinger M, Sandler A, Yu W, He P, Matheny C, Felizzi F, Rittmeyer A. Patient-Reported Outcomes in OAK: A Phase III Study of Atezolizumab Versus Docetaxel in Advanced Non-Small-cell Lung Cancer. Clin Lung Cancer. 2018 Sep;19(5):441-449.e4. doi: 10.1016/j.cllc.2018.05.011. Epub 2018 May 31. PubMed PMID: 30017645.
- 4 - Vokes EE, Ready N, Felip E, Horn L, Burgio MA, Antonia SJ, Arén Frontera O, Gettinger S, Holgado E, Spigel D, Waterhouse D, Domine M, Garassino M, Chow LQM, Blumenschein G Jr, Barlesi F, Coudert B, Gainor J, Arrieta O, Brahmer J, Butts C, Steins M, Geese WJ, Li A, Healey D, Crinò L. Nivolumab versus docetaxel in previously treated advanced non-small-cell lung cancer (CheckMate 017 and CheckMate 057): 3-year update and outcomes in patients with liver metastases. Ann Oncol. 2018 Apr 1;29(4):959-965. doi: 10.1093/annonc/mdy041. PubMed PMID: 29408986.
- 5 - Huang G, Sun X, Liu D, Zhang Y, Zhang B, Xiao G, Li X, Gao X, Hu C, Wang M, Ren H, Qin S. The efficacy and safety of anti-PD-1/PD-L1 antibody therapy versus docetaxel for pretreated advanced NSCLC: a meta-analysis. Oncotarget. 2017 Dec 15;9(3):4239-4248. doi: 10.18632/oncotarget.23279. eCollection 2018 Jan 9. PubMed PMID: 29423118; PubMed Central PMCID: PMC5790535.
- 6 - Fehrenbacher L, von Pawel J, Park K, Rittmeyer A, Gandara DR, Ponce Aix S, Han JY, Gadgeel SM, Hida T, Cortinovis DL, Cobo M, Kowalski DM, De Marinis F, Gandhi M, Danner B, Matheny C, Kowanetz M, He P, Felizzi F, Patel H, Sandler A, Ballinger M, Barlesi F. Updated Efficacy Analysis Including Secondary Population Results for OAK: A Randomized Phase III Study of Atezolizumab versus Docetaxel in Patients with Previously Treated Advanced Non-Small Cell Lung Cancer. J Thorac Oncol. 2018 Aug;13(8):1156-1170. doi: 10.1016/j.jtho.2018.04.039. Epub 2018 May 17. PubMed PMID: 29777823.
- 7 - Reck M, Brahmer J, Bennett B, Taylor F, Penrod JR, DeRosa M, Dastani H, Spigel DR, Gralla RJ. Evaluation of health-related quality of life and symptoms in patients with advanced non-squamous non-small cell lung cancer treated with nivolumab or docetaxel in CheckMate 057. Eur J Cancer. 2018 Oct;102:23-30. doi: 10.1016/j.ejca.2018.05.005. Epub 2018 Aug 10. PubMed PMID: 30103096.
- 8 - Schvartsman G, Peng SA, Bis G, Lee JJ, Benveniste MFK, Zhang J, Roarty EB, Lacerda L, Swisher S, Heymach JV, Fossella FV, William WN. Response rates to single-agent chemotherapy after exposure to immune checkpoint inhibitors in advanced non-small cell lung cancer. Lung Cancer. 2017 Oct;112:90-95. doi: 10.1016/j.lungcan.2017.07.034. Epub 2017 Aug 3. PubMed PMID: 29191606.
- 9 - Pickard AS, Neary MP, Cella D. Estimation of minimally important differences in EQ-5D utility and VAS scores in cancer. Health Qual Life Outcomes. 2007 Dec 21;5:70. Erratum in: Health Qual Life Outcomes. 2010;8:4. PubMed PMID: 18154669; PubMed Central PMCID: PMC2248572.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Huang, 2018 |
Yes |
Yes |
No |
Yes |
Not applicable |
Yes, using Jadad score |
No, different types of immunotherapy are combined |
No |
Yes |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
CheckMate 017 (Brahmer, 2015; Reck,2017; Horn, 2017; Vokes, 2018) |
Patients were randomly assigned (1:1) with a central interactive voice response system. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely (efficacy: ITT, safety: as treated) |
|
CheckMate 057 (Borghaei, 2015; Reck,2018; Horn, 2017; Vokes, 2018) |
Patients were randomly assigned (1:1) with a central interactive voice response system. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely (efficacy: ITT, safety: as treated) |
|
KEYNOTE-010 (Herbst, 2016) |
Patients were randomly assigned (1:1:1) with a central interactive voice-response system. The allocation schedule was generated by the system vendor using a computerised randomised list generator. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely (efficacy: ITT, safety: as treated) |
|
OAK (Rittmeyer, 2016; Bordoni, 2018; Fehrenbacher, 2018) |
Not described |
Likely, allocation was unmasked. |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely (efficacy: ITT, safety: as treated) |
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Huang, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise)
|
SR and meta-analysis of RCTs
Literature search up to April 2017
A: Borghaei 2015 (CheckMate 057) B: Brahmer 2015 (CheckMate 017) C: Herbst 2016 (Keynote 010) D: Rittmeyer, 2016 (OAK) E: Fehrenbacher, 2016 (POPLAR)
Study design: RCT A: Phase III B: Phase III C: Phase II/ III D: Phase III E: Phase II
Setting and Country: SR: China, RCT’s: international studies across different countries worldwide
Source of funding and conflicts of interest: SR: The authors declare no conflicts of interest. The study was supported by the National Natural Science Foundation of China.
A: Bristol-Myers Squibb B: Bristol-Myers Squibb C: Merck & Co D: F. Hoffmann-La Roche Ltd, Genentech, Inc. E: F Hoffmann-La Roche/Genentech
|
Inclusion criteria SR: The eligible literature was confined to randomized clinical trials written in English. The studies included met the following criteria: (1) Published studies comparing anti-PD-1/PD-L1 antibodies with docetaxel for patients with pretreated advanced non-small cell lung cancer; (2) The outcomes of the trials were available: overall survival (OS), progression-free-survival (PFS), objective response rate (ORR), adverse events (AE), and hazard ratio (HR).
Population included studies:* A: Stage IIIB or IV, recurrent non-squamous NSCLC after radiation therapy or surgical resection and had also disease recurrence or progression during one prior platinum-based doublet chemotherapy regimen. B: Stage IIIB or IV squamous-cell NSCLC who had disease recurrence after one prior platinum-containing regimen were eligible for participation in study. C: Patients, with progression, after two or more cycle of platinum-doublet chemotherapy, PD-L1 expression on at least 1% tumour cells. D: Patients who had squamous or non-squamous non-small-cell lung cancer. Patients had received one to two previous cytotoxic chemotherapy regimens (one or more platinum based combination therapies) for stage IIIB or IV non-small-cell lung cancer. E: Patients with NSCLC who progressed on post-platinum Chemotherapy.
Exclusion criteria SR: The exclusion criteria were (1) The phase I trials and (2) studies with no available outcomes.
5 studies included
Important patient characteristics at baseline:*
Number (I/C) A: 292/ 290 B: 135/ 137 C: I1: 345/ I2: 346/ C: 343 D: 425/ 425 E: 144/ 143
Age, median (range) (I/C) A: 61 (37-84)/ 64 (21-85) B: 62 (39-85)/ 64 (42-84) C: I1: 345/ I2: 346/ C: 63/ 63/ 62 D: 63.0 (33.0-82.0)/ 64.0 (34.0-85.0) E: 62 (42–82)/ 62 (36–84)
Sex: A: 52%/ 58% Male B: 82%/ 71% Male C: I1: 62%/ I2: 62% C: 61% Male D: 61%/ 61% Male E: 65%/ 53% Male
ECOG performance-status score, n (%) (I/C) A: 0: 20 (7)/ 24 (8) 1: 208 (71)/ 194 (67) Unknown: 0/ 1 (<1) B: 0: 27 (20)/ 37 (27) 1: 106 (79)/ 100 (73) Unknown: 2 (1)/ 0 C: I1/I2/C 0: 112 (33)/ 120 (35)/ 116 (34) 1: 229 (67)/ 225 (65)/ 224 (65) 2: 3 (1)/ 1 (<1%)/ 1 (<1%) 3: 0/ 0/ 1(<1%) Unknown: 0/ 0/ 1 (<1%) D: 0: 36%/ 38% 1: 64%/ 62% E: 0: 32%/ 32% 1: 68%/ 68%
Central nervous system metastasis, n (%) (I/C) A: 9 (7)/ 8 (6) B: 121 (90)/ 129 (94) C: brain: I1: 16%/ I2: 14%/ C: 14% D: NR E:
Mutations A: NR EGFR: 15%/ 13% ALK: 4%/ 3% KRAS: 10%/ 12% B: NR C: I1/ I2/ C EGFR wild-type: 85%/ 83%/ 86% EGFR mutant: 8%/ 9%/ 8% ALK: 2(1%)/ 4 (1%)/ 2 (1%) D: EGFR: 10%/ 10% ALK: <1%/ 0 KRAS: 6%/ 8% E: EGFR: 12%/ 10% ALK: 0/ 5% KRAS: 33%/ 43%
PD-L1 TPS A: <1%: 40%/ 38% ≥10%: 27%/ 24% B: <1%: 40%/ 38% ≥10%: 27%/ 24% C: 1–49%: I1: 60%/ I2: 56%/ C: 56% ≥50%: I1: 40%/ I2: 44%/ C: 44% D: TC3 or IC3: 17%/ 15% TC2/3 or IC2/3: 30%/ 32% TC1/2/3 or IC1/2/3: 57%/ 52% TC0 and IC0: 47%/ 42% E: TC3 or IC3: 16% TC2/3 or IC2/3: 37% TC1/2/3 or IC1/2/3: 68% TC0 and IC0: 32%
Groups comparable at baseline? Yes |
Describe intervention:
A: Nivolumab 3 mg/ kg IV q2w B: Nivolumab 3 mg/ kg IV q2w C: I1. Pembrolizumab 2 mg/ kg IV q3w I2. Pembrolizumab 10 mg/ kg IV q3w D: Atezolizumab 1200mg IV q3w E: Atezolizumab 1200mg IV q3w |
Describe control:
A: Docetaxel 75 mg/ m2 IV q3w B: Docetaxel 75 mg/ m2 IV q3w C: Docetaxel 75 mg/ m2 IV q3w D: Docetaxel 75 mg/ m2 IV q3w E: Docetaxel 75 mg/ m2 IV q3w
|
End-point of follow-up*:
A: The minimum follow-up for overall survival was 13.2 months. B: The minimum follow-up was approximately 11 months. C: A minimum of 8 months of follow-up after enrolment was complete to observe the required number of events. At the cutoff date the median follow-up was 13.1 months (IQR 8.6–17.7). D: The median follow-up was 21 months. E: Median follow-up was 14.8 months (range 0.2 to 19.6) in the atezolizumab group and 15.7 months (range 0.1 to 18.7) in the docetaxel group.
For how many participants were no complete outcome data available? (intervention/control) A: 0 B: 0 C: ITT: 1/ 0/ 0, Safety (did not receive assigned treatment: 6/ 3/ 34 D: 2/ 2 E: 1/ 1
|
Outcome measure-1 Defined as overall survival
Effect measure HR (95% CI): A: 0.73 (95% CI 0.59 to 0.89) Median OS 12.2 months (95% CI 9.7 to 15.0)/ 9.4 months (95% CI 8.1 to 10.7) B: 0.59 (95% CI 0.44 to 0.79) C: I1 vs C 0.61 (95% CI 0.49 to 0.76) I2 vs C 0.71 (95% CI 0.58 to 0.87) D: 0.73 (95% CI 0.62 to 0.87) E: 0.73 (95% CI 0.53 to 0.99)
PD-L1subgroups Positive Pooled HR A+B: 0.63; 95% CI 0.48 to 0.81 Pooled HR D+E: 0.69; 95% CI 0.56 to 0.84
Negative Pooled HR A+B: 0.75; 95% CI 0.49 to 1.15 Pooled HR D+E: 0.81; 0.62 to 1.07
Outcome measure-2 Defined as progression free survival
Effect measure: HR (95% CI): A: 0.92 (95% CI 0.77 to 1.10) Median PFS 2.3 months (95% CI 2.2 to 3.3)/ 4.2 (95% CI B: 0.59 (95% CI 0.44 to 0.79) C: I1 vs C 0.79 (95% CI 0.66 to 0.95) I2 vs C 0.88 (95% CI 0.75 to 1.03) D: 0.95 (95% CI 0.82 to 1.1.0) E: 0.94 (95% CI 0.72 to1.23)
PD-L1subgroups Positive Pooled HR A+B: 0.69; 95% CI 0.55 to 0.88 Pooled HR D+E: 0.89; 95% CI 0.75 to 1.06
Negative Pooled HR A+B: 0.90; 95% CI 0.50 to 1.61 Pooled HR D+E: 1.03; 0.83 to 1.26
Outcome measure-3 Defined as quality of life A: NR B: NR C: NR D: NR E: NR
Outcome measure 4 Defined as objective response rate
Number events A: 55 of the 292/ 35 of the 290 B: 27 of the 135/ 12 of the 137 C: I1: 64 of the 346/ I2: 62 of the 344/ C: 32 of the 343 D: 58 of the 425/ 57 of the 425 E: 21 of the 144/ 21 of the 143
Outcome measure 5 Defined as safety (Adverse events (CTCAE) and toxicity)
Any event N (%) (I/C) A: 199 of the 287 (69%)/ 236 of the 268 (88%) B: 76 of the 131 (58%)/ 111 of the 129 (86%) C: I1: 215 of the 339 (63%)/ I2: 226 of the 343 (66%)/ C: 251 of the 309 (81%) D: 390 of the 609/ 496 of the 578 E: 95 of the 142/ 119 of the 135
Grade 3 or higher A: 30 of the 278/ 144 of the 268 B: 9 of the 131/ 71 of the 129 C: I1: 43 of the 339/ I2: 55 of the 343/ C: 109 of the 309 D: 90 of the 609/ 247 of the 578 E: 17 of the 142/ 55 of the 135
|
Author’s conclusion Compared with docetaxel, anti-PD-1/PD-L1 antibody therapy improved clinical efficacy and safety in previously treated advanced NSCLC patients. This therapy may be a promising treatment for advanced NSCLC patients.
Level of evidence: GRADE not reported
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis)
*Not reported in SR, extracted from individual studies
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Reck, 2017 (QoL CheckMate 017) |
Type of study: Phase III RCT
Setting and country: study across different countries worldwide
Funding and conflicts of interest: Bristol-Myers Squibb
Dr. Reck reports serving in a consulting or advisory role and serving in the speakers' bureaus of AstraZeneca, Boehringer Ingelheim, Bristol-Myers Squibb, Celgene, Lilly, Merck Sharp and Dohme, Pfizer, and Roche. Ms. Taylor, Dr. DeRosa, and Ms. Morrissey report serving in a consulting or advisory role for and receiving research funding from Bristol-Myers Squibb (to their institution). Drs. Penrod, Dastani, and Orsini are employees of and report stock/other ownership in Bristol-Myers Squibb. Dr. Gralla reports receiving honoraria from Merck and serving in a consulting or advisory role for Boehringer Ingelheim, Bristol-Myers Squibb, Lilly, and Merck. |
Inclusion criteria: Patients with stage IIIB or IV squamous-cell NSCLC who had disease recurrence after one prior platinum-containing regimen were eligible for participation in the study. Eligible patients were 18 years of age or older, had an Eastern Cooperative Oncology Group (ECOG) performance-status score of 0 or 1 (on a scale from 0 to 5, with higher scores indicating greater disability; a score of 0 indicates no symptoms, and 1 mild symptoms), and had submitted a pretreatment tumour-tissue specimen for biomarker analyses. Patients with treated, stable brain metastases were eligible.
Exclusion criteria: Key exclusion criteria were autoimmune disease, symptomatic interstitial lung disease, systemic immunosuppression, prior therapy with T-cell costimulation or checkpoint-targeted agents, or prior docetaxel therapy. Patients who had received more than one prior systemic therapy for metastatic disease were excluded.
N total at baseline: Intervention: 135 Control: 137
Important prognostic factors2: Age median, range: I: 62 (39-85) C: 64 (42-84)
Sex: I: 82% M C: 71% M
EQ-5D utility index scores Baseline score: I: 0.683 ± 0.208 C: 0.663 ± 0.284
Mean EQ-5D VAS scores Baseline score: I: 63.7 ± 18.2 C: 66.3 ± 20.5
For other prognostic factors see evidence table for systematic reviews (Huang, 2017 – CheckMate 017 trial)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Nivolumab 3 mg/ kg IV q2w
|
Describe control (treatment/procedure/test):
Docetaxel 75 mg/ m2 IV q3w |
Length of follow-up: Up to 84 weeks
Incomplete outcome data: In both treatment groups, EQ-5D completion rates exceeded 70% up to week 12.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure – Quality of life EQ-5D utility index scores defined as mean ± SE Change compared with baseline; p Value
I: 0.053 ± 0.022; 0.016 (n= 94) C: 0.053 ± 0.022; 0.016 (n=87)
Difference in Mean Change 0.027 (95% CI -0.047 to 0.100)
Mean EQ-5D VAS scores defined as mean ± SE Change compared with baseline; p Value
I: 3.6 ± 2.4; 0.124 C: - 3.6 ± 2.8; 0.191
Difference in Mean Change 7.2 (95% CI 0.6 to 13.8) |
Author’s conclusion Nivolumab alleviates symptom burden and improves health status versus docetaxel as second-line squamous NSCLC treatment. |
|
Reck, 2018 (QoL CheckMate 057) |
Type of study: Phase III RCT
Setting and country: study across different countries worldwide
Funding and conflicts of interest: Bristol-Myers Squibb
M.R. has received honoraria for lectures and consulting from AstraZeneca, Boehringer Ingelheim, Bristol-Myers Squibb, Celgene, Lilly, Merck Sharp & Dohme, Novartis, Pfizer and Roche. J.B. has received grants, personal fees and non-financial support from Bristol-Myers Squibb and grants and personal fees from AstraZeneca and Merck. B.B., F.T. and M.D. have acted as consultants for and received research funding from Bristol-Myers Squibb. J.R.P and H.D. are employees of and have stock in Bristol-Myers Squibb. R.J.G. has received honoraria from Merck and has acted as a consultant for Boehringer Ingelheim, Bristol-Myers Squibb, Lilly and Merck. D.S. has declared no conflicts of interest. |
Inclusion criteria: Eligible patients had documented stage IIIB or IV or recurrent nonsquamous NSCLC after radiation therapy or surgical resection and had also had disease recurrence or progression during or after one prior platinum-based doublet chemotherapy regimen. Patients with known EGFR mutation or ALK translocation were allowed to have received or be receiving an additional line of tyrosine kinase inhibitor therapy, and a continuation of or switch to maintenance therapy with pemetrexed, bevacizumab, or erlotinib was allowed in all patients. Patients had to be 18 years of age or older, have an Eastern Cooperative Oncology Group (ECOG) performance-status score of 0 or 1 (on a scale from 0 to 5, with higher numbers indicating greater tumour-related disability; a score of 0 indicates no symptoms, and 1 mild symptoms), and have adequate hematologic, hepatic, and renal function; patients with central nervous system metastases were eligible if the metastases had been treated and were stable.
Exclusion criteria: Exclusion criteria were autoimmune disease, symptomatic interstitial lung disease, systemic immunosuppression, prior treatment with immune-stimulatory antitumor agents including checkpoint-targeted agents, and prior use of docetaxel.
N total at baseline: Intervention: 292 Control: 290
Important prognostic factors2:
EQ-5D utility index scores Baseline score: I: 0.721 ± 0.231 C: 0.290 ± 0.690
Mean EQ-5D VAS scores Baseline score: I: 68.6 ± 18.9 C: 66.6 ± 21.4
For other prognostic factors see evidence table for systematic reviews (Huang, 2017 – CheckMate 057 trial)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Nivolumab 3 mg/ kg IV q2w
|
Describe control (treatment/procedure/test):
Docetaxel 75 mg/ m2 IV q3w |
Length of follow-up: Up to 66 weeks
Incomplete outcome data: Intervention: 95 (32.5%) Reasons incomplete/ missing questionnaires
Control: 84 (29.0%) Reasons incomplete/ missing questionnaires
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure – Quality of life EQ-5D utility index scores defined as mean ± SE Change compared with baseline; p Value
I: 0.035 (0.018); 0.053 (n=197) C: 0.002 (0.019); 0.936 (n=206)
Difference in Mean Change 0.034 (95% CI -0.009 to 0.076)
Mean EQ-5D VAS scores defined as mean ± SE Change compared with baseline; p Value
I: 3.8 (1.6); 0.021 C -2.1 (1.7); 0.221
Difference in Mean Change 5.9 (95% CI 2.2 to 9.7) |
Author’s conclusion Nivolumab improved disease-related symptoms and overall health status versus docetaxel for second-line treatment of advanced non-squamous NSCLC. |
|
Horn, 2017 (two-years outcomes of the CheckMate 017 and CheckMate 057 trials) |
See evidence table systematic reviews (Huang, 2018, study A Borghaei, 2015 (CheckMate 057) and B Brahmer, 2015 (CheckMate 017)) for study characteristics. |
|
|
|
Length of follow-up: Minimum follow-up, 24.2 months among patients alive and in the studies.
Loss-to-follow-up: Checkmate 017 Intervention: Discontinued treatment (n = 121): Disease progression (n = 94) Study drug toxicity (n = 9) Adverse events unrelated to study drug (n = 7) Requested to discontinue treatment (n = 5) Withdrew consent (n = 3) Maximum clinical benefit (n = 1) Poor or no compliance (n = 1) No longer met study criteria (n=1)
Ongoing treatment (n = 10)
Included in efficacy analyses (n = 135) Included in safety analyses (n = 131)
Control: Discontinued treatment (n = 129): Disease progression (n = 80) Study drug toxicity (n = 13) Adverse events unrelated to study drug (n = 13) Maximum clinical benefit (n = 9) Requested to discontinue treatment (n = 5) Withdrew consent (n = 5) No longer met study criteria (n = 2) Not reported (n = 2)
Ongoing treatment (n = 10)
Included in efficacy analyses (n = 137) Included in safety analyses (n = 129)
CheckMate 057 Intervention: Discontinued treatment (n = 260) Disease progression (n = 202) (n = 11) (n = 21) Adverse events unrelated to study drug (n = 22) Study drug toxicity Requested to discontinue treatment (n = 6) Withdrew consent (n = 4) No longer met study criteria (n = 2) Died (n =1) Other (n = 2)
Ongoing (n = 27)
Included in efficacy analyses (n = 292) Included in safety analyses (n = 287)
Control: Discontinued treatment (n = 268) Disease progression (n = 179) Study drug toxicity (n = 43) Requested to discontinue treatment (n = 17) Adverse events unrelated to study drug (n=11) Maximum clinical benefit (n = 10) Withdrew consent (n = 5) Died (n = 1) Other (n = 2)
Ongoing (n = 0)
Included in efficacy analyses (n = 290) Included in safety analyses (n = 268)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1 Defined as overall survival Differences in OS rates between the nivolumab and docetaxel groups were consistent at 1 and 2 years.
OS rates Checkmate 017 (squamous) I: 23% (95% CI 16% to 30%) C: 8% (95% CI 4% to 13%)
CheckMate 057 (non-squamous) I: 29% (95% CI 24% to 34%) C: 16% (95% CI 12% to 20%)
Median OS (months) Checkmate 017 (squamous) I: 9.2 (95% CI 7.3 to 12.6) C: 6.0 (95% CI 5.1 to 7.3)
CheckMate 057 (non-squamous) I: 12.2 (95% CI 9.7 to 15.1) C: 9.5 (95% CI 8.1 to 10.7)
Pooled: I: 11.1 months (95% CI 9.2 to 13.1 months) C: 8.1 months (95% CI 7.2 to 9.2 months)
HR 0.72; 95% CI 0.62 to 0.84
Outcome measure-2 Defined as progression free survival
PFS rates Checkmate 017 (squamous) I: 16% (95% CI 10% to 23%) C: Not calculable because no patients continued with follow-up for progression at this time
CheckMate 057 (non-squamous) I: 12% (95% CI 8% to 16%) C: 1%
Median PFS (months (95% CI)) Checkmate 017 (squamous) I: 3.5 (2.1 to 5.1) C: 2.8 (2.1 to 3.5)
CheckMate 057 (non-squamous) I: 2.3 (2.2 to 3.4) C: 4.3 (3.4 to 4.9)
Outcome measure-3 Defined as quality of life NR
Outcome measure 4 Defined as objective response rate (of confirmed responders)
Checkmate 017 (squamous) I: 10 (37%) of the 27 patients C: 0
CheckMate 057 (non-squamous) I: 19 (34%) of 56 patients C: 0
Defined as median (months) duration of response Checkmate 017 (squamous) I: 25.2 (95% CI 9.8 to 30.4) C: 8.4 months (95% CI 3.6 to not estimable)
CheckMate 057 (non-squamous) I: 17.2 (95% CI 8.4 to not estimable) C: 5.6 (95%CI 4.4 to 6.9)
Outcome measure 5 Defined as safety (Adverse events (CTCAE) and toxicity) after 2 years’ minimum follow-up
AEs in each study remained similar to those reported in the primary analyses.
Any event (pooled) I: 68% C: 88%
Grade 3 to 4 (pooled) I: 10% C: 55% |
Author’s conclusion Nivolumab provides long-term clinical benefit and a favorable tolerability profile compared with docetaxel in previously treated patients with advanced NSCLC.
Treatment regime at 2 years At 2 years, 15 (11%) of 131 patients with squamous NSCLC treated with nivolumab and 34 (12%) of 287 patients with nonsquamous NSCLC treated with nivolumab remained on treatment; no docetaxel-treated patients remained on treatment. In the nivolumab and docetaxel groups, respectively, 55 patients (41%) and 44 patients (32%) with squamous NSCLC and 133 patients (46%) and 150 patients (52%) with nonsquamous NSCLC received other systemic therapy subsequent to study treatment, most commonly chemotherapy. In the docetaxel groups, 11 patients (8%) with squamous NSCLC and 28 (10%) with nonsquamous NSCLC received anti–PD-(L)1 or anti–cytotoxic T-lymphocyte–associated antigen 4 immunotherapy either during crossover or as subsequent therapy poststudy.
Subgroup analyses Higher PD-L1 expression levels were associated with greater OS benefit with nivolumab (pooled HR 0.42; 95% CI 0.28 to 0.63) in patients with ≥50% PD-L1 expression, but a benefit was still observed in patients with , 1% PD-L1 expression (pooled HR 0.78; 95% CI, 0.61 to 0.99). |
|
Vokes, 2018 (three-years outcomes of the CheckMate 017 and CheckMate 057 trials) |
See evidence table systematic reviews (Huang, 2018, study A and B) for study characteristics. |
|
|
|
Length of follow-up: 40.3 months’ minimum follow
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure-1 Defined as overall survival
OS rates (pooled) I: 17% (95 CI, 14% to 21%) C: 8% (95% CI 6% to 11%)
HR 0.70 (95% CI 0.61 to 0.81)
Outcome measure-2 Defined as progression free survival
PFS rates (pooled) I: 10% (95% CI, 7% to 14%) C: <1% (95% CI <1% to 2%)
Outcome measure-3 Defined as quality of life NR
Outcome measure 4 Defined as objective response rate (pooled) I: 19% (95% CI 16 to 24) C: 11% (95% CI 8 to 15) OR: 1.91 (95% CI 1.28–2.86)
Defined as median (months) duration of response of the responders I: 23.8 (95% CI 11.4 to 36.1) C: 5.6 (95% CI 4.4 to 7.0)
Outcome measure 5 Defined as safety (Adverse events (CTCAE) and toxicity) after 3 years’ minimum follow-up
No patient remained on docetaxel treatment for more than 2 years; therefore, updated safety data are presented in nivolumab-treated patients only.
Any event (pooled) I: 283 (68)
Grade 3 to 4 (pooled) I: 44 (10) |
Author’s conclusion After 3 years’ minimum follow-up, nivolumab continued to demonstrate an OS benefit versus docetaxel in patients with advanced NSCLC. Similarly, nivolumab demonstrated an OS benefit versus docetaxel in patients with liver metastases, and remained well tolerated.
Treatment regime at 3 years At 3 years, 7 of 131 (5%) nivolumab-treated patients with squamous NSCLC and 19 of 287 (7%) nivolumab-treated patients with nonsquamous NSCLC remained on treatment; no docetaxel-treated patients remained on treatment. In the nivolumab group, 57 (42%) patients with squamous NSCLC and 141 (48%) patients with nonsquamous NSCLC received other systemic therapy subsequent to study treatment; 48 (35%) patients and 156 (54%) patients treated with docetaxel, respectively, received other systemic therapy subsequent to study treatment. In the docetaxel groups, 11 (8%) patients with squamous NSCLC and 32 (11%) with non-squamous NSCLC received immunotherapy, either during crossover or as subsequent therapy post-study. |
|
Bordoni, 2018 (QoL OAK trial) |
Type of study: phase III RCT
Setting and country: international study conducted in 194 oncology centers across 31 countries
Funding and conflicts of interest: F. Hoffmann-La Roche Ltd, Genentech, Inc.
F.C. has an advisory board role for Amgen, Roche, Merck Serono, Servier, and Bayer. C.M. and T.K. are employees of Genentech, Inc, and own stocks in Roche. P.H. is an employee of Genentech, Inc, and owns stocks in Roche and Amgen; her husband owned stocks in Gilead and Allergan. M.B. and A.S. are employees of F. Hoffmann-La Roche, Ltd, and ow stocks in Roche. W.Y. is an employee of Genentech, Inc. D.C. is an advisory board member for F. Hoffmann-La Roche, Ltd. A.R. is an advisory board member for F. Hoffmann-La Roche, Ltd/Genentech, Inc, Eli Lilly, Bristol-Myer Squibbs, Pfizer, AstraZeneca, AbbVie, MSD, and Boehringer Ingelheim. The remaining authors declare that they have no competing interests. |
Inclusion criteria: Patients had developed PD after 1 to 2 previous cytotoxic chemotherapy regimens, including 1 platinum-based therapy regimen. Patients with epidermal growth factor receptor or anaplastic lymphoma kinase genomic alterations were required to have received approved targeted therapy.
Exclusion criteria: -
N total at baseline: Intervention: 425 Control: 425
Important prognostic factors2: The mean score for global health status on the QLQ-C30 I: 61.24, SD 22.31 C: 60.55, SD 22.25 with a higher score (scale, 0-100) indicating greater HRQoL or functioning
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Atezolizumab 1200 mg intravenously every 3 weeks until the loss of clinical benefit as assessed by the investigator in the absence of unacceptable toxicity or symptomatic deterioration attributed to disease progression.
|
Describe control (treatment/procedure/test):
Docetaxel 75 mg/m2 intravenously every 3 weeks until unacceptable toxicity or disease progression.
|
Length of follow-up: Up to 27 months
Incomplete outcome data: At baseline, 98.1% of the atezolizumab- and 96.5% of the docetaxel-treated patients completed the EORTC QLQ-C30. The completion rate was > 80% for all cycles to cycles 27 and 23 in the atezolizumab arm and docetaxel arm, respectively. For the EORTC QLQ-LC13, the completion rates were similar, with 96.7% of the atezolizumab and 95.8% of the docetaxel patients completing the questionnaire at baseline. The completion rates were > 80% for all cycles to cycles 28 and 24 in the atezolizumab arm and docetaxel arm, respectively.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure HRQoL Time to Deterioration in HRQoL (EORTC QLQ-C30) HR: 0.94 (95% CI 0.72 to 1.24)
The atezolizumab-treated patients reported numerically improved HRQoL from baseline starting at cycle 3 and continuing until cycle 13.
By cycles 5 and 6, the LS (least squares) mean difference between the 2 treatment arms was 4.32 (P = 0.015) and 3.08 (P = 0.1257) |
Author’s conclusion These PRO data support the clinical benefit of atezolizumab in patients with previously treated advanced or metastatic NSCLC. Atezolizumab prolonged the TTD of patients’ limitations in role and physical functions compared with docetaxel. |
|
Fehrenbacher 2018 (update OAK trial) |
See evidence table systematic reviews (Huang, 2018, study D Rittmeyer, 2016) |
Additional information
N total at baseline: Primary (n=850) and secondary (n=1225) efficacy populations of the randomized phase III OAK study (respectively referred to as the intention-to-treat (ITT) 850 (ITT850) and ITT1225).
ITT850, n I: 425 C: 425
ITT1225, n I: 613 C: 612 |
|
|
Length of follow-up: Additional 7 months of follow-up. The median follow-up was 28 months (minimum follow-up time of 26 months)
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Results of the ITT850 are described, unless stated otherwise.
Outcome measure-1 Defined as overall survival
OS rates 12 months I: 54.7% C: 41.1%
12 months I: 40% C: 26.9%
12 months I: 30.9% C: 21.1%
HR 0.75 (95% CI 0.64 to 0.89
Median OS (months) I: 13.8 (95% CI 11.8 to 15.7) C: 9.6 (95% CI 8.6 to 11.2)
Outcome measure-2 Defined as progression free survival
Median PFS (months) I: 2.8 (95% CI 2.6 to 3.0) C: 4.0 (95% CI3.3 to4.2)
HR 0.93 (95% CI 0.80 to 1.08)
Outcome measure-3 Defined as quality of life NR
Outcome measure 4 Defined as objective response rate I: 14.6 (11.4 to 18.3) C: 13.4 (10.3 to 17.0)
Defined as median (months) duration of response of the responders, months (95%CI) I: 16.3 (10.0 to 26.3) C: 6.2 (4.9 to 8.4)
Ongoing response, n (%) I: 28 (45.2) C: 10 (17.5)
Outcome measure 5 Defined as safety (Adverse events (CTCAE) and toxicity) in the ITT1225
Any event I: 574 (94.3) C: 557 (96.4)
Grade 3 to 4 I: 91 (14.9) C: 245 (42.4)
Grade 5 I: 0 C: 1 (0.2%) |
Author’s conclusion The results of the updated ITT850 and initial ITT1225 analyses were consistent with those of the primary efficacy analysis demonstrating survival benefit with atezolizumab versus with docetaxel. Atezolizumab continued to demonstrate a favourable safety profile after longer treatment exposure and follow-up.
Subgroups The survival benefit with atezolizumab versus docetaxel was observed across all PD-L1 expression subgroups defined by different cutpoints for TC or IC expression, including in the subgroup with low or no PD-L1 expression (TC0 and IC0) (HR 0.77, 95% CI 0.61–0.97), with the greatest benefit in the high–PD-L1 subgroup (TC3 or IC3) (HR 0.40, 95% CI 0.27–0.61).
Improvement in survival with atezolizumab was seen both in patients in the nonsquamous subgroup and in patients in the squamous subgroup (HR 0.74, 95% CI 0.61–0.89 and HR 0.77, 95% CI 0.57–1.03, respectively).
Evaluation of OS according to PD-L1 expression within histological subgroups revealed that increasing survival benefit with increased PD-L1 expression was more evident for patients with nonsquamous histological features than for patients with squamous histological features.
PFS benefit with atezolizumab versus docetaxel was not observed (HR 0.93, 95% CI 0.80 to 1.08) but was observed in the TC2/3 or IC2/3 (HR 0.76, 95% CI 0.59 to0.99) and TC3 or IC3 subgroups (HR 0.62, 95% CI 0.43 to 0.89) |
EQ-5D: European Quality of Life Five Dimensions
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Su 2017 |
Geen SR of origineel onderzoek |
|
Eu 2017 |
Voldoet niet aan PICO: EGFR driver mutatie |
|
Antonia 2016 |
Geen RCT (fase 1 studie) |
|
Borghaei 2015 |
Geëncludeerd in review Huang 2017 |
|
Hayashi 2017 |
Voldoet niet aan PICO: EGFR driver mutatie |
|
Katakami 2017 |
Vaccin |
|
Nokihara 2017 |
S-1 (orale chemotherapie) vs docetaxel |
|
Takayama 2016 |
Vaccin |
|
Zhao 2014 |
Voldoet niet aan PICO: GP vs GP chemotherapie |
|
Wang 2012 |
Recente review Huang 2017 als uitgangspunt genomen |
|
Abdel-Rahman 2016 |
Recente review Huang 2017 als uitgangspunt genomen |
|
Butts 2014 |
Vaccin |
|
De Lima Lopes 2016 |
Voldoet niet aan PICO: 1e lijns |
|
Dudnik 2017 |
Geen RCT |
|
Ettinger 2017 |
Richtlijn |
|
Felip 2016 |
Abstract met design checkmate 171 |
|
Garassino 2018 |
Geen RCT (fase 2 studie met één arm) |
|
Gerber 2017 |
Design artikel |
|
Gettinger 2018 |
Geen RCT (fase 1 studie) |
|
Gettinger 2015 |
Geen vergelijkende studie |
|
Hida 2017 |
Geen RCT (fase 2 studie) |
|
Horinouchi 2015 |
Geen RCT (fase 1 studie) |
|
Kanda 2016 |
Geen RCT |
|
Khozin 2018 |
Geen RCT |
|
Mitchell 2015 |
Vaccine |
|
Peng 2017 |
Review Huang 2017 als uitgangspunt genomen |
|
Ramalingam 2013 |
Voldoet niet aan PICO: Talactoferrin alfa vs placebo |
|
Rittmeyer 2017 |
Geïncludeerd in review Huang 2017 |
|
Uemura |
Comment |
|
Antonia 2017 |
Voldoet niet aan PICO: Durvalumab vs placebo |
|
Kim 2018 |
Voldoet niet aan PICO: KRAS mutatie |
|
Blair 2018 |
Review Huang 2017 als uitgangspunt genomen |
|
Chatterjee 2016 |
Geen RCT (fase 1 studie) |
|
Fiorica 2018 |
Geen RCT |
|
Fujimoto 2018 |
Geen RCT |
|
Goeree 2016 |
Economische evaluatie |
|
Hida 2016 |
Subgroepanalyse OAK trial voor alleen de Japanse patiënten, deze zijn al meegenomen voor de totaal analyses van de OAK trial |
|
Huang 2016 |
Review Huang 2017 als uitgangspunt genomen |
|
Lee 2018 |
Geen RCT (fase 2 studie) |
|
Lin 2018 |
Geen RCT |
|
Maymani 2018 |
Geen RCT |
|
Shukuya 2016 |
Review Huang 2017 als uitgangspunt genomen |
|
Tan 2018 |
Voldoet niet aan PICO: immunotherapie vs immunotherapie in netwerk analyse |
|
Teraoka 2017 |
Geen RCT |
|
Zhou 2016 |
Review Huang 2017 als uitgangspunt genomen |
|
Zhao 2018 |
Review Huang 2017 als uitgangspunt genomen |
|
You 2018 |
Voldoet niet aan PICO: immunotherapie vs immunotherapie |
|
Luo 2018 |
Review Huang 2017 als uitgangspunt genomen |
|
Khan 2018 |
Review Huang 2017 als uitgangspunt genomen |
|
Gandara 2018 |
Voldoet niet aan PICO: uitkomstmaat is benefit-risk beyond progression (data OAK trial gebruikt) |
|
Armoiry 2018 |
Review Huang 2017 als uitgangspunt genomen |
|
Zhuansun 2017 |
Review Huang 2017 als uitgangspunt genomen |
|
Dammeijer 2016 |
Review Huang 2017 als uitgangspunt genomen |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-09-2025
Beoordeeld op geldigheid : 24-01-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
2e lijns behandeling |
W.H. van Geffen |
2019 |
2020 |
jaarlijks |
NVALT |
Actualiteit |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. dr. A.F.T.M. Verhagen, cardio-thoracaal chirurg, Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel met gemelde belangen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingelheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patienten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van BMS (nivolumab) en Boehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Boehringer lngelheim) in 2016 financiële support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor AstraZeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt door geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator). |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (https://www.netwerk-path.nl/) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Bayer, Novartis, BMS, BioRad, Amgen, Illumina, Ageno BioSciences, Janssen Cilag (Johnson&Johnson), BioCartis (honoraria komen op een rekening op UMCG) Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, Illumina, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) betaald aan UMCG: Boehringer Ingelheim, Avenio/Roche/Cancer-ID, BMS (CA209-759), BioRad and Avenio - |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
geen |
getrouwd met praktijkhoudend huisarts |
geen |
|
Hofstede |
adviseur richtlijnontwikkeling |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. Longkanker Nederland heeft ook deelgenomen aan de Invitational conference. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longcarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Bij het vaststellen van welke verschil klinisch relevant is, heeft de werkgroep zich laten inspireren door de PASKWIL-criteria. De werkgroep is zich ervan bewust dat deze criteria zijn ontwikkeld voor de beoordeling van geneesmiddelen in de palliatieve setting en niet voor een curatieve setting.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
- Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS – voor observationeel onderzoek.
- QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2005 – september 2018
|
1 (non-small cell lung and (carcinoma* or neoplasm* or cancer*)).ti. or exp *Carcinoma, Non-Small-Cell Lung/ or nsclc.ti. (48317) 2 ((stage or cancer or nsclc or 'non-small-cell') adj4 (iii* or '3' or iv or '4' or advanced or metastatic)).ti,ab,kw. (243282) 3 Immunotherapy/ or (immunotherap* or 'anti pd1' or 'anti pdl1' or 'anti ctla4' or nivolumab or ipilimumab or pembrolizumab or durvalumab or atezolizumab or ticilimumab or tremelimumab).ti,ab,kw. (91825) 4 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (368805) 5 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1791074) 6 1 and 2 and 3 (849) 7 limit 6 to (english language and yr="2005 -Current") (783) 8 4 and 7 (56) 9 5 and 7 (345) 10 8 or 9 (355)
= 355 |
519 (uniek)
|
|
Embase (Elsevier) |
('non small cell lung cancer'/exp/mj OR ('non-small cell lung':ti AND (carcinoma*:ti OR neoplasm*:ti OR cancer*:ti)) OR nsclc:ti)
AND ((stage OR cancer OR nsclc OR 'non small cell') NEAR/4 (iii* OR 3 OR iv OR 4 OR advanced OR metastatic)):ti,ab
AND ('cancer immunotherapy'/exp OR immunotherap*:ab,ti OR 'anti pd1':ab,ti OR 'anti pdl1':ab,ti OR 'anti ctla4':ab,ti OR 'nivolumab'/exp OR nivolumab:ab,ti OR 'ipilimumab'/exp OR ipilimumab:ab,ti OR 'pembrolizumab'/exp OR pembrolizumab:ab,ti OR 'durvalumab'/exp OR durvalumab:ab,ti OR 'atezolizumab'/exp OR atezolizumab:ab,ti OR 'ticilimumab'/exp OR ticilimumab:ab,ti OR tremelimumab:ab,ti))
NOT ('first line':ti OR untreated:ti)
AND (2005-2018)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
= 331 |
