Eerstelijnsbehandeling met immunotherapie bij NSCLC
Uitgangsvraag
Wat is de plaats van immunotherapie of een combinatie van immunotherapie en chemotherapie in de eerstelijnsbehandeling (primaire behandeling) van patiënten met stadium IIIB/IV NSCLC?
Aanbeveling
De volgende aanbevelingen gelden voor patiënten met niet-curatief te behandelen NSCLC, performance score 0-1, geen contra-indicaties voor immunotherapie en zonder moleculaire abberatie waar een doelgerichte therapie voor beschikbaar is (zie hiervoor module ‘Behandeling gemetastaseerd NSCLC met zeldzame mutatie’).
Behandel patiënten met een PD-L1 ≥50% primair met pembrolizumab monotherapie, onafhankelijk van histologisch subtype.
Niet-plaveiselcel carcinoom
Overweeg bij de subgroep patiënten met niet-plaveiselcel NSCLC met PD-L1 ≥50% behandeling met platinum-pemetrexed-pembrolizumab of carboplatin-paclitaxel-bevacizumab-atezolizumab.
Behandel patiënten met niet-plaveiselcel NSCLC en een PD-L1 <50% bij voorkeur primair met platinum-pemetrexed-pembrolizumab of carboplatin-paclitaxel-bevacizumab-atezolizumab.
Plaveiselcel carcinoom
Overweeg bij de subgroep patiënten met plaveiselcel NSCLC met PD-L1 ≥50% behandeling met carboplatin-paclitaxel-pembrolizumab.
Behandel patiënten met een plaveiselcelcarcinoom met een PD-L1 <50% bij voorkeur met carboplatin-paclitaxel-pembrolizumab.
Ga in alle bovenstaande gevallen bij de patiënt na of er daadwerkelijk een behandelwens is en benoem ook de mogelijkheid van het afzien van tumorgerichte behandeling.
Overweeg behandeling met chemotherapie bij patiënten met een ECOG performance score van 2 of contra-indicaties voor immunotherapie.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De voorkeursbehandeling van gemetastaseerd NSCLC als eerstelijnsbehandeling wordt bepaald door de combinatie van zowel patiëntkarakteristieken als tumorkarakteristieken. Indien patiënt een goede performance status heeft (ECOG PS ≤1), asymptomatische of behandelde stabiele hersenmetastasen waarvoor geen dexamethason nodig is met een dosisequivalent van >10mg prednison, geen predictieve mutatie in EGFR, ALK, BRAF ROS1, en geen andere harde contra-indicaties voor immunotherapie moet immunotherapie als monotherapie danwel gecombineerd met chemotherapie als optie voor de eerstelijns behandeling overwogen worden. Tevens zijn er nog een aantal mutaties en genfusies/rearrangements zoals BRAF-V600E, ROS1 en RET waarvoor zeer effectieve TKI’s beschikbaar zijn en waarbij het effect van immunotherapie minder goed onderzocht is. Bij dergelijke abberaties dient met een expertisecentrum overlegd te worden over de behandeling van eerste voorkeur en zo nodig verwijzing. Vooralsnog zijn pembrolizumab en atezolizumab de immunotherapeutica waarvoor een klinisch relevant effect op progressie vrije overleving en overall survival is aangetoond.
Indien er sprake is van een PD-L1 TPS ≥50% is onafhankelijk van de histologie een klinisch relevant overlevingsvoordeel aangetoond van behandeling met pembrolizumab monotherapie ten opzichte van behandeling met chemotherapie alleen. Bij de niet-plaveiselcelcarcinomen is er daarnaast een voordeel aangetoond ten aanzien van progressie vrije overleving voor enkele combinaties van chemo- met immunotherapie versus chemotherapie alleen, in casu platinum-pemetrexed-pembrolizumab versus platinum-pemetrexed-placebo en voor carboplatin-paclitaxel-bevacizumab-atezolizumab versus carboplatin-paclitaxel-bevacizumab-placebo. Waarschijnlijk is er ook een voordeel ten aanzien van overall survival voor deze combinaties van chemotherapie-immunotherapie ten opzichte van chemotherapie alleen, echter deze data zijn op het moment van ontwikkeling van de richtlijn nog niet matuur en is de bewijskracht laag. Welke van de drie opties (pembrolizumab monotherapie, platinum-pemetrexed-pembrolizumab en carboplatin-paclitaxel-bevacizumab-atezolizumab) het grootste overlevingsvoordeel geeft is niet bekend, daar deze regimes niet head-to-head vergeleken zijn.
Op de datum van de literatuur search voor deze richtlijn was er nog geen fase 3 data beschikbaar over gecombineerde behandeling met chemotherapie en immunotherapie bij plaveiselcelcarcinomen. Na de search werden echter de resultaten van de keynote 407 studie (Paz-Ares, 2018) gepubliceerd. In deze studie werd chemotherapie (carboplatin + paclitaxcel of nab-paclitaxel) met placebo vergeleken met dezelfde chemotherapie met pembrolizumab. Hierbij werd een klinisch relevant voordeel gezien ten aanzien van overall survival voor de groep die behandeld werd met de pembrolizumab combinatie (HR voor overlijden 0,64; 95% BI 0,49 tot 0,85). Dit geldt met name voor de subgroepen met een PD-L1 TPS <1% en 1-49%. Voor de subgroep met een PD-L1 TPS ≥50% is het voordeel ten aanzien van overall survival niet significant. Voor progressie vrije overleving werd voor alle PD-L1 subgroepen een klinisch relevant voordeel gezien in de groep die behandeld werd met de pembrolizumab combinatie (HR voor progressie of overlijden 0,56; 95% BI 0,45 tot 0,70) .
Op grond van bijwerkingenprofiel, kosten en belasting voor de gezondheidszorg heeft de werkgroep een voorkeur voor behandeling met pembrolizumab monotherapie bij de populatie met een PD-L1 TPS ≥50%. Hier kan echter om meerdere redenen van afgeweken worden, bijvoorbeeld indien een snelle tumorrespons wenselijk danwel noodzakelijk is.
Indien er sprake is van een PD-L1 TPS 1 tot 49% is de tumorhistologie wel van belang. In geval van een niet-plaveiselcel NSCLC heeft behandeling met een combinatie van chemotherapie met immunotherapie in principe de voorkeur mits aan de voorwaarden genoemd in de eerste alinea wordt voldaan. Hiervoor zijn de combinatie carbo- of cisplatinum met pemetrexed en pembrolizumab of de combinatie carboplatin, paclitaxel, bevacizumab en atezolizumab beschikbaar. Het is moeilijk om op grond van de huidige literatuur een uitspraak te doen over welke van deze combinaties het meest effectief is daar er geen head to head vergelijking gedaan is.
Indien er sprake is van een PD-L1 TPS van 1 tot 49% bij een plaveiselcellig NSCLC was er op het moment van afkappen van de literatuur search voor deze richtlijn geen bewijs voor een significante meerwaarde van het toevoegen van immunotherapie is welke vorm dan ook aan de standaardbehandeling met chemotherapie. Zoals hierboven beschreven werden na de search de resultaten van de keynote 407 studie gepubliceerd. De uitkomsten van deze studie werden dermate relevant geacht, dat ondanks het feit dat de studie gepubliceerd werd na de zoekdatum, de werkgroep toch van mening is dat behandeling met carboplatin plus paclitaxel gecombineerd met pembrolizumab de behandeling van voorkeur zou moeten zijn voor deze groep patiënten met een plaveiselcellig NSCLC.
Ook indien er sprake is van een PD-L1 TPS <1% is de tumorhistologie van belang.
Voor het niet-plaveiselcel NSCLC werd in de Keynote-189 studie (Ghandi, 2018) voor de subgroep met een PD-L1 TPS <1% geen significant voordeel ten aanzien van progressie vrije overleving aangetoond (HR voor progressie of overlijden 0,57 (95% BI 0,53 tot 1,05), maar wel voor overall survival (HR voor overlijden 0,59 (95% BI 0,38 tot 0,92). Daarbij dient aangetekend te worden dat voor overall survival de data nog niet matuur was. Bij de IMpower150 studie (Socinski, 2018) werd in de groep met negatieve PD-L1 expressie op zowel tumorcellen als immuuncellen wel een statistisch significant voordeel gezien voor de groep die met de atezolizumab-combinatie behandeld werd versus de groep die met de placebo-combinatie behandeld werd. De hazard ratio voor progressie of overlijden bedroeg voor deze groep echter 0,77 (95% BI 0,61 tot 0,99), wat niet voldoet aan de door de werkgroep vooraf gedefinieerde criteria voor een klinisch relevant verschil. Desondanks is de werkgroep van mening dat ook bij deze subgroep behandeling met een combinatie van chemotherapie en immunotherapie in principe de voorkeur heeft mits aan de voorwaarden genoemd in de eerste alinea wordt voldaan. Een van de redenen hiervoor is de beperkte betrouwbaarheid van de gebruikte biomarker PD-L1 TPS. Het is bekend dat bij een aanzienlijk aantal patiënten de diagnose NSCLC gesteld wordt op zeer kleine biopten van 2mm of minder. In één studie bedroeg dit aantal 14,6% (Bigras, 2018). In deze studie werd deze zeer kleine biopten vergeleken met de preparaten verkregen na resectie. Hierbij werd mede op grond van een statistisch model geconcludeerd dat bij tot 35% van deze zeer kleine biopten sprake was van misklassificatie van PD-L1 TPS categorie (<1%, 1-49% of ≥50%). Dit betrof zowel een overschatting als een onderschatting van de daadwerkelijke mate van PD-L1 expressie. Een deel van de patiënten in de subgroep met een in de biopten PD-L1 negatieve tumor zal in de realiteit dus weldegelijk een tumor hebben met enige mate van PD-L1 expressie. Bij hen is er dus meer kans op voordeel van de behandeling van de combinatie met chemotherapie en immunotherapie dan op grond van predictieve markers gedacht. Een ander argument is dat van alle patiënten die als eerstelijnsbehandeling chemotherapie ontvangen meer dan de helft niet meer toekomt aan een vorm van tumorgerichte tweedelijns behandeling en dus ook niet aan de potentiële voordelen van immunotherapie (Davies, 2017; Lazzari, 2017). Desalniettemin is de bewijskracht voor toevoegen van immunotherapie aan de behandeling bij deze patiëntencategorie beperkt en is behandeling met chemotherapie alleen zeker ook een goede mogelijkheid die met patiënt besproken dient te worden.
Voor het plaveiselcellig NSCLC met een PD-L1 TPS <1% was er op het moment van afkappen van de literatuursearch voor deze richtlijn geen bewijs voor een klinische meerwaarde van het toevoegen van immunotherapie in welke vorm dan ook aan de standaardbehandeling met chemotherapie. Ook hier geldt dat de resultaten van de keynote 407 studie (Paz-Ares, 2018) niet meer in de systematische analyse meegenomen konden worden. Op grond van de eerder genoemde argumenten is de werkgroep van mening dat ook deze groep patiënten met een plaveiselcellig NSCLC bij voorkeur behandeld zouden moeten worden met de combinatie carboplatin plus paclitaxel en pembrolizumab.
Overall varieert de bewijskracht van de momenteel beschikbare data van moderate tot zeer laag, waarbij de GRADE-scores voor bewijskracht bij alle artikelen naar beneden moest worden aangepast. Dit gebeurde om meerdere redenen. Zie hiervoor de literature summary.
Voor de behandeling met pembrolizumab monotherapie bij patiënten met een niet-curabel NSCLC en een PD-L1 TPS ≥50% is de bewijskracht moderate. Hetzelfde geldt voor de patiënten met een niet-plaveiselcel NSCLC onafhankelijk van PD-L1 expressie. Voor alle andere beschreven behandelcombinaties zijn de GRADE-scores voor bewijskracht laag tot zeer laag.
In de groep patiënten met een PD-L1 TPS ≥50% is geen goede uitspraak te doen over welke behandeling leidt tot de beste uitkomst. Er is geen directe vergelijking van monotherapie pembrolizumab met een van beide immunotherapie-chemotherapie combinaties en deze combinaties zijn ook onderling niet direct vergeleken. Op grond van toxiciteitsprofiel en financiële impact geeft de werkgroep de voorkeur aan behandeling met pembrolizumab monotherapie. In specifieke casus en in overleg met de patiënt kan hiervan afgeweken worden en gekozen worden voor een van de combinaties met immunotherapie-chemotherapie.
In de subgroep van patiënten met een niet-plaveiselcellig NSCLC met een PD-L1 TPS van 1-49% is er weliswaar voldoende bewijs dat behandeling met een combinatie van immunotherapie-chemotherapie effectiever is dan platinumhoudende combinatiechemotherapie alleen, maar ook hier is geen directe vergelijking beschikbaar tussen de beide immunotherapie-chemotherapie regimes. Er is derhalve geen harde uitspraak te doen over welke combinatie de voorkeur zou moeten hebben.
De optimale behandelduur met immunotherapeutica bij NSCLC is niet bekend. In zowel de keynote 189 als de keynote 407 studie was de maintenance fase met pembrolizumab 2 jaar. In de IMpower 150 studie werden patiënten in de maintenance fase met atezolizumab/bevacizumab behandeld tot ziekteprogressie of niet-acceptabele toxiciteit. Er is niet onderzocht of kortere danwel langere behandeling (in het geval van de keynote studies) even effectief of beter zou zijn.
Immunotherapie kent een specifiek toxiciteitsprofiel. Voor de management van immunotherapie-gerelateerde toxiciteit verwijst de werkgroep naar de ESMO Clinical Practice Guideline Management of Toxicities from Immunotherapy.
Een ECOG performance score ≥2, belangrijke en actieve auto-immuunziekten, chronisch gebruik van immunosuppressie met een dosisequivalent van >10mg prednison/dag en onbehandelde of symptomatische hersenmetastasen golden als exclusiecriterium voor de geïncludeerde trials. Er is tot op heden geen gerandomiseerde data over deze patiëntengroepen beschikbaar.
Over de behandeling van patiënten met een ECOG performance score van 2 of hoger met immunotherapie als eerstelijnsbehandeling bij NSCLC is weinig data voor handen. Een ECOG performance score van 2 of hoger was een exclusiecriterium bij alle studies met immunotherapie of immuno-chemotherapie voor deze lijn van behandeling. Deels preliminaire data uit studies in de tweedelijns setting, onder andere de checkmate 153 en checkmate 171 studies (Popat, 2017; Spigel, 2017), tonen geen significant overlevingsvoordeel voor immunotherapie bij deze subgroep van patiënten. Bij deze patiënten is dan ook geen plaats voor eerstelijnsbehandeling met immunotherapie of immunotherapie-chemotherapie combinatie.
De werkgroep is van mening dat behandeling met chemotherapie dient te worden overwogen en/of besproken bij patiënten met een ECOG performance score van 2. De werkgroep is van mening dat bij een ECOG performance score van 3 of 4 best supportive care de behandeling van voorkeur is.
Ook patiënten met een onderliggende auto-immuunziekte werden in de meeste gevallen uitgesloten van deelname aan de trials met immunotherapie of combinatie immunotherapie-chemotherapie als eerstelijnsbehandeling. Over deze subgroep van patiënten is geen gerandomiseerde data voor handen. Retrospectieve case-series geven wel ondersteuning voor de aanname dat ook in een deel van deze subgroep patiënten behandeling met PD-L1of PD-L1 inhibitie veilig mogelijk kan zijn (Leonardi, 2018). De werkgroep is van mening dat voor deze patiënten individueel een afweging gemaakt zal moeten worden op grond van karakteristieken van patiënt, tumor en aard van de auto-immuunaandoening.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten en hun belangenverenigingen geven aan graag te worden behandeld door experts op het gebied van longkanker, bijvoorbeeld door longarts-oncologen. Zij geven hierbij aan dat er voor hen een groot belang wordt toegekend aan duidelijke voor hen begrijpelijke informatie over de te verwachten werking en de te verwachten bijwerkingen en belasting van de behandeling, zodat zij adequaat kunnen deelnemen aan de besluitvorming. Daarnaast geven zij aan dat toegankelijkheid en nabijheid van goede longoncologische zorg voor patiënten in alle regio’s belangrijk is. Dit geldt in sterkere mate voor ouderen en patiënten in minder goede conditie.
Kosten (middelenbeslag)
Immunotherapeutica zijn aanzienlijk duurder dan reguliere chemotherapeutica. Het exacte prijsniveau is echter niet inzichtelijk doordat deze middelen door de overheid aanvankelijk in “de sluis” geplaatst zijn en pas na het maken van geheime prijsafspraken zijn toegelaten tot de markt. De exacte impact op het geneesmiddelenbudget kan dus niet worden vastgesteld, maar vast staat dat deze impact hoog is. Vanuit medisch, politiek en maatschappelijk standpunt wordt het huidig prijsniveau echter acceptabel geacht in verhouding tot de effectiviteit van de behandeling. Een lagere prijs van de immunotherapeutica zou desondanks in alle opzichten zeer wenselijk en naar mening van de werkgroep zelfs noodzakelijk zijn, mede met het oog op de komende ontwikkelingen en het betaalbaar houden en borgen van een goede kwaliteit van de zorg in de nabije toekomst. Deze mening wordt gedeeld door de patiëntenvereniging.
Een adequate predictieve PD-L1 test is noodzakelijk voor een goede keuze van de optimale behandeling. De kosten van deze test liggen beduidend hoger dan diagnostische immuunhistochemie. Deze test wordt uitgevoerd bij alle patiënten met NSCLC die mogelijk voor behandeling met immunotherapie in aanmerking komen. In zijn totaliteit is hier een significante toename van kosten van de pathologische diagnostiek mee gemoeid. Hiervoor dient voldoende budget vrij gemaakt te worden.
Om de kosteneffectiviteit van immunotherapeutica in de huidige praktijk te optimaliseren zijn zowel het voorschrijven van een vaste dosering onafhankelijk van lichaamsgewicht, als verlenging van het toedieningsinterval onderzocht. Hierbij lijkt de farmacologische blootstelling bij een vaste dosering niet minder dan bij een dosering op grond van lichaamsgewicht en kan dit wel leiden tot een kostenreductie, o.a. door minder verspilling van medicatie (Hendrikx, 2017; Freshwater, 2017).
Aanvaardbaarheid voor de overige relevante stakeholders
Het inzetten van immunotherapeutica bij de eerstelijnsbehandeling van NSCLC betekent dat deze middelen aan grotere patiëntenaantallen verstrekt zullen worden. Dit zal in toenemende mate gelden als ook de data voor de patiënten met een plaveiselcelcarcinoom gunstig uitvallen. Gezien het huidige prijsniveau van deze middelen en de ontwikkelingen zowel binnen als buiten het indicatiegebied van het NSCLC zullen deze middelen in de nabije toekomst een zeer grote impact hebben op het totale geneesmiddelenbudget. De werkgroep verwacht dat er onherroepelijk een maatschappelijke discussie gevoerd zal moeten gaan worden over welk prijsniveau moreel gezien maatschappelijk te verantwoorden is en de ethische consequenties die hieruit voortvloeien.
Op dit moment gelden er aanvullende kwaliteitscriteria voor het voorschrijven van immunotherapie. Deze criteria dienen mede ter borging van de kwaliteit van zorg bij het gebruik van deze medicamenten. Deze borging vindt onder meer plaats door de zorg te organiseren binnen een (regionaal) netwerk, waar tenminste 1 immunotherapiecentrum in vertegenwoordigd is. Vanuit het patiënten perspectief van beschikbaarheid van zorg is het noodzakelijk om meer centra te creëren waar immunotherapie voor de eerstelijnsbehandeling van NSCLC gegeven kan worden, zodat voorkomen wordt dat de capaciteit in de bestaande centra niet toereikend zal zijn om alle patiënten te kunnen behandelen.
Vanuit de maatschappelijke tendens en professionele wens om de registratielast te verminderen is het naar mening van de werkgroep sterk te overwegen om de aanvullende eisen met betrekking tot registratie die rondom het gebruik van immunotherapie gelden strikt te beperken tot datgene wat bijdraagt aan het verbeteren van veiligheid en kwaliteit van zorg.
Haalbaarheid en implementatie
Voor implementatie van immunotherapie in de eerstelijnsbehandeling van NSCLC is op korte termijn uitbreiding van de behandelcapaciteit op alle niveaus een vereiste. Dit geldt à fortiori wanneer de indicatiegebieden worden uitgebreid, zoals op korte termijn verwacht wordt. Wanneer dit niet gebeurt kan de bereikbaarheid/toegankelijkheid van zorg voor de patiënten met incurabel NSCLC in het gedrang komen. Dit vergt uitbreiding en verbetering van de organisatie binnen de behandelende ziekenhuizen, maar ook een toenemende organisatiegraad binnen de huidige regio’s en netwerken en wellicht ook op landelijk niveau. Juiste zorg op het juiste moment op de juiste plek is hierbij essentieel. Om dit te bewerkstelligen zullen ook wijzigingen in de bekostiging/vergoeding gerealiseerd moeten worden (bijvoorbeeld DBC voor zelfde zorgproduct openen in verschillende ziekenhuizen).
Op de wat langere termijn zal de impact van de kosten van immunotherapie en de bijbehorende pathologische diagnostiek bij de oncologische zorg in zijn algemeenheid implementatie van deze middelen in de weg kunnen staan. Het is van belang dat hierover tijdig door alle betrokken partijen uit de zorg, overheid, patiëntenverenigingen, maatschappelijke organisaties, zorgverzekeraars en geneesmiddelenbedrijven wordt nagedacht over een structurele en voor alle partijen acceptabele oplossing.
De huidige registratieverplichtingen die gepaard gaan met de toestemming om behandeling met immunotherapeutica te mogen toepassen zouden ook de verdere implementatie van deze medicamenten kunnen vertragen en het is dan ook zaak deze belasting tot een minimum te beperken.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de beschikbare gerandomiseerde data met een matige tot lage bewijskracht is er voor specifieke patiëntengroepen met een niet curatief behandelbaar NSCLC een voordeel van behandeling met pembrolizumab alleen, een combinatie van platinum-pemetrexed-pembrolizumab, een combinatie van carboplatin-paclitaxel-bevacizumab-atezolizumab of een combinatie van carboplatin-paclitaxel-pembrolizumab ten opzichte van platinum-doublet chemotherapie of platinum-doublet chemotherapie gecombineerd met bevacizumab.
Voor pembrolizumab monotherapie wordt dit voordeel gezien bij de patiëntengroep met een tumor PD-L1 TPS ≥50%. Dit voordeel is onafhankelijk van histologisch subtype. Hiervoor is een positief advies afgegeven door de Commissie BOM.
Voor de combinatie platinum-pemetrexed-pembrolizumab is een voordeel aangetoond bij patiënten met een niet-plaveiselcel NSCLC in alle PD-L1 TPS subgroepen, waarbij het voordeel het grootst is in de groep met een PD-L1 TPS ≥50%. Voor deze combinatie is een positief advies afgegeven door de Commissie BOM.
Voor de combinatie carboplatin-paclitaxel-bevacizumab-atezolizumab is een voordeel in progressie vrije overleving aangetoond bij patiënten met een niet-plaveiselcel NSCLC in alle PD-L1 TPS subgroepen. Over deze combinatie is door de Commissie BOM nog geen advies uitgebracht.
Voor de combinatie carboplatin-paclitaxel-pembrolizumab is bij patiënten met een plaveiselcellig NSCLC een voordeel voor overall survival aangetoond in de subgroepen met een PD-L1 TPS <1% en 1-49% en een voordeel ten aanzien van de progressie vrije overleving voor alle PD-L1 subgroepen, dus ook de subgroep met een PD-L1 TPS ≥50%. Voor deze combinatie is een positief advies afgegeven door de Commissie BOM.
Voor de subgroep van patiënten met een PD-L1 TPS ≥50% is er bewijs van lage kwaliteit dat pembrolizumab monotherapie mogelijk gepaard gaat met minder treatment-related adverse events en een betere kwaliteit van leven dan behandeling met platinum-doublet chemotherapie.
Bij behandeling van deze subgroep met platinum-pemetrexed-pembrolizumab of met carboplatin-paclitaxel-bevacizumab-atezolizumab zijn de treatment related adverse events respectievelijk mogelijk vergelijkbaar en mogelijk toegenomen in vergelijking met de standaardbehandeling. Gegevens over kwaliteit van leven bij deze behandeling zijn niet beschikbaar.
Het is zeer aannemelijk dat de toxiciteit van behandeling met pembrolizumab monotherapie lager is dan de behandeling met de genoemde chemo-immunotherapie combinaties. Daarnaast is er sprake van lagere kosten.
De beschikbare data is kwetsbaar voor bias en verkregen in een geselecteerde patiëntengroep met een zeer goede performance, zonder (symptomatische) hersenmetastasen of actieve auto-immuunziekte en in vrijwel alle trials werden patiënten met tumoren met een activerende EGFR-mutatie en ALK-translocatie geëxcludeerd. Alleen in de studie van Socinski is een klein aantal patiënten met een activerende EGFR-mutatie en ALK-translocatie geïncludeerd bij wie geen behandelmogelijkheid met een TKI meer voor handen was.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Voor patiënten met een niet-curatief te behandelen NSCLC en een ECOG performance score ≥2 of actieve auto-immuunziekten is geen gerandomiseerde data beschikbaar die aantoont dat behandeling met immunotherapie als eerstelijnsbehandeling een meerwaarde heeft. Retrospectieve data tonen geen meerwaarde bij een ECOG performance score 2. Wel lijkt bij bepaalde auto-immuunziekten behandeling PD-L1 of PD-L1 inhibitoren veilig toegepast te kunnen worden.
Er kan geen uitspraak gedaan worden over de plaats van immunotherapie bij patiënten met niet-curatief te behandelen NSCLC en een ECOG performance score van 2 of actieve auto-immuunziekten.
Onderbouwing
Achtergrond
De huidige standaard eerstelijnsbehandeling voor patiënten met gemetastaseerd NSCLC zonder behandelbare oncogene drivermutatie is volgens de richtlijn NSCLC uit 2011 platinum-doublet chemotherapie. Inmiddels zijn er nieuwe ontwikkelingen op het gebied van immunotherapie, waaruit blijkt dat immunotherapie mogelijk superieur is ten opzichte van platinum-doublet chemotherapie bij tumoren met een PD-L1 expressie >50%. In de huidige zorgpraktijk worden deze patiënten nu al standaard behandeld met pembrolizumab. Mogelijk hebben ook andere patiënten baat bij behandeling met immunotherapie. Deze module zal de volgende klinische vraag bespreken: Welke patiënten moeten behandeld worden met immunotherapie, welke met chemotherapie en welke met een combinatie van beide.
Conclusies / Summary of Findings
Pembrolizumab versus platinum-doublet chemotherapy
|
Moderate GRADE |
Pembrolizumab results in a clinically relevant higher chance of overall survival compared to chemotherapy in patients with advanced non-small-cell lung cancer and a PD-L1 tumor proportion score ≥50%, independent of tumor histology.
References: (Reck, 2016) |
|
Moderate GRADE |
Pembrolizumab results in a clinically relevant longer progression free survival compared to chemotherapy in patients with advanced non-small-cell lung cancer and a PD-L1 tumor proportion score ≥50%, independent of tumor histology
References: (Reck, 2016) |
|
Moderate GRADE |
Pembrolizumab results in a clinically relevant increased response rate compared to chemotherapy in patients with advanced non-small-cell lung cancer and a PD-L1 tumor proportion score ≥50%, independent of tumor histology.
References: (Reck, 2016) |
|
Low GRADE |
Treatment with pembrolizumab possibly results in a better quality of life compared to treatment with chemotherapy in patients with advanced non-small-cell lung cancer and a PD-L1 tumor proportion score ≥50%.
Reference: (Brahmer, 2017) |
|
Low GRADE |
Pembrolizumab possibly results in less treatment-related adverse events compared with chemotherapy in patients with advanced non-small-cell lung cancer and a PD-L1 tumor proportion score ≥50%.
References: (Reck, 2016) |
Pembrolizumab with chemotherapy (platinum-pemetrexed) versus placebo with chemotherapy (platinum-pemetrexed)
|
Low GRADE |
Pembrolizumab with chemotherapy possibly results in a clinically relevant higher chance of overall survival compared to chemotherapy in patients with advanced nonsquamous non-small-cell lung cancer in all subcategories of PD-L1 expression.
Reference: (Gandhi, 2018; Langer, 2016) |
|
Moderate GRADE |
Pembrolizumab with chemotherapy results in a higher chance of progression free survival compared to chemotherapy alone in patients with advanced nonsquamous non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%.
Reference: (Gandhi, 2018; Langer, 2016) |
|
Moderate GRADE |
Pembrolizumab with chemotherapy results in an increased response rate compared to chemotherapy alone in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (Gandhi, 2018; Langer, 2016) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of pembrolizumab plus chemotherapy with chemotherapy alone in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (-) |
|
Low GRADE |
The safety (adverse events and toxicity) of pembrolizumab with chemotherapy is possibly comparable with chemotherapy alone in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (Gandhi, 2018; Langer, 2016) |
Ipilimumab plus chemotherapy (carboplatin/paclitaxel) versus chemotherapy (carboplatin/paclitaxel)
|
Low GRADE |
The overall survival of ipilimumab plus chemotherapy is possibly comparable with chemotherapy alone in patients with advanced squamous non-small-cell lung cancer.
References: (Govindan, 2017; Lynch, 2012) |
|
Low GRADE |
The progression free survival is possibly comparable for ipilimumab plus chemotherapy and chemotherapy in patients with advanced squamous non-small-cell lung cancer.
References: (Govindan, 2017; Lynch, 2012) |
|
Low GRADE |
The response rate of ipilimumab plus chemotherapy is possibly comparable with chemotherapy alone in patients with advanced squamous non-small-cell lung cancer.
References: (Govindan, 2017; Lynch, 2012) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of ipilimumab plus chemotherapy with chemotherapy in patients with advanced non-small-cell lung cancer.
References: (-) |
|
Very low GRADE |
We are uncertain about the safety (adverse events and toxicity) of ipilimumab with chemotherapy versus chemotherapy in patients with advanced non-small-cell lung cancer.
References: (Govindan, 2017; Lynch, 2012) |
Nivolumab versus platinum-based chemotherapy
|
Low GRADE |
The overall survival of nivolumab is possibly comparable with chemotherapy alone in patients with advanced non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%.
References: (Carbone, 2017; Hellmann, 2018) |
|
Very low GRADE |
We are uncertain about the progression free survival of nivolumab compared with chemotherapy in patients with advanced non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%.
References: (Carbone, 2017; Hellmann, 2018) |
|
Low GRADE |
The response rate of nivolumab is possibly comparable with chemotherapy alone in patients with advanced non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%.
Reference: (Carbone, 2017) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of nivolumab with chemotherapy in patients with advanced non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%.
References: (-) |
|
Moderate GRADE |
Nivolumab resulted in less treatment-related adverse events compared with chemotherapy in patients with advanced non-small-cell lung cancer and PD-L1 tumor proportion score ≥1%, but this difference was not clinically relevant.
References: (Carbone, 2017; Hellmann, 2018) |
Nivolumab plus ipilimumab versus platinum-doublet chemotherapy
|
- GRADE |
Because of a lack of data (not reported), it was not possible to compare the overall survival of nivolumab plus ipilimumab with chemotherapy.
References: (-) |
|
Very low GRADE |
We are uncertain whether nivolumab plus ipilimumab results in a higher progression free survival rate compared to chemotherapy in patients with advanced non-small-cell lung cancer, as well as in patients with high tumor mutational burden ≥10 mutations/Mb as in patients with a tumor mutational burden of <10 mutations/Mb.
Reference: (Hellmann, 2018) |
|
Very low GRADE |
We are uncertain whether nivolumab plus ipilimumab results in a higher response rate compared to chemotherapy in patients with advanced non-small-cell lung cancer and a high tumor mutational burden (>10 mutations/Mb).
Reference: (Hellmann, 2018) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of nivolumab plus ipilimumab with chemotherapy in patients with advanced non-small-cell lung cancer.
References: (-) |
|
Very low GRADE |
We are uncertain about the safety (adverse events and toxicity) of nivolumab with ipilimumab compared to chemotherapy in patients with advanced non-small-cell lung cancer.
Reference: (Hellmann, 2018) |
Atezolizumab, bevacizumab, carboplatin and paclitaxel (ABCP) versus bevacizumab, carboplatin and paclitaxel (BCP)
|
Low GRADE |
ABCP possibly results in a longer median overall survival and a higher chance of overall survival compared to BCP in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (Socinski, 2018) |
|
Low GRADE |
ABCP possibly results in a longer median overall survival and a higher chance of progression free survival compared to BCP in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (Socinski, 2018) |
|
Low GRADE |
ABCP possibly results in an increased response rate compared to BCP in patients with advanced nonsquamous non-small-cell lung cancer.
Reference: (Socinski, 2018) |
|
- GRADE |
Because of a lack of data, it was not possible to compare quality of life of ABCP with BCP in patients with advanced nonsquamous non-small-cell lung cancer.
References: (-) |
|
Low GRADE |
ABCP possibly results in more Grade 3 and 4 treatment-related adverse events compared to BCP in patients with advanced nonsquamous non-small-cell lung cancer but this difference was not clinically relevant. The incidence of any treatment-related adverse event is possibly comparable for the two treatment options.
Reference: (Socinski, 2018) |
Samenvatting literatuur
Description studies
A total of 9 articles of 8 studies were considered suitable to be included in this literature summary comparing different therapies. Two articles (Brahmer, 2017; Reck, 2016) reported different outcomes of the KEYNOTE-024 study. The included studies assessed the following immunotherapies; pembrolizumab (3 studies with a total of 1,047 patients), Ipilimumab (2 studies with a total of 1,160 patients), Nivolumab (2 studies with a total of 2,280 patients); atezolizumab (1 study with a total 1,200 patients of whom 800 patients are used fort his literature summary). One study (Hellmann, 2018) also assessed the effectivity and safety of Nivolumab plus Ipilimumab. Socinski (2018) randomised patients into 3 groups, but only reported results of 2 groups. See table 1 and evidence tables for details of the studies. All studies included patients of multiple hospitals across different countries. The length of follow-up varied between a median of 4.2 months and 24 months. Only patients with a baseline ECOG performance-status score 0 or 1 were included. All studies were designed and funded by the pharmaceutical industry and representatives of the funders contributed to various aspects of the study.
Table 1 Details of the included studies
|
Study |
Design |
Patients |
Intervention |
Control |
|
Reck, 2016
Brahmer, 2017 (KEYNOTE-024) |
Open label RCT, phase 3 |
305 stage IV NSCLC (squamous and nonsquamous) with a PD-L1 tumor proportion score of 50% or greater
|
Pembrolizumab |
Chemotherapy |
|
Langer, 2016 (KEYNOTE-021) |
Open label RCT, phase 2 |
123 stage IIIB or IV nonsquamous NSCLC |
Pembrolizumab plus chemotherapy |
Chemotherapy |
|
Ghandi, 2018 (KEYNOYE-189) |
Double-blind RCT, phase 3 |
616 metastatic nonsquamous NSCLC |
Pembrolizumab plus chemotherapy |
Placebo plus chemotherapy |
|
Govindan, 2017 |
Double-blind RCT, phase 3 |
956 recurrent or stage IV squamous NSCLC |
Ipilimumab plus chemotherapy |
Placebo plus chemotherapy |
|
Lynch, 2012 |
Double-blind RCT, phase 2 |
204 stage IIIB/IV or recurrent disease squamous or nonsquamous NSCLC |
1. Concurrent ipilimumab Regimen plus chemotherapy
2. Phased ipilimumab regimen plus chemotherapy |
Placebo plus chemotherapy |
|
Hellmann, 2018 (CHECKMATE-227) |
Open-label RCT, phase 3 |
1739 squamous or nonsquamous stage IV or recurrent NSCLC (only TMB-high subgroup reported) |
1. Nivolumab plus Ipilimumab
2. Nivolumab
3. Nivolumab plus chemotherapy |
Chemotherapy |
|
Carbone, 2017 (CHECKMATE-026) |
Open-label RCT, phase 3 |
541 squamous-cell or nonsquamous stage IV or recurrent NSCLC with PD-L1 TPS ≥1% |
Nivolumab |
Chemotherapy |
|
Socinski, 2018 (IMPower 150) |
Open-label RCT, phase 3 |
800 patients with metastatic nonsquamous non–small-cell lung cancer (NSCLC) who had a wild-type genotype (WT population; patients with EGFR or ALK genetic alterations were excluded in final analysis) |
Atezolizumab plus bevacizumab plus carboplatin plus paclitaxel |
Bevacizumab plus carboplatin plus paclitaxel |
Results
Pembrolizumab versus platinum-doublet chemotherapy
1. Overall survival (critical outcome)
One study compared pembrolizumab with chemotherapy versus chemotherapy and reported overall survival (Reck, 2016) in a total of 305 patients with squamous or nonsquamous NSCLC and an ECOG performance score of 0-1. Reck (2016) included only patients with a PD-L1 tumor proportion score of 50% or greater. The percentage of patients alive at 6 months was 80.2% in the pembrolizumab group versus 72.4% in the chemotherapy group. The median overall survival was not reached in either group. The hazard ratio (HR) for death was 0.60 (95% CI 0.41 to 0.89), meaning that patients in the pembrolizumab group had a higher chance of overall survival compared to patients in the chemotherapy group.
2. Progression free survival
Reck (2016) reported progression free survival in a total of 305 patients. The median progression free survival was 10.3 months in the pembrolizumab versus 6.0 months in the chemotherapy group in patients with a PD-L1 tumor proportion score of 50% or greater.
The pooled HR for progression or death was 0.50 (95% CI 0.37 to 0.68), meaning that patients in the pembrolizumab group had a higher chance of progression free survival compared to patients in the chemotherapy group.
3. Response rate
Reck (2016) reported the response rate according to Response Evaluation Criteria in Solid Tumors in a total of 305 patients. The response rate was 44.8% in the pembrolizumab group versus 27.8% in the chemotherapy group (RR 1.61; 95% CI 1.18 to 2.20).
4. Quality of life
One study (Brahmer, 2017) compared quality of life of 299 patients receiving either Pembrolizumab or chemotherapy using the Quality of Life Questionnaire Core 30 items (QLQ-C30) global health status (GHS)/ quality-of-life (QOL) score (scale from 0 (worst imaginable health) to 100 (best imaginable health). Least-squares mean baseline-to-week-15 change in QLQ-C30 GHS/QOL score was 6.9 (95% CI 3.3 to 10.6) for pembrolizumab and -0.9 (95% CI -4.8 to 3.0) for chemotherapy (difference in least-squares means 7.8 (95% CI 2.9 to 12.8), meaning that patients treated with pembrolizumab had a clinically meaningful improvement of health related quality of life compared to those treated with chemotherapy.
5. Safety (adverse events and toxicity)
Reck (2016) reported the adverse events in a total of 304 patients. 73.4% of the patients in the pembrolizumab versus 90.0% of the patients in the chemotherapy group had adverse events (RR 0.82; 95% CI 0.73 to 0.91). Serious adverse events occurred in 21.4% of the patients in the pembrolizumab group and in 20.7% of the patients in the chemotherapy group (RR 1.04; 95% CI 0.67 to 3.75). Grade 3, 4, or 5 treatment-related adverse events occurred in 26.6% of the patients in the pembrolizumab group versus 43.3% in the chemotherapy group (RR 0.50; 95% CI 0.37 to 2.51). Furthermore, a difference in type of adverse events in both treatment arms was observed. In the chemotherapy arm hematologic adverse events as well as nausea and vomiting were seen more frequently than in the pembrolizumab arm. In the pembrolizumab arm immune mediated adverse events like thyroiditis, pneumonitis and dermatitis were seen more frequently.
Level of evidence comparison pembrolizumab versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
The level of quality of evidence for the outcome overall survival was downgraded with 1 level from high to moderate because of imprecision (overlap with the border of clinical relevance and total number of patients <2000 per group).
The level of quality of evidence for the outcomes progression free survival and response rate was downgraded with 1 level from high to moderate because of imprecision of results (total number of patients <2000 per group).
The level of quality of evidence for the outcomes quality of life was downgraded with 2 levels from high to low because of limitations in the study design such as lack of blinding and imprecision of results (total number of patients <2000 per group).
The level of quality of evidence for the outcome adverse events was downgraded with 2 levels from high to low because of limitations in the study design such as lack of blinding (risk of bias) and imprecision (overlap with the border of clinical relevance and total number of patients <2000 per group).
Pembrolizumab with chemotherapy (platinum-pemetrexed) versus placebo with chemotherapy (platinum-pemetrexed)
1. Overall survival (critical outcome)
Two studies compared pembrolizumab with chemotherapy versus chemotherapy and reported overall survival (Ghandi, 2018; Langer, 2016) in a total of 739 nonsquamous NSCLC patients with an ECOG performance-status score of 0 to 1. The trial performed by Ghandi was phase III, the trial performed by Langer was phase II.
The proportion of patients who were alive at 12 months in the study of Ghandi (2018) was 69.2% in the pembrolizumab plus chemotherapy group and 49.4% in the chemotherapy group. The median overall survival was not reached in the pembrolizumab plus chemotherapy group and 11.3 months in the chemotherapy group. In the study of Langer (2016), 13 (22%) of 60 patients in the pembrolizumab plus chemotherapy group and 14 (22%) of 63 patients in the chemotherapy group had died at the time of data cutoff (median follow-up 10.6 months (IQR 8.2 to 13.3).
The pooled HR for death was 0.59 (95% CI 0.34 to 1.93), meaning that patients in the pembrolizumab plus chemotherapy group had a higher chance of overall survival compared to patients in the chemotherapy group (figure 1).
Figure 1 Overall survival pembrolizumab with chemotherapy versus chemotherapy

Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Ghandi (2018) reported that the benefit of the pembrolizumab combination regarding overall survival was observed in all subgroups of PD-L1 tumor proportion score, but the benefit was higher for those with a higher PD-L1 TPS (for Tumor Proportion Score); for those with a PD-L1 tumor proportion score of less than 1% the 12-month overall survival rate was 61.7% versus 52.2%; HR 0.59 (95% CI 0.38 to 0.92), for those with a PD-L1 TPS of 1 to 49% the 12-month overall survival rate was 71.5% versus 50.9%; HR 0.55 (95% CI 0.34 to 0.90), and for those with a PD-L1 TPS of 50% or greater the 12-month overall survival rate was 73.0% versus 48.1%; HR 0.42 (95% CI 0.26 to 0.68). Langer (2016) did not report results for PD-L1 subgroups.
2. Progression free survival
Two studies (Ghandi, 2018; Langer, 2016) reported the progression free survival in a total of 739 patients. Ghandi (2018) reported a median progression free survival of 8.8 months in the pembrolizumab plus chemotherapy group versus 4.9 months in the chemotherapy group. In the study of Langer (2016), the median progression free survival was 13.0 months in the Pembrolizumab plus chemotherapy group versus 8.9 months in the chemotherapy group.
The pooled HR for progression or death was 0.52 (95% CI 0.44 to 0.62), meaning that patients in the pembrolizumab plus chemotherapy group had a higher chance of progression free survival compared to patients in the chemotherapy group (figure 2).
Figure 2 Progression free survival (HR for progression or death) pembrolizumab with chemotherapy versus chemotherapy

Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Ghandi (2018) reported the HR for progression-free survival for different subgroups of PD-L1 tumor proportion score. The HR was 0.75 (95% CI 0.53 to 1.05) for patients with a PD-L1 tumor proportion score of less than 1% (median 6.1 months versus 5.1 months), HR 0.55 (95% CI 0.34 to 0.90) for patients with a score of 1 to 49%, and HR 0.42 (95% CI 0.26 to 0.68) for patients with a score of 50% or greater. Langer (2016) did not report results for PD-L1 subgroups.
3. Response rate
Two studies (Ghandi, 2018; Langer, 2016) reported the response rate according in a total of 701 patients. The response rate was 48.5% in the pembrolizumab group plus chemotherapy versus 21.7% in the chemotherapy group (RR 2.27; 95% CI 1.76 to 2.93) (figure 3).
Figure 3 Response rate pembrolizumab plus chemotherapy versus chemotherapy

Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Ghandi (2018) reported a higher response rate in the pembrolizumab combination group than in the chemotherapy group across all categories of PD-L1 tumor proportion score, with the greatest between-group difference in patients with a tumor proportion score of 50% or greater (61.4% versus 22.9%). The response rate in patients with a PD-L1 tumor proportion score of less than 1% was 32.3% versus 14.3% and in patients with a score of 1 to 49% 48.4% versus 20.7%.
In the study of Langer (2016), 12 of 21 patients who had a PD-L1 tumour proportion score of less than 1% achieved a response (response rate 57%) in the pembrolizumab combination group versus three of 23 patients (response rate 13%) in the chemotherapy alone group. Five (26%) of 19 patients who had a tumour proportion score of 1 to 49% and 16 (80%) of 20 patients who had a score of 50% or greater achieved an objective response in the the pembrolizumab plus chemotherapy versus 9 of 23 patients who had a score of 1 to 49% (39%) and 6 of 17 patients who had a score of 50% or greater (35%) in the chemotherapy alone group.
4. Quality of life
Ghandi (2018) and Langer (2016) did not report on quality of life.
5. Safety (adverse events and toxicity)
Two studies comparing pembrolizumab with chemotherapy reported adverse events (Ghandi, 2018; Langer, 2016) in a total of 728 patients. Langer (2016) reported the number of adverse events per grade, meaning that patients could have more than 1 adverse event in figure 4.
Ghandi (2018) reported adverse events in a total of 606 patients. 99.6% (404 of the 405) of the patients in the pembrolizumab plus chemotherapy versus 99.0% (200 of the 202) of the patients in the chemotherapy group had adverse events (RR 1.01; 95% CI 0.99 to 1.02). Grade 3, 4, or 5 treatment-related adverse events occurred in 67.2% (n=272) of the patients in the pembrolizumab group plus chemotherapy versus 65.8% (n=133) in the chemotherapy group (RR 1.02; 95% CI 0.90 to 1.15). In 6.7% (n=27) of the patients in the pembrolizumab group plus chemotherapy versus 5.9% (n=12) in the chemotherapy group the adverse event led to death.
99% adverse events occurred in the pembrolizumab combination group versus 97% in the chemotherapy group (RR 1.01; 95% CI 0.99 to 1.02). 63.6% grade 3, 4, or 5 treatment-related adverse events adverse events occurred in the pembrolizumab combination group versus 56.4% in the chemotherapy group (RR 1.14; 95% CI 0.80 to 1.63) (Ghandi, 2018; Langer, 2016), see figure 4.
Figure 4 Safety (adverse events and toxicity) pembrolizumab plus chemotherapy versus chemotherapy
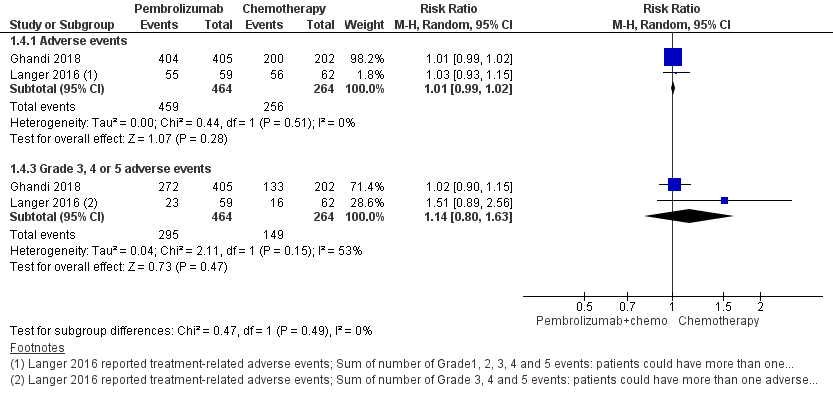
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Level of evidence comparison pembrolizumab with chemotherapy versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
The level of quality of evidence for the outcome overall survival was downgraded with 2 levels from high to low because of inconsistency (variance of point estimates across studies) and imprecision (overlap with the border of clinical relevance).
The level of quality of evidence for the outcomes progression free survival and response rate was downgraded with 1 level from high to moderate because of imprecision (total number of patients <2000 per group).
The level of quality of evidence for the outcome adverse events was downgraded with 2 levels from high to low because of inconsistency of results (variance of point estimates across studies) and imprecision (overlap with the border of clinical relevance).
As none of the included studies reported data on the quality of life, it was not possible to assess the level of evidence.
Ipilimumab with chemotherapy (carboplatin/paclitaxel) versus chemotherapy (carboplatin/paclitaxel)
1. Overall survival (critical outcome)
Two studies comparing ipilimumab with chemotherapy with chemotherapy alone reported overall survival (Govindan, 2017; Lynch, 2012) in a total of 953 patients with NSCLC and an ECOG performance-status score of 0 to 1. Lynch 2012) assessed the effect of a concurrent ipilimumab regimen with carboplatin/paclitaxel a phased ipilimumab regimen with carboplatin/paclitaxel and carboplatin/paclitaxel alone and included both squamous and nonsquamous NSCLC patients. Govindan (2017) only included squamous NSCLC patients who were randomly assigned 1:1 to receive carboplatin and paclitaxel plus blinded ipilimumab 10mg/kg or placebo every three weeks on a phased induction schedule. The patients with stable disease or better after induction treatment were treated with maintenance ipilimumab or placebo every 12 weeks.
Govindan (2017) reported the percentage alive at 1 year, which was 54% in the ipilimumab group versus 53% in the chemotherapy group and respectively 24% and 18% after 2 years. In the study of Lynch (2012), the median survival was 9.7 months in the concurrent ipilimumab group, 12.2 months in the phased ipilimumab group and 8.3 months in the chemotherapy group. The pooled HR for death was 0.91 (95% CI 0.79 to 1.06), favouring ipilimumab (figure 5) but the difference was not statistically significant.
Figure 5 Overall survival ipilimumab plus chemotherapy versus chemotherapy
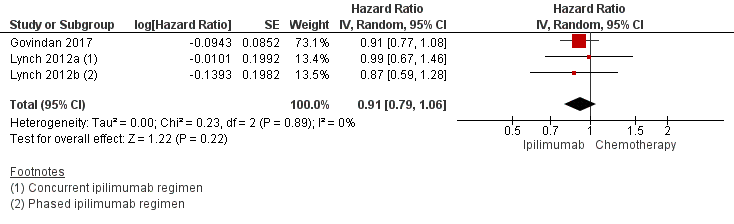
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
2. Progression-free survival
Two studies comparing ipilimumab plus chemotherapy with chemotherapy reported progression free survival (Govindan, 2017; Lynch, 2012) in a total of 953 patients. Govindan (2017) reported a median progression free survival of 5.6 months in both groups. In the study of Lynch (2012), the median progression free survival was 5.5 months in the concurrent ipilimumab group, 5.7 months in the phased ipilimumab group and 4.6 months in the chemotherapy group. The pooled HR for progression or death was 0.84 (95% CI 0.74 to 0.96), favouring ipilimumab (figure 6).
Figure 6 Progression free survival (HR for progression or death) ipilimumab plus chemotherapy versus chemotherapy
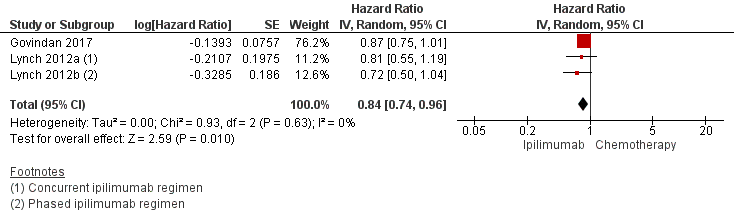
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
3. Response rate
Two studies comparing ipilimumab plus chemotherapy with chemotherapy reported the response rate (Govindan, 2017; Lynch, 2012) in a total of 953 patients. The response rate was 41.6% in the ipilimumab group versus 38.1% in the chemotherapy group (RR 1.67; 95% CI 0.70 to 4.01), favouring ipilimumab figure 7).
Figure 7 Response rate ipilimumab plus chemotherapy versus chemotherapy
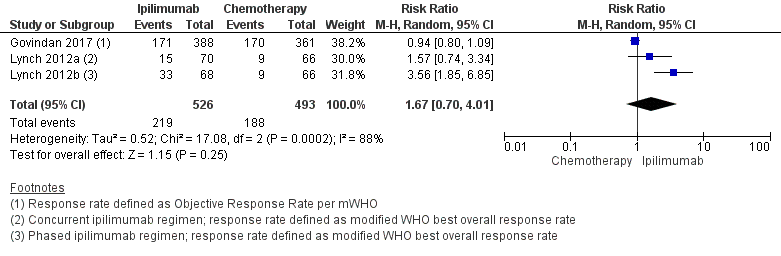
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
4. Quality of life
None of the included studies comparing ipilimumab plus chemotherapy with chemotherapy reported on quality of life.
5. Safety (adverse events and toxicity)
Two studies comparing ipilimumab plus chemotherapy with chemotherapy reported treatment-related adverse events (Govindan, 2017; Lynch, 2012) in a total of 952 patients. Approximately 95.4% of the patients in the ipilimumab group versus 92.1% of the patients in the chemotherapy group had adverse events (RR 1.10; 95% CI 1.03 to 1.17), favouring chemotherapy (figure 7), however Lynch, 2012 reported the number of Grade 1, 2, 3 and 4 events. Patients could have more than one adverse event thus the number of events was higher than the total number of patients. Grade 3, 4, or 5 treatment-related adverse events occurred in approximately 54.2% of the patients in the ipilimumab group versus 41.3% in the chemotherapy group (RR 1.18; 95% CI 0.89 to 1.56) (Govindan, 2017; Lynch, 2012), see figure 8. Seven treatment-related deaths occurred with chemotherapy plus ipilimumab, and one occurred with chemotherapy plus placebo.
Figure 8 Safety (adverse events and toxicity) ipilimumab plus chemotherapy versus chemotherapy
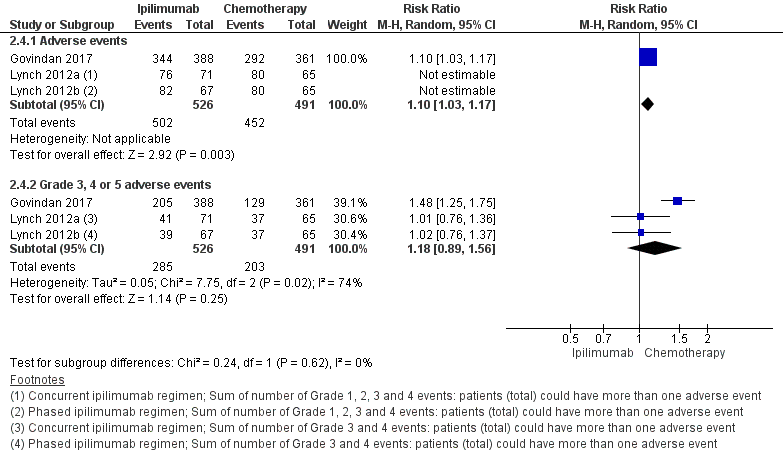
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Level of evidence comparison ipilimumab with chemotherapy versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
The level of quality of evidence for the outcome overall survival was downgraded with 2 levels from high to low because of limitations in the study design such as unclear allocation concealment, lack of blinding, violation of the intent to treat analysis and the involvement of the pharmaceutical industry (risk of bias) and imprecision (confidence interval crossing threshold for no difference).
The level of quality of evidence for the outcome measures progression free survival, response rate and safety (adverse events and toxicity) was downgraded with 3 levels from high to very low because of limitations in the study design such as unclear allocation concealment, lack of blinding, violation of the intent to treat analysis and the involvement of the pharmaceutical industry (risk of bias), inconsistency of results (variance of point estimates across studies) and imprecision (small number of patients or overlap with the border of clinical relevance).
As none of the included studies reported data on the quality of life, it was not possible to assess the level of evidence.
Nivolumab versus platinum-based chemotherapy
1. Overall survival (critical outcome)
One study compared nivolumab with chemotherapy and reported on overall survival (Carbone, 2017). 541 patients with squamous and non-squamous NSCLC, an ECOG performance-status score of 0 to 1 and a PD-L1 TPS ≥1% were randomly assigned to receive nivolumab or chemotherapy (1:1). The paper reported on overall survival in the group of patients with a PD-L1 TPS ≥5% (n=223). The percentage of patients with a PD-L1 expression level of ≥5% alive at 1 year was 56% in the nivolumab group versus 54% in the chemotherapy group. The median survival was 14.4 months and 13.2 months, respectively. The HR for death was 1.02 (95% CI 0.80 to 1.30), favouring chemotherapy. This was comparable with all randomised patients (median survival 13.3 months versus 13.8 months HR 1.07 (95% CI 0.86 to 1.33)). In an exploratory and not pre-specified subgroup analysis involving patients with a PD-L1 expression level of 50% or more, the HR for death was 0.90 (95% CI 0.63 to 1.29).
2. Progression free survival
Two studies comparing nivolumab with chemotherapy reported progression free survival (Carbone, 2017; Hellmann, 2018) in a total of 573 patients. Hellmann (2018) reported a median progression free survival in patients with Tumor Mutational Burden (TMB) ≥10 Mutations/Mb and ≥1% Tumor PD-L1 Expression (patients with a PD-L1 expression level of <1% were not eligible to receive nivolumab monotherapy) (n=71 in the nivolumab and n=79 in the chemotherapy group). The median progression free survival was 4.2 months in the nivolumab group versus 5.6 months in the chemotherapy group.
In the study of Carbone (2017), the median progression free survival in patients with a PD-L1 expression level of ≥5% was 4.2 months in the nivolumab group versus 5.9 months in the chemotherapy group. Similar results were found in all randomised patients (median progression free survival of 5.2 months in the nivolumab group versus 5.8 months in the chemotherapy group (HR 1.17 (95% CI 0.95 to 1.43)). In an exploratory subgroup analysis involving patients with a PD-L1 expression level of 50% or more, the HR for disease progression or death was 1.07 (95% CI 0.77 to 1.49).
The pooled HR for progression or death was 1.09 (95% CI 0.89 to 1.34), favouring chemotherapy (figure 9).
Figure 9 Progression free survival (HR for progression or death) nivolumab versus chemotherapy

Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
3. Response rate
One study (Carbone, 2017) compared nivolumab with chemotherapy and reported the response rate in a total of 223 patients with a PD-L1 expression level of 5%. The response rate was 26% in the nivolumab group versus 33% in the chemotherapy group (RR 0.74; 95% CI 0.54 to 1.00), favouring chemotherapy. In an exploratory subgroup analysis involving patients with a PD-L1 expression level of 50% or more, the response rate was 34% in the nivolumab group (n=88 patients) and 39% in the chemotherapy group (n=126 patients).
4. Quality of life
None of the included studies comparing nivolumab with or without chemotherapy versus chemotherapy reported on quality of life.
5. Safety (adverse events and toxicity)
Two studies comparing nivolumab with chemotherapy reported treatment-related adverse events (Carbone, 2017; Hellmann, 2018) in a total of 1,491 patients. The safety data in the study of Hellmann (2018) was exploratory. Approximately 67% of the patients in the nivolumab group versus 84% of the patients in the chemotherapy group had adverse events (RR 0.78; 95% CI 0.74 to 0.83), favouring nivolumab. Grade 3, 4, or 5 treatment-related adverse events occurred in approximately 18% of the patients in the nivolumab group versus 41% in the chemotherapy group (RR 0.43; 95% CI 0.29 to 0.64) (Carbone, 2017; Hellmann, 2018), see figure 10.
Figure 10 Safety (adverse events and toxicity) nivolumab versus chemotherapy
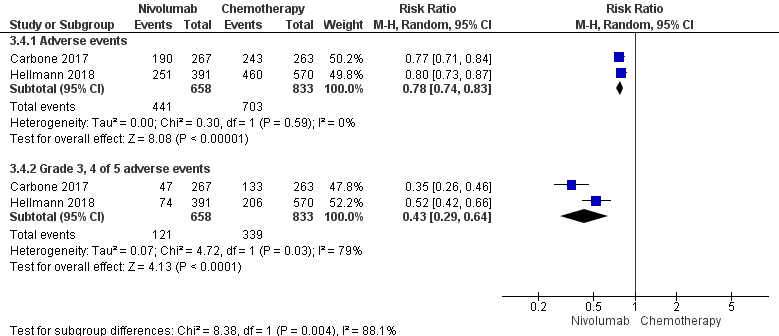
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Level of evidence comparison nivolumab versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
The level of quality of evidence for the outcome overall survival was downgraded with 2 levels from high to low because of limitations in the study design such as unclear allocation concealment and violation of the intent to treat analysis (risk of bias) and imprecision (confidence interval crossing threshold for no difference).
The level of quality of evidence for the outcome measures progression free survival and response rate was downgraded with 3 levels from high to very low because of limitations in the study design such as unclear allocation concealment, lack of blinding and violation of the intent to treat analysis (risk of bias), inconsistency of results (variance of point estimates across studies) and imprecision (confidence interval crossing threshold for no difference).
As none of the included studies reported data on the quality of life, it was not possible to assess the level of evidence.
The level of quality of evidence for the outcome safety (adverse events and toxicity) was downgraded with 1 level from high to moderate because of limitations in the study design such as unclear allocation concealment, lack of blinding and violation of the intent to treat analysis (risk of bias).
Nivolumab with ipilimumab versus platinum-doublet chemotherapy
1. Overall survival (critical outcome)
The included study (Hellmann, 2018) comparing nivolumab plus ipilimumab versus chemotherapy reported did not report overall survival. Although it was a co-primary endpoint in the study population that was selected based on PD-L1 expression, overall survival data was not mature at the time of publication of this manuscript.
2. Progression free survival
One study comparing nivolumab plus ipilimumab with chemotherapy reported progression free survival (Hellmann, 2018) in a total of 299 patients with squamous or nonsquamous NSCLC and an ECOG performance-status score of 0 to 1 selected on a tumor mutational burden (TMB) of ≥10 mutations/megabase. Hellmann (2018) reported a median progression free survival of 4.9 months in the nivolumab plus ipilimumab group versus 5.5 months in the chemotherapy group. The progression-free survival rate at 1 year was 30.9% in the nivolumab plus ipilimumab group versus 17% in the chemotherapy group. The HR for progression or death was 0.83 (95% CI 0.72 to 0.96), favouring nivolumab plus ipilimumab.
Patients with a high tumor mutational burden (TMB) (≥10 mutations per megabase) had a 1-year progression-free survival rate of 42.6% in the nivolumab plus ipilimumab versus 13.2% in the chemotherapy group, and the median progression-free survival was 7.2 months versus 5.5 months (HR, 0.58; 97.5% CI 0.41 to 0.81). Among patients with a low tumor mutational burden (<10 mutations per megabase), the median progression-free survival was 3.2 months with nivolumab plus ipilimumab and 5.5 months with chemotherapy (HR 1.07; 95% CI 0.84 to 1.35).
The study protocol was amended after enrolment of all patients had been completed (but before primary database lock) to include tumor mutational burden based efficacy analyses. Subgroup analysis among the in the initial protocol not pre-specified subgroup of patients with a high TMB according to PD-L1 status showed that progression-free survival was longer with nivolumab plus ipilimumab than with chemotherapy among patients with a PD-L1 expression level of at least 1% (HR for progression or death 0.62 (95% CI 0.44 to 0.88) and those with a level of less than 1% (HR 0.48 (95% CI 0.27 to 0.85).
3. Response rate
One study (Hellmann, 2018) compared nivolumab plus ipilimumab with chemotherapy and reported the response rate in a total of 299. In patients with a high TMB (≥10 mutations per megabase) the response rate was 45.3% in the nivolumab plus ipilimumab group versus 26.9% in the chemotherapy group (RR 1.69 95% CI 1.23 to 2.31), favouring nivolumab plus ipilimumab.
4. Quality of life
The included study comparing nivolumab plus ipilimumab versus chemotherapy did not report on quality of life.
5. Safety (adverse events and toxicity)
One study comparing nivolumab with chemotherapy reported treatment-related adverse events (Hellmann, 2018) in a total of 1,146 patients. Approximately 75% of the patients in the nivolumab plus ipilimumab group versus 81% of the patients in the chemotherapy group had adverse events (RR 0.93; 95% CI 0.88 to 0.99), favouring nivolumab plus ipilimumab. Grade 3, 4, or 5 treatment-related adverse events occurred in approximately 31% of the patients in the nivolumab group plus ipilimumab versus 36% in the chemotherapy group (RR 0.86; 95% CI 0.73 to 1.02) (Hellmann, 2018).
Level of evidence comparison nivolumab with Ipilimumab versus chemotherapy
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
As none of the included studies reported data on overall survival and quality of life, it was not possible to assess the level of evidence.
The level of quality of evidence for the other outcome measures was downgraded with 3 levels from high to very low, because of limitations in the study design such as lack of blinding, loss to follow-up and selective outcome reporting (risk of bias) and imprecision (limited number of patients ).
Atezolizumab, bevacizumab, carboplatin and paclitaxel (ABCP) versus bevacizumab, carboplatin and paclitaxel (BCP)
1. Overall survival
One study compared ABCP with BCP in a total of 800 nonsquamous NSCLC patients with an ECOG performance-status score of 0 to 1 (Socinski, 2018). After a protocol amendment the primary endpoint overall survival was reported in the 692 patients who had a wild-type genotype (WT population; patients with EGFR or ALK genetic alterations were excluded). The percentage of patients alive at 1 year was 67.3% of the 356 patients in the ABCP group versus 60.6% of the 336 patients in the BCP group. The median survival was 19.2 months and 14.7 months, respectively. The HR for death was 0.78 (95% CI 0.64 to 0.96), favouring ABCP.
2. Progression free survival
One study comparing ABCP with BCP reported progression free survival (Socinski, 2018) in a total of 692 patients in the WT population. The median progression free survival was 8.3 months om the ABCP group versus 6.8 months om the BCP group. The progression free survival rate at 1 year was 36.5% in the ABCP group versus 18.0% in the BCP group. The HR for progression or death was 0.62 (95% CI 0.52 to 0.74), favouring ABCP.
In the high expression of an effector T-cell gene signature (high Teff) WT population (n=284 patients) progression free survival was longer in the ABCP group than in the BCP group (median 11.3 months versus 6.8 months, HR 0.51 (95% CI 0.38 to 0.68). At 6 months, the rate of progression free survival was 71.7% in the ABCP group as compared with 57.0% in the BCP group; the corresponding rates at 12 months were 46.0% and 18.0%. In the subgroup of patients with low or negative PD-L1 expression (PD-L1 expression on <50% of tumor cells and <10% of tumor-infiltrating immune cells), progression-free survival was longer with ABCP than with BCP (median 8.0 months versus 6.8 months, HR 0.68 (95% CI 0.56 to 0.82). Progression free survival was also longer with ABCP in the subgroup with high PD-L1 expression (median 12.6 months versus 6.8 months, HR 0.39 (95% CI 0.25 to 0.60).
3. Response rate
One study (Socinski, 2018) compared ABCP with BCP and reported the response rate in a total of 692 patients in the WT population. The response rate was 63.5% in the ABCP group versus 48.0% in the BCP group (RR 1.32; 95% CI 1.16 to 1.52), favouring ABCP.
In the Teff-high WT population the response rate was 69.3% in the ABCP group (106 of the 153) versus 53.5% in the BCP group (68 of the 127) (RR 1.29 (95% CI 1.07 to 1.57).
4. Quality of life
The included studies comparing ABCP with BCP did not report on quality of life.
5. Safety (adverse events and toxicity)
One study comparing ABCP with BCP reported adverse events (Socinski, 2018) in a total of 787 patients (all patients). 94.4% of the 393 patients in the ABCP group versus 95.4% of the 394 patients in the BCP group had any treatment-related adverse events (RR 0.99; 95% CI 0.96 to 1.02). Grade 3 or 4 treatment-related adverse events occurred in 55.7% of the patients in the ABCP group versus 47.7% in the BCP group (RR 1.17; 95% CI 1.02 to 1.34), favouring BCP. Grade 5 treatment-related adverse events occurred in 2.8% of the patients in the ABCP group versus 2.3% in the BCP group.
Level of evidence comparison ABCP versus BCP
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
As none of the included studies reported data on the quality of life, it was not possible to assess the level of evidence.
The level of quality of evidence for the other outcome measures was downgraded with 2 levels from high to low, because of limitations in the study design such as unclear allocation concealment, lack of blinding and violation of the intent to treat analysis (risk of bias) and 1 level for imprecision (confidence intervals crossed the threshold for clinical relevance).
Summary of overall survival (critical outcome)
Figure 11 provides an overview of the critical outcome overall survival among different immunotherapies with or without chemotherapy.
Figure 11 Overall survival of different immunotherapies with or without chemotherapy versus chemotherapy
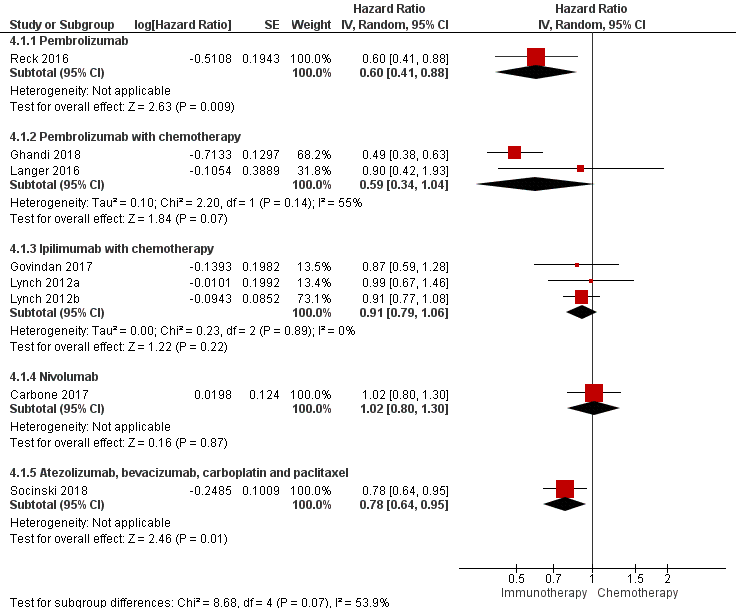
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Zoeken en selecteren
To answer our clinical question a systematic literature analysis was performed for the following research questions and accompanying PICO:
What is the effectivity and safety of first-line immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors (with or without chemotherapy) in patients with non–small-cell lung cancer stage IIIB/IV without sensitizing and druggable oncogene driver mutations compared to platinum-based doublet chemotherapy?
P (population) patients with non–small-cell lung cancer stage IIIB/IV without sensitizing oncogene driver mutations;
I (intervention) immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors (with or without chemotherapy);
C (comparison) platinum-based doublet chemotherapy;
O (outcome) overall survival, progression free survival, response rate, quality of life, safety;
Relevant outcome measures
The working group considered overall survival a critical outcome measure for the decision-making process; and progression free survival, response rate, quality of life, safety (adverse events and toxicity) important outcome measures for decision making.
The working group defined clinically relevant differences as follows:
Overall survival: Benefit >12 weeks or hazard ratio <0.7
Progression free survival: Benefit >12 weeks or hazard ratio <0.7
Adverse events and toxicity: lethal <5% (absolute difference), acute or severe <25%
Response rate: The working group had difficulty in determining what a clinically relevant response rate was. Until recently, single-agent chemotherapy was considered standard of care for patients with an adequate performance status, despite rendering responses in only 7.1 to 9.1% (Schvartsman, 2017).
Quality of life: The minimum important difference (MID) has been estimated to be a difference of 0.08 or more points for the EQ-5D utility index and seven or more points for the EQ-5D VAS (Pickard, 2007).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched from 1st of January 2005 up to 18th of July 2018 using relevant search terms for systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies (OBS). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 86 hits. Studies were selected based on the following criteria: systematic review or randomized trials including patients with non–small-cell lung cancer stage IIIB/IV without sensitizing oncogene driver mutations and comparing immunotherapy with PD-1-, PD-L1- and CTLA4-inhibitors (with or without chemotherapy) with chemotherapy. 43 studies were initially selected based on title and abstract. After reading the full text, 34 studies were excluded (see the table with reasons for exclusion under the tab Methods), and nine articles were definitely included in the literature summary. Important study characteristics and results are depicted in the evidence tables. The assessment of the risk of bias is depicted in the risk of bias tables.
Referenties
- 1 - Langer CJ, Gadgeel SM, Borghaei H, Papadimitrakopoulou VA, Patnaik A, Powell SF, Gentzler RD, Martins RG, Stevenson JP, Jalal SI, Panwalkar A, Yang JC, Gubens M, Sequist LV, Awad MM, Fiore J, Ge Y, Raftopoulos H, Gandhi L; KEYNOTE-021 investigators. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol. 2016 Nov;17(11):1497-1508. doi: 10.1016/S1470-2045(16)30498-3. Epub 2016 Oct 10. PubMed PMID: 27745820.
- 2 - Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, Gottfried M, Peled N, Tafreshi A, Cuffe S, O'Brien M, Rao S, Hotta K, Leiby MA, Lubiniecki GM, Shentu Y, Rangwala R, Brahmer JR; KEYNOTE-024 Investigators. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016 Nov 10;375(19):1823-1833. Epub 2016 Oct 8. PubMed PMID: 27718847.
- 3 - Carbone DP, Reck M, Paz-Ares L, Creelan B, Horn L, Steins M, Felip E, van den Heuvel MM, Ciuleanu TE, Badin F, Ready N, Hiltermann TJN, Nair S, Juergens R, Peters S, Minenza E, Wrangle JM, Rodriguez-Abreu D, Borghaei H, Blumenschein GR Jr, Villaruz LC, Havel L, Krejci J, Corral Jaime J, Chang H, Geese WJ, Bhagavatheeswaran P, Chen AC, Socinski MA; CheckMate 026 Investigators. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med. 2017 Jun 22;376(25):2415-2426. doi: 10.1056/NEJMoa1613493. PubMed PMID:28636851.
- 4 - Brahmer JR, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, Gottfried M, Peled N, Tafreshi A, Cuffe S, O'Brien M, Rao S, Hotta K, Zhang J, Lubiniecki GM, Deitz AC, Rangwala R, Reck M. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017 Dec;18(12): 1600-1609. doi:10.1016/S1470-2045(17)30690-3. Epub 2017 Nov 9. PubMed PMID: 29129441.
- 5 - Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F, Domine M, Clingan P, Hochmair MJ, Powell SF, Cheng SY, Bischoff HG, Peled N, Grossi F, Jennens RR, Reck M, Hui R, Garon EB, Boyer M, Rubio-Viqueira B, Novello S, Kurata T, Gray JE, Vida J, Wei Z, Yang J, Raftopoulos H, Pietanza MC, Garassino MC; KEYNOTE-189 Investigators. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018 May 31;378(22):2078-2092. doi: 10.1056/NEJMoa1801005. Epub 2018 Apr 16. PubMed PMID: 29658856.
- 6 - Freshwater T, Kondic A, Ahamadi M, Li CH, de Greef R, de Alwis D, Stone JA. Evaluation of dosing strategy for pembrolizumab for oncology indications. J Immunother Cancer. 2017 May 16;5:43. doi: 10.1186/s40425-017-0242-5. eCollection 2017. PubMed PMID: 28515943; PubMed Central PMCID: PMC5433037.
- 7 - Hellmann MD, Ciuleanu TE, Pluzanski A, Lee JS, Otterson GA, Audigier-Valette C, Minenza E, Linardou H, Burgers S, Salman P, Borghaei H, Ramalingam SS, Brahmer J, Reck M, O'Byrne KJ, Geese WJ, Green G, Chang H, Szustakowski J, Bhagavatheeswaran P, Healey D, Fu Y, Nathan F, Paz-Ares L. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. N Engl J Med. 2018 May 31;378(22):2093-2104. doi: 10.1056/NEJMoa1801946. Epub 2018 Apr 16. PubMed PMID: 29658845.
- 8 - Hendrikx JJMA, Haanen JBAG, Voest EE, Schellens JHM, Huitema ADR, Beijnen JH. Fixed Dosing of Monoclonal Antibodies in Oncology. Oncologist. 2017 Oct;22(10):1212-1221. doi: 10.1634/theoncologist.2017-0167. Epub 2017 Jul 28. Review. PubMed PMID: 28754722; PubMed Central PMCID: PMC5634778.
- 9 - Lynch TJ, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, Sebastian M, Neal J, Lu H, Cuillerot JM, Reck M. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol. 2012 Jun 10;30(17):2046-54. doi: 10.1200/JCO.2011.38.4032. Epub 2012 Apr 30. Erratum in: J Clin Oncol. 2012 Oct 10;30(29):3654. PubMed PMID: 22547592.
- 10 - Socinski MA, Jotte RM, Cappuzzo F, Orlandi F, Stroyakovskiy D, Nogami N, Rodríguez-Abreu D, Moro-Sibilot D, Thomas CA, Barlesi F, Finley G, Kelsch C, Lee A, Coleman S, Deng Y, Shen Y, Kowanetz M, Lopez-Chavez A, Sandler A, Reck M; IMpower150 Study Group. Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med. 2018 Jun 14;378(24):2288-2301. doi: 10.1056/NEJMoa1716948. Epub 2018 Jun 4. PubMed PMID: 29863955.
- 11 - Govindan R, Szczesna A, Ahn MJ, Schneider CP, Gonzalez Mella PF, Barlesi F, Han B, Ganea DE, Von Pawel J, Vladimirov V, Fadeeva N, Lee KH, Kurata T, Zhang L, Tamura T, Postmus PE, Jassem J, O'Byrne K, Kopit J, Li M, Tschaika M, Reck M. Phase III Trial of Ipilimumab Combined With Paclitaxel and Carboplatin in Advanced Squamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2017 Oct 20;35(30):3449-3457. doi: 10.1200/JCO.2016.71.7629. Epub 2017 Aug 30. PubMed PMID: 28854067.
- 12 - Schvartsman G, Peng SA, Bis G, Lee JJ, Benveniste MFK, Zhang J, Roarty EB, Lacerda L, Swisher S, Heymach JV, Fossella FV, William WN. Response rates to single-agent chemotherapy after exposure to immune checkpoint inhibitors in advanced non-small cell lung cancer. Lung Cancer. 2017 Oct;112:90-95. doi: 10.1016/j.lungcan.2017.07.034. Epub 2017 Aug 3. PubMed PMID: 29191606.
- 13 - Pickard AS, Neary MP, Cella D. Estimation of minimally important differences in EQ-5D utility and VAS scores in cancer. Health Qual Life Outcomes. 2007 Dec 21;5:70. Erratum in: Health Qual Life Outcomes. 2010;8:4. PubMed PMID: 18154669; PubMed Central PMCID: PMC2248572.
- 14 - Bigras G, Mairs S, Swanson PE, Morel D, Lai R, Izevbaye I. Small Biopsies Misclassify up to 35% of PD-L1 Assessments in Advanced Lung Non-Small Cell Lung Carcinomas. Appl Immunohistochem Mol Morphol. 2018 Nov/Dec;26(10):701-708. doi: 10.1097/PAI.0000000000000698. PubMed PMID: 30095468.
- 15 - Davies J, Patel M, Gridelli C, de Marinis F, Waterkamp D, McCusker ME. Real-world treatment patterns for patients receiving second-line and third-line treatment for advanced non-small cell lung cancer: A systematic review of recently published studies. PLoS One. 2017 Apr 14;12(4):e0175679. doi: 10.1371/journal.pone.0175679. eCollection 2017. Review. PubMed PMID: 28410405; PubMed Central PMCID: PMC5391942.
- 16 - Lazzari C, Bulotta A, Ducceschi M, Viganò MG, Brioschi E, Corti F, Gianni L, Gregorc V. Historical Evolution of Second-Line Therapy in Non-Small Cell Lung Cancer. Front Med (Lausanne). 2017 Jan 23;4:4. doi: 10.3389/fmed.2017.00004. eCollection 2017. Review. PubMed PMID: 28168189; PubMed Central PMCID: PMC5253463.
- 17 - Spigel D., Schwartzberg L., Waterhouse D., Chandler J., Hussein M., Jotte R., Stepanski E., McCleod M., Page R., Sen R., et al. Is Nivolumab Safe and Effective in Elderly and PS2 Patients with Non-Small Cell Lung Cancer (NSCLC)? Results of CheckMate 153. J. Thorac. Oncol. 2017;12:S1287–S1288. doi: 10.1016/j.jtho.2016.11.1821.
- 18 - Popat S., Ardizzoni A., Ciuleanu T., Cobo Dols M., Laktionov K., Szilasi M., Califano R., Carcereny Costa E., Griffiths R., Paz-Ares L., et al. Nivolumab in previously treated patients with metastatic squamous NSCLC: Results of a European single-arm, phase 2 trial (CheckMate 171) including patients aged >= 70 years and with poor performance status. Ann. Oncol. 2017;28:mdx380.006. doi: 10.1093/annonc/mdx380.006.
- 19 - Leonardi GC, Gainor JF, Altan M, Kravets S, Dahlberg SE, Gedmintas L, Azimi R, Rizvi H, Riess JW, Hellmann MD, Awad MM. Safety of Programmed Death-1 Pathway Inhibitors Among Patients With Non-Small-Cell Lung Cancer and Preexisting Autoimmune Disorders. J Clin Oncol. 2018 Jul 1;36(19):1905-1912. doi: 10.1200/JCO.2017.77.0305. Epub 2018 May 10. PubMed PMID: 29746230.
- 20 - Paz-Ares L, Luft A, Vicente D, Tafreshi A, Gümüş M, Mazières J, Hermes B, Çay Şenler F, Csőszi T, Fülöp A, Rodríguez-Cid J, Wilson J, Sugawara S, Kato T, Lee KH, Cheng Y, Novello S, Halmos B, Li X, Lubiniecki GM, Piperdi B, Kowalski DM; KEYNOTE-407 Investigators. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Nov 22;379(21):2040-2051. doi: 10.1056/NEJMoa1810865. Epub 2018 Sep 25. PubMed PMID: 30280635.
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Reck, 2016 and Brahmer, 2017 (KEYNOTE-024) |
Permuted block randomisation with a block size of four was done centrally using an interactive voice system and integrated web response system. The allocation sequence was generated by Clinical Schedule Generation System, a Merck & Co proprietary tool that provides for the automated generation and management of allocation schedules. Randomisation was stratified according to ECOG performance status (0 vs 1), tumour histology (squamous vs non-squamous), and region of enrolment (east Asia vs non-east Asia). |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Langer, 2016 (KEYNOTE-021) |
Using an interactive voice-response system, patients were randomly assigned (1:1) to treatment with pembrolizumab (Merck Sharp & Dohme Corp, a subsidiary of Merck & Co Inc, Whitehouse Station, NJ, USA) plus carboplatin and pemetrexed (Eli Lilly and Company, Indianapolis, IN, USA) or to carboplatin and pemetrexed alone. Randomisation was stratified by PD-L1 tumour proportion score (less than 1% vs 1% or greater), necessitating adequate tumour tissue for PD-L1. assessment. Treatment was allocated in blocks of four in each stratum via a schedule generated by Almac Clinical Technologies (Souderton, PA, USA) using a computerised randomised list generator. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Ghandi, 2018 |
Patients were randomly assigned, in a 2:1 ratio. Randomization was performed by means of an integrated interactive voice-response and Webresponse system (i.e., treatment assignments could be provided by following a series of prompts on a touch-tone phone or by following the same prompts in a Web-based portal). Randomization was stratified according to PD-L1 expression (tumour proportion score, ≥1% vs. <1%), choice of platinum-based drug (cisplatin vs. carboplatin), and smoking history (never vs. former or current). |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely, efficacy was assessed in the intention-to-treat population, which included all the patients who had undergone randomization. Safety was assessed in the as-treated population, which included all patients who had undergone randomization and received at least one dose of the assigned combination therapy. |
|
Govindan, 2017 |
Patients were randomly assigned (1:1) to receive blinded ipilimumab or placebo. Random assignment was stratified by ECOG PS (0 v 1), smoking status (heavy smokers (patients who smoked ≥ 10 pack-years) vs light smokers or nonsmokers (patients who did not meet the criteria to be classified as a heavy smoker)), sex, and region (North America or Western Europe v other). |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely, the original primary and secondary end points in the study were overall survival in the ITT and mITT populations, respectively; however, a pooled, blinded review of the initial data showed a higher than anticipated rate of discontinuation before the initiation of blinded therapy, making any ipilimumab effect difficult to detect in an ITT analysis. To measure the treatment effect of ipilimumab more accurately, the mITT analysis was made the primary analysis through a protocol amendment. |
|
Lynch, 2012 |
Patients were randomly assigned 1:1:1. Random assignment was stratified by tumour type and study site |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Hellmann, 2018
|
Patients with a PD-L1 expression level of at least 1% were randomly assigned (in a 1:1:1 ratio), with stratification according to tumour histologic type (squamous vs. nonsquamous Patients with a PD-L1 expression level of less than 1% were randomly assigned (in a 1:1:1 ratio), with stratification according to tumour histologic type.
|
Unlikely |
Likely |
Likely |
Likely |
Likely, given the recommendation of the data and safety monitoring committee to continue the trial for overall survival, analysis of the coprimary end point of overall survival among patients selected on the basis of the programmed death ligand 1 (PD-L1) expression level was not performed for the current database lock. |
Likely |
Unclear |
|
Carbone, 2017 |
Eligible patients were randomly assigned in a 1:1 ratio. Randomization was stratified according to PD-L1 expression level (<5% vs. ≥5%) and tumour histologic findings (squamous vs. nonsquamous). |
Unclear |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Socinski, 2018 |
Patients were randomly assigned, in a 1:1:1 ratio. Randomization was stratified according to sex, presence or absence of liver metastases at baseline, and PD-L1 tumour expression (as assessed by immunohistochemical analysis). |
Unclear |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Likely, a protocol amendment during the study changed the primary-analysis populations from the intention-to-treat population as a whole (which included both the WT population and patients with EGFR or ALK genomic alterations) and the population of patients with PD-L1 expression, as assessed by immunohistochemical analysis, to the WT population and the Teff-high WT population. The decision to exclude patients with EGFR or ALK genomic alterations from the primary analysis was based on data showing that with respect to progression-free and overall survival, the benefits of monotherapy with PD-L1 inhibitors or PD-L1inhibitors as second-line or later therapy were similar to the benefits with chemotherapy in these patients.
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Alfonso 2007 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Garcia Verdecia 2008 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Girouz 2017 |
Geen systematisch review of originele studie |
|
Ramos 2016 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Thatcher 2010 |
Geen systematisch review of originele studie |
|
Hellman 2017 |
Voldoet niet aan PICO: geen controlegroep met chemotherapie |
|
Jeanson 2017 |
Geen systematisch review of originele studie |
|
Neninger 2009 |
Vaccin |
|
Addeo 2017 |
Geen systematisch review of originele studie |
|
Alfonso 2014 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Assi 2018 |
Geen systematisch review of originele studie |
|
Britschgi 2017 |
Geen systematisch review of originele studie |
|
Forde 2018 |
Voldoet niet aan PICO: resectable early (stage I, II, or IIIA) NSCLC |
|
Mok 2016 |
Voldoet niet aan PICO: patients with advanced or metastatic (Stage IV) EGFR and ALK wild-type NSCLC |
|
Peters 2016 |
Voldoet niet aan PICO: patients with advanced or metastatic (Stage IV) EGFR and ALK wild-type NSCLC |
|
Peters 2016 |
Voldoet niet aan PICO: geen controlegroep met chemotherapie |
|
Quoix 2016 |
Vaccin |
|
Quoix 2016 |
Vaccin |
|
Tournoy 2016 |
Geen vergelijkende studie |
|
De Marinis 2018 |
Geen systematisch review of originele studie |
|
Ellis 2017 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Engel-Riedel 2018 |
Voldoet niet aan PICO: geen anti-PD1, anti-PDL1, anti-CTLA4 |
|
Giri 2016 |
Geen systematisch review of originele studie |
|
Hu 2014 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Khunger 2018 |
Voldoet niet aan PICO: vergelijking therapie als 1e lijn en 2e lijn |
|
Melosky 2018 |
Review van matige kwaliteit, zonder methodologische beoordeling; individuele studies zijn meegenomen |
|
Ostios-Garcia 2018 |
Geen vergelijkende studie |
|
Pabani 2018 |
Geen systematisch review of originele studie |
|
Passiglia 2018 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Ramlau 2008 |
Vaccin |
|
Rounds 2015 |
Voldoet niet aan PICO: geen eerstelijns behandeling |
|
Sgambato 2017 |
Geen systematisch review of originele studie |
|
Valecha 2017 |
Geen systematisch review of originele studie |
|
Xu 2018 |
Review pooled resultaten van observationele studies en RCTs zonder duidelijke methodologische beoordeling; individuele studies zijn meegenomen |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-09-2025
Beoordeeld op geldigheid : 24-01-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Immunotherapie bij de erstelijnsbehandelinng van niet-curatief te behandelen NSCLC |
NVALT |
2019 |
2020 |
Jaarlijks |
NVALT |
Wetenschappelijke ontwikkelingen |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. dr. A.F.T.M. Verhagen, cardio-thoracaal chirurg, Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel met gemelde belangen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingelheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patienten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van BMS (nivolumab) en Boehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Boehringer lngelheim) in 2016 financiële support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor AstraZeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt door geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator). |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (https://www.netwerk-path.nl/) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Bayer, Novartis, BMS, BioRad, Amgen, Illumina, Ageno BioSciences, Janssen Cilag (Johnson&Johnson), BioCartis (honoraria komen op een rekening op UMCG) Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, Illumina, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) betaald aan UMCG: Boehringer Ingelheim, Avenio/Roche/Cancer-ID, BMS (CA209-759), BioRad and Avenio - |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
geen |
getrouwd met praktijkhoudend huisarts |
geen |
|
Hofstede |
adviseur richtlijnontwikkeling |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. Longkanker Nederland heeft ook deelgenomen aan de Invitational conference. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longcarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Bij het vaststellen van welke verschil klinisch relevant is, heeft de werkgroep zich laten inspireren door de PASKWIL-criteria. De werkgroep is zich ervan bewust dat deze criteria zijn ontwikkeld voor de beoordeling van geneesmiddelen in de palliatieve setting en niet voor een curatieve setting.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
- Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS – voor observationeel onderzoek.
- QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2005 – 18 juli 2018
|
1 (non-small cell lung and (carcinoma* or neoplasm* or cancer*)).ti. or exp *Carcinoma, Non-Small-Cell Lung/ or nsclc.ti. (47495) 2 ((stage or cancer or nsclc) adj3 (iii* or '3' or iv or '4' or advanced or metastatic)).ti,ab,kw. (212531) 3 Immunotherapy/ or (immunotherap* or 'anti pd1' or 'anti pdl1' or 'anti ctla4' or nivolumab or ipilimumab or pembrolizumab or durvalumab or atezolizumab or ticilimumab or tremelimumab).ti,ab,kw. (72603) 4 (first-line or untreated).ti,ab,kw. (222701) 5 1 and 2 and 3 and 4 (104) 6 limit 5 to (english language and yr="2005 -Current") (96) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (360547) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1770514) 9 6 and 7 (12) 10 6 and 8 (55) 11 9 or 10 (55)
= 60 (58 uniek) |
86 |
|
Embase (Elsevier) |
('non small cell lung cancer'/exp/mj OR ('non-small cell lung':ti AND (carcinoma*:ti OR neoplasm*:ti OR cancer*:ti)) OR nsclc:ti)
AND ((stage OR cancer OR nsclc) NEAR/3 (iii* OR 3 OR iv OR 4 OR advanced OR metastatic)):ti,ab
AND ('cancer immunotherapy'/exp OR immunotherap*:ab,ti OR 'anti pd1':ab,ti OR 'anti pdl1':ab,ti OR 'anti ctla4':ab,ti OR 'nivolumab'/exp OR nivolumab:ab,ti OR 'ipilimumab'/exp OR ipilimumab:ab,ti OR 'pembrolizumab'/exp OR pembrolizumab:ab,ti OR 'durvalumab'/exp OR durvalumab:ab,ti OR 'atezolizumab'/exp OR atezolizumab:ab,ti OR 'ticilimumab'/exp OR ticilimumab:ab,ti OR tremelimumab:ab,ti)
AND ('first line':ab,ti OR untreated:ab,ti)
AND (2005-2018)/py AND (english)/lim NOT 'conference abstract':it)
= 63 (62 uniek) |

