Behandeling patiënten met activerende EGFR-mutatie bij NSCLC
Uitgangsvraag
Wat zijn de optimale systemische eerstelijnsbehandelingen en daarna voor gemetastaseerd NSCLC-patiënten met een activerende EGFR-mutatie?
Aanbeveling
Behandel patiënten in de eerste lijn met gemetastaseerd NSCLC met een exon(19)del of L858R-activerende EGFR mutatie met een EGFR TKI.
Overweeg behandeling met osimertinib (wanneer de sluisprocedure is afgerond en osimertinib wordt vergoed) in de eerste lijn bij gemetastaseerd NSCLC patiënten met een exon(19)del of L858R-activerende EGFR mutatie.
Overweeg behandeling met de volgende opties zolang osimertinib niet beschikbaar is:
- tweede generatie TKI;
- erlotinib-bevacizumab;
- eerste generatie TKI.
Vraag voor patiënten met een uncommon mutatie een behandeladvies aan de regionale Moleculaire Tumor Board en verwijs patiënten die in aanmerking komen voor targeted therapie naar een gespecialiseerd centrum (NVALT centrum voor zeldzame driver mutaties).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De cruciale uitkomstmaat was overall survival. Voor afatinib toonde de LUX-Lung 7 studie geen overlevingsvoordeel ten opzichte van gefitinib in de eerstelijnsbehandeling, evenwel, de powerberekening van deze studie was o.b.v. PFS en niet o.b.v. OS. Voor dacomitinib werd een statistisch en klinisch significant overlevingsvoordeel van ruim 7 maanden gezien ten opzichte van gefitinib, echter, dit werd alleen gezien in de eerstelijnsbehandeling bij patiënten die geen hersenmetastasen hadden bij aanvang van de behandeling. Voor osimertinib zijn er nog geen mature overlevingsdata van de eerstelijnsbehandeling. Een interim-analyse in 2018 toonde een HR voor OS van 0.63 (95% CI 0.45, 0.88 (p = 0.007), bij een 25% maturiteit, (Planchard ELCC 2018).
In meer dan de helft van de patiënten die behandeld worden met eerste- en tweedegeneratie EGFR-TKI’s ontstaat de secundaire resistentiemutatie T790M, die verantwoordelijk is voor ziekteprogressie. Omdat osimertinib ontwikkeld is om T790M te blokkeren, volgt de vraag of osimertinib alleen uiteindelijk tot een betere overleving leidt dan de combinatie van een eerste- of tweedegeneratie EGFR-TKI gevolgd door osimertinib in geselecteerde patiëntengroepen. Op basis van de huidige onderzoeken kunnen geen conclusies getrokken worden over welke volgorde van TKI’s de grootste overlevingswinst zal opleveren.
De levels of evidence voor de uitkomsten van de dacomitinib studies waren low grade en de afatinib en osimertinib studies moderate grade volgens de huidige systematiek van beoordeling.
De PFS in de eerstelijnsbehandeling was significant hoger voor afatinib, dacomitinib en osimertinib vergeleken met eerstegeneratie EGFR-TKI’s. In absolute aantallen werd de hoogste PFS gezien met osimertinib, namelijk 18.9 maanden. Het verschil met gefitinib was 8.7 maanden, dit verschil is niet eerder gezien met andere TKI’s en was aanleiding voor osimertinib om registratie aan te vragen voor eerstelijnsbehandeling.
De ORR was vergelijkbaar tussen eerstegeneratie-EGFR-TKI’s en dacomitinib en osimertinib. Alleen afatinib liet een hogere tumorrespons zien ten opzichte van gefitinib.
Er werd in de beoordeelde studies geen significante toename gezien van ernstige toxiciteit (graad 3 of hoger) tussen de eerste- en tweedegeneratie EGFR-TKI’s. Evenwel, de tweedegeneratie TKI’s zijn ontworpen om irreversibel te binden aan EGFR, maar ook aan meerdere andere receptoren van de ERB-familie (waartoe EGFR behoort). Het niet-gemuteerde EGFR wordt ook gebonden, weliswaar aan een lagere affiniteit. Dit maakt dat de bijwerkingen van afatinib en dacomitinib voor de aanbevolen dosis in het algemeen meer zijn dan van de eerstegeneratie EGFR-TKI’s. De tweedegeneratie EGFR-TKI’s adviseren dosisreductie om ernstige bijwerkingen tegen te gaan. Hiervoor zijn er formuleringen met lagere doseringen beschikbaar. Voor zowel afatinib als dacomitinib zijn er data die hun effectiviteit ondersteunen ondanks dosisreductie. Daarentegen is osimertinib ontworpen om alleen het gemuteerde EGFR en T790M te binden, het bindt dan ook niet het niet-gemuteerde EGFR. Als gevolg daarvan liet osimertinib minder bijwerkingen zien dan de eerste generatie EGFR-TKI’s.
Kwaliteit van leven werd onderzocht in de studies met afatinib en dacomitinib, hierbij werden geen significante verschillen gemeten. Voor osimertinib werd dit niet onderzocht.
Kosten (middelenbeslag)
In de eerstelijnsbehandeling is er voor nu alleen vergoeding voor erlotinib, gefitinib en afatinib. De kosten voor deze behandelingen zijn in dezelfde grootte orde. Voor dacomitinib is er nu nog geen vergoeding. Osimertinib wordt in de tweede lijn vergoed, de prijzen zijn niet beschikbaar. De vergoeding voor eerstelijnsbehandeling wordt binnenkort verwacht.
Omdat een predictieve EGFR test noodzakelijk is, dienen de kosten hiervoor ook meegenomen te worden. De kosten hiervan zijn lager dan van de EGFR tyrosinekinase remmers. Deze test wordt uitgevoerd bij alle ervoor in aanmerking komende patiënten, dus een grotere groep dan die behandeld worden. Binnen het ‘geneesmiddelenbudget’ dient een deel gereserveerd worden voor predictieve testen. Vanuit medisch, politiek en maatschappelijk standpunt wordt het huidig prijsniveau van de predictieve test acceptabel geacht in verhouding tot de effectiviteit van de behandeling.
Aanvaardbaarheid voor de overige relevante stakeholders
Op 26 juni 2018 is osimertinib in de ‘pakketsluis voor dure geneesmiddelen’ geplaatst omdat de toepassing van osimertinib, als eerstelijnsbehandeling, na opname in het verzekerde pakket gepaard zou gaan met grote financiële risico’s. Wanneer wordt uitgegaan van een ICER van €324.006 (bovengrens van ICER) dan zou de prijs van osimertinib ruim 55% moeten dalen om onder de referentiewaarde van €80.000 per QALY te vallen. Bij die prijsdaling komt de prijs van osimertinib in de buurt van de prijs van de standaardbehandeling. Dit meldt het Zorginstituut in haar brief van 7 november 2018 gericht aan de minister van Medische Zorg en Sport (Zorginstituut 2018).
Tevens meldt het Zorginstituut dat osimertinib alleen voldoet aan de ‘stand van de wetenschap en praktijk’ bij patiënten met een zogenoemde ex(19)del of L858R-activerende EGFR-mutatie. Voor de andere mutaties (uncommon) is op dit moment nog onvoldoende bewijs. Zij meldt dat ondanks dat gerandomiseerd onderzoek bij een dergelijk klein aantal patiënten niet haalbaar is, er eerst dient aangetoond te worden dat osimertinib werkzaam is bij deze mutaties. “Tegelijkertijd is het belangrijk dat voor deze patiënten toegang tot osimertinib bestaat, bij voorkeur in een onderzoeksetting. De fabrikant heeft kenbaar gemaakt dat voor patiënten met een mutatie in exon 20 (ongeveer 10% van de patiënten) een onderzoek loopt in vijf Nederlandse centra waarbinnen osimertinib gratis wordt verstrekt.” Het Zorginstituut adviseert om met de fabrikant aanvullende afspraken te maken met betrekking tot dit onderzoek, omdat het Zorginstituut van mening is dat bij het later beschikbaar komen van resultaten van onderzoek bij de uncommon mutaties de relevante veldpartijen kunnen beoordelen wanneer instroom in het verzekerde pakket van osimertinib voor de uncommon mutaties kan plaatsvinden. Behandeladviezen naar huidige mogelijkheden van de uncommon EGFR mutaties worden bij voorkeur besproken in de regionale Moleculaire Tumor Board en indien een targeted therapie overwogen wordt, verwezen naar een targeted therapy centrum (zie ook module Moleculaire tumor board NSCLC en module Behandeling patiënten met een zeldzame mutatie).
Haalbaarheid en implementatie
Voor de eerstelijnsbehandelingzijn er meerdere keuzes. Osimertinib is nu nog niet beschikbaar als eerstelijnsbehandeling maar wel voor de tweedelijnsbehandeling. Wanneer osimertinib uit de sluis komt, zullen er voor de haalbaarheid en implementatie geen bezwaren zijn om osimertinib te gebruiken in de eerstelijnsbehandeling. Dacomitinib is momenteel niet beschikbaar, het is al goedgekeurd door de EMA, en er zal een sluisprocedure volgen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Afatinib toonde een hogere tumorrespons en langere PFS (moderate grade), ten koste van meer toxiciteit. Afatinib kon geen overlevingsvoordeel laten zien, evenwel, de betreffende studie was niet gepowerd voor OS. Dacomitinib toonde wel een overlevingsvoordeel en hogere PFS bij patiënten zonder hersenmetastasen, ten koste van meer toxiciteit (low grade). Osimertinib toonde een verdubbeling van de PFS met significant minder toxiciteit (moderate grade). De overlevingsdata is nog immatuur op dit moment. Op basis van bovenstaande is er geen duidelijke voorkeur voor de tweedegeneratie EGFR-TKI’s. Osimertinib heeft de voorkeur tov de eerste generatie EGFR-TKI.
Subgroepen
De bovenstaande overwegingen gelden voor patiënten met een EGFR exon19del en L858R, dit is het overgrote deel van de EGFR-mutatie positieve patiëntenpopulatie. Er is een subgroep van patiënten met een ongewone (“uncommon”) activerende EGFR-mutatie die anders zijn dan de klassieke exon19del en L858R. Op deze uncommon subgroep hebben de overwegingen geen betrekking omdat de ongewone mutaties niet waren meegenomen in de geselecteerde studies. Echter, er zijn met de huidige literatuur-search geen vergelijkende studies gevonden die behandelingen bij de ongewone mutaties hebben onderzocht.
Daarom kunnen er geen uitspraken gedaan worden over de keuze van behandeling in het geval van uncommon EGFR-mutaties. Deze patiënten worden bij voorkeur besproken in de regionale Moleculaire Tumor Board en indien een targeted therapie overwogen wordt, verwezen naar een targeted therapy centrum.
Voor afatinib werd o.b.v. een post-hoc analyse verzamelde data uit de LUX-Lung 2, 3 en 6 tumorrespons aangetoond voor de volgende ongewone activerende EGFR-mutatie: G719X, L861Q and S768I. De FDA heeft daarom de indicatie van afatinib uitgebreid tot deze ongewone mutaties. (FDA 2018)).
Voor het opbouwen van kennis rondom deze ongewone EGFR-mutaties en om patiënten toegang te geven tot experimentele behandelopties dienen dergelijke zeldzame mutaties te worden voorgelegd aan de regionale Moleculaire Tumor Board.
Behandelopties voor eerstelijnsbehandeling die niet werden opgenomen in de huidige zoekvraag
EGFR-TKI werden gecombineerd met angiogeneseremmers. Een Japanse gerandomiseerde fase II-studie vergeleek de combinatie van erlotinib en bevacizumab met alleen erlotinib als eerstelijnsbehandeling (Seto 2014, Yamamoto 2018). Seto (2014) rapporteerde een mediane PFS van 16,4 en 9,8 maanden (HR 0.52, 95% CI 0.35-0.76), respectievelijk. Echter, er werd geen significant verschil gezien in OS tussen deze behandelingen (OS: 47 versus 47.4 maanden). Een Europese fase II-studie die ook de combinatie van erlotinib en bevacizumab bestudeerde liet een vergelijkbare PFS zien (Rosell 2017). Een fase III-onderzoek (Furuya 2018, NEJ026) waarin de combinatie van bevacizumab en erlotinib werd vergeleken met erlotinib toonde bemoedigende data uit de interim analyse met aanzienlijk voordeel op PFS (16.9 versus 13.3 maanden, HR 0.60, 95% CI 0.41-0.87); de overlevingsresultaten zijn nog niet bekend. De EMA heeft het gebruik van de combinatie van erlotinib en bevacizumab goedgekeurd, zo ook de CieBOM. Daarom is de combinatie erlotinib en bevacizumab een eerstelijns behandeloptie in patiënten met EGFR-gemuteerde tumoren.
Een andere strategie die momenteel bestudeerd wordt als eerstelijnsbehandeling is het combineren van chemotherapie en een EGFR-TKI. De NEJ009-studie (Nakamura 2018) was de eerste fase III-studie die de combinatie van gefitinib en platinum doublet chemotherapie (carboplatin/pemetrexed) onderzocht. Carboplatin/pemetrexed/gefitinib toonde een significant betere PFS (20.9 versus 11.2 maanden, HR 0.49, 95% CI 0.39-0.62) en OS (52.2 versus 38.8 maanden, HR 0.69, 95% CI 0.52-0.92) vergeleken met gefitinib alleen als eerstelijnsbehandeling. Er is geen EMA-goedkeuring voor deze combinatie.
Nog een strategie die nu prospectief bestudeerd wordt is het sequentieel toepassen van een eerste of tweede generatie TKI gevolgd door osimertinib bij resistentie met ontwikkelen van een T790M resistentiemutatie. De gedachte is dat wanneer osimertinib wordt toegepast als eerstelijnsbehandeling, er bij progressie geen TKI-opties meer overblijven. Terwijl osimertinib in de tweede lijn nog een optie is bij meer dan de helft van de patiënten die als eerstelijnsbehandeling een eerste of tweede generatie TKI ontvangen. Er zijn op dit moment geen prospectieve data beschikbaar met deze sequentiële aanpak.
Onderbouwing
Achtergrond
Sinds 2009 hebben meerdere trials, zoals de IPASS-trial en vele andere trials daarna, laten zien dat tyrosinekinaseremmers (TKIs) gericht tegen EGFR een betere tumorrespons geven in non-small cell lung cancer (NSCLC) patiënten met een activerende EGFR-mutatie in vergelijking met chemotherapie. Deze verbetering in overall response rate (ORR) en progression free survival (PFS) werd gezien ongeacht leeftijd, geslacht, rookstatus en performance status (PS). De eerste generatie EGFR-TKI konden geen voordeel in overall survival (OS) aantonen boven platina gebaseerde chemotherapie, waarschijnlijk als gevolg van cross-over. EGFR-TKI’s zijn de behandeling van keuze als eerstelijnsbehandeling voor het gemetastaseerd EGFR-gemuteerd NSCLC. Patiënten met PS 3 tot 4 kunnen ook met een eerste generatie EGFR-TKI worden behandeld, hierbij kan een klinisch voordeel worden verwacht, te vergelijken met patiënten met een goede PS (Inoue 2009). Patiënten die baat hebben gehad van een behandeling met een eerste generatie EGFR-TKI kunnen doorgaan met deze behandeling ondanks langzame radiologische progressie, zolang ze klinisch stabiel blijven (Park 2016a).
De ontwikkelingen binnen de EGFR-TKIs gaan razendsnel, er zijn al drie generaties EGFR-TKI beschikbaar en de vierde generatie is in ontwikkeling. Momenteel zijn er als eerstelijnsbehandeling eerste generatie EGFR-TKI's (erlotinib en gefitinib) en een tweedegeneratie EGFR-TKI (afatinib) beschikbaar. Dacomitinib, een tweedegeneratie EGFR-TKI, kan ook ingezet worden als eerstelijnsbehandeling, echter, deze wordt op dit moment nog niet vergoed in Nederland (oktober 2019). De derde generatie TKI osimertinib wordt momenteel alleen vergoed in de tweede lijn bij patiënten met de secundaire resistentiemutatie T790M, maar wordt binnenkort verwacht beschikbaar te zijn als eerstelijnsbehandeling. Dankzij de ontwikkelingen binnen de tweede- en derde generatie EGFR-TKI’s komen er steeds meer keuzemogelijkheden voor de eerstelijnsbehandeling. Wat zijn de verschillen in termen van overall survival, progression free survival, responskans, kwaliteit van leven en veiligheid? Deze module is bedoeld om de verschillende TKI’s te vergelijken op deze punten en te adviseren in de keuze van de eerstelijnsbehandeling met nadruk op de vergelijking tussen eerste generatie en latere- generatie EGFR-TKI’s.
Conclusies
Dacomitinib
|
LOW GRADE |
Treatment with dacomitinib as first line treatment might result in a better overall survival as compared to treatment with gefitinib in patients with non–small-cell lung cancer stage IIIB/IV and an EGFR mutation (HR=0.76, 95%CI 0.58 to 0.99). Treatment with dacomitinib as second line treatment might result in a comparable overall survival as compared to treatment with a 1st generation EGFR-TKI (HR=0.896, 95%CI 0.60 to 1.54)
References: (Ramalingam, 2016; Mok, 2018) |
|
LOW GRADE |
Treatment with dacomitinib as first line treatment might result in a lower risk of progression as compared to treatment with gefitinib in patients with non–small-cell lung cancer stage IIIB/IV and a EGFR mutation (HR=0.59; 95%CI 0.47 to 0.74).Treatment with dacomitinib as second line treatment might result in a comparable risk of progression as compared to treatment with a 1st generation EGFR-TKI (HR=0.81, 95%CI 0.54 to 1.23).
References: (Ramalingam, 2016; Wu, 2017; Mok, 2018) |
|
LOW GRADE |
The response rate is probably comparable in patients treated with dacomitinib as compared to patients treated with a 1st generation EGFR-TKI.
References: (Ramalingam, 2016; Wu, 2017; Mok, 2018) |
|
LOW GRADE |
The risk of severe adverse events is probably comparable in patients treated with dacomitinib as compared to patients treated with a 1st generation EGFR-TKI (absolute risk difference =0.05, 95%CI -0.03 to 0.13)
References: (Wu, 2017) |
|
LOW GRADE |
The change in patients’ quality of life is probably comparable in patients treated dacomitinib and patients treated with a 1st generation EGFR-TKI.
References: (Wu, 2017) |
Osimertinib
|
MODERATE GRADE |
The risk of death seems lower in patients treated with osimertinib as compared to treatment with a 1st generation EGFR-TKI. However, the follow up was too short to determine the median overall survival in both groups. References: (Soria, 2018) |
|
MODERATE GRADE |
Treatment with osimertinib results in a lower risk of progression as compared to a treatment 1st generation EGFR-TKI in patients with non–small-cell lung cancer stage IIIB/IV and a EGFR mutation (HR= 0.46 (0.37 to 0.57)).
References:Soria 2018 |
|
MODERATE GRADE |
In patients with non–small-cell lung cancer stage IIIB/IV and an EGFR mutation treatment with osimertinib results in a comparable objective response rate as compare to treatment with a 1st generation EGFR-TKI (absolute difference 0.04, 95%CI -0.03 to 0.11; NNT=25).
References: (Soria, 2018) |
|
MODERATE GRADE |
In patients with non–small-cell lung cancer stage IIIB/IV and an EGFR mutation and treated with osimertinib the risk of severe adverse events was slightly lower as compared to patients treated with a 1st generation EGFR-TKI (absolute risk difference -0.11, 95%CI -0.19 to -0.03; NNH=9).
References: (Soria, 2018) |
|
- GRADE |
No data were reported on patients’ quality of life after treatment with osimertinib. |
Afatinib
|
MODERATE GRADE |
Treatment with afatinib results in a comparable risk of death (overall survival) as compared to treatment with gefitinib EGFR-TKI in patients with non–small-cell lung cancer stage IIIB/IV and a EGFR mutation (HR=0.86, 95%CI 0.66 to 1.12).
References: (Paz-Ares, 2017) |
|
MODERATE GRADE |
Treatment with afatinib results in a reduction in the risk of progression (progression free survival) as compared to treatment with gefitinib (HR=0.74, 95%CI 0.57 to 0.96).
References: (Paz-Ares, 2017) |
|
MODERATE GRADE |
In patients treated with afatinib, the objective response rate was higher as compared to patients treated with gefitinib (73% versus 56%, absolute difference 0.17, 95%CI 0.06 to 0.27; NNT=6)
References: (Paz-Ares, 2017) |
|
LOW GRADE |
The risk of severe adverse events might be comparable in patients treated with afatinib as compared to patients treated with gefitinib EGFR-TKI (absolute risk difference 0.03, 95%CI -0.07 to 0.14).
References: (Paz-Ares, 2017) |
|
LOW GRADE |
The post-baseline adjusted mean score for quality of life might be comparable during treatment with afatinib compared to treatment with gefitinib in patients with non–small-cell lung cancer stage IIIB/IV and an EGFR mutation treatment.
References: (Park, 2016b) |
Samenvatting literatuur
A total of seven publications that examined the clinical outcome after second or third generation TKIs in NSCLC patient with a EGFR mutation were included in this literature review.
Description of studies
Table 1 Details of the included studies
|
Study |
Patients and previous treatments |
Intervention |
Control |
|
Ramalingam (2012, 2016) |
advanced NSCLC and progression after one or two prior chemotherapy regimens. Patients with known leptomeningeal or symptomatic brain metastases were excluded; EGFR mutation in exon 19 or 21 |
dacomitinib |
erlotinib |
|
ARCHER 1050 (Wu 2017, Mok 2018) |
newly diagnosed advanced NSCLC or recurrent NSCLC (minimum 12 months disease-free) and an EGFR mutation (exon 19 deletion or L858R), no brain metastases included |
dacomitinib |
gefitinib |
|
FLAURA trial (Soria 2018) |
treatment naïve patients with locally advanced or metastatic NSCLC and an EGFR mutation (exon 19 deletion or L858R). 21% of the patients had CNS metastases. |
osimertinib |
gefitinib or erlotinib |
|
LUX-Lung 7 (Park 2016b, Paz-Ares 2017) |
treatment naïve patients with stage IIIB or IV adenocarcinoma and an EGFR mutation (exon 19 deletion or L858R). 15% of the patients had brain metastases . |
afatinib |
gefitinib |
Four studies were included that reported on the effectiveness of dacomitinib (Ramalingam, 2012; Ramalingam, 2016; Wu, 2017; Mok, 2018). Ramalingam (2012, 2016) reported the results of trials in which dacomitinib (45 mg daily) was compared with erlotinib (150 mg daily) in patients with advanced NSCLC and progression after one or two prior chemotherapy regimens. Patients with known leptomeningeal or symptomatic brain metastases were excluded. Ramalingam (2016) reported the results of a pooled analysis of a subset of two RCT’s. These subsets consisted of patients with EGFR mutant NSCLC (mutation in exon 19 or 21) and included the results reported in the publication in 2012. The median duration of treatment was 11 months for dacomitinib and 9.6 months for erlotinib. Outcome measures were progression free survival, overall survival and objective response rate.
Wu (2017) and Mok (2018) reported the results of the ARCHER 1050 study, an open-label RCT in which dacomitinib (45 mg daily) was compared to gefitinib (250 mg daily). Patients were eligible if they had newly diagnosed advanced NSCLC or recurrent NSCLC (minimum 12 months disease-free) and an EGFR mutation (exon 19 deletion or L858R). Patients with brain metastases were excluded. 227 patients were treated with dacomitinib and 225 patients were treated with gefitinib. Wu (2017) reported on the progression free survival, objective response rate and number of patients with serious adverse events. At that time, the median duration of treatment was 15.3 months in the dacomitinib group and 12.0 months in the gefitinib group. The median duration of follow up was 22.1 months. Mok (2018) reported the results of the overall survival after a median follow up period of 31.3 months.
Soria (2018) compared osimertinib and first-generation EGFR-TKI in 556 treatment naïve patients with locally advanced or metastatic NSCLC and an EGFR mutation (FLAURA trial). The FLAURA trial was a double blind RCT carried out in 132 sites in 29 countries. In the control group, patients received gefitinib (250 mg daily) or erlotinib (150 mg daily). The median duration of treatment was 16.2 months (range 0.1 to 27.4) for patients receiving osimertinib and 11.5 months (range, 0 to 26.2) for those receiving a standard EGFR-TKI. Outcome measures were progression free survival, overall survival, objective response rate, number of patients with severe adverse events (grade 3 or more), and the number of fatal adverse events.
Park (2016b) and Paz-Ares (2017) reported the results of LUX-Lung 7 trial. In this open-label RCT, treatment with afatinib (40 mg orally once daily) was compared with gefitinib (250 mg daily) in treatment naïve patients with stage IIB or IV adenocarcinoma and a EGFR mutation (exon 19 deletion or L858R). 160 patients received afatinib and 159 patients received gefitinib. Park (2016b) reported the result of the primary analysis. At that time, the median duration of follow for the progression free survival (PFS) was 27.3 months (interquartile range 15.3 to 33.9). The outcome measures were progression free survival, objective response rate, severe adverse events (grade 3 or higher), and quality of life. The overall survival data were immature at that time. Paz-Ares (2017) reported the overall survival data of the LUX-Lung 7 trial. At that time, the median follow up was 42.6 months. The median duration of treatment was 13.7 months (range 0 to 6.4) with afatinib and 11.5 months (range 0.5 to 8.7) with gefitinib.
Study results
Overall survival
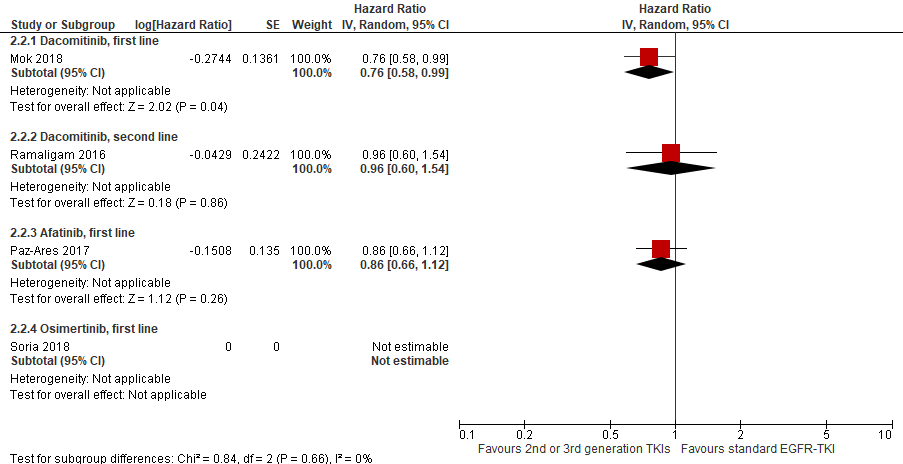
In the study by Mok (2018), the median overall survival was 7.3 months longer in patients treated with dacomitinib as first line treatment (median overall survival 34 months) as compared to patients treated with gefitinib (median overall survival 26.8 months). The hazard ratio (HR) showed a lower risk of death in patients treated with dacomitinib (HR=0.76, 95%CI 0.58 to 0.99).This difference was statistically significant. In the study by Ramalingam (2016), the difference in the median overall survival was 2.5 months after dacomitinib as second line treatment versus erlotinib and the hazard ratio was 0.96 (95%CI (0.60, 1.54)), indicating no clinically relevant difference in the risk of death between the two treatments.
The median overall survival could not be calculated for osimertinib (Soria, 2018). After 18 months, 83% of the patients treated with osimertinib and 71% of the patients treated with a standard EGFR-TKI were still alive.
The median overall survival in patients treated with afatinib was 3.4 months longer as compared to patients treated with gefitinib. The risk of death, however, was comparable for both treatment groups (HR=0.86, 95%CI 0.66 to 1.12). The results were comparable for the two types of mutation. The hazard ratio was 0.91 (95%CI 0.62 to 1.36) in patients with a L858R mutation, and 0.83 (95%CI 0.58 to 1.17) in patients with the exon 19 deletion (Paz-Ares 2017). This study was not powered for assessing OS.
Figure 1 Overall survival in 2nd or 3rd generation EGFR-TKIs versus 1st generation EGFR TKI in first line and second line
Progression free survival (PFS)
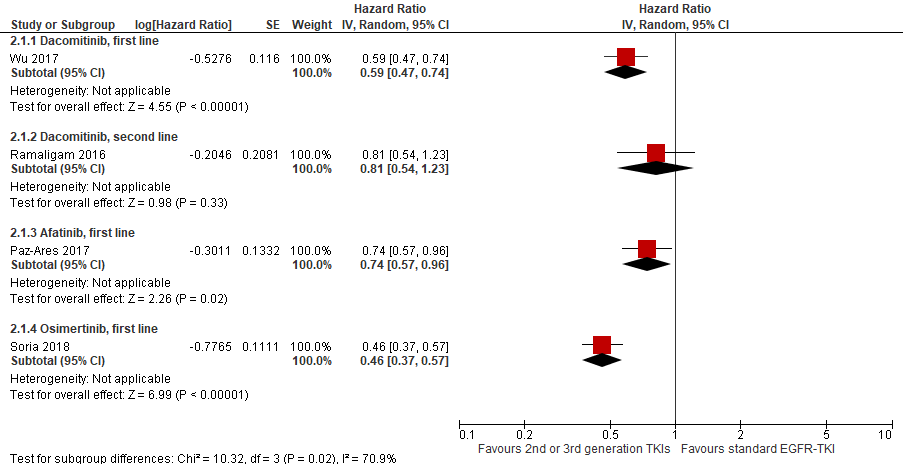
In the Archer 1050 study (Wu, 2017; Mok, 2018), the median PFS was 14.7 months with dacomitinib as first line treatment and 9.2 months with gefitinib treatment (difference 5.5 months). The lower risk of progression during treatment with dacomitinib was statisitically significant and clinically relevant (HR=0.59, 95%CI 0.47 to 0.74). Ramalingam (2016) reported a comparable PFS for dacomitinib (10.9 months) and erlotinib (9.6 months). The hazard ratio for the results in second line was 0.81 (95%CI 0.54 to 1.23).
The median PFS was 8.7 months longer in patients treated with osimertinib (18.9 months) as compared to patients treated with a standard EGFR-TKI (gefitinib or erlotinib: 10.2 months) (Soria, 2018). The risk of progression or death was significantly lower in patients treated with osimertinib as compared to a standard EGFR-TKI (HR= 0.46 (95%CI 0.37 to 0.57)).
The median PFS was comparable in patients treated with afatinib (11.0 months) as compared to patients treated with gefitinib (10.9 months). However, the hazard ratio showed a reduction in the risk of progression in patients treated with afatinib (HR=0.74, 95%CI 0.57 to 0.96). The probability of remaining progression-free after 18 months was significantly increased in patients receiving afatinib compared with those receiving gefitinib (27.3% versus 15.2%, respectively; p=0.02).
Figure 2 Progression free survival in 2nd or 3rd generation EGFR-TKIs versus 1st generation EGFR-TKI for both first and second line
Objective response rate
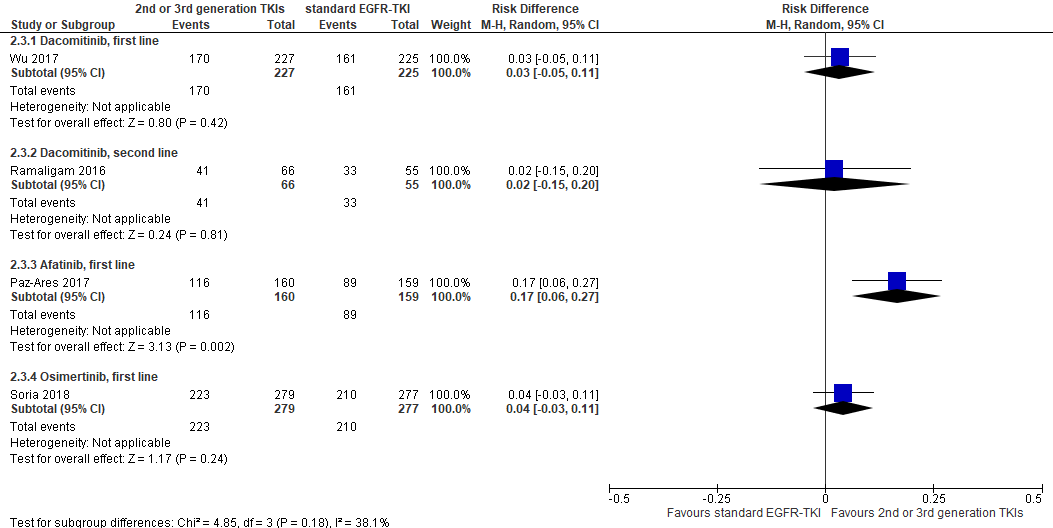
Overall, the percentage of patients who responded on the treatment ranged from 56% to 80%. 72% of the patients treated with dacomitinib responded versus 69% of the patients treated with gefitinib (absolute difference 0.03 (-0.04, 0.11); NNT=33). In patients treated with osimertinib, the objective response rate was 80% versus 76% in patients treated with a standard EGFR-TKI (absolute difference 0.04, 95%CI (-0.03, 0.11); NNT=25). In patients treated with afatinib, the objective response rate was 73% versus 56% in patients treated with gefitinib (absolute difference 0.17, 95%CI (0.06, 0.27); NNT=6).
Figure 3 Objective response rate 2nd or 3rd generation EGFR-TKIs versus 1st generation EGFR-TKI
Severe adverse events
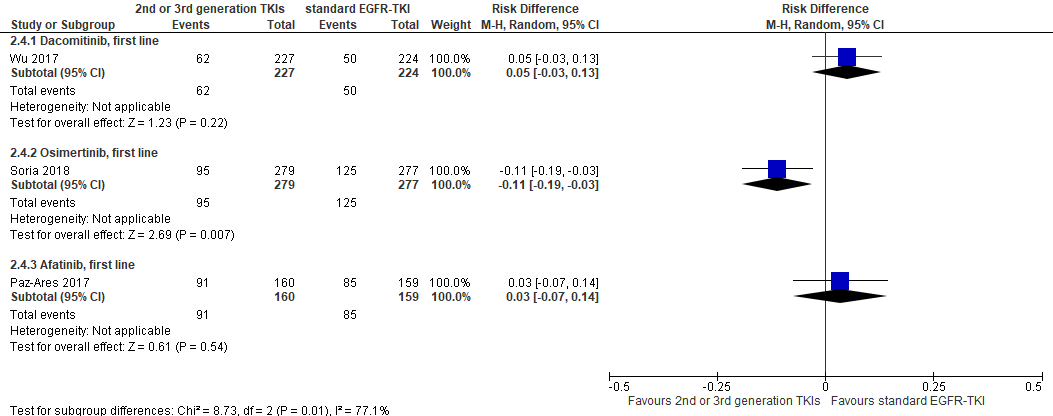
Many patients treated with EGFR-TKI’s developed severe adverse events (grade ≥3). The percentages of severe adverse events ranged from 34% to 57%. Soria (2018) reported a lower risk of severe adverse events in patients treated with osimertinib (34%) as compared to patients treated with a 1st generation EGFR-TKI (absolute difference -0.11 (-0.19, -0.03); NNH=9).
No statistically significant differences in the risk of severe adverse events were found between for dacomitinib versus gefitinib (absolute difference 0.05, 95%CI (-0.03, 0.13)) and afatinib versus gefitinib (0.03, 95%CI (-0.07, 0.14)).
Figure 4 Severe adverse events (grade 3 or more) 2nd or 3rd generation EGFR-TKIs versus 1st generation EGFR-TKI
Quality of life
Park (2016b) reported patients’ quality of life after treatment with afatinib, measured with the Euroqol questionnaire (EQ5D). The post-baseline adjusted mean score for quality of life was not different between patients treated with afatinib and patients treated with gefitinib. The mean post-baseline score was 0.77 (se=0.01) in patients treated with afatinib and 0.80 (se 0.01) in patients treated with gefitinib (p=0.14).
The difference in change in global quality of life was lower after treatment with dacomitinib in first line (change 0.20) as compared to treatment with gefitinib (change 4.94; Wu (2017). This difference in change was statistically significant but not clinically relevant (difference less than 10 points).
No data were found on patients’ quality of life after treatment with osimertinib.
Level of evidence
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence.
Dacomitinib
The level of quality of evidence for progression free survival, overall survival objective response rate, severe adverse events and quality of life was downgraded with two levels because of limitations in the study design (Risk of bias, no blinding and limited information on randomisation method and concealment of allocation) and imprecision (confidence interval crosses threshold form clinical relevance).
Osimertinib
The level of quality of evidence for progression free survival, overall survival, objective response rate and severe adverse events was downgraded with one level because of imprecision (survival: limited number of cases; objective response rate and severe adverse events: confidence interval crosses threshold for no difference).
Afatinib
The level of quality of evidence for progression free survival, overall survival and objective response rate was downgraded with one level because of imprecision (confidence interval crosses threshold for clinical relevance).
The level of quality of evidence for severe adverse events and quality of life was downgraded with two levels because of limitations in the study design (Risk of bias, no blinding) and imprecision (confidence interval crosses threshold for no difference).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Is treatment with a second or third generation tyrosine kinase inhibitor (TKI) preferred above treatment with a first generation TKI in patients with NSCLC and an EGFR mutation?
P (population) patients with non–small-cell lung cancer stage IIIB/IV and an EGFR mutation;
I (intervention) second or third generation tyrosine kinase inhibitors (afatinib, dacomitinib, osimertinib);
C (comparison) first generation tyrosine kinase inhibitors (gefitinib or erlotinib);
O (outcome) overall survival, progression free survival, objective response rate, quality of life and adverse events.
Relevant outcome measures
The working group considered overall survival a critical outcome measure for the decision-making process; and progression free survival, response rate, quality of life, safety (adverse events and toxicity) important outcome measures for decision making.
The working group defined clinically relevant differences as follows:
Overall survival: >12 weeks or hazard ratio <0.7
Progression free survival: >12 weeks or hazard ratio <0.7
Adverse events and toxicity: lethal <5%, acute or severe <25%
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched from 1st of January 2008 up to 20th of June 2018 using relevant search terms for systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies (OBS). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 637 hits. Studies were selected based on the following criteria: systematic review, randomized trials or cohort studies including patients with non–small-cell lung cancer stage IIIB/IV with EGFR mutations comparing tyrosine kinase inhibitors. 21 studies were initially selected based on title and abstract. After reading the full text, 14 studies were excluded (see the table with reasons for exclusion under the tab Methods). Seven publications, reporting the results of four trials, were included in the literature summary. Important study characteristics and results are depicted in the evidence tables. The assessment of the risk of bias is depicted in the risk of bias tables.
Referenties
- 1 - FDA 2018. FDA broadens afatinib indication to previously untreated, metastatic NSCLC with other non-resistant EGFR mutations. Via https://www.fda.gov/drugs/resources-information-approved-drugs/fda-broadens-afatinib-indication-previously-untreated-metastatic-nsclc-other-non-resistant-egfr
- 2 - Furuya N, Saito H, Watanabe K et al. Phase III study comparing bevacizumab plus erlotinib to erlotinib in patients with untreated NSCLC harboring activating EGFR mutations: NEJ026. J Clin Oncol 2018; 36(Suppl): abstr 9006.
- 3 - Inoue A, Kobayashi K, Usui K et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol 2009; 27: 1394–1400.
- 4 - Nakamura A, Morita S, Hosomi Y et al. Phase III study comparing gefitinib monotherapy (G) to combination therapy with gefitinib, carboplatin, and pemetrexed (GCP) for untreated patients (pts) with advanced non-small cell lung cancer (NSCLC) with EGFR mutations (NEJ009). J Clin Oncol 2018; 36(Suppl): abstr 9005.
- 5 - Mok TS, Cheng Y, Zhou X, et al. Improvement in Overall Survival in a Randomized Study That Compared Dacomitinib With Gefitinib in Patients With Advanced Non–Small-Cell Lung Cancer and EGFRActivating Mutations. J Clin Oncol 36:2244-50.
- 6 - Park K, Yu CJ, Kim SW et al. First-line erlotinib therapy until and beyond response evaluation criteria in solid tumors progression in Asian patients with epidermal growth factor receptor mutation-positive nonsmall- cell lung cancer: the ASPIRATION Study. JAMA Oncol 2016a; 2: 305–312.
- 7 - Park K, Tan EH, O'Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016b;17(5):577-89. doi: 10.1016/S1470-2045(16)30033-X.
- 8 - Paz-Ares L, Tan EH, O'Byrne K, et al. Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial. Ann Oncol. 2017 Feb 1;28(2):270-277. doi:10.1093/annonc/mdw611.
- 9 - Ramalingam SS, Blackhall F, Krzakowski M, et al. Randomized phase II study of dacomitinib (PF-00299804), an irreversible pan-human epidermal growth factor receptor inhibitor, versus erlotinib in patients with advanced non-small-cell lung cancer. J Clin Oncol. 2012 Sep 20;30(27):3337-44. doi: 10.1200/JCO.2011.40.9433.
- 10 - Ramalingam SS, O'Byrne K, Boyer M, et al. Dacomitinib versus erlotinib in patients with EGFR-mutated advanced nonsmall-cell lung cancer (NSCLC): pooled subset analyses from two randomized trials. Ann Oncol. 2016 Mar;27(3):423-9. doi: 10.1093/annonc/mdv593.
- 11 - Rosell R, Dafni U, Felip E et al. Erlotinib and bevacizumab in patients with advanced non-small-cell lung cancer and activating EGFR mutations (BELIEF): an international, multicentre, single-arm, phase 2 trial. Lancet Respir Med 2017; 5: 435–444.
- 12 - Seto T, Kato T, Nishio M et al. Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15: 1236–1244.
- 13 - Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2018 11;378(2):113-125. doi: 10.1056/NEJMoa1713137.
- 14 - Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol. 2017 Nov;18(11):1454-1466. doi: 10.1016/S1470-2045(17)30608-3.
- 15 - Yamamoto N, Seto T, Nishio M et al. Erlotinib plus bevacizumab (EB) versus erlotinib alone (E) as first-line treatment for advanced EGFR mutation-positive non-squamous non-small-cell lung cancer (NSCLC): survival follow-up results of JO25567. J Clin Oncol 2018; 36(Suppl): abstr 9007.
- 16 - Zorginstituut 2018. Pakketadvies sluisgeneesmiddel osimertinib (Tagrisso®) bij de eerstelijnsbehandeling van patiënten met gevorderde of gemetastaseerde niet-kleincellige longkanker (NSCLC) met activerende EGFR-mutaties. Via https://www.zorginstituutnederland.nl/actueel/nieuws/2018/11/09/advies-sluismiddel-osimertinib-niet-in-basispakket.
Evidence tabellen
Research question: are second and third generation TKIs more effective and safe as compared to first generation TKIs in NSCLC patients with a EGFR mutation?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Mok 2018 |
randomized, open-label, phase III study
|
treatment- naive patients with NSCLC with activating mutations in EGFR (exon 19 deletion or exon 21 L858R)
Age, years Median (range) I: 62 (28-87) C: 61 (33-86)
Female I: 64.3% C:55.6 %
ECOG =0 I: 33.0% C:27.6 %
ECOG=1 I:67.0% C:72.4%
EGFR mutation Exon 19 deletion: 59% Exon 21 L858R mutation: 41%
|
gefitinib (n = 225) |
up to 48 months from the date of first dosing.
median follow-up time = 31.3 months |
deaths I: 103 (45.4%) of 227 patients C: 117 (52.0%) of 225 patients
Median overall survival, months I: 34.1 (95% CI, 29.5 to 37.7) C: 26.8 (95% CI, 23.7 to 32.1) HR, 0.760; 95% CI, 0.582 to 0.993; P = .0438); favouring dacomitinib
Exon 19: HR= 0.880 (0.613 to 1.262) L858R mutation: HR= 0.707 (0.478 to 1.045)
After discontinuation of study treatment, a total of 253 patients (dacomitinib, n = 113 (49.8%); gefitinib, n = 140 (62.2%)) received a subsequent systemic therapy |
Authors conclusion In patients with advanced NSCLC and EGFR activating mutations, dacomitinib is the first secondgeneration epidermal growth factor receptor tyrosine kinase inhibitor (TKI) to show significant improvement in OS
follow up data; same study as Wu 2017
Third-generation EGFR TKIs used as a first subsequent therapy in 22 patients (9.7%) in the dacomitinib arm and in 25 patients (11.1%) in the gefitinib arm. |
|
|
Park 2016b |
a phase 2B, open-label, randomised controlled trial
at 64 centres in 13 countries
|
treatment-naive pathologically confirmed stage IIIB or IV adenocarcinoma of the lung; EGFR mutation (exon 19 deletion or Leu858Arg); ECOG PS) of 0 or 1;
EGFR mutation: Leu858Arg 42% Exon 19 deletion 58%
|
Afatinib 40 mg orally once daily; Dose escalation to 50 mg was allowed after 4 weeks of treatment for patients who did not experience drug-related adverse event of more than grade 1
N=160 |
Gefitinib daily dose of 250 mg. Modifications were allowed according to the summary of product characteristics or prescribing information or institutional guidelines.
N=159 |
treatment was continued until disease progression, intolerable adverse events as judged by the investigator, or other reasons necessitating withdrawal;
Tumours were assessed by CT (preferred) or MRI scan after 4 and 8 weeks of treatment, then every 8 weeks until week 64 and every 12 weeks thereafter until permanent discontinuation of study treatment.
The median duration of follow-up for progression-free survival was 27·3 months (IQR 15·3–33·9).
|
Median PFS, months All patients: I: 11·0 (10·6–12·9) C: 10·9 (9·1–11·5) HR=0·73 (95% CI 0·57–0·95); p=0·017
Median PFS Subgroup Leu858Arg I: 10·9 (8·1–12·9) C: 10·8 (7·2–12·8) HR= 0·71 (0·48–1·06)
Median PFS Subgroup Exon 19 deletion I: 12·7 (10·6–14·7) C: 11·0 (9·1–12·7) HR= 0·76 (0·55–1·06)
Objective response rate (ORR) I: 112/160 (70%) C: 89/159 (56%)
Overall survival data were immature at the time of this primary analysis
Median overall survival, months I: 27·9 (95% CI 25·1–32·2) C: 25·0 (20·6–29·3) (HR= 0·87 (95% CI 0·66–1·15); p=0·33).
AEs grade ≥3: I: n= 91 (57%) C: n=83 (52%)
QoL, EQ 5D Post-baseline adjusted mean (SE) I: 0·77 (0·01) C: 0·80 (0·01) P=0.14 mean score up to median follow-up of 56 weeks |
Most recent data: see Paz-Ares 2017
independent review of tumour response was done in a blinded manner
The funder designed the trial in collaboration with the LUX-Lung 7 steering committee Data were collected by the investigators and were analysed jointly with the funder.
105 (75%) of 140 patients who discontinued afatinib and 120 (81%) of 149 patients who discontinued gefitinib received at least one subsequent cancer treatment; 12 (9%) and 13 (9%), respectively, receiving a third-generation EGFR tyrosine kinase inhibitor. |
|
Paz-Ares 2017 |
a phase 2B, open-label, randomised controlled trial
LUX-Lung 7
at 64 centres in 13 countries |
See Park 2016b |
(n=160) |
Gefitinib
(n=159)
|
All randomised patients were included in the primary assessment of OS, and updated analysis of PFS
Safety analysis included all patients who received at least one dose of study drug
a median follow-up of 42.6 months
At the time of analysis, the median duration of treatment was 13.7 months (range: 0–46.4) with afatinib and 11.5 months (range: 0.5–48.7) with gefitinib |
OS events occurree at the date cut-off I: 109 (68.1%) C: 117 (73.6%)
Median overall survival months I: 27.9 C: 24.5 (HR, 0.86; 95% CI 0.66–1.12; P=0.2580
inpatients with exon 19 deletions: I: 30.7 C: 26.4 months; HR 0.83, 95% CI 0.58–1.17, P=0.2841)
In patients with L858R mutation: I: 25.0 C: 21.2 HR 0.91, 95%CI 0.62–1.36
Median PFS by independent review I: 11.0 C: 10.9 HR 0.74, 95% CI 0.57–0.95
ORR I: 116/160=72.5% C: 89/159=56.0%; odds ratio 2.121 (95% CI 1.32–3.40)
All cause grade ≥3 AEs I: 56.9% C: 53.5%
Treatment related grade ≥3 AEs I: 50/161=31.3% C: 31/159= 19.5% |
At data cut-off, 14 (8.8%) and 8 (5.0%) patients remained on treatment with afatinib and gefitinib
follow up data, same study as Park 2016 |
|
|
multicenter, randomized, open-label, phase II trial;
A7471028 study |
patients with advanced non–small-cell lung cancer; aged ≥ 18 years; disease progression after one or two prior chemotherapy regimens for advanced disease; ECOG PS = 0 to 2;
Exclusion criteria: prior EGFR-targeted therapy, known leptomeningeal or symptomatic brain metastases
patients characteristics only for whole group of NSCLC patients (not for subgroup with EGFR mutation) |
Dacomitinib, 45 mg once daily
N=94 With EGFR mutation: n=19 |
Erlotinib, 150 mg once Daily
N=94 With EGFR mutation: n=19 |
Patients were assessed in 28-day cycles
Treatment was discontinued for disease progression, intolerance, patient withdrawal, or death. Subsequent treatment: cross-over from erlotinib to dacomitinib was prohibited.
All patients were followed up for PFS and OS; five patients lost to follow-up. |
Subgroup EGFR mutation: Median PFS, months I: 7.44 (95%CI 3.89 to 18.42) C: 7.44 (95%CI 2.56 to 10.98) (HR=0.46; 95% CI, 0.18 to 1.18; P=.098
|
Patient baseline characteristics were balanced between treatment arms, except for baseline ECOG PS 2, EGFR mutation, and number of patients receiving two prior chemotherapy Regimens (I: more)
Patients recruitment Between November 2008 and October 2009 |
|
Pooled analysis of subset analyses from two randomized trials
ARCHER 1009 (NCT01360554) and A7471028 (NCT00769067). |
locally advanced/ metastatic NSCLC; progression with 1 or 2 prior chemotherapy regimens; ECOG 0-2
this analysis: subgroup of patients who had EGFR mutant NSCLC and that of patients who had activating EGFR mutation in exon 19 or 21
121 patients with EGFR mutant NSCLC; 101 had activating mutations in exon 19 or 21
higher proportion of exon 19 mutation in erlotinib group (75% versus 60.4%); exon 21 mutation was overrepresented in the dacomitinib group. |
Dacomitinib 45 mg daily
EGFR mutant: N=66
common activating EGFR mutant: N=53 |
Erlotinib 150 mg daily
EGFR mutant: N=55
common activating EGFR mutant: N=48 |
No information on duration follow up
Median duration of treatment was for dacomitinib 11.0 months (IQR: 3.7–19.4 months) and for erlotinib 9.6 months (IQR: 3.7–16.8 months). |
P= EGFR mutant NSCLC:
Median PFS based on investigator’s review, months I: 10.9 (95% CI 7.4–17.4) C: 9.6 (95% CI 7.4–11.3) HR = 0.815 (95% CI 0.542–1.224)
objective response rate (ORR I: n=41/66= 62.1% ; 95% CI 49.3% to 73.8%); C: n=33/55= 60.0% ; 95% CI 45.9% to 73.0%
median OS, months: I: 26.6 (95% CI20.1–29.0) C: 24.1 (95% CI 17.9–39.4) HR= 0.958;95% CI (0.596, 1.538), p= 0.861
P= common EGFR mutations median PFS, months I: 14.6 (95% CI 9.0–18.2) C: 9.6 (95% CI 7.4–12.7) HR = 0.717 (95% CI 0.458–1.124) ORR I: 67.9% (95% CI 53.7% to 80.1%) C: 64.6% (95% CI 49.5% to 77.8%)
median OS, months I: 26.6 (95% CI 21.6–41.5) C: 23.2 (95% CI 16.0–31.8) HR = 0.737 (95% CI 0.431–1.259)
exon 19 mutations: median PFS (months) I;14.6 (95% CI 9.2–20.6) C: 10.0 (95% CI 7.2–12.8) HR for PFS= 0.585 (95% CI 0.335–1.024
HR for OS= 0.719 (95% CI 0.366–1.412)
exon 21 mutations median PFS (months) I: 10.0 (95% CI 4.2–19.6) C: 9.0 (95% CI 1.0–27.7) HR for PFS= 0.955 (95% CI 0.421–2.168)
HR for OS was 0.688 (95% CI 0.276–1.717) |
• ARCHER 1009: A multinational, randomized, double-blinded, double dummy phase III study in second-/third-line NSCLC. • A7471028: A multinational, randomized, open-label phase II study in second-/third-line NSCLC.
One patient with EGFR mutation in exon 19 was randomized to dacomitinib, but did not receive study therapy
randomisation not stratified for EGFR mutation
Poststudy treatment with an EGFR inhibitor was given to 17% and 27% of patients on the dacomitinib and erlotinib groups, respectively
patients from Ramalingam 2012 included |
|
|
Soria 2018 |
double-blind, phase 3 trial, in 132 sites in 29 countries
|
556 patients with previously untreated, EGFR mutation–positive (exon 19 deletion or L858R) locally advanced or metastatic NSCLC Patients with CNS metastases whose condition was neurologically stable were eligible
Median age 64 yrs
Female: 63%
EGFR at randomisation: Exon 19 deletion: 63% L858R: 37%
CNS metastasis: n=116/556=21%
|
N=279
|
a standard EGFR-TKI (gefitinib at a dose of 250 mg once daily or erlotinib at a dose of 150 mg once daily)
n=277
n=183: gefitinib n=94: erlotinib |
Treatment continued until disease progression, the development of unacceptable side effects, or withdrawal of consent.
At the time of data cutoff, the median duration of total treatment exposure was 16.2 months (range, 0.1 to 27.4) for patients receiving osimertinib and 11.5 months (range, 0 to 26.2) for those receiving a standard EGFR-TKI
141 patients (51%) in the osimertinib group and 64 (23%) in the standard EGFR-TKI group continued to receive trial treatment.
|
Median PFS (determined by investigator assessments, according to RECIST, version 1.1.), months I: 18.9 (95% CI, 15.2 to 21.4) C: 10.2 (95% CI, 9.6 to 11.1) ∆=8.7 months HR=0.46 (95% CI, 0.37–0.57) P<0.001
Exon 19 deletion: HR=0.43 (0.32–0.56) L858R: HR= 0.51 (0.36–0.71)
Median overall survival, I: NC (NC–NC) C: NC (NC–NC) (NC=could not be calculated)
Percent of patients alive at 18 months (95% CI) I: 83 (78–87) C: 71 (65–76)
objective response rate, I: 80% (95% CI, 75 to 85) C: 76% (95% CI, 70 to 81) (odds ratio, 1.27; 95% CI, 0.85 to 1.90; P = 0.24)
AEs grade ≥3 I: 95/279=34% C: 125/277=45%
Fatal adverse events I: 6/ 279 patients (2%) C: 10/277 patients (4%)
None of the fatal adverse events were considered to be possibly related to osimertinib, and one fatal adverse event (of diarrhea) was considered to be possibly related to standard EGFR-TKIs. |
trial was funded by the sponsor and was designed by the principal investigators and the sponsor
patients who had been assigned to a standard EGFR-TKI allowed to cross over to open-label osimertinib after confirmation of objective disease progression. After RECIST-defined progression, 82 patients (29%) in the osimertinib group started a first subsequent anticancer therapy. Of these, 55 patients (43%) in the standard EGFR-TKI group received osimertinib |
|
Wu 2017 |
multicentre, randomised, open-label, phase 3 study (ARCHER 1050),
71 academic medical centres and university hospitals in seven countries (China, Hong Kong, Japan, South Korea, Poland, Italy, and Spain)
|
newly diagnosed advanced NSCLC and one EGFR mutation (exon 19 deletion or Leu858Arg) or recurrent NSCLC (minimum of 12 months disease-free interval between completion of adjuvant or neoadjuvant therapy and recurrence
(ECOG) performance status of 0–1;
Details population: see Mok 2018
|
Oral dacomitinib 45 mg once daily in 28-day cycles. Dacomitinib dose reductions for a maximum of two dose levels were permitted for treatment-related toxicity in the case of grade 3 or worse toxicity, or prolonged grade 2 adverse events
n=227 |
oral gefitinib 250 mg once daily in 28-day cycles. Gefitinib was only available as a 250 mg dose. If treatment was interrupted for grade 3, grade 4, or intolerable grade 2 toxicity, gefitinib was resumed at a daily or every-other-day dosing at the investigator’s discretion. N=225 |
Median duration of treatment at data cutoff was 15·3 months (IQR 6·9–20·9) in the dacomitinib group and 12·0 months (7·3–18·4) in the gefitinib group
Median duration of follow-up for progression-free survival in the intention-to-treat population, was 22·1 months (95% CI 20·3–23·9; dacomitinib group 22·1 months (20·2–23·9) and gefitinib group 23·0 months (20·3–25·8)). |
masked IRC review: Median progression free Survival, months I: 14·7 (95% CI 11·1–16·6 C: 9·2 (9·1–11·0) (HR 0·59 (95% CI 0·47–0·74); p<0·0001
ORR I:n= 170 (75%; 69–80) C:n=161 (72%; 65–77)
Serious adverse events of any cause I: 62 (27%) of 227 patients C: 50 (22%) of 224 patients
Treatment related serious adverse events I: 21 (9%) patients C: 10 (4%) patients
Deaths as adverse events (according to investigators) I: 22 (10%) patients C: 20 (9%) patients
I: 0.20 C: 4·94 Difference = 4.74, p=0·0002 |
See for follow up data Mok 2018
designed by a steering committee of academic advisers and representatives from the sponsors of the study
|
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Aguiar 2018 |
a decision-analytic model |
|
Beau-Faller 2014 |
No comparison |
|
Belani 2013 |
Other intervention (Combination therapy) |
|
Chouaid 2017 |
Costeffectiveness analysis, model based (no new data collection; Data from LUX-Lung 7) |
|
Ding 2017 |
Other research question |
|
Fan 2014 |
Specific population: patients with brain metastases |
|
Greenhalgh 2016 |
Other research question |
|
Heymach 2014 |
Not relevant for PICO |
|
Isla 2017 |
Other research question |
|
Remon 2017 |
PROTOCOL |
|
Reck 2018 |
Other intervention (Combination therapy) |
|
Zhang 2016
|
Ither intervention |
|
Zhang 2017 |
Relevant individual studies were included in our review |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 24-01-2020
Laatst geautoriseerd : 24-01-2020
Geplande herbeoordeling :
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling EGFR |
NVALT |
2019 |
2021 |
2 |
NVALT |
- |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. dr. A.F.T.M. Verhagen, cardio-thoracaal chirurg, Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel met gemelde belangen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingelheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patienten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van BMS (nivolumab) en Boehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Boehringer lngelheim) in 2016 financiële support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor AstraZeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt door geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator). |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (https://www.netwerk-path.nl/) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Bayer, Novartis, BMS, BioRad, Amgen, Illumina, Ageno BioSciences, Janssen Cilag (Johnson&Johnson), BioCartis (honoraria komen op een rekening op UMCG) Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, Illumina, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) betaald aan UMCG: Boehringer Ingelheim, Avenio/Roche/Cancer-ID, BMS (CA209-759), BioRad and Avenio - |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
geen |
getrouwd met praktijkhoudend huisarts |
geen |
|
Hofstede |
adviseur richtlijnontwikkeling |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. Longkanker Nederland heeft ook deelgenomen aan de Invitational conference. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longcarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Bij het vaststellen van welke verschil klinisch relevant is, heeft de werkgroep zich laten inspireren door de PASKWIL-criteria. De werkgroep is zich ervan bewust dat deze criteria zijn ontwikkeld voor de beoordeling van geneesmiddelen in de palliatieve setting en niet voor een curatieve setting.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
- Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS – voor observationeel onderzoek.
- QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

