(Neo)adjuvante immuuntherapie
Uitgangsvraag
Wat is de rol van immuuntherapie bij de behandeling van stadium I, II en III niet-kleincellig longcarcinoom?
Aanbeveling
Overweeg de toepassing van neoadjuvante chemotherapie en immuuntherapie gevolgd door resectie en adjuvante immuuntherapie bij patiënten zonder specifieke aberraties van het tumorgenoom (zie KNT-lijst) met een resectabel* stadium II en III NSCLC ongeacht PD-L1 TPS expressie. **
*(omdat er geen formele definitie bestaat van wat een resectabel NSCLC is, dient de technische resectabiliteit op het longoncologisch MDO beoordeeld te worden door ervaren longchirurgen, bij twijfel dient men een centrum te raadplegen met specifieke expertise in de bij patiënt betreffende longchirurgische complexiteit)
**(indien beschikbaar als vergoede zorg in Nederland)
Overweeg de toepassing van adjuvante immuuntherapie na complete resectie en na adjuvante chemotherapie bij patiënten zonder specifieke aberraties van het tumorgenoom (zie KNT-lijst) met een stadium II en III NSCLC:
- Overweeg atezolizumab bij patiënten met een verhoogde tumor PD-L1 expressie. Let wel, in Nederland wordt dit alleen vergoed bij PD-L1 ≥50% en stadium III zonder N2 betrokkenheid of stadium III o.b.v. unforeseen N2. Adjuvante chemotherapie voorafgaand aan adjuvante atezolizumab is voor deze indicatie verplicht.
- Overweeg pembrolizumab bij patiënten ongeacht tumor PD-L1 expressie.*
*(indien beschikbaar als vergoede zorg in Nederland)
Overwegingen
Voor- en nadelen bekend uit de literatuur
Neoadjuvante immuuntherapie met chemotherapie
Het neoadjuvante gebruik van immuuntherapie (nivolumab) met chemotherapie resulteert mogelijk in een langere totale overleving, eventvrije overleving en respons, wanneer dit vergeleken wordt met alleen neoadjuvante chemotherapie. Er is wellicht geen (of nauwelijks merkbaar) klinisch relevant verschil in kwaliteit van leven tussen de groepen.
Neoadjuvante chemoimmuuntherapie met adjuvante immuuntherapie (perioperatieve behandeling)
Neoadjuvante immuuntherapie (pembrolizumab of nivolumab) met chemotherapie in combinatie met adjuvante immuuntherapie resulteert mogelijk in een langere totale overleving, eventvrije overleving en respons, dan alleen neoadjuvante chemotherapie. En perioperatieve behandeling geeft mogelijk ook meer bijwerkingen. Het effect op kwaliteit van leven is onbekend.
Adjuvante immuuntherapie met of zonder voorafgaande chemotherapie
Adjuvante immuuntherapie (pembrolizumab of atezolizumab) met of zonder voorafgaande chemotherapie resulteert mogelijk in een betere ziektevrije overleving dan placebo/best supportive care met of zonder voorafgaande chemotherapie. Voor totale overleving is het onzeker of er een positief effect is. Adjuvante immuuntherapie geeft wellicht meer bijwerkingen. Het effect op kwaliteit van leven is onbekend.
Algemene overwegingen
De verwachte voordelen zijn het grootst voor het neoadjuvante/perioperatieve gebruik van immuuntherapie in combinatie met chemotherapie. Verder lijken de subgroepen met een hoger stadium en een positieve PD-L1 TPS meer voordeel te hebben (zie Professioneel perspectief).
De toegevoegde toxiciteit is niet verwaarloosbaar: de selectie (autoimmuun voorgeschiedenis o.a.) en voorlichting van de patiënt over het risico op het optreden van specifieke bijwerkingen is essentieel in deze.
Bewijskracht van de literatuur
De werkgroep concludeert dat de bewijskracht van de literatuur zeer laag tot laag is. Het werkelijke effect kan substantieel anders zijn dan het effect dat uit de studies is gebleken. Het gebrek aan mature data, imprecisie en potentiële publicatiebias liggen hieraan ten grondslag.
Professioneel perspectief
De huidige studies met neoadjuvante, perioperatieve en adjuvante immuuntherapie zijn methodologisch gezien erg divers, voornamelijk door de diversiteit in de inclusie van patiëntengroepen en behandelschema’s (aantal kuren, types chemotherapie etc.). De inclusiecriteria met betrekking tot patiënten met EGFR- en ALK-mutaties waren wisselend en er werd geen éénduidige definitie gehanteerd van wat resectabel stadium III NSCLC inhoudt.
De huidige studies hanteren alle een vorm van platinum-doublet chemotherapie als controle-arm-behandeling voor NSCLC-patiënten in alle stadia, van IB tot IIIC. Dit is niet perse in lijn met de standaardpraktijk, waarbij patiënten in de vroegere stadia eerst geopereerd worden. Voor de gevorderde stadia, van IIIA tot IIIB, bestaat er geen consensus over de beste controle-arm-behandeling.
Bij neoadjuvante chemo-immuuntherapie bestaat een reëel risico dat patiënten de geplande chirurgie niet ondergaan vanwege bijwerkingen van de behandeling. Verschillende studies tonen aan dat een aanzienlijk deel van de patiënten uiteindelijk niet geopereerd wordt, vaak door progressie van de ziekte of door behandelingsgerelateerde complicaties.
Een klinisch zeer relevante vraag is de rol van adjuvante immuuntherapie na neoadjuvante chemo-immuuntherapie en chirurgie. De huidige studies geven op deze vraag geen antwoord. Er is daarom behoefte aan gerandomiseerde studies om deze vraag te beantwoorden, mede gezien de hogere kosten van de perioperatieve aanpak t.o.v. de neoadjuvante aanpak.
Pathologische en moleculaire biomarkers zijn van groot belang voor het bepalen van de meest geschikte therapie. Het testen op EGFR- en ALK-mutaties voor de operatie wordt steeds belangrijker voor het afstemmen van neoadjuvante en adjuvante behandelingen. Bij patiënten met een oncogenic driver is de meerwaarde van immuuntherapie in de (neo)adjuvante setting niet bewezen, in tegendeel, het kan een eventuele latere behandeling met een TKI compliceren. De ADAURA en ALINA studies laten zien dat deze patiënten voordeel kunnen hebben van adjuvant een gerichte TKI. Ook is het testen op PD-L1 voor de operatie van groot belang. De huidige studies hebben in de subgroep-analyses laten zien dat de patiënten met PD-L1 negatieve tumoren heel weinig voordeel hebben van het toevoegen van immuuntherapie.
Uit subgroepanalyses blijkt ook dat patiënten met lagere stadia van NSCLC, zoals stadium I, minder voordeel halen uit de besproken behandelingsstrategieën. Tevens werd aangetoond dat zowel het OS- als EFS-voordeel voor de gehele studiepopulatie voornamelijk gedreven werd door de PD-L1 positieve subgroepen. In lijn met deze redenen heeft de EMA het gebruik van neoadjuvante chemo-nivolumab (Checkmate-816) alleen goedgekeurd voor patiënten met een PD-L1 positief NSCLC in stadium II-III.
In de context van adjuvante immuuntherapieën heeft de IMpower010-studie aangetoond dat het DFS voordeel van adjuvante atezolizumab hoger was bij patiënten in stadium II-IIIA met positieve PD-L1-expressie, vergeleken met patiënten in een lager stadium of patiënten die niet geselecteerd werden op basis van PD-L1-expressie. Dit resulteerde in een goedkeuring door de FDA voor deze specifieke patiëntengroep. Echter, de EMA heeft enkel goedkeuring verleend voor de behandeling van patiënten in stadium II-III met een PD-L1-expressie van ten minste 50%. Opmerkelijk genoeg toonde de KEYNOTE-091-studie aan dat er een voordeel was van adjuvante pembrolizumab voor de gehele studiepopulatie, onafhankelijk van het stadium en zonder specifieke selectie op basis van PD-L1-expressie. De FDA en EMA hebben voor deze indicatie een goedkeuring verleend.
Behoudens patiënten met een negatieve PD-L1-expressie, dient men terughoudend te zijn met het inzetten van neoadjuvante of adjuvante immuuntherapie bij patiënten met tumor-DNA-aberraties die geassocieerd zijn met verminderde werkzaamheid van immuuntherapie. Voorbeelden van dit soort ‘ongunstige’ tumormutaties zijn STK11 of KEAP1 mutaties en een lage tumor mutational burden (TMB) (van de Haar, 2024). Deze patiëntgroepen tonen over het algemeen een lagere respons en kortere progressievrije overleving op immuuntherapie. Voor deze specifieke groep patiënten dient chemotherapie te worden overwogen of dient men te verwijzen naar klinische studies die gericht zijn op gerichte nieuwe behandelmethoden. De Niet-kleincellig longcarcinoom Klinisch Noodzakelijke Targets (KNT) lijst biedt een overzicht van targets met consequenties voor de behandeling.
In oktober 2023 werd op het ESMO congres de update gepresenteerd van een aantal van de bovengenoemde studies maar ook interessante nieuwe studies. Echter zijn deze gegevens niet meegenomen in de huidige richtlijnaanbevelingen, aangezien ze zijn gepubliceerd na de formulering van de zoekvraag:
- CheckMate-77T, een gerandomiseerde fase 3-studie, vergeleek de effectiviteit van neoadjuvante nivolumab + chemotherapie, gevolgd door resectie en adjuvante nivolumab, met placebo + chemotherapie, gevolgd door chirurgie en adjuvante placebo. De patiënten werden 1:1 gerandomiseerd naar de nivolumab- of placebo-arm. Het primaire eindpunt van de studie was EFS, met secundaire eindpunten pCR en major pathological response (MPR). De interim-analyse toonde met een mediane follow-up tijd van 25,4 maanden een significant verbeterde EFS in de nivolumab-groep, met een HR van 0.58 (95% CI 0.42-0.81; P = 0.00025). Tevens werden hogere pCR- en MPR-rates waargenomen in vergelijking met de controle-groep, met OR van 6.64 (95% CI 3.40-12.97) en 4.01 (95% CI 2.48-6.49) ten faveure van de nivolumab arm, respectievelijk. De subgroepanalyse van zowel de pCR als de EFS toonde dat het voordeel voor de gehele studiepopulatie voornamelijk gezien werd in de PD-L1 positieve subgroep. Ondanks het intensievere behandelregime, bleven de chirurgische en behandeling gerelateerde bijwerkingen vergelijkbaar tussen beide groepen (Cascone, 2023).
- Van de KEYNOTE-671 studie werd een update gepresenteerd van het co-primaire eindpunt OS. Deze toonde met een mediane follow-up tijd van 36,6 maanden een significante verbetering van de OS in de pembro-arm, met een HR van 0.72 (95% CI 0.56-0.93; P = 0.00517) en een mediane OS die nog niet bereikt is, vergeleken met 52,4 maanden in de placebo-arm. De EFS was eveneens verbeterd in de pembro-arm (HR 0.59 [95% CI 0.48-0.72]; mediane [95% CI] 47,2 maanden vs 18,3 maanden). Er werd een hogere incidentie van graad ≥3 bijwerkingen in de pembro-arm (45,2% vs 37,8% in de placebo-arm) gezien (Spicer, 2023). De subgroepanalyse van zowel de OS als de EFS toonde aan dat het voordeel voor de gehele studiepopulatie voornamelijk gedreven werd door de PD-L1 positieve subgroepen.
Patiëntenperspectief
Vanuit het patiëntenperspectief zijn er geen aanvullende overwegingen bovenop de analyse van de voor- en nadelen en het professioneel perspectief van de werkgroep.
Acceptatie, haalbaarheid, implementatie
Elke patiënt met een potentieel resectabel niet-kleincellig longcarcinoom (NSCLC) dient tijdens een multidisciplinair overleg (MDO) te worden besproken. Hierbij dient een zorgvuldige afweging van de risico's en voordelen van neoadjuvante chemo-immuuntherapie te worden gemaakt om de meest geschikte behandelstrategie te bepalen. Bij twijfel dient men een centrum te raadplegen met specifieke expertise in de bij de patiënt betreffende longchirurgische complexiteit.
Neoadjuvante chemo-immuuntherapie wordt vooral aanbevolen voor patiënten in stadium II en III. Specifiek kan deze behandeling sterk worden aanbevolen voor patiënten in stadium III met een positieve PD-L1 expressie (TPS >1%), die geen contra-indicaties voor immuuntherapie of targetable DNA-aberraties hebben.
Bij elke patiënt bij wie er neoadjuvante of adjuvante chemoimmuuntherapie overwogen wordt, dient een moleculaire analyse van het NSCLC te worden verricht omdat bij patiënten met specifieke aberraties immuuntherapie achterwege gelaten dient te worden.
Kosten
De kosteneffectiviteitsstudie van Das (2023) evalueerde atezolizumab versus best supportive care (volgens Amerikaans commercieel betalerperspectief). Atezolizumab zorgde voor 1,045 extra voor kwaliteit gecorrigeerde levensjaren (QALY) tegen een incrementele kostprijs van $ 48.956, wat een incrementele kosteneffectiviteitsratio opleverde van $ 46.859/QALY. Das (2023) concludeerde dat bij een betalingsbereidheidsdrempel van $ 150.000/QALY en een incrementele kosteneffectiviteitsratio van $ 46.859/QALY atezolizumab kosteneffectief is ten opzichte van best supportive care. Op dit moment is er geen kosteneffectiviteitsstudie gedaan binnen het Nederlandse gezondheidszorgsysteem. De hoge kosten van de behandeling zouden moeten worden afgewogen tegen de verwachte kwaliteit van de overlevingswinst.
In 2024 is er een overzicht gepubliceerd van kosteninschattingen van nieuwe adjuvante en neoadjuvante behandelingen gebaseerd op de NSCLC incidentie in Nederland (Houda, 2024).
Onderbouwing
Achtergrond
In de huidige situatie worden patiënten met een vroeg-stadium NSCLC, te weten stadia I-IIIA, behandeld met bij voorkeur een resectie in het geval van resectabele ziekte. Na resectie wordt aanvullende adjuvante platinum-doublet chemotherapie besproken met de patiënt bij pathologisch stadium IIA-IIIA (TNM 8). Met het bekend worden van de resultaten van een aantal studies waarin neo-adjuvante, adjuvante en perioperatieve immuuntherapie wordt gebruikt, zullen er meer behandelopties binnen het vroeg-stadium NSCLC beschikbaar komen in de nabije toekomst. Dit maakt een richtlijnmodule over dit onderwerp voor de Nederlandse situatie wenselijk.
Conclusies / Summary of Findings
Neoadjuvant chemoimmunotherapy
|
Low GRADE |
The evidence is uncertain about the effect of neoadjuvant immunotherapy in addition to neoadjuvant chemotherapy on overall survival when compared to neoadjuvant chemotherapy alone.
Source: Forde 2022, Felip 2022 [CheckMate 816] |
|
Low GRADE |
Neoadjuvant immunotherapy in addition to neoadjuvant chemotherapy may increase event-free survival when compared to neoadjuvant chemotherapy alone.
Source: Forde 2022, Felip 2022 [CheckMate 816] |
|
Low GRADE |
Neoadjuvant immunotherapy in addition to neoadjuvant chemotherapy may increase response rate when compared to neoadjuvant chemotherapy alone.
Source: Forde 2022, Felip 2022 [CheckMate 816] |
|
Low GRADE |
Neoadjuvant immunotherapy in addition to neoadjuvant chemotherapy may have little to no effect on grade 3 or 4 adverse events when compared to neoadjuvant chemotherapy alone.
Source: Forde 2022, Felip 2022 [CheckMate 816] |
|
Very low GRADE |
Neoadjuvant immunotherapy in addition to neoadjuvant chemotherapy may have little to no effect on health-related quality of life when compared to neoadjuvant chemotherapy alone.
Source: Forde 2022, Felip 2022 [CheckMate 816] |
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy (perioperative treatment)
|
Low GRADE |
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy may increase overall survival* when compared to neoadjuvant chemotherapy alone.
Source: Wakelee 2023 [KEYNOTE-671], Provencio 2023 [NADIM-II]* |
|
Low GRADE |
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy may increase event-free survival when compared to neoadjuvant chemotherapy alone.
Source: Wakelee 2023 [KEYNOTE-671], Provencio 2023 [NADIM-II] |
|
Low GRADE |
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy may increase response rate when compared to neoadjuvant chemotherapy alone.
Source: Wakelee 2023 [KEYNOTE-671], Provencio 2023 [NADIM-II] |
|
Low GRADE |
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy may increase grade 3 or 4 adverse events when compared to neoadjuvant chemotherapy alone.
Source: Wakelee 2023 [KEYNOTE-671], Provencio 2023 [NADIM-II] |
|
- GRADE |
No evidence was found regarding the effect of neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy on health-related quality of life when compared to neoadjuvant chemotherapy alone.
Source: - |
Adjuvant immunotherapy with or without preceding chemotherapy
|
Very low GRADE |
Adjuvant immunotherapy, with or without preceding chemotherapy, may have little to no effect on overall survival when compared to placebo or best supportive care. However, mature OS data are awaited.
Source: O’Brien 2022 [PEARLS / KEYNOTE-091], Felip 2021, Felip 2023 [IMpower010] |
|
Low GRADE |
Adjuvant immunotherapy, with or without preceding chemotherapy, may increase disease-free survival when compared to placebo or best supportive care.
Source: O’Brien 2022 [PEARLS / KEYNOTE-091], Felip 2021, Felip 2023 [IMpower010] |
|
Low GRADE |
Adjuvant immunotherapy, with or without preceding chemotherapy, may increase grade 3 or 4 adverse events when compared to placebo or best supportive care.
Source: O’Brien 2022 [PEARLS / KEYNOTE-091], Felip 2021, Felip 2023 [IMpower010] |
|
- GRADE |
No evidence was found regarding the effect of adjuvant immunotherapy, with or without preceding chemotherapy, on health-related quality of life when compared to placebo or best supportive care.
Source: - |
Samenvatting literatuur
Neoadjuvant chemoimmunotherapy
Description of studies
The CheckMate 816 trial (Forde 2022) included patients with early-stage NSCLC (IB (≥4 cm) to IIIA NSCLC) (7th TNM classification) and no known EGFR/ALK alterations. This trial compared nivolumab (360 mg) plus platinum-doublet chemotherapy (three cycles) to chemotherapy alone (Table 4). The neoadjuvant treatment was followed by surgery and adjuvant chemotherapy, radiotherapy or both.
A total of 358 patients was randomized (179 patients in each study arm) and efficacy was analyzed for all patients. The minimum follow-up was 21 months (median follow-up 29.5 months). In this multicenter RCT several, geographically widespread, centers participated (located in South America, Canada, China, Europe, Japan, Korea, Taiwan, Turkey, and the United States).
The study was an open-label trial and both patients and healthcare providers were not blinded. Outcome assessors, however, were blinded. Bristol Myers Squibb was involved in designing the trial and analyzing the data. It was noticed that protocol changes were not plainly justified, questioning the analytic plan of the trial (Olivier 2022).
The primary endpoints were event-free survival and pathological complete response.
Table 4. Study characteristics of the RCT on neoadjuvant chemoimmunotherapy
|
Trial (author year) |
Study design |
Intervention |
Control |
Outcomes |
|
CheckMate 816 (Forde 2022, Felip 2022) |
RCT |
Neoadjuvant nivolumab (360 mg) plus platinum-doublet chemotherapy (three cycles) |
Neoadjuvant platinum-doublet chemotherapy (three cycles) |
|
(pCR = pathological complete response; MPR = major pathological response; QoL = Quality of Life)
* primary endpoint
Results
Overall survival
Median overall survival was not reached in either the nivolumab-plus-chemotherapy group or the chemotherapy-alone group. At 24 months, 82.7% of the patients was alive in the nivolumab-plus-chemotherapy group, versus 70.6% in the chemotherapy-alone group (HR: 0.57) (Forde 2022).
Event-free survival
Event-free survival was longer in the group of patients receiving nivolumab plus chemotherapy (31.6 months; 95% CI 30.2 to not reached) compared to the group of patients that received chemotherapy (20.8 months; 95% CI 14.0 to 26.7) (HR: 0.63) (Forde 2022).
Response rate
The proportion of patients with a pCR was higher in the group that received nivolumab plus chemotherapy (24.0%; 95% CI: 18.0 to 31.0) compared to the group that received chemotherapy (2.2%; 95% CI: 0.6 to 5.6) (RR: 10.8) (Forde 2022). A benefit with nivolumab plus chemotherapy with respect to pCR was observed across all key subgroups, including those based on disease stage, tumor PD-L1 expression level, and histologic type.
Grade 3 or 4 adverse events
Occurrence of grade 3 or 4 adverse events was 41% (72/179) in the nivolumab plus chemotherapy group versus 44% (77/179) in the chemotherapy group (Forde 2022).
Quality of life
HRQoL was evaluated using the 3-level version of the EQ-5D (EQ-5D-3L) during the neoadjuvant period (week 4, week 7, and post-neoadjuvant visit 1) (Felip 2022). Scores during the neoadjuvant period were similar to baseline for both treatment arms. No clinically meaningful differences between the groups were found. In both treatment arms, most patients reported “no problems” for individual EQ-5D-3L dimensions (mobility, self-care, usual activities, pain/discomfort, and anxiety/depression) at baseline and during treatment.
Level of evidence of the literature
The level of evidence for all outcomes started at ‘high’, as the included studies were RCTs.
The level of evidence regarding the outcome overall survival was downgraded by two levels because of limitations in study design and execution (risk of bias, one level) and very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level). No further downgrading was applied for potential publication bias (selective reporting included in RoB).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome event-free survival was downgraded by two levels because of limitations in study design and execution (risk of bias, one level) and very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level). No further downgrading was applied for potential publication bias (selective reporting included in RoB).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome response rate was downgraded by two levels because of limitations in study design and execution (risk of bias, one level) and very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level). No further downgrading was applied for potential publication bias (selective reporting included in RoB).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome adverse events was downgraded by two levels because of limitations in study design and execution (risk of bias, one level) and very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level). No further downgrading was applied for potential publication bias (selective reporting included in RoB).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome quality of life was downgraded by three levels because of limitations in study design and execution (absence of blinding of patients) (serious risk of bias, two levels) and very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level). No further downgrading was applied for potential publication bias (selective reporting included in RoB).
Therefore, the level of evidence was graded as very low.
Neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy (perioperative treatment)
Description of studies
The double-blind KEYNOTE-671 trial (Wakelee 2023) included patients with resectable stage II, IIIA or IIIB (N2 stage) NSCLC (8th TNM classification). A total of 797 patients were randomized to receive pembrolizumab (200 mg) (4 cycles) (n=397) with cisplatin-based chemotherapy or placebo with cisplatin-based chemotherapy (n=400), followed by surgical resection and adjuvant pembrolizumab therapy (200 mg) (up to 13 cycles)(Table 5). The median follow-up was 25.2 months. Few patients with EGFR mutations or ALK translocations were identified. Multiple centers participated in this global trial, located in North America, South America, Australia, Europe, Asia and Africa. Employees of the funder, Merck Sharp and Dohme, were involved with the trial design and oversight.
The primary endpoints were event-free survival and overall survival.
The NADIM-II trial (Provencio 2023) is an open-label RCT conducted at 21 hospitals in Spain. Patients with previously untreated resectable stage IIIA or IIIB NSCLC (8th TNM classification) and no known EGFR/ALK alterations were considered eligible. A total of 86 patients were randomized to receive nivolumab (360 mg) plus platinum-based chemotherapy (3 cycles) (n=57) or chemotherapy alone (n=29), followed by surgery. Patients with an R0 resection in the nivolumab group also received adjuvant nivolumab (480 mg) for 6 months. The median follow-up was 26.1 months (IQR 17.4-30.9). The trial funders (Bristol Myers Squibb and others) had no role in designing the trial and analyzing the data.
The primary endpoint was a pathological complete response.
Table 5. Study characteristics of the RCT on neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy (perioperative treatment)
|
Trial (author year) |
Study design |
Intervention |
Control |
Outcomes |
|
KEYNOTE-671 (Wakelee 2023) |
RCT |
Neoadjuvant pembrolizumab (200 mg) (4 cycles) + cisplatin-based chemotherapy + adjuvant pembrolizumab (200 mg) (up to 13 cycles)
|
Neoadjuvant placebo (4 cycles) + cisplatin-based chemotherapy |
|
|
NADIM-II (Provencio 2023) |
RCT |
Neoadjuvant nivolumab (360 mg) + paclitaxel + carboplatin (3 cycles) + adjuvant nivolumab (480 mg) (every 4 weeks for 6 months) (optional) |
Neoadjuvant paclitaxel + carboplatin |
|
(pCR = pathological complete response; MPR = major pathological response; OR = Overall response; QoL = Quality of Life)
* primary endpoint
Results
Overall survival
In the KEYNOTE-671 trial, median overall survival was not reached in the pembrolizumab-plus-chemotherapy group. The median overall survival was 45.5 months (95% CI: 42.0 to not reached) in the placebo group (Wakelee 2023).
At 24 months, 80.9% (95% CI: 76.2-84.7) of the patients was alive in the pembrolizumab plus chemotherapy group, versus 77.6% (95% CI: 72.5-81.9) in the placebo group.
In the NADIM-II trial, overall survival at 24 months was 85.0% (95% CI: 75.9-95.2) in the nivolumab plus chemotherapy group versus 63.3% (95% CI: 47.8-84.6) in the chemotherapy alone group (HR: 0.43; 95% CI: 0.19-0.98) (Provencio 2023).
Event-free survival
In the KEYNOTE-671 trial, median event-free survival was not reached in the pembrolizumab-plus-chemotherapy group. The median overall survival was 17.0 months (95% CI: 14.3-22.0) in the placebo group. (HR: 0.58; 95% CI: 0.46-0.72; p<0.001, in favor of pembrolizumab plus chemotherapy) (Wakelee 2023).
At 24 months, 62.4% (95% CI: 56.8-67.5) of the patients was alive without an event in the pembrolizumab plus chemotherapy group, versus 40.6% (95% CI: 34.8-46.3) in the placebo group.
The NADIM-II trial reported progression-free survival at 24 months. Progression-free survival was 67.2% (95% CI: 55.8-81.0) in the nivolumab plus chemotherapy group versus 40.9% (95% CI: 26.2-63.6) in the chemotherapy alone group (HR: 0.47; 95% CI: 0.25-0.88) (Provencio 2023).
Response rate
In the KEYNOTE-671 trial, the proportion of patients with a pCR was higher in the group that received pembrolizumab plus chemotherapy (18.1%; 95% CI: 14.5-22.3) compared to the placebo group (4%; 95% CI: 2.3-6.4). The proportion of patients with a MPR was also higher in the pembrolizumab plus chemotherapy group (30.2%; 95% CI: 25.7-35.0) than in the placebo group (11.0%; 95% CI: 8.1-14.5) (Wakelee 2023).
In the NADIM-II trial, the proportion of patients with a pCR was higher in the group that received nivolumab plus chemotherapy (37%; 95% CI: 24-51) than in the chemotherapy alone group (7%; 95% CI: 1-23) (RR: 5.34; 95% CI: 1.34-21.23).
The proportion of patients with a MPR was also higher in the nivolumab plus chemotherapy group (53%; 95% CI: 39-66) than in the chemotherapy alone group (14%; 95% CI: 4-32) (RR: 3.82; 95% CI: 1.04-2.34) (Provencio 2023).
Grade 3 or 4 adverse events
In the KEYNOTE-671 trial, grade 3 or 4 adverse events were numerically higher in the pembrolizumab plus chemotherapy group (178/396, 44.9%) than in the placebo group (149/399, 37.3%) (p=0.03) (Wakelee 2023).
In the NADIM-II trial, grade 3 or 4 adverse events occurred in 19% of the patients in the nivolumab plus chemotherapy group and in 10% of the patients of the chemotherapy alone group (Provencio 2023).
Quality of life
No data on quality of life were reported in either of the studies.
Level of evidence of the literature
The level of evidence for all outcomes started at ‘high’, as the included studies were RCTs.
The level of evidence regarding the outcome overall survival was downgraded by two levels because of very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level) and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome event-free survival was downgraded by two levels because of very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level) and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome response rate was downgraded by two levels because of very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level) and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome adverse events was downgraded by two levels because of very wide confidence intervals that include the boundaries for clinical decision making (imprecision, one level) and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence could not be graded for the outcome quality of life, as it was not reported in the included studies.
Adjuvant immunotherapy with or without preceding chemotherapy
Description of studies
The IMpower010 trial (Felip, 2021; Felip, 2023) was an open-label, global trial conducted in Australia, Europe, Canada, Asia, Russian Federation, and the United States. A total of 1005 patients with resected stage IB-IIIA NSCLC (7th TNM classification) was randomized to receive adjuvant atezolizumab (16 cycles or 1 year) (n=507) or best supportive care (n=498). Both groups received up to four 21-day cycles of cisplatin-based adjuvant chemotherapy in the enrollment phase. The mean follow-up of the DFS interim analysis (Felip, 2021) was 32.2 (27.5-38.4) months. The mean follow-up of the OS interim analysis (Felip, 2023) was 45.3 months (IQR 35.5-52.3).
F Hoffmann-La Roche and Genentech were involved in designing the trial and analyzing and interpreting the data. It was noticed that three secondary outcome measures in the trial registry were not reported (details in RoB table).
The primary endpoint was disease-free survival.
The IMpower010 results presented at the ASCO 2023 were not systematically worked out, as the peer-reviewed article was not published yet at the moment of writing this module (October 2023).
The PEARLS / KEYNOTE-091 trial (O’Brien 2022) was a triple-blinded (patients, healthcare professionals, outcome assessors) RCT and conducted among centers in Australia, Europe, Canada, Asia, Russian Federation, and the United States. A total of 1177 patients with completely resected stage IB-IIIA NSCLC (7th TNM classification) was randomized to receive adjuvant pembrolizumab (up to 18 cycles) (n=590) or placebo (n=587). Adjuvant chemotherapy was recommended but not mandatory. The median follow-up was 35.6 months (IQR 27.1-45.5).
Merck Sharp & Dohme (MSD) participated in study design, data analysis, data interpretation, and writing the report. They had no role in data collection. No other plausible sources of a risk of bias were encountered.
The primary endpoint was disease-free survival.
Both trials reported on overall survival, disease-free survival and adverse events, but not on quality of life (Table 6).
Table 6. Study characteristics of RCTs on adjuvant immunotherapy
|
Trial; author, year |
Study design |
Intervention |
Control |
Outcomes |
|
PEARLS / KEYNOTE-091 (O’Brien 2022) |
RCT |
Adjuvant pembrolizumab (up to 18 cycles) preceded by adjuvant chemotherapy (optional) |
Placebo (up to 18 cycles) + adjuvant chemotherapy (optional) |
|
|
IMpower010 (Felip 2021, Felip 2023) |
RCT |
Adjuvant atezolizumab (16 cycles or 1 year) preceded by adjuvant platinum-based chemotherapy |
Best supportive care preceded by adjuvant platinum-based chemotherapy |
|
* primary endpoint
Results
Overall survival
At the moment of developing this guideline module (May 2023) the overall survival data of the IMpower010 trial was immature. The interim analysis of Felip (2021) showed that overall survival between groups was similar with 97/507 (19%) deaths in the adjuvant atezolizumab group and 90/498 (18%) deaths in the best supportive care group (HR: 1.07, 95% CI 0.80 to 1.42) (Felip 2021). The interim analysis of Felip (2023) also showed a similar overall survival between groups with 127/507 (25%) deaths in the adjuvant atezolizumab group and 124/498 (24.9%) deaths in the best supportive care group (HR: 0.995, 95% CI: 0.78 to 1.28) (Felip 2023).
Also in the PEARLS / KEYNOTE-091 trial median overall survival (and 95% CI) was not reached in either group and an HR 0.87 (95% CI 0.67 to 1.15) was reported (O’Brien 2022).
Disease-free survival
Both trials showed a better disease-free survival in the adjuvant immunotherapy group compared to control, although this difference might not be clinically relevant (HR>0.6).
The IMpower010 trial showed less disease recurrence in the adjuvant atezolizumab group (187/507, 37%) compared to the best supportive care group (212/498, 43%) (HR: 0.81, 95% CI: 0.67 to 0.99) (Felip 2021).
The PEARLS / KEYNOTE-091 trial found a median disease-free survival of 53.6 months (95% CI 39.2 to not reached) in the adjuvant pembrolizumab group compared to 42.0 months (95% CI 31.3 to not reached) (HR: 0.76, 95% CI 0.63 to 0.91) (O’Brien 2022).
Grade 3 or 4 adverse events
Among patients treated with adjuvant atezolizumab, 22% (108/495) experienced grade 3 or 4 adverse events compared to 12% (57/495) in the best supportive care group (Felip 2021). The atezolizumab-related adverse event incidences remained unchanged in the analysis by Felip 2023. The median follow-up duration of ~32 months was insufficient to report the incidence of chronic immune-related adverse events (see also the comment by Remon 2022).
With pembrolizumab, grade 3 or worse (including grade 5) treatment-related adverse events occurred in 198/590 (34%) of the participants compared to 150/587 (26%) in the placebo group (O’Brien 2022). Adverse events led to treatment discontinuation in 115 (20%) patients in the immunotherapy group. Immune-mediated adverse events and infusion reactions occurred in 226 (39%) of 580 patients in the pembrolizumab group, with 84 (37%) of them requiring steroids (see also the comment by Gangulu 2022).
Quality of life
No data on quality of life was reported in either of the studies.
Level of evidence of the literature
The level of evidence for all outcomes started at ‘high’, as the included studies were RCTs.
The level of evidence regarding the outcome overall survival was downgraded by three levels because of immature data, wide confidence intervals that include both a clinically relevant difference and no clinically relevant difference (very serious imprecision, two levels) and potential publication bias as in both trials the funders were involved in designing the study, data analysis and data interpretation (one level).
Therefore, the level of evidence was graded as very low.
The level of evidence regarding the outcome disease-free survival was downgraded by two levels because of wide confidence intervals that include both a clinically relevant difference and no clinically relevant difference (serious imprecision, one level) and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence regarding the outcome adverse events was downgraded by two levels because of the absence of blinding in one trial and immature data for long-term adverse events (risk of bias, one level), and potential publication bias (one level).
Therefore, the level of evidence was graded as low.
The level of evidence could not be graded for the outcome quality of life, as it was not reported in the included studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects of neoadjuvant or adjuvant immunotherapy in patients with early-stage (I to IIIA) pathologically confirmed non-small cell lung cancer (NSCLC)?
P: patients with early-stage (stage I to IIIA) pathologically confirmed NSCLC;
I: neoadjuvant or adjuvant (or both) immunotherapy with or without other treatment;
C: neoadjuvant or adjuvant treatment other than immunotherapy or another immunotherapy regime ;
O: overall survival, disease-free survival, event-free survival, response rate (MPR/pCR), adverse events, quality of life.
Relevant outcome measures
The guideline development group considered overall survival as a critical outcome measure for decision making, whereas disease/event-free survival, response rate, adverse events and quality of life were considered as important outcome measures for decision making. A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. The working group defined the following minimal clinically (patient) important differences. For these definitions, the PASKWIL criteria for adjuvant treatment https://www.nvmo.org/over-de-adviezen/ were used where possible, since there are no specific criteria for neoadjuvant therapy):
- Overall survival: >5% difference between the groups or >3% difference and HR <0.7, at least three years of median follow-up time
- Disease-free survival: HR <0.6
- Event-free survival: not described (not defined by PASKWIL)
- Response rate (for neoadjuvant treatment): major pathological response (MPR), pathological complete response (pCR)
- Adverse events: absolute difference <5% for lethal complications, or <25% for serious complications
- Quality of life: A minimal clinically important difference of 10 points on the quality-of-life instrument EORTC QLQ-C30 or a difference of a similar magnitude on similar, validated quality of life instruments
Search and select (Methods)
The systematic review published by Wang (2022) was used to retrieve relevant RCTs. Wang searched PubMed, Cochrane Library and Embase with relevant search terms until November 2021. The detailed search strategy is depicted in the supplemental methods (Wang, 2022). Four of the 52 included studies were considered eligible (NEOSTAR, CheckMate 816, IMpower010, PEARLS/KEYNOTE-091).
On the 24th of February 2023, we performed a systematic search for systematic reviews and RCTs about early non-small cell lung cancer and immunotherapy in the databases Embase.com and Ovid/Medline. The search resulted in 223 unique hits and we screened publications published after the search date of Wang (2022). This search yielded one additional RCT (NCT02904954).
On the 3rd of October 2023, the systematic search was updated with systematic reviews and RCTs published from the 24th of February 2023. The search resulted in 104 unique extra hits. This search yielded five additional RCTs (KEYNOTE-671, NADIM-II, TD-FOREKNOW, NeoCOAST, NCT03110978).
An overview of all excluded and ongoing trials was added as a supplement. Results published in abstracts are described in the considerations, awaiting peer-reviewed publication.
One publication was added to the body of evidence (Felip 2022), because it was considered to be a unique contribution for assessing the effect of neoadjuvant immunotherapy. This conference abstract described quality of life data of the CheckMate 816 trial not mentioned elsewhere.
Results
A total of ten studies was included in the analysis of the literature: six for neoadjuvant chemoimmunotherapy (Table 1), two for neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy (Table 2) and two for adjuvant immunotherapy (Table 3). Important study characteristics and results of all studies are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Not all described treatments were available in the Netherlands for patients with early-stage (stage I to III) NSCLC at the time of developing this guideline module (October 2023). The analysis of outcomes below is restricted to the studies with relevant available treatments (CHECKMATE-816, KEYNOTE-671, NADIM-II, PEARLS / KEYNOTE-091 and IMpower010). The results of these studies are represented in the conclusions.
Table 1 Study characteristics of RCTs on neoadjuvant chemoimmunotherapy
|
Trial (author year) |
Study design |
Intervention |
Control |
Stage (N) |
TNM |
|
CheckMate 816 (Forde 2022, Felip 2022) |
RCT (phase III) |
Neoadjuvant nivolumab (360 mg) plus platinum-doublet chemotherapy (three cycles) |
Neoadjuvant platinum-doublet chemotherapy (three cycles) |
IB or II: 127 IIIA: 228 |
7 |
|
TD-FOREKNOW* (Lei 2023) |
RCT (phase II) |
Neoadjuvant camrelizumab (200 mg) + nab-paclitaxel + platinum |
Neoadjuvant nab-paclitaxel + platinum |
IIIA: 66 IIIB: 22 |
8 |
|
NeoCOAST* (Cascone 2023) |
RCT (platform trial) (phase II) |
- Neoadj. durvalumab (1500 mg Q4W) + oleclumab (3000 mg Q2W) - Neoadj. durvalumab (1500 mg Q4W) + monalizumab (750 mg Q2W) - Neoadj. durvalumab (1500 mg Q4W) + danvatirsen (200 mg every week) |
Neoadjuvant durvalumab (1500 mg Q4W)
|
IA3: 12 IB: 14 IIA: 10 IIB: 33 IIIA: 15 |
7 |
|
NEOSTAR* (Cascone 2021, Cascone 2023, Sepesi 2023) |
RCT (platform trial) (phase II) |
Neoadjuvant nivolumab + ipilimumab |
Neoadjuvant nivolumab |
IB or II: 20 IIIA: 24 |
7 |
|
NCT03110978* (Chang 2023) |
RCT (phase II) |
Neoadjuvant nivolumab (480 mg, Q4W) + stereotactic ablative radiotherapy |
Stereotactic ablative radiotherapy |
Not reported (IA/IB/ IIA/IIB) |
8 |
|
NCT02904954* (Altorki 2021) |
RCT (phase II) |
Neoadjuvant durvalumab with stereotactic body radiotherapy |
Neoadjuvant durvalumab |
IA: 4 IB: 15 IIA: 7 IIB: 8 IIIA: 26 |
7 |
*Not available as standard care in the Netherlands (October 2023)
Table 2. Study characteristics of RCTs on neoadjuvant chemoimmunotherapy plus adjuvant immunotherapy (perioperative treatment)
|
Trial (author year) |
Study design |
Intervention |
Control |
Stage (N) |
TNM |
|
KEYNOTE-671 (Wakelee 2023) |
RCT (phase III) |
Neoadjuvant pembrolizumab (200 mg) (4 cycles) + cisplatin-based chemotherapy + adjuvant pembrolizumab (200 mg) (up to 13 cycles)
|
Neoadjuvant placebo (4 cycles) + cisplatin-based chemotherapy |
II: 239 IIIA: 442 IIIB: 116 |
8 |
|
NADIM-II (Provencio 2023) |
RCT (phase II) |
Neoadjuvant nivolumab (360 mg) + paclitaxel + carboplatin (3 cycles) + adjuvant nivolumab (480 mg) (every 4 weeks for 6 months) (optional) |
Neoadjuvant paclitaxel + carboplatin |
T1N2M0: 16 T2N2M0: 23 T3N1M0: 3 T3N2M0: 18 T4N0M0: 15 T4N1M0: 11 |
8 |
Table 3. Study characteristics of RCTs on adjuvant immunotherapy with or without preceding chemotherapy
|
Trial; author, year |
Study design |
Intervention |
Control |
Stage (N) |
TNM |
|
PEARLS / KEYNOTE-091 (O’Brien 2022) |
RCT (phase III) |
Adjuvant pembrolizumab (up to 18 cycles) + adjuvant chemotherapy (optional) |
Placebo (up to 18 cycles) + adjuvant chemotherapy (optional) |
IB: 169 II: 667 IIIA: 339 IV: 2 |
7 |
|
IMpower010 (Felip 2021, Felip 2023) |
RCT (phase III) |
Adjuvant atezolizumab (16 cycles or 1 year) preceded by adjuvant platinum-based chemotherapy |
Best supportive care preceded by adjuvant platinum-based chemotherapy |
IB: 123 IIA: 295 IIB: 174 IIIA: 413 |
7 |
Referenties
- 1 - Altorki NK, McGraw TE, Borczuk AC, Saxena A, Port JL, Stiles BM, Lee BE, Sanfilippo NJ, Scheff RJ, Pua BB, Gruden JF, Christos PJ, Spinelli C, Gakuria J, Uppal M, Binder B, Elemento O, Ballman KV, Formenti SC. Neoadjuvant durvalumab with or without stereotactic body radiotherapy in patients with early-stage non-small-cell lung cancer: a single-centre, randomised phase 2 trial. Lancet Oncol. 2021 Jun;22(6):824-835. doi: 10.1016/S1470-2045(21)00149-2. Epub 2021 May 18. PMID: 34015311.
- 2 - Awad, M. M., Forde, P. M., Girard, N., Spicer, J. D., Wang, C., Lu, S., ... & Pulla, M. P. (2023). 1261O Neoadjuvant nivolumab (N)+ ipilimumab (I) vs chemotherapy (C) in the phase III CheckMate 816 trial. Annals of Oncology, 34, S731.
- 3 - Cascone T, William WN Jr, Weissferdt A, Leung CH, Lin HY, Pataer A, Godoy MCB, Carter BW, Federico L, Reuben A, Khan MAW, Dejima H, Francisco-Cruz A, Parra ER, Solis LM, Fujimoto J, Tran HT, Kalhor N, Fossella FV, Mott FE, Tsao AS, Blumenschein G Jr, Le X, Zhang J, Skoulidis F, Kurie JM, Altan M, Lu C, Glisson BS, Byers LA, Elamin YY, Mehran RJ, Rice DC, Walsh GL, Hofstetter WL, Roth JA, Antonoff MB, Kadara H, Haymaker C, Bernatchez C, Ajami NJ, Jenq RR, Sharma P, Allison JP, Futreal A, Wargo JA, Wistuba II, Swisher SG, Lee JJ, Gibbons DL, Vaporciyan AA, Heymach JV, Sepesi B. Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial. Nat Med. 2021 Mar;27(3):504-514. doi: 10.1038/s41591-020-01224-2. Epub 2021 Feb 18. PMID: 33603241; PMCID: PMC8818318.
- 4 - Cascone T, Kar G, Spicer JD, Garcia-Campelo R, Weder W, Daniel DB, Spigel DR, Hussein M, Mazieres J, Oliveira J, Yau EH, Spira AI, Anagnostou V, Mager R, Hamid O, Cheng LY, Zheng Y, Blando J, Tan TH, Surace M, Rodriguez-Canales J, Gopalakrishnan V, Sellman BR, Grenga I, Soo-Hoo Y, Kumar R, McGrath L, Forde PM. Neoadjuvant Durvalumab Alone or Combined with Novel Immuno-Oncology Agents in Resectable Lung Cancer: The Phase 2 NeoCOAST Platform Trial. Cancer Discov. 2023 Sep 14. doi: 10.1158/2159-8290.CD-23-0436. Epub ahead of print. PMID: 37707791.
- 5 - Cascone, T., Awad, M. M., Spicer, J. D., He, J., Lu, S., Sepesi, B., ... & Pulla, M. P. (2023). LBA1 CheckMate 77T: Phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage II–IIIb NSCLC. Annals of Oncology, 34, S1295.
- 6 - Chang JY, Lin SH, Dong W, Liao Z, Gandhi SJ, Gay CM, Zhang J, Chun SG, Elamin YY, Fossella FV, Blumenschein G, Cascone T, Le X, Pozadzides JV, Tsao A, Verma V, Welsh JW, Chen AB, Altan M, Mehran RJ, Vaporciyan AA, Swisher SG, Balter PA, Fujimoto J, Wistuba II, Feng L, Lee JJ, Heymach JV. Stereotactic ablative radiotherapy with or without immunotherapy for early-stage or isolated lung parenchymal recurrent node-negative non-small-cell lung cancer: an open-label, randomised, phase 2 trial. Lancet. 2023 Sep 9;402(10405):871-881. doi: 10.1016/S0140-6736(23)01384-3. Epub 2023 Jul 18. Erratum in: Lancet. 2023 Sep 9;402(10405):850. PMID: 37478883; PMCID: PMC10529504.
- 7 - Das M, Ogale S, Jovanoski N, Johnson A, Nguyen C, Bhagwakar J, Lee JS. Cost-effectiveness of adjuvant atezolizumab for patients with stage II-IIIA PD-L1+ non-small-cell lung cancer. Immunotherapy. 2023 Jun;15(8):573-581. doi: 10.2217/imt-2022-0311. Epub 2023 Apr 6. PMID: 37021770; PMCID: PMC10334222.
- 8 - Felip E, Wang C, Ciuleanu, Saylors G, Tanaka F, Chen K-N, et al. 32MO Nivolumab (NIVO) plus platinum-doublet chemotherapy (chemo) versus chemo as neoadjuvant treatment for resectable non-small cell lung cancer (NSCLC): Health-related quality of life (HRQoL) outcomes from CheckMate 816. Annals of Oncol. 2022 Sept;33, Supp 7, S973-S974. DOI:https://doi.org/10.1016/j.annonc.2022.07.1058.
- 9 - Felip, E., Wang, C., Ciuleanu, T. E., Saylors, G., Tanaka, F., Chen, K. N., ... & Spicer, J. (2022). 932MO Nivolumab (NIVO) plus platinum-doublet chemotherapy (chemo) versus chemo as neoadjuvant treatment for resectable non-small cell lung cancer (NSCLC): Health-related quality of life (HRQoL) outcomes from CheckMate 816. Annals of Oncology, 33, S973-S974.
- 10 - Felip E, Altorki N, Zhou C, Vallières E, Martínez-Martí A, Rittmeyer A, Chella A, Reck M, Goloborodko O, Huang M, Belleli R, McNally V, Srivastava MK, Bennett E, Gitlitz BJ, Wakelee HA. Overall survival with adjuvant atezolizumab after chemotherapy in resected stage II-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase III trial. Ann Oncol. 2023 Oct;34(10):907-919. doi: 10.1016/j.annonc.2023.07.001. Epub 2023 Jul 17. PMID: 37467930.
- 11 - Forde PM, Spicer J, Lu S, Provencio M, Mitsudomi T, Awad MM, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022 May 26;386(21):1973-1985. doi: 10.1056/NEJMoa2202170. Epub 2022 Apr 11. PMID: 35403841; PMCID: PMC9844511.
- 12 - Ganguly S, Gogia A. Pembrolizumab as adjuvant therapy in non-small-cell lung cancer. Lancet Oncol. 2022 Dec;23(12):e528. doi: 10.1016/S1470-2045(22)00652-0. PMID: 36455577.
- 13 - van de Haar J, Mankor JM, Hummelink K, Monkhorst K, Smit EF, Wessels LFA, Cuppen E, Aerts JGJV, Voest EE. Combining Genomic Biomarkers to Guide Immunotherapy in Non-Small Cell Lung Cancer. Clin Cancer Res. 2024 Apr 1;30(7):1307-1318. doi: 10.1158/1078-0432.CCR-23-4027. PMID: 38300729; PMCID: PMC10982639.
- 14 - Houda I, Dickhoff C, Uyl-de Groot CA, Reguart N, Provencio M, Levy A, Dziadziuszko R, Pompili C, Di Maio M, Thomas M, Brunelli A, Popat S, Senan S, Bahce I. New systemic treatment paradigms in resectable non-small cell lung cancer and variations in patient access across Europe. Lancet Reg Health Eur. 2024 Mar 4;38:100840. doi: 10.1016/j.lanepe.2024.100840. PMID: 38476748; PMCID: PMC10928304.
- 15 - Lei J, Zhao J, Gong L, Ni Y, Zhou Y, Tian F, Liu H, Gu Z, Huang L, Lu Q, Wang X, Sun J, Yang E, Wang T, Zhong D, Wang J, Zhao Z, Liu Z, Wang C, Wang X, Lei G, Yan X, Jiang T. Neoadjuvant Camrelizumab Plus Platinum-Based Chemotherapy vs Chemotherapy Alone for Chinese Patients With Resectable Stage IIIA or IIIB (T3N2) Non-Small Cell Lung Cancer: The TD-FOREKNOW Randomized Clinical Trial. JAMA Oncol. 2023 Oct 1;9(10):1348-1355. doi: 10.1001/jamaoncol.2023.2751. PMID: 37535377; PMCID: PMC10401395.
- 16 - O'Brien M, Paz-Ares L, Marreaud S, Dafni U, Oselin K, Havel L, et al. Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol. 2022 Oct;23(10):1274-1286. doi: 10.1016/S1470-2045(22)00518-6. Epub 2022 Sep 12. PMID: 36108662.
- 17 - Olivier T, Prasad V. Neoadjuvant checkpoint inhibition in non-small cell lung cancer: Is earlier unquestionably better than later? Transl Oncol. 2022 Oct;24:101505. doi: 10.1016/j.tranon.2022.101505. Epub 2022 Aug 4. PMID: 35953223; PMCID: PMC9381437.
- 18 - Provencio M, Nadal E, González-Larriba JL, Martínez-Martí A, Bernabé R, Bosch-Barrera J, Casal-Rubio J, Calvo V, Insa A, Ponce S, Reguart N, de Castro J, Mosquera J, Cobo M, Aguilar A, López Vivanco G, Camps C, López-Castro R, Morán T, Barneto I, Rodríguez-Abreu D, Serna-Blasco R, Benítez R, Aguado de la Rosa C, Palmero R, Hernando-Trancho F, Martín-López J, Cruz-Bermúdez A, Massuti B, Romero A. Perioperative Nivolumab and Chemotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Aug 10;389(6):504-513. doi: 10.1056/NEJMoa2215530. Epub 2023 Jun 28. PMID: 37379158.
- 19 - Remon J, Besse B. Adjuvant immunotherapy for NSCLC - does treating earlier mean treating better? Nat Rev Clin Oncol. 2022 Jan;19(1):7-8. doi: 10.1038/s41571-021-00574-1. PMID: 34707252.
- 20 - Sepesi B, Zhou N, William WN Jr, Lin HY, Leung CH, Weissferdt A, Mitchell KG, Pataer A, Walsh GL, Rice DC, Roth JA, Mehran RJ, Hofstetter WL, Antonoff MB, Rajaram R, Negrao MV, Tsao AS, Gibbons DL, Lee JJ, Heymach JV, Vaporciyan AA, Swisher SG, Cascone T. Surgical outcomes after neoadjuvant nivolumab or nivolumab with ipilimumab in patients with non-small cell lung cancer. J Thorac Cardiovasc Surg. 2022 Nov;164(5):1327-1337. doi: 10.1016/j.jtcvs.2022.01.019. Epub 2022 Jan 23. PMID: 35190177; PMCID: PMC10228712.
- 21 - Spicer, J. D., Gao, S., Liberman, M., Kato, T., Tsuboi, M., Lee, S. H., ... & Wakelee, H. (2023). LBA56 Overall survival in the KEYNOTE-671 study of perioperative pembrolizumab for early-stage non-small-cell lung cancer (NSCLC). Annals of Oncology, 34, S1297-S1298.
- 22 - Wakelee H, Liberman M, Kato T, Tsuboi M, Lee SH, Gao S, Chen KN, Dooms C, Majem M, Eigendorff E, Martinengo GL, Bylicki O, Rodríguez-Abreu D, Chaft JE, Novello S, Yang J, Keller SM, Samkari A, Spicer JD; KEYNOTE-671 Investigators. Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Aug 10;389(6):491-503. doi: 10.1056/NEJMoa2302983. Epub 2023 Jun 3. PMID: 37272513.
- 23 - Wang Y, Li C, Wang Z, Wang Z, Wu R, Wu Y, Song Y, Liu H. Comparison between immunotherapy efficacy in early non-small cell lung cancer and advanced non-small cell lung cancer: a systematic review. BMC Med. 2022 Nov 7;20(1):426. doi: 10.1186/s12916-022-02580-1. PMID: 36345004; PMCID: PMC9641944.
Evidence tabellen
Evidence table for intervention studies
Research question: What are the effects of neoadjuvant or adjuvant immunotherapy in patients with early-stage (I to III) pathologically confirmed non-small cell lung cancer (NSCLC)?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
KEYNOTE-671 (Wakelee, 2023) |
Phase III RCT
North America, South America, Australia, Europe, Asia and Africa
Funding: Merck Sharp and Dohme. Disclosure forms of the authors are provided with the article.
|
Inclusion criteria: - at least 18 years of age stage II, IIIA, or IIIB (with involvement of ≥1 ipsilateral mediastinal lymph node or subcarinal lymph node [N2 node stage]) NSCLC as assessed according to the American Joint Committee on Cancer staging system, 8th edition that was considered to be resectable after surgical consultation and investigator assessment Oncology Group performance-status score of 0 or 1within 10 days before randomization - an ability to provide a tumor sample for PD-L1 assessment at a central laboratory.
(exclusion criteria in protocol)
N total at baseline: Intervention: 397 Control: 400
Important prognostic factors2: I: 63 (26-83) C: 64 (35-81)
Sex: I: 70% M C: 71% M
Groups comparable at baseline? Yes
|
Neoadjuvant pembrolizumab plus cisplatin-based chemotherapy 4 cycles of pembrolizumab (200 mg) given intravenously once every 3 weeks and 4 cycles of neoadjuvant chemotherapy with either cisplatin and gemcitabine (squamous histologic features) or cisplatin and pemetrexed (nonsquamous histologic features) followed by surgery and adjuvant pembrolizumab (200 mg) once every 3 weeks for up to 13 cycles. |
Neoadjuvant placebo plus cisplatin-based chemotherapy 4 cycles of placebo given intravenously once every 3 weeks and 4 cycles of neoadjuvant chemotherapy with either cisplatin and gemcitabine (squamous histologic features) or cisplatin and pemetrexed (nonsquamous histologic features) followed by surgery and placebo once every 3 weeks for up to 13 cycles. |
Length of follow-up: median follow-up: 25.2 months (range 7.5 to 50.6)
Follow-up: Intervention: 396 participants received at least one dose of neoadjuvant pembrolizumab plus chemotherapy for a median of four cycles; among these participants, 325 (82.1%) underwent in-trial surgery, and 290 (73.2%) received at least one dose of adjuvant pembrolizumab. Control: 399 participants received at least one dose of neoadjuvant placebo plus chemotherapy for a median of four cycles; of these, 317 (79.4%) underwent intrial surgery, and 267 (66.9%) received at least one dose of adjuvant placebo.
Treatment-related adverse events leading to discontinuation of all trial treatment: Intervention: 12.6%
Incomplete outcome data: Intervention: Not reported
Control: Not reported
|
Median event-free survival I: not reached (95% CI: 34.1 to not reached) HR: 0.58 (95% CI: 0.46-0.72) (in favor of pembrolizumab group)
Percentage alive without event 24 months I: 62.4% (95% CI: 56.8-67.5) C: 40.6 (95% CI: 34.8-46.3)
Median overall survival I: not reached C: 45.5 months (95% CI: 42.0 to not reached)
Percentage alive 24 months I: 80.9% (95% CI: 76.2-84.7) C: 77.6% (95% CI: 72.5-81.9)
MPR I: 120/397 (30.2%, 95% CI: 25.7-35.0) C: 44/400 (11.0%, 95% CI: 8.1-14.5) Difference: 19.2% (95% CI: 13.9 to 24.7)
pCR I: 72/397 (18.1%, 95% CI: 14.5-22.3) C: 16/400 (4%, 95% CI: 2.3-6.4) p<0.0001
Grade 3 or 4 adverse events I: 178/396 (44.9%) |
Authors conclusion: The addition of pembrolizumab to neoadjuvant cisplatin-based chemotherapy, followed by surgical resection and adjuvant pembrolizumab therapy, led to a significant improvements in eventfree survival, major pathological response, and pathological complete response among participants with resectable stage II, IIIA, or IIIB (N2 stage) NSCLC.
The limitations and possible biases mentioned for the CheckMate 816 trial (Olivier 2022) were also considered applicable for the KEYNOTE-671 trial. |
|
NADIM-II (Provencio, 2023) |
Phase II RCT (open-label)
Spain
Funding: Bristol Myers Squibb and others. Disclosure forms of the authors are provided with the article. |
Inclusion criteria: - 18 years of age or older eighth edition of the AJCC Cancer Staging Manual) that was deemed to be surgically resectable by a multidisciplinary tumor board Oncology Group performance-status score of 0 or 1 disease according to Response Evaluation Criteria in Solid Tumors (RECIST), version 1.1.
Exclusion criteria: - nodal stage N3 disease
N total at baseline: Intervention: 57 Control: 29
Important prognostic factors2: Median age (IQR): I: 65 (58-70) C: 63 (57-66)
Sex: I: 63% M C: 55% M
Groups comparable at baseline? Yes |
Neoadjuvant nivolumab + paclitaxel + carboplatin Nivolumab (360 mg), paclitaxel (200 mg per square meter of body-surface area), and carboplatin (area under the concentration–time curve, 5 mg per milliliter per minute) as neoadjuvant treatment every 21 days (with a window of ±3 days) for three cycles. also received adjuvant treatment with nivolumab at a dose of 480 mg once every 4 weeks (with a window of ±3 days) for 6 months. This was followed by surgery and three observation visits.
|
Neoadjuvant paclitaxel + carboplatin body-surface area), and carboplatin (area under the concentration–time curve, 5 mg per milliliter per minute) as neoadjuvant treatment every 21 days (with a window of ±3 days) for three cycles. This was followed by surgery and three observation visits. |
Length of follow-up: median follow-up: 26.1 months (IQR 17.4-30.9)
Follow-up: A total of 81 patients (94%) completed the planned neoadjuvant treatment according to the protocol. The reasons for discontinuation of neoadjuvant treatment are provided the supplemental content.
Treatment-related adverse events leading to discontinuation of all trial treatment: Intervention: N=4
Incomplete outcome data: Intervention: Not reported.
Control: Not reported.
|
Overall survival C: 63.3% (95% CI: 47.8-84.6)
Progression-free survival 24 months I: 67.2% (95% CI: 55.8-81.0) C: 40.9% (95% CI: 26.2-63.6) HR=0.47 (95% CI: 0.25-0.88)
pCR C: 2/29 (7%, 95% CI: 1-23)
MPR I: 53% (95% CI: 39-66) C: 14% (95% CI: 4-32) RR=3.82 (95% CI: 1.49-9.79)
OR C: 48% (95% CI: 29-67)
Grade 3 or 4 adverse events |
Authors conclusion: Perioperative treatment with chemotherapy and nivolumab resulted in a higher percentage of patients with a pathological complete response and a higher percentage of patients undergoing resection than chemotherapy alone. Survival outcomes were also better with chemotherapy and nivolumab than with chemotherapy alone.
The limitations and possible biases mentioned for the CheckMate 816 trial (Olivier 2022) were also considered applicable for the NADIM-II trial. |
|
CheckMate 816 (Forde, 2022) |
Phase III RCT (open-label)
Argentina, Brazil, Canada, China, France, Greece, Hungary, Italy, Japan, Korea, Republic of, Romania, Spain, Taiwan, Turkey, United States
Funding: Bristol Myers Squibb (sponsoring, designing trial, analyzing data). Individual disclosure forms are provided with the article. |
Inclusion criteria: - adults with resectable stage IB (≥4 cm) to IIIA NSCLC (according to the staging criteria of the American Joint Committee on Cancer, 7th edition) - an Eastern Cooperative Oncology Group performance-status score of 0 or 1 - no previous anticancer therapy - measurable disease according to the Response Evaluation Criteria in Solid Tumors, version 1.1 - pretreatment tumor tissue available to assess the expression of programmed death ligand 1 (PD-L1)
Exclusion criteria: - known ALK translocations or EGFR mutations
N total at baseline: Intervention: 179 Control: 179
Important prognostic factors2: Age (median (range)): I: 64 (41-82) C: 65 (34-84)
Sex: I: 72% M C: 71% M
Groups comparable at baseline? Yes
|
Neoadjuvant nivolumab (360 mg) plus platinum-doublet chemotherapy. Surgery was planned to occur within 6 weeks after the completion of neoadjuvant treatment, after which patients could receive up to four cycles of adjuvant chemotherapy, radiotherapy, or both. |
Neoadjuvant platinum-doublet chemotherapy alone (every 3 weeks for three cycles). Surgery was planned to occur within 6 weeks after the completion of neoadjuvant treatment, after which patients could receive up to four cycles of adjuvant chemotherapy, radiotherapy, or both. |
Length of follow-up: minimum follow-up: 21 months median follow-up: 29.5 months
Follow-up: Intervention: 14 (8%) --> 3 did not receive assigned treatment 2 no longer met study criteria
11 discontinued treatment 10 had study drug toxicity 1 had disease progression
Control: 30 (17%) --> 3 did not receive assigned treatment 2 withdrew consent 1 no longer met study criteria
27 discontinued treatment 2 had disease progression 12 had study drug toxicity 3 had unrelated adverse event 4 withdrew consent 5 was withdrawn by patient request 1 no longer met study criteria
Incomplete outcome data: Intervention: 165 (92%) completed treatment
Control: 149 (83%) completed treatment 179 (100%) had efficacy analyzed 176 (98%) had safety analyzed |
Median event-free survival I: 31.6 months (95% CI: 30.2-not reached) C: 20.8 months (95% CI: 14.0-26.7) HR: 0.63 (97.38% CI: 0.43-0.91) p=0.005 (in favor of nivolumab plus chemotherapy)
Pathological complete response I: 24.0% (95% CI: 18.0-31.0) C: 2.2% (95% CI: 0.6-5.6) OR: 13.94 (99% CI: 3.49-55.75) p<0.001 (in favor of nivolumab plus chemotherapy)
Major pathological response I: 36.9% (95% CI: 29.8-44.4) C: 8.9% (95% CI: 5.3-14.1) OR: 5.70 (95% CI: 3.16-10.26) (in favor of nivolumab plus chemotherapy)
Median overall survival I: not reached C: not reached HR: 0.57 (99.67% CI: 0.30-1.07)
Grade 3 or 4 adverse events I: 72/179 (41%) C: 77/179 (44%)
|
Authors conclusion: Neoadjuvant nivolumab plus chemotherapy had a significant benefit over chemotherapy alone with respect to event-free survival and pathological complete response and had no adverse effect on surgical feasibility or surgical outcomes.
Note: A third group that received nivolumab (3 mg per kilogram of body weight every 2 weeks for three cycles) plus ipilimumab (1 mg per kilogram, cycle 1 only) closed enrollment early on the basis of external trial data reported during the trial (NADIM, NEOSTAR, KEYNOTE-021).
Besides the methodological limitations encountered in the risk of bias assessment, some additional remarks about the CheckMate 816 trial were observed by Olivier 2022:
|
|
IMpower010 (Felip, 2021; Felip 2023) |
Phase III RCT (open-label)
Australia, Belgium, Canada, China, France, Germany, Hong Kong, Hungary, Israel, Italy, Japan, Korea, Republic of, Netherlands, Poland, Portugal, Romania, Russian Federation, Spain, Taiwan, Ukraine, United Kingdom, United States
Funding: F Hoffmann-La Roche and Genentech (sponsoring, providing study drugs, collaborating on study design and collection, analysis and interpretation)
All authors report editorial support from F Hoffmann-La Roche. Individual declarations of interests are provided in the article.
|
Inclusion criteria: - 18 years or older - an Eastern Cooperative Oncology Group (ECOG) performance status of 0 or 1 - completely resected stage IB (tumours ≥4 cm) to IIIA (T2–3 N0, T1–3 N1, T1–3 N2, and T4 N0–1 NSCLC, per the Union Internationale Contre le Cancer and American Joint Committee on Cancer staging system, 7th edition) - able to receive cisplatin-based chemotherapy (additional criteria in article appendix)
Exclusion criteria: - pregnant and lactating women - treatment with prior systemic chemotherapy at any time - hormonal cancer therapy or radiation therapy as prior cancer treatment within 5 years before enrollment (additional criteria in article appendix)
N total at baseline: Intervention: 507 Control: 498
Important prognostic factors2: Age (median (IQR)): I: 62 (57-67) C: 62 (56-68)
Sex: I: 66% M C: 67% M
Groups comparable at baseline? Yes
|
Enrollment Phase: Up to four 21-day cycles of cisplatin-based adjuvant chemotherapy (cisplatin plus either vinorelbine or docetaxel or gemcitabine or pemetrexed [non-squamous cell NSCLC only]), unless unacceptable toxicity, disease relapse, or participant's decision to discontinue occur.
Randomization Phase: Adjuvant atezolizumab 1200 milligrams (mg) intravenously (IV) every 3 weeks (Q3W) for up to sixteen 21-day cycles and periodic chest X-ray and CT scan. |
Enrollment Phase: Up to four 21-day cycles of cisplatin-based adjuvant chemotherapy (cisplatin plus either vinorelbine or docetaxel or gemcitabine or pemetrexed [non-squamous cell NSCLC only]), unless unacceptable toxicity, disease relapse, or participant's decision to discontinue occur.
Randomization Phase: Best supportive care (periodic chest X-ray and CT scan). |
Length of follow-up: DFS interim analysis 32.2 (27.5-38.4) months
Follow-up: Intervention: 184 (36%) --> 12 did not receive assigned treatment 11 withdrew
172 discontinued treatment 92 adverse events 55 disease relapse 22 withdrew 2 protocol deviations 1 withdrawn by physician
Control: 125 (25%) --> 3 did not receive assigned treatment 2 withdrew 1 protocol deviation
122 discontinued treatment 90 disease relapse 18 withdrew 5 adverse events 3 protocol deviations 3 withdrawn by physician 1 lost to follow-up 2 other reasons
Incomplete outcome data: Intervention: Not reported; 323 completed treatment.
Control: Not reported; 373 completed treatment.
|
DFS interim analysis (Felip 2021)
Disease-free survival I: 187/507 (37%) events C: 212/498 (43%) events HR: 0.81 (95% CI: 0.67-0.99) (in favor of atezolizumab) Overall survival I: 97/507 (19%) events C: 90/498 (18%) events
Grade 3 or 4 adverse events I: 108/495 (22%) C: 57/495 (12%)
Grade 5 adverse events
OS interim analysis (Felip 2023)
Overall survival C: 124/498 (24.9%) events
Grade 3 or 4 adverse events I: 53 (10.7%)
Grade 5 adverse events |
Authors conclusion: Adjuvant atezolizumab was associated with significant improvement in disease-free survival versus best supportive care after adjuvant chemotherapy in the stage II-IIIA population with tumours expressing PD-L1 on 1% or more of tumour cells and in all patients in the stage II-IIIA population. |
|
PEARLS / KEYNOTE-091 (O’Brien, 2022) |
Phase III RCT
Australia, Austria, Belgium, Brazil, Canada, Chile, Czechia, Denmark, Estonia, France, Germany, Greece, Hungary, Ireland, Israel, Italy, Japan, Korea, Republic of, Latvia, Netherlands, Peru, Poland, Portugal, Russian Federation, Slovenia, Spain, Switzerland, Turkey, United Kingdom
Funding: Merck Sharp & Dohme, a subsidiary of Merck & Co. The funder of the study, in collaboration with representatives of the EORTC Lung Cancer Group and ETOP, participated in study design, data analysis, data interpretation, and writing of this report. The funder had no role in data collection. Individual declarations of interests are provided in the article. |
Inclusion criteria: - 18 years or older - no evidence of disease on clinical examination and radiographic assessment per Response Evaluation Criteria in Solid Tumours (RECIST) version 1.1,12
Exclusion criteria: - previous neoadjuvant or adjuvant radiotherapy for the current malignancy - a history of HIV (additional criteria in article appendix)
N total at baseline: Intervention: 590 Control: 587
Important prognostic factors2: Age (median (IQR)): I: 65 (59-70) C: 65 (59-70)
Sex: I: 68% M C: 69 % M
Groups comparable at baseline? Yes
|
Adjuvant pembrolizumab 200 mg administered intravenously once every 3 weeks until recurrence assessed per RECIST version 1.112 by investigator review, new malignancy, unacceptable toxicity, investigator decision, consent withdrawal, completion of 18 administrations (approximately 1 year of treatment), or other reason. |
Saline placebo administered intravenously once every 3 weeks until recurrence assessed per RECIST version 1.112 by investigator review, new malignancy, unacceptable toxicity, investigator decision, consent withdrawal, completion of 18 administrations (approximately 1 year of treatment), or other reason. |
Length of follow-up: median follow-up: 35.6 months (IQR 27.1-45.5)
Follow-up: Intervention: 290 (49%) --> 4 ineligible 5 participant decision not related to toxicity
280 discontinued treatment 131 adverse events 46 participant decision not related to toxicity 18 investigator decision 5 other malignancy 3 lost to follow-up 3 other reason 1 administrative reasons 1 ineligible
Control: 206 (35%) --> 1 ineligible 3 participant decision not related to toxicity 2 recurrence, relapse, or death due to progressive disease
200 discontinued treatment 127 progressive disease 28 adverse event 21 participant decision not related to toxicity 13 investigator decision 8 other malignancy 2 other reason 1 administrative reason
Incomplete outcome data: Intervention: Not reported; 300 (52%) completed treatment.
Control: Not reported; 381 (66%) completed treatment. |
Median DFS I: 53.6 months (95% CI: 39.2 to not reached) C: 42.0 months (95% CI: 31.3 to not reached) (in favor of pembrolizumab)
Median OS I: not reached C: not reached HR: 0.87 (95% CI: 0.67-1.15) p=0.17 (in favor of pembrolizumab)
I: 98/590 (17%) deaths C: 111/587 (19%) deaths
Grade 3 or worse adverse events I: 198/590 (34%) C: 150/587 (26%)
|
Authors conclusion: Pembrolizumab monotherapy provided a significant and clinically meaningful improvement in disease-free survival compared with placebo after complete resection and, when recommended per guidelines, adjuvant chemotherapy in the overall population of participants with stage IB (tumours of ≥4 cm in diameter)– IIIA NSCLC. The difference in disease-free survival in the PD-L1 TPS of 50% or greater population was not significant at this interim analysis. The safety profile observed was consistent with the known safety profile of pembrolizumab, with no new adverse events. These data suggest adjuvant pembrolizumab is potentially a new treatment option for this population, regardless of PD-L1 expression. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What are the effects of neoadjuvant or adjuvant immunotherapy in patients with early-stage (I to III) pathologically confirmed non-small cell lung cancer (NSCLC)?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
KEYNOTE-671 (Wakelee, 2023) |
Definitely yes;
Reason: Randomization was performed with an interactive response system. |
Probably yes;
Reason: Randomization was done centrally. Allocation concealment was probably covered by the interactive response system. |
Definitely yes;
Reason: Double blind trial |
Probably yes;
Reason: Loss to follow-up was not reported.
There are no signs of unequal loss to follow-up in the two groups. |
Probably yes;
Reason: Most predefined outcome measures (in the trial registry) were reported. Only Quality of Life (secondary outcome) was not reported. |
Probably no;
Reason: Merck Sharp and Dohme was involved in the trial design and oversight. |
Some concerns |
|
NADIM-II (Provencio, 2023) |
No information. |
No information. |
Definitely no;
Reason: Open-label trial
However, outcomes were evaluated by blinded independent review. |
Probably yes;
Reason: Loss to follow-up was not reported.
There are no signs of unequal loss to follow-up in the two groups. |
Definitely yes;
Reason: The predefined primary outcome measure (in the trial registry) was reported. |
Probably yes;
Reason: The trial funders had no role in the design of the trial; the collection, analysis, or interpretation of the data; or the writing of the manuscript. |
HIGH |
|
CheckMate 816 (Forde, 2022) |
Definitely yes;
Reason: Randomization was done with the Interactive Response Technology (IRT) (as described in the protocol). |
Probably yes;
Reason: Allocation concealment was not described, but probably covered by the IRT system. |
Definitely no;
Reason: Open-label trial
However, outcomes were evaluated by blinded independent review. |
Probably yes;
Reason: Loss to follow-up was not reported.
The percentage of participants for whom efficacy and safety were analyzed was similar between both groups.
|
Definitely yes;
Reason: All predefined outcome measures (in the trial registry) were reported.
|
Definitely no;
Reason: Bristol Myers Squibb was involved in designing the trial and analyzing data. |
HIGH |
|
PEARLS / KEYNOTE-091 (O’Brien, 2022) |
Definitely yes;
Reason: Randomization was done with a central interactive voice-response system. |
Definitely yes;
Reason: Randomization numbers were scrambled to ensure concealment of treatment assignment. |
Definitely yes;
Reason: Triple-blind design |
Probably yes;
Reason: Three participants were lost to follow-up (intervention arm), but this did not result in a significant difference in percentage of missing outcome data between the two groups. |
Definitely yes;
Reason: All predefined outcome measures (in the trial registry) were reported.
|
Definitely no;
Reason: The funder of the study participated in study design, data analysis, data interpretation, and writing the report. The funder had no role in data collection. |
Some concerns |
|
IMpower010 (Felip, 2021; Felip, 2023) |
Definitely yes;
Reason: Randomization was done with an interactive voice-web response system. |
Probably yes;
Reason: Allocation concealment was not described, but probably covered by the voice-web response system. |
Definitely no;
Reason: Open-label trial
|
Definitely yes;
Reason: Only one participant was lost to follow-up (control arm). |
Probably no;
Reason: Three secondary outcome measures in the trial registry were not reported (percentage of participants with ATAs to atezolizumab, Cmax of atezolizumab, Cmin at steady-state within a dosing interval of atezolizumab). |
Definitely no;
Reason: F Hoffmann-La Roche and Genentech collaborated on study design and collection and data analysis and interpretation.
|
HIGH |
Table of excluded and ongoing studies
Last update: October 2023
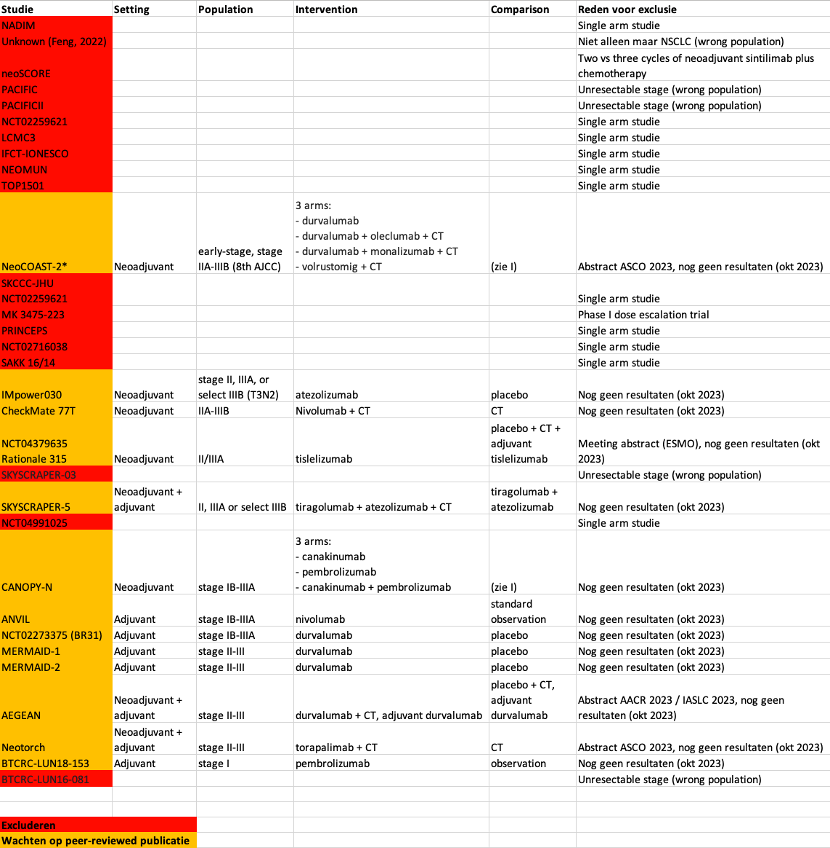
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-01-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met niet kleincellig longcarcinoom. Deze werkgroep is ingesteld in het kader van het cluster longoncologie.
Werkgroep
• dr. A. (Annemarie) Becker (voorzitter), Longarts, Amsterdam UMC, NVALT
• dr. A.J. (Anthonie) van der Wekken, Longarts, UMCG, NVALT
• dr. A. (Annemarieke) Bartels – Rutten, Radioloog, AVL, NVvR
• prof. dr. V. (Volkher) Scharnhorst, Klinisch chemicus, Catharina Ziekenhuis, NVKC
• prof. dr. E.F.I. (Emile) Comans, Nucleaire geneeskundige, Amsterdam UMC, NVNG
• prof. dr. J.J.C. (Joost) Verhoeff, Radiotherapeut-Oncoloog, Amsterdam UMC, NVRO
• prof. dr. J. (Jerry) Braun, Hoogleraar Cardio-thoracale chirurgie, LUMC, NVT
• dr. K.J. (Koen) Hartemink, Chirurg, AVL, NVvH
• dr. R.A.M. (Ronald) Damhuis, Arts-onderzoeker, IKNL
• drs. L.A. (Lidia) Barberio, Directeur Longkanker Nederland
• dr. B.J.M. (Bas) Peters, Ziekenhuisapotheker, St. Antonius Ziekenhuis, NVZA
• dr. R. (Rob) ter Heine, Ziekenhuisapotheker- klinisch farmacoloog, Radboudumc, NVZA
• drs. D.C.M. (Desirée) Verheijen, Klinisch geriater, ZGV, NVKG
• dr. J.H. (Jan) von der Thüsen, Patholoog, Erasmus MC, NVVP
• dr. W. (Wouter) van Geffen, Longarts, MCL, NVALT
• dr. L.E.L. (Lizza) Hendriks, Longarts, MUMC+, NVALT
• dr. A. (Arifa) Moons-Pasic, Longarts, OLVG, NVALT
• dr. I. (Idris) Bahce, Longarts, Amsterdam UMC, NVALT
• prof. dr. E. (Ed) Schuuring, Hoogleraar in de Moleculaire Oncologische Pathologie, UMCG, NVVP
• dr. J.M.J. (Josephine) Stoffels, Internist Ouderengeneeskunde, NIV
• dr. J.W. (Joost) van den Berg, Internist Ouderengeneeskunde i.o., NIV
In het kader van het cluster longoncologie
Met ondersteuning van
• dr. J.S. (Julitta) Boschman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot december 2023)
• M.L. (Miriam) te Lintel Hekkert, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• dr. L.C. (Lisanne) Verbruggen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• dr. D. (Dagmar) Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• A. (Alies) Oost, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de volgende clustercyclus.
De NVALT heeft vastgesteld dat het niet mogelijk was werkgroepleden af te vaardigen met voldoende expertise zonder potentiële belangenverstrengeling. Het gaat daarbij met name om werkgroepleden die deelnemen aan adviesraden/kennisuitwisselingsbijeenkomsten met de farmaceutische industrie. Gedurende de ontwikkeling van de modules heeft daarom afstemming plaatsgevonden tussen de werkgroepvoorzitter, de belangencommissie van het Kennisinstituut van de Federatie Medisch Specialisten en de NVALT over passende acties naar aanleiding van de gemelde belangen.
Restricties voor de modules over onderwerpen (medicamenteuze behandeling) waar de adviesraden betrekking op hebben:
• Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module;
• Werkgroeplid werkt tenminste samen met een werkgroeplid met een vergelijkbare expertise in alle fasen (zoeken, studieselectie, data-extractie, evidence synthese, Evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces. Indien nodig worden werkgroepleden toegevoegd aan de werkgroep;
• In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken;
• Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen).
Aansluitend op de reguliere commentaarronde bij de achterban van de bij de richtlijn betrokken wetenschappelijke verenigingen, hebben (een aantal) leden van de richtlijn- en kwaliteitscommissie van de NVALT en een methodoloog van het Kennisinstituut die niet betrokken waren bij ontwikkeling van de modules, aanvullend beoordeeld of de aanbevelingen logischerwijs aansluiten bij het gevonden bewijs en de overwegingen, om de onafhankelijkheid van de richtlijn te waarborgen.
Wellicht ten overvloede willen wij erop wijzen dat medisch specialistische richtlijnen niet worden vastgesteld door de betreffende richtlijnwerkgroep maar door de besturen/ledenvergadering van de betrokken verenigingen.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Ondernomen actie |
|
Becker |
Longarts Amsterdam UMC |
Geen |
Extern gefinancierd onderzoek: SYMPRO studie Project over beeldvorming in de follow-up na behandeling voor longkanker gaat nog starten (gefinancierd door ZIN) |
geen |
|
Bartels-Rutten |
Radioloog, NKI-AVL (betaald) |
Geen |
Geen |
geen |
|
van der Wekken |
UMCG - longarts |
Geen |
Extern gefinancierd onderzoek: Lid bestuur Sectie oncologie NVALT Lid dure geneesmiddelen commissie NVALT Lid Cie Geneesmiddelen FMS Specialisten panel Longkanker Nederland Consortium partner 3D modeling in MTB Adviesraden voor UMCG bij Lilly, Astra Zeneca, Roche, Janssen |
restricties |
|
Comans |
Nucleair geneeskundige HMC Den Haag (0.6 FTE) |
Hoogleraar nucleaire geneeskunde Amsterdam UMC lokatie VUmc (0.4 FTE). |
Geen |
geen |
|
Braun |
Hoogleraar Cardio-thoracale Chirurgie, Leids Universitair Medisch Centrum en Amsterdams Universitair Medisch Centrum. |
Lid bestuur Nederlandse Vereniging voor Thoraxchirurgie (onbetaald). |
Geen |
geen |
|
Verhoeff |
Radiation oncologist and professor of radiotherapy at the Amsterdam UMC |
Niet van toepassing |
Extern gefinancierd onderzoek: 1. STOPSTORM H2020, bestraling van hartritmestoornissen |
geen |
|
Hartemink |
Chirurg NKI-AVL, Amsterdam |
Onbetaald: |
KWF-grant ontvangen (2021) voor het doen van onderzoek naar radiotherapie en chirurgie bij het vroeg-stadium NSCLC. |
geen |
|
Scharnhorst |
Klinisch chemicus, Catharina Ziekenhuis Eindhoven |
Deeltijdhoogleraar klinische chemie TU/e |
Extern gefinancierd onderzoek: |
geen |
|
Moons -Pasic |
Longarts OLVG Amsterdam |
Niet van toepassing |
Extern gefinancierd onderzoek: |
geen |
|
Peters |
Ziekenhuisapotheker |
Niet van toepassing |
Extern gefinancierd onderzoek: * Abbvie - Systematic evaluation of the efficacy-effectiveness gap of systemic treatmens in extensive disease - Geen projectleider |
geen |
|
Verheijen |
Klinisch geriater, voor 0,8 fte. |
Geen |
Geen |
geen |
|
Schuuring |
Senior staflid en lid van MT (Management Team) van de afdeling Pathologie van het Universitair Medisch Centrum Groningen. |
Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden, voor Martini Ziekenhuis te Groningen, voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen en voor ADCNV to Curacao (allen onbetaald) |
Adviseur/consultant m.b.t. (moleculaire) diagnostiek voor firma's (2019-2023): MSD/Merck, AstraZeneca, Astellas Pharma, Roche, Novartis, Bayer, BMS, Lilly, Amgen, Illumina, Agena Bioscience, Janssen Cilag (Johnson&Johnson), GSK, Diaceutics, CC Diagnostics (honoraria op UMCG rekening) Extern gefinancierd onderzoek: In UMCG-team heb ik financiele ondersteuning voor onderzoek ontvangen van: |
restricties |
|
Bahce |
Commissielid |
Geen |
Geen dienstverband, eigendom, patent of anderszins Extern gefinancierd onderzoek: Diverse investigator-initiated onderzoeken op de longafdeling van het Amsterdam worden gefinancierd door de bedrijven Boehringer Ingelheim, AstraZeneca en BMS |
restricties |
|
von der Thüsen |
Patholoog |
Geen |
Honoraria en consulting fees van: Extern gefinancierd onderzoek: |
restricties |
|
Barberio |
Directeur patiëntenorganisatie Longkanker Nederland (betaald) |
lid RvT Stichting Agora, leven tot het einde (betaald) |
Extern gefinancierd onderzoek: |
geen |
|
Hendriks |
Longarts |
mede-auteur geweest van ESMO richtlijn SCLC |
Betaling voor webinars Benecke, MedTalks, VJOncology Extern gefinancierd onderzoek: chair metastatic NSCLC systemic therapy EORTC secretaris stichting NVALT studies adviesraden (betaald aan instituut niet aan mij): Amgen, BMS, Boehringer Ingelheim, Janssen, Lilly, Merck, MSD, Novartis, Pfizer, Roche and Takeda betaling voor educational webinars (betaald aan instituut niet aan mij) Janssen, podcasts Takeda, invited speaker AstraZeneca, Bayer, high5oncology, Lilly en Merck Sharp & Dohme (MSD), interview sessies Roche betaling aan instituut voor lokale PI farma studies van AbbVie, AstraZeneca, Blueprint Medicines, Gilead, GlaxoSmithKline (GSK), Merck Serono, Mirati, MSD, Novartis, Roche en Takeda |
restricties |
|
ter Heine |
Ziekenhuisapotheker-klinisch farmacoloog, Radboudumc |
Geen |
Ik heb een onkostenvergoeding ontvangen voor het geven van een scholing over de klinische farmacologie van sotorasib, een nieuw middel in de behandeling van longkanker, van de firma AMGEN. Extern gefinancierd onderzoek: |
geen |
|
Damhuis |
Onderzoeker IKNL (betaald) |
Lid wetenschappelijke commissie DLCA-S (onbetaald) |
Extern gefinancierd onderzoek: |
geen |
|
van Geffen |
Medisch Centrum Leeuwarden |
NVALT bestuur |
Extern gefinancierd onderzoek: * Projectleider |
restricties |
|
Stoffels |
Internist ouderengeneeskunde Amsterdam UMC |
freelance nieuwsschrijver Nederlands Tijdschrift voor Geneeskunde
|
Amsterdam UMC innovatiefonds |
geen |
|
van den Berg |
Arts assistent Inwendige Geneeskunde Amsterdam UMC |
Betaalde nevenfunctie: * Post-doctoraal onderzoek Professional Performance and Compassionate Care-onderzoeksgroep AmsterdamUMC (niet extern gefinancierd) |
Geen |
geen |
Inbreng patiëntenperspectief
Longkanker Nederland heeft bijgedragen aan de schriftelijke knelpunteninventarisatie voor het cluster Longoncologie. Daarnaast werd er aandacht besteed aan het patiëntenperspectief door de afvaardiging van Longkanker Nederland in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule werden tevens voor commentaar voorgelegd bij Longkanker Nederland (in afstemming met de Nederlandse Federatie van Kankerpatiëntenorganisaties).
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
|
Module |
Uitkomst raming |
Toelichting |
|
Module ‘(Neo)adjuvante immuuntherapie’ |
Geen financiële gevolgen |
Hoewel het niet duidelijk is of de aanbevelingen breed toepasbaar zijn, volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de schriftelijke knelpuntenanalyse werden verschillende partijen uitgenodigd om input te geven op een concept-raamwerk voor de richtlijnen niet kleincellig longcarcinoom en kleincellig longcarcinoom. Deze richtlijnen zijn dermate verouderd, dat een grotere herziening noodzakelijk is om uiteindelijk goed mee te kunnen draaien in het modulair onderhoud zoals in de Koploperprojecten wordt beoogd.
Het doel van deze stakeholderraadpleging was om te inventariseren welke knelpunten men ervaart rondom de te herziene richtlijnen. De benoemde knelpunten werden vervolgens door de richtlijnwerkgroep geprioriteerd en vertaald in uitgangsvragen.
De volgende vijf modules kregen prioriteit bij het uitvoeren van onderhoud aan de richtlijn Niet kleincellig longcarcinoom:
- (Neo)adjuvante immuuntherapie
- Dubbele immuuntherapie
- Behandeling na (chemo-)immuuntherapie
- Eerstelijnsbehandeling incurabel NSCLC met EGFR exon 19/21 mutatie
- Behandeling incurabel NSCLC met (zeldzame) mutaties
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model (Review Manager 5.4). De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
