Chirurgie of radiotherapie bij stadium I NSCLC
Uitgangsvraag
Wat is de behandeling van voorkeur voor operabele patiënten met een stadium I niet-kleincellig longcarcinoom: chirurgie bestaande uit een lobectomie of segmentresectie dan wel stereotactische radiotherapie? Bestaan er patiëntcategorieën waarbij sprake is van een behandeling van voorkeur?
Aanbeveling
Behandel patiënten met stadium I NSCLC zonder verhoogd operatierisico door het verrichten van een lobectomie inclusief lymfeklierdissectie.
Overweeg voor kwetsbare patiënten en patiënten met een verhoogd operatierisico SBRT als behandeling van voorkeur voor stadium I NSCLC.
Betrek tumorkarakteristieken en ligging in de behandelkeuze bij twijfel over de keuze voor SBRT dan wel chirurgie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Goed vergelijkend onderzoek van SBRT ten opzichte van lobectomie ontbreekt in de literatuur, het is daarom onduidelijk of SBRT leidt tot eenzelfde overleving als chirurgie voor patiënten met een stadium I NSCLC.
Ook ten aanzien van complicaties van de behandeling ontbreekt een goede vergelijking in de literatuur. Mogelijk leidt SBRT in de eerste maanden tot een lager percentage behandeling gerelateerde complicaties.
Eveneens ontbreekt goed vergelijkend onderzoek naar kwaliteit van leven; de kwaliteit van leven na SBRT of lobectomie is waarschijnlijk vergelijkbaar.
In de literatuur is slechts 1 RCT beschikbaar met overleving als uitkomst maat, die bestaat uit 2 samengevoegde studies, met beiden een klein aantal geïncludeerde patiënten. Daarnaast zijn een groot aantal observationele studies beschikbaar, echter met een kans op selectiebias. Complicaties van behandeling zijn, met name in de chirurgische cohorten, vaak niet in detail beschreven. Ten aanzien van de kwaliteit van leven is één prospectieve cohortstudie beschikbaar.
Een vergelijking tussen SBRT en een sublobaire (segment) resectie ten aanzien van bovenstaande uitkomstindicatoren is op grond van de huidige literatuur niet mogelijk.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Uit de literatuur kan niet worden opgemaakt of er in het algemeen bij patiënten en familie een voorkeur bestaat voor SBRT ten opzichte van een lobectomie. Het heeft derhalve de voorkeur om beide opties aan de patiënt voor te leggen.
Kosten (middelenbeslag)
In de praktijk blijken kosten geen overweging te zijn in de keuze voor lobectomie of SBRT. Vanuit de literatuur zijn hierover geen relevante data beschikbaar.
Aanvaardbaarheid voor de overige relevante stakeholders
In de praktijk zijn er geen beperkingen om beide modaliteiten met de patiënt bespreekbaar te maken. Zowel lobectomie als SBRT zijn aanvaarde behandelmethoden.
Haalbaarheid en implementatie
In Nederland zijn zowel SBRT als lobectomie ruim beschikbaar met de nodige kwaliteit, apparatuur en personeel. In de huidige situatie spelen wachttijden voor deze indicatie geen rol van betekenis in de keuze van de behandeling.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Wegens ontbreken van literatuur, is het onzeker of SBRT leidt tot eenzelfde overleving als resectie door middel van een lobectomie.
Omdat historisch gezien een lobectomie de standaardbehandeling vormt, heeft het de voorkeur om chirurgie aan te bevelen als behandeling van keuze voor patiënten met stadium I NSCLC, mits er geen verhoogd operatierisico (zoals cardiovasculair profiel, longfunctie en kwetsbaarheid) bestaat voor operatie.
Omdat SBRT mogelijk leidt tot een lager percentage (korte termijn) behandel complicaties, kan SBRT de behandeling van keuze vormen voor kwetsbare patiënten en patiënten met belangrijke comorbiditeit.
Wegens het ontbreken van goede vergelijkende studies, kunnen (in aanvulling op bovenstaande aanbevelingen) in de keuze voor lobectomie of SBRT op patiënt basis, ook tumorkarakteristieken een rol spelen.
Bij tumoren met een scherpe begrenzing op beeldvorming kan laagdrempeliger SBRT overwogen worden, terwijl aanduiding van een lepidische groeiwijze, holtevorming dan wel necrose en een (post-obstructie) infiltraat een argument voor lobectomie vormen.
Bij heel centraal gelegen tumoren waarbij kritische organen een te hoge dosis zouden krijgen bij SBRT, heeft lobectomie de voorkeur.
Onderbouwing
Achtergrond
Vanwege gunstige resultaten van stereotactische radiotherapie (Sterotactic Body Radiotherapy, SBRT of Stereotactic Ablative Radiotherapy, SABR, beiden kunnen in de context van deze uitgangsvraag gebruikt worden) bij patiënten met een medisch inoperabel stadium I NSCLC, wordt SBRT in toenemende mate naar voor geschoven als alternatief voor een lobectomie of voor een segmentresectie bij operabele patiënten met een stadium I NSCLC. Het is de vraag of SBRT inderdaad als een volwaardig alternatief voor lobectomie of segmentectomie mag worden aangeboden aan operabele patiënten, dan wel of er groepen zijn bij wie een van de drie opties de voorkeur geniet. In de praktijk wordt hierover wisselend gedacht.
Conclusies / Summary of Findings
|
VERY LOW GRADE |
It is uncertain whether the overall survival was better or worse after stereotactic radiotherapy as compared to surgery in patients with stage I NSCLC.
References: (Chen, 2018; Chang, 2015; Stokes, 2018) |
|
VERY LOW GRADE |
It is uncertain whether the occurrence of severe toxicities or treatment related mortality is lower in patients with stage I NSCLC treated with stereotactic therapy as compared to surgery.
References: (Chang, 2015; Robinson, 2013; Crabtree, 2010; Verstegen, 2013) |
|
VERY LOW GRADE |
Patients’ quality of life after stereotactic radiotherapy might be comparable with patients’ quality of life after surgery in patients with stage I NSCLC.
References: (Wolff, 2018) |
Samenvatting literatuur
A total of four studies were included in this literature analysis. Chang (2015) reported the pooled results of two discontinued RCTs. Both studies (ROSEL trial and STARS trial) were open-label, randomised, phase 3 trials. In the ROSEL study, ten centres in the Netherlands participated. The STARS trial was performed in 28 sites in USA, China, and France. Both studies were closed early because of slow accrual. The number of included patients (n=58 patients) remained far below the anticipated enrolment (anticipated enrolment: 1030 patients in the STARS trial and 960 patients in the ROSEL trial). In these two trials, 31 patients were treated by stereotactic radiotherapy and 27 patients underwent surgery. Patients with peripherally located lesions received a total radiation dose of 54 Gy in three 18 Gy fractions. In patients with central lesions, 50 Gy in four 12.5 Gy fractions was used. Treatment delivery was recommended to be complete within 5 days of its initiation. A toxicity risk-adapted fractional scheme was used in which a total dose of 54 Gy in three 18 Gy fractions given over 5 to days; alternatively, a total dose of 60 Gy at five 12 Gy fractions was given over 10 to 14 days. Surgery included anatomic lobectomy by open thoracotomy or video-assisted thoracotomy.
Chen (2018) reported the results of a systematic review and meta-analysis of observational studies comparing SABR and surgery in early-stage NSCLC patients eligible for both SABR and surgery. The databases MEDLINE and Embase were searched until December 2016. Sixteen studies using a propensity score methodology were included in the meta-analysis (8 retrospective reviews, 5 surveillance studies, 2 studies using databases, 1 single arm trial). Surgery included lobectomy (9 studies), sublobar resection (6 studies), or surgery without further details on type of surgery (4 studies). No details on the used doses in SABR treatment were reported. Fourteen studies used matching to control for confounding. In the remaining studies covariate adjustment and inverse probability of treatment weighting were used. Fifteen studies with 19,882 patients were included in the primary meta-analysis for overall survival. Toxicity was not reported as an outcome in the systematic review by Chen (2018). After reading the original reports, we found that only four of the included studies reported toxicity in both treatment arms (Ezer, 2015; Verstegen, 2013; Crabtree, 2010; Robinson, 2013). Data on the number of patients with toxicity in each group were substracted from the original reports.
Furthermore, two recent observational studies were included. Stokes (2018) reported the results of surgery or SBRT using data from the American National Cancer Database, a hospital-based registry that captures approximately 70% of incident cancer cases in the United States. 84.839 patients with cT1-T2a, N0, M0 NSCLC diagnosed between 2004 and 2013 undergoing either surgery or SBRT. For this analysis, data from 27,200 propensity score–matched patients were used. 6,800 patients underwent SBRT. SBRT fractionation schedules were 50 Gy in five fractions (19.3%), 60 Gy in three fractions (17.7%), 48 Gy in four fractions (17.0%), and 54 Gy in three fractions (14.0%). 20,400 patients underwent surgery (lobectomy (77.7%), sublobar resection (20.3%), or pneumonectomy (2.0%)). Outcome measures were the 30- and 90-day post-treatment mortality rates.
Wolff (2018) described the results in patients’ quality of life in two prospective cohorts of patients with stage I NSCLC who were treated either with SBRT or surgery. Data were from two hospitals in the Netherlands. 261 patients were treated by stereotactic radiotherapy, of whom 41 patients were included in the propensity score matched cohort (N=18 were treated with 5x12 Gy; N=15: 3x20 Gy; N=4: 3x18 Gy; N=4: 8x7.5 Gy). 41 patients underwent lobectomy (n=32 thoracotomy – lobectomy, n=5 VATS lobectomy, N=2 Bilobectomy, N=1 Wedge, N=1 Pneumonectomy). Health utility was measured with European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire–Core 30 (QLQ-C30). The average health utility for the first year was calculated as the weighted average of baseline, 3, 6, and 12 months.
Study results
Overall survival
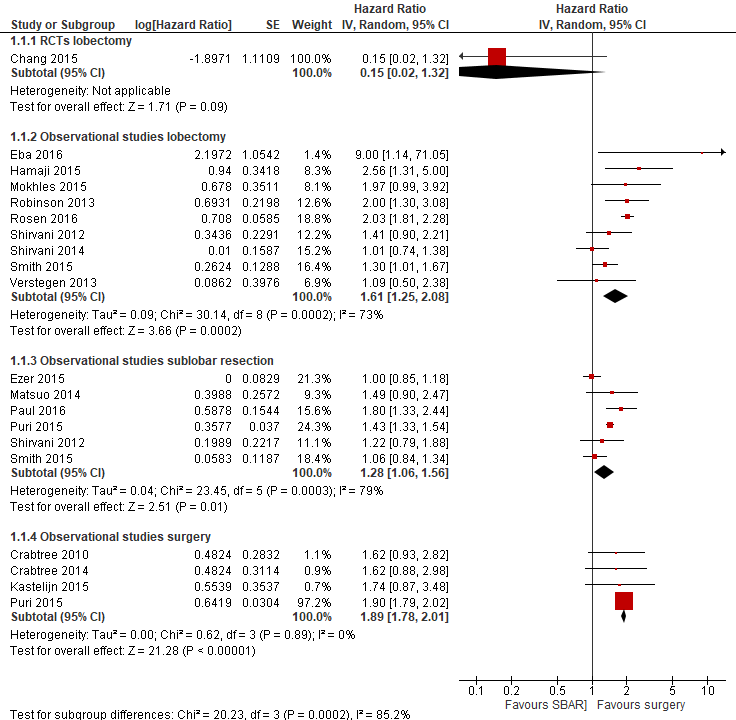
The pooled analysis of the two RCTs reported no significantly different risk of mortality after stereotactic radiotherapy as compared to surgery (HR=0.15 (0.02, 1.32), although the uncertainty is high.
Most observational studies reported either a better survival after surgery or no difference between SABR and surgery (Chen 2018). The median follow-up durations in the individual studies ranged from 16 to 80 months. The reported results included only the hazard ratios for overall survival and recurrence free survival. Pooling the results of all observational studies, irrespective of the type of surgery, showed a higher risk of mortality after stereotactic radiotherapy as compared to surgery (HR=1.49, 95%CI 1.30 to 1.72). Observational studies comparing stereotactic radiotherapy with lobectomy reported a higher mortality for stereotactic radiotherapy as compared to lobectomy (HR= 1.61, 95%CI 1.25 to 2.08). Comparing stereotactic radiotherapy with sublobar resection resulted in a small but not clinically relevant difference in mortality (HR = 1.28, 95%CI 1.06 to 1.56). The heterogeneity, however, was high (73% and 79% respectively).
Stokes (2018) reported the 30-day and 90-day mortality. Between 2004 and 2013, 8,216 patients underwent SBRT and 76,623 patients underwent surgery (sublobar resection, lobectomy, or pneumonectomy). In propensity score–matched patients (27,200 patients), the 30 day mortality rates were 0.79% in SBRT treated patients and 2.41% in surgically treated patients (difference 1.62%; P<.001). The 90-day mortality rates were 2.82% in SBRT and 4.23 % in surgically treated patients (difference 1.41%; P<.001). The hazard ratio for 90-day mortality was 0.66 (95%CI 0.56 to 0.77), favouring SBRT.
Figure 1 RCTs and cohort studies comparing SBRT with surgery
Adverse events
Chang (2015) reported the number of patients with grade 3 or worse acute or chronic toxicity. Three patients (10%) in the SABR group and twelve patients (44%) in the surgery group, developed grade 3 or worse toxicity (Absolute risk reduction: 35%, 95% CI: (13% to 56%); NNH: 2.9 patients. N=1 (4%) patient died of surgical complications; No patients in the SABR group experienced treatment-related grade 4 toxic effects or treatment-related death.
Four observational studies included in the systematic review by Chen (2018) reported on toxicity. The results are summarised in Table 1.
Ezer (2015) reported the number of complications without grading the severity. Respiratory complications occurred more often after surgery (28%) compared with patients treated with SBRT (14%; p < 0.0001). Cardiovascular events occurred in 3% of patients treated with surgery; however, this complication was rare (<1%) after SBRT.
Robinson (2013) reported the occurrence of late severe toxicities after SBRT in two patients (one patient with grade 3 pneumonitis and one patient with grade 3 soft-tissue necrosis). After lobar resection, operative mortality was 1.9% (n=5). Cardiovascular complications after surgery included atrial fibrillation in 28 patients (10.8%), other arrhythmia in three patients, myocardial infarction in five patients, and a stroke in one patient. Pulmonary complications included new requirements for supplemental oxygen in 18 (6.9%), pneumonia/ respiratory failure in 15 (5.8%), prolonged air leak in 11, vocal cord paralysis in four, and tracheostomy placement in two patients, respectively. Bleeding requiring additional surgery occurred in seven patients.
Crabtree (2010) found no treatment-related deaths associated with SBRT. One (1.3%) patient treated with SBRT experienced grade 3 pneumonitis. Among very high-risk surgical patients, the operative mortality was 7.0% (4/57). Among the lower-risk surgical patients, the operative mortality was 2.7% (11/405).
Verstegen (2013) also reported no treatment related deaths in patients treated with SBRT. Four patients (6.3%) experienced ≥grade 3 toxicity. The 30- and 90-day mortality after VATS resection was 1.6%, with one patient dying of multi-organ failure caused by septicemia due to thoracic empyema and bronchopleural fistulae. In the VATS cohort, fifteen patients (23.4%) experienced complications with grade 3 or higher toxicity.
Table 1 Number of patients with grade 3 or more toxicity, including treatment-related deaths
|
|
Number of patients with grade 3 or more toxicity or treatment related mortality (%) |
ARR (95%CI) |
|
|
reference |
stereotactic radiotherapy |
surgery |
|
|
Chang 2015 |
3 (10%) |
13 (48%) |
-0.38 (-0.60, -0.17) |
|
Verstegen 2013 |
4 (6.3%) |
16 (25%) |
0.01 (-0.03, 0.05) |
|
Crabtree 2010 |
1 (1.3%) |
15 (3.2%) |
-0.02 (-0.05, 0.01) |
|
Robinson 2013 |
2 (2.6%) |
5 (1.9%)* |
-0.17 (-0.29, -0.05) |
*) operative mortality was 1.9% (n=5); complications after surgery occurred in 94 patients, but severity (grade) was not reported
Quality of life
Over one year, a small and non-significant difference of 0.026 (95%: CI –0.028 to 0.080) was observed in the average utility score between the SBRT and surgery groups (Wolff 2018). This difference is smaller than the minimally important difference (MID) that the authors reported in their article (minimally important difference in health utility = 0.07).
Level of evidence
There are four levels of evidence: high, moderate, low, and very low. RCTs start at a high level of evidence and observational studies start at low.
The results on the overall survival were based on data from two very small RCTs and many observational studies. Therefore, the level of evidence for overall survival started at low was downgraded with 1 level because of limitations in the study design (Risk of bias), imprecision and heterogeneity.
The level of evidence for adverse events was downgraded with 1 level because of limitations in the study design (Risk of bias) and imprecision (small numbers of patients).
The level of evidence for quality of life was downgraded with 1 level because of limitations in the study design (Risk of bias) and imprecision (small numbers of patients).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects in terms of overall survival, quality of life and adverse events of surgery (lobectomy or sublobar resection) as compared to stereotactic radiotherapy in patients with stage I operable NSCLC?
P (population) patients with non–small-cell lung cancer stage I;
I (intervention) stereotactic radiotherapy;
C (comparison) surgery (lobectomy, sublobar resection);
O (outcome) overall survival, quality of life and adverse events.
Relevant outcome measures
The working group considered overall survival a critical outcome measure for the decision-making process and quality of life and adverse events as important outcome measures for decision making.
The working group defined clinically relevant differences as follows:
Overall survival: >12 weeks or hazard ratio <0.7
Progression free survival: >12 weeks or hazard ratio <0.7
Adverse events and toxicity: lethal <5%, acute or severe <25%
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched up to 6th of July 2018 using relevant search terms for systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies (OBS). The detailed search strategy is depicted under the tab Methods. The search resulted in 226 hits. Studies were selected based on the following criteria: systematic review, randomized trials or cohort studies including patients with stage I NSCLC comparing stereotactic radiotherapy with surgery. 22 studies were initially selected based on title and abstract. After reading the full text articles, 18 studies were excluded (see the table with reasons for exclusion under the tab Methods). Four articles were included in the literature summary. Important study characteristics and results are depicted in the evidence tables. The assessment of the risk of bias is depicted in the risk of bias tables.
Referenties
- 1 - Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol. 2015; 16(6): 630–637. doi:10.1016/S1470-2045(15)70168-3.
- 2 - Chen H, Laba JM, Boldt RG et al. Stereotactic Ablative Radiation Therapy Versus Surgery in Early Lung Cancer: A Meta-analysis of Propensity Score Studies. Int J Radiat Oncol Biol Phys. 2018;101(1):186-194. doi: 10.1016/j.ijrobp.2018.01.064.
- 3 - Stokes WA, Bronsert MR, Meguid RA, et al. Post-Treatment Mortality After Surgery and Stereotactic Body Radiotherapy for Early-Stage Non-Small-Cell Lung Cancer. J Clin Oncol. 2018;36(7):642-651. doi: 10.1200/JCO.2017.75.6536.
- 4 - Wolff HB, Alberts L, Kastelijn EA, et al. Differences in Longitudinal Health Utility between Stereotactic Body Radiation Therapy and Surgery in Stage I Non-Small Cell Lung Cancer. J Thorac Oncol. 2018;13(5):689-698. doi: 10.1016/j.jtho.2018.01.021.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: what are the effects (overall survival, quality of life and adverse events) of surgery (lobectomy or sublobar resection) as compared to stereotactic radiotherapy in patients with stage I operable NSCLC ?
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Deng 2017 |
More recent and comprehensive systematic review available |
|
Wang 2018 |
More recent and comprehensive systematic review available |
|
Zhang 2014 |
More recent and comprehensive systematic review available |
|
Yu 2017 |
More recent and comprehensive systematic review available |
|
Wink 2017 |
The aim of the current systematic review is to shed more light on the outcome of SBRT with respect to the regional lymph nodes. Studies on the incidence of, and risk factors for, regional failure following SBRT will be discussed. |
|
Wen 2017 |
More recent and comprehensive systematic review available |
|
Klapper 2017 |
Narrative review |
|
Nguyen 2016 |
Another research question (to assess the influence of comorbidities among elderly patients)
|
|
Ma 2016 |
Incl of retrospective study, not necessarily comparing the 2 interventions (selection per intervention) |
|
Jones 2015 |
Narrative review |
|
Boily 2015 |
More recent and comprehensive systematic review available |
|
Zheng 2014 |
No direct comparison; Separately searched for SBRT and surgery |
|
Solda 2013 |
Not relevant for PICO; To assess the efficacy of stereotactic ablative radiotherapy (SABR) (not searched for studies with a direct comparison) |
|
Mahmood 2013 |
Narrative review |
|
Palma 2012 |
Not relevant for PICO; Specific population: Stage I NSCLC patients with severe COPD |
|
Nguyen 2008 |
Narrative review |
|
Schneider 2018 |
Clinical Guideline |
|
Tandberg 2018 |
Narrative review |
|
Takahashi 2016 |
Not relevant for PICO (Only surgery (no comparison)) |
|
Eba 2016 |
Comparison between two separate trials on radiotherapy and lobectomy |
|
Crabtree 2013 |
Andere vraagstelling |
|
Alberts 2015 |
Not relevant for PICO; another outcome measure (pulmonary function) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-03-2020
Beoordeeld op geldigheid : 24-01-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Chirurgie of radiotherapie bij stadium I NSCLC |
NVALT / NVvH / NVRO |
2019 |
2021 |
Eens in 2 jaar |
NVALT |
Lopend onderzoek |
Met betrekking tot de positie van sublobaire (segment) resecties ten opzichte van een lobectomie worden naar verwachting in 2021 en 2022 de resultaten van 2 gerandomiseerde studies gepubliceerd (CALGB 140503 en JCOG 0802). Hoewel niet vergelijkend tov SBRT, zullen deze studies van invloed zijn op de therapie keuze.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. dr. A.F.T.M. Verhagen, cardio-thoracaal chirurg, Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en TBC (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel met gemelde belangen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingelheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patienten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van BMS (nivolumab) en Boehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Boehringer lngelheim) in 2016 financiële support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor AstraZeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt door geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator). |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (https://www.netwerk-path.nl/) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Bayer, Novartis, BMS, BioRad, Amgen, Illumina, Ageno BioSciences, Janssen Cilag (Johnson&Johnson), BioCartis (honoraria komen op een rekening op UMCG) Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, Illumina, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) betaald aan UMCG: Boehringer Ingelheim, Avenio/Roche/Cancer-ID, BMS (CA209-759), BioRad and Avenio - |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiele verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
geen |
getrouwd met praktijkhoudend huisarts |
geen |
|
Hofstede |
adviseur richtlijnontwikkeling |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. Longkanker Nederland heeft ook deelgenomen aan de Invitational conference. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longcarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Bij het vaststellen van welke verschil klinisch relevant is, heeft de werkgroep zich laten inspireren door de PASKWIL-criteria. De werkgroep is zich ervan bewust dat deze criteria zijn ontwikkeld voor de beoordeling van geneesmiddelen in de palliatieve setting en niet voor een curatieve setting.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
- Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS – voor observationeel onderzoek.
- QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Uitgangsvraag: Stadium I: chirurgie versus radiotherapie |
|
|
Database(s): Medline, Embase |
Datum: 6-7-2018 |
|
Periode: > 1946 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – juli 2018 |
1 (non-small cell lung and (carcinoma* or neoplasm* or cancer*)).ti. or exp *Carcinoma, Non-Small-Cell Lung/ or nsclc.ti. (47316) 2 (Stage i or early stage).ti,ab. (108938) 3 ((Stereotactic adj6 (radiotherapy or therapy)) or sbrt or sabr).ti,ab. (7539) 4 exp Pneumonectomy/ or segmentectom*.ti,ab. or segment resect*'.ti,ab. or lobectom*.ti,ab. or sublobar resect*.ti,ab. or ((lung or pneumo* or pulmonar*) adj4 resect*).ti,ab. or pneumonectom*.ti,ab. or surger*.ti,ab. or surgic*.ti,ab. or pneumoresection.ti,ab. or pulmonectomy.ti,ab. (1638139) 5 1 and 2 and 3 and 4 (305) 6 limit 5 to english language (280) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (358901) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1766067) 9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2992814) 10 6 and 7 (19) 11 6 and 8 (102) 12 11 not 10 (91) 13 6 and 9 (129) 14 13 not 10 not 12 (73) 15 10 or 12 or 14 (183) = 183 |
226 |
|
Embase (Elsevier) |
(((('non-small cell lung':ti AND (carcinoma*:ti OR neoplasm*:ti OR cancer*:ti) OR 'non small cell lung cancer'/exp/mj OR nsclc:ti) AND ('stage i':ti,ab OR 'early stage':ti,ab) AND ('stereotactic body radiation therapy'/exp OR ((stereotactic NEAR/6 (radiotherapy OR therapy)):ti,ab) OR sbrt:ti,ab OR sabr:ti,ab) AND ('lung resection'/exp OR 'segmentectomy'/exp OR 'lung lobectomy'/exp OR segmentectom*:ti,ab OR 'segment resect*':ti,ab OR lobectom*:ti,ab OR 'sublobar resect*':ti,ab OR (((lung OR pneumo* OR pulmonar*) NEAR/4 resect*):ti,ab) OR pneumonectom*:ti,ab OR surger*:ti,ab OR surgic*:ti,ab OR pneumoresection:ti,ab OR pulmonectomy:ti,ab)) AND (english)/lim NOT 'conference abstract':it) = 322
Gebruikte filters: Systematic Reviews: (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) = 27
Randomized Controlled Trials: (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) = 84
Observationele studies: ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti))) = 46
= 157 |
