Niet kleincellig longcarcinoom - Mediastinale stadiëring
Uitgangsvraag
Wat is de beste diagnostische strategie voor mediastinale stadiëring bij patiënten met mediastinale lymphadenopathie en/of een centraal gelegen tumor?
Aanbeveling
Verricht bij voorkeur mediastinale stadiëring (waarbij een combinatie van EBUS en EUS de voorkeur heeft) bij patiënten met (verdenking op) niet-kleincellig longcarcinoom, bij wie een in opzet curatieve behandeling wordt overwogen als er op FDG-PET/CT scan verdenking is op een hilaire en/of mediastinale lymfekliermetastase.
Overweeg mediastinale stadiëring (bij voorkeur een combinatie van EBUS en EUS) bij patiënten met (verdenking op) NSCLC, bij wie een in opzet curatieve behandeling wordt overwogen bij tenminste één van de volgende punten:
- De primaire afwijking neemt FDG niet of nauwelijks op.
- De primaire afwijking is centraal gelokaliseerd (meest centrale begrenzing op CT minder dan 1,5 cm verwijderd van de hilaire of mediastinale lymfeklieren).
- Er sprake is van mediastinale lymfadenopathie op CT (> 1 cm korte as diameter).
- De primaire afwijking groter is dan 3 cm.
Overweeg een mediastinoscopie bij negatieve EBUS en/of EUS en tenminste één van de onderstaande punten:
- positieve N1 klieren;
- bij FDG-opname van N2 klieren die met een mediastinoscopie te bereiken zijn;
- als een endoscopisch onderzoek niet-systematisch en dus onvolledig is uitgevoerd;
- bij geen representatieve bevindingen.
Maak de keuze voor een alternatief invasief diagnostisch onderzoek afhankelijk van de lokalisatie van een voor metastase verdachte klier, bijvoorbeeld CT-geleide punctie/ biopsie of een parasternale mediastinotomie of thoracoscopie.
Bewijs bij voorkeur cytologisch of histologisch dat er sprake is van mediastinale kliermetastasering, voordat wordt overwogen af te zien van een in opzet curatieve behandeling op basis van bevindingen van verrichtte beeldvormende diagnostiek.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De sensitiviteit van EBUS/ EUS was in de meeste studies iets hoger dan de sensitiviteit van mediastinoscopie. De studie van Larsen (2005) rapporteerde een veel lagere sensitiviteit voor mediastinoscopie dan alle andere studies, maar dit lijkt een uitzondering. De specificiteit was voor beide diagnostische technieken (bijna) 100%. Wel was de specificiteit niet voor alle studies te berekenen, omdat het aantal terecht negatieven niet gerapporteerd werd.
Mediastinoscopie resulteerde in meer ernstige complicaties vergeleken met EBUS/ EUS. Het absolute risicoverschil was 6,8%.
De overall bewijskracht is laag. Dit komt doordat de studies erg heterogeen zijn, zowel in klinisch als statistisch opzicht. De patiëntpopulaties verschillen in de studies zoals de procedures voor de diagnostiek (zie ook de evidencetabel). De prevalentie binnen de studiepopulaties varieerden van 32% tot 89%. Daarnaast werden EUS, EBUS of een combinatie van beiden ervan gebruikt als diagnostische test.
In de literatuursamenvatting is gekeken naar de vergelijking EBUS/ EUS versus mediastinoscopie. Een andere interessante vergelijking is de work-up EUS/EBUS plus mediastinoscopie versus alleen EUS/ EBUS. De studies die dit onderzoeken zijn relevant, maar voldeden niet aan de PICO en zijn daarom niet meegenomen in de literatuuranalyse.
Voor de indicatie en meerwaarde van de gecombineerde EBUS/ EUS stadiëring in vergelijking met een van de technieken wordt op de gemeenschappelijke richtlijn van de ESGE, ERS en ESTS (Vilman, 2015) gewezen:
- Endoscopische technieken worden als initiele procedure voor mediastinsocopie geadviseerd.
- De combinatie van beide technieken wordt aanbevolen boven één van beide technieken alleen. Als er een keuze moet worden gemaakt, wordt een EBUS geadviseerd.
Niettemin worden de resultaten van ons literatuuronderzoek ook door de bevindingen van een meta-analyse bevestigd (Bousema, 2019) welke een vergelijkbare rate van “unforeseen N2 disease” van 9,6% en 9,9% na negatieve endosonografie (combinatie EUS/EBUS) met en zonder mediastinoscopie beschrijft. De meerwaarde van mediastinoscopie na gecombineerde endoscopische stadiëring blijft dus twijfelachtig, en de resultaten van de MEDIASTrial zullen hierover meer zekerheid brengen.
Voor een subgroep van patiënten met verhoogd risico op N2, wordt het verwaardigen van een mediastinoscopie ook na negatieve endoscopische stadiering geadviseerd:
- als patiënten alleen een van de twee endoscopische technieken met negatief resultaat hebben ondergaan;
- als er een cN1 bestaat (in circa 25% is er ook sprake van N2 kliermetastasen);
- bij patiënten met sterk verhoogde FDG-uptake van N2 klieren.
Aangezien niet alle klierstations met EBUS, EUS en/of mediastinoscopie bereikt kunnen worden, kan afhankelijk van de lokalisatie van een voor metastase verdachte klier, gekozen worden voor een bepaald invasief diagnostisch onderzoek.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een EBUS/EUS zijn invasieve ingrepen, er wordt in het lichaam gekeken met een scoop. Daarna wordt meestal een punctie vanuit de luchtwegen of de slokdarm/maag genomen. Zowel EBUS als EUS worden verricht onder sedatie, de patiënt voelt zich wat slaperig en zal daardoor over het algemeen weinig last hebben van het onderzoek. Een nadeel kan zijn dat de patiënt nog enkele uren na het onderzoek suf is en misschien het stukje herinnering aan het onderzoek mist. In zeldzame gevallen kan er vanwege lichte sedatie problemen ontstaan met de ademhaling of de hartfunctie. Het voordeel van een EBUS/ EUS is dat de patiënt niet onder narcose hoeft.
Een mediastinoscopie is een operatie, onder narcose met beademing van de patiënt. Hierbij worden bij inspectie achter het borstbeen biopten uit lymfeklieren genomen. De mediastinoscoop wordt via een kleine snee van ongeveer vier cm naar binnen gebracht vlak boven het borstbeen. Na het afnemen van de biopten wordt de snee gehecht.
Kosten (middelenbeslag)
De kosteneffectiviteit van de beide interventies is niet bekend.
Aanvaardbaarheid voor de overige relevante stakeholders
De werkgroep voorziet geen problemen voor de aanvaardbaarheid voor de overige relevante stakeholders.
Haalbaarheid en implementatie
De werkgroep voorziet geen problemen voor de haalbaarheid en implementatie.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Aangezien de diagnostische opbrengst van EBUS/EUS vergelijkbaar is met een mediastinoscopie, maar gepaard gaat met minder complicaties, wordt geadviseerd een combinatie van EBUS en EUS te doen als initiele stadiëring van het mediastinum.
Bij voorkeur wordt een combinatie van EBUS en EUS aanbevolen. Indien een keuze gemaakt dient te worden tussen beide technieken, wordt een EBUS geadviseerd.
Onderbouwing
Achtergrond
Volgens de huidige Amerikaanse en Europese richtlijn (De Leyn, 2014; Postmus, 2017) wordt een invasieve mediastinale stadiëring aanbevolen:
- voor alle centrale tumoren;
- voor alle tumoren > 3 cm (met name adenocarcinomen welke FDG avide zijn);
- als er sprake is van tumorpositieve N1 klieren;
- als er sprake is van vergrote klieren op CT en/of FDG-aviditeit van mediastinale klieren.
Voor perifere tumoren met gunstige tumorkenmerken (in ESTS < 3 cm, in NCCN < 1 cm solide en < 3 cm nonsolide tumoren), geen lymfadenopathie op CT (< 10 mm korte as) en geen FDG-aviditeit wordt de waarschijnlijkheid van lymfogene metastasering als zo laag ingeschat dat er geen mediastinale stadiëring nodig is.
Als grenswaarde voor een vergroting op CT wordt de kortste as > 10 mm aangehouden. Voor de definitie van centrale tumorligging bestaat er een grote variabiliteit in de literatuur: zichtbaarheid van de tumor bij video bronchoscopie of tumor nabij het mediastinum < 0,5 cm op CT (Mediast trial) of tumorligging in het centrale 1/3 van de thorax (Mediast trial) of in het centrale 2/3 van de thorax (ESTS, NCCN). Gezien het feit dat deze verschillende definities van een centrale tumor in de klinische praktijk vaak niet eenvoudig kunnen worden toegepast lijkt een meer praktische definitie in dit opzicht wenselijk. De werkgroepsleden stellen voor om van een centrale tumor te spreken, indien de meest centrale/mediale begrenzing van een (FDG avide) tumor op de (diagnostische) CT scan minder dan 1,5 cm (dit is ruim 2x de resolutie van de thans beschikbare PET systemen) van de hilaire of mediastinale lymfeklieren verwijderd is.
Er zijn meerdere manieren in de literatuur beschreven om PET positiviteit van mediastinale of hilaire lymfeklieren aan te geven. In sommige centra worden (semi quantitatieve) SUV waarden gebruikt om PET positieve klieren aan te geven (bijvoorbeeld een waarde van 2,5 als afkapwaarde). Internationaal wordt nog steeds de visuele beoordeling het meest gebruikt om FDG opname in lymfeklieren te beoordelen. Hierbij wordt intranodale FDG opname incompatibel met fysiologische stapeling als afwijkend beoordeeld.
Er zijn een aantal discussiepunten aangaande de mediastinale stadiëring:
- Er is veel variabiliteit betreffende gerapporteerde centrale ligging van een tumor.
- Is er een gegeneraliseerde threshold te definiëren wat een PET positieve lymfeklier is?
- Er bestaat er een behoorlijke variabiliteit tussen verschillende centra met betrekking tot de sensitiviteit en specificiteit van PET (ondere andere scanner en tumor afhankelijk) (Schmidt-Hansen, Cochrane Database Syst Rev,2014).
- Is er een indicatie voor (en meerwaarde van) mediastinoscopie na negatieve (representatieve) EUS/ EBUS? Er is momenteel een multicentertrial (MEDIASTrial) gaande in Nederland, maar resultaten zijn nog niet bekend).
Conclusies / Summary of Findings
|
Low GRADE |
EBUS/ EUS possibly results in a higher diagnostic sensitivity compared to mediastinoscopy in the mediastinal staging of patients with non-small cell lung cancer.
EBUS/ EUS possibly results in a comparable specificity and diagnostic accuracy compared to mediastinoscopy in the mediastinal staging of patients with non-small cell lung cancer.
Sources: (Seghal, 2016) |
|
Low GRADE |
Mediastinoscopy possibly results in more complications compared to EBUS/ EUS in the mediastinal staging of patients with non-small cell lung cancer.
Sources: (Seghal, 2016) |
Samenvatting literatuur
Description of studies
The review of Seghal (2016) included 1) RCTs that randomized patients to either endosonographic procedures or mediastinoscopy in mediastinal staging of NSCLC, 2) observational studies describing the concurrent performance of mediastinoscopy and endosonography (EUS or EBUS)-guided procedures in mediastinal staging of NSCLC, in the same set of subjects, and 3) studies providing diagnostic sensitivity values of both the procedures or allowing calculation of sensitivity from the study observations. Studies were excluded when describing either the use of mediastinoscopy or endosonographic-guided procedures (but not both) in staging of NSCLC and studies where mediastinoscopy was performed only in subjects where endosonography yielded negative results.
A total of 9 studies with 960 patients (466 patients with N2/N3. Disease (Annema, 2005; Annema, 2010; Ernst, 2008; Larsen, 2005; Liberman, 2014; Tournoy, 2008; Um, 2015; Yasufuku, 2011; Zhang, 2012) being included.
Two studies were randomized controlled trials (Annema, 2010; Tournoy, 2008) that randomized patients to either endosonographic procedures or mediastinoscopy in mediastinal staging of NSCLC. Six studies prospectively enrolled subjects who were either suspected or known to have lung cancer (Annema, 2005; Ernst, 2008; Um, 2015 Yasufuku, 2011, Zhang, 2012) while 1 was a retrospective study (Larsen, 2005). Table 1 provides a description of inclusion and exclusion criteria used in the studies included in the review.
Table 1 Description of inclusion and exclusion criteria used in the studies included in the review (source: Seghal, 2016)
|
Study |
Inclusion criteria |
Exclusion criteria |
|
Annema, 2005 |
Patients with proven NSCLC without distant metastasis, patients were included irrespective of the lymph node size on CT scan |
Patients detected to have N3 disease after EUS-FNA examination |
|
Larsen, 2005 |
Patients with suspected or newly diagnosed NSCLC, who were candidates for invasive staging prior to intended curative surgery |
Inoperability because of poor medical conditions, refusal of surgery, verified N2/3, T4 or M1 disease or small cell lung cancer, pregnancy, age<18 years |
|
Ernst, 2008 |
Technically resectable pulmonary lesions in patients fit for operation, mediastinal lymph node ≥1 cm on CT and confined to lymph node stations 2, 4, or 7 |
Patients with lymph node stations other than 2, 4, 7 |
|
Tournoy, 2008 |
Patients with histological or cytological proof of NSCLC or with a high clinical suspicion for lung |
Contraindication for esophageal endoscopy, surgery (unresectable tumor or inoperable patient), former therapy for lung cancer or concurrent other malignancy |
|
Annema, 2010 |
Patients with potentially resectable NSCLC with an indication for mediastinal lymph node sampling (lymph node size ≥ 1 cm or PET-positive mediastinal or hilar nodes or centrally located tumor), age ≥18 years, medically fit to undergo surgical resection of the lung |
Concurrent malignancy, contraindication to EUS, EBUS, or surgical staging, pregnancy, or inability to give consent, small peripheral lung tumors without evidence of enlarged or PET-positive intrathoracic lymph nodes |
|
Yasufuku, 2011 |
Age≥18 years, confirmed or suspected NSCLC |
Patients unfit for bronchoscopy or mediastinoscopy, verified stage IV disease or who were not appropriate for lung cancer resection by virtue of technical inoperability, patients with known small cell lung cancer, high clinical suspicion of lymphoma, unable to consent |
|
Zhang, 2012 |
Histologically proven or suspected NSCLC, eligibility for lung resection and age>18 years |
Distant metastasis, neoadjuvant therapy, N-2 bulky disease, previous mediastinoscopy, pregnancy, coagulation or platelet function disorder, ongoing anticoagulation therapy |
|
Liberman, 2014 |
Lung lesion <1 cm with mediastinal lymphadenopathy and/or positive PET-CT scan in mediastinum or lung lesion ≥1 cm without mediastinal lymphadenopathy or positive PET-CT in the mediastinum |
Age<18 years, CT scan/ PET-CT positivity in extrathoracic site, history of previous mediastinoscopy, inability to give consent, cervical or thoracic anatomy precluding mediastinoscopy, inability to tolerate general anaesthesia, active pulmonary infection, active cutaneous infection overlying the operative sites |
|
Um, 2015 |
Histologically proven NSCLC, a suspicion of N2 or N3 lymph node metastasis on CT or PET-CT (≥ 1cm, FDG uptake by mediastinal nodes or FDG uptake by N1 nodes), subject a candidate for curative surgery |
Distant metastasis, inoperable T4 disease, supraclavicular lymph node metastasis, prior therapy for lung cancer, presence of contraindications for bronchoscopy, uncorrected coagulopathy, concurrent malignancy, suspicious mediastinal node metastasis inaccessible by EBUS-TBNA or mediastinoscopy (station 5 or 6) |
EUS-FNA was compared to cervical mediastinoscopy in 3 studies (Annema, 2005; Larsen, 2005; Tournoy, 2008), whereas EBUS-TBNA was compared to mediastinoscopy in 4 studies (Ernst, 2008; Um, 2015; Yasufuku, 2011; Zhang, 2012). In 2 of these studies, EBUS-TBNA was compared with VAM (Um, 2015; Zhang, 2012). In the remaining 2 studies, both EBUS-TBNA and EUS-FNA were performed and compared with mediastinoscopy (Annema, 2010; Liberman, 2014). In 3 studies, the surgeons were blinded to the results of the EBUS-TBNA/ EUS-FNA (Annema, 2005; Um, 2015; Yasufuku, 2011), whereas in 2 studies, the surgeons were not blinded to the results of EBUS-TBNA/EUS-FNA (Larsen, 2005; Zhang, 2012). In the other 4 studies, the information on blinding was lacking. The endoscopic procedures were performed under moderate sedation except for 3 studies where general anesthesia was used (Liberman, 2014; Yasufuku, 2011; Zhang, 2012). The reference standard for the final diagnosis was histological evaluation either by mediastinoscopy or systematic lymph node dissection during surgery or clinical follow-up.
Results
Sensitivity
The sensitivity for the use of EBUS-TBNA/EUS-FNA varied from 0.50 (95% CI 0.26 to 0.74) to 0.96 (95% CI 0.80 to 1.00) (figure 1). The sensitivity for the use of mediastinoscopy ranged from 0.24 (95% CI 0.09 to 0.45) to 0.79 (95% CI 0.66 to 0.85). The sensitivity was higher for the use of EBUS/ EUS in all studies, except in the study of Zhang (2012).
Specificity
The specificity or numbers of true negatives and false positive for the use of EBUS/ EUS or mediastinoscopy were often not provided. The results of studies who did report specificity found a high specificity (almost 100%) for the use of both diagnostic tests (figure 1).
Figure 1 Sensitivity and specificity comparing the endoscopic procedures with cervical mediastinoscopy in staging of mediastinal lymph nodes in non-small cell lung carcinoma
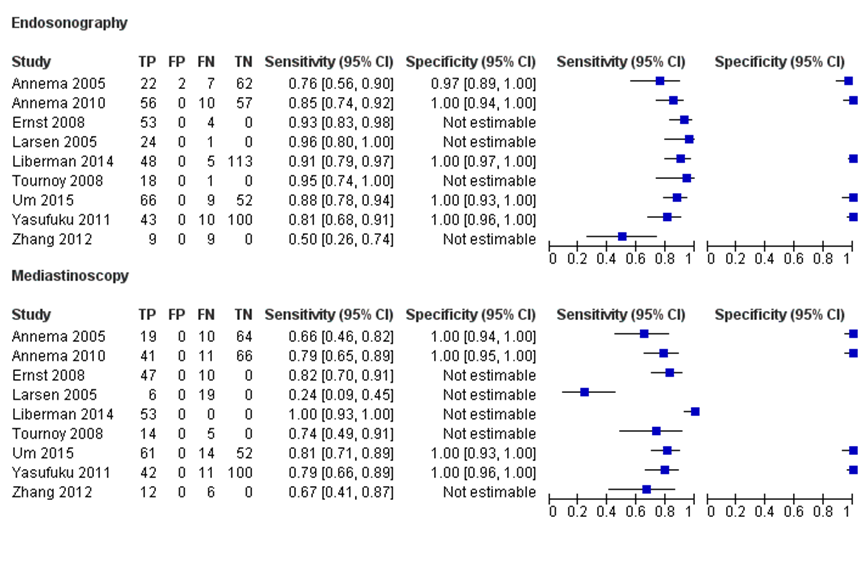
Diagnostic accuracy
Four studies reported the diagnostic accuracy. Annema (2005) reported a diagnostic accuracy of 91% in the EUS group versus 90% in the mediastinoscopy group. Liberman (2014) reported an accuracy of 97% in the EUS+EBUS group but did not report the accuracy for the mediastinoscopy group. Um (2015) reported a diagnostic accuracy of 93% for EBUS-TBNA and 89% for mediastinoscopy. Yasufuku (2011) reported a diagnostic accuracy of 93% for both EBUS-TBNA and mediastinoscopy. In addition, we calculated the diagnostic accuracy for Annema (2010) which was 92% in the endosonography and 91% in the mediastinoscopy group.
Level of evidence of the literature
The level of evidence regarding the outcome sensitivity, specificity and diagnostic accuracy was downgraded by two levels from high to low because inconsistency (heterogeneity in the patient population and procedures between the studies and statistical heterogeneity) and imprecision (overlap with the border of clinical relevance).
Complications
There were usually minor complications with the endosonography-guided procedures. There was a higher occurrence of major complications with mediastinoscopy (35 of 445 (7.9%) versus 5 of 459 (1.1%)) including bleeding, esophageal perforation, tracheal injury or prolonged need for ventilation. The absolute RD of complication rate with mediastinoscopy as compared to endosonography was 6.8% (95% CI 4.3 to 9.8).
Table 2 Complications EUS/ EBUS versus mediastinoscopy/ surgical staging. Source: Seghal (2016)
|
Study |
EUS/ EBUS |
Mediastinoscopy |
|
Annema (2005) |
No complication |
Hoarseness of voice after mediastinoscopy (n=6) |
|
Larsen (2005) |
No complication |
Postoperative fever (n=1), mediastinitis due to esophageal rupture and left recurrent laryngeal palsy (n=1) |
|
Ernst (2008) |
No complication |
Wound infection (n=2), prolonged bleeding (n=3), prolonged ventilation (n=1) |
|
Tournoy (2008) |
No complication |
Esophageal perforation (n=1), prolonged hospital stay |
|
Annema (2010) |
Pneumothorax (n=1) |
Hoarseness of voice (n=4), pneumothorax (n=1), mediastinitis (n=1), major bleeding (n=3), conversion to thoracotomy (n=1) |
|
Yasufuku (2011) |
No complication |
Hematoma (n=2), left recurrent nerve palsy (n=1), wound infection (n=1) |
|
Zhang (2012) |
No complication |
No complication |
|
Liberman (2014) |
Left main bronchus laceration requiring surgical repair (n=1), massive hemoptysis (n=1) |
Tracheal injury requiring muscle flap repair (n=1), external jugular vein injury (n=1), left vocal cord palsy (n=1), bleeding (n=7), arrhythmia (n=2), pneumothorax (n=1), cervical wound seroma (n=1), cervical hematoma (n=1) |
|
Um (2015) |
minor bleeding (n=1), transient hypoxemia (n=1) |
Minor bleeding (n=1) |
Level of evidence of the literature
The level of evidence regarding the outcome measure complications was downgraded by two levels from high to low because inconsistency (heterogeneity in the patient population and procedures between the studies) and imprecision (very low number of events).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the diagnostic accuracy of endosonographic techniques (EBUS/ EUS) compared to mediastinoscopy in the initial mediastinal staging of patients with NSCLC?
P: patients with suspected mediastinal lymphadenopathy or with central tumors;
I: endoscopic staging (EBUS/ EUS);
C: mediastinoscopy;
O: sensitivity, specificity, diagnostic accuracy of mediastinal staging and complications.
Relevant outcome measures
The guideline development group considered diagnostic accuracy of mediastinal staging and complications as critical outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched from 1st of January 2004 up to 29th of March 2019 using relevant search terms for systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies (OBS). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 223 hits. Studies were selected based on the following criteria: systematic review, randomized trials or observational studies including patients with non–small-cell lung cancer and comparing endosonographic techniques (EBUS/ EUS) with mediastinoscopy in the initial mediastinal staging of patients with NSCLC. 26 studies were initially selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 1 systematic review, including 9 of the initially selected studies, was included.
Results
One systematic review including 9 studies was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Bousema JE, van Dorp M, Noyez VJJM, Dijkgraaf MGW, Annema JT, van den Broek FJC. Unforeseen N2 Disease after Negative Endosonography Findings with or without Confirmatory Mediastinoscopy in Resectable Non-Small Cell Lung Cancer: A Systematic Review and Meta-Analysis. J Thorac Oncol. 2019 Jun;14(6):979-992. doi: 10.1016/j.jtho.2019.02.032. Epub 2019 Mar 21. Review. PubMed PMID: 30905829.
- 2 - De Leyn P, Dooms C, Kuzdzal J, Lardinois D, Passlick B, Rami-Porta R, Turna A, Van Schil P, Venuta F, Waller D, Weder W, Zielinski M. Revised ESTS guidelines for preoperative mediastinal lymph node staging for non-small-cell lung cancer. Eur J Cardiothorac Surg. 2014 May;45(5):787-98. doi: 10.1093/ejcts/ezu028. Epub 2014 Feb 26. PubMed PMID: 24578407.
- 3 - Postmus PE, Kerr KM, Oudkerk M, Senan S, Waller DA, Vansteenkiste J, Escriu C, Peters S; ESMO Guidelines Committee. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl_4):iv1-iv21. doi:10.1093/annonc/mdx222. PubMed PMID: 28881918.
- 4 - Sehgal IS, Dhooria S, Aggarwal AN, Behera D, Agarwal R. Endosonography Versus Mediastinoscopy in Mediastinal Staging of Lung Cancer: Systematic Review and Meta-Analysis. Ann Thorac Surg. 2016 Nov;102(5):1747-1755. doi: 10.1016/j.athoracsur.2016.05.110. Review. PubMed PMID: 27637288.
- 5 - Vilmann P, Clementsen PF, Colella S, Siemsen M, De Leyn P, Dumonceau JM, Herth FJ, Larghi A, Vazquez-Sequeiros E, Hassan C, Crombag L, Korevaar DA, Konge L, Annema JT. Combined endobronchial and esophageal endosonography for the diagnosis and staging of lung cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline, in cooperation with the European Respiratory Society (ERS) and the European Society of Thoracic Surgeons (ESTS). Endoscopy. 2015 Jun;47(6):545-59. doi: 10.1055/s-0034-1392040. Epub 2015 Jun 1. Erratum in: Endoscopy. 2015 Jun;47(6):c1. Vasquez-Sequeiros, Enrique (corrected to Vazquez-Sequeiros, Enrique). PubMed PMID: 26030890.
Evidence tabellen
Table of quality assessment for systematic reviews of diagnostic studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Sehgal 2016 |
Yes |
Yes |
Included: yes Excluded: no |
Yes |
Yes |
Yes |
Yes |
No |
Evidence table for systematic reviews of diagnostic test accuracy studies
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bousema 2019 |
Voldoet niet aan PICO: work-up confirmatory mediastinoscopy after negative endosonography findings |
|
Silvestri 2013 |
Richtlijn |
|
Micames 2007 |
Review met bredere PICO en ouder, review Seghal 2016 als uitgangspunt |
|
Houijmakers 2019 |
Voldoet niet aan PICO, alleen mediastinoscopie beschreven |
|
Crombag 2019 |
Voldoet niet aan PICO: EBUS/ EUS versus PET -CT |
|
Chouaid 2018 |
Voldoet niet aan PICO: work-up patients with negative or uninformative EBUS-TBNA and positron-emission tomography-positive or -negative nodes, respectively, underwent either mediastinoscopy or surgery. |
|
Vial 2018 |
Voldoet niet aan PICO: sensitivity of EBUSTBNA compared with a composite reference standard of surgical stage or EBUS-TBNA stage if EBUS demonstrated N2/N3 disease. |
|
Tanaka 2016 |
Voldoet niet aan PICO: geen vergelijking EBUS/ EUS met mediastinoscopy |
|
Liberman 2014 |
Geïncludeerd in het review van Seghal 2016 |
|
Zhang 2012 |
Geïncludeerd in het review van Seghal 2016 |
|
Yasufuku 2011 |
Geïncludeerd in het review van Seghal 2016 |
|
Soja 2010 |
Voldoet niet aan PICO: diagnostic value of blind TBNA in staging of lung cancer, using systematic mediastinal lymph node dissection (SLND) at thoracotomy as a confirmatory test. |
|
Hwangbo 2009 |
Voldoet niet aan PICO: diagnostic values of PET/CT scanning and EBUS-TBNA for mediastinal staging |
|
Tournoy 2008 |
Geïncludeerd in het review van Seghal 2016 |
|
Ernst 2008 |
Geïncludeerd in het review van Seghal 2016 |
|
Larsen 2005 |
Geïncludeerd in het review van Seghal 2016 |
|
Annema 2005 |
Geïncludeerd in het review van Seghal 2016 |
|
Zhang 2018 |
Geen directe vergelijking: retrospectief cohort waar deel EUS en deel mediastinoscopie kreeg |
|
Srinivasan 2012 |
Voldoet niet aan PICO: accuracy of EUS-FNA of mediastinal LNs in patients with known or suspected lung cancer, as well as mediastinal LNs of unknown etiology |
|
Sokucu 2009 |
Voldoet niet aan PICO: this study was designed to address the question of whether EBUS-guided TBNA can decrease the need of mediastinoscopy. |
|
Kalade 2008 |
Voldoet niet aan PICO: to assess the incremental value of endoscopic ultrasound (EUS)‐guided fine‐needle aspiration (FNA) to positron emission tomography (PET) in the diagnosis of unexplained mediastinal lymphadenopathy and staging of non‐small‐cell lung cancer (NSCLC) |
|
Labarca 2016 |
Review met bredere PICO, review Seghal 2016 als uitgangspunt |
|
Um 2015 |
Geïncludeerd in het review van Seghal 2016 |
|
Sharples 2012 |
Kosteneffectiviteitsanalyse |
|
Annema 2010 |
Geïncludeerd in het review van Seghal 2016 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-06-2020
Beoordeeld op geldigheid : 07-07-2020
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Mediastinale stadiëring |
NVALT |
2020 |
2021 |
Jaarlijks |
NVALT |
Nieuwe studies |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. I. Bahce, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Drs. N.J.M Claessens, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Prof. dr. E.F.I. Comans, Nucleaire geneeskundige, Nederlandse Vereniging voor Nucleaire Geneeskunde
- Dr. W.A. Draaisma, chirurg, Nederlandse Vereniging voor Heelkunde (tot 1 december 2018)
- Dr. W.H. van Geffen, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. K.J. Hartemink, chirurg, Nederlandse Vereniging voor Heelkunde (vanaf 1 december 2018)
- Dr. L.E.L. Hendriks, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Prof. dr. D. de Ruysscher, Radiotherapeut, Nederlandse Vereniging voor Radiotherapie en Oncologie
- Dr. C. Schaefer-Prokop, radioloog, Nederlandse Vereniging voor Radiologie
- Dr. J.H. Schouwink, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (voorzitter)
- Prof. dr. E.M.D. Schuuring, Klinisch Moleculair Bioloog in de Pathologie, Nederlandse Vereniging voor Pathologie
- Dr. E. Thunnissen, patholoog, Nederlandse Vereniging voor Pathologie
- Dr. J.H. von der Thüsen, patholoog, Nederlandse Vereniging voor Pathologie
- Prof. A.F.T.M. Verhagen, cardio-thoracaal chirurg Nederlandse Vereniging voor Thoraxchirurgie
- Dr. A.J. van der Wekken, longarts, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (vice-voorzitter)
Met ondersteuning van
- Dr. M. Moret-Hartman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medische Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in tabel met gemelde belangen in de bijlage. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Gezien een substantieel aantal van de werkgroepleden functies of werkzaamheden heeft die een mogelijke verstrengeling van belangen met zich meebrengen, zijn een aantal afspraken gemaakt over de werkwijze. Besproken is of het mogelijk was de deelname aan adviesraden voor de farmaceutische industrie stop te zetten gedurende de looptijd van het project. Dit werd echter onhaalbaar geacht, omdat de informatie uit de bijeenkomsten voor hen belangrijk werd geacht voor goede patiëntenzorg waarbij recente ontwikkelingen worden meegenomen. Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, bleek het onhaalbaar om tijdens het bespreken van aanbevelingen de werkgroepleden met mogelijke belangen te vragen de zaal te verlaten, omdat er dan slechts een klein aantal werkgroepleden zou overblijven. Daarom is besloten om overwegingen en aanbevelingen te formuleren tijdens een vergadering met de gehele werkgroep. De adviseurs hebben kritisch meegekeken bij de definitieve selectie van abstracts. Tot slot is een nieuwe voorzitter gezocht die geen bezwaar had tegen het opschorten van werkzaamheden voor de farmaceutische industrie gedurende de looptijd van het richtlijnproject. De oorspronkelijk beoogde voorzitter is als vice-voorzitter benoemd.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bahce |
longarts |
geen |
Participeert incidenteel en op uitnodiging in adviesraden en nascholingen bij diverse farmaceutische bedrijven, te weten Boehringer Ingelheim, AstraZeneca, BMS, Roche.
voert als hoofdonderzoeker investigator-initiated onderzoek uit met sponsoring van Boehringer Ingeleheim (18F-Afatinib-PET) en AstraZeneca (89Zr-durvalumab-PET) |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hendriks |
longarts |
t/m 31/10/18 postdoc lnstitut Gustave Roussy, Villejuif, Frankrijk |
bezig om een studie op te zetten die veranderingen neurocognitie na cerebrale bestraling concurrent met een tyrosine kinase inhibitor bij niet-kleincellig longkanker patiënten onderzoekt. We zijn bezig funding te zoeken, bedoeling is geld vanuit de industrie te krijgen: voor iedere TKI hebben we de betreffende firma benaderd (industrie heeft geen invloed op het studieprotocol of de analyse/publicatie van de resultaten)
subsidie bij de industrie aangevraagd om psychische belasting te onderzoeken bij patiënten die weten dat ze (asymptomatische) hersenmetastasen hebben. Roche heeft een grant toegezegd
funding gekregen van Roche om vermoeidheid na prophylactische schedelbestraling bij SCLC patiënten te onderzoeken (geen bemoeienis met protocol, analyse of publiceren van de resultaten)
neemt af en toe deel aan adviesraad van SMS (nivolumab) en Soehringer lngelheim (afatinib), betaald (instituut); van meerdere industrieen (Pfizer, Amgen, Soehringer lngelheim) in 2016 financhiele support gekregen voor drukken proefschrift (hersenmetastasen bij longkanker). Voor Astra Zeneca een stukje over mijn proefschrift voor hun website geschreven; voor SMS heb ik een voordracht gehouden. Van Roche, SMS, MSD en AstraZeneca financiele compensatie gekregen voor het houden van lezingen over longkanker |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Comans |
Nucleaire geneeskundige |
geen |
geen |
geen |
|
Draaisma |
chirurg |
geen |
geen |
geen |
|
Van Geffen |
longarts |
Editorial board Cochrane Airways: Onbetaald
Commisie Bronkhorst Nvalt: Onbetaald
|
Deelname aan een investigator initiated onderzoek naar COPD firma Novartis. Financiering is overgemaakt aan UMCG; Voor de bedrijven Chiesi, Boehringer en AstraZeneca deelname aan adviesraden. De hiervoor gebruikelijke CGR vergoeding wordt geweigerd. Reiskosten worden wel vergoed. |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Hartemink |
chirurg |
"Faculty NVALT cursus oncologie voor de longarts Bestuurslid tumorwerkgroep thoracale oncologie AvL commissielid "Kwaliteit" longchirurgijn Nederland Specialisten adviesraad longkanker Nederland Commissielid Wetenschap DLCA-S Bestuurslid PLCRG (research longkanker)" |
Diverse studies die de rol van neo adjuvante immunotherapie bij stadium I, II en III NSCLC onderzoeken |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Claessens |
longarts |
Lid sectie oncologie NVALT - onbetaald Incidenteel adviesraad Astra Zeneca - betaald Gelegenheidsredacteur iPulmonologist - betaald Bestuurslid Holland-Stellenbosch Medical Foundation - onbetaald |
Binnen ons ziekenhuis nemen wij deel en hebben wij deelgenomen aan verscheidende industrie-gedreven klinische trials, onder andere van Astra Zeneca, MSD, BMS, Eli-Lilly en regeneron. Hierbij bestond er onzerzijds geen persoonlijk financieel belang. |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
De Ruysscher |
radiotherapeut-oncoloog |
Hoogleraar Radiotherapie-Oncologie KU Leuven, België. Betaald. |
Onderzoek gefinancierd door Bristol-Myers-Squibb (principal investigator).
Advisory board van Bristol-Myers-Squibb, Roche/ Genentech, Merck/ Pfizer, Astra-Zeneca, Celgene. (betaald aan Maastro clinic) |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Schaefer-Prokop |
radioloog |
|
geen |
geen |
|
Schouwink |
longarts |
Voorzitter bestuur Emil starkenstein Stichting, onbezoldigd |
Hij heeft in het verleden (2015, 2016) tweemaal deelgenomen aan een adviesraad. |
Afgesproken om gedurende het project deelname aan adviesraden stop te zetten. |
|
Schuuring |
Klinisch Moleculair Bioloog in de Pathologie |
"Adviseur/KMBP voor Moleculaire Pathologie voor de Stichting Pathologie Friesland in Leeuwarden (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Martini Ziekenhuis te Groningen en Pathologie SSZOG/OZG in Winschoten (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Treant Zorggroep Bethesda ziekenhuis in Hoogeveen (onbetaald)
Adviseur/KMBP voor Moleculaire Pathologie voor Pathologie van Isala in Zwolle (onbetaald)
Bestuurslid van de NVVP (Nederlandse Vereniging voor Pathologie) (onbetaald)
Bestuurslid/voorzitter van de NVVP-sectie Klinische Moleculaire Experimentele Pathologie (onbetaald)
Lid stuurgroep ZONMW-PATH: “Optimising Access to Personalised Cancer Therapy in the Netherlands; from Tissue to Therapy” (www.netwerk-path) (onbetaald)
Scientific Advisory Board. ESP-Quality Control committee (onbetaald)" |
Adviseur/consultant met betrekking tot (moleculaire) diagnostiek voor longkanker (en andere maligniteiten) voor de firma's AstraZeneca, Roche, Pfizer, Novartis, BMS, BioRad, Amgen, BioCartis (honoraria komen op een rekening op UMCG)
Adviseur/scientific expert voor organisatie van (inter)nationale ringstudies voor weefsel en plasma tbv diagnostiek van longkanker (External Quality Assessment) voor de European Society of Pathology (ESP) en overkoepelende IQNPATH
lezingen, onderwijs, nascholing op het gebied van de moleculaire pathologie van longkanker deels tegen vergoeding van firma zoals AstraZeneca, Roche, Pfizer, Novartis, BioRad, BioCartis (honoraria komen op een rekening op UMCG)
financiële ondersteuning voor onderzoek ontvangen van (als PI verantwoordelijk voor een workpackage (onderdeel) van het project) -Boehringer Ingelheim FGFR1 study / The NVALT-17 Study - Roche, Cobas / BMS (CA209-759) - |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Thunnissen |
patholoog |
histogenex, consultant long pathologie; training onder andere PD-L1. bezoldigd |
Investigator initiated research Pfizer naar ALK IHC+ m+ NSCLC (principal investigator)
advisory board bij farmaceutische industrie in verleden (MSD, Pfizer, Clovis, BMS, AstraZeneca, Amgen, Diaceutics, Abbvie,) bezoldigd tegen standaard tarief.
Adviseur UKNEQAS= organisation for external quality assurance in UK (onbezoldigd)" |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Von der Thüsen |
patholoog |
|
deelname advisory boards: AbbVie BMS MSD Roche" |
Aangezien een groot aantal werkgroepleden een potentiële verstrengeling van belangen heeft, is besloten dat het niet werkbaar is het werkgroeplid uit te sluiten als trekker of uit te sluiten bij het formuleren van overwegingen en aanbevelingen. Besloten is aanbevelingen zoveel mogelijk te formuleren tijdens een werkgroepvergadering. |
|
Verhagen |
Cardio-thoracaal chirurg |
|
geen |
geen |
|
van der Wekken |
longarts |
|
Deelname aan eenmalige adviesraden voor: AstraZeneca, BMS, Roche, MSD, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
lectures voor AstraZeneca, Roche, BMS, Novartis, Pfizer, Boehringer-Ingelheim (geld gaat naar UMCG)
"Research grant voor investigator initiated study door AstraZeneca voor indicatie die niets met de huidige richtlijn ontwikkeling te maken heeft (geld gaat naar UMCG)
De afdeling longoncologie doet mee aan verschillende internationale onderzoeken, die betaald worden aan het UMCG door BMS, MSD, Roche, Novartis, AbbVie, Boehringer-Ingelheim, Pfizer, ARIAD (Takeda)." |
In verband met gemelde belangen is gezocht naar een nieuwe voorzitter zonder potentiële verstrengeling van belangen. Van de Wekken is vice-voorzitter die onder andere vergaderingen leidt. Schouwink zal onder andere zorgvuldigheid tijdens proces van formuleren van aanbevelingen bewaken. |
|
Moret-Hartman |
adviseur richtlijnontwikkeling |
- |
getrouwd met praktijkhoudend huisarts |
- |
|
Hofstede |
adviseur richtlijnontwikkeling |
- |
|
- |
Inbreng patiëntenperspectief
Er is een focusgroepbijeenkomst georganiseerd om knelpunten en aandachtspunten voor goede zorg te inventariseren bij patiënten met niet-kleincellig longcarcinoom. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de module. De conceptmodules zijn tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep en de patiëntenvereniging Longkanker Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat dit proces reeds is verankerd in de kwaliteitsregistratie longkanker (https://dica.nl/).
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door Sectie oncologie van de NVALT (SON) kwam naar voren dat er een noodzaak was voor de herziening van de richtlijn niet-kleincellig longarcinoom. Tijdens een invitational conference zijn er knelpunten aangedragen door Longkanker Nederland, de Inspectie Gezondheidszorg en Jeugd (IGJ), de Nederlandse Associatie Physician Assistants (NAPA), de Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR - voor systematische reviews.
- Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS - voor observationeel onderzoek.
- QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de Kennislacunes. Deze zijn te vinden bij de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodules zijn aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zijn de conceptmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve modules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2004 – maart 2019
|
1 (non-small cell lung and (carcinoma* or neoplasm* or cancer*)).ti,ab,kw. or exp *Carcinoma, Non-Small-Cell Lung/ or nsclc.ti,ab,kw. or (adenocarcinoma adj5 (lung or broncho*)).ti,ab,kw. (76992) 2 exp Endosonography/ or (endobronchial adj3 (ultraso* or echo*)).ti,ab,kw. or ebus.ti,ab,kw. or eus.ti,ab,kw. or endoscop*.ti,ab,kw. or echoendoscop*.ti,ab,kw. or endosono*.ti,ab,kw. (200448) 3 1 and 2 (856) 4 limit 3 to (english language and yr="2004 -Current") (709) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (387254) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1842210) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3150408) 8 4 and 5 (31) 9 4 and 6 (88) 10 9 not 8 (79) 11 4 and 7 (307) 12 11 not 8 not 10 (253) 13 8 or 10 or 12 (363) = 363 |
460 |
|
Embase (Elsevier) |
('non small cell lung cancer'/exp/mj OR ('non-small cell lung':ti,ab AND (carcinoma*:ti,ab OR neoplasm*:ti,ab OR cancer*:ti,ab)) OR nsclc:ti,ab OR ((adenocarcinoma NEAR/5 (lung OR broncho*)):ti,ab)) AND ('endobronchial ultrasonography'/exp OR ((endobronchial NEAR/3 (ultraso* OR echo*)):ti,ab) OR ebus:ti,ab OR 'endoscopic ultrasonography'/exp OR eus:ti,ab OR endoscop*:ti,ab OR echoendoscop*:ti,ab OR endosono*:ti,ab) AND (2004-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 36
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 155
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case controlstudy'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observationalNEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 32
= 223 |
