Drainage met dubbel J katheter versus nefrostomie katheter in de behandeling van obstructieve ureterolithiasis
Uitgangsvraag
Welk type drainage is het beste bij obstructieve ureterolithiasis?
Aanbeveling
Aanbeveling-1
Bespreek met patiënten met obstructieve ureterolithiasis de voor- en nadelen van het plaatsen van een nefrostomie katheter en het plaatsen van een dubbel J katheter.
Bespreek met patiënt dat zowel een nefrostomie katheter als een dubbel J katheter ter drainage van obstructieve ureterolithiasis even goed zijn ter behandeling van
- Infectie
- Pijn
- Nierfunctie
- Complicaties
- Spontane steenlozing
- Succes rate
Aanbeveling-2
Geef de voorkeur aan drainage met een nefrostomie katheter bij patiënten met dreigende septische shock.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn een systematische review en twee gerandomiseerde studies van lage kwaliteit gevonden die rapporteren over de uitkomstmaten herstel van nierfunctie, herstel van infectie, pijn, opname duur, complicaties, spontane steen passage en kans van slagen. Er zijn geen studies gevonden die rapporteren over de uitkomstmaten bijwerkingen, IC opname en kosten.
Voor opnameduur lijkt het erop dat behandeling met een dubbel J katheter gunstiger is dan behandeling met nefrostomie katheter, voor de overige uitkomstmaten is de bewijskracht te laag om uitspraken over de richting van het effect te doen.
Het is echter onduidelijk in welke setting de dubbel J katheter en nefrostomie katheter plaatsingen werden verricht: in poliklinische setting of klinische setting en of de keuze van drainagemethode beïnvloed werd door de aanwezigheid van een infectie?
Lokale afspraken, logistiek, ervaring en beschikbaarheid bepalen regelmatig de opname duur.
De uitkomstmaat bijwerkingen werd wel gerapporteerd in een observationele studie (Joshi, 2021). In deze studie werd een vergelijking gemaakt tussen behandeling met een dubbel J katheter (n=21) ten opzichte van een nefrostomie katheter (n=13). Follow-up tijd was 12 ± 5 dagen in de PCN en 28.2 ± 14 dagen in de dubbel J katheter groep, waarna een vragenlijst werd afgenomen om bijwerkingen in kaart te brengen. Bijwerkingen werden beschreven als pijn en urinary symptoms. Met betrekking tot pijn rapporteerden 54% van de patiënten in de PCN-groep ten opzichte van 42% in de dubbel J katheter groep pijn in de lendenstreek (p=0.770) en 31% van de patiënten in de PCN groep ten opzichte van 68% in de Dubbel J katheter groep pijn in de blaas (p=0.083). Patiënten behandeld met de dubbel J katheter ervaarden meer hematurie (p=0.022) en mictieklachten (dysurie (p=<0,0001), urgentie (p=0,0020) en frequency (p=0,0202)) dan patiënten behandeld met PCN. Tot slot ervaarden patiënten in de dubbel J katheter groep meer dagelijks ongemak dan patiënten in de PCN-groep (p=0.023). Samengenomen suggereerden de auteurs dat behandeling met PCN minder bijwerkingen/klachten geeft dan een dubbel J katheter. De bewijskracht voor deze studie is zeer laag. Tevens zijn de uitkomstmaten sterk gerelateerd aan de dubbel J katheter plaatsing en zijn andere zaken zoals de verzorging en wisselingen van een nefrostomie katheter niet onderzocht.
Voor een beperkt aantal patiënten/subgroepen wordt er een duidelijke voorkeur voor type interventie geadviseerd, namelijk: het gebruik van antistolling (voorkeur dubbel J katheter), of het niet retrograad kunnen bereiken van de nier bij een niet passeerbare ureter (voorkeur NSK) of bij sommige typen urine deviaties (voorkeur NSK).
Rationale van de aanbeveling- 1: weging van argumenten voor en tegen de interventies
De uitkomstmaten: herstel van de nierfunctie, herstel van infectie, pijn, complicaties, spontane steenpassage en succes rate tonen geen significant verschil tussen de interventie (dubbel J) en de nefrostomie katheter plaatsing. Ten aanzien van bijwerkingen, IC opnames en kostenaspect zijn geen studies voorhanden om hier een uitspraak over te doen.
De bewijskracht voor alle genoemde effecten van interventie (dubbel J katheter versus nefrostomie katheter) is zeer laag met uitzondering van de ziekenhuisduur als uitkomstmaat. Die is laag. De reden hiervan zijn bias risico, mogelijke randomisatie fouten, ongeblindeerd onderzoek, onduidelijke confouder correctie en onduidelijke inclusie dus mindere precisie. Lokale afspraken met betrekking tot poliklinisch of klinische interventies voor deze twee technieken kunnen hier belangrijk aan bijdragen.
Vanwege de bovengenoemde beperkingen is er een kennislacune aanwezig ten aanzien van deze uitgangsvraag, met name ten aanzien van de patiënt gerelateerde uitkomsten zoals irritatieve mictieklachten, hematurie, urineweginfecties en verzorging van dubbel J katheters en nefrostomie katheters.
Op basis van de uitkomstmaten kan er vanuit de literatuursearch geen eenduidig besluit worden genomen over de interventie bij voorkeur bij een patiënt met obstructieve nefropathie. Wel zien we dat de ziekenhuisopname duur significant korter is bij de dubbel J katheter plaatsing, waarschijnlijk te verklaren door plaatsing in poliklinische setting.
Patiënten kunnen door het hebben van een nefrostomie katheter gehinderd worden in hun ADL omdat er een externe slang met opvangzak vanuit de flank is aangebracht welke ook nog eens verzorging nodig heeft en potentieel kan luxereen. De doubleJ katheter zie je niet extern maar kan blaas gerelateerde klachten geven zoals pijn en loze aandrang maar kan ook refluxpijn geven tijdens de mictie. De slangen dienen met enige regelmaat te worden vervangen wat een kleine procedure inhoudt poliklinisch of klinisch, afhankelijk van de lokale afspraken.
Gezien bovenstaande is dus het Samen Beslissen van belang.
Rationale van de aanbeveling-2: weging van argumenten voor en tegen de interventie
De werkgroep voelt de behoefte om een expert opinion mee te geven in het geval wordt overwogen een drainage te verrichten bij een afvloedbelemmering van de nier in combinatie met een ernstige sepsis. De opinie bestaat daaruit dat een drainage via het plaatsen van een nefrostomie katheter een (lichte) voorkeur heeft (bij het voorhanden zijn van beide technieken), ten aanzien van de snelheid waarmee decompressie bereikt kan worden alsmede de controleerbaarheid van de drainage, welke niet makkelijk kan worden bereikt na plaatsing van een dubbel J katheter.
Onderbouwing
Achtergrond
Het draineren van de hoge urinewegen is noodzakelijk zodra er sprake is van een obstructie door ureterolithiasis die daardoor een infectie veroorzaakt, nierfunctie achteruitgang of forse pijnklachten geeft. Indien deze obstructie niet wordt behandeld is er een grote kans op morbiditeit en zelfs mortaliteit. Het behandelen van een urinewegobstructie kan middels een retrograde of antegrade route, achtereenvolgens de dubbel J katheter en de nefrostomie katheter. Beide drainage methoden hebben zo hun eigen voor- en nadelen. Deze zijn ten aanzien van de techniek, kosten, consequenties voor de patiënten en hun kwaliteit van leven verschillend maar er is ook onduidelijkheid welke techniek de voorkeur heeft bij bijvoorbeeld alleen pijn of nierfunctieachteruitgang ten gevolge van obstructie of bij een gelijktijdig aanwezige infectie. In de keuze van de 2 technieken spelen ook beschikbaarheid van personeel, ervaring en behandelruimte een rol. Er is dan ook een grote praktijkvariatie.
Met deze specifieke vraag doen we een aanbeveling ten aanzien van de drainage voorkeur bij obstructieve ureterolithiasis, al dan niet gecompliceerd door infectie.
Conclusies / Summary of Findings
|
Very low GRADE |
It is uncertain what the effects of drainage with double J catheter compared to percutaneous nephrostomy are on recovery of kidney function in treatment of patients with obstructive ureterolithiasis.
Sources: Xu, 2021 |
|
very low GRADE |
It is uncertain what effects of drainage with double J catheter compared to percutaneous nephrostomy are on recovery of infection in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021; Xu, 2021 |
|
Very low GRADE |
It is uncertain what effects of drainage with double J catheter compared to percutaneous nephrostomy are on pain in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021 |
|
low GRADE |
Length of hospital stay might be shorter after treatment through double J catheter compared to percutaneous nephrostomy in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021; Xu, 2021 |
|
Very low GRADE |
It is uncertain what effects of drainage with double J catheter compared to percutaneous nephrostomy are on complications in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021; Ahmad, 2013 |
|
Very low GRADE |
It is uncertain what effects of drainage with double J catheter compared to percutaneous nephrostomy are on spontaneous stone passage in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021 |
|
Very low GRADE |
It is uncertain what effects of drainage with double J catheter compared to percutaneous nephrostomy are on success rate in treatment of patients with obstructive ureterolithiasis.
Sources: Hinojosa-Gonzalez, 2021; Ahmad, 2013 |
|
No GRADE |
The effects of drainage with double J catheter compared to percutaneous nephrostomy in treatment of patients with obstructive ureterolithiasis on side effects are unknown. None of the studies reported on side effects. |
|
No GRADE |
The effects of drainage with double J catheter compared to percutaneous nephrostomy in treatment of patients with obstructive ureterolithiasis on ICU admission are unknown. None of the studies reported on ICU admission. |
|
No GRADE |
The effects of drainage with double J catheter compared to percutaneous nephrostomy in treatment of patients with obstructive ureterolithiasis on costs are unknown. None of the studies reported on costs. |
Samenvatting literatuur
Description of studies
Hinojosa-Gonzalez (2021) performed a systematic review and meta-analysis with the objective to analyze available evidence on various clinical and quality of life (QoL) parameters to determine the advantages and disadvantages associated with percutaneous nephrostomy (PCN) and ureteric stenting (URS) for decompression in acute stone-related obstruction. Searches were performed in online databases PubMed, Web of Science, Scopus and Google Scholar until August 2020. Inclusion criteria of the systematic review were: comparison of demographic outcomes, clinical outcomes, QoL, and resource allocations of adult subjects with acute obstructive urolithiasis associated with infection or kidney injury treated through either URS or PCN. Excluded studies did not provide statistical comparison, the included patients were not adults or were pregnant. Length of follow-up was not reported.
Ten articles were included (n=772 patients of whom 420 treated with URS and 352 with PCN). The included study designs were five randomized controlled trials, of which two were prospective trials and three retrospective trials.
Ahmad (2013) conducted a randomized controlled trial to compare complication rate of PCN and double J ureteral stenting in the management of obstructive uropathy. A total of 300 patients were included of whom 100 were treated with double J stent and 200 with PCN. The majority of patients were male (72.7%). Age at baseline was 43 ± 9.65 years and 40 ± 10.35 years in the double J stent and PCN group respectively (p=<0.001). It should be noted that not all patients had an obstruction due to stone disease (25% in double J stent and 35% in PCN group) but due to for instance carcinomas. Outcome measures were complications and procedural success rate. Outcomes were assessed immediately after the procedure and after fifteen days to a maximum of three months (in patients experiencing complications).
The randomized controlled trial by Xu (2021) aimed to compare the efficacy of PCN versus URS for acute upper urinary tract obstruction with urosepsis in terms of recovery of infection, kidney function and length of hospital stay. Of the 65 patients included in the study, 35 were treated through PCN and 30 were treated through URS. Mean age was 65 years (IQR 51.5 to 71 years), the majority of patients were female (63%) and mean BMI was 23.83 kg/m2 (IQR 21.73 to 26.12). Follow-up period was defined as the time for patients’ body temperature to return to normal and biochemical indicators were assessed 3 days after treatment.
Results
- Recovery of kidney function
One randomized controlled trial (Xu, 2021) reported on recovery of kidney function expressed as postoperative serum creatinine. The outcome was assessed three days after treatment and did not differ between the double J stent (n=30, median serum creatinine 82.1 (mmol/L); IQR (64.1 to 113.6)) and the PCN group (n= 35, median serum creatinine 78.4 (mmol/L); IQR (65.4 to 104.6)) (p= 0.916). The 95% CI was not reported.
- Recovery of infection
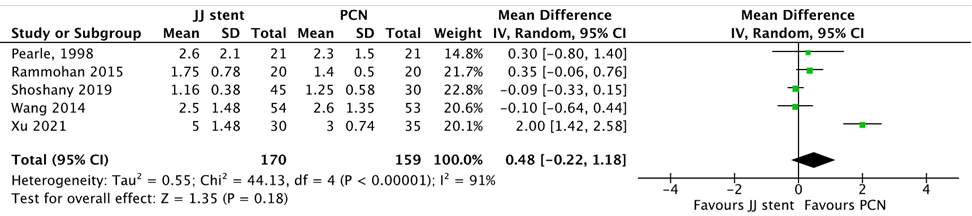
Four studies included in the systematic review (Hinojosa-Gonzalez, 2021) and one study published thereafter (Xu, 2021) reported the outcome recovery of infection. Both studies reported on time to normal temperature (shown in Figure 1). Additionally, Hinojosa-Gonzalez (2021) reported on time to normal white blood cell count and Xu (2021) reported on postoperative white blood cell count and postoperative CRP.
Time to normal temperature was determined for 170 patients treated through double J stent and 159 patients treated through PCN. No significant difference was found in normalization times, the mean difference was 0.48 (95% CI -0.22 to 1.18) (p=0.18) in favor of PCN (Figure 1).
Figure 1 Time to normal temperature, comparison double J stent versus PCN
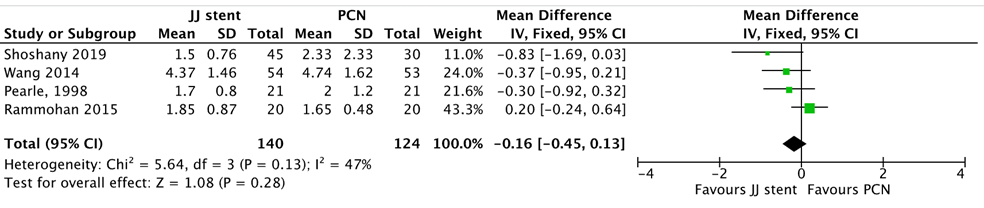
Time to normal white blood cell count (WBC) was reported in four studies included in Hinojosa-Gonzalez (2021), 140 patients were treated through double J stent and 124 were treated through PCN. The mean difference was -0.16 (95% CI -0.45 to 0.13) (p=0.28) in favor of double J stent (Figure 2).
Figure 2 Time to normal WBC, comparison double J stent versus PCN
Postoperative white blood cell count as reported by Xu (2021) (measured three days after treatment) did not differ between the double J stent (n=30, median WBC count 7,12 (109/L); IQR (5.05 to 9.39) and the PCN group (n= 35, median WBC count 7,67 (109/L); IQR (6.13 to 17.24)) (p= 0.422). The 95% CI was not reported.
Finally, postoperative CRP (Xu 2021) was significantly lower in patients treated through PCN (median CRP 23.2 (mg/L); IQR (12.4 to 38)) than those treated through double J stent (median CRP 32.2 (mg/L); IQR (21.1 to 73.9)) (p=0.029). The 95% CI was not reported. Preoperative CRP was (median (IQR)) 117.7 (28.4 to 160.4) in the PCN compared to 115.3 (50.4 to 175.9) in de double J stent group (p=0.54).
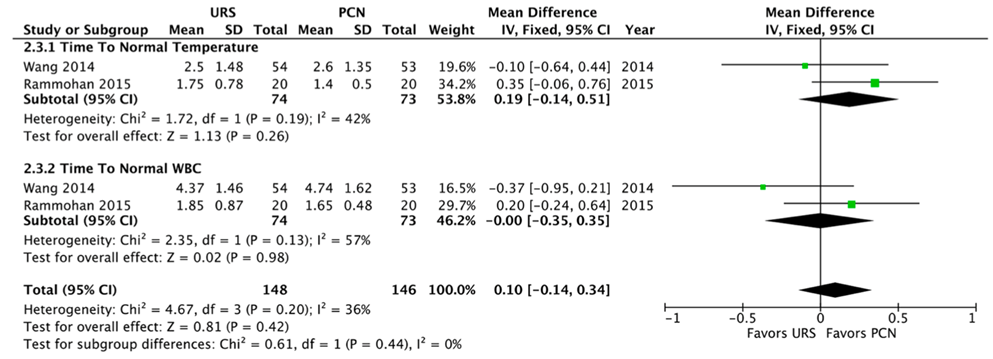
The systematic review (Hinojosa-Gonzalez, 2021) also reported on two studies that only focused on cases with related sepsis, in which time to normal temperature and time to normal white blood cell count were assessed and pooled into one outcome “urosepsis parameters”. In total 148 patients were treated through double J stent and 146 were treated through PCN. The outcome did not differ significantly between groups with a mean difference of 0.10 (95% CI -0.14 to 0.34) (p= 0.81) in favour of PCN (Figure 3).
Figure 3* Time to normal temperature and WBC in patients with sepsis, comparison double J stent versus PCN
*Figure from Hinojosa-Gonzalez, 2021
(URS = double J stent)
- Pain
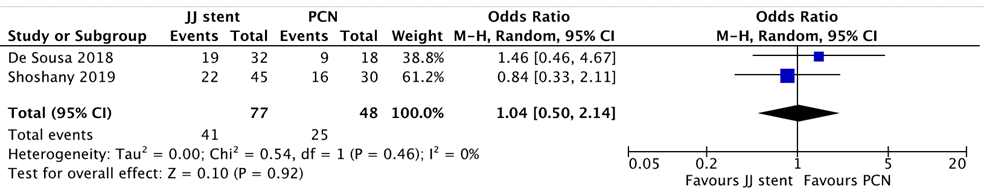
The outcome measure pain (assessed after the procedure) was reported in two studies included in the systematic review (Hinojosa-Gonzalez 2021). In total 77 patients were treated through double J stent and 48 patients were treated through PCN. There were no differences between treatments, mean difference was 1.04 (95% CI -0.50 to 2.14) (p=0.92) (Figure 4).
Figure 4 Pain, comparison double J stent versus PCN
- Length of hospital stay
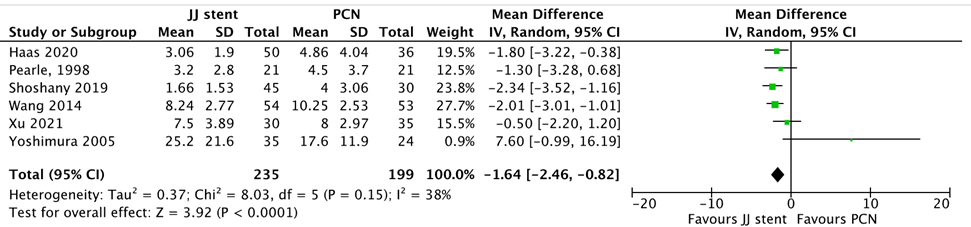
Five studies included in the systematic review (Hinojosa-Gonzalez, 2021) and the study by Xu (2021) reported on the outcome length of hospital stay (shown in Figure 5). In total, 235 patients were treated through double J stent and 199 patients were treated through PCN. Significant differences in hospital stay were found in favor of the double J stent. Mean difference was -1.64 (95% CI -2.46 to -0.82) (p=<0.0001) (Figure 5).
Figure 5 Length of hospital stay, comparison double J stent versus PCN
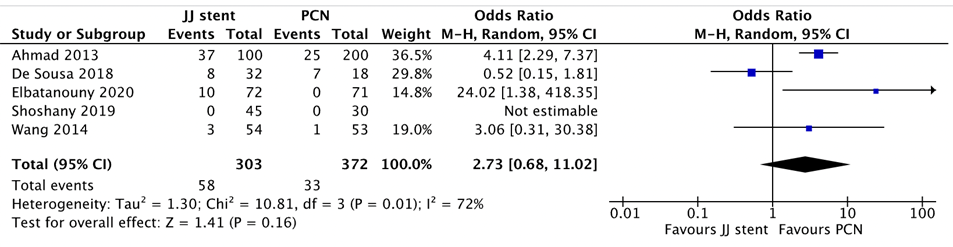
- Complications
The outcome complications was reported in four studies included in Hinojosa-Gonzalez (2021) and in the study by Ahmad (2013). In total, 303 patients were treated through double J stent and 372 patients were treated through PCN. The pooled analysis showed a complication rate of 19% in the double J stent group compared to 8.8% in the PCN group (OR=2.73 (95% CI 0.68 to 11.02)) (p=0.16) in favor of PCN (shown in Figure 6). Reported complications were fever/septicemia, hematuria, PCN dislodgement, painful trigone irritation, ureteral perforation, stent migration and stent encrustation (Ahmad, 2013). It should be noted that none of the studies reported on treatment specific complications resulting in bleeding. These complications were combined under the term “bleeding/hematuria”. Moreover, it is unclear to which Clavien-Dindo classification the reported complications belong.
Figure 6 Complications, comparison double J stent versus PCN
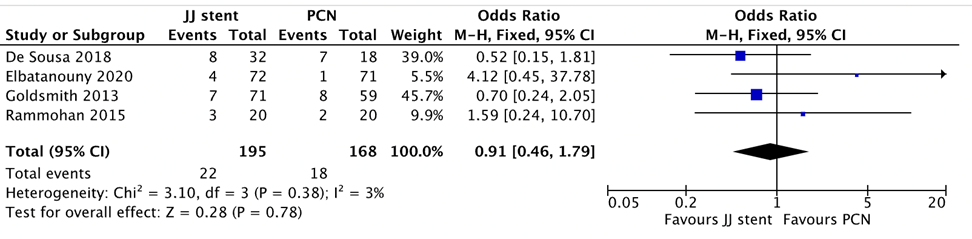
- Spontaneous stone passage
The systematic review by Honojosa-Gonzalez (2021) reported on spontaneous stone passage, based on four studies. Out of 195 patients in the double J stent group, 22 experienced spontaneous stone passage compared to 18 out of 168 patients in the PCN group (OR=0.91 (95% CI 0.48 to 1.79)) (p=0.78) in favor of PCN (Figure 7).
Figure 7 Spontaneous stone passage, comparison double J stent versus PCN
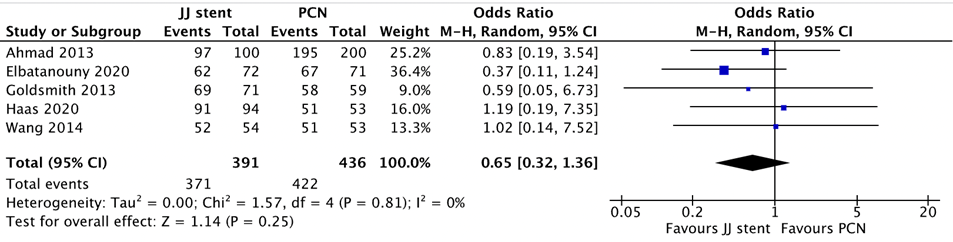
- Success rate
The systematic review by Hinojosa-Gonzalez (2021) (based on 4 included studies) and the study by Ahmad (2013) reported on success rate. In total, 391 patients were treated through double J stent and 436 patients were treated through PCN. The pooled analysis showed a success rate of 95% in the double J stent group compared to 97% in the PCN group (OR=0.65 (95% CI 0.32 to 1.36) (p=0.25) in favor of double J stent (shown in Figure 8).
Figure 8 Success rate, comparison double J stent versus PCN
8. Side effects
No studies reported on the outcome measure side effects.
9. ICU admission
No studies reported on the outcome measure ICU admission.
10. Costs
No studies reported on the outcome measure costs.
Level of evidence of the literature
Systematic reviews of randomized controlled trials and randomized controlled trials started at GRADE high.
The level of evidence regarding the outcome measure recovery of kidney function was downgraded to very low GRADE because of study limitations (risk of bias; doubts about randomization, no blinding, one level) and number of included patients (imprecision, two levels).
The level of evidence regarding the outcome measure recovery of infection was downgraded to very low GRADE because of study limitations (risk of bias; doubts about randomization, no blinding, correction for confounders unclear, one level); applicability (bias due to indirectness due to varying measures of recovery of infection, one level); number of included patients (imprecision, two levels).
The level of evidence regarding the outcome measure pain was downgraded to very low GRADE because of study limitations (risk of bias; correction for confounders unclear, one level); number of included patients (imprecision, two levels).
The level of evidence regarding the outcome measure length of hospital stay was downgraded to low GRADE because of study limitations (risk of bias; doubts about randomization, no blinding, correction for confounders unclear, one level); number of included patients (imprecision).
The level of evidence regarding the outcome measure complications was downgraded to very low GRADE because of study limitations (risk of bias; doubts about randomization, no blinding, correction for confounders unclear, one level); conflicting results (inconsistency, one level); applicability (bias due to indirectness due to varying measures of complications, one level).
The level of evidence regarding the outcome measure spontaneous stone passage was downgraded to very low GRADE because of study limitations (risk of bias; correction for confounders unclear, one level); imprecision (very wide confidence interval, 2 levels).
The level of evidence regarding the outcome measure success rate was downgraded to very low GRADE because of study limitations (risk of bias; doubts about randomization, no blinding, correction for confounders unclear, one level); conflicting results (inconsistency, one level); imprecision (very wide confidence interval, two levels)
The level of evidence regarding the outcome measures side effects, ICU admission and costs could not be assessed as the included studies did not report on these outcome measures.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of double J catheter compared to nephrostomy catheter in patients with obstructive ureterolithiasis with and without infection.
| P: patients | patients with obstructive ureterolithiasis with and without infection |
| I: intervention | double J catheter |
| C: control | nephrostomy catheter |
| O: outcome measure | recovery of infection, recovery of kidney function, pain, length of hospital stay, complications, spontaneous stone passage, success rate, side effects, ICU admission and costs |
Relevant outcome measures
The guideline development group considered recovery of infection, recovery of kidney function and pain as a critical outcome measure for decision making; and length of hospital stay, complications, spontaneous stone passage, success rate, side effects and costs as important outcome measures for decision making.
For this question a clinically relevant difference was not determined at forehand.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until March 9th, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 809 hits. Studies that met the following criteria were eligible for selection: studies reporting original data, systematic reviews, randomized controlled trials (RCTs) and observational studies reporting on the effects of double J catheter compared to nephrostomy catheter in patients with obstructive ureterolithiasis. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, twelve studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
One systematic review and meta-analysis (Hinojosa-Gonzalez, 2021) was selected and supplemented with two RCT’s (Ahmad, 2013 & Xu, 2021) for the analysis of literature.
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Ahmad, I., Pansota, M. S., Tariq, M., Saleem, M. S., Tabassum, S. A., & Hussain, A. (2013). Comparison between double J (DJ) ureteral stenting and percutaneous nephrostomy (PCN) in obstructive uropathy. Pakistan journal of medical sciences, 29(3), 725.
- Hinojosa-Gonzalez, D. E., Torres-Martinez, M., Villegas-De Leon, S. U., Galindo-Garza, C., Roblesgil-Medrano, A., Alanis-Garza, C., ... & Flores-Villalba, E. (2021). Emergent urinary decompression in acute stone-related urinary obstruction: A systematic review and meta-analysis. Journal of Clinical Urology, 20514158211017027.
- Xu, Z. H., Yang, Y. H., Zhou, S., & Lv, J. L. (2021). Percutaneous nephrostomy versus retrograde ureteral stent for acute upper urinary tract obstruction with urosepsis. Journal of Infection and Chemotherapy, 27(2), 323-328.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ahmad 2013 |
Type of study:
Setting and country:
Funding and conflicts of interest: Not reported |
Inclusion criteria: Exclusion criteria: Patients with: - uremia due to bladder outflow obstruction
N total at baseline: Intervention: 200 Control: 100
Important prognostic factors2: For example age ± SD: I: 40 ± 10,35 C: 43 ± 9,65
Sex: in full sample
Groups comparable at baseline? No. age differed significantly with on average older patients in JJ stent group.
In addition, not all patients had an obstruction due to stone disease (25% in jj stent group and 35% in PCN group) but due to for instance carcinomas |
Describe intervention (treatment/procedure/test):
Relief of urinary tract obstruction by PCN
|
Describe control (treatment/procedure/test):
Relief of urinary tract obstruction by JJ ureteric stent |
Length of follow-up: Immediately after procedure and 15 days to 3 months
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 2
Outcome measure 3
Outcome measure 4
Outcome measure 5
Outcome measure 6 Spontaneous stone passage Not reported
Outcome measure 7 I: 97,5%
Outcome measure 8 Not reported
Outcome measure 9
Outcome measure 10 Costs |
Authors conclude:
“Ultrasound guided percutaneous nephrostomy is a safe, quick and better method of temporary urinary diversion than double J stenting for management of obstructive uropathy with lower incidence of complications”.
Reported complications per condition: I: Fever/septicemia (7), hematuria (9), PCN dislodgement (9) |
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
1st author, year of publication
individual study characteristics deduced from Hinojosa-Gonzalez 2021
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of 5 RCTs, 3 retrospective- and 2 prospective trials
Literature search up to August 2020
A: Pearle, 1998 B: Mokhalji, 2001 C: Yoshimura, 2005 D: Goldsmith, 2013 E: Rammohan, 2015 F: Wang, 2015 G: De sousa, 2018 H: Shoshany, 2019 I: Elbotouany, 2020 J: Haas, 2020
Study design: B: RCT, parallel C: retrospective cohort D: retrospective cohort E: RCT, parallel F: RCT, parallel G: Prospective trial H: Prospective trial I: RCT, parallel J: retrospective cohort
Setting and Country: B: Multi centre, Germany & Syria C: Single centre, Japan D: Single centre, USA E: F: Multi centre, Taiwan G: Multi centre, Portugal H: Multi centre, Israel I: Single centre, Egypt J:
Source of funding and conflicts of interest: For included studies not reported.
|
Inclusion criteria SR: Exclusion criteria SR: 10 studies included.
Important patient characteristics at baseline:
N, mean age (yrs) A: B: Not reported C: D: E: URS: 20, 46,05, PCN: 20, 46,5 F: G: H: I: J:
Sex: Not reported in SR
B: Not reported C: D: E: Not reported F: G: H: I: Not reported J: Not reported
Groups comparable at baseline? Yes, no significant differences in mean age and BMI |
Describe intervention:
All studies: adult subjects with treatment of acute obstructive urolithiasis treated through either URS or PCN – Details of individual studies not reported
|
Describe control:
Not applicable/not reported |
Endpoint of follow-up:
Not reported
For how many participants were no complete outcome data available?
Not reported
|
Outcome measure 1 Infection – Time to normal white blood cell count A: -0,30 (-0,92 to 0,32) B: Not reported C: Not reported D: Not reported E: 0,20 (-0,24 to 0,64) F: -0,37 (-0,95 to 0,21) G: Not reported H: -0,83 (-1,69 to 0,03) I: Not reported J: Not reported
Pooled effect (fixed effects model): Heterogeneity (I2): 47%
Time to normal temperature B: Not reported C: Not reported D: Not reported E: 0,95 (-0,66 to 0,76) F: -0,10 (-0,64 to 0,44) G: Not reported H: -0,09 (-0,33 to 0,15) I: Not reported J: Not reported
Pooled effect (fixed effects model): Heterogeneity (I2): 21%
In patients with sepsis: Time to normal white blood cell count B: Not reported C: Not reported D: Not reported E: 0,20 (-0,24 to 0,64) F: -0,37 (-0,95 to 0,21) G: Not reported H: Not reported I: Not reported J: Not reported
Heterogeneity (I2): 57%
B: Not reported C: Not reported D: Not reported E: 0,35 (-0,06 to 0,76) F: -0,10 (-0,64 to 0,44) G: Not reported H: Not reported I: Not reported J: Not reported Heterogeneity (I2): 42%
Outcome measure 2
Effect measure: OR [95% CI]: B: Not reported C: Not reported D: Not reported E: Not reported F: Not reported G: 1,46 (0,46 to 4,67) H: 0,84 (0,33 to 2,11) I: Not reported J: Not reported
Heterogeneity (I2): 0%
Outcome measure 4 Length of hospital stay Effect measure: mean difference [95% CI]: A: -1,30 (-3,28 to 0,68) B: Not reported C: 7,60 (-0,99 to 16,19) D: Not reported E: Not reported F: -2,01 (-3,01 to -1,01) G: Not reported H: -2,34 (-3,52 to -1,16) I: Not reported J: -1,94 (-2,57 to -1,30)
Pooled effect (fixed effects model): Heterogeneity (I2): 29%
Outcome measure 5 Effect measure: OR [95% CI]: B: Not reported C: Not reported D: Not reported E: Not reported F: 3,06 (0,31 to 30,38) G: 0,52 (0,15 to 1,81) H: Not estimable I: 24,02 (1,38 to 418,35) J: Not reported Heterogeneity (I2): 74%
Outcome measure 6 Spontaneous stone passage B: Not reported C: Not reported D: 0,70 (0,24 to 2,05) E: 1,59 (0,24 to 10,70) F: Not reported G: Not reported H: 0,52 (0,15 to 1,81) I: 4,12 (0,45 to 37,78) J: Not reported Heterogeneity (I2): 3%
Outcome measure 7 Effect measure: OR [95% CI]: B: Not reported C: Not reported D: 0,59 (0,05 to 6,73) E: Not reported F: 1,02 (0,14 to 7,52) G: Not reported H: Not reported I: 0,37 (0,11 to 1,24) J: 1,19 (0,19 to 7,35)
Pooled effect (fixed effects model): OR 95% CI Heterogeneity (I2): 0%
Outcome measure 8 Not reported
Outcome measure 9
Outcome measure 10 Costs
|
Facultative:
Brief description of author’s conclusion “Intraoperative parameters such as operative time might be influenced by local staff expertise. Physicians should advise patients based on their preference after a thorough and honest discussion on the side effect profiles of each technique, on local skill levels, and on resource availability in order to tailor urinary drainage methods better until definitive treatment”.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question “Study heterogeneity and scarcity of randomized controlled trials with low patient populations limit the quality evidence produced by this study. Further studies could aim to replicate RCTs described in the current review with larger patient pools”.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Not reported. “Randomized control trials were assessed for bias using Cochrane’s Risk of Bias Tool. Overall, all studies were graded for evidence level using the Oxford Centre for Evidence-Based Medicine—Levels of Medicine grading system”. Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Not reported
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis)
Not applicable |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
1st author, year of publication
Xu 2021 |
Type of study: RCT
Setting and country: Hospital, single centre, Japan
Funding and conflicts of interest: No conflict of interest. |
Inclusion criteria: -upper urinary tract stones and urosepsis upon admission
Exclusion criteria:
- urethral or ureteral stricture, urinary diversion - pregnancy - solitary kidney - severe sepsis (diagnosed as bacterial septic shock) - septic shock - unwillingness or impossibility to commit to the study follow-up protocol
N total at baseline: Intervention: 35 Control: 30 (started with 37, but failed treatment, not included in analysis)
Important prognostic factors2: Age, mean (IQR): I: 65 (49 to 72) C: 64,5 (54 to 70)
Sex: I: 37% M C: 37% M
BMI, mean (IQR)
Groups comparable at baseline? Yes. No differences were observed between the two groups in terms of height, body weight, BMI, hospital stay, hypertension, diabetes mellitus, or history of urolithiasis or acute pyelonephritis.
|
Describe intervention (treatment/procedure/test):
Percutaneous nephrostomy (PCN) for treatment of upper urinary trat obstruction with urosepsis
|
Describe control (treatment/procedure/test):
Retrograde ureteric stent (RUS) for treatment of upper urinary trat obstruction with urosepsis |
Length of follow-up: Time for patients’ body temperature to return to normal and biochemical indicators 3 days after treatment
Loss-to-follow-up: No loss to follow-up
Incomplete outcome data: I (PCN):
Reasons:
|
Outcome measures and effect size (mean, IQR and p-value):
Postoperative white blood cell count (109/L)
Time to normal temperature (hours)
Outcome measure 2
Outcome measure 3
Outcome measure 4
Outcome measure 5
Outcome measure 6 Spontaneous stone passage Not reported
Outcome measure 7 Not reported
Outcome measure 8 Not reported
Outcome measure 9
Outcome measure 10 Costs |
Authors conclusion:
“Both RUS and PCN are effective drainage methods. RUS has a higher failure rate than PCN. RUS was less effective than PCN in improving symptoms in patients with urosepsis. Therefore, PCN is recommended as the primary emergency drainage method for patients with urosepsis, especially for patients with high fever and severe inflammation”.
|
Risk of bias systematic review
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Hinojosa-Gonzalez 2021 |
Yes |
Yes |
Yes |
unclear
Potential confounders not reported per study |
Unclear |
Yes |
Yes |
No
No mention of publication bias |
No
Only reported for the systematic review |
Risk of bias assessment intervention studies
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Ahmad, 2013 |
Definitely yes;
Reason: Randomization with random numbers table |
Probably no;
Reason: Random numbers table was used, no mention of concealment |
Definitely no;
Reason: Patients, health care providers not blinded (blinding of outcome assessors and data analysts not reported) |
Probably yes;
Reason: No loss to follow-up reported in intervention and control group and measurement was taken immediately after the procedure |
Probably yes;
Reason: Relevant outcomes were reported |
Probably no;
Reason: Sample consisted of patients with varying afflictions, not only stone disease |
High
|
|
Xu, 2021 |
Definitely yes;
Reason: Randomization with random numbers table |
Probably no;
Reason: Random numbers table was used, no mention of concealment |
Definitely no;
Reason: Patients, health care providers not blinded (blinding of outcome assessors and data analysts not reported) |
Probably yes;
Reason: Loss to follow-up was infrequent in intervention and control group. Incomplete outcome data was due to treatment failure |
Probably yes;
Reason: Relevant outcomes were reported; |
No information;
Reason: No information |
High |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Blanco, 2017 |
In pregnant patiënts |
|
Dai, 2021 |
In pregnant patiënts |
|
De Sousa Morais, 2019 |
Included in SR Hinojosa 2021 |
|
Deng, 2020 |
In Chinese |
|
Doronchuk, 2010 |
In Russian |
|
Elbatanouny, 2020 |
Included in SR Hinojosa 2021 |
|
Ghous, 2021 |
Cross sectional study |
|
Goldsmith, 2013 |
Included in SR Hinojosa 2021 |
|
Low, 2021 |
No comparison JJ vs PCN |
|
Mokhmalji, 2001 |
Included in SR Hinojosa 2021 |
|
Netsch, 2016 |
In German |
|
Osorio, 2008 |
Narrative review |
|
Osorio, 2018 |
Bundel of abstracts |
|
Pandey, 2018 |
Outcomes do not match PICO |
|
Pasiechnikov, 2015 |
Outcomes do not match PICO |
|
Pearle, 1998 |
Included in SR Hinojosa 2021 |
|
Qi, 2020 |
In Chinese |
|
Ramsey, 2010 |
Narrative review |
|
Scheidt, 2020 |
Summary of data |
|
Shoshany, 2019 |
Included in SR Hinojosa 2021 |
|
Trapeznikova, 1999 |
In Russian |
|
Wang, 2016 |
Included in SR Hinojosa 2021 |
|
Weltings, 2019 |
More recent systematic review that fit the PICO available |
|
Zul, 2021 |
Systematic review available that better fits the PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met nierstenen.
Werkgroep
- Dr. F. (Frank) d’Ancona (voorzitter) , Uroloog, NVU
- Dr. S. (Stijn) Roemeling, Uroloog, NVU
- Drs. B.M. (Linda) Dirven-Konijn, Radioloog, NVvR
- Dr. D. (Diederick) Duijvesz, Uroloog, NVU
- Dr. B.M.A. (Barbara) Schout, Uroloog, NVU
- Drs. R. (Rozanne) Tijssen, AIOS Spoedeisende geneeskunde, NVSHA
Meelezers
- Drs. G.M. (Guido) Kamphuis, Uroloog, NVU
- Drs. B. (Bart) van der Heij, Uroloog, NVU
- Dr. S. (Saskia) Weltings, Uroloog, NVU
- Dr. E.G.W.M. (Eef) Lentjes, Klinisch chemicus, NVKC
- Drs. U.P. (Ulf) Arndt, Huisarts, NHG
Met ondersteuning van
- Dr. M. (Margreet) Pols, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. M. (Mohammadreza) Abdollahi, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. J. (Janneke) Schultink, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
F. (Frank) d’Ancona (voorzitter) |
Uroloog Radboudumc
|
Consultant Boston Scientific waarvoor soms tegen betaling presentaties/proctoring, geen verband met de huidige modules van de richtlijn |
Geen |
Geen |
|
S. (Stijn) Roemeling |
Uroloog, UMCG |
Electro Medical Systems (EMS; Nyons, Zwitserland): financiële ondersteuning van voordrachten, masterclasses en workshops op het gebied van percutane steenchirurgie |
Geen |
Werkgroeplid wordt niet betrokken bij uitwerking en besluitvorming betreffende uitgangsvraag naar nieuwe interventietechnieken. |
|
B.M. (Linda) Dirven-Konijn, |
Radioloog, UZ Leuven |
Geen
|
Geen |
Geen |
|
D. (Diederick) Duijvesz |
Uroloog in het Canisius Wilhelmina Ziekenhuis (CWZ) te Nijmegen- Plaatsvervangend opleider Urologie- |
Lid beroepsbelangencommissie (BBC) van de Nederlandse Vereniging voor Urologie (NVU), vacatiegelden - Lid stichting werkgroep endo-urologie (SWEN) van de Nederlandse Vereniging voor Urologie (NVU), vacatiegelden |
Geen |
Geen |
|
B.M.A. (Barbara) Schout |
Uroloog |
- Lid stichting werkgroep endo-urologie (SWEN) van de Nederlandse Vereniging voor Urologie (NVU) waarbinnen voorzitter SENN (Steen Expertise Netwerk Nederland) - DURO: dutch urology research organization - CUVO: commissie urologisch vaardigheidsonderwijs - DMC: data monitoring commissie Vacatiegelden NVU |
mede onderzoeker/auteur bij buscopanstudie (betaald door eigen ziekenhuis) en projectleider STONE studie (leading the change) |
Werkgroeplid wordt niet betrokken bij de uitwerking betreffende de vraag over buscopan en over drainagetechnieken. |
|
R. (Rozanne) Tijssen |
AIOS Spoedeisene geneeskunde, st. Antonius Ziekenhuis Utrecht/Nieuwegein |
Lid Richtlijncommissie Nederlandse Vereniging van Spoedeisende Hulp artsen (NVSHA) |
Geen |
Geen |
|
Klankbord |
|
|
|
|
|
E.G.W.M. (Eef) Lentjes |
Klinisch Chemicus UMCU, afdeling Centraal Diagnostisch Laboratorium |
Geen |
Geen |
Geen |
|
S. (Saskia) Weltings |
Uroloog |
Geen |
Geen |
Geen |
|
B. (Bart) van der Heij |
Uroloog, Zuyderland Medisch Centrum |
Geen |
Geen |
Geen |
|
G.M. (Guido) Kamphuis |
Uroloog, Amsterdam UMC |
advisory board lid Coloplast Porgès, Boston Scientific en Olympus; betaald onderwijs verzorgend voor Urologie Opleiding Instituut van de Nederlandse Vereniging Urologie; betaald |
Projectleider van StONE studie (leading the change); studie naar verschil tussen dubbel J ureter catheter en nefrostomie katheter in patienten met obstruerende ureter stenen. (https://zorgevaluatienederland.nl/evaluations/stone) |
Geen, gezien het deelname aan de klankbordgroep betreft |
|
U.P. (Ulf) Arndt |
Medisch manager bij Huisartsenposten de Limes BV 2 dagen per week, Waarnemend huisarts bij Huisartswaarnemer Arndt variabek; tot 01-01-2023 |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patientfederatie Nederland en Nierpatiëntenvereniging Nederland voor schriftelijke knelpunteninventarisatie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patientfederatie Nederland en Nierpatiëntenvereniging Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Drainage met dubbel J katheter versus nefrostomie katheter |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten) maar dat de aanbevolen zorg al breed wordt toegepast. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met nierstenen. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Urologie (NVU), Nederlandse Internisten Vereniging (Nederlandse federatie voor Nefrologie), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC), Nederlandse Vereniging voor Radiologie (NVvR), Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor Spoedeisende Hulp Artsen (NVSHA), Patientfederatie Nederland, Nierpatiëntenvereniging Nederland, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Zorgautoriteit, Zorginstituut Nederland, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging van Ziekenhuizen, Samenwerkende Topklinische opleidingsZiekenhuizen, Zelfstandige Klinieken Nederland, Lareb, Vereniging Innovatieve Geneesmiddelen, Zorgverzekeraars Nederland (vallen Achmea, CZ, Menzis en VGZ onder) via een schriftelijke knelpunteninventarisatie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. Erratum in: BMJ. 2008 May 24;336(7654).
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324.
Zoekverantwoording
Literature search strategy
Search date: 9-3-2022
Search results
Embase
|
No. |
Query |
Results |
|
#19 |
#16 NOT #15 NOT #14 OBS |
600 |
|
#18 |
#15 NOT #14 RCT |
101 |
|
#17 |
#14 OR #15 OR #16 |
657 |
|
#16 |
#13 AND (#2 OR #3) |
629 |
|
#15 |
#2 AND #13 |
100 |
|
#14 |
#1 AND #13 SR |
58 |
|
#13 |
#12 AND [1-1-1990]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1623 |
|
#12 |
#9 AND #10 AND #11 |
2738 |
|
#11 |
'nephrostomy'/exp OR 'nephrostomy catheter'/exp OR 'nephrostomy tube'/exp OR 'nephrostom*':ti,ab,kw OR nephrotom*:ti,ab,kw |
12482 |
|
#10 |
'double j stent'/exp OR 'double j catheter'/exp OR 'biosoft':ti,ab,kw OR (((jj OR dj OR uret*) NEAR/2 (stent* OR catheter*)):ti,ab,kw) OR 'pyelostent*':ti,ab,kw OR 'stenostent*':ti,ab,kw OR 'vortek':ti,ab,kw OR 'double j':ti,ab,kw OR 'pigtail stent*':ti,ab,kw OR 'pigtail ureteral stent*':ti,ab,kw OR 'ureter stent'/exp OR 'ascerta':ti,ab,kw OR 'bard fluoro-4 silicone ureteral stent':ti,ab,kw OR 'carbosoft':ti,ab,kw OR 'contour suredrive':ti,ab,kw OR 'contour vl':ti,ab,kw OR 'convertx nephroureteral stent system':ti,ab,kw OR 'endo-sof':ti,ab,kw OR 'inlay optima':ti,ab,kw OR 'mardis soft':ti,ab,kw OR 'memokat':ti,ab,kw OR 'opti-j':ti,ab,kw OR 'percuflex plus suredrive':ti,ab,kw OR 'percuflex urinary diversion stent':ti,ab,kw OR 'polaris loop':ti,ab,kw OR 'retromax plus':ti,ab,kw OR 'silhouette scaffold ureteral stent':ti,ab,kw OR 'sof-curl':ti,ab,kw OR 'universa':ti,ab,kw OR 'uriprene':ti,ab,kw OR 'uventa':ti,ab,kw OR 'bare metal ureteral stent':ti,ab,kw OR 'bare-metal ureteral stent':ti,ab,kw OR 'polymeric ureteral stent':ti,ab,kw OR 'removal ureteral stent':ti,ab,kw OR 'ureter stent':ti,ab,kw OR 'ureter stents':ti,ab,kw OR 'ureteral stent':ti,ab,kw OR 'ureteral stents':ti,ab,kw OR 'ureteric stent':ti,ab,kw OR 'ureteral stenting'/exp OR 'ureter stenting':ti,ab,kw OR 'ureteral stenting':ti,ab,kw |
24761 |
|
#9 |
'urolithiasis'/exp OR 'urethra stone'/exp OR 'urinary tract obstruction'/exp OR (((kidney OR urologic* OR renal OR urinary OR uret* OR urine OR coral OR uro OR uropathology) NEAR/3 (calcul* OR lithias* OR stone* OR colic* OR obstruct*)):ti,ab,kw) OR urocalculo*:ti,ab,kw OR urol?t*:ti,ab,kw OR nephrolit*:ti,ab,kw OR renolit*:ti,ab,kw OR urocalcul*:ti,ab,kw |
130553 |
|
#8 |
#5 OR #6 OR #7 |
3 |
|
#7 |
optimal AND method AND urgent AND decompression AND of AND the AND collecting AND system AND for AND obstruction AND infection AND due AND to AND ureteral AND calculi AND miller |
1 |
|
#6 |
percutaneous AND nephrostomy AND versus AND retrograde AND ureteral AND stent AND for AND acute AND upper AND urinary AND tract AND obstruction AND with AND urosepsis AND xu |
1 |
|
#5 |
nephrostomy AND versus AND double AND j AND ureteral AND catheterization AND in AND patients AND with AND obstructive AND urolithiasis AND weltings |
1 |
|
#4 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
12733536 |
|
#3 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#2 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#1 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
Ovid/Medline
|
# |
Searches |
Results |
|
15 |
limit 12 to yr="1990 -Current" OBS |
594 |
|
14 |
limit 11 to yr="1990 -Current" RCT |
116 |
|
13 |
limit 10 to yr="1990 -Current" SR |
35 |
|
12 |
5 and (8 or 9) |
628 |
|
11 |
5 and 7 |
118 |
|
10 |
5 and 6 |
35 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5101458 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4088318 |
|
7 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2231297 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
551553 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1424 |
|
4 |
2 and 3 |
1460 |
|
3 |
exp Urinary Catheterization/ or (biosoft or ((jj or dj or uret*) adj2 (stent* or catheter*)) or pyelostent* or stenostent* or vortek or double j or pigtail stent* or pigtail ureteral stent* or ascerta or bard fluoro-4 silicone ureteral stent or carbosoft or contour suredrive or contour vl or convertx nephroureteral stent system or endo-sof or inlay optima or mardis soft or memokat or opti j or percuflex plus suredrive or percuflex urinary diversion stent or polaris loop or retromax plus or silhouette scaffold ureteral stent or sof-curl or universa or uriprene or uventa or bare metal ureteral stent or bare-metal ureteral stent or polymeric ureteral stent or removal ureteral stent or ureter stent or ureter stents or ureteral stent or ureteral stents or ureteric stent or ureter stenting or ureteral stenting).ti,ab,kf. |
23726 |
|
2 |
Nephrotomy/ or nephrostom*.ti,ab,kf. or nephrotom*.ti,ab,kf. |
5085 |
|
1 |
exp Urolithiasis/ or Renal Colic/ or exp Urinary Calculi/ or exp Ureteroscopy/ or Ureteral Obstruction/ or exp Urethral Obstruction/ or ((kidney or urologic* or renal or urinary or uret* or urine or coral or uro) adj3 (calcul* or lithias* or stone* or colic* or obstruct*)).ti,ab,kf. or urocalculo*.ti,ab,kf. or urol?t*.ti,ab,kf. or nephrolit*.ti,ab,kf. or renolit*.ti,ab,kf. or urocalcul*.ti,ab,kf. or rirs.ti,ab,kf. or retrograde intrarenal surg*.ti,ab,kf. or retrograde intra renal surg*.ti,ab,kf. or ureteroscop*.ti,ab,kf. or ureteropyeloscop*.ti,ab,kf. or pyeloureteroscop*.ti,ab,kf. |
92471 |