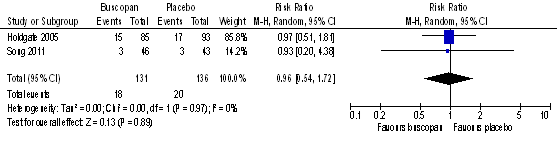De rol van buscopan IV bij koliekaanvallen
Uitgangsvraag
Wat is de plaats van butylscopolamine iv bij koliekaanvallen door niersteenlijden bij volwassenen?
Aanbeveling
Geef geen buscopan bij de behandeling van obstructieve urolithiasis.
Doseer en titreer bij patiënten met pijn op basis van urolithiasis pijnstilling middels paracetamol, NSAID’s en morfinemimetica zonder toevoeging van buscopan iv.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuurstudie verricht naar de (on)gunstige effecten van intraveneuze buscopan in combinatie met standaard pijnstilling (combinatie van paracetamol, NSAID, morfinomimetica) in vergelijking met alleen standaard pijnstilling bij volwassenen met pijn bij niersteenlijden. Op basis van de resultaten van de literatuuranalyse lijken er geen verschillen te zijn in de cruciale uitkomstmaat (pijnvermindering) of de belangrijke uitkomstmaten (bijwerkingen en noodzaak voor (chirurgische) interventie) tussen behandeling met intraveneuze buscopan in combinatie met standaard pijnstilling en standaard pijnstilling alleen. De bewijskracht werd beoordeeld als zeer laag vanwege risico op bias en imprecisie. Er is dus vanuit de gevonden literatuur geen wetenschappelijke ondersteuning om buscopan iv als aanvullende pijnstilling aan patiënten met koliekpijnen op basis van urolithiasis te geven met als doel een betere pijnstilling te bewerkstelligen of een (chirurgische) interventie te voorkomen. Het toedienen van buscopan iv geeft geen toename van bijwerkingen boven de bekende bijwerkingen van de bestaande pijnstilling. In de overwegingen moet wel worden meegenomen dat de gevonden literatuur van zeer lage bewijskracht is en ook als zodoende moet worden beoordeeld. Er wordt namelijk wel in één van de studies (Song, 2011) een significant verschil gevonden maar dit wordt door de auteurs als klinisch niet relevant beoordeeld vanwege het geringe absolute verschil. Er blijft dus enige theoretische onzekerheid dat, indien een nieuwe studie met betere bewijslast verschijnt, er een aanpassing van de aanbeveling zou kunnen komen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
- Het toedienen van buscopan iv als aanvullende pijnstilling bij patiënten met pijn op basis van urolithiasis is in Nederland al langer een gewoonte die niet wetenschappelijk onderbouwd is. Na wederom al het wetenschappelijke bewijs te hebben beoordeeld en gewogen, zien wij geen meerwaarde van het gebruik van buscopan aangezien de behandeling met buscopan iv als aanvullende pijnstilling bij niersteenkolieken niet leidt tot een significante verbetering van pijnreductie, het aantal benodigde interventies of bijwerkingen.
- De kans op bijwerkingen van buscopan is gelijk aan die van een placebo volgens de gevonden evidence, dus gebruik lijkt ook niet nadelig te zijn. Echter door medicatie helemaal niet toe te dienen is er natuurlijk geen kans op bijwerkingen.
- Het geven van buscopan iv brengt extra zorgkosten met zich mee. Niet alleen de kosten van het medicament buscopan zelf, maar de werkgroep is ook van mening dat gebruik van buscopan iv de ligduur verlengt door een extra iv medicament wat afgebouwd moet worden vóór ontslag omdat er geen acceptabel oraal alternatief voor thuis is. Dit verhoogt ook de zorgkosten significant. Tevens zou het routinematig toevoegen van buscopan aan de pijnstilling ervoor kunnen zorgen dat patiënten laagdrempeliger worden opgenomen door de intraveneuze toegangsweg van het middel, wat ook weer meer zorgkosten met zich meebrengt.
- Er zijn slechts een drietal studies gevonden die bruikbaar zijn voor het beantwoorden van de uitgangsvraag en de bewijskracht is zeer laag voornamelijk vanwege de kans op blinding bias. De werkgroep is wel van mening dat de overtuiging van de behandelaar in de klinische therapie zeker een rol speelt in de uitkomst.
Onderbouwing
Achtergrond
Obstructieve urolithiasis kan zeer pijnlijk verlopen. Het kan zich presenteren als klassieke koliekaanvallen met bewegingsdrang maar ook als een meer constante uitstralende pijn; beide zijn zeer ingrijpend voor de patiënt. Dit maakt, buiten het oplossen van de oorzaak van de obstructie, pijnstilling van essentieel belang in de behandeling van deze patiëntengroep, zeker aangezien een grote groep patiënten de steen vanzelf uit plast zonder interventie. Van oudsher wordt buscopan iv, een spasmolytisch medicament, gebruikt in deze patiëntengroep, naast paracetamol, NSAID's en morfinepreparaten ter pijnreductie. De rationale achter het gebruik van een spasmolyticum voor pijn in deze patiëntengroep is dat de peristaltische en spastische beweging van de geobstrueerde ureter de meeste pijn genereerd. Een spasmolyticum zoals buscopan inhibeert acetylcholine wat aangrijpt op de muscarine receptoren in de wand van de ureter en zorgt zo voor relaxatie van de gladde spiercel. Er is meermaals onderzoek gedaan naar de effectiviteit van buscopan iv op het gebied van pijnreductie t.o.v. analgetische preparaten voor deze specifieke patiëntengroep. Recent zijn er meerdere studies uitgekomen die vraagtekens zetten bij de effectiviteit van buscopan iv op dit gebied. Het doel van deze vraag is om op basis van de nu beschikbare literatuur een goed advies te kunnen geven over het gebruik van buscopan iv in deze patiëntengroep. De werkgroep heeft bewust gekozen orale en rectale preparaten buiten beschouwing te laten vanwege de overtuiging dat als het middel via intraveneuze toegang geen meerwaarde blijkt te hebben, dat er dan ook geen plaats is voor orale/rectale preparaten in de behandeling van pijn bij urolithiasis. Bovendien is de ervaring dat met deze toedieningswijze eigenlijk niet meer gewerkt wordt.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of intravenous buscopan as addition to normal pain relief on pain reduction when compared with only normal pain relief for admitted adults with colic pain in renal stone disease.
Source: Song, 2011; Weltings, 2021 |
|
Very Low GRADE |
The evidence is very uncertain about the effect of intravenous buscopan as addition to normal pain relief on side effects when compared with only normal pain relief for admitted adults with colic pain in renal stone disease.
Source: Holdgate, 2005; Song, 2011; Weltings, 2021 |
|
Very Low GRADE |
The evidence is very uncertain about the effect of intravenous buscopan as addition to normal pain relief on need for (surgical) intervention when compared with only normal pain relief for admitted adults with colic pain in renal stone disease.
Source: Holdgate, 2005; Song, 2011; Weltings, 2021 |
Samenvatting literatuur
Description of studies
Holdgate (2005) performed a randomized controlled trial to assess whether the addition of hyoscine butylbromide reduces the amount of opioid analgesia required and decreases the need for ongoing opioid analgesia in patients with acute renal colic. Adult patients between age 18 and 75 years whose presenting clinical symptoms consistent with renal colic as adjudged by a senior doctor and who required parenteral opioid analgesia were included. Exclusion criteria were receiving parenteral opioid analgesia or buscopan within 4 hours before presentation, pregnancy, glaucoma, urinary retention, and allergy to morphine or buscopan. Patients were randomized to 20 mg intravenous buscopan diluted to 10 ml or placebo (10 ml saline intravenously). In addition, 1 L normal saline for 2 hours, incremental doses of intravenous morphine in 2.5 mg aliquots at 5-minute intervals, 100 mg rectal indomethacin (unless in whom NSAIDs were contraindicated) were administered to all patients. In total, 91 patients were randomized to buscopan and 101 patients to placebo. Groups were comparable at baseline. Measured outcomes were the proportion of patients who required further morphine and adverse event rates.
Song (2011) conducted a prospective, double-blind, randomized controlled trial to determine the effect of adding butylscopolammonium bromide (BB) to morphine and ketorolac for the treatment of acute renal colic in the emergency department. Patients with a clinical presentation of ‘typical renal colic’ rather than ‘confirmed urinary stone by CT scan’ were eligible. Patients presenting to the emergency department who were at least 18 years of age whose flank pain was consistent with an abrupt onset of severe paroxysmal unilateral location were included. Exclusion criteria were a patient pain rating <5 on a 10 cm visual analogue scale (VAS), confirmed or suspected pregnancy, breastfeeding, contraindication to NSAIDs, opioids or BBs, history of peptic ulcer or renal disease, use of analgesics within 6 hours of presentation, current use of anticoagulants, history of bleeding tendency, suspicious surgical condition, hemodynamic instability defined as pulse >110/min and systolic blood pressure <100 mmHg, and previous participation in the study. In total, 43 patients were randomized to placebo (50 mL of normal saline) and 46 patients to 20 mg intravenous BB diluted with 50 mL of normal saline. In addition, patients received 1 L of normal saline at 240 mL/h, 30 mg ketorolac intravenously and 5 mg morphine intravenously over 5 min at time zero. Groups were comparable at baseline. Measured outcomes were pain reduction, need for rescue morphine and occurrence of adverse effects. The level of pain was measured on a 10 cm VAS at baseline, 20 minutes, and 40 minutes after receiving the medication.
Weltings (2021) performed a placebo-controlled, multicenter, double-blind randomized clinical trial to assess whether placebo is non-inferior to continuous infusion of butylscopolamine in patients with renal colic. Adults presenting with a renal colic admitted to the urological ward for analgesics when pain was not under control with oral NSAIDs and a confirmation of a renal calculus by ultrasound or CT-scan were included. Exclusion criteria were pregnancy or lactation, contra-indication or known allergy to any of the drugs used (NSAIDs, morphine, paracetamol), a temperature >38.5 °C in the 24 hours before inclusion or receiving antibiotics for urinary tract infection, or indication for immediate drainage of the upper urinary tract. Patients were randomized to either 100 mg/24 h butylscopolamine via intravenous continuous infusion or placebo (consisting of saline). In addition, patients received 1000 mg oral paracetamol four times daily, 50 mg oral diclofenac three times daily, and oral tamsulosin 0.4 mg once daily. Piritramide 15 mg subcutaneously was used as escape analgesic as needed up to a maximum of five times and an intravenous anti-emetic was prescribed as needed. In total, 62 patients received butylscopolamine and 62 patients received placebo. Groups were comparable at baseline. Measured outcomes were reduction in pain, side effects and surgical interventions necessary for ongoing pain. The level of pain was measured with the Numerical Rating Scale (NRS) at the start of the study and at 1, 4, 8, and 24 hours.
Results
Pain reduction
Song (2021) reported mean pain scores with the Visual Analogue Scale (VAS) at baseline, 20 minutes, and 40 minutes after treatment with placebo or butylscopolammonium. At baseline, the mean pain score was 8.4 (SD 1.4) for placebo and 8.4 (SD 1.4) for butylscopolammonium (p=0.823). After 20 minutes, the mean pain score was 3.1 (SD 2.4) for placebo and 2.6 (SD 2.4) for butylscopolammonium (p=0.343). The mean difference in VAS score was -0.6 cm (95% CI -1.6 to 0.5, p=0.287). After 40 minutes, a significant difference in mean pain score between placebo (2.5, SD 2.6) and butylscopolammonium (1.3, SD 1.9) was found (p=0.023). The mean difference was -1.2 cm (95% CI -2.2 to -0.2, p=0.024), but was not clinically relevant.
Weltings (2021) measured the reduction in pain with the Numerical Rating Scale (NRS). A similar decrease in pain over time was found for patients receiving butylscopolamine or placebo (no absolute numbers were presented).
Side effects
Holdgate (2005) reported adverse event rates for nausea, vomiting, urinary retention, allergic reactions, and other important events mentioned by the patients. For patients receiving buscopan, 15 of the 85 (18%) reported adverse events and 17 of the 93 (18%) patients who received placebo mentioned adverse events (RR 0.97, 95% CI 0.51 to 1.81) (Figure 1).
Song (2011) reported that 3 of the 46 patients (6.5%) treated with butylscopolammonium and 3 of the 43 patients (6.9%) treated with placebo experienced side effects (RR 0.93, 95% CI 0.20 to 4.38) (Figure 1). For placebo, the adverse events nausea, vomiting, and dizziness were reported, while for treatment with butylscopalammonium, two patients experienced dizziness and one patient mentioned another adverse event.
Weltings (2021) reported that, in total, 24 of the 124 patients (19.4%) experienced side effects. No statistical differences in adverse events were found between treatment with butylscopolamine or placebo.
Figure 1. Occurrence of side effects, comparison buscopan versus placebo
Need for (surgical) intervention
Holdgate (2005) reported that 28 of the 85 patients (33%) receiving buscopan and 35 of the 93 patients (38%) receiving placebo required further treatment with morphine (RR 0.88, 95% CI 0.59 to 1.31, p=0.5) (Figure 2).
Song (2011) reported how many patients needed rescue morphine to control sustained pain. For patients receiving butylscopolammonium, 7 of the 46 patients (15.2%) needed rescue morphine as compared to 14 of the 43 patients (32.6%) who received placebo (RR 0.47, 95% CI 0.21 to 1.05) (Figure 2). However, this difference was not significant (p=0.059).
Weltings (2021) reported that no surgical interventions were needed for ongoing pain during the study period.
Figure 2. Need for (surgical) intervention (treatment with morphine), comparison buscopan versus placebo
Level of evidence of the literature
According to GRADE, randomized controlled trials (RCTs) start at a high level of evidence.
The level of evidence regarding the outcome measure pain reduction was downgraded to a very low GRADE. One level because of risk of bias (doubts about blinding), one level for inconsistency (heterogeneity in the direction of the effect between studies) and one level for imprecision (not enough statistical power because of the low number of included patients).
The level of evidence regarding the outcome measure side effects was downgraded to a very low GRADE. One level because of risk of bias (doubts about blinding) and two level for imprecision (the 95% confidence interval crossed the lines of no (clinically relevant) effect).
The level of evidence regarding the outcome measure need for (surgical) intervention was downgraded to a very low GRADE. One level because of risk of bias (doubts about blinding) and two level for imprecision (the 95% confidence interval crossed the lines of no (clinically relevant) effect).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of intravenous buscopan compared to normal analgesia (combination of paracetamol, NSAID, morphinomimetics) in admitted adults with colic pain associated with renal stone disease?
P: Adults with colic pain due to renal stone disease
I: Intravenous buscopan as an addition to 'normal pain relief'
C: Normal pain relief (combination of paracetamol, NSAID, morphinomimetics)
O: Pain reduction (NRS, VAS), side effects, need for (surgical) intervention, hospital admission
Relevant outcome measures
The guideline development group considered pain reduction as a critical outcome measure for decision making; and side effects, need for (surgical) intervention and hospital admission as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions as stated in the studies.
The GRADE-standard limit of 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25) and 0.5 SD for continuous outcomes was taken as minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until February, 28th 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 69 hits. Studies were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO
- The intervention had to be as defined in the PICO
- Research type: systematic review or randomized controlled trial
- Articles written in English or Dutch
Thirteen studies were initially selected based on title and abstract screening. After reading the full text, ten studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three randomized controlled trials (Holdgate 2005; Song 2011; Weltings 2021) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Holdgate A, Oh CM. Is there a role for antimuscarinics in renal colic? A randomized controlled trial. J Urol. 2005 Aug;174(2):572-5; discussion 575. doi: 10.1097/01.ju.0000165337.37317.4c. PMID: 16006900.
- Song SW, Kim K, Rhee JE, Lee JH, Seo GJ, Park HM. Butylscopolammonium bromide does not provide additional analgesia when combined with morphine and ketorolac for acute renal colic. Emerg Med Australas. 2012 Apr;24(2):144-50. doi: 10.1111/j.1742-6723.2011.01502.x. Epub 2011 Nov 28. PMID: 22487663.
- Weltings S, Buddingh KT, van Diepen DC, Pelger RCM, Putter H, Rad M, Schout BMA, Roshani H. The BUSCOPAN study: a randomized-controlled non-inferiority trial of a continuous butylscopolamine infusion versus placebo in patients with a renal colic not responding to oral non-steroidal anti-inflammatory drugs. World J Urol. 2021 Jul;39(7):2747-2752. doi: 10.1007/s00345-020-03460-0. Epub 2020 Sep 19. PMID: 32949255; PMCID: PMC8332573.
Evidence tabellen
Evidence table for intervention studies
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Weltings, 2021 |
Type of study: Multicenter double-blind randomized-controlled trial
Setting and country: Two general hospitals in the Netherlands (between January 2018 and November 2019)
Funding and conflicts of interest: A research grant was given by the science bureau of Haga teaching hospital. No conflicts of interest
|
Inclusion criteria: - Adults presenting with a renal colic admitted to the urological ward for analgesics when pain was not under control with oral NSAIDs - Confirmation of a renal calculus by ultrasound or CT-scan was required
Exclusion criteria: - Pregnancy or lactation - Contra-indication or known allergy to any of the drugs used (NSAIDs, morphine, paracetamol) - Temperature >38.5 °C in the 24 h before inclusion or receiving antibiotics for urinary tract infection - Indication for Immediate drainage of the upper urinary tract
N total at baseline: Intervention: 62 Control: 62
Important prognostic factors2: Age ± SD: I: 49 ± 14 C: 45 ± 15
Sex: I: 44 (71%) M C: 41 (66%) M
Groups were comparable at baseline
|
Describe intervention (treatment/procedure/test): Butylscopolamine 100 mg/24 h via intravenous continuous infusion
For both intervention and control: All patients were given 1000 mg oral paracetamol four times daily and 50 mg oral diclofenac three times daily. They also received oral tamsulosin 0.4 mg once daily. Escape analgesics consisted of piritramide 15 mg subcutaneously as needed up to a maximum of five times. An IV anti-emetic was prescribed as needed.
|
Describe control (treatment/procedure/test): Placebo (saline)
|
Length of follow-up: Mean follow-up was 68 days in butylscopolamine group and 60 days in placebo group.
Loss-to-follow-up: 128 patients were randomized and data of 124 patients were available for analysis. Three of the four patients that were excluded after randomization developed fever soon after admission and required urgent upper tract drainage. The fourth patient withdrew for personal reasons.
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95% CI and p-value if available): Reduction in pain (measured with Numeric Rating Scale) Both groups showed a similar decrease in pain over time
Side effects Side effects were reported by 24 patients with no statistical differences between the groups
Surgical interventions necessary for ongoing pain No surgical interventions for ongoing pain during the study period |
Author’s conclusion Placebo is non-inferior to continuous IV butylscopolamine for pain relief in patients with renal colic. Based on this study and previous evidence, there is no role for continuous butylscopolamine IV in the treatment of renal colic. |
|
Song, 2011 |
Type of study: Prospective, randomized, controlled, double-blind clinical trial
Setting and country: Adult emergency department of a tertiary-care urban academic hospital in Bundang, Korea between 1 November 2007 to 30 December 2008.
Funding and conflicts of interest: No funding or conflicts of interest
|
Inclusion criteria: - Patients with a clinical presentation of ‘typical renal colic’ rather than ‘confirmed urinary stone by CT scan’ - Patients presenting to the emergency department who were at least 18 years of age whose flank pain was consistent with an abrupt onset of severe paroxysmal unilateral location
Exclusion criteria: - Patient pain rating <5 on a 10 cm visual analogue scale (VAS) - Confirmed or suspected pregnancy - Breastfeeding -Contraindication to NSAIDs, opioids or BBs - History of peptic ulcer or renal disease - Use of analgesics within 6 h of presentation - Current use of anticoagulants - History of bleeding tendency - Suspicious surgical condition - Hemodynamic instability defined as pulse >110/min and systolic blood pressure <100 mmHg - Previous participation in the study
N total at baseline: Intervention: 43 Control: 46
Important prognostic factors2: Age ± SD: I: 41.9 ± 9.6 C: 38.8 ± 9.8
Sex: I: 34 (79.1%) M C: 38 (82.6%) M
Groups were comparable at baseline
|
Describe intervention (treatment/procedure/test): Placebo (50 mL of normal saline)
For both intervention and control: All patients received standard treatment defined as 1 L of normal saline hydration at 240 mL per hour, 30 mg ketorolac i.v. and 5 mg morphine i.v. over 5 min at time zero. |
Describe control (treatment/procedure/test): Butylscopolammonium bromide 20 mg i.v. diluted with 50 mL of normal saline
|
Length of follow-up: 40 minutes
Loss-to-follow-up: No loss-to-follow-up
Incomplete outcome data: No incomplete outcome data
|
Outcome measures and effect size (include 95% CI and p-value if available): Pain reduction (measured on a 10 cm VAS at time 0, 20, and 40 minutes)
Mean pain scores (±SD) 0 min: 8.4 ± 1.4 vs. 8.4 ± 1.4 20 min: 3.1 ± 2.4 vs. 2.6 ± 2.4 p = 0.343 40 min: 2.5 ± 2.6 vs. 1.3 ± 1.9 p = 0.023
After 20 minutes: mean difference is
After 40 minutes: mean difference is
Adverse effects I: 3/43 (6.9%) C: 3/46 (6.5%)
Rescue morphine (to control sustained pain) I: 14/43 (32.6%) C: 7/46 (15.2%) OR = 0.372, 95% CI 0.133 to 1.038, p = 0.059 |
Author’s conclusion Although the addition of BB to morphine and ketorolac appeared to show a statistically significant reduction in pain compared with morphine and ketorolac alone, a reduction of 1.2 cm on VAS is unlikely to be clinically significant. |
|
Holdgate, 2005 |
Type of study: Randomized controlled trial
Setting and country: Emergency Department of a tertiary teaching hospital in Australia.
Funding and conflicts of interest: Not reported.
|
Inclusion criteria: Adult patients between age 18 and 75 years whose presenting clinical symptoms and signs consistent with renal colic as adjudged by a senior doctor and who required parenteral opioid analgesia
Exclusion criteria: - Received parenteral opioid analgesia or buscopan within 4 hours before presentation - Pregnancy - Glaucoma - Urinary retention - Allergy to morphine or buscopan
N total at baseline: Intervention: 91 Control: 101
Important prognostic factors2: Age I: 45.4 C: 45.6
Sex: I: 75% M C: 81% M
Groups were comparable at baseline
|
Describe intervention (treatment/procedure/test): Buscopan (20 mg intravenous Buscopan diluted to 10 ml)
For both intervention and control: All patients received standardized treatment which consisted of 1 L normal saline for 2 hours, incremental doses of intravenous morphine in 2.5 mg aliquots at 5-minute intervals, 100 mg rectal indomethacin (unless stratified to no NSAID group) and the study drug/placebo. |
Describe control (treatment/procedure/test): Placebo (10 ml intravenous saline) |
Length of follow-up: 4 hours
Loss-to-follow-up: I: 6/91 (6.6%) C: 8/101 (7.9%)
14 patients were excluded from study because of protocol violations (7 patients), inadequate recording of pain data (4 patients), withdrawal of consent (2 patients) and patient absconding before completion of trial (1 patient)
Incomplete outcome data: Not reported |
Outcome measures and effect size (include 95% CI and p-value if available): Required further morphine I: 28/85 (33%) C: 35/93 (38%) p = 0.5
Adverse event rates (nausea/vomiting, urinary retention, and allergic reaction, or other events) I: 15/85 (18%) C: 17 (18%) p = 0.9 |
Author’s conclusion There is no evidence that the addition of Buscopan to standard treatment reduces the amount of opioid required to achieve initial analgesia in renal colic or the rate of pain recurrence. We do not support the use of Buscopan in the treatment of renal colic |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Weltings, 2021 |
Definitely yes
Reason: Randomization of treatment was determined in advance using random numbers table.
|
Definitely yes
Reason: Opaque sealed envelopes were used. |
Definitely yes
Reason: Patients, clinical staff, and investigators were blinded to the allocation. Study allocation remained blinded until completion of the entire study.
|
No information
Reason: Loss to follow-up not specified for intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably no
Reason: Principles of an intention-to-treat analysis were not followed because some patients were excluded after randomisation and not included in the analysis. |
Some concerns
|
|
Song, 2011 |
Definitely yes
Reason: Randomization table was used.
|
No information
|
Probably yes
Reason: All patients, attending physician and clinical research nurse (who collected data) were blinded. The triage nurse (who did the randomisation) and treating nurse were not. Blinding of data analysts not reported.
|
Definitely yes
Reason: No loss to follow-up reported. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably no
Reason: The sample size did not provide enough statistical power for analysing the secondary outcomes. |
Some concerns |
|
Holdgate, 2005 |
Definitely yes
Reason: Randomization of treatment was determined in advance using a random numbers table.
|
Definitely yes
Reason: Opaque sealed envelopes were used. |
Definitely no
Reason: Doctor may have inadvertently informed the patient or treating nurse which drug they had given. This may have resulted in unblinded scoring of pain scores and vital signs by patients and nurses. No identical ampoules for buscopan and placebo.
|
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably no
Reason: No information provided on conflicts of interest or funding. |
High
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Afshar, 2018 |
Wrong comparison: no comparison Buscopan with painkiller vs painkiller alone |
|
Anonymous, 2009 |
Wrong study design: narrative review |
|
Carley, 2006 |
Article not traceable |
|
Forster, 2008 |
Article in German |
|
Jones, 2001 |
Wrong intervention: hyoscyamine sulfate instead of buscopan |
|
Kheirollahi, 2020 |
Wrong comparison: intramuscular hyoscine N-butyl bromide vs intranasal desmopressin with intramuscular hyoscine N-butyl bromide |
|
Papadopoulos, 2014 |
Wrong study design: narrative review |
|
Singh, 2011 |
Wrong study design: narrative review |
|
Yakoot, 2014 |
Wrong intervention: rectal suppositories containing ketoprofen and hyoscine butylbromide |
|
Yencilek, 2008 |
Wrong comparison: hyoscine-N-butylbromide vs papaverine hydrochloride vs pethidine |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met nierstenen.
Werkgroep
- Dr. F. (Frank) d’Ancona (voorzitter) , Uroloog, NVU
- Dr. S. (Stijn) Roemeling, Uroloog, NVU
- Drs. B.M. (Linda) Dirven-Konijn, Radioloog, NVvR
- Dr. D. (Diederick) Duijvesz, Uroloog, NVU
- Dr. B.M.A. (Barbara) Schout, Uroloog, NVU
- Drs. R. (Rozanne) Tijssen, AIOS Spoedeisende geneeskunde, NVSHA
Meelezers
- Drs. G.M. (Guido) Kamphuis, Uroloog, NVU
- Drs. B. (Bart) van der Heij, Uroloog, NVU
- Dr. S. (Saskia) Weltings, Uroloog, NVU
- Dr. E.G.W.M. (Eef) Lentjes, Klinisch chemicus, NVKC
- Drs. U.P. (Ulf) Arndt, Huisarts, NHG
Met ondersteuning van
- Dr. M. (Margreet) Pols, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. M. (Mohammadreza) Abdollahi, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Dr. J. (Janneke) Schultink, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
F. (Frank) d’Ancona (voorzitter) |
Uroloog Radboudumc
|
Consultant Boston Scientific waarvoor soms tegen betaling presentaties/proctoring, geen verband met de huidige modules van de richtlijn |
Geen |
Geen |
|
S. (Stijn) Roemeling |
Uroloog, UMCG |
Electro Medical Systems (EMS; Nyons, Zwitserland): financiële ondersteuning van voordrachten, masterclasses en workshops op het gebied van percutane steenchirurgie |
Geen |
Werkgroeplid wordt niet betrokken bij uitwerking en besluitvorming betreffende uitgangsvraag naar nieuwe interventietechnieken. |
|
B.M. (Linda) Dirven-Konijn, |
Radioloog, UZ Leuven |
Geen
|
Geen |
Geen |
|
D. (Diederick) Duijvesz |
Uroloog in het Canisius Wilhelmina Ziekenhuis (CWZ) te Nijmegen- Plaatsvervangend opleider Urologie- |
Lid beroepsbelangencommissie (BBC) van de Nederlandse Vereniging voor Urologie (NVU), vacatiegelden - Lid stichting werkgroep endo-urologie (SWEN) van de Nederlandse Vereniging voor Urologie (NVU), vacatiegelden |
Geen |
Geen |
|
B.M.A. (Barbara) Schout |
Uroloog |
- Lid stichting werkgroep endo-urologie (SWEN) van de Nederlandse Vereniging voor Urologie (NVU) waarbinnen voorzitter SENN (Steen Expertise Netwerk Nederland) - DURO: dutch urology research organization - CUVO: commissie urologisch vaardigheidsonderwijs - DMC: data monitoring commissie Vacatiegelden NVU |
mede onderzoeker/auteur bij buscopanstudie (betaald door eigen ziekenhuis) en projectleider STONE studie (leading the change) |
Werkgroeplid wordt niet betrokken bij de uitwerking betreffende de vraag over buscopan en over drainagetechnieken. |
|
R. (Rozanne) Tijssen |
AIOS Spoedeisene geneeskunde, st. Antonius Ziekenhuis Utrecht/Nieuwegein |
Lid Richtlijncommissie Nederlandse Vereniging van Spoedeisende Hulp artsen (NVSHA) |
Geen |
Geen |
|
Klankbord |
|
|
|
|
|
E.G.W.M. (Eef) Lentjes |
Klinisch Chemicus UMCU, afdeling Centraal Diagnostisch Laboratorium |
Geen |
Geen |
Geen |
|
S. (Saskia) Weltings |
Uroloog |
Geen |
Geen |
Geen |
|
B. (Bart) van der Heij |
Uroloog, Zuyderland Medisch Centrum |
Geen |
Geen |
Geen |
|
G.M. (Guido) Kamphuis |
Uroloog, Amsterdam UMC |
advisory board lid Coloplast Porgès, Boston Scientific en Olympus; betaald onderwijs verzorgend voor Urologie Opleiding Instituut van de Nederlandse Vereniging Urologie; betaald |
Projectleider van StONE studie (leading the change); studie naar verschil tussen dubbel J ureter catheter en nefrostomie katheter in patienten met obstruerende ureter stenen. (https://zorgevaluatienederland.nl/evaluations/stone) |
Geen, gezien het deelname aan de klankbordgroep betreft |
|
U.P. (Ulf) Arndt |
Medisch manager bij Huisartsenposten de Limes BV 2 dagen per week, Waarnemend huisarts bij Huisartswaarnemer Arndt variabek; tot 01-01-2023 |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patientfederatie Nederland en Nierpatiëntenvereniging Nederland voor schriftelijke knelpunteninventarisatie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patientfederatie Nederland en Nierpatiëntenvereniging Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Conservatieve behandeling: de rol van buscopan IV bij koliekaanvallen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten) maar dat de aanbevolen zorg al breed wordt toegepast. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met nierstenen. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Urologie (NVU), Nederlandse Internisten Vereniging (Nederlandse federatie voor Nefrologie), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC), Nederlandse Vereniging voor Radiologie (NVvR), Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor Spoedeisende Hulp Artsen (NVSHA), Patientfederatie Nederland, Nierpatiëntenvereniging Nederland, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Zorgautoriteit, Zorginstituut Nederland, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging van Ziekenhuizen, Samenwerkende Topklinische opleidingsZiekenhuizen, Zelfstandige Klinieken Nederland, Lareb, Vereniging Innovatieve Geneesmiddelen, Zorgverzekeraars Nederland (vallen Achmea, CZ, Menzis en VGZ onder) via een schriftelijke knelpunteninventarisatie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. Erratum in: BMJ. 2008 May 24;336(7654).
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Richtlijn: NVU Herziening nierstenen |
|
|
Uitgangsvraag: Wat zijn (on)gunstige effecten van intraveneuze buscopan in vergelijking met normale pijnstilling (combinatie van paracetamol, NSAID, morfinomimetica) bij opgenomen volwassenen met koliekpijn bij niersteenlijden? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 28-2-2022 |
|
Periode: 2000- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende elementen: Urolithiasis EN buscopan EN koliek Alhoewel het aantal gevonden referenties voor urolithiasis en buscopan te overzien is, is in overleg met de adviseur besloten om koliek toe te voegen aan de zoekstrategie omdat koliek het hoofdonderwerp is. Daarnaast worden in deze combinatie alle sleutelreferenties nog steeds gevonden. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 2022 met relevante zoektermen gezocht naar systematische reviews en RCTs over de effecten van intraveneuze buscopan bij opgenomen volwassenen met koliekpijn bij niersteenlijden. De literatuurzoekactie leverde 69 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
19 |
4 |
21 |
|
RCTs |
53 |
16 |
48 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
69 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#49 |
#47 AND #48 sleutelartikelen gevonden |
4 |
|
#48 |
#42 OR #43 |
61 |
|
#47 |
#44 OR #45 OR #46 |
4 |
|
#46 |
is AND there AND a AND role AND for AND antimuscarinics AND in AND renal AND colic AND holdgate |
1 |
|
#45 |
hyoscine AND 'n butylbromide' AND buscopan® AND in AND the AND treatment AND of AND acute AND ureteral AND colic |
2 |
|
#44 |
the AND buscopan AND study AND weltings |
1 |
|
#43 |
#39 AND #41 RCT |
53 |
|
#42 |
#39 AND #40 SR |
19 |
|
#41 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1880101 |
|
#40 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
803497 |
|
#39 |
#38 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
146 |
|
#38 |
#35 AND #36 AND #37 |
239 |
|
#37 |
'colic'/exp OR 'kidney colic'/exp OR colic*:ti,ab,kw |
25077 |
|
#36 |
'scopolamine butyl bromide'/exp OR 'spasmolytic agent'/exp OR 'muscarinic receptor blocking agent'/exp OR 'buscolysin':ti,ab,kw OR 'buscopan':ti,ab,kw OR 'buscopax':ti,ab,kw OR 'buscopoxan':ti,ab,kw OR 'scobutil':ti,ab,kw OR 'scobutyl':ti,ab,kw OR 'skf 1637':ti,ab,kw OR 'sporamin':ti,ab,kw OR butylscopolam*:ti,ab,kw OR (((hyoscin* OR hyoscein* OR hyascin* OR hyocin* OR joscin* OR bromid* OR scopolam*) NEAR/3 butyl*):ti,ab,kw) |
534962 |
|
#35 |
'urolithiasis'/exp OR 'urethra stone'/exp OR (((kidney OR urologic* OR renal OR urinary OR ureteral OR urine OR coral OR uro) NEAR/3 (calcul* OR lithias* OR stone* OR obstruct*)):ti,ab,kw) OR urocalculo*:ti,ab,kw OR urolit*:ti,ab,kw OR nephrolit*:ti,ab,kw OR renolit*:ti,ab,kw |
106846 |
Ovid/Medline
Search Strategy:
|
# |
Searches |
Results |
|
10 |
5 and 8 RCT |
16 |
|
9 |
5 and 7 SR |
4 |
|
8 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1355792 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
550300 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
23 |
|
5 |
limit 4 to yr="2000 -Current" |
25 |
|
4 |
1 and 2 and 3 |
55 |
|
3 |
exp Colic/ or exp Renal Colic/ or colic*.ti,ab,kf. |
16037 |
|
2 |
exp Scopolamine Derivatives/ or Parasympatholytics/ or exp Muscarinic Antagonists/ or buscolysin.ti,ab,kf. or buscopan.ti,ab,kf. or buscopax.ti,ab,kf. or buscopoxan.ti,ab,kf. or scobutil.ti,ab,kf. or scobutyl.ti,ab,kf. or skf 1637.ti,ab,kf. or sporamin.ti,ab,kf. or butylscopolam*.ti,ab,kf. or ((hyoscin* or hyoscein* or hyascin* or hyocin* or joscin* or bromid* or scopolam*) adj3 butyl*).ti,ab,kf. |
67800 |
|
1 |
exp Urolithiasis/ or Urinary Bladder Calculi/ or Renal Colic/ or ((kidney or urologic* or renal or urinary or ureteral or urine or coral or uro) adj3 (calcul* or lithias* or stone* or obstruct*)).ti,ab,kf. or urocalculo*.ti,ab,kf. or urolit*.ti,ab,kf. or nephrolit*.ti,ab,kf. or renolit*.ti,ab,kf. |
68906 |