Dialyse of conservatieve behandeling
Uitgangsvraag
Wat is het effect op de mortaliteit, functionaliteit en de kwaliteit van leven bij ouderen (>70 jaar) wanneer gekozen wordt voor dialyse of voor een conservatief beleid?
Aanbeveling
Gebruik leeftijd op zich niet als criterium om wel of niet nierfunctievervangende behandeling als reële optie voor te stellen tijdens het gesprek met de patiënt. Echter boven de leeftijd van 80 jaar is een positief effect van nierfunctievervangende behandeling op de overleving niet duidelijk.
Breng de comorbiditeit, kwaliteit van leven en functionaliteit van patiënten boven de 70 jaar goed in kaart bij chronisch nierschade stadium 4 en stadium 5, bij voorkeur met gevalideerde schalen.
Neem de comorbiditeit, kwaliteit van leven en functionaliteit mee in de adviezen over wel of niet starten met een nierfunctievervangende behandeling.
Maak duidelijk dat er verschillen kunnen zijn in de tijdsduur die in een ziekenhuissetting wordt doorgebracht tussen patiënten die kiezen voor nierfunctievervangende behandeling en die kiezen voor conservatieve behandeling.
Maak duidelijk dat het effect op de mentale gezondheid na starten met nierfunctievervangende behandeling niet noodzakelijkerwijs positief is.
Overwegingen
Gezien de kwaliteit van de huidige literatuur is er geen hoge bewijskracht voor het verlengen van het leven door nierfunctievervangende behandelingen bij alle patiënten van 70 jaar of ouder. De meeste studies vinden wel een duidelijk voordeel, maar hoge comorbiditeit en functionele afhankelijkheid bij het starten van dialyse blijken een grote rol te spelen in het verminderen van dit voordeel.
Isaacs (2012) verrichtte een retrospectieve studie bij patiënten van 80 jaar en ouder die startten met nierfunctievervangende behandeling in een kliniek in de UK. De groep bestond uit 93 patiënten met een gemiddelde leeftijd van 83 jaar. De mediane Charlson Comorbidity Index was 7. De eenjaarsoverleving was 78,5% en de mediane overleving was 46,5 maanden. In deze kliniek kregen patiënten uitgebreide informatie over zowel de optie dialyse als de optie conservatieve behandeling. De auteurs stellen dat mogelijk hierdoor tijdens de studieperiode een sterke toename was van het aantal patiënten dat koos voor conservatieve behandeling. In een grote retrospectieve studie bij patiënten ouder dan 70 jaar van Hussain (2013) nam het voordeel van nierfunctievervangende behandeling op de overleving significant af ten opzichte van conservatieve behandeling bij patiënten ouder dan 80 jaar. En in de studie van Verberne (2016) werd bij patiënten van 80 jaar en ouder geen significant betere overleving gevonden tussen de patiënten met nierfunctievervangende of conservatieve behandeling onafhankelijk van de mate van comorbiditeit, mediane overleving respectievelijk 2,1 jaar versus 1,4 jaar. De overleving in de groep met nierfunctievervangende behandeling van 2,1 jaar is aanzienlijk lager dan de overleving van 46,5 maanden in de studie van Isaacs. In beide studies wordt gewezen op de invloed van selectiebias, wat het trekken van conclusies lastig maakt, maar wel lijkt de studie van Isaacs te ondersteunen dat er blijkbaar een groep van 80+ is, die wel baat heeft bij nierfunctievervangende behandeling.
Er zijn studies die gekeken hebben naar hoeveel van het voordeel van overleving, de zogenaamde gewonnen tijd, wordt ingenomen door dagen in het ziekenhuis. Carson (2009) vond dat de hemodialysepatiënten 47,5% van de overlevingstijd na starten met dialyse doorbrachten in het ziekenhuis. Voor conservatief behandelde patiënten was dit 4,3%, berekend vanaf de gecalculeerde eGFR waarop de dialysegroep ging starten. In de studie van Da Silva-Gane (2012) hadden de patiënten die nierfunctievervangende behandeling kregen 13,2 maanden extra overleving ten opzichte van de conservatief behandelde groep, waarvan gemiddeld 10,7 maanden dialyse plaatsvond. Daartegenover vond Shum (2014) in de dialysegroep een significant lager aantal acute opnames en minder dagen opgenomen in het ziekenhuis dan in de conservatief behandelde groep, maar deze laatste groep had minder hinderlijke interventies rondom het levenseinde.
In de studies waarin gekeken wordt naar kwaliteit van leven (QOL), hebben de patiënten die kiezen voor conservatieve behandeling baseline een lagere score op de Short Form-36 Physical Health Scale (SF-36 PH) dan de groep die kiest voor nierfunctievervangende behandeling (Brown, 2015; Yong, 2009; Da Silva-Gane, 2012; Brown, 2015). In al deze studies was leeftijd geen inclusiecriterium, zodat de leeftijd tussen de groepen sterk verschilde. Yong (2009) beschreef een cross-sectionele studie met 179 patiënten uit Hong Kong, die na het doorlopen van een voorlichtingsprogramma een keuze voor dialyse (134) of voor conservatieve behandeling (45) hadden gemaakt, de gemiddelde leeftijd was respectievelijk 58 en 73 jaar. Er werden deelscores van de Chinese SF-36 gegeven: PF: Physical Health; RP: Role Limitation by physical; BP: Bodily Pain; GH: General Health; VT: Vitality; SF: Social Functioning; RE: Role limitation by emotion; MH: Mental Health. Deze zijn per groep vergeleken met de deelscores van de gewone bevolking, gecorrigeerd voor leeftijd en geslacht. De dialysegroep scoorde significant lager op alle acht domeinen ten opzichte van de gewone bevolking, de conservatief behandelde groep slechts op 4 domeinen (PF, RP, VT, SF). In de studie van Da Silva-Gane (2012) is de kwaliteit van leven onderzocht in een prospectieve studie, waarin de QOL elke drie maanden werd gemeten, tot ten minste 12 maanden na start dialyse en drie jaar of langer in conservatief behandelde patiënten. Op het eind van de QOL-follow-up periode waren er 124 dialysepatiënten (80 hemodialyse, gemiddelde leeftijd 60,6 jaar en 44 peritoneale dialyse, gemiddelde leeftijd 48 jaar), 30 conservatief behandelde patiënten, gemiddelde leeftijd 77,5 jaar en 16 hadden nog niet beslist, gemiddelde leeftijd 68 jaar. In de SF-36 Mental Health Subscale was geen verschil in baseline en geen significant verschil na start dialyse. De SF-36 Physical Health Subscale was voor alle groepen laag bij baseline, maar significant lager voor de conservatief behandelde patiënten. Dit veranderde niet echt na start dialyse. In de Hospital Anxiety and Depression Scale (HADS) waren bij baseline (na correctie voor covariaten) geen verschillen en dit veranderde niet na dialyse. De Satisfaction with life scale (SWLS) was bij baseline niet verschillend, maar daalde significant na het starten met dialyse en herstelde niet.
Brown (2015) verrichtte een prospectieve observationele studie bij 273 patiënten die voor nierfunctievervangende behandeling kozen, gemiddelde leeftijd 67 jaar en 122 patiënten die voor conservatieve behandeling kozen, gemiddelde leeftijd 82 jaar. Bij follow-up was er een behouden of verbeterde SF-36- Physical Health in minder dan de helft van beide groepen en een behouden of verbeterde SF-36-Mental Health in iets meer dan de helft van beide groepen. In deze studie is alleen niet duidelijk hoeveel van de aanvankelijke groep bij follow-up zijn gestart met dialyse.
Er zijn geen studies gevonden waarin het functioneren wordt vergeleken tussen een groep met nierfunctievervangende behandeling en een groep met conservatieve behandeling. Kurella (2009) beschrijft een database studie waarin het functioneren van een groep verpleeghuispatiënten is gemeten 12 maanden voor tot 12 maanden na start nierfunctievervangende behandeling. Hiervoor werd de Minimum Data Set-Activities of Daily Living (MDS-ADL) gebruikt. Het betrof 3702 patiënten met een gemiddelde leeftijd van 73,4 ± 10.9 jaar. Er werd een geleidelijke afname gevonden in functionaliteit in het jaar voor start van dialyse, met een scherpe daling drie maanden voor start en een nog sterkere daling in de drie maanden na start. Hierna trad geen herstel op. Na een jaar was 58% overleden en had 13% hun functionaliteit van vóór de dialyse behouden.
Murtagh (2011) verrichtte een longitudinale cohortstudie naar functionaliteit in een groep patiënten met CKD 5 in drie nefrologie units in de UK. Het betrof 74 patiënten die hadden gekozen voor conservatieve behandeling met een gemiddelde leeftijd van 80,7 jaar (51 tot 95). De functionele status werd gemeten met de Karnofsky Performance Scale (KPS). 49 patiënten overleden tijdens de studieduur. Hun KPS was significant lager bij baseline dan van degenen die nog in leven waren bij het eind van de studie. De functionaliteit bleef vrij stabiel tijdens de follow-up, maar daalde twee maanden voor overlijden en met name heel sterk in de laatste maand.
Ook op oude leeftijd kan nierfunctievervangende behandeling bij vitale ouderen bijdragen aan een langere levensverwachting, wat aanzienlijk minder duidelijk is voor ouderen met hoge comorbiditeit en verminderde functionaliteit. Daarbij moet ook bij de gezonde ouderen worden meegenomen dat een deel van de winst op overleving, tijd is die doorgebracht wordt met dialyse en dat, mogelijk mede hierdoor, mensen tijdens dialyse minder tevreden zijn met hun leven dan mensen die kiezen voor conservatieve behandeling. De kans dat een patiënt niet in een instelling overlijdt lijkt groter als gekozen wordt voor conservatieve behandeling wat voor sommige patiënten ook een relevant gegeven kan zijn.
Het is belangrijk om tijdens het beslissingsproces de comorbiditeit en de functionaliteit goed te inventariseren middels gevalideerde schalen, zodat ze kunnen worden meegenomen in de besluitvorming. Tevens is het belangrijk om de belasting van dialyse uit te leggen en het feit dat er geen grote verschillen lijken te zijn in de ervaren kwaliteit. Helaas zijn er geen goede studies over ouderen met dementie en de effecten van al of niet dialyseren op mortaliteit, functionaliteit en kwaliteit van leven, zodat over deze specifieke groep geen uitspraak kan worden gedaan. Echter een verminderde cognitie is medebepalend voor de kwetsbaarheid van een patiënt net als comorbiditeit en functionaliteit. Daarom lijkt het redelijk om aan te nemen dat dementie wel gezien moet worden als een additionele risicofactor ten aanzien van verminderde levensverwachting en afname van kwaliteit van leven, na starten met dialyse.
Onderbouwing
Achtergrond
In de afgelopen decennia is de gemiddelde leeftijd van patiënten met chronische nierschade stadium 5, toegenomen en hoge leeftijd vormt geen beperking voor het starten met dialyse. Deze factoren hebben ertoe geleid dat het aandeel van ouderen in de dialysepopulatie sterk is toegenomen. Bij een deel van deze ouderen is sprake van veel comorbiditeit met daarbij beperkingen in hun functioneren. Het is op dit moment nog onvoldoende duidelijk of dialyse bij deze kwetsbare groep bijdraagt aan een betere levensverwachting met behouden of verbeterde functionaliteit en goede kwaliteit van leven.
In besluitvorming rondom keuzes voor wel of geen nierfunctievervangende therapie is het belangrijk om ook aan deze patiënten duidelijke informatie voor te leggen en de voor- en nadelen te bespreken zodat zij tot een afgewogen behandelkeuze kunnen komen.
Conclusies / Summary of Findings
|
GRADE LAAG |
Patiënten met chronische nierschade stadium 5 die behandeld worden met dialyse hebben een lagere mortaliteit dan patiënten die conservatief worden behandeld.
Bronnen (Verberne, 2016; Shum, 2014; Chandna, 2011; Murtagh, 2007) |
|
GRADE LAAG |
Het positieve effect op mortaliteit van dialyse behandeling neemt af bij patiënten ouder dan 70 jaar met hoge comorbiditeit.
Bronnen (Verberne, 2016; Shum, 2014; Chandna, 2011; Murtagh, 2007) |
Samenvatting literatuur
Beschrijving studies
In totaal zijn er vier studies gevonden die geschikt waren voor een analyse middels GRADE. In vier studies werd de uitkomstmaat ‘Mortaliteit’ beschreven, geen van de studies beschreef de uitkomstmaat ‘Kwaliteit van Leven’, hetzelfde geldt voor de uitkomstmaat functioneren. Alle geïncludeerde onderzoeken betroffen observationeel onderzoek, veelal retrospectief. Na de full-tekst bestudering van de artikelen werd duidelijk dat de patiëntengroepen die binnen de studies werden beschreven moeilijk te vergelijken zijn. Vanwege het observationele karakter van de studies verschilden de patiëntengroepen vaak significant van elkaar onder andere op het gebied van leeftijd, geslacht, en comorbiditeit. De interventiegroep die dialyse als nierfunctievervangende behandeling ontving was vaak jonger dan de controlegroep. In alle studies werd een vergelijking gemaakt tussen de uitkomsten van patiënten die een vorm van dialyse ontvingen (niet altijd gespecificeerd) en patiënten die een conservatieve behandeling ontvingen. De inhoud van deze conservatieve behandeling verschilde per studie en is terug te vinden in de evidence tabel. Het tijdstip van inclusie, in casu de mate van nierfunctiestoornis, werd wisselend gedefinieerd en in meerdere studies werden patiënten met acute nierfunctie verslechtering geëxcludeerd. Hieronder volgt een korte beschrijving van de individuele studies.
Murtagh (2007) beschreef een cohort van 129 patiënten, allen ouder dan 75 jaar, die multidisciplinaire pre-dialyse zorg ontvingen. Deze patiënten doorliepen een voorlichtingsprogramma en konden de keuze maken tussen een conservatieve behandeling of dialyse. De groepen bestonden uiteindelijk uit respectievelijk 77 en 52 patiënten. Mortaliteit is de beschreven uitkomstmaat in deze studie.
Chandna (2011) verrichtte een retrospectief onderzoek in de UK onder patiënten >18 jaar die een nefrologie kliniek bezochten met CKD 5 (indien eGFR <10ml/min werden ze geëxcludeerd). Er waren 689 patiënten die nierfunctievervangende behandeling kregen en 155 patiënten, die conservatief behandeld werden. Er bleek een groot verschil in leeftijd te bestaan tussen beide groepen, respectievelijk 58,5 en 77,5 jaar. De overleving was respectievelijk 67,1 en 21,2 maanden. In deze studie werd echter een subgroep analyse uitgevoerd met patiënten >75 jaar gecorrigeerd voor onderlinge verschillen. Er waren in deze groep 77 patiënten die nierfunctievervangende behandeling kregen en 106 patiënten die conservatief behandeld werden.
In een retrospectief cohort in Hong Kong is door Shum (2014) gekeken naar een groep vanaf 65 jaar, met een gemiddelde leeftijd van 75 jaar, waarvan 157 patiënten peritoneale dialyse (PD) kregen en 42 patiënten een conservatieve behandeling. In de studie wordt benadrukt dat de conservatieve groep hetzelfde niveau van gezondheidszorg heeft ontvangen als de PD-groep.
In een retrospectieve Nederlandse cohortstudie, gepubliceerd na het uitvoeren van de search (Verberne, 2016) zijn 311 patiënten ouder dan 70 jaar beschreven. 204 patiënten kozen voor een nierfunctievervangende behandeling, 107 patiënten kozen voor een conservatieve behandeling. De beschreven uitkomstmaat was mortaliteit.
Resultaten
Uitkomstmaat Mortaliteit
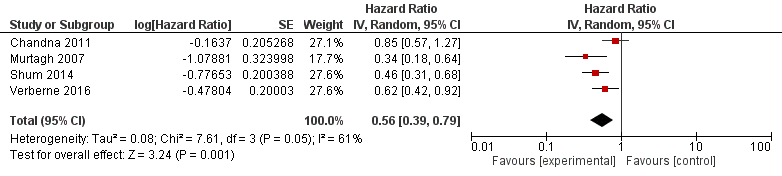
De uitkomstmaat mortaliteit is in vier studies beschreven (Verberne, 2016; Shum, 2014; Chandna, 2011; Murtagh, 2007). De resultaten van deze studies waren alle ten faveure van dialyse (figuur 1). Het gepoolde effect kwam uit op HR 0,56 95% CI [0,39 tot 0,79]. Dit ging gepaard met enige mate van heterogeniteit (τ2 0,08, I2 61%).
Echter het positieve effect op mortaliteit in de nierfunctievervangende behandelgroep neemt sterk af of is zelfs niet meer significant als er sprake is van hoge comorbiditeit. In de studie van Murtagh (2007) verdween het voordeel van overleving in de groep met nierfunctievervangende behandeling als er sprake was van hoge comorbiditeit volgens de Davis comorbidity score. In de 75+ groep in de studie van Chandna (2011) hadden patiënten met hoge comorbiditeit (gemeten volgens eigen score) een vijf maanden hogere overleving als ze nierfunctievervangende behandeling kregen ten opzichte van de conservatief behandelde groep. Dit verschil was niet meer significant. In de studie van Shum (2014) verdween het positieve effect op overleving bij de dialysepatiënten met hoge comorbiditeit, gemeten met de modified Charlson Comobidity Index (mCCI) en met lage Basic activities of daily living (BADL). In de Nederlandse studie van Verberne (2016) nam het overlevingsvoordeel sterk af in de groep met nierfunctievervangende behandeling met een hoge Davis comorbidity score (≥3). Het verschil bleef wel significant (P=0,02): mediaan: 75 tot 25ste percentiel: 1,8, 0,7 tot 4,1 jaar met nierfunctievervangende behandeling versus 1,0, 0,6 tot 1,4 jaar met conservatieve behandeling. Het verschil in overleving was niet meer significant als gekeken werd naar de leeftijdsgroep van 80 jaar of ouder, onafhankelijk van comorbiditeit of startpunt van meting (eGFR <20ml/min, <15ml/min, <10ml/min of tijdstip waarop behandelkeuze werd gemaakt).
Figuur 1 Conservatief vs. Dialyse, uitkomstmaat Mortaliteit
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Mortaliteit is niet verlaagd. Vanwege de observationele studiedesign van de geïncludeerde studies is de uitgangspositie van de bewijskracht ‘LAAG’, hetgeen tot gevolg heeft dat de uiteindelijke bewijskracht voor deze uitkomstmaat ‘LAAG’ is.
Uitkomstmaat Kwaliteit van Leven
Er werden geen studies gevonden waarin deze uitkomstmaat is beschreven.
Bewijskracht van de literatuur
Niet mogelijk om de bewijskracht voor deze uitkomstmaat te beoordelen
Uitkomstmaat Functioneren
Er werden geen studies gevonden waarin deze uitkomstmaat is beschreven.
Bewijskracht van de literatuur
Niet mogelijk om de bewijskracht voor deze uitkomstmaat te beoordelen
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Leidt dialyse in vergelijking tot conservatieve behandeling bij patiënten die een nierfunctievervangende behandeling moeten ondergaan tot meer kwaliteit van leven, een betere functionaliteit en een lagere mortaliteit?
De uitkomstmaten mortaliteit, kwaliteit van leven en functioneren werden gekozen als relevante uitkomstmaten voor deze uitgangsvraag. De werkgroep specificeerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase (Elsevier) is met relevante zoektermen gezocht naar studies waarin verschillende vormen van dialyse zijn vergeleken met conservatieve behandeling van patiënten die het eindstadium chronische nierschade zullen bereiken en nierfunctievervangende behandelingen nodig hebben. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 562 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- primair vergelijkend onderzoek;
- studiedesign RCT of vergelijkend observationeel onderzoek;
- artikel in het Engels of Nederlands;
- gepubliceerd na 2004;
- vergelijking tussen dialyse en conservatieve behandeling;
- beschreven patiëntenpopulatie ≥70 jaar;
- beschrijving van minstens één van de uitkomstmaten (mortaliteit, functionaliteit of kwaliteit van leven).
Op basis van titel en abstract werden in eerste instantie 43 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 40 studies geëxcludeerd (zie in-/ exclusietabel), en drie studies definitief geselecteerd. Nadien is daar nog één relevante studie aan toegevoegd die is gepubliceerd na het uitvoeren van de literatuursearch. Uit de literatuurselectie zijn verschillende onderzoeken naar voren gekomen die in aanmerking komen om te worden meegenomen in de overwegingen.
(Resultaten)
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De evidence tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u onder het tabblad Onderbouwing vinden.
Referenties
- Basic-Jukic N, Kes P, Juric I, et al. Octogenarians on hemodialysis: a prospective study. Archives of Gerontology & Geriatrics. 2008;47(1):19-24.
- Brown M, Collett G, Josland E, et al. CKD in elderly patients managed without dialysis: survival, symptoms, and quality of life. Clinical Journal of The American Society of Nephrology: CJASN. 2015;10(2):260-8.
- Carson R, Juszczak M, Davenport A, et al. Is maximum conservative management an equivalent treatment option to dialysis for elderly patients with significant comorbid disease? Clinical Journal of The American Society of Nephrology: CJASN. 2009;4(10):1611-9.
- Chandna S, Da Silva-Gane M, Marshall C, et al. Survival of elderly patients with stage 5 CKD: comparison of conservative management and renal replacement therapy. Nephrology Dialysis Transplantation. 2011;26(5):1608-14.
- Da Silva-Gane M, Wellsted D, Greenshields H, et al. Quality of life and survival in patients with advanced kidney failure managed conservatively or by dialysis. Clinical Journal of The American Society of Nephrology: CJASN. 2012;7(12):2002-9.
- Hussain J, Mooney A, Russon L. Comparison of survival analysis and palliative care involvement in patients aged over 70 years choosing conservative management or renal replacement therapy in advanced chronic kidney disease. Palliative Medicine. 2013;27(9):829-39.
- Isaacs A, Burns A, Davenport A. Is dialysis a viable option for the older patient? Outcomes for patients starting dialysis aged 80 years or older. Blood Purification. 2012;33(4):257-62.
- Kurella Tamura M, Covinsky K, Chertow G, et al. Functional status of elderly adults before and after initiation of dialysis. New England Journal of Medicine. 2009;361(16):1539-47.
- Murtagh F, Addington-Hall J, Higginson I. End-stage renal disease: a new trajectory of functional decline in the last year of life. Journal of the American Geriatrics Society. 2011;59(2):304-8.
- Murtagh F, Marsh J, Donohoe P, et al. Dialysis or not? A comparative survival study of patients over 75 years with chronic kidney disease stage 5. Nephrology Dialysis Transplantation. 2007;22(7):1955-62.
- O'Connor N, Kumar P. Conservative management of end-stage renal disease without dialysis: a systematic review. Journal of Palliative Medicine. 2012;15(2):228-35.
- Seow Y, Cheung Y, Qu L, et al. Trajectory of quality of life for poor prognosis stage 5D chronic kidney disease with and without dialysis. American Journal of Nephrology. 2013;37(3):231-8.
- Shum C, Tam K, Chak W, et al. Outcomes in older adults with stage 5 chronic kidney disease: comparison of peritoneal dialysis and conservative management. Journals of Gerontology Series A-Biological Sciences & Medical Sciences. 2014;69(3):308-14.
- Verberne W, Geers A, Jellema W, et al. Comparative Survival among Older Adults with Advanced Kidney Disease Managed Conservatively Versus with Dialysis. Clin J Am Soc Nephrol. 2016;11.
- Yong D, Kwok A, Wong D, et al. Symptom burden and quality of life in end-stage renal disease: a study of 179 patients on dialysis and palliative care. Palliative Medicine. 2009;23(2):111-9.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Shum, 2014 |
Type of study: Retrospective cohort
Setting: Single-centre
Country: Hong Kong, China
Source of funding: Not mentioned |
Inclusion criteria: - Chinese older adults (≥65 years) - stage 5 CKD (defined as estimated glomerular filtration rate [eGFR] < 15 mL/min/1.73 m2 using the Modification of Diet in Renal Disease equation) - received “dialysis assessment” - identified over a 7-year period (from July 1, 2003 to June 30, 2010).
Exclusion criteria:
N total at baseline: Intervention: 157 Control: 42
Important prognostic factors2: age ± SD: I:73,4 ± 5,3 C:75,3 ± 5,7 P=0,04
Sex: I: 52,2% M C: 42,9% M P=0,28
modified Charlson’s Comorbidity Index: mCCI ± SD: I:4,3 ± 1,5 C: 4,6 ± 1,8 P= 0,21
No Helper for PD: I: 17,6 % C: 58,8% P<0,001
Groups more or less comparable at baseline |
Describe intervention (dialysis):
PD group (defined as those who received PD as the first modality of longterm RRT or had made a decision to commence on PD and had begun preparation for the temporary dialysis, PD catheter insertion but had died before dialysis initiation).
|
Describe control:
Conservative group (defined as those who received no dialysis or conservative management after “dialysis assessment”
Participants in the conservative group would receive the same level of medical care as those in the PD group except no PD |
Length of follow-up: Median follow-up (interquartile range): 1,96 years (0,90-3,62)
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Mentioned that in general all variables had less than 5% missing data.
|
Outcome measures and effect size:
Mortality: I:96/ 157 C: 39/ 42 P>0,001 Adjusted HR: 0,46 95%CI (0,31-0,68) p<0,001 in favour of intervention. Median survival in years (interquartile range)
I: 3,75 (2,49-5,25) C: 2,35 (1,13-3,71) P<0,001 |
In favour of intervention (dialysis) |
|
Verberne, 2016 |
Type of study: Retrospective cohort
Setting: Single-centre
Country: Netherlands
Source of funding:
Research was made possible thanks to an unrestricted grant from Roche tot the St. Antonius Research Fund. |
Inclusion criteria: - Patients >70 years; - eGFr fell below 20 ml / min per 1.73 m2; - Exclusion criteria: -
N total at baseline: Intervention: 204 Control: 107
Important prognostic factors2: age ± SD: I:75,9 ± 4,4 C:82,5 ± 4,5 P< 0,001
Sex: I: 66 % M C: 55% M
Groups more or less comparable at baseline |
Describe intervention (dialysis):
Patients chose for PH, HD or transplantation. |
Describe control:
Conservative management. Full medical treatment and multidisciplinary care, including specialist nurses, dieticians, and social workers were continued on CM. |
Length of follow-up: Not mentioned
Loss-to-follow-up: No loss-to-follow-up.
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Mortality
Adjusted HR 0,62 (0,42 – 0,92) in favour of intervention, control is reference.
|
|
|
Murtagh, 2007 |
Type of study: Retrospective cohort
Setting: Multi-centre
Country: UK
Source of funding:
Not mentioned |
Inclusion criteria: - Patients >75 years receiving dedicated multidisciplinary pre-dialysis care.
Exclusion criteria: - Patients presenting late with previously undiagnosed CKD or in whom a rapid unforeseen deterioration in function has occurred.
N total at baseline: Intervention: 52 Control: 77
Important prognostic factors2: Sex: I: 65,4 % M C: 66,2% M
Groups not comparable at baseline. |
Describe intervention (dialysis):
Dedicated multidisciplinary pre-dialysis care is provided by a team of physicians, specialist nurses, counsellors and dieticians providing additional educational, dietary, social and psychological support to that available in the general clinic. Within all four units, all patients predicted to need dialysis within 18 months are directed from general nephrology care into this dedicated multidisciplinary predialysis care.
|
Describe control (treatment/procedure/test):
Dedicated multidisciplinary pre-dialysis care is provided by a team of physicians, specialist nurses, counsellors and dieticians providing additional educational, dietary, social and psychological support to that available in the general clinic. Within all four units, all patients predicted to need dialysis within 18 months are directed from general nephrology care into this dedicated multidisciplinary predialysis care.
|
Length of follow-up: Not mentioned
Loss-to-follow-up: No loss-to-follow-up mentioned.
Incomplete outcome data: Mentioned that there was no missing data.
|
Outcome measures and effect size:
2 year mortality
I: 12/52 C: 41/77
Adjusted HR 2,937 (1,560 – 5,531) in favour of intervention
Flipped with reference control.
0.340 ( 0,180 – 0,641)
|
|
|
Chandna, 2011 |
Type of study: Retrospective cohort
Setting: Muli-centre
Country: UK Source of funding:
Not mentioned |
Inclusion criteria: - Patients with stage 5 CKD based on eGFR estimated by MDRD-4 equation. - Patient had at least one value of eGFR in the range 10–15 mL/min/1.73 m2. - All subsequent recorded values of eGFR <15 mL/min/1.73 m2.
Exclusion criteria: None mentioned N total at baseline: Intervention: 689 Control: 155
Important prognostic factors2: age ± SD: I: 58,5 ± 15,0 C: 77,5 ± 7,6 P<0,001
Sex: I: 66,6 % M C: 59,4 % M NS
High Comorbidity: I: 17,3% C: 49,7 P<0,001
Groups not comparable at baseline.
|
Describe intervention:
We aimed to offer patients a free choice of modality constrained only by clinical and social imperatives. After the diagnosis of progressive CKD, patients were referred by the nephrologists to a liaison team, led by a senior nurse and a renal counsellor. This referral usually took place when the patient had stage 4 CKD—but for a minority of patients this was sometimes later. The role of the team included assessment, education, counselling and support of the patient and family/carer before, during and after modality choice.
HD patients were treated exclusively using high-flux membranes, predominantly polysulphone. Around 40% of patients were treated by online haemodiafiltration (HDF). Bicarbonate was used exclusively as the buffer, and ultrapure water was standard. Target total two-pool Kt/V urea (Kt/VTotal) was 1.2 per session for thrice-weekly HD and HDF. PD patients were treated by continuous ambulatory peritoneal dialysis (CAPD) or automated peritoneal dialysis. Disconnect systems were used exclusively for CAPD. Minimum weekly Kt/VTotal target for both PD modes was 2.0. |
Describe control:
We aimed to offer patients a free choice of modality constrained only by clinical and social imperatives. After the diagnosis of progressive CKD, patients were referred by the nephrologists to a liaison team, led by a senior nurse and a renal counsellor. This referral usually took place when the patient had stage 4 CKD—but for a minority of patients this was sometimes later. The role of the team included assessment, education, counselling and support of the patient and family/carer before, during and after modality choice.
Patients opting for conservative management were offered ongoing support by the multidisciplinary team in liaison with community, primary care and hospice services. Full medical treatment was continued, which included the use of erythropoietin as appropriate to treat or prevent anaemia. |
Length of follow-up: Not mentioned
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Not mentioned
|
Mortality
Subgroup of 75+ Adjusted HR 1,177 (0,787 – 1,759) in favour of intervention
Flipped with control reference: 0.849 (0.568 – 1.270)
|
|
Risk of Bias assessment observationele studies
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Shum, 2014 |
unlikely |
unlikely |
unlikely |
unlikely |
|
Chandna, 2011 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Verberne, 2016 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Murtagh, 2007 |
unlikely |
unclear |
unlikely |
unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-08-2016
Beoordeeld op geldigheid : 11-10-2016
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2020 bepaalt het bestuur van de Nederlandse Internisten Vereniging/Nederlandse federatie voor Nefrologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door Nefrovisie (www.nefrovisie.nl) & het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft tijdens het ontwikkelproces op geen enkele wijze invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is ondersteuning bieden bij het maken van een keuze betreffende het starten van nierfunctievervangende therapie dan wel conservatief behandelen. De verwachting is dat patiënten de optie om geen nierfunctievervangende therapie te starten beter kunnen overwegen, indien zij beschikken over aangepaste informatie. Ook zal er mogelijk een afname zijn van onbegrepen praktijkvariatie. Met behulp van concrete gegevens en getallen hopen we handvatten te bieden voor goede voorlichting waarbij centraal staat welke behandeling het beste aansluit bij wensen en verwachtingen van de individuele patiënt.
Doelgroep
Deze richtlijn is geschreven voor alle beroepsgroepen die betrokken zijn bij de zorg voor patiënten met chronische nierschade stadium 4 en 5 (eGFR <30 ml/min/1,73m2), die progressief is en zal leiden tot eindstadium chronische nierschade.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische nierschade. In de werkgroep participeerden de Nederlandse Internisten Vereniging-sectie Ouderengeneeskunde, Nederlandse Federatie voor Nefrologie, Nederlandse Vereniging voor Klinische Geriatrie, Vereniging Maatschappelijk Werk Nefrologie, Nederlands Huisartsen Genootschap, Nierpatiënten Vereniging Nederland, Verpleegkundigen & Verzorgenden Nederland – Dialyse en Nefrologie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Mw. dr. C.E. Douma, internist-nefroloog, werkzaam in het Spaarne Gasthuis, Hoofddorp; Nederlandse Internisten Vereniging/Nederlandse federatie voor Nefrologie (voorzitter)
- Dhr. dr. F.T.J. Boereboom, internist-nefroloog, werkzaam in het Diakonessenhuis en Dianet, Utrecht; Nederlandse Internisten Vereniging/Nederlandse federatie voor Nefrologie
- Mw. dr. M. van Buren, internist-nefroloog, werkzaam in het Hagaziekenhuis, Den Haag en LUMC, Leiden; Nederlandse Internisten Vereniging/Nederlandse federatie voor Nefrologie
- Dhr. dr. W. de Grauw, huisarts, werkzaam bij Huisartsenpraktijk Berghem, Berghem en Radboudumc, Nijmegen; Nederlands Huisartsen Genootschap
- Mw. dr. E.J.M. van Melick, klinisch geriater, werkzaam in het Reinier de Graaf Gasthuis, Delft; Nederlandse Vereniging voor Klinische Geriatrie
- Dhr. dr. S.P. Mooijaart, internist-ouderengeneeskunde, werkzaam in het LUMC, Leiden; Nederlandse Internisten Vereniging - sectie ouderengeneeskunde
- Mw. drs. K. Prantl, patiëntvertegenwoordiger, Nierpatiënten Vereniging Nederland
- Anonieme ervaringsdeskundige; Nierpatiënten Vereniging Nederland
- Mw. G. Smeets, verpleegkundige, werkzaam in de Isala Klinieken, Zwolle; Verpleegkundigen & Verzorgenden Nederland – Dialyse en Nefrologie
- Mw. G. Verbraak-Wijers, maatschappelijk werker nefrologie, werkzaam in het Amphia Ziekenhuis, Breda; Vereniging Maatschappelijk Werk Nefrologie
Met ondersteuning van:
- Mw. drs. A.T.M. Jorna, internist n.p., richtlijncommissie Nederlandse federatie voor Nefrologie, Utrecht.
- Dhr. A.A. Lamberts, MSc, junior adviseur, Kennisinstituut van Medisch Specialisten, Utrecht.
- Mw. M.E. Wessels, MSc, literatuurspecialiste, Kennisinstituut van Medisch Specialisten, Utrecht.
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar (financieel ondersteunde) betrekkingen onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten. Een overzicht van de belangen van werkgroepleden vindt u hieronder.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Boereboom |
medisch specialist diakonessenhuis (40%) |
geen bezoldigde nevenfunctie |
geen nevenfuncties, ook niet onbezoldigd, bij farmaceutische of medisch anderszins actieve bedrijven in de zorg. Geen aandeelhouder van bedrijven actief in de zorg. |
geen |
Niet aan de orde. Eerder actief geweest binnen de OMS en BBC van de NIV. Onderwerp sluit aan bij interesse en sinds kort gestart prospectief wetenschappelijk project. |
Dianet financiert de AIOS/promovenda van onze GOUD-studie. GOUD=Geriatric assessments in Older patients starting Dialysis. |
geen |
geen |
|
De Grauw |
huisarts te Berghem 0,7 fte |
bestuurslid diabetes huisartsen adviesgroep, aansturen expertgroep huisartsen, onbetaald. Hulpherder Grazerie, hoeden schaapskunde in natuurgebieden, onbetaald |
geen |
geen |
bestuurslid diabetes huisartsen adviesgroep medeauteur Landelijke Transmurale Afspraken CNS |
begeleiding onderzoek (promoverend) gefinancierd door Nierstichting Nederland |
Concept telenefrologie ontwikkeld, e-health product voor communicatie tussen huisarts en nefroloog en in toekomst mogelijk patiënt. |
geen |
|
Douma (vz) |
internist nefroloog |
lid Kwaliteitscommissie NfN, vergoeding onkosten |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jorna |
internist np, functionaris kwaliteitscommissie Nederlandse federatie voor Nefrologie en richtlijncommissie NIV |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lamberts |
junior adviseur, Kennisinstituut van Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Mooijaart |
internist afd. Ouderengeneeskunde LUMC (100%) |
Directeur van het institute for Evidence-Based Medicine in Old Age(IEMO). Het instituut is een project dat wordt gefinancierd door het ministerie van VWS en wordt uitgevoerd door ZonMW. Het LUMC treedt op als penvoerder. Werkzaamheden vallen derhalve onder de hoofdaanstelling |
geen |
geen |
geen |
geen |
geen |
geen |
|
Ervarings-deskundige |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Prantl |
Coördinator Kwaliteit en Onderzoek Nierpatiënten Vereniging Nederland (NVN) |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Smeets |
verpleegkundig specialist |
geen |
geen |
geen |
afgevaardigde vanuit landelijke netwerkgroep verpleegkundig specialisten nefrologie (LENN) en vanuit VenVN Dialyse & Nefrologie beroepsgroep |
geen |
geen |
geen |
|
Van Buren |
Internist-nefroloog Haga Ziekenhuis (0,8 fte) |
expertpanel nefrologie Amgen (12-16 uur/jaar betaald) |
geen |
geen |
geen |
hoofdonderzoeker van COPE-studie naar cognitieve achteruitgang en prognose bij oudere pre-dialyse patiënten. Dit onderzoek wordt deels gefinancierd door Roche NI. Roche heeft geen belang bij uitkomst van dit onderzoek |
Met het COPE onderzoek hopen we een model te kunnen maken voor betere inschatting en voorspelling van prognose van oudere pre-dialyse patienten. Dit zou uiteindelijk een model kunnen worden vor bredere uitrol in Nederland. Resultaten worden pas over 4-5 jaar verwacht, dus nu geen directe invloed op richtlijn. |
geen |
|
Van Melick |
klinisch geriater |
lid werkgroep klinische gerontofarmacologie; onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verbraak-Wijers |
medisch maatschappelijk werker nefrologie Amphia Ziekenhuis Breda |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd uitgebreid aandacht besteed aan het patiëntenperspectief door ervaringsdeskundigen uit te nodigen tijdens de Invitational Conference, daarnaast hebben twee afgevaardigden van de Nierpatiënten Vereniging Nederland zitting genomen in de werkgroep (één ervaringsdeskundige en één patiëntvertegenwoordiger) en is er tijdens de oriënterende zoekactie gezocht naar literatuur over het patiëntenperspectief. De conceptrichtlijn is voor commentaar voorgelegd aan Nierpatiënten Vereniging Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen, en op de ‘Richtlijn voor richtlijnen’ (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de adviseurs en de afgevaardigden van de NVN de knelpunten. Tevens zijn er tijdens de invitational conference knelpunten aangedragen. Een verslag van deze bijeenkomst is opgenomen onder aanverwante producten. De volgende organisaties zijn uitgenodigd voor de invitational conference:
- Diëtisten Nierziekten Nederland;
- Inspectie voor de Gezondheidszorg;
- Nederlandse Federatie voor Nefrologie;
- Nederlands Huisartsen Genootschap;
- Nederlandse Internisten Vereniging;
- Nederlandse Vereniging voor Klinische Geriatrie;
- Nefrovisie;
- Nierpatiënten Vereniging Nederland;
- Nierstichting;
- Vereniging Maatschappelijk Werk Nefrologie;
- Verpleegkundigen & Verzorgenden Nederland – Dialyse & Nefrologie;
- Zorginstituut Nederland;
- Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen, systematische reviews, en literatuur over patiëntvoorkeuren in de Guidelines International Network (G-I-N) database & Medline database via Ovid. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie is opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen schatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
er is veel vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is zeer onwaarschijnlijk dat de literatuurconclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Matig |
er is matig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is mogelijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Laag |
er is beperkt vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is waarschijnlijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Zeer laag |
er is weinig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; de conclusie is zeer onzeker. |
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De GRADE-methodiek is door de Nederlandse werkgroep GRADE-NL (nog) niet vastgesteld voor dit type vraagstelling. De bewijskracht van de conclusie is bepaald volgens de GRADE-Like-methode.
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie(s). Er is geen mate van bewijskracht toegevoegd.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. In enkele bleek het niet mogelijk om relevante literatuur die uit de search naar voren is gekomen middels de GRADE-systematiek te waarderen. Er is toen voor gekozen om deze artikelen in de ‘Overwegingen’ aan bod te laten komen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep besloten om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl). De werkgroep heeft uiteindelijk één indicator ontwikkeld bij de huidige richtlijn.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers M, Kho M, Browman GP, et al. for the AGREE Next Steps Consortium. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Can Med Assoc J. 2010;182:E839-842.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from www.guidelinedevelopment.org/handbook.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2004-april 2015
Engels, |
9 exp Renal Insufficiency, Chronic/ or ("severe kidney" adj3 (failure* or impairment* or disease*)).ti,ab. or ("severe renal" adj3 (failure* or impairment* or disease*)).ab,ti. or ("chronic kidney" adj3 (failure* or impairment* or disease*)).ab,ti. or ("chronic renal" adj3 (failure* or impairment* or disease*)).ab,ti. or ("end-stage kidney" adj3 (failure* or impairment* or disease*)).ab,ti. or ("end-stage renal" adj3 (failure* or impairment* or disease*)).ab,ti. or CKD.ti,ab. (120547) 10 exp Renal Replacement Therapy/ or exp Kidney Transplantation/ or ('renal replacement therapy' or rrt or dialy* or hemodialy* or haemodialy*).ti,ab. or (replacement adj3 'renal function').ti,ab. or (Hemofiltration* or Hemodiafiltration* or Haemofiltration* or Haemodiafiltration or transplant*).ti,ab. or conservative.ti,ab. (590711) 11 (9 and 10) or *"Dialysis"/ (70190) 12 "Life Expectancy"/ (14251) 13 (life adj3 expect*).ti,ab. (22669) 14 exp aged/ (2415938) 15 (elderly or geriatric or frailty or ageing or elders or frail or septuagenarian* or octogenarian* or nonagenarian*).ti,ab. (231440) 16 13 or 14 or 15 (2494876) 17 11 and 16 (21024) 18 limit 17 to (yr="2004 -Current" and (dutch or english)) (10619) 19 "Quality of Life"/ (124273) 20 patient admission/ or patient readmission/ (27758) 21 mortality/ or survival rate/ (164716) 22 "Activities of Daily Living"/ (51574) 23 ("Quality of Life" or QoL or (admission* adj3 hospital) or mortalit* or survival or adl or "functional status" or "Activities of Daily Living").ti,ab. (1233613) 24 19 or 20 or 21 or 22 or 23 (1367940) 25 18 and 24 (4363) 26 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (233513) 27 25 and 26 (70) – 68 uniek 28 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1446708) 29 25 and 28 (1051) 30 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. or Cross sectional.tw. or Cross-sectional studies/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2120243) 31 25 and 30 (2863) 32 (((conservative* or 'non-dialytic') adj3 (treatment* or therap* or manag*)) or 'palliative care' or ((forego* or withhold* or initiat* or start) adj2 dialysis)).ti,ab. (67475) 33 Palliative Care/ (41574) 34 32 or 33 (97947) 35 25 and 34 (441) 36 28 and 35 (93) 37 30 and 35 (275) 38 36 not 27 (90) – 83 uniek 39 37 not (36 or 27) (210) – 205 uniek |
562 |
|
Embase (Elsevier) |
'chronic kidney failure':ab,ti OR 'end stage renal disease':ab,ti OR 'severe renal impairment':ab,ti OR 'chronic kidney disease':ab,ti OR 'chronic renal failure':ab,ti OR 'severe renal failure':ab,ti OR 'severe renal disease':ab,ti OR 'chronic renal disease':ab,ti OR 'chronic renal insufficiency':ab,ti OR 'chronic kidney failure'/exp OR 'end stage renal disease'/exp OR 'severe renal impairment'/exp OR 'renal replacement therapy-dependent renal disease'/exp OR 'chronic kidney disease'/exp AND ('renal replacement therapy':ab,ti OR rrt:ab,ti OR dialy*:ab,ti OR hemodialy*:ab,ti OR haemodialy*:ab,ti OR (replacement NEAR/3 'renal function'):ab,ti OR transplantation*:ab,ti OR conservative:ab,ti OR 'renal replacement therapy'/exp OR 'kidney transplantation'/exp)
AND ('life expectancy'/exp OR 'aged'/exp OR (life NEAR/3 expect*):ab,ti OR elderly:ab,ti OR geriatric:ab,ti OR frailty:ab,ti OR ageing:ab,ti OR elders:ab,ti OR frail:ab,ti OR septuagenarian*:ab,ti OR octogenarian*:ab,ti OR nonagenarian*:ab,ti)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [2004-2015]/py
AND ('quality of life'/exp OR 'hospital admission'/exp OR 'hospital readmission'/exp OR 'mortality'/exp OR 'survival rate'/exp OR 'daily life activity'/exp OR 'quality of life':ab,ti OR qol:ab,ti OR (admission* NEAR/3 hospital):ab,ti OR mortalit*:ab,ti OR survival:ab,ti OR adl:ab,ti OR 'functional status':ab,ti OR 'activities of daily living':ab,ti)
AND 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp))) (39) – 25 uniek
AND ('conservative treatment'/exp OR ((conservative* OR 'non-dialytic') NEAR/3 (treatment* OR therap* OR manag*)):ab,ti OR 'palliative care':ab,ti OR ((forego* OR withhold* OR initiat* OR start) NEAR/3 dialysis):ab,ti) AND 'clinical study'/exp NOT 'conference abstract':it
AND 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it (81) - 489 uniek
'clinical study'/exp (217) – 132 uniek |
|
In- en exclusie tabellen
|
Nummer in search |
Auteur + jaartal |
Inclusie / Exclusie |
Toelichting |
|
Systematische review |
|||
|
3 |
Tong, 2014 |
Exclusie |
SR van kwalitatieve studies, voldoet niet aan selectiecriteria. |
|
8 |
Foote, 2014 |
Exclusie |
Conference proceeding, voldoet niet aan selectiecriteria. |
|
12 |
Brown, 2014 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
18 |
Thorsteindottir, 2013 |
Inclusie |
Nagaan in full-tekst of onderzoeksvraag PICO kan beantwoorden. |
|
31 |
Hall, 2013 |
Exclusie |
Geen antwoord PICO. Voor overwegingen. |
|
37 |
Brown, 2013 |
Exclusie |
Studieprotocol, geen primair onderzoek. |
|
44 |
O’Conner |
Exclusie |
Geen antwoord op PICO. |
|
56 |
Heldal, 2011 |
Exclusie |
Artikel in het Deens. |
|
83 |
Cohen |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
Nummer in search |
Auteur + jaartal |
Inclusie / Exclusie |
Toelichting |
|
RCT |
|||
|
15 |
Fasset 2014 |
Exclusie |
Geen antwoord op PICO. |
|
37 |
Williams, 2012 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
45 |
Isaacs, 2012 |
Exclusie |
Voldoet niet aan selectiecriteria. |
|
47 |
Foote 2012 |
Exclusie |
Geen vergelijkend onderzoek. |
|
61 |
Murtagh, 2011 |
Exclusie |
Geen vergelijkend onderzoek. |
|
66 |
Fasset 2011 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
73 |
Passadakis 2010 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
76 |
Cavalli, 2010 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
88 |
Kurella Tamura, 2009 |
Exclusie |
Geen vergelijkend onderzoek. |
|
99 |
Brunori, 2008 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
Nummer in search |
Auteur + jaartal |
Inclusie / Exclusie |
Toelichting |
|
Overige designs |
|||
|
5 |
Brown 2015 |
Exclusie |
Geen antwoord op PICO |
|
9 |
Ying 2014 |
Exclusie |
Geen primair onderzoek. |
|
17 |
Shum 2014 |
Inclusie |
|
|
18 |
Shih 2014 |
Exclusie |
Geen antwoord op PICO |
|
25 |
Schmidt 2014 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
59 |
Somma 2013 |
Exclusie |
Narrative review, voldoet niet aan selectiecriteria. |
|
62 |
Seow, 2013 |
Exclusie |
Geen antwoord op PICO. |
|
69 |
Lin 2013 |
Exclusie |
Geen antwoord op PICO. |
|
80 |
Hussain 2013 |
Exclusie |
Geen antwoord op PICO. |
|
120 |
Da Silva-Gane 2012 |
Exclusie |
Niet juist leeftijdsgroepen, voldoet niet aan selectiecriteria |
|
122 |
Cornelis, 2012 |
Exclusie |
Geen primair onderzoek |
|
134 |
Szeto 2011 |
Exclusie |
Geen vergelijkend onderzoek, voor overwegingen. |
|
163 |
Chandna 2011 |
Inclusie |
|
|
196 |
Yong 2009 |
Exclusie |
Niet juist leeftijdsgroep, voldoet niet aan selectiecriteria. |
|
207 |
Murphy 2009 |
Exclusie |
Geen antwoord op PICO. |
|
213 |
Ellam 2009 |
Exclusie |
Geen vergelijkend onderzoek, voor overwegingen. |
|
220 |
Carson 2009 |
Exclusie |
Niet de juiste gegevens gepresenteerd. |
|
237 |
De Biase 2008 |
Exclusie |
Geen vergelijkend onderzoek. |
|
242 |
Basic-Jukic 2008 |
Exclusie |
Geen vergelijkend onderzoek, voor overwegingen |
|
248 |
Wong 2007 |
Exclusie |
Geen vergelijkend onderzoek, voor overwegingen |
|
252 |
Vachharajani 2007 |
Exclusie |
Full-tekst bekijken of het echt vergelijkend onderzoek is. |
|
262 |
Murtagh 2007 |
Inclusie |
|
|
266 |
Kurella 2007 |
Exclusie |
Geen antwoord op PICO. |
|
278 |
Rakowski 2006 |
Exclusie |
Geen antwoord op PICO. |
|
X |
Verberne 2016 |
Inclusie |
Later toegevoegd aan analyse. |



