Doelgerichte therapie versus immuuntherapie bij niercelcarcinoom
Uitgangsvraag
Wat is de rol van doelgerichte therapie vergeleken met immuuntherapie of vergeleken met een combinatie van beide bij patiënten met gemetastaseerd niercelcarcinoom in de 1e lijn?
Aanbeveling
Bied behandeling met pembrolizumab + axitinib aan voor patiënten met een gemetastaseerd heldercellig niercelcarcinoom in alle IDMC risicogroepen.
Overweg voor patiënten in de good-risk groep het alternatief van monotherapie TKI.
Bied behandeling met ipilimumab en nivolumab aan voor patiënten met een gemetastaseerd heldercellig niercelcarcinoom met intermediate en poor risk kenmerken.
Overweeg cabozantinib, sunitinib of pazopanib voor patiënten met intermediate of poor risk kenmerken die een contra-indicatie voor immuuntherapie hebben.
Overweeg sunitinib of pazopanib voor good risk patiënten met een contra-indicatie voor immuuntherapie.
Registreer de IMDC Risico score bij iedere pt met gemetastaseerd niercelcarcinoom in de conclusie van het multidisciplinair overleg.
Overwegingen
Conclusies en aanbevelingen zijn van toepassing voor patiënten met gemetastaseerd niercelcarcinoom met tenminste een heldercellige component. Er zijn geen fase 3 studies met patiënten die een niet-heldercellig niercelcarcinoom hebben. Kleine single-arm fase 2 studies en subgroep analyses hebben wel enige effectiviteit van doelgerichte therapie en immuuntherapie laten zien bij verschillende typen niet-heldercellig niercelcarcinoom.
Voorstel voor conclusie: Hoewel enige effectiviteit van doelgerichte therapie en immuuntherapie bij het niet-heldercellig niercelcarcinoom wel lijkt te bestaan, is dit niet aangetoond in gerandomiseerd onderzoek.
Er is een klinisch relevant voordeel in progressievrije overleving van behandeling met zowel pembrolizumab + axitinib als axitinib + avelumab in alle IDMC risico groepen in vergelijking met sunitinib.
Een verschil in totale overleving is aangetoond bij combinatiebehandelingen van ipilimumab + nivolumab en pembrolizumab + axitinib. Voor ipilimumab + nivolumab is dit beperkt tot de intermediate en poor risk patiënten, met pembrolizumab + axitinib werd een klinisch relevant voordeel in totale overleving voor alle IMDC groepen beschreven in vergelijking met sunitinib. Echter, voor de favourable-risk IMDC groep behandeld met pembrolizumab + axitinib bestaat hierover de minste zekerheid op basis van lage aantallen events in de fase 3 studie.
Bij intermediate en poor risk patiënten is ook van cabozantinib een voordeel in progressievrije overleving aangetoond in fase 2 onderzoek, in vergelijking met sunitinib.
Bij een patiënt fit genoeg voor combinatie behandeling is er bewijs voor zowel ipilimumab + nivolumab (intermediate en poor) als ook pembrolizumab + axitinib (alle IMDC risico categorieën).
Bij monotherapie is de standaard therapie een TKI waarbij er beperkt bewijs (fase2) dat cabozantinib een gunstiger effect heeft op PFS in vergelijking met sunitinib. Bewijs van effect op totale overleving ontbreekt. Sunitinib en cabozantinib, maar ook pazopanib zijn een optie in de 1e lijn voor patiënten die een contra-indicatie voor immuuntherapie hebben.
Naast effectiviteit kan de keuze beïnvloed worden door co-morbiditeit, ander bijwerkingen profiel en therapeutische opties in verdere lijnen, waarbij een echte class-switch alleen na ipilimumab en nivolumab een optie is.
Voorkeuren van patiënten kunnen meegenomen worden in geval van keuzemogelijkheid monotherapie versus combinatie therapie. Tevens kan het bijwerkingen profiel bij zowel de verschillende vormen van monotherapie als ook de verschillende vormen van combinatie behandeling de voorkeur van patiënt beïnvloeden, waarbij kwaliteit van leven studies behulpzaam kunnen zijn. (Chen, 2020)
Bij falen van immuuntherapie combinaties zijn geen resultaten uit studies beschikbaar welke therapie de voorkeur zou hebben. De werkgroep adviseert het gebruik van een niet eerder gebruikte VEGFR-TKI. Voor patienten die in eerste lijn alsnog met sunitinib of pazopanib zijn behandeld adviseert de werkgroep nivolumab of cabozantinib gebaseerd op twee gerandomiseerde fase 3 studies (Choueiri, 2018; Motzer, 2015).
Het betreft kostbare behandelingen waarbij altijd de afweging gemaakt dient te worden of de gehoopte winst een haalbare doelstelling is bij iedere individuele patiënt.
Het betreft behandelingen met zeer specifieke bijwerkingen bij een zeer heterogeen belopende ziekte. Voldoende expertise op het gebied van ziekteontwikkeling en de aanpak van bijwerkingen die gepaard gaan met de diverse behandelingen is vereist.
Palliatieve behandelingen zoals deze momenteel beschikbaar zijn kunnen in een aanzienlijk percentage van patiënten met gemetastaseerd niercelcarcinoom in een overleving van meerdere jaren resulteren, met zeer acceptabele kwaliteit van leven. Met de juiste expertise kunnen bijwerkingen van deze therapieën goed worden gecontroleerd en daarmee kan het beoogde doel van levensverlenging en behoud van kwaliteit van leven steeds gewaarborgd worden.
Rationale voor de aanbevelingen
Palliatieve behandelingen zoals deze momenteel beschikbaar zijn, kunnen bij een aanzienlijk percentage van patiënten met gemetastaseerd niercelcarcinoom in een overleving van meerdere jaren resulteren, met zeer acceptabele kwaliteit van leven. Met de juiste expertise kunnen bijwerkingen van deze therapieën goed worden gecontroleerd en daarmee kan het beoogde doel van levensverlenging en behoud van kwaliteit van leven steeds gewaarborgd worden.
Onderbouwing
Achtergrond
Snelle veranderingen in aanbod systemische behandelingen bemoeilijken juiste timing van en keuze van eerste-, tweede- en derdelijns behandelingen van patiënten met gemetastaseerd heldercellig niercelcarcinoom.
Conclusies / Summary of Findings
Progressievrije overleving
|
Redelijk GRADE |
Het is aannemelijk dat cabozantinib leidt tot een langere progressievrije overleving dan sunitinib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom bij patiënten met intermediate- of poor risk kenmerken.
Bronnen: (Wallis, 2018; Choueiri, 2018) |
Progressievrije overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat pembrolizumab + axitinib leidt tot een langere progressievrije overlevingsduur dan sunitib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, in alle IMDC risicogroepen.
Bronnen: (Rini, 2019) |
Progressievrije overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat avelumab + axitinib leidt tot een langere progressievrije overlevingsduur dan sunitib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, in alle IMDC risicogroepen.
Bronnen: (Motzer, 2019) |
Progressievrije overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat nivolumab plus ipilimumab leidt niet tot een langere progressievrije overlevingsduur dan sunitinib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, bij patiënten met intermediate- of poor risk kenmerken.
Bronnen: (Motzer, 2018) |
Overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat nivolumab plus ipilimumab leidt tot een langere overlevingsduur dan monotherapie TKI in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom bij patiënten met intermediate- of poor risk kenmerken.
Bronnen: (Wallis, 2018, Tannir, 2019) |
Overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat avelumab + axitinib leidt tot een vergelijkbare overlevingsduur als sunitinib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, in alle IMDC risicogroepen.
Bronnen: (Motzer, 2019) |
Overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat nivolumab plus ipilimumab leidt tot een langere overlevingsduur dan sunitinib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, , bij patiënten met intermediate- of poor risk kenmerken.
Bronnen: (Motzer, 2018) |
Overleving
|
Redelijk GRADE |
Het is waarschijnlijk dat pembrolizumab + axitinib leidt tot een langere overlevingsduur dan sunitinib in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom, in alle IMDC risicogroepen.
Bronnen: (Rini, 2019) |
Kwaliteit van leven
|
- GRADE |
Er waren geen studies die systemische therapieën onderling vergeleken of ten opzichte van immuuntherapie op de uitkomst kwaliteit van leven in patiënten met gemetastaseerde niercelcarcinoom. |
Samenvatting literatuur
Beschrijving studies
Wallis (2018) beschrijft een systematische review met netwerk meta-analyse van 37 gerandomiseerde studies die twee systemische therapieën vergeleken in de eerstelijns behandeling van niercelcarcinoom. Van deze 37 studies voldeden 10 studies aan de inclusie criteria voor de netwerk meta-analyse. De behandelingen werden vergeleken bij patiënten met gemetastaseerd niercelcarcinoom op de uitkomsten overlevingsduur (5 studies, n=3379) en progressie-vrije overlevingsduur (10 studies, n=4819). Deze uitkomsten werden niet gedefinieerd. In de netwerk meta-analyses werden de volgende behandelopties vergeleken: (1) atezolizumab+bevacizumab, cabozantinib, nivolumab+ipilimumab, pazopanib+everolimus of pazopanib versus sunitinib op overlevingsduur; (2) atezolizumab+bevacizumab, cabozantinib, pazopanib+everolimus, pazopanib of sunitinib versus nivolumab+ipilimumab op overlevingsduur; (3) atezolizumab, atezolizumab+bevacizumab, axitinib, cabozantinib, nivolumab+ipilimumab, pazopanib+everolimus, pazopanib, sorafenib of tivozanib versus sunitinib op progressie-vrije overleving; en (4) atezolizumab, atezolizumab+bevacizumab, axitinib, nivolumab+ipilimumab, pazopanib+everolimus, pazopanib, sorafenib, sunitinib of tivozanib versus cabozantinib op progressie-vrije overleving. In vervolganalyses werden vervolgens alle behandelopties gerangschikt naar grote van effect.
Unverzaght (2017) beschrijft een systematische review met meta-analyse waarin meerdere vergelijkingen worden gedaan en ook meerdere uitkomsten worden gerapporteerd. De enige vergelijking die relevant is voor de huidige uitgangsvraag is de vergelijking van targeted immunotherapie met standaard targeted therapie. Omdat in de review van Wallis (2018) reeds een uitgebreidere meta-analyse voor de uitkomsten overlevingsduur en ziektevrije overlevingsduur geschreven wordt, beperken we ons bij het beschrijven van de review van Unverzaght (2017) tot de uitkomstmaat kwaliteit van leven. De review vond twee studies die de uitkomstmaat kwaliteit van leven rapporteerden. Echter, geen van deze twee studies betrof een vergelijking van behandelingen die relevant is voor de huidige uitgangsvraag: Motzer(2007) vergeleek IFNa met sunitinib op FKSI; Hudes (2007) vergeleek IFNa met temsirolimus op EQ-5D. Deze review kan dus alsnog niet meegenomen worden in de analyse.
In de gerandomiseerde trial van Choueiri, 2018 werd de effectiviteit van behandeling met cabozantinib vergeleken met behandeling met sunitinib in patiënten met niercelcarcinoom. Eerdere resultaten van deze studie werden reeds meegenomen in de review van Wallis (2018). Deze publicatie uit 2018 betreft een update met langere follow-up duur. De cabozantinib-groep (n=79, gemiddelde leeftijd=63 jaar (range 56 tot 69), 84% man) ontving eens per dag 60 mg cabozantinib gedurende 4 weken, gevolgd door 2 weken zonder behandeling. De dosis kon indien nodig worden aangepast naar 40 mg of 20 mg om bijwerkingen te onderdrukken. De sunitinib-groep groep (n=78, gemiddelde leeftijd=64 jaar (range 57 tot 71), 73% man) ontving eens per dag 50 mg sunitinib gedurende 4 weken, gevolgd door 2 weken zonder behandeling. In beide groepen werd de 6-weekse behandelcyclus gecontinueerd tot sprake was van radiologisch-aangetoonde ziekteprogressie (gemeten door de onderzoeker), therapie-intolerantie of terugtrekken van informed consent. De groepen werden vergeleken op de uitkomsten progressie-vrije overleving (gebaseerd op 12-wekelijkse MRI scans) en overleving met een maximale follow-up duur van 5 jaar.
Motzer (2018) beschrijft een RCT waarin 1097 patiënten waarvan 847 847 is aantal intermediair en slecht risico patiënten, patiënten met gemetastaseerd niercelcarcinoom werden gerandomiseerd voor een behandeling met nivolumab plus ipilimumab (550 patiënten) of sunitinib (546 patiënten). Progressievrije overleving en overleving waren primaire uitkomstmaten. Patiënten werden gedurende een mediane tijd van 25.2 maanden gevolgd.
Motzer (2019) beschrijft een RCT waarin 886 patiënten met gemetastaseerd niercelcarcinoom werden gerandomiseerd voor een behandeling met avelumab (10mg/kg lichaamsgewicht, intraveneus elke twee weken) plus axitinib (5mg oraal 2 maal daags) (442 patiënten) of sunitinib sunitinib (50mg, oraal, 1 maal daags voor de eerste 4 weken van elke 6-weekse cyclus) (444 patiënten). Progressievrije overleving en overleving waren primaire uitkomstmaten.
Rini (2019) beschrijft een RCT waarin 861 patiënten met gevorderd niercelcarcinoom en minstens één metastase waren gerandomiseerd om pembrolizumab (200mg, intraveneus, eens per 3 weken) plus axitinib (5mg, 2 maal daags) (432 patiënten) of sunitinib (50mg, oraal, 1 maal daags voor de eerste 4 weken van elke 6-weekse cyclus) (429 patiënten). Progressievrije overleving en overleving waren primaire uitkomstmaten. Patiënten werden gedurende een mediane tijd van 12.8 maanden gevolgd.
Tannir (2019) beschrijft aanvullende lange-termijn effecten van de CheckMate 214 studie (RCT) die reeds in de systematische review van Wallis (2018) is opgenomen. Hierin wordt behandeling met nivolumab + ipilimumab (550 patiënten) vergeleken met behandeling met sunitinib (546 patiënten).
Resultaten
Progressievrije overleving
In de netwerk meta-analyse van Wallis (2018) werden 10 verschillende eerstelijns therapieën voor de behandeling van metastatisch niercelcarcinoom vergeleken op progressievrije overleving (10 studies, n=4819). In twee aparte analyses werden de negen andere medicijnen vergeleken ten opzichte van respectievelijk sunitinib en cabozantinib (Figuur 1). Vergeleken met sunitinib, zijn behandelingen met atezolizumab+bevacizumab (HR: 0,85 95%BI: 0,74 tot 0,98) en cabozantinib (HR: 0,48, 95%BI: 0,31 tot 0,74) geassocieerd met een lagere kans op progressie. Vergeleken met cabozantinib, zijn behandelingen met atezolizumab (HR: 2.3 95%BI: 1,3 tot 3,9), atezolizumab+bevacizumab (HR: 1,8 95%BI: 1,1 tot 2,8) en nivolimumab + ipilimumab (HR: 2,1, 95%BI: 1,3 tot 3,3), pazopanib (HR: 2,2, 95%BI: 1,4 tot 3,5), sorafenib (HR: 2,2, 95%BI: 1,3 tot 3,6) en sunitinib (HR: 2,1, 95%BI: 1,4 tot 3,2) geassocieerd met een lagere kans op progressie. In een analyse van de relatieve rangschikking van elke behandeling ten opzichte van elkaar, kon met 91% waarschijnlijkheid gezegd worden dat cabozantinib de hoogste progressievrije overlevingskans gaf (Wallis, 2018).
Choueiri (2018) vergelijkt cabozantinib (n=79) met sunitinib (n=78) op progressie-vrije overleving. Radiografisch beeldmateriaal was beschikbaar voor 156 van de 157 patiënten; de mediaan follow-up duur bedroeg 25 maanden (interkwartielrange: 21,9 tot 30,9). In die periode werd bij 92 patiënten ziekteprogressie waargenomen: 43 in de cabozantinib-groep (mediaan: 8,6 maanden, 95% betrouwbaarheidsinterval (BI): 6,8-14,0) en 49 in de sunitinib-groep (mediaan: 5,3 maanden, 95%BI: 3,0-8,2). De progressievrije overlevingsduur was statistisch significant langer in de cabozantinib-groep dan in de sunitinib-groep (HR: 0,48, 95%BI: 0,31 tot 0,74, p=<0,001) (Choueiri, 2018). Deze resultaten bieden verdere ondersteuning voor de bevindingen uit de netwerk meta-analyse van Wallis (2018).
Motzer (2018) rapporteert een mediane progressivrije overleving van 11.6 maanden in de nivolumab plus ipilimumab groep vergeleken met 8.4 maanden in de sunitinib groep, HR: 0.82; P = 0.03, 95% CI niet genoemd voor de intermediar en slecht risicogroep; voor de gehele populatie 99.5% CI, 0.64–1.05. P=0.03
Motzer (2019) rapporteert een mediane progressie-vrije overleving van 13.8 maanden in de avelumab plus axitinib groep, vergeleken met 8.4 maanden in de sunitinib groep (hazard ratio, 0.69; 95% CI, 0.56 to 0.84; P<0.001).
Rini (2019) beschrijft dat bij een mediane follow-up duur van 12.8 maanden de pembrolizumab-axitinib groep een mediane progressievrije overleving had van 15.1 maanden, in vergelijking met 11.1 maanden in de sunitinib groep (HR voor ziekteprogressie of mortaliteit: 0.69, 95% CI 0.57 – 0.84, p<0.001).
Tannir (2019) beschrijft dat net zoals voorheen gepubliceerd in de CheckMate 214 studie de progressievrije overleving langer is in de nivolumab + ipilimumab groep vergeleken met de sunitinib groep (HR: 0.85 (95% CI:0.73–0.98) p=0.027); voor de intermediar en slecht risicogroep is dit: HR 0.77 (95% Cl 0.65–0.90), p=0.0014.
Figuur 1 Vergelijking van eerstelijns therapieën ten opzichte van sunitinib (boven) en cabozantinib (onder) op progressievrije overleving
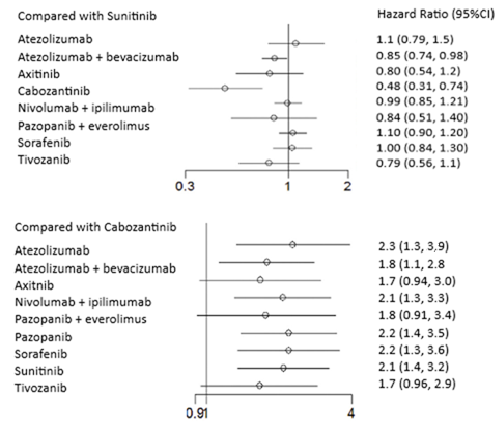
Bron: Figuur 2B en 2C in Wallis (2018)
Overleving
In de netwerk meta-analyse van Wallis (2018) werden zes verschillende eerstelijns therapieën voor de behandeling van metastatisch niercelcarcinoom vergeleken op progressievrije overleving (5 studies, n=3379). De vijf andere geneesmiddelen werden vergeleken ten opzichte van respectievelijk sunitinib en nivolumab + ipilimumab (Figuur 2). Vergeleken met sunitinib was alleen behandeling met nivolumab + ipilimumab geassocieerd met een significant lager risico op overlijden (HR: 0.68, 95% CrI: 0.55–0.85). Er was geen verschil in OS tussen nivolumab + ipilimumab en cabozantinib (HR: 1.2, 95% CrI: 0.73–1.9) of atezolizumab plus bevacizumab (HR: 1.2, 95% CrI: 0.84–1.6). Met 48% waarschijnlijkheid kan gezegd worden dat nivolumab +ipilimumab de voorkeurbehandeling is wat betreft OS. Sunitinib was met 57% waarschijnlijkheid de laagste keuze. In een analyse van de relatieve rangschikking van elke behandeling ten opzichte van elkaar, kon met 48% waarschijnlijkheid gezegd worden dat nivolumab + ipilimumab de hoogste overlevingskans gaf (Wallis, 2018).
Choueiri (2018) vergeleek cabozantinib (n=79) met sunitinib (n=78) op overleving (mediaan follow-up: 35,4 maanden, interkwartielrange: 31,4 tot 40,4). In die periode overleden 90 deelnemers: 43 in de cabozantinib-groep (overlevingsduur mediaan: 26,6 maanden, 95%BI: 14,6-not estimable) en 47 in de sunitinib-groep (overlevingsduur mediaan: 21,2 maanden, 95%BI: 16,3 tot 27,4). Er werd geen statistisch significant verschil gevonden tussen de groepen in tijd tot overlijden (HR: 0.80, 95%BI: 0,53 tot 1,21) (Choueiri, 2018). Deze resultaten sluiten aan bij de analyse van Wallis (2018) waarin tevens significante verschillen werden gevonden in overlevingskans tussen cabozantinib en sunitinib. Het is waarschijnlijk dat cabozantinib leidt tot een langere progressievrije overlevingsduur dan sunitinib (Choueiri 2018) en het is waarschijnlijk dat cabozantinib leidt tot een langere progressievrije overlevingsduur dan atezolizumab, atezolizumab + bevacizumab, nivolimumab + ipilimumab, pazopanib, sorafenib en sunitinib (wallis 2018) in de eerstelijns behandeling van gemetastaseerd niercelcarcinoom bij patiënten met intermediate- of poor risk kenmerken.
Motzer (2018) rapporteert dat een mediane overleving niet bereikt werd in de nivolumab plus ipilimumab groep vergeleken met 26.0 maanden in de sunitinib groep, HR: 0.63; P <0.001, 95% CI: 0,44 tot 0,89). 99.8% CI, 0.44–0.89 P<0.001.
Motzer (2019) rapporteert dat er 63 (14.3%) patiënten overleden in de avelumab plus axitinib groep, vergeleken met 75 (16.9%) patiënten die overleden in de sunitinib groep. Dit verschil was niet statistisch significant. (HR: 0.78; 95% CI, 0.55 to 1.08; P=0.14).
Rini (2019) beschrijft dat bij een mediane follow-up duur van 12.8 maanden de geschatte percentage patiënten dat na 12 maanden in leven was 89.9% was in de pembrolizumab-axitinib groep, in vergelijking met 78.3% in de sunitinib groep (HR voor mortaliteit: 0.53, 95% CI 0.38 – 0.74, p<0.001).
Tannir (2019) beschrijft dat net zoals voorheen gepubliceerd in de CheckMate 214 studie de overleving langer is in de nivolumab + ipilimumab groep vergeleken met de sunitinib groep (HR: 0.71 (95% CI: 0.59–0.86)) p=0.0003). Voor de intermediar en slecht risico patiënten is dit: HR 0.66 (95% Cl 0.54–0.80), p<0.0001. Inmiddels zijn er 48-maand data gepubliceerd van de CheckMate 214 trial, die buiten de zoekdatum van de systematische search vallen maar die de hierboven vermelde resultaten ondersteunen (Albiges, 2020).
Figuur 2 Vergelijking van eerstelijns therapieën ten opzichte van sunitinib (boven) en nivolimumab + ipilimumab (onder) op overleving
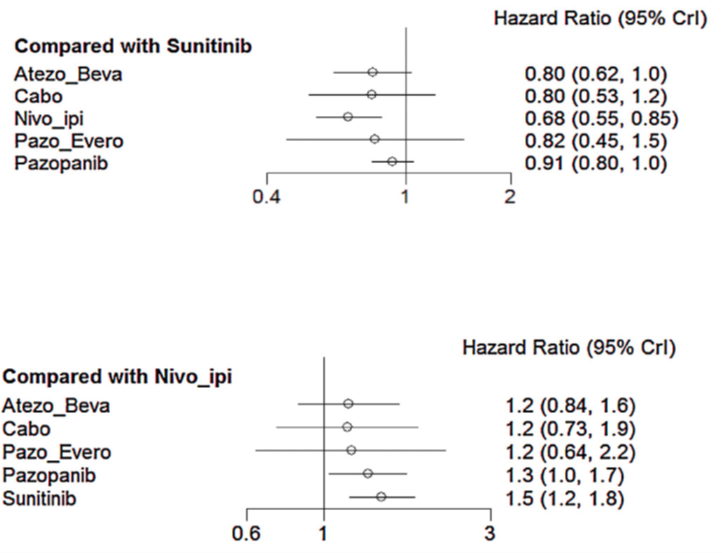
Bron: Figuur 3B en 3C in Wallis (2018)
Kwaliteit van leven
Er is binnen de onderzochte systematische reviews geen informatie gevonden over de kwaliteit van leven in patiënten met gemetastaseerd niercelcarcinoom.
Bewijskracht van de literatuur
Progressievrije overleving en algehele overleving
De bewijskracht voor de uitkomstmaten progressievrije overleving en overleving is gebaseerd op data uit respectievelijk 10 en 6 gerandomiseerde trials en start daarmee op “hoog”. De bewijskracht wordt met één niveau afgewaardeerd gezien de indirecte vergelijkingen in de netwerk meta-analyse, het geringe aantal studies (en soms ook proefpersonen) per directe vergelijking (imprecisie en indirektheid). De bewijskracht komt daarmee uit op “redelijk”.
Kwaliteit van leven
De bewijskracht voor de uitkomst kwaliteit van leven kon niet gegradeerd worden in verband met een gebrek aan onderbouwing.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van doelgerichte therapie vergeleken met immuuntherapie of vergeleken met een combinatie van beiden bij patiënten met gemetastaseerd niercelcarcinoom?
P: patiënten met gemetastaseerd niercelcarcinoom;
I: systemische therapie met doelgerichte therapie;
C: immuuntherapie of immuuntherapie plus doelgerichte therapie;
O: progressievrije overleving, overleving, kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte de uitkomsten progressievrije overleving en overleving voor de besluitvorming cruciale uitkomstmaten; en kwaliteit van leven een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) zijn op 20 maart 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde trials gepubliceerd sinds 2008. De search is vervolgens geupdate op 26 november 2019. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1036 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (1) gerandomiseerde trials of systematische reviews van gerandomiseerde trials, (2) vergelijking van systemische therapie met immuntherapie of immuntherapie plus systemische therapie, en (3) patiënten met gemetastaseerd niercelcarcinoom. Op basis van titel en abstract werden in eerste instantie 33 reviews voorgeselecteerd. Na raadpleging van de volledige tekst, werden 19 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording). Uit alle 14 relevante reviews werden per uitkomstmaat de reviews met de meest recente en volledige search gekozen. Voorts zijn 228 titels en abstracts gescreend van RCT’s die gepubliceerd zijn sinds 2015 (aansluitend op de search van de geselecteerde reviews). Hierbij gold als aanvullend selectiecriterium dat alleen studies met meer dan 100 deelnemers werden meegenomen. 1264 (1036 + 228) studies werden geëxcludeerd en 4 studies werden definitief geselecteerd. Via cross-referencing vonden de auteurs daarnaast nog 3 relevante RCTs.
Relevante vergelijkingen:
- ipilimumab+nivolumab;
- sunitinib;
- pazopanib;
- cabozantinib;
- everolimus +/- lenvatinib;
- sorafenib;
- axitinib;
- atezo + beva (REF 5 in Wallis);
- pembrolizumab + axitinib;
- axitinib + avelumab.
Resultaten
Twee reviews en 5 RCTs zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- 1 - Albiges, L., Tannir, N. M., Burotto, M., et al.. (2020). Nivolumab plus ipilimumab versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended 4-year follow-up of the phase III CheckMate 214 trial. ESMO open, 5(6), e001079.
- 2 - Choueiri, Toni K., et al. "Cabozantinib versus everolimus in advanced renal-cell carcinoma." New England Journal of Medicine 373.19 (2015): 1814-1823.
- 3 - Choueiri, T. K., Hessel, C., Halabi, S., Sanford, B., Michaelson, M. D., Hahn, O., ... & Dakhil, S. (2018). Cabozantinib versus sunitinib as initial therapy for metastatic renal cell carcinoma of intermediate or poor risk (Alliance A031203 CABOSUN randomised trial): Progression-free survival by independent review and overall survival update. European journal of cancer, 94, 115-125.
- 4 - Johal, S., Smare, C., Malcolm, B., & Doan, J. (2018). Retrospective Validation of Predicted Long-Term Survival Estimates from an Early Data Cut of the Phase III Checkmate 025 Study in Advanced Renal Cell Carcinoma. Value in Health, 21, S20.
- 5 - Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019;380:1103–15.
- 6 - Motzer RJ, et al. "Nivolumab versus everolimus in advanced renal-cell carcinoma." New England Journal of Medicine 373.19 (2015): 1803-1813.
- 7 - Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma.NEnglJMed . 2018;378:1277–1290
- 8 - Rini, B. I., Plimack, E. R., Stus, V., Gafanov, R., Hawkins, R., Nosov, D., ... & Vynnychenko, I. (2019). Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. New England Journal of Medicine, 380(12), 1116-1127.
- 9 - Tannir NMF, Arén Frontera O, Hammers HJ, et al. Thirty-month follow-up of the phase III CheckMate 214 trial of first-line nivolumab+ ipilimumab (N + I) or sunitinib (S) in patients (pts) with advanced renal cell carcinoma (aRCC). J Clin Oncol 2019;37:547.
- 10 - Unverzagt, S., Moldenhauer, I., Nothacker, M., Rossmeissl, D., Hadjinicolaou, A. V., Peinemann, F., ... & Seliger, B. (2017). Immunotherapy for metastatic renal cell carcinoma. Cochrane Database of Systematic Reviews, (5).
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Wallis, 2018
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and network meta-analysis of RCTs
Literature search up to October 2017
A: Atkins, 25 B: Choueiri, 2017 C: Cirkel, 24 D: Eichelberg, 23 E: Excudier, 4 F: Hutson, 22, 29 G: Motzer, 21, 27 H: Motzer, 16 I: Motzer, 5 J: Tomita, 26
Region/Country: A: International B: USA C: Netherlands D: Germany E: International F: International G: International H: International I: International J: Japan
|
Inclusion criteria SR: -RCTs that compared two systemic therapies in the first line treatment of metastatic renal cell carcinoma. -English language
Exclusion criteria SR: -observational studies, editorials, commentaries, review articles and those not subject to peer-review -samples that included patients previously treated with systemic therapy (if these could not be excluded from the overall cohort for the purpose of the analyses)
10 studies included
Important patient characteristics at baseline: N(I)/N(C) A: 101/101 B: 79/78 C: 52/49 D: 182/183 E: 550/546 F: 192/96 G: 557/553 H: 181/181 I: 454/461 J: 57/63
Median age (range) I/C: A: not reported B: 63 (40-82) / 64 (31-87) C: 65 (44-87) / 67 (38-82) D: 64 (39-84) / 65 (40-83) E: 62 / 62 F: 58 (23-83) / 58 (20-77) G: 61 (18-88) / 62 (23-86) H: 59 (23-83) / 59 (23-85) I: 62 (24-88) / 60 (18-84) J: not reported |
Describe intervention:
A1: Atezolizumab + Bevacizumab A2: Atezolizumab B: Cabozantinib C: Pazopanib + Everolimus D: Sorafenib E: Nivolumab + Ipilimumab F: Axitinib G: Pazopanib H: Tivozanib I: Atezolizumab + Bevacizumab J: Sunitinib
|
Describe control:
A: Sunitinib B: Sunitinib C: Pazopanib D: Sunitinib E: Sunitinib F: Sorafenib G: Sunitinib H: Sorafenib I: Sunitinib J: Sorafenib
|
Median Progression-free survival (months) I /C: A1: 11.7 / 8.4 A2:: 6.1 / 8.4 B: 8.2 / 5.6 C: 7.4 / 9.4 D: 5.9 / 8.5 E: 12.4 / 12.3 F: 10.1 / 6.5 G: 8.4 / 9.5 H: 12.7 / 9.1 I: 11.2 / 8.4 J: 8.7 / 7.0
Median survival (months) I/C: A1: n/a A2: n/a B: 26.6 / 21.2 C: 35.0 / 18.5 D n/a / n/a E: not reported / 32.9 F: n/a / n/a G: 28.3 / 29.1 H: n/a / n/a I: not reported / not reported J: n/a
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Progression free survival Defined as reported by study authors. Effect measure: HR (95%CI) A1: 1.00 (0.69-1.45) A2: 1.19 (0.82–1.71) B 0.48 (0.31–0.74) C: 0.81 (0.50–1.29) D: 1.19 (0.97–1.47)* E: 0.98 (0.79–1.23)£ F: 0.77 (0.56–1.05) G: 1.05 (0.90–1.22) H: 0.76 (0.58–0.99) I: 0.83 (0.70–0.97) J: 0.67 (0.42–1.08)
For results of network meta-analysis, see Figure 1 in the text.
Overall survival Defined as reported by study authors. Effect measure: HR (95%CI) A1: n/a A2: n/a B: 0.79 (0.53–1.20) C: 0.90 (0.51–1.58) D: n/a E: 0.68 (0.49–0.95)* F: n/a G: 0.92 (0.79–1.06) H: n/a I: 0.81 (0.63–1.03) J: n/a
For results of network meta-analysis, see Figure 2 in the text. |
Risk of bias While the studies were reviewed on risk of bias, fours studies were published as abstract and contained insufficient information for a full risk of bias assessment.
Conclusion of the authors In this systematic review and network meta-analysis of first-line systemic therapy for patients with mRCC, utilizing indirect comparison of data from phase 2 and 3 clinical trials, cabozantinib was identified as being highly likely to provide the greatest PFS benefit, while nivolumab plus ipilimumab was most likely to provide the greatest OS benefit. Furthermore, nivolumab plus ipilimumab was likely to be the best tolerated regime.
|
|
Unverzagt, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise)
Note: only studies that reported quality of life data were included as the above review by Wei, 2018 was more comprehensive for the outcomes overall survival and progression-free survival. |
SR and meta-analysis of RCTs
Literature search up to November 2016
A: Motzer, 2007 (reported in Cella, 2008) B: Hudes, 2007 (reported in Yang, 2010) C: Motzer, 2015a (reported in Cella, 2016)
Study design: A: 2-arm, open label RCT B: 3-arm, open label RCT C: 2-arm, open label RCT
Setting and Country: A: multicentre (101 centres), international B: multicentre, international C: multicentre (146 centres), international
Source of funding: A: Commercial; industrial co-authorship B: Commercial; industrial co-authorship C: Commercial, industrial co-authorship
|
Inclusion criteria SR: -participants diagnosed with all types of histologically conferimed mRCC. -comparisons of experimental intervention versus comparator interventions utilizing at least one immunotherapeutic agent. -ptorocol-defined immunotherapeutic, experimental interventions to standard treatment options as defined in current, evidence based guidelines for systemic therapy. -the following experimental interventions were included: ILs alone or combined with other immunotherapy or targeted therapies; IFNa alone or combined with other immunotherapy or targeted therapies; vaccine treatment (dentritic-cell-mediated, bacillus Calmette-Guerin (BCG) with tumour antigen, tumour-associated peptides) alone or in combination with other immunotherapy or targeted therapies; adoptive T-cell therapies; targeted immunotherapy (checkpoint inhibitors) either alone or in combination with other immunotherapy or targeted therapies; other immunotherapies identified from the searches. -Comparator interventions were: targeted therapies in first-, second0 or third-line therapies; immunotherapies and targeted therapies (IFNa plus bevacizumab) in first-line therapy.
Exclusion criteria SR: -Studies that focused on locally advanced disease.
3 studies included (for the outcome quality of life)
Important patient characteristics at baseline: N, median age A-I: n=375, 59 (34-85) A-C: n=375, 62 (27-87) B-I1: n=210, 59 (32-82) B-I2: n=207, 60 (23-86) B-C: 58 (32-81) C-I: n=410, 65 (23-88) yrs C-C: n=411, 62 (18-86)
Sex (% male): A-I: 72% A-C: 71% B-I1: 69% B-I2: 71% B-C: 66% C-I: 77% C-C: 74%
Groups comparable at baseline? Not reported |
Describe intervention:
A: IFNα-2a (Roche) SCinjection 3 times/week on non-consecutive days at 3MU per dose during first week, 6 MU per dose during second week and 9 MU per dose thereafter) until the occurrence of disease progression, unacceptable AEs or withdrawal of consent B1: Temsirolimus (Wyeth Research, 15 mg IV weekly, 30-minute infusion) + IFN-_ (Roferon-A, Roche, starting dose 3 MU 3 times/week for week 1 and 6 MU SC 3 times/week thereafter) B2: IFNα starting dose of 3 MU SC 3 times/week for the first week, dose was raised to 9 MU 3 times/week for the second week and to 18 MU 3 times/week for week 3, if tolerated. Participants who were unable to tolerate 9MU or 18MU received the highest tolerable dose (3 MU, 4.5 MU or 6 MU) C: Nivolumab 3 mg/kg IV every 2 weeks, no dose modifications permitted)
|
Describe control:
A: Sunitinib orally 50 mg once daily in 6-week cycles consisting of 4 weeks of treatment followed by 2 weeks without treatment B: Temsirolimus 25 mg IV weekly 30-minute infusion. C: Everolimus 10 mg orally, every day, dose modifications permitted
|
Endpoint follow duration: A: 17 weeks B: 12 weeks C: 100 days
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Outcome: quality of life Measurements and effect measures:
A: FACT-G, mean difference: -5.58 points (95%CI -7.24 to -3.91); A: FKSI-15, mean difference: -3.27 points (95% CI -4.18 to -2.36) A: FKSI-DRS, mean difference: -1.98 points (95% CI -2.51 to -1.46) A: EQ-5D, mean difference: -0.036 points (95% CI -0.06 to -0.01) A: EQ-VAS, mean difference: --4.74 points (95%CI -6.87 to -2.60) B: EQ-5D, mean difference at last measurement: -0.099 (95%CI -0.16 to -0.04) B: EQ-VAS, mean difference at last measurement: -4.5 (95%CI -8.18 to –0.82)
Pooled effect (random effects model): *EQ-5D:-0.06. (95% CI -0.12 to 0) favoring standard targeted therapies Heterogeneity (I2): 69% *EQ-VAS:-4.68. (95% CI -6.53 to -2.83) favoring standard targeted therapies Heterogeneity (I2): 0%
C: clinical important mean difference in FKSI-DRS, RR: 1.51 (95%CI 1.28-1.78) C: clinical important mean difference in EQ-5D-VAs, RR: 1.37 (95%CI 1.16-1.61) |
Brief description of author’s conclusion (limited to conclusions relevant to QoL): Comparisons of adverse effects (AEs) and preferably blinded quality of life (QoL) assessment are especially required for non-inferiority trials of adequate size.
Risk of bias was assessed using the Cochrane tool. All studies lacked blinding of participants and personnel (performance bias, which is particularly relevant for subjective outcomes). Two studies also lacked blinding of outcome assessment. One study had incomplete data on the outcome QoL. All included studies are commercially funded and published with industry co-authorship. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Motzer, 2019 |
Type of study: multicenter, randomized, open-label, phase 3 trial
Setting and country: United States of America
Funding and conflicts of interest: Commercial funding Supported by Pfizer and an alliance between Pfizer and Merck (Darmstadt, Germany). The conduct of the trial at the Memorial Sloan Kettering Cancer Center was supported in part by Memorial Sloan Kettering Cancer Center Support Grant/Core Grant (P30 CA008748). |
Inclusion criteria: previously untreated advanced renal-cell carcinoma with a clear-cell component. Additional key inclusion criteria were the presence of at least one measurable lesion according to the Response Evaluation Criteria in Solid Tumors (RECIST), version 1.1; age of 18 years or older; Eastern Cooperative Oncology Group (ECOG) performance-status score of 0 or 1 (on a 5-point scale in which higher numbers indicate greater disability); a fresh or archival tumor specimen; and adequate renal, cardiac, and hepatic function
Exclusion criteria: active central nervous system metastases, autoimmune disease, and current or previous use of glucocorticoids or other immunosuppressants within 7 days before randomization
N total at baseline: Intervention: 442 Control: 444
Important prognostic factors2: For example age (median and range): I: 62.0 (29.0–83.0) C: 61.0 (27.0–88.0)
Sex: I: 75% M C: 78% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
avelumab (10 mg per kilogram of body weight) intravenously every 2 weeks plus axitinib (5 mg) orally twice daily
|
Describe control (treatment/procedure/test):
sunitinib (50 mg) orally once daily for 4 weeks (6-week cycle) |
Length of follow-up: Up to 24 months
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Progression free survival: I: 13.8 months, C: 8.4 months (hazard ratio, 0.69; 95% CI, 0.56 to 0.84; P<0.001)
Overall survival: Deaths from any cause were observed in 63 patients (14.3%) who received avelumab plus axitinib and 75 patients (16.9%) who received sunitinib (stratified hazard ratio for death, 0.78; 95% CI, 0.55 to 1.08; P=0.14) |
|
|
Motzer, 2018 |
Type of study: randomized, open-label, phase 3 trial
Setting and country: United States of America
Funding and conflicts of interest: Commercial funding Supported by Bristol-Myers Squibb and Ono Pharmaceutical. The authors received no financial support or compensation for publication of this manuscript. |
Inclusion criteria: previously untreated advanced renal-cell carcinoma with a clear-cell component. Additional key inclusion criteria were measurable disease according to the Response Evaluation Criteria in Solid Tumors (RECIST), version 1.1, and a Karnofsky performance-status score of at least 70 (on a scale from 0 to 100, with lower scores indicating greater disability)
Exclusion criteria: central nervous system metastases or autoimmune disease and glucocorticoid or immunosuppressant use
N total at baseline: Intervention: 550 Control: 546
Important prognostic factors2: For example Age (median and range): I: 62 (26-85) C: 61 (21-85)
Sex: I: 74% M C: 71% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
nivolumab (3 mg per kilogram of body weight) plus ipilimumab (1 mg per kilogram) intravenously every 3 weeks for four doses, followed by nivolumab (3 mg per kilogram) every 2 weeks
|
Describe control (treatment/procedure/test):
sunitinib (50 mg) orally once daily for 4 weeks (6-week cycle) |
Length of follow-up: median follow-up 25.2 months
Loss-to-follow-up: The primary reason for treatment discontinuation was disease progression, observed in 229 of 547 patients (42%) in the nivolumab-plus-ipilimumab group and 296 of 535 (55%) in the sunitinib group.
Incomplete outcome data: See above
|
Outcome measures and effect size (include 95%CI and p-value if available):
Progression free survival: I: 11.6 months C: 8.4 months HR: 0.82; P = 0.03
Overall survival: I: not reached C: 26.0 months (hazard ratio for death, 0.63; P<0.001 |
|
|
Rini, 2019 |
Type of study: Phase 3 Randomized controlled trial
Setting and country: United states of America
Funding and conflicts of interest: Commercial funding Supported by Merck Sharp & Dohme. Axitinib and sunitinib were provided by Pfizer. |
Inclusion criteria: Eligible patients were 18 years of age or older; had newly diagnosed or recurrent stage IV (according to the American Joint Commission on Cancer, seventh edition, classification) clear-cell renal-cell carcinoma; had received no previous systemic therapy for advanced disease; had a Karnofsky performance-status score of 70 or more (on a scale from 0 to 100, with lower scores indicating greater disability); had at least one measurable lesion as evaluated according to Response Evaluation Criteria in Solid Tumors (RECIST), version 1.1; and had an available tumor sample for biomarker assessment.
Exclusion criteria: symptomatic central nervous system metastases, active autoimmune disease, or poorly controlled hypertension (systolic blood pressure ≥150 mm Hg or diastolic blood pressure ≥90 mm Hg), if they had had an ischemic cardiovascular event or New York Heart Association class III or IV congestive heart failure within 1 year before screening, or if they were receiving systemic immunosuppressive treatment.
N total at baseline: Intervention: 432 Control: 429
Important prognostic factors2: For example age (median and range): I: 62 (30–89) C: 61 (26–90)
Sex: I: 71% M C: 75% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
pembrolizumab (200 mg) intravenously once every 3 weeks plus axitinib (5 mg) orally twice daily
|
Describe control (treatment/procedure/test):
sunitinib (50 mg) orally once daily for the first 4 weeks of each 6-week cycle |
Length of follow-up: Median: 12.8 months
Loss-to-follow-up: In the as-treated population, 253 of the 429 patients (59.0%) in the pembrolizumab– axitinib group and 183 of the 425 patients (43.1%) in the sunitinib group were still receiving the trial treatment. The most common reason for treatment discontinuation was disease progression. In the pembrolizumab–axitinib group, 88 patients (50.0% of the 176 patients who discontinued pembrolizumab plus axitinib) received subsequent anticancer therapy, most commonly a VEGF or VEGF receptor inhibitor (44.3%). In the sunitinib group, 147 patients (60.7% of the 242 patients who discontinued sunitinib) received subsequent anticancer therapy, most commonly a PD-1 or PD-L1 inhibitor (37.6%))
|
Outcome measures and effect size (include 95%CI and p-value if available):
Overall survival at 12 months:
I: 89.9% in the pembrolizumab–axitinib group C: 78.3% in the sunitinib group (hazard ratio for death, 0.53; 95% confidence interval [CI], 0.38 to 0.74; P<0.001)
Progression free survival: I: 15.1 months C: 11.1 months (hazard ratio for disease progression or death, 0.69; 95% CI, 0.57 to 0.84; P<0.001) |
|
|
Tannir, 2019 |
Type of study: A Phase 3, Randomized, Open-Label Study
Setting and country: United States of America
Funding and conflicts of interest: commercial funding Bristol-Myers Squibb |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 550 Control: 546
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Nivolumab 3 mg/kg combined with Ipilimumab 1 mg/kg solutions intravenously every 3 weeks for 4 doses then Nivolumab 3 mg/kg solutions intravenously every 2 weeks until documented disease progression, discontinuation due to toxicity, withdrawal of consent or the study ends
|
Describe control (treatment/procedure/test):
Sunitinib 50 mg capsules by mouth once daily for 4 weeks then 2 weeks off, continuously until documented disease progression, discontinuation due to toxicity, withdrawal of consent or the study ends After completion of final analysis eligible participants may switch from receiving Sunitinib to receiving Nivolumab 3 mg/kg IV combined with Ipilimumab 1 mg/kg IV every 3 weeks for 4 doses then Nivolumab 240mg flat dose IV every 2 weeks
|
Length of follow-up: 30 months
Loss-to-follow-up: Into reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Progression free survival: I: 9.7 C: 9.7 HR: 0.85 (0.73–0.98)
Overall survival at 24 months: I: 71% C: 61% HR: 0.71 P= 0.0003
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Mohe, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
|
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Wallis, 2018 |
Yes |
|
Yes |
Yes |
Yes |
n/a – all RCTs |
Yes – but 4 studies were published as abstracts only and contained insufficient information to assess risk of bias |
Yes |
No |
Yes – none declared |
|
Unverzagt, 2017 |
Yes |
|
Yes |
Yes |
Yes |
n/a - all RCTs |
Yes |
Yes |
Yes |
Yes – SU: institution received support from the Federal Ministry of Education and Research, Germany (grant number: 01KG1024) US, IM, DR - institution received support from the Wilhelm-Roux- Program, Martin Luther University Halle-Wittenberg, Germany, for travel to meetings for this review. MN, AVH, FP, FG, BS: none known |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera.).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Motzer, 2019 |
Randomization (in a 1:1 ratio) was stratified according to ECOG performancestatus score (0 vs. 1) and geographic region |
Unlikely (open label trial, but survival outcomes are not biased by concealment of allocation) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely |
Unlikely |
Unclear |
|
Motzer, 2015 |
Randomization (in a 1:1 ratio) was stratified according to ECOG performancestatus score (0 vs. 1) and geographic region |
Unlikely (open label trial, but survival outcomes are not biased by concealment of allocation) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely |
Unlikely |
Unclear |
|
Rini, 2019 |
patients were randomly assigned in a 1:1 ratio to receive pembrolizumab (Keytruda, Merck Sharp & Dohme) plus axitinib (Inlyta, Pfizer) or sunitinib (Sutent, Pfizer). Randomization was stratified according to International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) risk group |
Unlikely (open label trial, but survival outcomes are not biased by concealment of allocation) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely |
Unlikely |
Unlikely |
|
Tannir, 2019 |
patients were randomly assigned in a 1:1 ratio |
Unlikely (open label trial, but survival outcomes are not biased by concealment of allocation) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely (open label trial, but survival outcomes are not biased by inadeqyate blinding) |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabellen
|
Auteur, datum |
Reden van exclusie |
|
Albiges, 2015 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (MA van effect targeted therapieen op overlevingsuur in mRCC) |
|
Bergerot, 2018 |
review van CABOSUN en CheckMate214 studies |
|
Bex, 2018 |
update van Europese richtlijn n.a.v. trial die sunitinib vergelijkt met sunitinib na nefrectomie |
|
Buti, 2016 |
Narratieve review |
|
Calvo, 2019 |
Narratieve review |
|
Canil, 2011 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Carlo, 2016 |
Narratieve review |
|
Castellano, 2018 |
observationele studie |
|
Ciccarese, 2018 |
voldoet aan PICO, maar de review van Wallis is breder; deze review kijkt alleen naar immune checkpoint inhibitors versus anti-VEGF/VEGFR agents in mRCC |
|
Coppin, 2008 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Coppin, 2011 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Coppin, 2016 |
Protocol voor systematische review, geen resultaten |
|
Di Lorenzo, 2009 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Donskov, 2018 |
behandeling niet in lijst met relevante vergelijkingen en sluit niet aan bij vergelijkingen in NMA van Wallis 2018 |
|
Durán, 2013 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Eichelberg, 2015 |
vergelijking van zelfde medicijnen in andere volgorde - vergelijkingen sluiten niet aan op de NMA van Wallis 2018 |
|
Escudier, 2017 |
secundaire data analyse van de CheckMate025 studie naar predictoren van overlevingsduur |
|
Flaherty, 2015 |
Vergelijking sluit niet aan op klinisch relevant geachte vergelijkingen en de NMA van Wallis |
|
Gill, 2018 |
Narratieve review |
|
Goebell, 2018 |
Cohort studie |
|
Graham, 2018 |
is geen originele paper maar een letter to the editor |
|
Guida, 2018 |
Narratieve review |
|
Guo, 2016 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (NMA naar progression-free-survival na behandeling met FDA goedgekeurde medicatie voor RCC (Targeted en immunologisch)) |
|
Haalaand, 2014 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (indirecte vergelijking van systemische therapien voor mRCC op overlevingsduur) |
|
Hale, 2019 |
Narratieve review |
|
Hofmann, 2017 |
geen originele paper, protocol voor een review |
|
Iacovelli, 2014 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (MA van effect antiangiogenic agents op progression-free-survival ten opzichte van interferon of placebo in mRCC) |
|
Iacovelli, 2015 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (MA ter vergelijking van anti-VEGF/VEGFR behandeling op overlevingsduur in mRCC) |
|
Ko, 2015 |
observationele studie |
|
Lalani, 2018 |
voldoet aan PICO, maar meta-analyse ontbreekt |
|
Larkin, 2013 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Liu, 2011 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Ljunberg, 2014, update 2015 |
Europese richtlijn voor RCC uit 2014, bevat SR van systemische therapie; geen transparant beschreven systematische review |
|
Macleod, 2015 |
observationele studie |
|
Motzer, 2016 |
follow-up van behandeling met everolimus na uitblijven van effect 1e-lijnsbehandeling (sunitinib, sorafenib, pazopanib, axitinib, bevacizumab, cytokine therapy), geen controle groep |
|
Nishino, 2016 |
voldoet niet aan PICO: vergelijking van incidentie van PD-1-inhibitor pneumonitis bij verschillende tumortypes (melanoma, NSCLC, RCC) en therapeutische behandelingen |
|
Ornstein, 2019 |
review van trials gepubliceerd in 2018, op basis van abstract lijkt het geen systematische review |
|
Osorio, 2017 |
review van registratiedata voor goedgekeurde medicijnen |
|
Pilié, 2018 |
SR (zonder MA) over systemische therapy in pre- peri en post chirurgische fasen van behandeling mRCC - 5 phase I/II trials |
|
Ravaud, 2015 |
bevacizumab niet in lijst met relevante vergelijkingen en sluit niet aan bij vergelijkingen in meta-analyses van Wallis 2018 |
|
Reeves, 2009 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Retz, 2019 |
vergelijking van zelfde medicijnen in andere volgorde - sluit niet aan op de vergelijkingen in de NMA van Wallis 2018 |
|
Rini, 2018 |
controle behandeling niet in lijst met relevante vergelijkingen |
|
Sankin, 2015 |
Narratieve review |
|
Schmidt, 2018 |
voldoet aan PICO, maar de vergelijkingen tussen behandelingen zijn niet logisch/relevant |
|
Shinohara, 2015 |
observationele studie |
|
Stenehjem, 2016 |
observationele studie |
|
Takyar, 2017 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (MA systemische therapie (TT of IT) ten opzichte van andere systemische therapie of placebo in mRCC op overleving en QoL) |
|
Tan, 2016 |
voldoet aan PICO, maar er zijn recentere reviews van goede kwaliteit (MA ter vergelijking van effectiviteit en bijwerkingen multikinaise inhbitors in RCC) |
|
Thompson, 2011 |
er zijn recentere reviews van goede kwaliteit te zijn, daarom niet meegenomen in systematische literatuuranalyse |
|
Tremblay, 2019 |
voldoet aan PICO, maar andere manier van data analyse en voor details search verwezen naar eerdere publicatie |
|
Wei, 2018 |
voldoet aan PICO, maar de vergelijkingen tussen behandelingen zijn niet logisch/relevant |
|
Zerders, 2018 |
voldoet aan PICO, maar meta-analyse ontbreekt |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-07-2021
Beoordeeld op geldigheid : 07-03-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Doelgerichte therapie versus immuuntherapie |
NVU |
2021 |
2023 |
2 jaarjaar |
NVU |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De richtlijn is ontwikkeld in samenwerking met:
- Beroepsvereniging Verpleegkundigen en Verzorgenden Nederland (V&VN)
Doel en doelgroep
Doel
Het doel van de herziening van de richtlijn is om onderbouwde adviezen te geven over diagnostiek, behandeling en follow-up van het niercelcarcinoom. Dit dient te leiden tot de ontwikkeling van een up-to-date, evidence-based richtlijn over diagnostiek en behandeling van het niercelcarcinoom waarmee doelmatig patiëntenzorg kan worden geleverd volgens de laatste wetenschappelijke inzichten en bovendien specifiek toegespitst op de Nederlandse praktijk.
Doelgroep
Deze richtlijn is geschreven voor alle leden van beroepsgroepen die betrokken zijn bij de zorg voor patiënten met niercelcarcinoom.
De richtlijn geldt dus met name voor urologen en internist oncologen, maar ook voor andere medisch specialisten zoals pathologen( interventie) radiologen en voor wat betreft de lokale therapie van metastasering en hersenmetastasering, de radiotherapeuten, neurologen en neurochirurgen, orthopeden en thoraxchirurgen. Daarnaast moeten ook verpleegkundigen en patiënten aanknopingspunten kunnen vinden in de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met niercelcarcinoom.
De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. A. (Axel) Bex, uroloog, Antoni van Leeuwenhoek, Amsterdam, NVU (voorzitter)
- Dr. D.M. (Deirdre) Bochove-Overgaauw, uroloog, Gelre Ziekenhuizen locatie Apeldoorn en Zutphen, NVU
- Dr. G.J.L.H. (Arno) van Leenders, patholoog, Erasmus Medisch Centrum, Rotterdam, NVvP
- C. (Corinne) Tillier, verpleegkundig specialist MANP, Antoni van Leeuwenhoek, Amsterdam, V&VN
- Dr. R. L. (Razvan) Miclea, abdomen-radioloog, Maastricht Universitair Medisch Centrum, Maastricht, NVvR
- Dr. A.P. (Paul) Hamberg, internist-oncoloog, Franciscus Gasthuis en Vlietland Ziekenhuis, Rotterdam, NIV/NVMO
- Dr. R.F.M. (Rob) Bevers, uroloog, Leids Universitair Medisch Centrum, Leiden, NVU
- Dr. R.W. (Rutger) van der Meer, interventie-radioloog, Leids Universitair Medisch Centrum, Leiden, NVvR
- Dr. J.V. (Hans) van Thienen, internist-oncoloog, Antoni van Leeuwenhoek, Amsterdam, NIV/NVMO
Namens patiëntenvereniging Leven met Blaas- of Nierkanker
- Lisa Bracht, patiënt vertegenwoordiger (tot augustus 2018)
- Guus Venderbosch, patiënt vertegenwoordiger (vanaf oktober 2018)
Klankbordgroep
- Dr. F.A (Erik) Klok, internist vasculair geneeskundige, Leids Universitair Medisch Centrum, Leiden, NIV
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. H. (Hanneke) van de Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Neven werkzaam heden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Van Leenders |
Patholoog, Erasmus MC, Rotterdam |
geen |
Consulent Roche (betaald); geven van vakinhoudelijk advies voer de interpretatie van wetenschappelijke literatuur en eventuele implementatie van immunohistochemische testen bij de behandeling van urotheelcelcarcinoom en niercelcarcinoom. |
geen |
onderzoek ondersteuning door Roche toegekend voor project 'Pathologische karakteristiek van PD-L1 expressie in blaascarcinoom'. Onderzoek ondersteuning door Astra Zeneca toegekend voor project ‘Kallibratie van PD-L1 immunohistochemische bepalingen bij blaaskanker. |
geen |
geen |
5-12-2017 |
Geen |
|
Bracht |
Voorzitter patiëntenvereniging Leven met blaas- of nierkanker (vrijwilligersfunctie) Lid PACO, Patiënten Adviescommissie Onderzoek, KWF (vrijwilligersfunctie). |
geen |
geen |
geen |
geen |
geen |
geen |
5-12-2017 |
geen |
|
Tillier |
Verpleegkundig Specialist Urologie NKI-AVL |
geen |
geen |
geen |
geen |
geen |
geen |
5-12-2017 |
geen |
|
Bochove-Overgaauw |
uroloog Gelre Ziekenhuizen locatie Apeldoorn en Zutphen |
Lid Werkgroep Oncologische Urologie subgroep niercelcarcinoom Deelnemer WIN O Deelnemer wetenschappelijke Advies Raad van Pro RCC (Prospectief Nederlands Nierkanker Cohort) Deelnemer werkgroep niercelcarcinoom Itemlijst |
geen |
geen |
geen |
geen |
geen |
17-12-2017 |
Geen |
|
Miclea |
Radioloog Maastricht UMC |
geen |
geen |
geen |
geen |
geen |
geen |
7-2-2018 |
Geen |
|
Bex |
Voorzitter Richtlijngroep Uroloog in het NKI-AvL |
Voorzitter werkgroep Immunotherapie Nederland Oncologie (WIN-O) onbetaald. Vice Voorzitter EAU richtlijn Niercelcarcinoom, voorzitter EORTC groep vanaf juni 2018 |
Deelname adviesraad bij Pfizer, BMS, Roche, Eisai and Ipsen |
geen |
PL van de NeoAvAx studie in het NKI-AvL, gefinancierd door Plizer. Lid steering commitee en PI van de IMMotion 010 adjuvante stie met atezolizumab bij hoog risico RCC, gefinacieerd door Roche/Genetech Lid steering commitee en PI van de CheckMate 914 adjuvante studie met nivolumab plus ipilumimab bij hoog - risico RCC, gefinancierd door BMS |
geen |
geen |
7-2-2018 |
Geen |
|
Hamberg |
Internist Oncoloog in het Franciscus Gasthuis en Vlietland |
Bestuurslid werkgroep Immunotherapie Nederland Oncologie (WIN-O |
Deelnemer adviesraden van BMS, IPSEN, Novartis, Eisai,Sanofi, Jansen Pfizer |
nee |
Lokale PI van Meerdere fase II en II studies |
nee |
nee |
9-2-2018 |
Geen |
|
Bevers |
Uroloog, LUMC Leiden |
geen |
geen |
geen |
geen |
geen |
geen |
9-3-2018 |
Geen |
|
van der Meer |
Interventieradioloog LUMC |
geen |
geen |
geen |
geen |
geen |
geen |
27-5-2018 |
Geen |
|
Klok |
Internist Vasculair geneeskundige, LUMC, Leiden |
Adjunct Professor Universiteit van Mainz, Duitsland (onbetaald) |
geen |
geen |
Dr. F.A. Klok heeft financiële steun ontvangen voor studies (unrestricted research grants) van Bayer, BMS/Pfizer, Boehringer Ingelheim, Daiichi Sankyo, MSD, Actelion, Trombose Stichting Nederland en de Hartstichting. |
geen |
geen |
28-5-2019 |
Geen |
|
van Thienen |
Internist-oncoloog NKI-AvL |
Geen |
Geen |
Geen |
Mede PI van de NeoAvAx studie in het NKI-AvL, gefinancierd door Plizer PI van de CheckMate 914 gefinancierd door BMS |
Geen |
Nascholing Novartis, MSD |
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van de Vereniging Leven met Blaas- of Nierkanker. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Vereniging Leven met Blaas- of Nierkanker en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen van de individuele modules. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Het verslag van de Invitational Conference bevindt zich in de bijlage.
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Er was financiële ruimte om 8 uitgangsvragen uit te werken met een systematische literatuursearch. Daarom moest de werkgroep een prioritering maken van de relevante klinische knelpunten. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen zoekvragen geformuleerd. Zoekvragen werden vertaald naar PICO’s (Patient, Intervention, Control, Outcome). Aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen in de bijlage.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (algehele conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een algehele conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van zorg'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.htm.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2008 – maart 2019
|
1 *Carcinoma, Renal Cell/ (27240) 2 exp *Kidney Neoplasms/ (58798) 3 (((kidney or renal or nephroid or hypernephroid or collecting duct) adj3 (cancer* or carcinoma* or adenocarcinoma* or neoplasm* or tumor* or tumour* or mass*)) or (grawitz tumor* or hypernephrom* or RCC)).ti. (43056) 4 1 or 2 or 3 (66259) 5 exp *IMMUNOTHERAPY/ or exp *CYTOKINES/ or exp *Interleukins/ or exp *Interferons/ or (biological* or immune therap* or immunotherap* or cytokine* or interleukin* or interferon* or systemic therap*).ti,ab,kw. or (combin* adj2 (therap* or treatment)).ti,ab,kw. (1662439) 6 exp *Neoplasm Metastasis/ or (metasta* or disseminat* or advanced).ti. (300484) 7 4 and 5 and 6 (2877) 8 limit 7 to (english language and yr="2008 -Current") (1317) 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (386554) 10 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1840163) 11 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3146033) 12 8 and 9 (81) 13 8 and 10 (583) 14 13 not 12 (526) 15 8 and 11 (436) 16 15 not 12 not 14 (246) 17 12 or 14 or 16 (853) |
1036 |
|
Embase (Elsevier) |
('renal cell carcinoma'/exp/mj OR 'kidney tumor'/exp/mj OR (((kidney OR renal OR nephroid OR hypernephroid OR 'collecting duct') NEAR/3 (cancer* OR carcinoma* OR adenocarcinoma* OR neoplasm* OR tumor* OR tumour* OR mass*)):ti) OR 'grawitz tumor*':ti OR hypernephrom*:ti OR rcc:ti) AND (((combin* NEAR/2 (therap* OR treatment)):ti,ab) OR 'cancer immunotherapy'/exp/mj OR immunotherap*:ti,ab OR 'immune therap*':ti,ab OR biological*:ti,ab OR 'cytokine'/exp/mj OR interleukin*:ti,ab OR cytokine*:ti,ab OR 'interferon'/exp/mj OR interferon*:ti,ab OR 'systemic therapy'/exp/mj OR 'systemic therap*':ti,ab) AND ('metastasis'/exp/mj OR metasta*:ti OR disseminat*:ti OR advanced:ti) AND (2008-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 85
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 545
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case controlstudy'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 54
= 684 |
