(Neo-)adjuvante behandeling van niercelcarcinoom
Uitgangsvraag
Wat zijn de (on)gunstige effecten van (neo-)adjuvante behandeling van niercelcarcinoom, vergeleken met follow-up?
Aanbeveling
Gebruik geen adjuvante therapie bij patiënten met intermediair tot en met hoog-risico niercelcarcinoom.
Overwegingen
De onderstaande overwegingen gelden in principe voor het overgrote deel van de patiëntenpopulatie waarop de uitgangsvraag betrekking heeft. Voor de subgroep ‘hoogst-risico’ zijn echter afwijkende en/of aanvullende overwegingen van belang met betrekking tot de voor- en nadelen van de interventie, kwaliteit van het bewijs, waarden en voorkeuren van patiënten, kosten, aanvaardbaarheid voor overige stakeholders en/of haalbaarheid en implementatie. Deze afwijkende en/of aanvullende overwegingen worden bij de betreffende aspecten expliciet benoemd maar leiden niet tot een verschil in aanbeveling.
Adjuvante therapie heeft geen klinisch relevant effect op ziektevrije interval en heeft geen effect op de overleving. Daarentegen is er een grote toxiciteit met name bij de VEGFR-tyrosine kinase remmer adjuvante therapie.
Door het aantal studies met vergelijkbare uitkomsten is de bewijskracht voor de ongunstige effecten hoog, inclusief het ontbreken van gunstige effecten.
Op basis van het ontbreken van een winst in algehele overleving zijn de kosten van adjuvante therapie het inzetten van de middelen niet waard.
Er is geen literatuur gevonden over de effecten van neoadjuvante therapie versus geen therapie of placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom. De werkgroep kan daarom geen aanbevelingen doen over neoadjuvante therapie.
Rationale voor aanbevelingen
Op dit moment worden de nadelen van adjuvante behandeling groter geacht dan de zeer beperkte en slechts in een studie aangetoonde verlenging van het ziektevrije interval zonder verlenging van de overleving. Adjuvante therapie kan niet worden aanbevolen.
Onderbouwing
Achtergrond
Hoog-risico niercelcarcinoom heeft een 50% kans op recidief binnen 5 jaar. Er heerst een unmet clinical need om deze hoge recidieffrequentie te verlagen door (neo)adjuvante therapie.
Conclusies / Summary of Findings
|
Hoog GRADE |
Adjuvante therapie verhoogt de algehele overleving niet vergeleken met geen therapie of placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom.
Bronnen: (Bai, 2018) |
|
Hoog GRADE |
Adjuvante therapie verhoogt de ziektevrije overleving niet vergeleken met geen therapie of placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom.
Bronnen: (Bai, 2018; Gross-Goupil, 2018, Motzer, 2017) |
|
Hoog GRADE |
Adjuvante therapie leidt tot een sterk verhoogde kans op graad 3 of 4 bijwerkingen vergeleken met placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom.
Bronnen: (Bai, 2018; Motzer, 2017; Sun, 2018) |
|
Laag GRADE |
Adjuvante therapie heeft waarschijnlijk een klein, niet-klinisch relevant geacht, negatief effect op Kwaliteit van Leven vergeleken met placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom.
Bronnen: (Staehler, 2018) |
|
… GRADE |
Er is geen literatuur gevonden over de effecten van neoadjuvante therapie versus geen therapie of placebo bij patiënten die geopereerd zijn aan een niet-gemetastaseerd niercelcarcinoom.
Bronnen: … |
Samenvatting literatuur
Beschrijving studies
In de (vrij summier gerapporteerde, niet commercieel gesponsorde) systematic review van Bai (2018) werden 12 RCT’s geïncludeerd met in totaal 5193 deelnemers. Het risico op bias van de SR was laag. De interventies in de geïncludeerde RCT’s betroffen sunitinib, sorafenib, thalidomide, Vitespen®, Active specific immunotherapy (ASI – autologe met radiotherapie behandelde tumorcellen gemengd met Bacillus Calmette‐Guèrin), Tumor Cell Vaccine, girentuximab, Interferon alfa-NL (Wellferon, Burroughs-Wellcome, Research Park, NC), de combinatie IL-2 en Interferon-alfa, Alfa-2b, Interferon-alfa, en de combinatie van 5-flurouracil, interferon-alfa en IL-2. In 2 van de geïncludeerde studies werd de interventie met placebo vergeleken; in de andere studies was de vergelijking observatie. De methodologische kwaliteit van de individuele studies werd door de reviewers beoordeeld als voldoende. Er werden meta-analyses gepresenteerd van Algehele overleving, ziektevrije overleving en bijwerkingen.
Naast de RCT’s in de SR zijn er 3 RCT’s opgenomen in de literatuuranalyse. Eén hiervan (Staehler, 2018) beschreef een uitkomstmaat (Kwaliteit van Leven, gemeten met de EORTC QLQ-C30) uit een trial (Ravaud, 2016) die ook was geïncludeerd in de SR van Bai (2018). Hierin werd sunitinib (50 mg/dag oraal in een cyclus van 4 weken op, 2 weken af) gedurende maximaal een jaar vergeleken met placebo. Er werden internationaal 610 patiënten geïncludeerd. In de RCT van Gross-Goupil ,2018, werd bij 724 patiënten het effect van axitinib (5 mg 2 maal daags gedurende 1 tot 3 jaar) vergeleken met placebo op DSF en OS . Deze trial werd voortijdig beëindigd vanwege futiliteit. Motzer (2017) beschreven een trial waarin het effect van pazopanib op DFS werd vergeleken met placebo. Aanvankelijk was de dosering 800 mg/dag, maar nadat 198 patiënten die dosis hadden ontvangen werd besloten om de dosering te verlagen naar 600 mg/dag, hetgeen als de patiënt het verdroeg na 8 tot 12 weken werd verhoogd tot 800 mg/dag. In de fase van 600 mg/dag werden 1135 patiënten geïncludeerd. Alle 3 RCT’s weren gesponsord door een farmaceutisch bedrijf. De methodologische kwaliteit was goed.
Resultaten
1. Algehele overleving
De algehele overleving was niet significant lager in de adjuvante therapie groep vergeleken met de placebo/observatie groep. Deze werd gerapporteerd in de SR van Bai (2018). In de vroegtijdig gestopte RCT van Gross-Goupil (2018) was OS wel een uitkomstmaat, maar de data hadden geen maturiteit bereikt. Hoe lang de follow-up was in de trials geïncludeerd Door Bai (2018) werd in die SR niet gerapporteerd. De gepoolde HR (95% CI) over 9 trials was niet significant lager in de adjuvante therapie groep, maar 1.04 (0.95 to 1.15), in het voordeel van placebo, I2: 0.0%.
2. Ziektevrije overleving.
De ziektevrije overleving was niet significant lager in de adjuvante therapie groep vergeleken met de placebo/observatie groep. Deze uitkomstmaat werd gerapporteerd in de SR van Bai, door Gross-Goupil (2018) en door Motzer (2017). De S-TRAC studie is de enige studie waarin een significant langer DFS werd geconstateerd na 1 jaar sunitinib versus placebo (Ravaud, 2016) ten koste van een hogere toxiciteit. De resultaten zijn te zien in onderstaande forest plot; de gepoolde HR (95% CI) is 0.99 (0.90; 1.08); I2 35%. Georde (2018) rapporteerde ook resultaten van een jaar later: HR (95% CI) 0.94 (0.77; 1.14), p=0.51. In de SR van Bai (2018) werd ook subgroepanalyses gedaan op typen adjuvante medicijnen, met ziektevrije overleving als uitkomst; de resultaten hiervan waren als volgt:
- Doelgerichte therapie (sunitinib, sorafenib): 1.07 (0.90 to1.26); I2 5.6%.
- Vaccine therapy (Vitespen, ASI): 0.98 (0.84 to 1.16); I2 0.0%.
- Immunotherapie (girentuximab, interferon alfa-NL combinatie IL-2 + Interferon-alpha, alfa-2b, en interferon-alpha): 1.08 (0.92 to 1.28); I2 0.0%.
Figuur 1
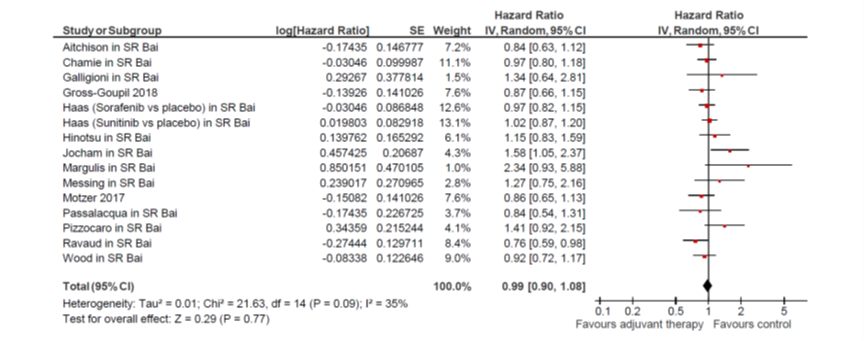
3. Bijwerkingen. In de SR van Bai (2018) werden alleen data gerapporteerd over specifieke bijwerkingen, bijvoorbeeld hypertensie, hand- voetsyndroom, diarree. In de SR van Sun (2018), die overigens niet gebruikt is om de algehele overleving en ziektevrije overleving te rapporteren omdat de SR van Bai (2018) meer studies omvatte, werden wel data van graad 3 of 4 bijwerkingen gerapporteerd. Deze zijn gebruikt voor onderstaande forest plot. In alle geïncludeerde vergelijkingen was het risico op bijwerkingen aanzienlijk hoger bij adjuvante therapie dan bij placebo. De gepoolde OR (95% CI) is 5.69 (4.74 – 6.83); I2 45%.
Figuur 2
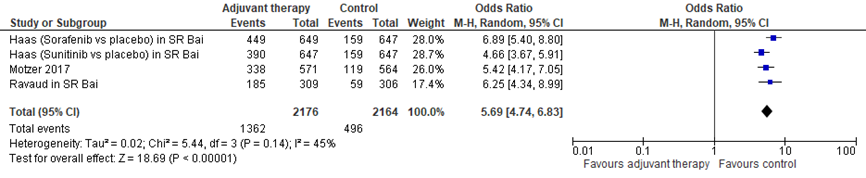
4. Kwaliteit van Leven werd alleen gerapporteerd door Staehler, 2016 bij in total 610 patiënten. Kwaliteit van leven was - wel statistisch significant, maar niet klinisch relevant - lager in de adjuvante therapie groep vergeleken met de placebogroep. Het gemiddelde verschil op de EORTC QLQ-C30 van -4.76 (95% CI: -6.82, -2.71; P<0.0001) in het voordeel van placebo. Dit was een kleiner verschil dan wat klinisch relevant geacht werd (10 punten).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Algehele overleving start hoog en is niet verlaagd.
De bewijskracht voor de uitkomstmaat ziektevrije overleving start hoog en is niet verlaagd .
De bewijskracht voor de uitkomstmaat bijwerkingen is niet verlaagd
De bewijskracht voor de uitkomstmaat Kwaliteit van Leven is met 2 niveaus verlaagd gezien het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag :
Wat zijn de (on)gunstige effecten van (neo) adjuvante behandeling van niercelcarcinoom, vergeleken met follow-up?
P: patiënten met niercelcarcinoom (zonder metastasen);
I: (neo-)adjuvante behandeling;
C: expectatief beleid; geen behandeling
O: (ziektevrije) overleving, bijwerkingen, kwaliteit van Leven.
Relevante uitkomstmaten
De werkgroep achtte algehele overleving en ziektevrije overleving voor de besluitvorming cruciale uitkomstmaten; en kwaliteit van leven een voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is in februari 2019 met relevante zoektermen gezocht vanaf 1998 naar studies waarin adjuvante of neoadjuvante behandeling werd vergeleken met placebo of afwachtend beleid. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 538 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: het onderzoek betrof patiënten met niercelcarcinoom zonder metastasen, bij wie een vorm van adjuvante of neoadjuvante therapie liefst gerandomiseerd werd vergeleken met placebo of afwachtend beleid en waarbij de uitkomstmaten overall survival, ziektevrije overleving of kwaliteit van leven werden gerapporteerd. Op basis van titel en abstract werden in eerste instantie 26 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 21 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 5 studies definitief geselecteerd.
Resultaten
Eén systematic review en 3 RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. Er werden geen gerandomiseerde studies gevonden waarin neoadjuvante therapie werd onderzocht. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- 1 - Bai, Y., Li, S., Jia, Z., Ding, Y., Gu, C., & Yang, J. (2018). Adjuvant therapy for locally advanced renal cell carcinoma: A meta-analysis and systematic review. In Urologic Oncology: Seminars and Original Investigations (Vol. 36, No. 2, pp. 79-e1).
- 2 - George, D. J., Figlin, R., Motzer, R. J., Paty, J., Lechuga Frean, M. J., Zanotti, G., ... & Ravaud, A. (2018). 916P Sunitinib tolerance following an initial exposure period: Results of longitudinal PRO data from S-TRAC study. Annals of Oncology, 29(suppl_8), mdy283-125.
- 3 - Gross-Goupil, M., Kwon, T. G., Eto, M., Ye, D., Miyake, H., Seo, S. I., ... & DeBenedetto, R. (2018). Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: results from the phase III, randomized ATLAS trial. Annals of Oncology, 29(12), 2371-2378.
- 4 - Motzer, R. J., Haas, N. B., Donskov, F., Gross-Goupil, M., Varlamov, S., Kopyltsov, E., ... & Zemanova, M. (2017). Randomized phase III trial of adjuvant pazopanib versus placebo after nephrectomy in patients with locally advanced renal cell carcinoma (RCC)(PROTECT).
- 5 - Staehler, M., Motzer, R. J., George, D. J., Pandha, H. S., Donskov, F., Escudier, B., ... & Ramaswamy, K. (2018). Adjuvant sunitinib in patients with high-risk renal cell carcinoma: safety, therapy management, and patient-reported outcomes in the S-TRAC trial. Annals of Oncology, 29(10), 2098-2104.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Bai, 2018
individual study characteristics deduced from Wood, 2008
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April, 2017
A: Haas, 2016 B: Ravaud, 2016 C: Margulis, 2009 D: Wood, 2008 E: Galligioni, 1996 F: Jocham, 2004 G: Chamie, 2016 H: Messing, 2003 I: Passalacqua, 2014 J: Pizzocaro, 2001 K: Hinotsu, 2013 L: Aitchison, 2014
Study design: RCT
Setting and Country: A, C, D, G, H: USA B, E, F, I, J, L: Europe K: Japan
Source of funding: National Natural Science Foundation of China Conflicts of interest: No CoI
|
Inclusion criteria SR: RCTs adjuvant therapy versus. no active treatment after surgery for loco-regional RCC published in English
Exclusion criteria SR: radiation trials articles with no key data
12 studies included
Number of patients A: n=1286 B: n=615 C: n=59 D: n=765 E: n=117 F: n=172 G: n=874 H: n=391 I: n=184 J: n=290 K: n=104 L: n=336
|
Describe intervention:
A: Sunitinib (n= 637)or Sorafenib (n= 639) B: Sunitinib C: Thalidomide D: vitespen E: ASI F: Tumor cell vaccine G: Girentuximab H: Alfa-NL I: IL-2 + IFN-alpha J: Alfa-2b K: Interferon-alpha L: 5 -flurouracil, interferon-alpha and interleukin-2
|
Describe control:
A: placebo (n=649) B: placebo C: observation D: observation E: observation F: observation G: observation H: observation I: observation J: observation K: observation L: observation
|
End-point of follow-up: not reported
For how many participants were no complete outcome data available? not reported
|
Outcome measure-1 Overall survival
Effect measure: HR (95% CI): A: Sunitinib: 1.17 (0.90 – 1.47) Sorafenib: 0.98 (0.78 – 1.24) B: NA C: NA D: 0.98 (0.70 – 1.36) E: 1.39 (0.63 – 3.05) F: NA G: 0.99 (0.74 – 1.32) H: 1.51 (0.94 – 2.43) I: 1.07 (0.64 – 1.79) J: 1.04 (0.67 – 1.61) K: 1.07 (0.79 – 1.45 L: 0.87 (0.61 – 1.23)
Pooled effect (fixed effects model): 1.04 (95% CI 0.95 to 1.15) favoring observation/placebo Heterogeneity (I2): 0.0%
Outcome measure-2 Disease-free survival Effect measure: HR (95% CI): A: Sunitinib: 1.02 (0.87 – 1.20) Sorafenib: 0.97 (0.82 - 1.15 B: 0.76 (0.59 – 0.98) C: 2.34 (0.93 – 5.88) D: 0.92 (0.73 – 1.17) E: 1.34 (0.63 – 2.81) F: 1.58 (1.05 – 2.37) G: 0.97 (0.79 – 1.18) H: 1.27 (0.75 – 2.16) I: 0.84 (0.54 – 1.31) J: 1.41 (0.93 – 2.15) K: 1.15 (0.84 – 1.59) L: 0.84 (0.63 - 1.12)
Pooled effect (fixed effects model): 1.00 (95% CI 0.92 to 1.08) Heterogeneity (I2): 35.0%
Outcome measure-3 Adverse events ≥ grade 3 Pooled Odds Ratio Intervention versus Control (95% CI)
Hypertension (A, B, D, F, H) 3.22 (1.90 – 5.46) Fatigue (A, B, C, D, F, K) 3.43 (2.03 – 5.79) Rash (A, B, C, H, I, K) 6.18 (1.51 – 25.33) Hand-foot syndrome (A, B, F) 11.4 (2.4 – 53.91) Diarrhea (A, B, D, F, H, I) 14.2 (1.68 – 120) Pain (A, B, C, D, H, K) 3.24 (2.34 – 4.47) Infection (A, B, F, H, K) 1.88 (1.06 – 3.33) |
Facultative:
Authors’ conclusion: “Adjuvant therapies were ineffective, possibly harmful”
Personal remarks (H. van der Lee): The article was written by Chinese authors; the language is not optimal; overall survival data extracted from the study of Wood et al. 2008 were wrong (and included in the meta-analysis)); data presented here extracted from original paper
Level of evidence: GRADE moderate for OS and PFS (1 level downgraded because of imprecision; low for Adverse Events (1 level downgraded for imprecision and 1 level downgraded for high probability of reporting bias
Subgroup analyses for separate types of adjuvant therapy: DFS HR Targeted therapy (A) 1.07 (0.90 – 1.26); I2 5.6% Vaccine therapy (D, E) 0.98 (0.84 – 1.16); I2 0.0% Immune therapy (G, H, I, J, K) 1.08 (0.92 – 1.28); I2 0.0%
|
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Staehler, 2018 |
Type of study: RCT
Setting and country: multicentre, international, EU and USA
Funding and conflicts of interest: Pfizer, many consultancy fees from various companies reported |
Inclusion criteria: histologically confirmed clear-cell RCC, pre-nephrectomy Eastern Cooperative Oncology Group performance status (ECOG PS) 0–2, beginning treatment within 3–12weeks of nephrectomy
Exclusion criteria: macroscopic residual or metastatic disease post-nephrectomy, prior systemic treatment
N total at baseline: Intervention: 304 (or 309? Figures) Control: 306
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
sunitinib (oral, 50 mg/day), 4-weeks-on/2- weeks-off schedule for nine cycles (1 year) or until disease relapse, occurrence of secondary malignancy, significant toxicity, death, or withdrawal of consent
|
Describe control (treatment/procedure/test):
placebo 4-weeks-on/2- weeks-off schedule for nine cycles (1 year) until disease relapse, occurrence of secondary malignancy, significant toxicity, death, or withdrawal of consent |
Length of follow-up: 28 days after the last on-study treatment administration
Loss-to-follow-up: Not clear
Incomplete outcome data: Not clear
|
Outcome measures and effect size (include 95%CI and p-value if available): EORTC QLQ-C30 mean (95% CI) difference in the overall means –4.76 (95% CI: –6.82, –2.71; P<0.0001) favoring placebo |
This paper reports QoL outcomes from the trial by Ravaud, 2016, included in SR by Bai, 2018.
Difference in EORTC QLQ30 not clinically relevant (MCID 10) |
|
Gross-Goupil, 2018 |
Type of study: RCT
Setting and country: multicentre, worldwide
Funding Pfizer Inc and SFJ Pharmaceuticals conflicts of interest: many consultancy fees from various companies reported |
Inclusion criteria: newly diagnosed RCC (≥pT2 and/or N+, any Fuhrman grade (FG), Eastern Cooperative Oncology Group performance status (ECOG PS) 0/1), prior nephrectomy
Exclusion criteria: previous antiangiogenic treatment or systemic treatment of RCC
N total at baseline: Intervention: 363 Control: 361
Important prognostic factors2: median age (IQR): I: 58 (51-66) C: 58 (51-66)
Sex: I: 77% M C: 69% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test): twice-daily oral axitinib 5mg, up to 3 years and for a minimum of 1 year unless there was recurrence, occurrence of a second primary malignancy, significant toxicity, or withdrawal of consent
|
Describe control (treatment/procedure/test): placebo twice daily, up to 3 years and for a minimum of 1 year unless there was recurrence, occurrence of a second primary malignancy, significant toxicity, or withdrawal of consent |
Length of follow-up:
Loss-to-follow-up: not clear (survival endpoint)
Incomplete outcome data: not clear
|
Outcome measures and effect size (include 95%CI and p-value if available): DFS HR (95% CI) 0.870 (0.660–1.147), p= 0.3211
OS (data not mature) HR (95% CI) 1.026 (0.600-1.756), p=0.9246
|
Trial was stopped early for futility |
|
Motzer, 2017 |
Type of study: RCT
Setting and country: multicentre, worldwide
Funding and conflicts of interest: Novartis, many consultancy fees from various companies reported |
Inclusion criteria: resected nonmetastatic (M0) clear-cell or predominant clear-cell RCC histology, any of the combinations: pT2G3-4N0, pT3-T4 GanyN0, or pTanyGanyN1, Karnofsky performance score ≥80 and adequate organ function Exclusion criteria:
N total at baseline: Intervention: 571 Control: 564
Important prognostic factors2: Median (range) age I: 58 (22-83) C: 58 (21-82)
Sex: I: 70% M C: 71% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
pazopanib 600 mg/day for 1 year After the first 8 to 12 weeks of treatment, the dose could be maintained or escalated to 800 mg daily, based on a patient’s safety and tolerability
|
Describe control (treatment/procedure/test):
placebo |
Length of follow-up: 3 years Loss-to-follow-up: Intervention: 2 (0.4%) Reasons not reported
Control: 1 (0.2%) Reasons not reported
Incomplete outcome data: not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
DFS (median 30 months after randomisation) HR (95% CI) 0.86 (0.70; 1.06), p=0.16
DFS (1 year later) HR (95% CI) 0.94 (0.77; 1.14), p=0.51
|
Trial started using 800 mg/day; dose lowered after 198 participants in intervention group; results of the 600 mg/day group presented here |

|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Staehler, 2018* |
not reported |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Gros-Goupil, 2018 |
centralised method |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Motzer, 2017 |
not reported |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wei, 2018 |
P voldoet niet aan de PICO |
|
Sun, 2018 |
Specifieke interventie, ook in SR Bai 2018 |
|
Sonbol, 2018 |
Specifieke interventie, ook in SR Bai, 2018 |
|
Kourie, 2018 |
Geen SR, alleen meta-analyse, methode onduidelijk |
|
Mamtani, 2019 |
Post-hoc subgroepanalyse van de ASSURE trial (Haas, 2017) |
|
Zhao, 2018 |
Analyse van secundaire uitkomst (vermoeidheid) van ASSURE trial (Haas 2017) |
|
Motzer, 2018 |
Secundaire analyse S-TRAC trial (Ravaud 2016) |
|
Lenis, 2018 |
Narrative review |
|
Lawrence, 2018 |
Survey onder investigators over beslissing voor adjuvante therapie |
|
Haas, 2017 |
Eerder paper over deze trial opgenomen in SR van Bai |
|
Chamie, 2017 |
Opgenomen in SR van Bai, 2018 |
|
Bex, 2017 |
Update richtlijn obv resultaten ASSURE en S-TRAC (beide opgenomen in SR van Bai) |
|
Ravaud, 2016 |
Opgenomen in SR van Bai, 2018 |
|
Patel, 2016 |
Narrative review |
|
Haas, 2016 |
Opgenomen in SR van Bai, 2018 |
|
Haas, 2015 |
O voldoet niet aan PICO |
|
Haas, 2012 |
O voldoet niet aan PICO |
|
Kunkle, 2007 |
Narrative review |
|
Eisen, 2007 |
Geen full text |
|
Eisen, 2006 |
Geen full text |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-03-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Neoadjuvante behandeling van niercelcarcinoom |
NVU |
2020 |
2025 |
5 jaar |
NVU |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
De richtlijn is ontwikkeld in samenwerking met:
- Beroepsvereniging Verpleegkundigen en Verzorgenden Nederland (V&VN)
Doel en doelgroep
Doel
Het doel van de herziening van de richtlijn is om onderbouwde adviezen te geven over diagnostiek, behandeling en follow-up van het niercelcarcinoom. Dit dient te leiden tot de ontwikkeling van een up-to-date, evidence-based richtlijn over diagnostiek en behandeling van het niercelcarcinoom waarmee doelmatig patiëntenzorg kan worden geleverd volgens de laatste wetenschappelijke inzichten en bovendien specifiek toegespitst op de Nederlandse praktijk.
Doelgroep
Deze richtlijn is geschreven voor alle leden van beroepsgroepen die betrokken zijn bij de zorg voor patiënten met niercelcarcinoom.
De richtlijn geldt dus met name voor urologen en internist oncologen, maar ook voor andere medisch specialisten zoals pathologen( interventie) radiologen en voor wat betreft de lokale therapie van metastasering en hersenmetastasering, de radiotherapeuten, neurologen en neurochirurgen, orthopeden en thoraxchirurgen. Daarnaast moeten ook verpleegkundigen en patiënten aanknopingspunten kunnen vinden in de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met niercelcarcinoom.
De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. A. (Axel) Bex, uroloog, Antoni van Leeuwenhoek, Amsterdam, NVU (voorzitter)
- Dr. D.M. (Deirdre) Bochove-Overgaauw, uroloog, Gelre Ziekenhuizen locatie Apeldoorn en Zutphen, NVU
- Dr. G.J.L.H. (Arno) van Leenders, patholoog, Erasmus Medisch Centrum, Rotterdam, NVvP
- C. (Corinne) Tillier, verpleegkundig specialist MANP, Antoni van Leeuwenhoek, Amsterdam, V&VN
- Dr. R. L. (Razvan) Miclea, abdomen-radioloog, Maastricht Universitair Medisch Centrum, Maastricht, NVvR
- Dr. A.P. (Paul) Hamberg, internist-oncoloog, Franciscus Gasthuis en Vlietland Ziekenhuis, Rotterdam, NIV/NVMO
- Dr. R.F.M. (Rob) Bevers, uroloog, Leids Universitair Medisch Centrum, Leiden, NVU
- Dr. R.W. (Rutger) van der Meer, interventie-radioloog, Leids Universitair Medisch Centrum, Leiden, NVvR
- Dr. J.V. (Hans) van Thienen, internist-oncoloog, Antoni van Leeuwenhoek, Amsterdam, NIV/NVMO
Namens patiëntenvereniging Leven met Blaas- of Nierkanker
- Lisa Bracht, patiënt vertegenwoordiger (tot augustus 2018)
- Guus Venderbosch, patiënt vertegenwoordiger (vanaf oktober 2018)
Klankbordgroep
- Dr. F.A (Erik) Klok, internist vasculair geneeskundige, Leids Universitair Medisch Centrum, Leiden, NIV
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. H. (Hanneke) van de Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Neven werkzaam heden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Van Leenders |
Patholoog, Erasmus MC, Rotterdam |
geen |
Consulent Roche (betaald); geven van vakinhoudelijk advies voer de interpretatie van wetenschappelijke literatuur en eventuele implementatie van immunohistochemische testen bij de behandeling van urotheelcelcarcinoom en niercelcarcinoom. |
geen |
onderzoek ondersteuning door Roche toegekend voor project 'Pathologische karakteristiek van PD-L1 expressie in blaascarcinoom'. Onderzoek ondersteuning door Astra Zeneca toegekend voor project ‘Kallibratie van PD-L1 immunohistochemische bepalingen bij blaaskanker. |
geen |
geen |
5-12-2017 |
Geen |
|
Bracht |
Voorzitter patiëntenvereniging Leven met blaas- of nierkanker (vrijwilligersfunctie) Lid PACO, Patiënten Adviescommissie Onderzoek, KWF (vrijwilligersfunctie). |
geen |
geen |
geen |
geen |
geen |
geen |
5-12-2017 |
geen |
|
Tillier |
Verpleegkundig Specialist Urologie NKI-AVL |
geen |
geen |
geen |
geen |
geen |
geen |
5-12-2017 |
geen |
|
Bochove-Overgaauw |
uroloog Gelre Ziekenhuizen locatie Apeldoorn en Zutphen |
Lid Werkgroep Oncologische Urologie subgroep niercelcarcinoom Deelnemer WIN O Deelnemer wetenschappelijke Advies Raad van Pro RCC (Prospectief Nederlands Nierkanker Cohort) Deelnemer werkgroep niercelcarcinoom Itemlijst |
geen |
geen |
geen |
geen |
geen |
17-12-2017 |
Geen |
|
Miclea |
Radioloog Maastricht UMC |
geen |
geen |
geen |
geen |
geen |
geen |
7-2-2018 |
Geen |
|
Bex |
Voorzitter Richtlijngroep Uroloog in het NKI-AvL |
Voorzitter werkgroep Immunotherapie Nederland Oncologie (WIN-O) onbetaald. Vice Voorzitter EAU richtlijn Niercelcarcinoom, voorzitter EORTC groep vanaf juni 2018 |
Deelname adviesraad bij Pfizer, BMS, Roche, Eisai and Ipsen |
geen |
PL van de NeoAvAx studie in het NKI-AvL, gefinancierd door Plizer. Lid steering commitee en PI van de IMMotion 010 adjuvante stie met atezolizumab bij hoog risico RCC, gefinacieerd door Roche/Genetech Lid steering commitee en PI van de CheckMate 914 adjuvante studie met nivolumab plus ipilumimab bij hoog - risico RCC, gefinancierd door BMS |
geen |
geen |
7-2-2018 |
Geen |
|
Hamberg |
Internist Oncoloog in het Franciscus Gasthuis en Vlietland |
Bestuurslid werkgroep Immunotherapie Nederland Oncologie (WIN-O |
Deelnemer adviesraden van BMS, IPSEN, Novartis, Eisai,Sanofi, Jansen Pfizer |
nee |
Lokale PI van Meerdere fase II en II studies |
nee |
nee |
9-2-2018 |
Geen |
|
Bevers |
Uroloog, LUMC Leiden |
geen |
geen |
geen |
geen |
geen |
geen |
9-3-2018 |
Geen |
|
van der Meer |
Interventieradioloog LUMC |
geen |
geen |
geen |
geen |
geen |
geen |
27-5-2018 |
Geen |
|
Klok |
Internist Vasculair geneeskundige, LUMC, Leiden |
Adjunct Professor Universiteit van Mainz, Duitsland (onbetaald) |
geen |
geen |
Dr. F.A. Klok heeft financiële steun ontvangen voor studies (unrestricted research grants) van Bayer, BMS/Pfizer, Boehringer Ingelheim, Daiichi Sankyo, MSD, Actelion, Trombose Stichting Nederland en de Hartstichting. |
geen |
geen |
28-5-2019 |
Geen |
|
van Thienen |
Internist-oncoloog NKI-AvL |
Geen |
Geen |
Geen |
Mede PI van de NeoAvAx studie in het NKI-AvL, gefinancierd door Plizer PI van de CheckMate 914 gefinancierd door BMS |
Geen |
Nascholing Novartis, MSD |
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van de Vereniging Leven met Blaas- of Nierkanker. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Vereniging Leven met Blaas- of Nierkanker en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen van de individuele modules. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Het verslag van de Invitational Conference bevindt zich in de bijlage.
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Er was financiële ruimte om 8 uitgangsvragen uit te werken met een systematische literatuursearch. Daarom moest de werkgroep een prioritering maken van de relevante klinische knelpunten. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen zoekvragen geformuleerd. Zoekvragen werden vertaald naar PICO’s (Patient, Intervention, Control, Outcome). Aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen in de bijlage.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (algehele conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een algehele conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van zorg'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.htm.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
