Keuze eerstelijns systemische therapie heldercellig niercelcarcinoom
Uitgangsvraag
Welke eerstelijns systeemtherapie heeft de voorkeur bij patiënten met gemetastaseerd heldercellig niercelcarcinoom?
Aanbeveling
Bied bij patiënten met gemetastaseerd heldercellig niercelcarcinoom met good risk kenmerken behandeling aan met sunitinib of pazopanib. In uitzonderingen kan er indicatie
zijn voor combinatie behandeling. Bied in dergelijke situaties behandeling met pembrolizumab + axitinib of nivolumab + cabozantinib of Lenvatinib + pembrolizumab aan.
Bied bij patiënten met gemetastaseerd heldercellig niercelcarcinoom met intermediair of ongunstige IMDC Risico score kenmerken behandeling met ipilimumab + nivolumab of pembrolizumab + axitinib of nivolumab + cabozantinib of Lenvatinib + pembrolizumab aan.
Overweeg cabozantinib, sunitinib of pazopanib voor patiënten met intermediair of ongunstige IMDC Risico score kenmerken die een contra-indicatie voor immuuntherapie hebben.
Overweeg met de patiënt uitstel van de start van systemische therapie voor gemetastaseerd niercelcarcinoom bij een zorgvuldig geselecteerde groep met een relatief indolent ziektebeloop. Zie hiervoor ook de module over Uitgestelde Behandeling.
Registreer de IMDC Risico score (gunstig, intermediair, ongunstig) bij iedere patiënt met gemetastaseerd niercelcarcinoom in de conclusie van het multidisciplinair overleg.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de uitgebreide systematic review en network meta-analysis van Aldin (2023) worden een aantal systemische behandelingen vergeleken. Voor de cruciale uitkomsten progressie-vrije overleving en overall survival lijken de combinaties lenvatinib + pembrolizumab, nivolumab + ipilimumab,pembrolizumab + axitinib en nivolumab + cabozantinib de meest gunstige behandelingen. Deze combinaties komen er geen van allen gunstig uit wanneer gekeken wordt naar de belangrijke uitkomst serious adverse events, en voor de uitkomst Kwaliteit van Leven zijn er onvoldoende data gerapporteerd. De bewijskracht voor de cruciale uitkomsten voor deze vier combinaties varieert van laag tot redelijk. De meeste behandelingen zijn vergeleken met sunitinib, en niet met elkaar; daardoor is er geen directe onderlinge vergelijking mogelijk. Bij bijna alle geïncludeerde trials was niet duidelijk of degenen die patiënten includeerden geblindeerd waren voor de volgorde van de randomisatie; dat kan ertoe geleid hebben dat de groepen bij baseline een verschillende prognose hadden. Daarnaast was er bij veel uitkomsten sprake van imprecisie, waarbij de betrouwbaarheidsintervallen zo breed waren dat er geen uitsluitsel werd gegeven over klinische relevantie.
Afhankelijk van de risico-groep waarin de patiënt valt, zullen de verschillende opties voor systemische therapie besproken worden, met inachtneming van de kansen op verlenging van progressievrije overleving en overall survival, alsmede de kans op mogelijke bijwerkingen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Keuzen omtrent het al dan niet starten van systemische therapie en de soort systemische therapie zullen te allen tijde door middel van shared decision making tussen patiënt, de naasten en de behandelaren gemaakt worden. Deze keuzen zullen worden ingegeven door de risicogroep waarin patiënt zich bevindt en de mogelijke voor- en nadelen betreffende levensduur en kwaliteit van leven die de behandeling met zich mee kan brengen en door wat voor patiënten belangrijk is in het leven.
Kosten (middelenbeslag)
De steeds stijgende kosten van systemische therapie voor patiënten in alle risicogroepen met gevorderd niercelcarcinoom zijn een belangrijk punt van maatschappelijke zorg voor het beschikbaar houden van alle therapeutische opties voor deze patiënten in de toekomst.
Aanvaardbaarheid, haalbaarheid en implementatie
Mits uitgevoerd in centra met de volgens de geldende afspraken in de geeigende landelijke gremia vereiste expertise en organisatie van zorg, zijn de momenteel beschikbare systemische therapieën voor patiënten met gevorderd niercelcarcinoom uitvoerbaar en van voldoende meerwaarde om deze toe te passen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Voor patiënten met gevorderd niercelcarcinoom, dienen onderstaande systemische therapieën besproken te worden, gezien de aangetoonde meerwaarde van deze behandelingen. Dit dient te geschieden met inachtneming van de risico-groep waarin patiënt zich bevindt en door middel van shared decision making, gezien de multipele opties die voorhanden zijn.
Onderbouwing
Achtergrond
In recent years, the options for systemic treatment of patients with metastatic renal cancer have rapidly expanded. Great improvements have been made with the advent of immune-therapy and the combination with targeted agents. This has raised the important question how these therapeutic modalities are optimally used to benefit patients. Sequencing of these therapies may be key to improve disease control, quality of live and survival.
Conclusies / Summary of Findings
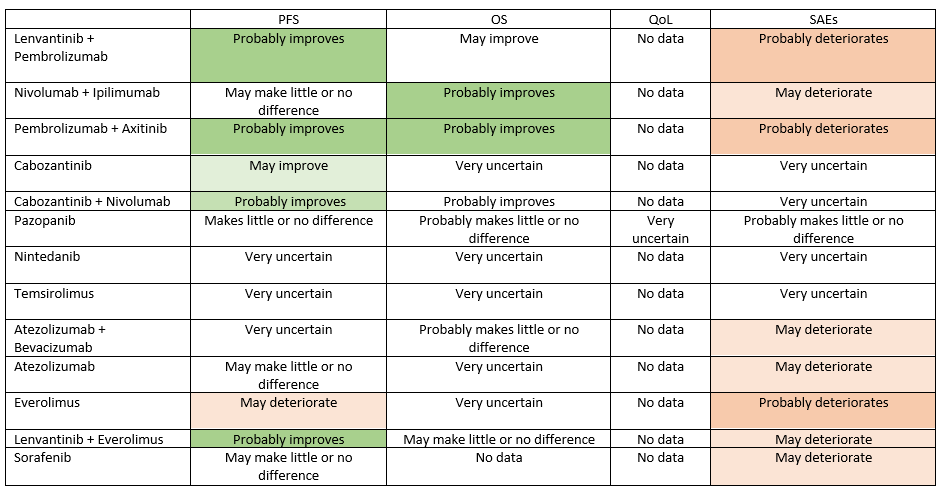
Progression-free survival – all risk groups combined
|
High GRADE |
Pazopanib makes little or no difference in progression-free survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Moderate GRADE |
Lenvantinib + pembrolizumab, pembrolizumab + axitinib, nivolumab + cabozantinib, lenvantinib + everolimus probably improve progression-free survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Low GRADE |
Nivolumab + ipilimumab, atezolizumab, sorafenib may make little or no difference in progression-free survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Low GRADE |
Cabozantinib may improve progression-free survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
Overall survival
|
Moderate GRADE |
Nivolumab + ipilimumab, pembrolizumab + axitinib, nivolumab + cabozantinib probably improve overall survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Moderate GRADE |
Pazopanib, atezolizumab + bevacizumab probably make little or no difference in overall survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Low GRADE |
Lenvantinib + pembrolizumab may improve overall survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Low GRADE |
Lenvantinib + everolimus may make little or no difference in overall survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
- GRADE |
The evidence is very uncertain about the effect of cabozantinib, nintedanib, temsirolimus, atezolizumab, everolimus on overall survival compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma since no data were reported.
Source: Aldin, 2023. |
Quality of Life
|
Very low GRADE |
The evidence is very uncertain about the effect of pazopanib on Quality of Life compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
- GRADE |
No conclusion could be drawn about the effect of lenvantinib +pembrolizumab, nivolumab + ipilimumab, pembrolizumab + axitinib, cabozantinib, nintedanib, temsirolimus, atezolizumab + bevacizumab, atezolizumab, everolimus, lenvantinib + everolimus, sorafenib on quality of life since no data were reported.
Source: Aldin, 2023. |
Adverse events
|
Moderate GRADE |
Pembrolizumab + axitinib, lenvantinib + pembrolizumab, everolimus probably result in more serious adverse events compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Moderate GRADE |
Pazopanib probably results in little or no difference in serious adverse events compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Low GRADE |
Nivolumab + ipilimumab, atezolizumab + bevacizumab, atezolizumab, lenvantinib + everolimus, sorafenib may result in more serious adverse events compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
|
Very low GRADE |
The evidence is very uncertain about the effect of cabozantinib, nintedanib, temsirolimus on adverse events compared to sunitinib in formerly untreated patients with metastatic renal cell carcinoma.
Source: Aldin, 2023. |
Summary of conclusions
Samenvatting literatuur
Description of studies
One Cochrane SR with NMA was included (Aldin, 2023), which included 36 RCTs comparing two treatments (targeted therapy or immunotherapy) among patients with previously untreated mRCC. The comprehensive search was performed in February 2022, and information was retrieved from the Clinical Study Reports as much as possible. Data extraction and assessment of Risk of Bias was performed by two reviewers independently, and the SR was reported in a clear and comprehensive way. The SR included 36 RCTs, in 16 of which sunitinib was used as comparator. In one RCT the outcomes considered critical or important by the guideline development group were not reported for all risk groups combined, but only for subgroups with intermediate or poor risk (NCT02684006, JAVELIN renal 101, Haanen, 2021).
Results
Since there were no ‘closed loops’ in the network but only pairwise comparisons with sunitinib, the results of the network meta-analysis were ignored. The data for the one-to one comparisons were copied from the forest plots of pairwise comparisons (all risk groups combined and intermediate and poor risk groups according to the International Metastatic RCC Database Consortium (IMDC))(Aldin, 2023). Results were not pooled, as the trials were considered insufficiently comparable with regards to study populations and interventions. The results for progression-free survival in all risk groups combined and in IMDC intermediate and poor risk groups are shown in Tables 1 and 2, respectively. The results for overall survival in all risk groups combined and in IMDC intermediate and poor risk groups are shown in Tables 3 and 4, respectively. Results for SAEs in all risk groups combined are shown in Table 5.
Progression-free survival - all risk groups combined
The outcome PFS was reported for all risk groups combined in 15 RCTs (Table 1), of which only one was considered to have a low risk of bias (trial number NCT00720941, COMPARZ). The effect estimator of this trial, comparing pazopanib with sunitinib (HR [95% CI] 1.05 [0.90, 1.22]) was not clinically relevant. Clinically relevant effects in favour of the intervention were reported for lenvantinib + pembrolizumab (HR [95% CI] 0.39 [0.32, 0.48]), pembrolizumab + axitinib (HR [95% CI] 0.68 [0.58, 0.80]), nivolumab + cabozantinib (HR [95% CI] 0.51 [0.41, 0.64], cabozantinib (HR [95% CI] 0.48 [0.31, 0.74](some concerns for RoB), lenvantinib + everolimus (HR [95% CI] 0.65 [0.53, 0.80]), but these trials were at high risk of bias.
Progression-free survival – IMDC intermediate and poor risk groups
The outcome PFS was reported for IMDC intermediate and poor risk groups in five RCTs (Table 2). All five trials reported clinically relevant effects in favour of the intervention, but all but one were considered to have a high risk of bias. The one trial with some concerns for RoB (trial number NCT01835158 (CABOSUN)) reported HR [95% CI] of 0.52 [0.32, 0.83] and 0.31 [0.11, 0.90] for IMDC intermediate and poor risk groups, respectively.
Overall survival – all risk groups combined
The outcome OS (Table 3) was reported for all risk groups combined in 13 RCTs. The results of the low risk of bias RCTs indicate a clinically relevant effect compared to sunitinib of nivolumab + ipilimumab (HR [95% CI] 0.69 [0.59, 0.81]) and of pembrolizumab + axitinib (HR [95% CI] 0.73 [0.60, 0.88]). The effect estimators of the other two trials with low risk of bias are not clinically relevant: pazopanib (HR [95% CI] 0.92 [0.79, 1.07]) and atezolizumab + bevacizumab (HR [95% CI] 0.91 [0.76, 1.08]). In two other trials a clinically relevant effect in favour of the intervention was reported (lenvantinib + pembrolizumab, HR [95% CI] 0.66 [0.49, 0.88], nivolumab + cabozantinib, HR [95% CI] 0.60 [0.44, 0.82]), but these trials had a high risk of bias.
Overall survival - IMDC intermediate and poor risk groups
The outcome PFS was reported for IMDC intermediate and poor risk groups in six RCTs (Table 4), of which only one was considered to have a low RoB (NCT02231749 (Checkmate 214)). The effect estimator of this trial (HR [95% CI] 0.65 [0.54, 0.78]) for IMDC intermediate-poor risk groups was clinically relevant in favour of nivolumab + ipilimumab. Clinically relevant effects in favour of the intervention were reported for avelumab + axitinib in the IMDC poor risk group (HR [95% CI] 0.60 [0.40, 0.91]), and for lenvantinib and pembrolizumab in the IMDC intermediate and poor risk groups (HR [95% CI] 0.72 [0.50, 1.04] and 0.30 [0.14, 0.64], respectively), but these trials were at high risk of bias.
Quality of Life – all risk groups combined
The only intervention for which Aldin (2023) could report the outcome quality of life was pazopanib (trial number NCT00720941, COMPARZ). The mean difference on the FACIT-F (Functional Assessment of Chronic Illness Therapy Fatigue, range 0 to 52) at the end of treatment was 9.00 (95% CI -9.86, 27.86) in favour of pazopanib. However, this information was only available for four trial participants, two in each trial arm. The trial was considered to have a high risk of bias for this outcome.
The outcome Quality of Life was not reported for the IMDC intermediate and poor risk groups separately.
|
Intervention |
RCT number (name) |
Risk of Bias* |
Progression-free survival HR [95% CI] |
Clinically relevant in favour of |
|
NCT02811861a (CLEAR) |
High (D3, 4) |
Lenvantinib + Pembrolizumab |
||
|
Nivolumab + Ipilimumab |
NCT02231749 (Checkmate 214) |
High (D4) |
0.89 [0.76, 1.05] |
- |
|
NCT02853331 (KEYNOTE-426) |
High (D5) |
0.68 [0.58, 0.80] |
Pembrolizumab + Axitinib |
|
|
Nivolumab + Cabozantinib |
NCT03141177 (CHECKMATE 9ER) |
High (D3, 5) |
0.51 [0.41, 0.64] |
Nivolumab + Cabozantinib |
|
Cabozantinib |
NCT01835158 (CABOSUN) |
Some concerns (D5) |
0.48 [0.31, 0.74] |
Cabozantinib |
|
Pazopanib |
NCT00720941 (COMPARZ) |
Low |
1.05 [0.90, 1.22] |
- |
|
Nintedanib |
NCT01024920 |
High (D4, 5) |
1.12 [0.70, 1.80] |
- |
|
Temsirolimus |
NCT00979966 |
High (D1 t/m 5) |
1.76 [0.70, 4.44] |
sunitinib |
|
Atezolizumab + Bevacizumab |
NCT01984242b (IMmotion150) |
High (D4, 5) |
1.00 [0.69, 1.45] |
- |
|
|
NCT02420821 |
High (D4) |
0.83 [0.71, 0.98] |
- |
|
Atezolizumab |
NCT01984242a |
High (D4, 5) |
1.19 [0.82, 1.72] |
- |
|
Everolimus |
NCT01108445 (ASPEN) |
High (D4, 5) |
1.41 [0.87, 2.28] |
sunitinib |
|
|
NCT00903175 (RECORD-3) |
High (D4, 5) |
1.40 [1.14, 1.71] |
sunitinib |
|
Lenvantinib + Everolimus |
NCT02811861b (CLEAR) |
High (D3, 4) |
Lenvantinib + Everolimus |
|
|
Sorafenib |
NCT00732914 (SWITCH) |
High (D4, 5) |
1.19 [0.93, 1.53] |
- |
* D1 Bias arising from the randomization process
D2 Bias due to deviations from intended intervention
D3 Bias due to missing outcome data
D4 Bias in measurement of the outcome
D5 Bias in selection of the reported result
|
Intervention |
RCT number (name) |
IMDC risk group |
Risk of Bias* |
Progression-free survival HR [95% CI] |
Clinically relevant in favour of |
|
Avelumab + Axitinib |
NCT02684006 (Javelin renal 101) |
intermediate |
High (D3, 5) |
0.71 [0.58, 0.87] |
Avelumab + Axitinib |
|
|
|
poor |
|
0.45 [0.30, 0.67] |
Avelumab + Axitinib |
|
Lenvantinib + Pembrolizumab |
NCT02811861a (CLEAR) |
intermediate |
High (D3, 4) |
0.39 [0.29, 0.52] |
Lenvantinib + Pembrolizumab |
|
Nivolumab + Ipilimumab |
NCT02231749 (Checkmate 214) |
intermediate-poor |
High (D4) |
0.74 [0.62, 0.88] |
Nivolumab + Ipilimumab |
|
Cabozantinib |
NCT01835158 (CABOSUN) |
intermediate |
Some concerns (D5) |
0.52 [0.32, 0.83] |
Cabozantinib |
|
|
|
poor |
|
0.31 [0.11, 0.90] |
Cabozantinib |
|
Lenvantinib + Everolimus |
NCT02811861b (CLEAR) |
intermediate |
High (D3, 4) |
0.67 [0.51, 0.88] |
Lenvantinib + Everolimus |
|
|
|
poor |
|
0.73 [0.42, 1.28] |
Lenvantinib + Everolimus |
* D1 Bias arising from the randomization process
D2 Bias due to deviations from intended intervention
D3 Bias due to missing outcome data
D4 Bias in measurement of the outcome
D5 Bias in selection of the reported result
Table 3. Overall survival. Results of pairwise comparisons with sunitinib (all risk groups combined)
|
Intervention |
RCT number (name) |
Risk of Bias* |
Overall survival HR [95% CI] |
Clinically relevant in favour of |
|
Lenvantinib + Pembrolizumab |
NCT02811861a (CLEAR) |
High (D3) |
0.66 [0.49, 0.88] |
Lenvantinib + Pembrolizumab |
|
Nivolumab + Ipilimumab |
NCT02231749 (Checkmate 214) |
Low |
0.69 [0.59, 0.81] |
Nivolumab + Ipilimumab |
|
Pembrolizumab + Axitinib |
NCT02853331 (KEYNOTE-426) |
Low |
0.73 [0.60, 0.88] |
Pembrolizumab + Axitinib |
|
Nivolumab + Cabozantinib |
NCT03141177 (CHECKMATE 9ER) |
High (D3, 5) |
Nivolumab + Cabozantinib |
|
|
Cabozantinib |
NCT02761057 |
Some concerns (D5) |
0.84 [0.47, 1.51] |
- |
|
Pazopanib |
NCT00720941 (COMPARZ) |
Low |
0.92 [0.79, 1.07] |
- |
|
Nintedanib |
NCT01024920 |
Some concerns (D5) |
0.92 [0.54, 1.56] |
- |
|
Temsirolimus |
NCT00979966 |
High (D1, 2, 3, 5) |
0.98 [0.31, 3.09] |
- |
|
Atezolizumab + Bevacizumab |
NCT01984242b (IMmotion150) |
Some concerns (D5) |
1.30 [0.80, 2.12] |
sunitinib |
|
|
NCT02420821 |
Low |
0.91 [0.76, 1.08] |
- |
|
Atezolizumab |
NCT01984242a |
Some concerns (D5) |
1.06 [0.65, 1.73] |
- |
|
Everolimus |
NCT01108445 (ASPEN) |
Some concerns (D5) |
1.12 [0.48, 2.60] |
- |
|
Lenvantinib + Everolimus |
NCT02811861b (CLEAR) |
High (D3) |
1.15 [0.88, 1.50] |
- |
* D1 Bias arising from the randomization process
D2 Bias due to deviations from intended intervention
D3 Bias due to missing outcome data
D4 Bias in measurement of the outcome
D5 Bias in selection of the reported result
|
Intervention |
RCT number (name) |
IMDC risk group |
Risk of Bias * |
Overall survival HR [95% CI] |
Clinically relevant in favour of |
|
Avelumab + Axitinib |
NCT02684006 (Javelin renal 101) |
intermediate |
High (D3, 5) |
0.84 [0.65, 1.08] |
- |
|
|
|
poor |
|
0.60 [0.40, 0.91] |
Avelumab + Axitinib |
|
Lenvantinib + Pembrolizumab |
NCT02811861a (CLEAR) |
intermediate |
High (D3) |
0.72 [0.50, 1.04] |
Lenvantinib + Pembrolizumab |
|
|
|
poor |
|
0.30 [0.14, 0.64] |
Lenvantinib + Pembrolizumab |
|
Nivolumab + Ipilimumab |
NCT02231749 (Checkmate 214) |
intermediate-poor |
Low |
0.65 [0.54, 0.78] |
Nivolumab + Ipilimumab |
|
Cabozantinib |
NCT01835158 (CABOSUN) |
Intermediate-poor |
High (D3, 5) |
0.80 [0.53, 1.21] |
- |
|
Lenvantinib + Everolimus |
NCT02811861b (CLEAR) |
intermediate |
High (D3) |
1.22 [0.86, 1.73] |
- |
|
|
|
poor |
|
0.90 [0.52, 1.55] |
- |
* D1 Bias arising from the randomization process
D2 Bias due to deviations from intended intervention
D3 Bias due to missing outcome data
D4 Bias in measurement of the outcome
D5 Bias in selection of the reported result
Table 5. SAEs. Results of pairwise comparisons with sunitinib (all risk groups combined)
|
Intervention |
RCT number (name) |
Risk of Bias* |
SAEs RR [95% CI] |
Clinically relevant In favour of |
|
Lenvantinib + Pembrolizumab |
NCT02811861a (CLEAR) |
High (D2, 4) |
1.52 [1.27, 1.83] |
sunitinib |
|
Nivolumab + Ipilimumab |
NCT02231749 (Checkmate 214) |
High (D2) |
1.40 [1.23, 1.59] |
sunitinib |
|
Pembrolizumab + Axitinib |
NCT02853331 (KEYNOTE-426) |
Low |
1.29 [1.07, 1.55] |
sunitinib |
|
Cabozantinib |
NCT01835158 (CABOSUN) |
High (D2, 5) |
0.92 [0.68, 1.26] |
- |
|
Pazopanib |
NCT00720941 (COMPARZ) |
Some concerns (D2) |
0.99 [0.87, 1.14] |
- |
|
Nintedanib |
NCT01024920 |
High (D2, 4, 5) |
0.91 [0.50, 1.66] |
- |
|
Temsirolimus |
NCT00979966 |
High (D1, 2, 4, 5) |
0.97 [0.48, 1.95] |
- |
|
Atezolizumab + Bevacizumab |
NCT01984242 (IMmotion151) |
Some concerns (D4, 5) |
1.73 [1.19, 2.52] |
sunitinib |
|
|
NCT02420821 |
High (D2) |
1.11 [0.95, 1.31] |
- |
|
Atezolizumab |
NCT01984242a |
Some concerns (D4, 5) |
1.28 [0.85, 1.93] |
sunitinib |
|
Everolimus |
NCT01108445 (ASPEN) |
High (D2, 4, 5) |
0.79 [0.62, 1.00] |
everolimus |
|
|
NCT00903175 (RECORD-3) |
Some concerns (D5) |
1.03 [0.88, 1.20] |
- |
|
Lenvantinib + Everolimus |
NCT02811861b (CLEAR) |
High (D2) |
1.39 [1.15, 1.68] |
sunitinib |
|
Sorafenib |
NCT00732914 (SWITCH) |
High (D4, 5) |
1.08 [0.87, 1.34] |
- |
* D1 Bias arising from the randomization process
D2 Bias due to deviations from intended intervention
D3 Bias due to missing outcome data
D4 Bias in measurement of the outcome
D5 Bias in selection of the reported result
Adverse events
The outcome serious adverse events was reported for all risk groups combined in 14 trials. In the only trial at low risk of bias for this outcome, the effect of pembrolizumab + axitinib was clinically relevant in favour of sunitinib (HR [95% CI] 1.29 [1.07, 1.55]. In only one trial a clinically relevant effect estimate was reported in favour of the intervention, everolimus (HR [95% CI] 0.79 [0.62, 1.00]), but this trial had a high risk of bias. Clinically relevant effects in favour of sunitinib were reported for lenvantinib + pembrolizumab (HR [95% CI] 1.52 [1.27, 1.83]), nivolumab +ipilimumab (HR [95% CI] 1.40 [1.23, 1.59]), lenvantinib + everolimus (HR [95% CI] 1.39 [1.15, 1.68]), in trials at high risk of bias, and for atezolizumab + bevacizumab (HR [95% CI] 1.73 [1.19, 2.52]) and atezolizumab (HR [95% CI] 1.28 [0.85, 1.93]) in trials with some concerns for risk of bias.
The outcome serious adverse events was not reported for the IMDC intermediate and poor risk groups separately.
Level of evidence of the literature
Evidence from RCTs starts at the level high GRADE.
Progression-free survival – all risk groups combined
The level of evidence for pazopanib compared to sunitinib regarding the outcome measure progression free survival was not downgraded. High GRADE.
The level of evidence for lenvantinib + pembrolizumab, pembrolizumab + axitinib, nivolumab + cabozantinib, lenvantinib + everolimus compared to sunitinib regarding the outcome measure progression free survival was downgraded by one level to a moderate GRADE because of study limitations (risk of bias).
The level of evidence for nivolumab + ipilimumab, cabozantinib, atezolizumab, everolimus, sorafenib compared to sunitinib regarding the outcome measure progression free survival was downgraded by two levels to a low GRADE, one level because of study limitations (risk of bias) and one level because the lower margin of clinical relevance was crossed by the 95% confidence interval (imprecision).
The level of evidence for nintedanib, temsirolimus, atezolizumab + bevacizumab compared to sunitinib regarding the outcome measure progression free survival was downgraded by three levels to a very low GRADE, one level because of study limitations (risk of bias) and two levels because both the lower and upper margins of clinical relevance were crossed by the 95% confidence interval (imprecision).
Overall survival – all risk groups combined
The level of evidence for nivolumab + ipilimumab, pembrolizumab + axitinib, nivolumab + cabozantinib, pazopanib, atezolizumab + bevacizumab compared to sunitinib regarding the outcome measure overall survival was downgraded by one level to a moderate GRADE because of study limitations (risk of bias).
The level of evidence for lenvantinib + pembrolizumab, lenvantinib + everolimus compared to sunitinib regarding the outcome measure overall survival was downgraded by two levels to a low GRADE, one level because of study limitations (risk of bias) and one level because one of the margins of clinical relevance was crossed by the 95% confidence interval (imprecision).
The level of evidence for cabozantinib, nintedanib, temsirolimus, atezolizumab, everolimus compared to sunitinib regarding the outcome measure overall survival was downgraded by three levels to a very low GRADE, one level because of study limitations (risk of bias) and two levels because both the lower and upper margins of clinical relevance were crossed by the 95% confidence interval (imprecision).
Quality of life – all risk groups combined
The level of evidence for pazopanib compared to sunitinib regarding the outcome measure quality of life was downgraded by three levels to a very low GRADE, one level because of study limitations (risk of bias) and two levels because the number of participants with this outcome was extremely small (n=4)(imprecision).
Adverse events – all risk groups combined
The level of evidence for pembrolizumab + axitinib compared to sunitinib regarding the outcome measure adverse events was downgraded by one level to a moderate GRADE because the upper margin of clinical relevance was crossed by the 95% confidence interval (imprecision).
The level of evidence for lenvantinib + pembrolizumab, pazopanib, everolimus compared to sunitinib regarding the outcome measure adverse events was downgraded by one level to a moderate GRADE because of study limitations (risk of bias).
The level of evidence for nivolumab + ipilimumab, atezolizumab + bevacizumab, atezolizumab, lenvantinib + everolimus, sorafenib compared to sunitinib regarding the outcome measure adverse events was downgraded by two levels to a low GRADE, one level because of study limitations (risk of bias) and one level because one of the margins of clinical relevance was crossed by the 95% confidence interval (imprecision).
The level of evidence for cabozantinib, nintedanib, temsirolimus compared to sunitinib regarding the outcome measure adverse events was downgraded by three levels to a very low GRADE, one level because of study limitations (risk of bias) and two levels because both the lower and upper margins of clinical relevance were crossed by the 95% confidence interval (imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
| P: |
Patients with metastatic clear cell renal carcinoma |
| I: |
Immunotherapy + targeted therapy |
| C: |
Other combinations of immunotherapy + targeted therapy, sunitinib |
| O: |
Progression-free survival (PFS), overall survival (OS), Quality of Life, adverse events |
Relevant outcome measures
The guideline development group considered progression-free survival and overall survival as a critical outcome measure for decision making; and Quality of Life and treatment-related adverse events as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a relative risk (RR) or hazard ratio (HR) < 0.80 or >1.25 as a minimal clinically (patient) important difference for dichotomous or survival variables, and >0.5 SD for continuous variables.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched using relevant search terms until July 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 521 hits. Studies were selected based on the following criteria Systematic reviews or randomized clinical trials comparing various combinations of immunotherapy and targeted therapy with each other or with sunitinib in patients with metastatic clear cell renal carcinoma. 38 studies were initially selected based on title and abstract screening. After reading the full text, 37 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review and network meta-analysis (NMA) was included. At the time of the search only a protocol for this SR was available, but the full SR with NMA was published in May 2023 and included in this summary in August 2023.
Results
One SR with NMA was included in the analysis of the literature. Important study characteristics and results of the included RCTs with relevant comparisons are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table. Risk of bias assessment of the individual RCTs is copied from Aldin (2023).
Referenties
- 1 - Aldin A, Besiroglu B, Adams A, Monsef I, Piechotta V, Tomlinson E, Hornbach C, Dressen N, Goldkuhle M, Maisch P, Dahm P. First‐line therapy for adults with advanced renal cell carcinoma: a systematic review and network meta‐analysis. Cochrane Database of Systematic Reviews. 2023(5).
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
P: patients with metastatic clear cell renal carcinoma
I: immunotherapy + targeted therapy
C: sunitinib
O: progression-free survival (PFS), overall survival (OS), Quality of Life, adverse events
Only RCTs of which results for the selected outcomes were reported in the SR for all risk groups combined and for intermediate and poor risk groups (according to the International Metastatic RCC Database Consortium) are reported in this table. For other information, see Aldin, 2023.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Aldin, 2023
Only RCTs of which results for the selected outcomes were reported in the SR for all risk groups combined.
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 9 February 2022
A: NCT00979966 (Bergmann, 2020) B: NCT01024920 (Eisen, 2015) C: NCT00720941 (COMPARZ) (Motzer, 2013) D: NCT00732914 (SWITCH) (Eichelberg, 2015) E: NCT00903175 (RECORD-3) (Motzer, 2014) F: NCT01108445 (ASPEN) (Armstrong, 2016) G: NCT01835158 (CABOSUN) (Choueiri, 2018) H: NCT01984242a (IMmotion150) (McDermott, 2018) I: NCT01984242b (IMmotion150) (McDermott, 2018) J: NCT02231749 (Checkmate 214) (Albiges, 2020) K: NCT02420821 (IMmotion 151) (Rini, 2021) L: NCT02761057 (SWOG 1500) (Pal, 2021) M: NCT02811861a (CLEAR) (Motzer, 2021) N: NCT02811861b (CLEAR) (Motzer, 2021) O: NCT02853331 (KEYNOTE-426) (Rini, 2021) P: NCT03141177 (CHECKMATE 9ER) (Choueiri, 2021) Q: NCT02684006 JAVELIN renal 101 (Haanen, 2021) Study design: RCT parallel (for cross-over studies, only the first period was extracted by the reviewers)
Setting and Country: A: 1 country (Germany), clinics, university hospitals (14 study locations) B: 5 countries (Hungary, Poland, Romania, Ukraine, UK), cancer centres, hospitals, university hospitals, research centres (15 study locations) C: 14 countries (Australia, Canada, China, Germany, Ireland, Italy, Japan, Republic of Korea, the Netherlands, Spain, Sweden, Taiwan, UK, USA), types of centres: not reported (227 study locations) D: 1 country (Germany), 1 urology clinic E: 19 countries (Argentina, Australia, Brazil, Canada, Denmark, France, Germany, Hong Kong, Italy, Republic of Korea, Mexico, the Netherlands, Peru, Spain, Taiwan, Thailand, Turkey, UK, USA), types of centres: cancer centres/institutes, hospitals, (84 study locations) F: 3 countries (Canada, UK, USA), types of centres: medical centres/agencies, clinics, hospitals, (18 study locations) G: 1 country (USA), types of centres: cancer centres/clinics, medical centres, hospitals (488 study locations) H, I: 9 countries (Czech Republic, France, Germany, Italy, Poland, Romania, Spain, UK, USA), types of centres: cancer centres, medical centres, hospitals, research institutions (45 study locations) J: 28 countries (Argentina, Australia, Austria, Belgium, Brazil, Canada, Chile, Colombia, Czech Republic, Denmark, Finland, France, Germany, Hungary, Ireland, Israel, Italy, Japan, Republic of Korea, Mexico, the Netherlands, Poland, Spain, Sweden, Taiwan, Turkey, UK USA), types of centres: not reported (190 study locations) K: 21 countries (Australia, Bosnia and Herzegovina, Brazil, Canada, Czech Republic, Denmark, France, Germany, Italy, Japan, Republic of Korea, Mexico, Poland, Russian Federation, Singapore, Spain, Taiwan, Thailand, Turkey, UK USA), types of centres: cancer centres/institutes, medical centres, hospitals, university hospitals (154 study locations) L: 2 countries (Canada, U.S.A.), cancer centres, medical centres, hospitals, (597 study locations) M, N: 20 countries (Australia, Austria, Belgium, Canada, Czech Republic, France, Germany, Greece, Ireland, Israel, Italy, Japan, Republic of Korea, the Netherlands, Poland, Russian Federation, Spain, Switzerland, UK USA), types of centres: hospitals, university hospitals, medical centres, cancer centres (183 study locations) O: 16 countries (not reported), types of centres: hospitals, cancer centres (129 study locations) P: 18 countries, (Argentina, Australia, Brazil, Chile, Czech Republic, Germany, Greece, Israel, Italy, Japan, Mexico, Poland, Romania, Russia, Spain, Turkey, UK, USA) Q: 21 countries (Australia, Austria, Belgium, Canada, Denmark, France, Germany, Hungary, Israel, Italy, Japan, Republic of Korea, Mexico, the Netherlands, New Zealand, Romania, Russian Federation, Spain, Sweden, UK, USA), types of centres: hospitals, university hospitals, medical centres, centres/ institutes (280 study locations)
Source of funding and conflicts of interest: A: Pfizer, Germany B: Quote: "Pfizer, Bayer and AstraZeneca, and travel funding for a conference from Novartis. MM and YS have received research funding from Boehringer Ingelheim. RJJ has received research funding from Bristol-Myers Squibb, Boehringer Ingelheim, GlaxoSmithKline, Novartis, Pfizer and Roche. Funding for this study was provided by Boehringer Ingelheim." C: GlaxoSmithKline Pharmaceuticals and Novartis Pharmaceuticals D: Bayer, Pfizer, and Novartis E: Novartis, Pfizer, GlaxoSmithKline, Amgen, Bayer AG/Onyx Pharmaceuticals, Genentech, ZymoGenetics F: Novartis and Pfizer G: Funder: National Cancer Institute (part of the National Institutes of Health); extensive declarations of interests H, I: “Prometheus Laboratories. M.B.A., Roche/Genentech, Novartis, Pfizer, Eisai, and Exelixis, F. Hoffmann-La Roche, AG (...)” “consulting/advisory role for Bristol-Myers Squibb, Merck, Roche/ Genentech, Pfizer, Exelixis, Novartis, Eisai, X4 Pharmaceuticals, and Array BioPharma” J: Bristol-Myers Squibb and ONO Pharmaceutical and grants and personal fees from Pfizer, Novartis, Eisai, Exelixis, and Genentech/Roche K: Hoffmann–La Roche Ltd and Genentech Inc. L: National Institutes of Health and National Cancer Institute M, N: Eisai and Merck Sharp and Dohme O: Merck Sharp & Dohme P: Bristol-Myers Squibb and others Q: Pfizer and Merck |
Inclusion criteria SR: RCTs, patients with metastatic RCC without previous systemic therapy, intervention targeted therapy, immunotherapy, interferon, interleukin, placebo, or any combinations
Exclusion criteria SR: adjuvant setting, comparison between interleukin and interferon only
36 studies included in the SR; in 16 sunitinib was used as comparator
Important patient characteristics at baseline:
N, mean age (range) or mean (SD)(yrs) A: 22 patients, I: 57.4 (29-85), C: 64.8 (46-80) B: 96 patients, I: 62 (42-86), C: 58 (29-79) C: 1110 patients, Group 1: 60.9 (10.89), Group 2: 61.2 (10.98) D: 365 patients, I: median (range) 63 (39-84) yrs, C: (median, range) 65 (40-83) yrs E: 471 patients, I: median (range) 62 (20-89) yrs, C: median (range) 62 (29-84) yrs F: 108 patients, I: median (range) 64 (29-90) yrs, C: median (range) 59 (24-100) yrs G: 157 patients, I: median (range 63 (56-69) yrs, C: median (range) 64 (57-71) yrs H: 204 patients, I: median (range) 61 (27-81) yrs, C: median (range) 61 (25-85) yrs I: 202 patients, I: median (range) 62 (32-88) yrs, C: median (range) 61 (25-85) yrs J: 1096 patients, median (range) age I: 62 (26-85) yrs, C: 62 (21-85) yrs K: 915 patients, median (range) age I: 62 (56-69) yrs, C: 60 (54-66) yrs L: 147 patients in 4 arms, median (range) age 66 (58-75) yrs (all participants), 90 patients (I: 44, C: 46) for interventions reported in this table M: 692 patients, median (range) age I: 64 (34-88) yrs, C: 61 (29-82) yrs N: 695 patients, median (range) age I: 62 (32-86) yrs, C: 61 (29-82) yrs O: 861 patients, median (range) age I: 62 (55-68) yrs, C: 61 (53-68) yrs P: 651 patients, median (range) age I: 62 (29-90) yrs, C: 61 (28-86) yrs Q: 886 patients, median (range) age I: 62 (29-83) yrs, C: 61 (27-88) yrs
Sex (% male): A: 73 B: 85 C: 73 D: 75 E: 73 F: 75 G: 78 H: 76 I: 76 J: 74 K: 73 L: 24(?) M: 77 N: 78 O: 73 P: 74 Q: 74
Groups comparable at baseline? Probably yes, randomized. |
A: temsirolimus (25 mg, IV, once a week) B: nintedanib (200 mg, oral, twice/day) C: pazopanib (800 mg, oral, once/day) D: sorafenib (400 mg, oral, twice/day) E: everolimus (10 mg, oral, once/day) F: everolimus (10 mg, oral, once/day) G: cabozantinib (60 mg, oral, once/day) H: atezolizumab (1200 mg, intravenous, every three weeks) I: atezolizumab (1200 mg, intravenous, every three weeks) + bevacizumab (15 mg/kg, intravenous, every three weeks) J: nivolumab (3 mg/kg, intravenous) + ipilimumab (1 mg/kg, intravenous), every 3 weeks for four doses (induction phase) followed by nivolumab montherapy (maintenance therapy) K: atezolizumab (1200 mg, intravenous) + bevacizumab (15 mg/kg, intravenous), once every 3 weeks L: cabozantinib (60 mg, oral, once/day) M: lenvatinib (20 mg, oral, once/day), pembrolizumab (200mg, intravenous, every 3 weeks) N: lenvatinib (18 mg, oral, once/day) + everolimus (5mg, oral, once/day) O: pembrolizumab (200 mg, intravenous, every 3 weeks for up to 35 cycles) + sxitinib (5 mg, oral, twice/day) P: nivolumab (240 mg, intravenous, every 2 weeks) + cabozantinib (40 mg, oral, once/day) Q: avelumab (10 mg/kg, intravenous, every 2 weeks) + axitinib ( mg, oral, twice/day)
|
A: sunitinib (50 mg, oral, once/day) B: sunitinib (50 mg, oral, once/day) C: sunitinib (50 mg, oral, once/day) D: sunitinib (50 mg, oral, once/day) E: sunitinib (50 mg, oral, once/day) F: sunitinib (50 mg, oral, once/day) G: sunitinib (50 mg, oral, once/day) H: sunitinib (50 mg, oral, once/day) I: sunitinib (50 mg, oral, once/day) J: sunitinib (50 mg, oral, once/day) K: sunitinib (50 mg, oral, once/day) L: sunitinib (50 mg, oral, once/day) M: sunitinib (50 mg, oral, once/day) N: sunitinib (50 mg, oral, once/day) O: sunitinib (50 mg, oral, once/day) P: sunitinib (50 mg, oral, once/day) Q: sunitinib (50 mg, oral, once/day) |
End-point of follow-up:
A: 12 months B: 36 months C: 67 months D: 48 months E: 56 months F: 24 months G: 60 months H: 33 months I: 33 months J: 31 months K: 27 months L: not reported M: 67 months N: 67 months O: 22 months P: 23 months Q: 40 months
|
Outcome measure-1 Defined as Overall survival
Effect measure: HR [95% CI] A: 0.98 [0.31, 3.09] B: 0.92 [0.54, 1.56] C: 0.92 [0.79, 1.07] F: 1.12 [0.48, 2.60] H: 1.06 [0.65, 1.73] I: 1.30 [0.80, 2.12] J: 0.69 [0.59, 0.81] K: 0.91 [0.76, 1.08] L: 0.84 [0.47, 1.51] M: 0.66 [0.49, 0.88] N: 1.15 [0.88, 1.50] O: 0.73 [0.60, 0.88] P: Q: Intermediate IMDC risk group 0.84 [0.65, 1.08]; poor IMDC risk group 0.60 [0.40, 0.91]
No statistical pooling
Outcome measure-2 Defined as Quality of Life Effect measure: mean difference [95%CI] C: FACIT-F 9.00 [-9.86; 27.86] in favour of pazopanib (n=4)
Outcome measure-3 Defined as Serious Adverse Events (SAEs) Effect measure: RR [95% CI] A: 0.97 [0.48, 1.95] B: 0.91 [0.50, 1.66] C: 0.99 [0.87, 1.14] D: 1.08 [0.87, 1.34] E: 1.03 [0.88, 1.20] F: 0.79 [0.62, 1.00] G: 0.92 [0.68, 1.26] H: 1.28 [0.85, 1.93] I: 1.73 [1.19, 2.52] J: 1.40 [1.23, 1.59] K: 1.11 [0.95, 1.31 M: 1.52 [1.27, 1.83] N: 1.39 [1.15, 1.68] O: 1.29 [1.07, 1.55]
No statistical pooling
Outcome measure-4 Defined as Progression-Free Survival (PFS) Effect measure: HR [95% CI] A: 1.76 [0.70, 4.44] B: 1.12 [0.70, 1.80] C: 1.05 [0.90, 1.22] D: 1.19 [0.93, 1.53] E: 1.40 [1.14, 1.71] F: 1.41 [0.87, 2.28] G: 0.48 [0.31, 0.74] H: 1.19 [0.82, 1.72] I: 1.00 [0.69, 1.45] J: 0.89 [0.76, 1.05] K: 0.83 [0.71, 0.98] L: 0.61 [0.37, 0.99] M: 0.39 [0.32, 0.48] N: 0.65 [0.53, 0.80] O: 0.68 [0.58, 0.80] P: 0.51 [0.41, 0.64] Q: Intermediate IMDC risk group 0.71 [0.58, 0.87]; poor IMDC risk group 0.45 [0.30, 0.67]
No statistical pooling
|
Risk of bias (high, some concerns or low): Tool used by authors: RoB 2.0 tool
A: High B: Some concerns C: Low D: High E: High F: Some concerns G: Some concerns H: Some concerns I: Some concerns J: Low K: Low L: Some concerns M: High N: High O: Low P: High Q: High
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Albiges, 2020 |
Included in Aldin 2023 |
|
Alam, 2020 |
Less comprehensive than Aldin 2023, some studies not over ccRCC |
|
Atkins, 2021 |
No RCT, no comparison with sunitinib |
|
Bedke, 2021 |
Guideline, not a study |
|
Bedke, 2021 |
Guideline, not a study |
|
Buti, 2020 |
Less methodological quality than Aldin 2023 |
|
Cao, 2020 |
Less comprehensive than Aldin 2023 |
|
Cella, 2019 |
Included in Aldin 2023 |
|
Choueiri, 2020 |
Included in Aldin 2023 |
|
Choueiri, 2021 |
Included in Aldin 2023 |
|
Elaidi, 2020 |
Less comprehensive than Aldin 2023 |
|
George, 2019 |
Included in Aldin 2023 |
|
Hahn, 2019 |
Less comprehensive than Aldin 2023 |
|
Heo, 2021 |
Wrong population, Less comprehensive than Aldin 2023 |
|
Hofmann, 2020 |
Wrong Intervention; VEGF-targeted therapies |
|
Karner, 2019 |
Wrong population; VEGF-targeted treatment |
|
Liu, 2021 |
Less comprehensive than Aldin 2023 |
|
Manz, 2020 |
Wrong comparison, Less comprehensive than Aldin 2023 |
|
McFarlane, 2020 |
Wrong Population, no comparison with sunitinib |
|
Monteiro, 2020 |
Less comprehensive than Aldin 2023 |
|
Mori, 2021 |
Less comprehensive than Aldin 2023 |
|
Motzer, 2019 |
Included in Aldin 2023 |
|
Motzer, 2020 |
No comparison with sunitinib |
|
Motzer, 2020 |
Included in Aldin 2023 |
|
Motzer, 2021 |
Included in Aldin 2023 |
|
Motzer,2020 |
Included in Aldin 2023 |
|
Powles, 2020 |
Included in Aldin 2023 |
|
Quhal, 2021 |
Less comprehensive than Aldin 2023 |
|
Quhal, 2021 |
Less comprehensive than Aldin2023; wrong outcome |
|
Riaz, 2021 |
Less comprehensive than Aldin 2023 |
|
Rini, 2019 |
Included in Aldin 2023 |
|
Su, 2020 |
Less comprehensive than Aldin 2023 |
|
Sun, 2019 |
Wrong PICO; new alternative dosing schedule (2 weeks on/1 week off) of sunitinib with the traditional 4/2 schedule |
|
Tomita, 2020 |
Wrong Intervention and Comparison; sunitinib followed by sorafenib and vice versa |
|
Tremblay, 2019 |
Wrong comparison (everolimus) |
|
Wang, 2019 |
Less comprehensive than Aldin 2023 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-09-2025
Beoordeeld op geldigheid : 13-05-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met nierkanker en een vertegenwoordiger namens de patiëntenvereniging.
Werkgroep
- Dr. A. (Axel) Bex, uroloog, Antoni van Leeuwenhoek, Amsterdam, NVU (voorzitter)
- Dr. R.F.M. (Rob) Bevers, uroloog, Leids Universitair Medisch Centrum, Leiden, NVU
- Dr. J.F. (Hans) Langenhuijsen, uroloog, Radoudumc, Nijmegen, NVU
- Dr. A.P. (Paul) Hamberg, internist-oncoloog, Franciscus Gasthuis en Vlietland Ziekenhuis, Rotterdam, NIV/NVMO
- Dr. J.V. (Hans) van Thienen, internist-oncoloog, Antoni van Leeuwenhoek, Amsterdam, NIV/NVMO
- J. (Jolanda) Bloos-van der Hulst, verpleegkundig specialist, Antoni van Leeuwenhoek, Amsterdam, V&VN
- Dr. A.M.E. (Anna) Bruynzeel, radiotherapeut-oncoloog, Amsterdam Medisch Centrum, NVRO
- Dr. L. (Linda) Kerkmeijer, radiotherapeut-oncoloog, Radboudumc, Nijmegen, NVRO
- Drs. E. (Else) Wolak, belangenbehartiger Kwaliteit van zorg, Patiëntenvereniging Blaas- of Nierkanker
- Dr. M.A.J. (Mark) Meier, interventieradioloog, Isala Ziekenhuis, Zwolle, NVvR / NVIR
Met ondersteuning van
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.H.D. (Majke) van Bommel, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Mohammadreza) Abdollahi, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J.H. (Hanneke) van der Lee, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. I.M. (Irina) Mostovaya, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Linda Niesink, medisch informatie specialist, Kennisinstituut van de Federatie Medisch Specialisten
- Esther van der Bijl, medisch informatie specialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bex (voorzitter) |
Uroloog AVL Amsterdam. Afdelingshoofd in het Specialist Centre of Kidney Cancer, Royal Free London NHS Foundation Trust, Professor of Urology, UCL Division of Surgery and Investigational Science. |
Alle nevenfuncties zijn onbetaald: |
- Restricted educational grant van Pfizer tbv een neoadjuvante studie (sponsor is het NKI-AvL). - Steering committee op twee internationale adjuvante fase 3 studies van BMS en Roche. - Lid van medical steering committee van twee patientenorganisaties (Kidney Cancer Association en IKCC). - Financier BMS: randomised phase 3 trial of adjuvant nivolumab plus ipilimumab versus placebo in high risk RCC. - Financier Roche: randomised phase 3 trial of adjuvant atezolizumab versus placebo in high risk RCC. - Financier Pfizer: single-arm phase 2 trial of neoadjuvant avelumab plus axitinib in high risk RCC (funded by restricted educational grant) |
Geen restricties |
|
Bevers |
Uroloog LUMC Leiden |
Geen |
Geen |
Geen restricties |
|
Langenhuijsen |
Uroloog Radboudumc Nijmegen |
Invited speaker Update Urology (Astra Zeneca), vergoeding+reiskosten |
Financier: ZonMW Voorbereidende studie Doelmatigheidsonderzoek, Pentixafor PET vs veneuze sampling bij primair hyperaldosteronisme - Financier: PentixaPharm GmbH, CASTUS trial. |
Geen restricties |
|
Hamberg |
Oncoloog Franciscus Gasthuis en Vlietland Rotterdam |
voorzitter WIN-O nier (onbetaald) bestuurslid Pro RCC (onbetaald) |
- Adviesraden meerdere farmaceutische bedrijven actief binnen RCC zorg - lokale hoofonderzoeker van aantal adjuvante nierkanker studies (Farma sponsored). Tevens ook van studies (farma sponsored) naar medicamenteuze interventies bij gemetastaseerde ziekte (oa RCC) |
Geen restricties |
|
Van Thienen |
Internist-oncoloog NKI-AvL Amsterdam |
Alle nevenfuncties zjn onbetaald: - Inhoudelijk/vice voorzitter Medisch Inhoudelijke Standpunten (MIS) groep van DRCG - Lid wetenschappelijke adviesraad Stichting PRO-RCC |
Pfizer Neoadjuvant axitinib en avelumab bij niercelcarcinoom (projectleider); BMS Checkmate 914 Adjuvant immunotherapy in high-risk renal cancer (onderzoeker); Eisai CLEAR study: levantinib and everolimus or pembrolizumab vs sunitinib in mRCC (onderzoeker); Goethe University Frankfurt am Main Sunniforecast (nivolumab+ipilimumab vs sunitinib in non-clear cell mRCC)(onderzoeker); Roche Adjuvant atezolizumab in high risk renal cancer (onderzoeker) |
Geen restricties |
|
Bloos-van der Hulst |
Verpleegkundig specialist uro-oncologie AVL Amsterdam |
Geen |
Geen |
Geen restricties |
|
Kerkmeijer |
Radiotherapeut-oncoloog, Radboudumc Nijmegen. Plaatsvervangend keteneigenaar Urologische Oncologie Radboudumc Nijmegen |
Alle nevenfuncties zjn onbetaald: - DUOS bestuurslid - Raad van Advies Tie Ribbon - Associate Editor Frontiers in oncology - Radiotherapeut-oncoloog UMC Utrecht (gastaanstelling) |
KWF subsidie FLAME studie prostaatcarcinoom |
Geen restricties |
|
Wolak |
Belangenbehartiger kwaliteit van zorg Patiëntenvereniging blaas- of nierkanker (PBNK) |
Patiëntenvereniging blaas- of nierkanker |
Werkzaam bij patiëntenorganisatie Leven met blaas- of nierkanker, geen boegbeeldfunctie |
Geen restricties |
|
Meier |
Interventieradioloog Isala Zwolle Voorzitter RVE Medische Beeldvorming, Isala Zwolle |
|
Geen |
Geen restricties |
|
Bruynzeel |
Radiotherapeut-oncoloog, Amsterdam UMC |
Geen |
ViewRay Inc: Een onderzoek naar hoge en precieze bestraling (stereotactische ablatieve radiotherapie) bij patiënt |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenvereniging blaas- of nierkanker (PBNK) voor de schriftelijke knelpunteninventarisatie en afvaardiging namens PBNK in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenvereniging blaas- of nierkanker (PBNK) en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Systemische therapie |
geen financiële gevolgen |
Uitkomst 1 |
De kwalitatieve raming volgt na de commentaarfase.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met nierkanker. Tevens zijn er knelpunten aangedragen door de NVU (Nederlandse Vereniging voor Urologie) en NVRO, NVVR en Patiëntenvereniging blaas- of nierkanker (PBNK) via een schriftelijke knelpuntenanalyse.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Herziening Niercelcarcinoom |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van targeted therapy vergeleken met een combinatie van immuuntherapie en targeted therapy bij patiënten met gemetastaseerd niercelcarcinoom? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 12-07-2021 |
|
Periode: >2019 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting:
→ Voor deze vraag is gezocht op de elementen gemetastaseerd (in het groen) niercelcarcinoom (in het blauw), en immuuntherapie óf targeted therapy (in het oranje). → de genoemde sleutelartikelen van Choueiri (2021) en Motzer (2021) worden gevonden met de zoekstrategie. → resultaten staan in Rayyan. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 12-07-2021 met relevante zoektermen gezocht naar systematische reviews en RCT’s over immuuntherapie en targeted therapy bij patiënten met gemetastaseerd niercelcarcinoom. De literatuurzoekactie leverde 521 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
125 |
89 |
135 |
|
RCTs |
259 |
276 |
386 |
|
Totaal |
384 |
365 |
521 |
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Carcinoma, Renal Cell/ or (('kidney cell*' or 'renal cell*' or nephroid or hypernephroid or 'collecting duct') adj3 (cancer* or carcinoma* or adenocarcinoma* or neoplasm* or tumor* or tumour* or mass*)).ti,kw. or (grawitz* adj3 (tumor* or tumour*)).ti,ab,kw. or hypernephroma*.ti,ab,kw. or (RCC or MRCC).ti,kw. (42401) 2 exp *Neoplasm Metastasis/ or (advanced or metastat*).ti,ab,kw. (701807) 3 exp Molecular Targeted Therapy/ or (targeted adj3 therap*).ti,ab,kw. or exp Nivolumab/ or exp Axitinib/ or exp Ipilimumab/ or nivolumab.ti,ab,kw. or lenvatinib.ti,ab,kw. or tivozanib.ti,ab,kw. or axitinib.ti,ab,kw. or exp *IMMUNOTHERAPY/ or (immune therap* or immunotherap* or immune checkpoint or cabozantinib or ipilimumab or pembrolizumab or tivozanib or avelumab).ti,ab,kw. (311736) 4 1 and 2 and 3 (4294) 5 limit 4 to ((english or dutch) and yr="2019 -Current") (1049) 6 5 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (998) 7 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) (490203) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2105819) 9 6 and 7 (89) – SRs 10 (6 and 8) not 9 (276) - RCTs 11 9 or 10 (365) |