Behandeling neurologische complicaties DM1
Uitgangsvraag
Hoe worden neurologische verschijnselen behandeld?
De uitgangsvraag omvat de volgende deelvragen:
1. Wat is de optimale medicamenteuze therapie om myotonie te behandelen?
2. Wat zijn de optimale psychostimulantia om hypersomnie (slaperigheid overdag) te behandelen?
3. Is creatine effectief bij DM1 patiënten met spierzwakte?
4. Is oefentherapie effectief bij DM1 patiënten met spierzwakte?
5. Is cognitieve gedragstherapie effectief bij DM1 patiënten?
Aanbeveling
Communicatie
Verwijs laagdrempelig naar psycholoog of maatschappelijk werker met ervaring in DM1, indien partner of patiënt onderlinge communicatie als problematisch ervaart.
Myotonie
Behandel myotonie alleen medicamenteus bij ernstige klachten.
Slaperigheid overdag
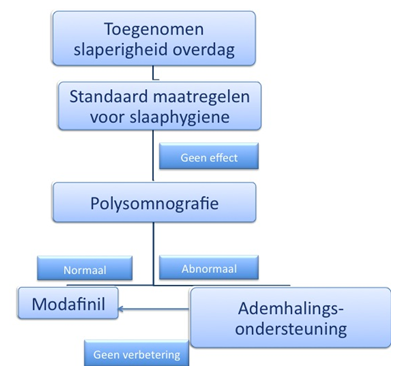
Behandel eventuele oorzaken van nachtelijke hypoventilatie (nachtelijke beademing, zie hoofdstuk 6). Adviseer bij slaperigheid overdag korte (<30 minuten) hazenslaapjes. Als dit niet voldoende is en indien er geen indicatie is voor nachtelijke ademhalingsondersteuning, behandel dan met modiodal (niet later dan 13.00 uur innemen in verband met slapeloosheid) (figuur 1).
Spierzwakte
Verwijs patiënt naar een revalidatiearts bij spierzwakte die interfereert met dagelijks leven (vallen) en voor orthesen en/of bewegingsadvies.
Vermoeidheid
Overweeg cognitieve gedragstherapie, indien u vermoeidheid hebt kunnen afgrenzen van stemmingsstoornissen, verminderd initiatief en respiratoire problemen.
Overwegingen
De communicatie tussen patiënt en partner, patiënt en werkgever en tussen patiënt en hulpverlener wordt door veel DM1 patiënten en hun omgeving als problematisch ervaren. Vooral de partner van de patiënt kan lijden onder de gebrekkige communicatie. In dat geval is het zinvol om als advies patiënt en partner te verwijzen naar psycholoog of maatschappelijk werker met ervaring in DM1.
Myotonie is zelden een klacht waarvoor de DM1 patiënt behandeling wenst, daarnaast hebben de anti-myotonie medicijnen bijwerkingen en is het meest bekende anti-myotonie medicijn (mexiletine) in Nederland moeilijk te verkrijgen. Behandel myotonie medicamenteus alleen bij ernstige klachten.
Slaperigheid overdag is bij DM1 patiënten een frequent probleem met vele mogelijke onderliggende oorzaken van nachtelijke hypoventilatie tot slaapapneu syndroom.
Indien nachtelijke oorzaken voor slaperigheid overdag zijn uitgesloten, kunnen korte periodes van (<30 minuten) slaap geadviseerd worden. Als dit niet werkt, kan men behandeling met modiodal (niet later dan 13.00 uur innemen in verband met slapeloosheid) overwegen (zie figuur 1 voor algoritme).
Spierzwakte is een van de meest in het oogspringende verschijnselen van DM1. Spierzwakte kan niet direct (door oefening of medicatie) verbeterd worden. Wel kunnen de gevolgen van spierzwakte door revalidatiebehandeling worden verminderd door training, orthesen, huisaanpassingen en hulpmiddelen. Aerobe conditietraining kan een gunstig effect hebben op deconditionering en algemeen welbevinden.
Vermoeidheid is een frequent en relevant probleem bij mensen met DM1. Indien er geen andere oorzaken (cardiale oorzaken, schildklierproblemen, laag Hb of andere somatische oorzaken) zijn, kan behandeling door middel van cognitieve gedragstherapie worden overwogen, zoals dat bewezen effectief is bij patiënten met het chronisch vermoeidheidssyndroom en bij patiënten met vermoeidheid na kanker.
Figuur 1. Algoritme voor diasgnostiek en behandeling bij toegenomen slaperigheid overdag.
Onderbouwing
Conclusies / Summary of Findings
Wat is de optimale medicamenteuze therapie om myotonie te behandelen?
|
Zeer lage bewijslast (GRADE) |
Imipramine vermindert de klachten van myotonie.
Bronnen (Trip et al., 2006 (Gascon et al., 1989)) |
|
Zeer lage bewijslast (GRADE) |
Imipramine en taurine verkorten de relaxatietijd.
Bronnen (Trip et al., 2006 (Gascon et al.,; Antonini et al., 1990)) |
|
Zeer lage bewijslast (GRADE) |
Taurine heeft een gunstig effect op de EMG relaxatie tijd’.
Bronnen (Trip et al., 2006 (Durelli et al., 1983)) |
|
Lage bewijslast (GRADE) |
Mexiletine 150 of 200mg driemaal daags verbetert de relaxatietijd.
Behandeling met Mexiletine 150 of 200mg driemaal daags leidt niet tot (ernstige) bijwerkingen.
Bronnen (Logigian et al., 2010) |
Wat zijn de optimale psychostimulantia om hypersomnie (slaperigheid overdag) te behandelen?
|
Zeer lage bewijslast (GRADE) |
Modafinil verbetert de MWT op korte termijn (4 weken)
Bronnen (Annane et al., 2011) (Orlikowski et al., 2009; Talbot et al., 2003)) |
|
Lage bewijslast (GRADE) |
Modafinil verbetert de ESS op korte termijn (4 weken)
Bronnen (Annane et al., 2011) (Orlikowski et al., 2009; Talbot et al., 2003; MacDonald et al., 2002; Wintzen et al., 2007)) |
Is creatine effectief bij DM1 patiënten met spierzwakte?
|
Zeer lage bewijslast (GRADE) |
Creatine verbetert de MVC op korte termijn.
Bronnen (Kley et al., 2011) (Tarnopolsky et al., 2004; Walter et al., 2002)) |
|
Lage bewijslast (GRADE) |
Creatine verbetert de dagelijkse activiteiten op korte termijn.
Bronnen (Kley et al., 2011) (Walter et al., 2002) |
Is oefentherapie effectief bij DM1 patiënten met spierzwakte?
|
Lage bewijslast (GRADE) |
Spierversterkende oefeningen hebben geen effect op kracht.
Bronnen (Voet et al., 2010) (Lindeman et al., 1995)) |
|
Lage bewijslast (GRADE) |
Groepsinspanningstraining van een uur, tweemaal per week, geeft geen verbetering in de zes minuten looptest.
Bronnen (Kierkegaard et al., 2011) |
Samenvatting literatuur
Vier systematische reviews (Trip et al., 2006, Annane et al., 2006; Kley et al., 2011; Voet et al., 2010) zijn opgenomen in de literatuuranalyse. Uit deze reviews zijn alleen die gegevens in de richtlijn opgenomen die betrekking hebben op de uitgangsvraag. Tevens zijn twee RCT’s opgenomen in de richtlijn die na de searchdatum van de reviews van Trip, Annane en Kley gepubliceerd werden (Logigian et al., 2010; Kierkegaard et al., 2011).
Wat is de optimale medicamenteuze therapie om myotonie te behandelen?
Een Cochrane review (Trip) van tien gerandomiseerde cross-over onderzoeken (N = 143 deelnemers), onderzocht de gunstige en ongunstige effecten van medicamenteuze behandeling van myotonie bij DM1 patiënten. Bij zeven onderzoeken was echter het risico op bias te groot of de rapportage van gegevens onvoldoende, zodat de auteurs slechts op basis van drie onderzoeken (Antonini et al., 1990; Gascon et al., 1989; Durelli et al., 1983) conclusies konden trekken. Deze drie RCT’s vergeleken clomipramine 75 mg/dag (Antonini) / taurine 100-150mg/dag / (Durelli) / imipramine 50-375 mg/dag (Gascon) versus een placebo bij DM1 patiënten. De duur van één behandelperiode was 33 dagen met een totale duur van 166 dagen (Antonini), zes maanden met een totale duur van één jaar (Durelli) of zes weken met een totale duur van 12 weken (Gascon). Twee studies onderzochten de uitkomstmaat verbetering van klachten en vonden een significant voordeel voor imipramine (Gascon) en geen effect voor clomipramine (Antonini). Dezelfde studies onderzochten ook de uitkomstmaat relaxatietijd en vonden een significant voordeel voor zowel imipramine als clomipramine. Durelli vond een significant voordeel van taurine op de ‘EMG relaxation time’ ten opzichte van placebo.
Nieuwe studie
In twee RCT’s van 20 ambulante volwassenen met DM1 vergeleek Logigian 150mg / 200mg mexiletine driemaal daags met een placebo op het verschil in tijd tot relaxatie na isometrische knijpkracht en het voorkomen van ongewenste effecten. De RCT laat een significant verschil zien in het voordeel van mexiletine. De RCT laat geen verschil zien in het voorkomen van ongewenste effecten.
De evidencetabellen van de studies van Antonini, Gascon en Durelli zijn te vinden in de review van Trip. De studie van Logigian is opgenomen in de evidencetabel (zie bijlage van dit hoofdstuk), omdat deze studie na de searchdatum van de review-update van Trip gepubliceerd is.
Bewijskracht van de literatuur
a) voor de vergelijkingen in de review van Trip:
De bewijskracht voor alle uitkomstmaten is zeer laag, omdat:
in alle drie studies het aantal patiënten gering is (bias ten gevolge van imprecisie);
de drie studies ernstige beperkingen in de studieopzet vertoonden (geen intention to treat analyse (drie studies), blindering en randomisatie onduidelijk (drie studies) en carry-over effect (twee studies));
extrapoleerbaarheid naar de Nederlandse situatie matig is.
Momenteel is mexiletine slecht verkrijgbaar in Nederland en wordt het alleen verkregen via de internationale apotheek. Recent is er periode geweest dat het niet leverbaar was.
b) voor de vergelijking mexiletine versus placebo:
de bewijskracht voor alle uitkomstmaten is laag, vanwege:
het geringe aantal studiedeelnemers (bias ten gevolge van imprecisie).
Wat zijn de optimale psychostimulantia om hypersomnie (slaperigheid overdag) te behandelen?
Een Cochrane review (Annane et al., 2011) van vier gerandomiseerde onderzoeken onderzocht het effect van psychostimulantia op slaperigheid overdag, gemeten met de maintanace of wakefulness test (MWT) en de Epworth Sleepiness Scale (ESS), bij patiënten met DM1.
Resultaten:
a) twee studies (N=48 deelnemers) (Orlikowski et al., 2009; Talbot et al., 2003) vergeleken bij volwassen patiënten met DM1 en een MSLT <8 minuten (Orikowski) of een ESS score ³10 het effect van modafinil met dat van een placebo op de MWT. Patiënten kregen dagelijks 300mg modafinil of een placebo voor een periode van één maand (Orlikowski), of 100mg modafinil of een placebo de eerste vijf dagen gevolgd door 200mg modafinil of een placebo de daaropvolgende 23 dagen (Talbot). De resultaten lieten een statistisch niet-significante verbetering van de MWT zien in het voordeel van modafinil (mean difference (MD) 2.52; 95% BI -2.32 tot 7.37).
b) vier studies (N=101 deelnemers) (Orlikowski; Talbot; MacDonald et al., 2002; Wintzen et al., 2007) vergeleken bij volwassen patiënten met DM1 het effect van modafinil met dat van een placebo op de ESS en vonden een significante verbetering van de ESS in het voordeel van modafinil (MD -2,26; 95% BI -3.78 tot -0.73). De gebruikte behandelschema’s in de studies van Orlikowski en Talbot zijn hierboven beschreven. Bij MacDonald kregen patiënten 100 mg modafinil tweemaal daags gedurende een week gevolgd door 200 mg modafinil gedurende een week voor een totaal van vier weken. Bij Wintzen kregen patiënten dagelijks 200mg modafinil gedurende een week gevolgd door 200 of 400 mg modafinil gedurende een week voor een totaal van vier weken.
De evidencetabellen van de studies van Orlikowski, Talbot, MacDonald en Wintzen kunt u vinden in de review van Annane.
Bewijskracht van de literatuur
a) de bewijskracht voor de uitkomstmaat slaperigheid overdag, gemeten met de MWT, is zeer laag, omdat:
het aantal patiënten gering is en de betrouwbaarheidsintervallen breed zijn (imprecisie);
de resultaten tussen de twee studies tegenstrijdig zijn (heterogeniteit).
b) de bewijskracht voor de uitkomstmaat slaperigheid overdag, gemeten met de ESS, is laag, omdat:
het aantal patiënten gering is;
de resultaten tussen de studies tegenstrijdig zijn (heterogeniteit).
Is creatine effectief bij DM1 patiënten met spierzwakte?
Een Cochrane review (Kley et al., 2011) van twee gerandomiseerde onderzoeken bij volwassen patiënten met DM1, onderzocht het placebogecontroleerde effect van creatine op spierkracht, gemeten met kwantitatieve spiermetingen (maximum voluntary contraction (MVC)) en vragenlijsten over functionele testen van dagelijkse activiteiten. Patiënten kregen dagelijks 5g creatine voor een periode van vier maanden (Tarnopolsky et al., 2004) of dagelijks 10,6g creatine voor een periode van tien dagen gevolgd door 5,3g creatine de daaropvolgende 46 dagen (Walter et al., 2002).
De resultaten:
a) een meta-analyse liet een statistisch niet-significante toename van de spierkracht (MVC) zien in het voordeel van creatine (WMD 4.39; 95% BI -8.61 tot 17.30);
b)Walter onderzocht eveneens de uitkomstmaat verbetering van dagelijkse activiteiten en vond dat patiënten in de creatine groep zich beter voelden, hoewel dit statistisch niet-significant was (RR 2.0; 95% BI 0.54 tot 7.35).
De evidencetabellen van de studies van Tarnopolsky en Walter kunt u vinden in de review van Annane.
Bewijskracht van de literatuur
a) de bewijskracht voor de uitkomstmaat spierkracht, gemeten met MVC, is zeer laag, omdat:
het aantal patiënten gering is en de betrouwbaarheidsintervallen breed zijn (imprecisie);
de resultaten tussen de twee studies tegenstrijdig zijn (heterogeniteit).
b) de bewijskracht voor de uitkomstmaat verbetering van dagelijkse activiteiten is laag, omdat:
het aantal patiënten gering is en de betrouwbaarheidsintervallen breed zijn (imprecisie).
Is oefentherapie effectief bij DM1 patiënten met spierzwakte?
Een Cochrane review (Voet et al., 2010) onderzocht het effect van spierversterkende oefeningen en conditietraining bij patiënten met een spierziekte. Één van de drie geïncludeerde RCTs vergeleek spierversterkende oefeningen met geen spierversterkende oefeningen bij 36 volwassen patiënten met DM1 (Lindeman et al., 1995). Patiënten oefenden driemaal wekelijks een halfuur gedurende een periode van 24 weken. De resultaten lieten geen verschil in kracht zien tijdens isometrische knie-extensie (WMD 3.90; 95% BI -4.11 tot 11,91), knieflexie (WMD -3.78; 95% BI -3.78 tot 11.18) en geen verschil in kracht gemeten als maximum voluntary contraction (MVC). Tevens waren er geen ongunstige effecten in de groep spierversterkende oefeningen.
Nieuwe studies:
In een RCT van 35 volwassen DM1 patiënten werd het effect van een groepsinspanningstraining van een uur, tweemaal per week, voor een periode van 14 weken op de zes minuten wandeltest gemeten (Kierkegaard et al., 2011). De resultaten lieten geen significant verschil zien. Er waren geen ongunstige effecten.
De evidencetabellen van de studie van Lindeman kunt u vinden in de review van Voet. De studie van Kierkegaard is opgenomen in de evidencetabel op pagina 52 van deze richtlijn, omdat deze studie na de searchdatum van de review van Voet gepubliceerd is.
Bewijskracht van de literatuur
a) spierversterkende oefeningen versus geen spierversterkende oefeningen:
de bewijskracht voor de uitkomstmaten is laag, omdat het aantal patiënten gering is (imprecisie).
b) groepsinspanningstraining versus geen groepsinspanningstraining:
de bewijskracht voor de uitkomstmaat zes minuten wandeltest is laag, omdat het aantal patiënten gering is (imprecisie).
Een Cochrane review (Voet et al., 2010) onderzocht het effect van spierversterkende oefeningen en conditietraining bij patiënten met een spierziekte. Één van de drie geïncludeerde RCTs vergeleek spierversterkende oefeningen met geen spierversterkende oefeningen bij 36 volwassen patiënten met DM1 (Lindeman et al., 1995). Patiënten oefenden driemaal wekelijks een halfuur gedurende een periode van 24 weken. De resultaten lieten geen verschil in kracht zien tijdens isometrische knie-extensie (WMD 3.90; 95% BI -4.11 tot 11,91), knieflexie (WMD -3.78; 95% BI -3.78 tot 11.18) en geen verschil in kracht gemeten als maximum voluntary contraction (MVC). Tevens waren er geen ongunstige effecten in de groep spierversterkende oefeningen.
Nieuwe studies:
In een RCT van 35 volwassen DM1 patiënten werd het effect van een groepsinspanningstraining van een uur, tweemaal per week, voor een periode van 14 weken op de zes minuten wandeltest gemeten (Kierkegaard et al., 2011). De resultaten lieten geen significant verschil zien. Er waren geen ongunstige effecten.
De evidencetabellen van de studie van Lindeman kunt u vinden in de review van Voet. De studie van Kierkegaard is opgenomen in de evidencetabel op pagina 52 van deze richtlijn, omdat deze studie na de searchdatum van de review van Voet gepubliceerd is.
Bewijskracht van de literatuur
a) spierversterkende oefeningen versus geen spierversterkende oefeningen:
de bewijskracht voor de uitkomstmaten is laag, omdat het aantal patiënten gering is (imprecisie).
b) groepsinspanningstraining versus geen groepsinspanningstraining:
de bewijskracht voor de uitkomstmaat zes minuten wandeltest is laag, omdat het aantal patiënten gering is (imprecisie).
Is cognitieve gedragstherapie effectief bij DM1 patiënten?
De werkgroep heeft geen RCTs gevonden waarin het effect van cognitieve gedragstherapie in DM1 patiënten is onderzocht.
Zoeken en selecteren
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar patiënten met DM1 en neurologische verschijnselen. De zoekstrategieën zijn weergegeven in de bijlage van dit hoofdstuk.
De literatuurzoekactie voor diagnostiek leverde 181 treffers op. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: origineel onderzoek, gecontroleerd onderzoek, patiënten met DM1, klinisch spectrum patiënten duidelijk beschreven, selectie patiënten en controles duidelijk beschreven en duidelijke beschrijving referentietest.
De literatuurzoekactie voor therapeutische interventies leverde 278 treffers op. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: origineel onderzoek, vergelijkend onderzoek, en rapportage van ‘kwaliteit van leven en vermindering van klachten van patiënt en partner’ als uitkomstmaten.
Referenties
- Annane, D., Moore, D.H., Barnes, P.R., & Miller, R.G. (2006). Psychostimulants for hypersomnia (excessive daytime sleepiness) in myotonic dystrophy. Cochrane Database Syst Rev., 19 (3), CD003218-.
- Antonini, G., Vichi, R., Leardi, M.G., Pennisi, E., Monza, G.C., & Millefiorini, M. (1990). Effect of clomipramine on myotonia: a placebo-controlled, double-blind, crossover trial. Neurology, 40 (9), 1473-4.
- Durelli, L., Mutani, R., & Fassio, F. (1983). The treatment of myotonia: evaluation of chronic oral taurine therapy. Neurology, 33 (5), 599-603.
- Gagnon, C., Noreau, L., Moxley, R.T., Laberge, L., Jean, S., Richer, L., … Mathieu, J. (2007). Towards an integrative approach to the management of myotonic dystrophy type 1. J Neurol Neurosurg Psychiatry, 78, 800-6.
- Gascon, G.G., Staton, R.D., Patterson, B.D., Konewko, P.J., Wilson, H., Carlson, K.M., & Brumback, R.A. (1989). A pilot controlled study of the use of imipramine to reduce myotonia. Am J Phys Med Rehabil, 68 (5), 215-20.
- Harper, P. S. (2001). Myotonic dystrophy (3rd ed). London: Saunder, 0, X-.
- Kierkegaard, M., Harms-Ringdahl, K., Edström, L., Widén Holmqvist, L., & Tollbäck, A. (2011). Feasibility and effects of a physical exercise programme in adults with myotonic dystrophy type 1: a randomized controlled pilot study. J Rehabil Med, 43 (8), 695-702.
- Kley, R.A, Tarnopolsky, M.A., & Vorgerd, M. (2011). Creatine for treating muscle disorders.. Cochrane Database Syst Rev, 16 (2), CD004760-.
- Lindeman, E., Leffers, P., Spaans, F., Drukker, J., Reulen, J., Kerckhoffs, M., & Köke, A. (1995). Strength training in patients with myotonic dystrophy and hereditary motor and sensory neuropathy: a randomized clinical trial. Arch Phys Med Rehabil, 76 (7), 612-20.
- Logigian, E.L., Martens, W.B., Moxley, R.T. 4th, McDermott, M.P., Dilek, N., Wiegner, A.W., … Moxley, R.T. 3rd. (2010). Mexiletine is an effective antimyotonia treatment in myotonic dystrophy type 1. Neurology, 74 (18), 1441-8.
- MacDonald, J.R., Hill, J.D., & Tarnopolsky, M.A. (2002). Modafinil reduces excessive somnolence and enhances mood in patients with myotonic dystrophy. Neurology, 59 (12), 1876-80.
- Orlikowski, D., Chevret, S., Quera-Salva, M.A., Laforêt, P., Lofaso, F., Verschueren, A., … Annane, D. (2009). Modafinil for the treatment of hypersomnia associated with myotonic muscular dystrophy in adults: a multicenter, prospective, randomized, double-blind, placebo-controlled, 4-week trial. Clin Ther, 31 (8), 1765-73.
- Talbot, K., Stradling, J., Crosby, J., & Hilton-Jones, D. (2003). Reduction in excess daytime sleepiness by modafinil in patients with myotonic dystrophy. Neuromuscul Disord, 13 (5), 357-64.
- Tarnopolsky, M., Mahoney, D., Thompson, T., Naylor, H., & Doherty, T.J. (2004). Creatine monohydrate supplementation does not increase muscle strength, lean body mass, or muscle phosphocreatine in patients with myotonic dystrophy type 1. Muscle Nerve., 29 (1), 51-8.
- Trip, J., Drost, G., Engelen, B.G. van, & Faber, C.G. (2006). Drug treatment for myotonia. Cochrane Database Syst Rev, 25 (1), CD004762-.
- Voet, N.B., Kooi, E.L. van der, Riphagen, I.I., Lindeman, E., Engelen, B.G. van, & Geurts, A.Ch. (2011). Strength training and aerobic exercise training for muscle disease. Cochrane Database Syst Rev., 20 (1), CD003907-.
- Walter, M.C., Reilich, P., Lochmüller, H., Kohnen, R., Schlotter, B., Hautmann, H., … Müller-Felber, W. (2002). Creatine monohydrate in myotonic dystrophy: a double-blind, placebo-controlled clinical study. J Neurol., 249 (12), 1717-22.
- Wintzen, A.R., Lammers, G.J., & Dijk, J.G. van (2007). Does modafinil enhance activity of patients with myotonic dystrophy?: a double-blind placebo-controlled crossover study. J Neurol, 254 (1), 26-8.
Evidence tabellen
Table Assessment of trial quality
|
|
Concealment of allocation |
Blinding patients |
Blinding care provider |
Blinding outcome assessor |
Drop-out rate described and acceptable |
Analysis by intention-to-treat |
|
Kierkegaard 2011 |
Adequate |
No |
No |
No |
Adequate |
Yes |
|
Logigian 2010 (2 trials) |
Adequate |
Yes |
Yes |
Yes |
Adequate (trial 1: 2/20) (trial 2: 2/20) |
No |
Table Study population, interventions and outcome
|
|
Design |
Setting |
Demographics |
Treatment (T) and control group (C) |
Outcomes |
|
Kierkegaard 2011 |
RCT |
35 Adults with DM who had been screened for cardiac involvement, had distal or mild-to-moderate proximal muscle impairment, and no severe cognitive impairments. |
|
T: 60-minute comprehensive group-training program twice a week for 14 weeks.
C: no training |
Six-minute walk test T (18): plus 9 meter C (17): min 2 meter P > 0.05 |
|
Logigian 2010 |
2 RCTs |
Trial 1: 20 ambulatory DM1 adults with grip or percussion myotonia on examination.
Trial 2: 20 ambulatory DM1 adults with grip or percussion myotonia on examination.
|
|
Trial 1 T (11): 150 mg mexiletine 3 times daily
C (9): placebo
Trial 2 T (10): 200 mg mexiletine 3 times daily
C (10): placebo
Remark: two treatment periods of 7 weeks in duration separated by a 4- to 8-week washout period. |
Time for isometric grip force to relax from 90% to 5 % (seconds) Trial 1 T: 1.32 C: 2.55 Treatment effect: -1.23; 95% BI (-1.81 to -0.64); P < 0.0004
Trial 1 T: 1.27 C: 2.63 Treatment effect: -1.36; 95% BI (-2.09 to -0.63); P < 0.05
Serious adverse events Trial 1 T: none C: none
Trial 1 T: none C: none
Mild adverse events Trial 1 P > 0.05
Trial 2 P > 0.05 |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-03-2013
Uiterlijk in 2017 bepaalt het bestuur van de Vereniging Klinische Genetica Nederland of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Vereniging Klinische Genetica Nederland is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Met ondersteuning van de Orde van Medisch Specialisten. De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
De richtlijn heeft als doel de kwaliteit van de begeleiding en de behandeling van volwassen patiënten met DM1 te verbeteren door een uniform beleid.
Deze richtlijn is geschreven voor de leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen, en voor overige zorgverleners die betrokken zijn bij de zorg voor DM1 patiënten. DM1 patiënten kunnen bij vrijwel alle orgaanspecialisten om hulp vragen. Ook huisartsen kunnen deze richtlijn gebruiken. Juist wegens de veelheid aan complicaties en betrokken specialisten zal de huisarts het overzicht (mede) moeten bewaken. Paramedici (fysiotherapeuten, logopedisten etc.) kunnen een belangrijke rol hebben bij de begeleiding; deze richtlijn kan ook voor hen van waarde zijn. Tevens is een patiëntenversie van de richtlijn ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2010 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van een aantal relevante specialismen die betrokken zijn bij de zorg voor patiënten met DM1 (zie de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. C.G. Faber (voorzitter), neuroloog, Maastricht Universitair Medisch Centrum
- Prof. Dr. C.E.M. de Die-Smulders (projectleider), klinisch geneticus, Maastricht Universitair Medisch Centrum
- Prof. Dr. B.G.M. van Engelen, neuroloog, Universitair Medisch Centrum Sint Radboud te Nijmegen
- Dr. J. Driessen, anesthesioloog, Universitair Medisch Centrum Sint Radboud te Nijmegen
- Dr. W.G.M. Janssen, revalidatiearts, Erasmus Medisch Centrum te Rotterdam
- Drs. J. Cluitmans, revalidatiearts, atrium Medisch Centrum te Heerlen
- Dr. J.M. Conchillo, MDL-arts, Maastricht Universitair Medisch Centrum
- Dr. M. Michels, cardioloog, Erasmus Medisch Centrum te Rotterdam
- Dr. A.M.C. Horemans, Hoofd Kwaliteit van zorg, Spierziekten Nederland te Baarn
- Prof. Dr. A. Masclee, MDL-arts, Maastricht Universitair Medisch Centrum
- Drs. A.A.B. Otte, longarts, Maastricht Universitair Medisch Centrum, Centrum voor thuisbeademing Maastricht
Met ondersteuning van:
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.), senior adviseur, afdeling Ondersteuning Professionele Kwaliteit, Orde van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij het secretariaat OPK (Orde van Medisch specialisten) opvragen.
Inbreng patiëntenperspectief
In deze richtlijn worden de patiënten vertegenwoordigd door een bureaumedewerker van de VSN, die in nauw contact staat met de diagnosewerkgroep Myotone Dystrofie van de VSN.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad voor Wetenschap, Opleiding en Kwaliteit (WOK). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door de Vereniging Spierziekten Nederland (VSN).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen in Medline (OVID), de databases van het Guidelines International Network (GIN), de Kwaliteitskoepel en Artsennet (13 referenties, vanaf 2006) en naar systematische reviews in Medline (OVID) en de Cochrane Library (11 referenties vanaf 2000). Ook werd gezocht naar artikelen over patiëntenperspectief (24 referenties, geen beperking naar datum). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van de op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen schatten. Deze beoordelingen kunt u vinden in de kolom ‘Beoordeling kwaliteit studie’ van een evidencetabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur zijn beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (Van Everdingen et al., 2004).
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in één of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt de conclusie getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn er naast het wetenschappelijke bewijs nog andere aspecten van belang, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische facetten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij de afdeling Ondersteuning Professionele Kwaliteit (OPK) van de Orde van Medisch Specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Referenties
Atkins, D., Best, D., Briss, P.A., Eccles, M., Falck-Ytter, Y., Flottorp, S., … GRADE Working Group. (2004). Grading quality of evidence and strength of recommendations. BMJ Jun, 19 328 (7454), 1490.
Everdingen, J.J.E. van, Burgers, J.S., Assendelft, W.J.J., Swinkels, J.A., Barneveld, T.A. van, & Klundert, J.L.M. van de (2004). Evidence-based richtlijnontwikkeling. Bohn Stafleu: Van Loghum.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
