Welke vaccinaties zijn geïndiceerd voor de start en tijdens de behandeling?
Uitgangsvraag
Welke vaccinaties zijn geïndiceerd voor de start en tijdens de behandeling?
Aanbeveling
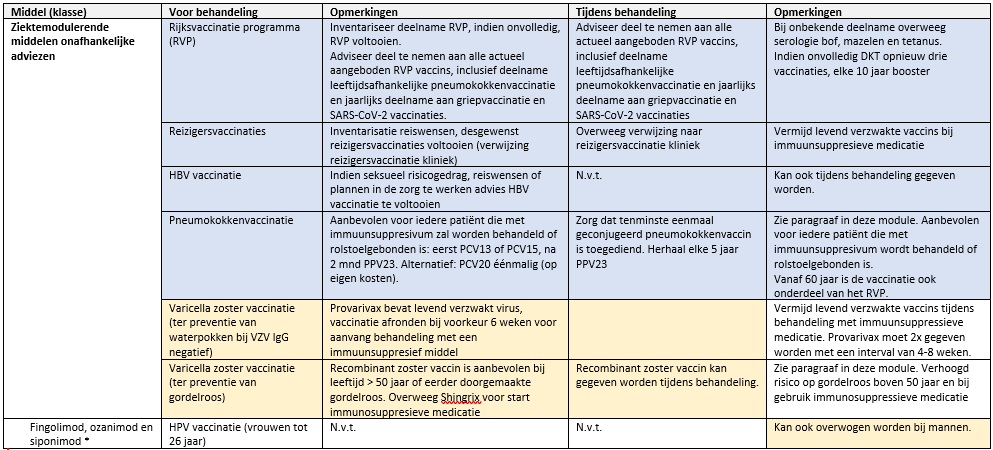
Voltooi het volledige Rijksvaccinatie programma voor de start van ziektemodulerende behandeling bij onvolledige deelname. Let hierbij op de aanvullende vaccinaties voor kwetsbaren (pneumokokken vaccinatie, influenza, COVID-19) en de HPV vaccinatie bij S1P receptor modulatoren
Bepaal VZV IgG indien onbekend is of iemand waterpokken heeft doorgemaakt. Indien VZV IgG negatief is, wordt aanbevolen te vaccineren tegen waterpokken, behalve als iemand vanwege ziektemodulerende therapie geen levend verzwakte virusvaccins mag ontvangen.
Overweeg vaccinatie tegen gordelroos, bij patiënten die dit eerder hebben doorgemaakt of boven de 50 jaar zijn en overweeg dit voor start met ziektemodulerende therapie die het risico op herpesvirus (re-)activatie vergroot .
Consulteer een vaccinatiepoli die gespecialiseerd is in vaccineren van patiënten met immuun-modulerende therapie, indien de patiënt specifieke reizigers vaccinaties nodig heeft.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Ziektemodulerende behandeling en invaliditeit door MS kunnen het risico op infecties verhogen. Een deel van deze risico’s is te verkleinen en zelfs te voorkomen middels vaccinatie. Het vaccineren zelf is veilig gebleken en verhoogt het risico op een relapse niet. Om die reden is het belangrijk bij iedere MS patiënt stil te staan bij de vaccinatiestatus, risicofactoren voor infecties en toekomstige reiswensen om vaccins optimaal te kunnen inzetten. Hoewel ziektemodulerende therapie gepaard kan gaan met een verminderde respons op vaccinatie, valt zelfs dan vaak nog winst te behalen met vaccineren. Waar mogelijk verdient het aanbeveling om te vaccineren voordat de ziektemodulerende behandeling wordt ingesteld.
De vaccinatieadviezen uit deze module zijn in eerste instantie gebaseerd op het Nederlandse Rijksvaccinatieprogramma (RVP). In dit programma zijn de vaccins verwerkt die zinvol worden geacht voor de hele bevolking en daarbij wordt ook al rekening gehouden met risicogroepen en leeftijdsafhankelijke risico’s. Daarnaast zijn de adviezen uit de RIVM Handreiking Vaccinatie bij chronisch inflammatoire aandoeningen overgenomen (RIVM, 2023a). Deze handreiking is opgesteld door een multidisciplinaire werkgroep en bevat vaccinatieadviezen voor mensen met diverse auto-immuunziekten. De adviezen uit deze handreiking worden door de werkgroep ook zinvol geacht voor MS patiënten. Tot slot zijn de vaccinatieadviezen uit de SmPCs van ziektemodulerende middelen overgenomen. Er is geen systematische search verricht om de individuele vaccinatieadviezen te onderbouwen omdat de opbrengst daarvan als laag werd ingeschat. De adviezen zijn vergeleken met de adviezen van de American Academy of Neurology en recente reviews over dit onderwerp. In tabel 2 is een overzicht weergegeven van mogelijke vaccinaties voor en tijdens de start van ziektemodulerende behandeling bij MS.
Recent is de website www.immunostart.nl gelanceerd. Deze tool is ontwikkeld met financiering van SKMS gelden en heeft als doel screenings- en vaccinatieadviezen voor behandelaren inzichtelijk te maken. De adviezen op deze site komen overeen met de RIVM leidraad en sluiten ook aan bij deze module.
Bij de vaccinatie van MS patiënten is het zinvol om onderscheid te maken tussen a) ziektemodulerende-onafhankelijke en ziektemodulerende-afhankelijke adviezen, b) vaccinatie vóór start van ziektemodulerende behandeling en tijdens gebruik van ziektemodulerende behandeling en c) de zogenaamde levende en geïnactiveerde vaccins.
- De ziektemodulerende behandeling onafhankelijke adviezen bevatten de algemene vaccinatieadviezen die voortkomen uit het RVP en adviezen die gebaseerd zijn op specifieke risicofactoren of reiswensen van de patiënt. De ziektemodulerende behandeling afhankelijke adviezen komen erbij wanneer het specifieke middel een aanvullend advies wenselijk maakt.
- Het onderscheid tussen vaccinatie vóór start en tijdens ziektemodulerende behandeling is gebaseerd op de kans dat het specifieke middel de werking van het vaccin ondermijnt en op het risico op bijwerkingen door het vaccin zelf veroorzaakt.
- Het onderscheid tussen levende en geïnactiveerde vaccins is van belang voor het risico dat een vaccin kan veroorzaken bij toediening tijdens een immuungecompromitteerde status.
Overwegingen bij het aanbieden van pneumokokkenvaccinatie
De pneumokokkenvaccinatie is onderdeel van het rijksvaccinatieprogramma en is volgens het advies van de gezondheidsraad aanbevolen voor 60+ en risicogroepen (Gezondheidsraad, 2020). Studies laten een verhoogd risico zien op een pneumonie bij MS patiënten (Vinogradova, 2009; Wotton, 2012; Wijnands, 2018), mate van invaliditeit (rolstoel gebonden zijn) en/of immuunsuppresieve medicatiegebruik zijn hier de meest verklarende factoren voor. Pneumokokken veroorzaken circa 20% van de pneumoniën. Daarnaast kunnen pneumokokken andere ziektebeelden veroorzaken, zoals otitis-media, sepsis en meningitis. Er is vrijwel geen onderzoek gedaan naar de effectiviteit van pneumokokken vaccins bij MS patiënten, maar op basis van de ervaring met andere auto-inflammatoire aandoeningen kan worden aangenomen dat vaccinatie (gedeeltelijk) bescherming biedt tegen invasieve pneumokokken ziekte (Moberley, 2013). Vanuit verschillende instanties, zoals de American Academy of Neurology en National MS society (National MS Society, 2023b) wordt in lijn met andere autoimmuunaandoeningen geadviseerd om ook MS patiënten tegen pneumokokken te vaccineren. De werkgroep adviseert om pneumokokken vaccinatie aan te bieden aan iedere MS patiënt die rolstoelgebonden is of met immuunsuppressieve medicatie behandeld wordt of zal worden. Om optimale effectiviteit te bereiken worden de vaccins bij voorkeur voor start van immuunsuppressieve medicatie gegeven, hoewel er geen contra-indicaties zijn voor toediening tijdens de behandeling.
Als eerste vaccin tegen pneumokokken infectie wordt éénmalig het 13-valente conjugaat vaccin (PCV13) of het 15-valente conjugaat vaccin (PCV15) aanbevolen en tenminste twee maanden later het 23-valente polysaccharide vaccin (PPV23). Het conjugaatvaccin is nodig om affiniteitsmaturatie van antistoffen en B-cel memory op te wekken. PCV13 en PCV15 worden als gelijkwaardig beschouwd. Het polysaccharide vaccin biedt bredere bescherming en moet iedere 5 jaar worden herhaald. Een uitgebreide toelichting op de pneumokokkenvaccinatie bij mensen met een chronisch inflammatoire aandoening is te vinden op de leidraad van het RIVM (RIVM, 2023a). Een alternatief vaccinatieschema bestaat uit enkel vaccinatie met het 20-valente conjucaatvaccin (PCV20) (RIVM, 2023c). Dit heeft als voordeel dat geen vervolgvaccinatie nodig is met het polysaccharide vaccin, een nadeel is dat deze vaccinatie nog niet standaard vergoed wordt.
Overwegingen bij het aanbieden van SARS-CoV-2 vaccinatie
Voor de meest recente adviezen voor SARS-CoV-2 vaccinaties bij mensen met chronisch inflammatoire aandoeningen en/of immuunsuppressieve medicatie verwijst de werkgroep naar de pagina van het RIVM (RIVM, 2023b). Hierin staan ook specifieke adviezen voor neurologische patiënten.
Overwegingen bij het aanbieden van recombinant zoster vaccin ter preventie van gordelroos
Gordelroos ontstaat door een reactivatie van varicella zostervirus en komt alleen voor bij mensen die ooit waterpokken hebben doorgemaakt (>97% van de Nederlanders; de Melker, 2006). Naast het veroorzaken van directe morbiditeit kan gordelroos ook bacteriële wondinfecties, postherpetische neuralgie en cerebrovasculaire incidenten veroorzaken (Liu, 2016). Bij vrouwen is het risico op gordelroos verhoogd. Het risico en de kans op complicaties nemen verder toe met de leeftijd (met name >50 jaar; Levin, 2012). Ook immuunsuppresieve medicatie verhoogt het risico met gemiddeld twee keer (Schröder , 2017). Van een groot aantal tweede- en derdelijns MS middelen is bekend dat ze de kans op herpesvirus reactivaties verhogen; het is echter onbekend hoe vaak gordelroos voorkomt in specifieke populaties MS patiënten.
Vaccinatie tegen gordelroos is effectief om gordelroos en post-herpetische neuralgie te voorkomen (Anderson, 2022; Izurieta 2021; Oostvogels, 2019). Er is een gordelroosvaccin dat gebruik maakt van een levend-verzwakte virus (zostavax), maar dat is minder effectief dan het recombinant zoster vaccin (Shingrix). Aangezien dit geen replicerend virus bevat, kan het ook gegeven worden tijdens behandeling met immuunsuppresieve medicatie. Het is betrekkelijk kort op de markt (in Nederland sinds 2019). In 2019 heeft de gezondheidsraad een positief advies gegeven voor RZV vaccinatie van personen van 60 jaar en ouder, met als aandachtspunt de beperkte kosteneffectiviteit (https://www.gezondheidsraad.nl/documenten/adviezen/2019/07/15/vaccinatie-tegen-gordelroos ). Het advies voor de leeftijd van 60-jaar was gebaseerd op de doelmatigheid. De landelijke leidraad van het RIVM over Vaccinatie bij chronisch inflammatoire aandoeningen is terughoudend in het advies over vaccinatie (RIVM, 2023a), omdat nog te weinig informatie over de effectiviteit beschikbaar was op het moment van schrijven. Inmiddels is bekend dat de bescherming van het recombinant zoster vaccin zeker 10 jaar aanhoudt (Strezova Open Forum ID 2022). Het Nederlandse ’Immunostart’ SKMS-project, dat als doel heeft om de vaccinatie-zorg bij patiënten met afweerstoornissen te verbeteren, adviseert het RZV voor alle patiënten met autoimmuunziekten >50 jaar en vaccinatie onafhankelijk van de leeftijd wanneer iemand eerder gordelroos heeft doorgemaakt (https://immunostart.nl/vaccinatie/).
De CDC bracht in 2022 het advies uit om het RZV aan te bieden aan alle immuungecompromitteerde patiënten >19 jaar (Anderson,2022; CDC, 2022). Dit wordt ondersteund door de National MS Society van de Verenigde Staten (National MS Society, 2023a). Er zijn op het moment van schrijven geen directe studies naar het voorkomen van gordelroos bij MS patiënten en het effect van DMTs op het risico daarop. Op basis van theoretische overwegingen en in aansluiting op het advies van Immunostart en diverse internationale richtlijnen beveelt de werkgroep aan om de recombinant zoster vaccinatie aan te bieden aan alle MS patiënten >50 jaar en aan mensen onder de 50 wanneer die eerder gordelroos hebben doorgemaakt. In aansluiting op het advies van de CDC kan ook overwogen worden MS patiënten onder de 50 zonder geschiedenis van gordelroos te vaccineren, in het kader van start met een DMT waarvan het risico op herpesvirus reactivatie verhoogd is of lijkt te zijn (alemtuzumab, cladribine, S1P modulatoren, natalizumab, anti-CD20 monoclonalen, teriflunomide en fumaraten). De wens van de patiënt om gevaccineerd te worden kan hierbij doorslaggevend zijn.
Overwegingen bij het aanbieden van Provarivax vaccinatie ter preventie van waterpokken
Voor mensen die nooit waterpokken hebben doorgemaakt is een levend-verzwakt virus vaccin beschikbaar (Provarivax). Provarivax kan zowel worden ingezet als post-expositie profylaxe, na een recent waterpokken contact, of om primaire immuniteit tegen VZV op te wekken. Provarivax is niet geschikt voor preventie van gordelroos. recombinant zoster vaccin is niet geschikt om te beschermen tegen waterpokken.
De werkgroep adviseert om Provarivax te geven in bij die ziektemodulerende middelen waarbij het doormaken van waterpokken een ernstiger verloop kan kennen (S1P modulatoren, alemtuzumab, anti-CD20 therapie en cladribine). Daarnaast kan overwogen worden Provarivax te geven voorafgaand aan die ziektemodulerende middelen waarbij gebruik van vaccins met levend-verzwakte virussen gecontraïndiceerd is (natalizumab, fumaraten en teriflunomide), waardoor post-expositie profylaxe met Provarivax niet gegeven kan worden. In het algemeen valt te overwegen om MS patiënten die nog nooit waterpokken hebben doorgemaakt danwel VZV IgG negatief zijn, hiervoor te vaccineren middels Provarivax aangezien er gerede kans is dat zij in de toekomst met een ziektemodulerende behandeling zullen starten waarvoor dit geadviseerd wordt (en er dan tijd bespaard kan worden voor starten van behandeling).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is voor de meeste patiënten van belang zo goed mogelijk tegen infecties beschermd te worden met een zo laag mogelijk risico op bijwerkingen van de vaccinatie. Er zijn echter patiënten die prefereren zich niet te laten vaccineren om uiteenlopende redenen. Of patiënten tot de eerste of de tweede groep behoren zal vaak afhangen van hun risicoprofiel en dus ook van de betreffende ziektemodulerende behandeling, maar soms is het puur het gevolg van een persoonlijke overtuiging en staat het los van de ziekte specifieke situatie.
Kosten (middelenbeslag)
Vaccinaties zijn een veilige en effectieve methode om infecties die een kans hebben op een ernstig beloop te voorkomen. Bij de werkgroepleden zijn geen kosteneffectiviteitsstudies bekend die specifiek MS patiënten onderzocht hebben. In geval van infectieziekten met een risico op ernstig beloop of veel voorkomende infectieziekten is vaccinatie naar verwachting kosteneffectief, gezien de beperkte kosten in relatie tot de ziektelast en kosten die ziekte met zich meebrengt. De vaccinatie tegen gordelroos biedt bijvoorbeeld belangrijke bescherming tegen het optreden van gordelroos. Of dit daadwerkelijk kosteneffectief is, is onzeker.
Aanvaardbaarheid, haalbaarheid en implementatie
Sommige vaccins (bijvoorbeeld recombinant zoster vaccin of PCV-20) worden nog niet vergoed, wanneer ze aangeboden worden buiten het Rijksvaccinatieprogramma (RVP). Vanaf januari 2024 is de vergoeding van recombinant zoster vaccin wel geregeld, mogelijk ook van PCV-20. De arts zal een motivatiebrief moeten schrijven om vergoeding te regelen. Het vaccineren kan leiden tot uitstel van de behandeling, omdat in sommige gevallen eerst gewacht moet worden totdat de vaccinatie serie compleet gegeven is. Dat kan soms onwenselijk zijn vanwege de MS activiteit. Het is aan de behandelaar om samen met de patiënt af te wegen wat prioriteit heeft.
Tabel 2. Vaccinaties voor en tijdens de start van ziektemodulerende behandeling bij MS
Blauw = richtlijn RIVM voor andere autoimmuunziekten; Geel = expert opinion, Geen kleur = SmPC. Zie ook www.immunostart.nl
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De monitorstrategie in deze richtlijn is gebaseerd op kennis over specifieke werkingsmechanismen, de ernst en frequentie van bijwerkingen gerapporteerd in de registratie studies of real world data studies, en adviezen zoals geformuleerd in de SmPC teksten. Deze richtlijn beoogt de screening voor de verschillende middelen zo uniform mogelijk weer te geven.
Onderbouwing
Achtergrond
In module ‘Ziektemodulerende middelen bij relapsing remitting multiple sclerosis (MS) en behandelindicatie’ wordt aanbevolen dat de zorgverlener en patiënt gezamenlijk de keuzeopties van de ziektemodulerende middelen bespreken. Hierbij dienen factoren zoals patiëntvoorkeuren, prognostische factoren, comorbiditeit, zwangerschapswens en veiligheid van behandeling te worden afgewogen.
Naast de afweging van verschillende factoren is er ook steeds meer aandacht voor de screening op vaccinaties, infectieziekten en andere comorbiditeiten. Fabrikanten doen veelal een eigen aanbeveling per middel voor screening op vaccinaties, infectieziekten en comorbiditeit. Zo kan het zijn dat middelen met hetzelfde biologisch werkingsmechanisme toch andere aanbevelingen kennen waarop en hoe vaak te screenen voor start en tijdens behandeling van het ziektemodulerende middelen. Daarnaast is er variatie in de standaardscreening tussen ziekenhuizen.
In deze module worden aanbevelingen gedaan over de standaard screening voordat gestart wordt met een ziektemodulerend middel en welke aspecten ten aanzien van veiligheid en (potentiële) bijwerkingen gemonitord dienen te worden tijdens de behandeling. Het doel van deze module is om een praktisch en overzichtelijk handvat te bieden voor algemene screeningsvoorwaarden en adviezen, naast patiëntkarakteristieken en -voorkeuren die essentieel zijn om samen tot een weloverwogen behandelbesluit te komen. Extra aandacht wordt besteed aan vaccinatieadviezen voor en tijdens behandeling met de verschillende ziektemodulerende middelen. Om de uitgangsvraag goed te kunnen beantwoorden, is deze opgedeeld in twee deelvragen waarbij onderscheid gemaakt wordt tussen monitoringsstrategie en de geïndiceerde vaccinaties bij start en tijdens de behandeling.
Samenvatting literatuur
Bij het beantwoorden van deze uitgangsvragen heeft de werkgroep gebruikt gemaakt van informatie weergeven in de Summary of Product Characteristics (SmPCs) van de ziektemodulerende middelen. De geraadpleegde SmPCs waren zeer recent geüpdatet. Er is daarom geen systematische search verricht, omdat de verwachte opbrengst in geen verhouding zou staan tot de inspanning. Naast de informatie uit de SmPCs heeft de werkgroep gebruik gemaakt van wetenschappelijke publicaties, het Rijksvaccinatieprogramma, de RIVM Handreiking ‘Vaccinatie bij chronisch inflammatoire aandoeningen’, het immunostart project (link: www.immunostart.nl; tool voor artsen bij vaccineren patiënten uit risicogroepen), lokale werkafspraken en expert opinie vanuit de werkgroep.
Referenties
- Anderson TC, Masters NB, Guo A, Shepersky L, Leidner AJ, Lee GM, Kotton CN, Dooling KL. Use of Recombinant Zoster Vaccine in Immunocompromised Adults Aged ?19 Years: Recommendations of the Advisory Committee on Immunization Practices - United States, 2022. MMWR Morb Mortal Wkly Rep. 2022 Jan 21;71(3):80-84. doi: 10.15585/mmwr.mm7103a2. PMID: 35051134; PMCID: PMC8774159.
- Baker D, Asardag AN, Quinn OA, Efimov A, Kang AS. Anti-drug antibodies to antibody-based therapeutics in multiple sclerosis. Hum Antibodies. 2021;29(4):255-262. doi: 10.3233/HAB-210453. PMID: 34397407.
- Bianco A, Patanella AK, Nociti V, De Fino C, Lucchini M, Savio FL, Rossini PM, Mirabella M. Severe dyspnoea with alteration of the diffusion capacity of the lung associated with fingolimod treatment. Mult Scler Relat Disord. 2016 Sep;9:11-3. doi: 10.1016/j.msard.2016.06.005. Epub 2016 Jun 11. PMID: 27645336.
- Biolato M, Bianco A, Lucchini M, Gasbarrini A, Mirabella M, Grieco A. The Disease-Modifying Therapies of Relapsing-Remitting Multiple Sclerosis and Liver Injury: A Narrative Review. CNS Drugs. 2021 Aug;35(8):861-880. doi: 10.1007/s40263-021-00842-9. Epub 2021 Jul 28. PMID: 34319570; PMCID: PMC8354931.
- Bucello S, Annovazzi P, Ragonese P, Altieri M, Barcella V, Bergamaschi R, Bianchi A, Borriello G, Buscarinu MC, Callari G, Capobianco M, Capone F, Cavalla P, Cavarretta R, Cortese A, De Luca G, Di Filippo M, Dattola V, Fantozzi R, Ferraro E, Filippi MM, Gasperini C, Grimaldi LME, Landi D, Re ML, Mallucci G, Manganotti P, Marfia GA, Mirabella M, Perini P, Pisa M, Realmuto S, Russo M, Tomassini V, Torri-Clerici VLA, Zaffaroni M, Zuliani C, Zywicki S, Filippi M, Prosperini L. Real world experience with teriflunomide in multiple sclerosis: the TER-Italy study. J Neurol. 2021 Aug;268(8):2922-2932. doi: 10.1007/s00415-021-10455-3. Epub 2021 Feb 22. PMID: 33616742.
- Camm J, Hla T, Bakshi R, Brinkmann V. Cardiac and vascular effects of fingolimod: mechanistic basis and clinical implications. Am Heart J. 2014 Nov;168(5):632-44. Doi: 10.1016/j.ahj.2014.06.028. Epub 2014 Jul 11. PMID: 25440790.
- CDC, 2022. Centers for Disease Control and Prevention > Vaccines & Preventable Diseases Home > Vaccines by Disease > Shingles> For Healthcare Professionals > Shingrix Recommendations. Page last reviewed: January 24, 2022. Link: https://www.cdc.gov/vaccines/vpd/shingles/hcp/shingrix/recommendations.html
- Cugati S, Chen CS, Lake S, Lee AW. Fingolimod and macular edema: Pathophysiology, diagnosis, and management. Neurol Clin Pract. 2014 Oct;4(5):402-409. doi: 10.1212/CPJ.0000000000000027. PMID: 29443255; PMCID: PMC5765686.
- Dauvergne M, Buob D, Rafat C, Hennino MF, Lemoine M, Audard V, Chauveau D, Ribes D, Cornec-Le Gall E, Daugas E, Pillebout E, Vuiblet V, Boffa JJ; French Nephropathology Group. Renal diseases secondary to interferon-? treatment: a multicentre clinico-pathological study and systematic literature review. Clin Kidney J. 2021 Jul 6;14(12):2563-2572. doi: 10.1093/ckj/sfab114. PMID: 34950468; PMCID: PMC8690152.
- Dolladille C, Chrétien B, Peyro-Saint-Paul L, Alexandre J, Dejardin O, Fedrizzi S, Defer G. Association Between Disease-Modifying Therapies Prescribed to Persons with Multiple Sclerosis and Cancer: a WHO Pharmacovigilance Database Analysis. Neurotherapeutics. 2021 Jul;18(3):1657-1664. doi: 10.1007/s13311-021-01073-y. Epub 2021 Jul 6. PMID: 34231126; PMCID: PMC8608969.
- El Mahdaoui, S., Romme Christensen, J., Magyari, M., Wandall-Holm, M. F., & Sellebjerg, F. (2022). Intravenous ofatumumab treatment of multiple sclerosis and related disorders: An observational study. Multiple sclerosis and related disorders, 68, 104246. https://doi.org/10.1016/j.msard.2022.104246
- Gezondheidsraad, 2020. COVID-19 en vaccinatie tegen pneumokokken (2). Den Haag: Gezondheidsraad, 2020; publicatienr. 2020/28. Link: https://www.gezondheidsraad.nl/documenten/adviezen/2020/12/17/covid-19-en-vaccinatie-tegen-pneumokokken-2
- Habek, M., Piska?, D., Gabeli?, T., Barun, B., Adamec, I., & Krbot Skori?, M. (2022). Hypogammaglobulinemia, infections and COVID-19 in people with multiple sclerosis treated with ocrelizumab. Multiple sclerosis and related disorders, 62, 103798. https://doi.org/10.1016/j.msard.2022.103798
- Izurieta HS, Wu X, Forshee R, Lu Y, Sung HM, Agger PE, Chillarige Y, Link-Gelles R, Lufkin B, Wernecke M, MaCurdy TE, Kelman J, Dooling K. Recombinant Zoster Vaccine (Shingrix): Real-World Effectiveness in the First 2 Years Post-Licensure. Clin Infect Dis. 2021 Sep 15;73(6):941-948. doi: 10.1093/cid/ciab125. PMID: 33580242.
- de Jong HJI, Kingwell E, Shirani A, Cohen Tervaert JW, Hupperts R, Zhao Y, Zhu F, Evans C, van der Kop ML, Traboulsee A, Gustafson P, Petkau J, Marrie RA, Tremlett H; British Columbia Multiple Sclerosis Clinic Neurologists. Evaluating the safety of ?-interferons in MS: A series of nested case-control studies. Neurology. 2017 Jun 13;88(24):2310-2320. doi: 10.1212/WNL.0000000000004037. Epub 2017 May 12. PMID: 28500224; PMCID: PMC5567323.
- FTK, Natalizumab 2022. Farmacotherapeutisch Kompas. Natalizumab, MS-middelen, L04AA23. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/n/natalizumab. Geraadpleegd op: 06-12-2022.
- FTK, Alemtuzumab 2022. Farmacotherapeutisch Kompas. Alemtuzumab, MS-middelen, L04AA34. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/a/alemtuzumab. Geraadpleegd op: 30-01-2023.
- FTK, Fingolimod 2023. Farmacotherapeutisch Kompas. Fingolimod, MS-middelen, L04AA27. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/f/fingolimod. Geraadpleegd op: 30-01-2023.
- FTK, Teriflunomide 2023. Farmacotherapeutisch Kompas. Teriflunomide MS-middelen L04AA31. Link: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/t/teriflunomide. Geraadpleegd op: 30-01-2023.
- Fischer S, Proschmann U, Akgün K, Ziemssen T. Lymphocyte Counts and Multiple Sclerosis Therapeutics: Between Mechanisms of Action and Treatment-Limiting Side Effects. Cells. 2021 Nov 15;10(11):3177. doi: 10.3390/cells10113177. PMID: 34831400; PMCID: PMC8625745.
- Grebenciucova, E., & Pruitt, A. (2017). Infections in patients receiving multiple sclerosis disease-modifying therapies. Current neurology and neuroscience reports, 17(11), 1-12.ISO 690.
- Holmøy T, Fevang B, Olsen DB, Spigset O, Bø L. Adverse events with fatal outcome associated with alemtuzumab treatment in multiple sclerosis. BMC Res Notes. 2019 Aug 12;12(1):497. doi: 10.1186/s13104-019-4507-6. PMID: 31405369; PMCID: PMC6689881.
- Levin MJ. Immune senescence and vaccines to prevent herpes zoster in older persons. Curr Opin Immunol. 2012 Aug;24(4):494-500. doi: 10.1016/j.coi.2012.06.002. Epub 2012 Aug 2. PMID: 22857823.
- Liu X, Guan Y, Hou L, Huang H, Liu H, Li C, Zhu Y, Tao X, Wang Q. The Short- and Long-Term Risk of Stroke after Herpes Zoster: A Meta-Analysis. PLoS One. 2016 Oct 21;11(10):e0165203. doi: 10.1371/journal.pone.0165203. PMID: 27768762; PMCID: PMC5074516.
- Ma SB, Griffin D, Boyd SC, Chang CC, Wong J, Guy SD. Cryptococcus neoformans var grubii meningoencephalitis in a patient on fingolimod for relapsing-remitting multiple sclerosis: Case report and review of published cases. Mult Scler Relat Disord. 2020 Jan 3;39:101923. doi: 10.1016/j.msard.2019.101923. Epub ahead of print. PMID: 31986367.
- de Melker, Hester et al. "The epidemiology of varicella and herpes zoster in The Netherlands: implications for varicella zoster virus vaccination." Vaccine vol. 24,18 (2006): 3946-52. doi:10.1016/j.vaccine.2006.02.017
- Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev. 2013 Jan 31;2013(1):CD000422. doi: 10.1002/14651858.CD000422.pub3. PMID: 23440780; PMCID: PMC7045867.
- Moiola, L., Barcella, V., Benatti, S., Capobianco, M., Capra, R., Cinque, P., ... & Riva, A. (2021). The risk of infection in patients with multiple sclerosis treated with disease-modifying therapies: A Delphi consensus statement. Multiple Sclerosis Journal, 27(3), 331-346
- Monzani F, Caraccio N, Casolaro A, Lombardo F, Moscato G, Murri L, Ferrannini E, Meucci G. Long-term interferon beta-1b therapy for MS: is routine thyroid assessment always useful? Neurology. 2000 Aug 22;55(4):549-52. doi: 10.1212/wnl.55.4.549. PMID: 10953190.
- Muñoz MA, Kulick CG, Kortepeter CM, Levin RL, Avigan MI. Liver injury associated with dimethyl fumarate in multiple sclerosis patients. Mult Scler. 2017 Dec;23(14):1947-1949. doi: 10.1177/1352458516688351. Epub 2017 Jan 13. PMID: 28086032.
- National MS Society, 2023a. Managing MS > Immunization. Link: https://www.nationalmssociety.org/For-Professionals/Clinical-Care/Managing-MS/Immunization
- National MS Society, 2023b. Living well with MS > Diet, exercise & healthy behaviors > Vaccinations. Geraadpleegd op 05-04-2023. Link: https://www.nationalmssociety.org/Living-Well-With-MS/Diet-Exercise-Healthy-Behaviors/Vaccinations.
- Oostvogels L, Heineman TC, Johnson RW, Levin MJ, McElhaney JE, Van den Steen P, Zahaf T, Dagnew AF, Chlibek R, Diez-Domingo J, Gorfinkel IS, Hervé C, Hwang SJ, Ikematsu H, Kalema G, Lal H, McNeil SA, Mrkvan T, Pauksens K, Smetana J, Watanabe D, Weckx LY, Cunningham AL. Medical conditions at enrollment do not impact efficacy and safety of the adjuvanted recombinant zoster vaccine: a pooled post-hoc analysis of two parallel randomized trials. Hum Vaccin Immunother. 2019;15(12):2865-2872. doi: 10.1080/21645515.2019.1627818. Epub 2019 Jun 28. PMID: 31216205; PMCID: PMC6930113.
- Otero-Romero S, Sánchez-Montalvá A, Vidal-Jordana A. Assessing and mitigating risk of infection in patients with multiple sclerosis on disease modifying treatment. Expert Rev Clin Immunol. 2021 Mar;17(3):285-300. doi: 10.1080/1744666X.2021.1886924. Epub 2021 Mar 8. PMID: 33543657.
- Schröder C, Enders D, Schink T, Riedel O. Incidence of herpes zoster amongst adults varies by severity of immunosuppression. J Infect. 2017 Sep;75(3):207-215. doi: 10.1016/j.jinf.2017.06.010. Epub 2017 Jul 1. PMID: 28676411.
- RIVM, 2023a. Handleiding Vaccinatie bij chronisch inflammatoire aandoeningen. Gepubliceerd: 29 april 2019. Geraadpleegd op 04-01-2023. Link: https://lci.rivm.nl/richtlijnen/vaccinatie-bij-chronisch-inflammatoire-aandoeningen#inleiding
- RIVM, 2023b. COVID-19-vaccinatie van immuungecompromitteerde patiënten. Specifieke adviezen: Neurologische patiënten. Gepubliceerd: 05-04-2023. Geraadpleegd op 13-04-2023. Link: https://lci.rivm.nl/handleiding-covid-19-vaccinatie-van-immuungecompromitteerde-patienten#neurologische-pati-nten
- RIVM, 2023c. Handleiding Vaccinatie bij hematologische aandoeningen. Algemene opmerkingen. Versie 7 maart 2023. Geraadpleegd op 13-04-2023. Link: https://lci.rivm.nl/richtlijnen/vaccinatie-bij-hematologische-aandoeningen#algemene-opmerkingen.
- Tuohy O, Costelloe L, Hill-Cawthorne G, Bjornson I, Harding K, Robertson N, May K, Button T, Azzopardi L, Kousin-Ezewu O, Fahey MT, Jones J, Compston DA, Coles A. Alemtuzumab treatment of multiple sclerosis: long-term safety and efficacy. J Neurol Neurosurg Psychiatry. 2015 Feb;86(2):208-15. doi: 10.1136/jnnp-2014-307721. Epub 2014 May 21. PMID: 24849515.
- Stamatellos VP, Rigas A, Stamoula E, Lallas A, Papadopoulou A, Papazisis G. S1P receptor modulators in Multiple Sclerosis: Detecting a potential skin cancer safety signal. Mult Scler Relat Disord. 2022 Mar;59:103681. doi: 10.1016/j.msard.2022.103681. Epub 2022 Feb 9. PMID: 35168096.
- Scappaticcio L, Castellana M, Virili C, Bellastella G, Centanni M, Cannavò S, Campennì A, Ruggeri RM, Giovanella L, Trimboli P. Alemtuzumab-induced thyroid events in multiple sclerosis: a systematic review and meta-analysis. J Endocrinol Invest. 2020 Feb;43(2):219-229. doi: 10.1007/s40618-019-01105-7. Epub 2019 Aug 26. PMID: 31452116.
- Shosha E, Casserly C, Tomkinson C, Morrow SA. Blood pressure changes during alemtuzumab infusion for multiple sclerosis patients. Eur J Neurol. 2021 Apr;28(4):1396-1400. doi: 10.1111/ene.14633. Epub 2020 Dec 5. PMID: 33175474.
- Sorensen PS. Antidrug Antibodies Against Biological Treatments for Multiple Sclerosis. CNS Drugs. 2022 Jun;36(6):569-589. doi: 10.1007/s40263-022-00920-6. Epub 2022 May 19. Erratum in: CNS Drugs. 2022 Aug;36(8):917. PMID: 35590041.
- Warny M, Helby J, Nordestgaard BG, Birgens H, Bojesen SE. Lymphopenia and risk of infection and infection-related death in 98,344 individuals from a prospective Danish population-based study. PLoS Med. 2018 Nov 1;15(11):e1002685. doi: 10.1371/journal.pmed.1002685. PMID: 30383787; PMCID: PMC6211632.
- Wotton CJ, Goldacre MJ. Risk of invasive pneumococcal disease in people admitted to hospital with selected immune-mediated diseases: record linkage cohort analyses. J Epidemiol Community Health. 2012 Dec;66(12):1177-81. doi: 10.1136/jech-2011-200168. Epub 2012 Apr 6. PMID: 22493476.
- Wijnands JMA, Zhu F, Kingwell E, Fisk JD, Evans C, Marrie RA, Zhao Y, Tremlett H. Disease-modifying drugs for multiple sclerosis and infection risk: a cohort study. J Neurol Neurosurg Psychiatry. 2018 Oct;89(10):1050-1056. doi: 10.1136/jnnp-2017-317493. Epub 2018 Mar 30. PMID: 29602795.
- Winkelmann, A., Loebermann, M., Reisinger, E. C., Hartung, H. P., & Zettl, U. K. (2016). Disease-modifying therapies and infectious risks in multiple sclerosis. Nature Reviews Neurology, 12(4), 217-233.
- van Rossum JA, van Kempen ZLE, Schilder L, Lissenberg-Witte BI, Uitdehaag B, Killestein J. Abnormalities and erythroblasts in peripheral blood of multiple sclerosis patients treated with natalizumab. Mult Scler Relat Disord. 2019 Nov;36:101382. doi: 10.1016/j.msard.2019.101382. Epub 2019 Sep 3. PMID: 31546224.
- Vikse, Jens et al. "Tolerability and safety of long-term rituximab treatment in systemic inflammatory and autoimmune diseases." Rheumatology international vol. 39,6 (2019): 1083-1090. doi:10.1007/s00296-019-04272-1
- Vinogradova Y, Hippisley-Cox J, Coupland C. Identification of new risk factors for pneumonia: population-based case-control study. Br J Gen Pract. 2009 Oct;59(567):e329-38. doi: 10.3399/bjgp09X472629. PMID: 19843413; PMCID: PMC2751937.
- Ziemssen T, Bass AD, Berkovich R, Comi G, Eichau S, Hobart J, Hunter SF, LaGanke C, Limmroth V, Pelletier D, Pozzilli C, Schippling S, Sousa L, Traboulsee A, Uitdehaag BMJ, Van Wijmeersch B, Choudhry Z, Daizadeh N, Singer BA; CARE-MS I, CARE-MS II, CAMMS03409, and TOPAZ investigators. Efficacy and Safety of Alemtuzumab Through 9 Years of Follow-up in Patients with Highly Active Disease: Post Hoc Analysis of CARE-MS I and II Patients in the TOPAZ Extension Study. CNS Drugs. 2020 Sep;34(9):973-988. doi: 10.1007/s40263-020-00749-x. PMID: 32710396; PMCID: PMC7447657.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de modules voor het addendum is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de indicatiestelling en monitoring van ziektemodulerende therapie bij mensen met MS (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Mevr. dr. B.A. de Jong, neuroloog, NVN (voorzitter)
- Mevr. B. Bakker, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. drs. R. Haenen, revalidatiearts, VRA
- Mevr. K. Harrison, verpleegkundig specialist, V&VN
- Dhr. drs. B.J.A. van Hoeve, neuroloog, NVN
- Mevr. dr. E. Hoitsma, neuroloog, NVN
- Dhr. prof. dr. J. Killestein, neuroloog, NVN
- Dhr. drs. J.B. Masselink, ziekenhuisapotheker, NVZA
- Dhr. dr. B. Moraal, radioloog, NVVR
- Dhr. dr. J. Mostert, neuroloog, NVN
- Dhr. dr. J. Murk, arts-microbioloog, NVMM
- Mevr. M. Pippel, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. dr. J. Smolders, neuroloog, NVN
- Dhr. dr. M.T. Wijburg, AIOS neurologie, NVN
- Mevr. Dr. A. Coumans, Gynaecoloog, NVOG
Met dank aan:
- Dhr. Dr. Ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog
- Mevr. dr. S. Huygens, gezondheidseconoom, Huygensandversteegh.com
- Dhr. dr. M. Versteegh, gezondheidseconoom, Huygensandversteegh.com
Met ondersteuning van:
- Mevr. dr. C.T.J. Michels, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
BelandenCie |
|
Bakker |
MS Patiënt vertegenwoordiger MSVN |
Functionel tester software Thunderbyte AI |
geen |
Geen restrictie |
|
Coumans |
Gynaecoloog |
Geen |
geen |
Geen restrictie |
|
De Jong (voorzitter) |
Functie: neuroloog |
Voorzitter commissie Addendum MS richtlijn van NVN (onbetaald). Voorzitter commissie MS registratie van NVN (onbetaald). Lid van wetenschappelijk adviesraad van Prinses Beatrixfonds (onbetaald) Lid van het PROMS initiative, onderdeel van Global MSIF Movement (onbetaald) |
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI*).
*TKI: Dit is een studie gesponsord door Sanofi, het gaat om een Bruton’s tyrosine kinase inhibitor: tolebrutinib (komt niet voor in richtlijn).
Dit zijn deels wel en niet persoonsgebonden subsidies (= deels contractonderzoek). Subsidies van instanties zoals MS research, ZonMw, hersenstichting zijn allemaal persoonsgebonden maar hierbij ik ben hierbij geen PI. Ik ben wel PI bij: - subsidie van ZN om onderzoek te doen met de landelijke MS registratie. - fase IV studie waarbij observationeel de kwaliteit en veiligheid van alemtuzumab (Sanofi Genzyme) gemonitord wordt (zit niet in adviesraad, krijg er geen geld voor). Studie gaat over post-surveillance en houdt geen relatie met indicatiestelling. - fase III studie naar tyrosine kinase inhibitors bij MS (dit middel staat niet in de richtlijn en komt naar verwachting niet op korte termijn op de markt).
Ontvangen onderzoekssubsidie van MS Vereniging Nederland in 2022: “Prevalentie van MS in Nederland” met een bedrag €60.167 Ontvangen onderzoekssubsidie van Stichting MS Research in 2016: "Improving cognitieve functioning among patients with multiple sclerosis by cognitive rehabilitation therapy or mindfulness based cognitive therapy: a dual-center, investigator-blinded, parallel group randomized controlled trial" met een bedrag van € 250.000.
|
Restrictie als TKIs ter sprake komt in een module. |
|
Haenen |
Functie: revalidatiearts |
Geen |
Geen |
Geen restrictie. |
|
Harrisson |
Functie: Verpleegkundig Specialist Werkgever: Tergooi ziekenhuis |
Richtlijn Revalidatie bij MS, vergoeding van gemaakte uren. |
Geen |
Geen restrictie. |
|
Hoitsma |
Functie: neuroloog |
Voorzitter landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
Betreft bij allen betaling onderzoeksactiviteiten. |
Geen restrictie. |
|
Killestein |
Functie: neuroloog (hoogleraar MS) |
Adviseur Springer Healthcare - Mednet Neurologie (betaald). Hoofdredacteur Tijdschrift voor Neurologie en Neurochirurgie (TNN), tot februari 2021, (betaald).
Voorzitter Horizonscan geneesmiddelen Zorginstituut Nederland. Werkgroep Neurologische aandoeningen inclusief gedrag (onbetaald). Lid Wetenschappelijke Adviesraad Stichting MS Research (onbetaald). Lid editorial board Neurology (onbetaald). Lid editorial board MS Journal (onbetaald).
|
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Immunic Therapeutics, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI)
1. Principle investigator NEXT-MS -natalizumab extended dosing bij MS -NCT04225312. Sponsor: Hersenstichting en Stichting MS Research. 2. Principle investigator DOT-MS - discontinuation of therapy in MS, NCT04260711- Sponsor: ZonMW en Stichting MS research 3. Principle investigator BLOOMS trial: efficacy, safety and cost-effectiveness of B cell tailored ocrelizumab versus standard ocrelizumab in RRMS - Sponsor: ZonMW en Treatmeds, moet nog starten. 4. Principle investigator Apps-MS studie - Sponsor: Stichting MS-Research en Health~Holland TKI. 5. Principle investigator Blood platelet-based liquid biopsies for optimization of diagnosis and treatment of patients with multiple sclerosis - Sponsor Merck. à Merck maakt medicatie die gebruikt wordt bij MS, Rebif en Mavencla. Betrfet onderzoek m.b.t. diagnostische biomarker (wel/geen MS). Geen enkele bemoeienis van Merck met de inhoud. 6. Deelname RELAMS - onderzoek naar relapses en pseudorelapses bij MS. 7. Deelname RAM-MS trial: Randomized Autologous heMatopoietic stem cell transplantation versus alemtuzumab, cladribine or ocrelizumab for patients with RRMS. EudraCT Number: 2017-001362-25 Sponsor: Stichting MS Research en Nationaal MS fonds. 8. Lid Steering Committee Ensemble trial Roche, vergoeding naar VUmc. 9. Lid Steering Committee Liberto trial Roche, vergoeding naar VUmc. 10. Lid Steering Committee NOVA trial Biogen, vergoeding naar VUmc. 11. Lid Adjudication Committee Immunic Calliper Phase II trial, vergoeding naar VUmc |
Geen restrictie. |
|
Masselink |
Functie: ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
Lid werkgroep neurologische aandoeningen (incl. gedrag) Horizonscan Geneesmiddelen, |
Geen |
Geen restrictie. |
|
Mostert |
Functie: neuroloog |
Lid hoofdredactieraad Tijdschrift voor Neurologie en Neurochirurgie (onbetaald).
Tot mei 2021: 1.5 jaar voorzitter en daarvoor 2 jaar secretaris van de landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
De financiering op contractbasis (per verrichting vergoeding). |
Bij wijzigingen, graag contact opnemen met belangencie (n.a.v. non-inferiority study) |
|
Murk |
Functie: arts-microbioloog Werkgever: Elisabeth-Tweesteden ziekenhuis Tilburg |
Redactielid tijdschrift infectieziekten (onbetaald)
Sectielid infectieziektenserologie SKML, coördinator rondzending H. pylori serologie (Nederlandse organisatie die externe kwaliteitsrondzendingen voor laboratoria organiseert) (onbetaald)
|
Ik werk als arts-microbioloog in vrije vestiging. Het verrichten van laboratoriumdiagnostiek is een onderdeel van de werkzaamheden waardoor een vrijgevestigde arts-microbioloog gefinancierd wordt. |
Geen restrictie. |
|
Pippel |
Functie: Gemeentesecretaris Werkgever: Gemeente Zandvoort |
Lid Adviesplatform MS vereniging |
Geen |
Geen restrictie. |
|
Smolders |
Neuroloog, 0.8 FTE afdeling Neurologie, Erasmus Medisch Centrum Rotterdam |
Bestuurslid MS werkgroep (onbetaald).
Kosteneffectiviteitsonderzoek MS in samenwerking met het bedrijf Huygens & Versteegh |
Onderzoek wordt gefinancierd door de MS research stichting (Voorschoten), het Nationaal MS fonds (Rotterdam) en de Erasmus Foundation (Rotterdam) Van de collectebusfondsen-studies ben ik PI. De bedrijven betreft onderzoeksprojecten met het centrum, waarbij ik niet als PI fungeer. Onderzoeksprojecten binnen MS centrum ErasMS worden gefinancierd door Merck (BTK inhibitor), Idorsia (preklinisch onderzoek compound), GSK (preklinisch onderzoek compound) en Roche (federated learning project).
In verleden:
|
Geen restrictie. |
|
Van Hoeve |
Functie: neuroloog Werkgever: ZorgSaam Zeeuws-Vlaanderen, Terneuzen |
Lid van MS zorg Zuid Zuid West, regionaal samenwerkingsverband tussen neurologen uit verschillende ziekenhuis, met MS als aandachtsgebied (onbetaald). |
April 2023: Binnenkort deelnemend centrum aan SPIN-P studie (gericht op o.a. etiologische/ prognostische factoren m.b.t. primair progressieve MS). Deelname Ectrims congres (oktober 2023) op uitnodiging Merck |
Geen restrictie. |
|
Wijburg |
Functie: AIOS Neurologie, Werkgever: Amsterdam UMC |
Geen |
Geen |
Geen restrictie.
|
|
Huygens (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
|
Versteegh (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) Editorial board member Medical Decision Making (onbetaald) Lid EuroQoL research foundation (onbetaald maar met vergoeding reiskosten en congresbezoek) Columnist NTvG (onbetaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de MS-patiënten Vereniging Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door twee afgevaardigden van de MS-patiënten Vereniging Nederland. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en MS-patiënten Vereniging Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met MS. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012; NVN, 2020) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen via een schriftelijke knelpunteninventarisatie. Een rapportage hiervan kan worden aangevraagd via de Richtlijnendatabase. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.