Voeding bij MS
Uitgangsvraag
Wat is de plaats van leefstijlinterventies die zijn gericht op voeding met betrekking tot de ziekteprogressie en het welbevinden van patiënten met MS?
Aanbeveling
Adviseer de patiënt om de richtlijn Gezonde voeding te volgen. Verwijs naar de volgende webpagina:
https://www.voedingscentrum.nl/nl/gezond-eten-met-de-schijf-van-vijf.aspx.
Vitamine D
Laat de vitamine D status bepalen bij aanvang van de behandeling/begeleiding. Suppleer de patiënt met vitamine D3 (5600iE/w) wanneer de vitamine D status lager is dan 75 nmol/l. Controleer na 3 tot 6 maanden de status opnieuw. Verhoog de dosering tot 2000-4000 IU/d indien het level nog niet toereikend is.
Bespreek de nadelen van vitamine D-deficiëntie.
Wahls en Jelinek
Bespreek de mogelijk nadelige effecten van Wahls of Jelinek diëten (en andere diëten), wanneer de patiënt aangeeft deze te willen volgen. Overweeg door te verwijzen naar een diëtist.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Omega-3 suppletie lijkt geen effect te hebben op ziekteprogressie gemeten op basis van het aantal nieuwe laesies bij patiënten met MS (lage bewijskracht). Ten aanzien van de Extended Disability Status Scale (EDSS)-score en aantal relapses is het effect onduidelijk. Het effect van vitamine D suppletie op de ziekteprogressie van patiënten met MS is eveneens onduidelijk vanwege de zeer lage bewijskracht. De gezamenlijke bewijskracht voor de cruciale uitkomstmaten voor zowel omega-3 of als vitamine D suppletie was zeer laag. De zeer lage bewijskracht werd voornamelijk veroorzaakt doordat veelal kleine studies werden uitgevoerd (omega-3, vitamine D) en/of door risk of bias (vitamine D). Er is dan ook behoefte aan kwalitatief goed opgezette studies met voldoende power.
Belangrijke uitkomstmaten als kwaliteit van leven en adverse events kunnen geen richting geven aan de klinische besluitvorming ten aanzien van omega-3 suppletie, vanwege eveneens lage bewijskracht. Ten aanzien van vitamine D suppletie lijkt er geen klinisch relevant verschil te zijn in adverse events (lage bewijskracht).
Hoewel er geen harde bewijzen zijn voor suppletie omega 3 en vitamine D, zullen de meeste patiënten met MS al gebaat zijn bij het volgen van de adviezen van de gezondheidsraad, vertaald in de richtlijn Gezonde voeding. Dan neemt de intake van omega 3 en vitamine D meestal toe. De ervaring van de werkgroep is dat patiënten met MS zich bij het opvolgen van deze richtlijn beter gaan voelen.
Ten aanzien van vitamine D is het belangrijk in ogenschouw te nemen dat vitamine D-deficiëntie op den duur botontkalking, osteoporose en/of spierzwakte kan veroorzaken. Bovendien heeft het invloed op het immuunsysteem. Dit geldt met name voor ouderen en mensen met een chronische ziekte (Holick, 2017).
Recente ervaringen van de werkgroepleden zijn dat er bij steeds meer chronische aandoeningen, denk hierbij aan onder andere diabetes type 2 en reuma, stemmen op gaan om de vitamine D status hoger te adviseren dan momenteel door de gezondheidsraad gedaan wordt. Voor ouderen wordt een waarde van ongeveer 75 nmol/l gezien als een goede waarde (Hupperts, 2019). Holick (2017) raadt een waarde van 100 nmol/l aan. Deze waarden zouden ook goed bruikbaar kunnen zijn voor patiënten met MS. De werkgroep is van mening dat een range van 75nmol/L-100nmol/L (zoals ook benoemd in het farmacotherapeutisch kompas) wellicht het beste level is. Wanneer uit onderzoek blijkt dat dit level lager is, start dan met vitamine D3 (bijvoorbeeld 5600 IE/w) en controleer het bloed nog een keer na 3-6 mnd. Houd hierbij rekening met seizoensfluctuaties. Als de range niet gehaald wordt, verhoog dan de dosering vitamine D3 suppletie (rond 2000-4000 IU/d).
Ten aanzien van Wahls en Jelinek diëten werd geen relevante literatuur gevonden die aan de gestelde kwaliteitseisen voldoet, waardoor geen conclusies over de effectiviteit van deze diëten getrokken konden worden. De werkgroepleden zijn niet bekend met positieve effecten van diëten op de lange termijn. In de praktijk zien we dat, als het gaat om leefstijlinterventies en voedingssupplementen, de meeste vragen betrekking hebben op de leefstijl van Wahls of Jelinek. Het Wahls dieet gaat uit van wat mensen aten in de oertijd, ook wel bekend als het paleodieet. Het is meer dan een dieet, namelijk een leefstijl waarbij onder andere ook beweging, stress management en de hoeveelheid gifstoffen in het lichaam een rol spelen. Nadelen wat betreft deze leefstijl zijn onder andere de verkrijgbaarheid en de hogere kosten. Er wordt veel gebruik gemaakt van biologisch (orgaan)vlees van gras gevoerd vee. Voordelen zijn onder andere dat de patiënt het initiatief neemt en hierdoor zelf aan het stuur staat. De grote hoeveelheden groenten en fruit passen binnen een gezond voedingspatroon.
Het Jelinek dieet gaat uit van het gedachtengoed van Swank. Swank (1987) beschreef dat bij patiënten met MS die bijna geen dierlijke producten gebruikten, de voortgang van de ziekte werd geremd. In aanvulling op dit dieet betreft Jelinek een leefstijl waarbij onder andere ook vitamine D, beweging, medicatie en meditatie een rol spelen. Nadelen wat betreft deze leefstijl zijn onder andere de verkrijgbaarheid van producten en de hogere kosten. Bovendien is er een verhoogd risico op ondervoeding. Voordelen zijn onder andere dat de patiënt het initiatief neemt en hierdoor zelf aan het stuur staat. De grote hoeveelheden groenten en fruit passen binnen een gezond voedingspatroon.
Ten aanzien van andere diëten ontvangt de werkgroep nauwelijks vragen. De werkgroep kent geen positieve effecten van deze diëten ten aanzien van het ziekteverloop MS. Mocht de patiënt een dieet willen volgen dat niet direct aansluit bij het advies van de gezondheidsraad, dan kan een diëtist adviseren over de voor- en nadelen van deze diëten.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor de patiënt zelf is het belangrijk het idee te hebben dat hij/ zij zelf iets kan doen (weer aan het stuur gaan staan van zijn eigen leven). Dit geldt voor de leefstijlinterventies Vit. D3, Omega 3-6, MS-anders/Voeding leeft, de voedingswijze volgens Wahls en Jelinek.
Zowel de leefwijze van Wahls als die van Jelinek schetsen het beeld dat MS tot stilstand kan worden gebracht of dat de patiënt kan worden genezen. Deze bewering kan echter niet worden gestaafd met bewijskracht. Patiënten nemen hoge kosten, ondanks beperkte financiële middelen, en nadelen van de interventie voor lief/zijn zich niet bewust van de nadelen van de interventie.
Kosten (middelenbeslag)
De kosten voor suppletie van omega-3 en vitamine D suppletie zijn laag. Er worden geen bijwerkingen verwacht die zullen leiden tot hoge kosten van de gezondheidszorg, mits er geen overdosering plaatsvindt.
Er bestaan wel kosten ten aanzien van de vitamine D bepaling. Deze worden doorgaans vergoed door de zorgverzekeraar. De werkgroep is van mening dat deze kosten opwegen tegen de nadelige gevolgen van een vitamine D deficiëntie.
Ten aanzien van Wahls en Jelinek dienen vaak dure levensmiddelen te worden aangeschaft, terwijl de effectiviteit hiervan niet is bewezen. Deze middelen worden niet vergoed door de zorgverzekeraar. Daarnaast kunnen eventuele bijwerkingen zoals ondergewicht leiden tot hogere kosten voor de gezondheidzorg.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie die van invloed zijn op de besluitvorming.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In de literatuur is onvoldoende bewijs dat de leefstijl interventie voeding bijdraagt aan het stoppen of genezen van de MS. Voedingsadviezen gebaseerd op de richtlijn ‘Gezonde voeding’ hebben een positief effect op de gezondheidsstatus van mensen. Patiënten willen wel graag zelf iets aan hun ziekte doen, dit geeft ze het gevoel zelf aan het roer te staan. Er zijn geen nadelen op kosten en haalbaarheid te verwachten wanneer de richtlijn Gezonde voeding gevolgd wordt.
Nadelen van diëten die niet voldoen aan de richtlijn Gezonde Voeding zullen besproken moeten worden, om mogelijk nadelige gevolgen te beperken. Mensen met een chronische ziekte waarvoor geen genezing mogelijk is zullen wel eerder openstaan voor interventies die binnen een kleine doelgroep worden gebruikt en waar geen wetenschappelijk bewijs voor is.
De werkgroep raadt de algemene adviezen van de Gezondheidsraad vertaald in de richtlijn Gezonde voeding aan. Ook mensen met een lager budget kunnen gezonde producten kopen.
Vitamine D
Ten aanzien van vitamine D is de werkgroep van mening dat vitamine D-deficiëntie tegen moet worden gegaan, om de nadelige gevolgen van een vitamine D tekort tegen te gaan.
De werkgroep is van mening, analoog aan Hupperts (2019), dat er een streefwaarde van 75 dient te worden aangehouden en vitamine D suppletie dient te worden toegepast wanneer dit level niet gehaald wordt.
Wahls en Jelinek
De werkgroep is van mening dat in eerste instantie de adviezen van de gezondheidsraad opgevolgd dienen te worden. Omdat er geen bewijs is voor de effectiviteit van Wahls en Jelinek diëten, worden deze niet vanzelfsprekend aanbevolen. Er zijn echter ook geen grote nadelige effecten, met uitzondering van het risico op ondervoeding. De werkgroep acht het belangrijk de patiënt hiervoor te waarschuwen, zodat ondervoeding wordt voorkomen. Een diëtist kan hierin adviseren.
Onderbouwing
Achtergrond
In de behandeling van patiënten met MS wordt regelmatig gebruik gemaakt van verschillende leefstijlinterventies t.a.v. voeding. Daarbij kan onder andere worden gedacht aan voedingsinterventies en voedingssupplementen. De precieze invulling van de leefstijlinterventies die worden ingezet varieert sterk op basis van individuele behandelvoorkeuren van patiënten en behandelaars. Er is in het veld behoefte aan eenduidige aanbevelingen.
Er is de laatste jaren veel aandacht voor vitamine D en omega-3 in relatie tot MS. Daarnaast is er in deze module voor gekozen om Wahls en Jelinek verder te onderzoeken. Het Wahls dieet is grotendeels gebaseerd op het paleodieet, ook wel oerdieet, oerdis, OERsterk genoemd. Het betreft geen afvaldieet, maar een manier van eten, gebaseerd op de overtuiging dat onze voorouders vlees, vis, groente, fruit en noten aten. Het Jelinek dieet richt zich op laag vetgehalte dat daarnaast extreem laag verzadigd vet betreft. De focus in deze module is met name op Wahls en Jelinek diëten gelegd, omdat er in de praktijk vooral vragen zijn over deze leefstijlen. Verder wekken Wahls en Jelinek de indruk dat er een wetenschappelijke onderbouwing is voor deze leefstijlinterventies. Ook ten aanzien van Stichting MS-Anders in samenwerking met Voeding Leeft bestaan er veel vragen. Er is echter nog geen onderzoek beschikbaar dat een positief effect bevestigt.
Naar het gebruik van andere leefstijlinterventies en voedingssupplementen is vanwege de diversiteit en voorkeur per persoon geen onderzoek verricht. Individueel kunnen verschillende leefstijlinterventies en het gebruik van voedingssupplementen succesvol zijn. De vraag is echter of dit toepasbaar is voor een grote populatie patiënten met MS. Het is vooral van belang dat mensen kiezen wat in hun leven past.
Conclusies / Summary of Findings
Zoekvraag 1: Omega-3 suppletie
1. Ziekteprogressie (cruciale uitkomstmaat)
|
Laag GRADE |
Er lijkt geen klinisch relevant effect te zijn van suppletie van omega-3 vetzuren op ziekteprogressie bij MS, zoals gemeten met MRI (aantal laesies).
Bronnen: (Torkildsen, 2012) |
|
Laag GRADE |
Er lijkt geen klinisch relevant effect te zijn van suppletie van omega-3 vetzuren op ziekteprogressie bij MS, zoals gemeten met de Extended Disability Status Scale (EDSS).
Bronnen: (Sedighiyan, 2019) |
|
Laag GRADE |
Er lijkt geen klinisch relevant effect te zijn van suppletie van omega-3 vetzuren op ziekteprogressie bij MS, zoals gemeten op basis van het aantal relapses.
Bronnen: (Ramirez, 2013; Torkildsen, 2012) |
2-3. Urineweginfecties en bristol-stool-chart (belangrijke uitkomstmaten)
|
- GRADE |
Er zijn geen studies gevonden die gaan over de suppletie van omega-3 vetzuren op urineweginfecties en bristol-stool-charts bij patiënten met MS. |
4. Kwaliteit van leven (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of suppletie van omega-3 vetzuren een effect heeft op de kwaliteit van leven.
Bronnen: (Torkildsen, 2012) |
5. Adverse events (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of suppletie van omega-3 vetzuren een effect heeft op het voorkomen van adverse events.
Bronnen: (Ramirez, 2013, Torkildsen, 2012; Zandi, 2017) |
Zoekvraag 2: Vitamine D suppletie
1. Ziekteprogressie (cruciale uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of vitamine D suppletie een effect heeft op de ontwikkeling van het aantal laesies bij patiënten met MS.
Bronnen: (Jagannath 2018, Camu, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of vitamine D suppletie een effect heeft op de Extended Disability Status Scale (EDSS)-score bij patiënten met MS.
Bronnen: (Jagannath 2018, Camu, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of vitamine D suppletie een effect heeft op het aantal relapses bij patiënten met MS.
Bronnen: (Jagannath 2018, Camu, 2019) |
2-3. Urineweginfecties en bristol-stool-chart (belangrijke uitkomstmaten)
|
- GRADE |
Er is geen literatuur gevonden waaruit conclusies kunnen worden getrokken ten aanzien van het effect van vitamine D suppletie op urineweginfecties of de Bristol-Stool-chart. |
4. Kwaliteit van leven (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of vitamine D suppletie een effect heeft op de kwaliteit van leven binnen patiënten met MS.
Bronnen: (Jagannath 2018, Camu, 2019) |
5. Adverse events (belangrijke uitkomstmaat)
|
Laag GRADE |
Er lijkt geen klinisch relevant effect te zijn van vitamine D op het aantal adverse events bij patiënten met MS.
Bronnen: (Jagannath 2018, Camu, 2019) |
Zoekvraag 3: Dieet volgens Wahls of Jelinek
|
- GRADE |
Er zijn geen studies gevonden die gaan over de effectiviteit van een dieet volgens Wahls of Jelinek op ziekteprogressie (MRI-laesies, Extended Disability Status Scale (EDSS), aantal relapses), kwaliteit van leven of adverse events bij patiënten met MS. |
Samenvatting literatuur
Zoekvraag 1: Omega-3 suppletie
Beschrijving studies
Er werd één systematische review geselecteerd waarin vier RCT’s worden beschreven waarin het effect van Omega-3 (of visolie) op de EDSS-score van patiënten met MS ten opzichte van ‘placebo’ wordt gerapporteerd (n=209) (Sedighiyan, 2019). In de vier geïncludeerde studies wordt in de interventieconditie zowel EPA (eicosapentaeenzuur) als DHA (docosahexaeenzuur) gegeven, maar de doseringen verschillen. Deze lopen uiteen van 180 mg/d EPA tot 1980 mg/d EPA en van 120 mg/d DHA tot 1600 mg/d DHA. De studieduur varieert van 12 maanden tot 24 maanden.
In de placebogroepen wordt gebruik gemaakt van zonnebloemolie (Ramirez-Ramirez, 2013; Zandi-Esfahan, 2017) of maisolie (Torkildsen, 2012), zijnde omega-6. Hoewel dit geen zuiver placebo betreft, zijn deze studies toch geïncludeerd vanwege een gebrek aan studies met een zuiver placebo. De studie van Weinstock-Guttman (2005) wordt niet meegenomen in deze literatuursamenvatting, omdat deze niet alleen van olijfolie (omega-9) gebruik maakt in de placebogroep, maar deze tevens combineert met een 30% vet dieet, terwijl in interventiegroep omega-3 wordt gecombineerd met een 15% vet dieet. Hierdoor kan het effect van omega-3 ten opzichte van omega-6 of -9 niet zuiver worden gemeten.
Resultaten
1. Ziekteprogressie (cruciale uitkomstmaat)
Ziekteprogressie op basis van MRI (aantal laesies)
De systematische review van Sedighiyan (2019) rapporteert de uitkomstmaat aantal laesies niet. In Torkildsen (2012) wordt deze uitkomstmaat wel onderzocht in 88 patiënten. Er werd geen significant verschil gevonden tussen de interventie- en placebogroep na zes maanden (interventiegroep: aantal laesies=3 (range 0-41); controlegroep: aantal laesies=2 (range 0-44)) en 24 (verschillen niet gerapporteerd) maanden. Het verschil van één T1 laesie (95% CI niet bekend) werd ook niet klinisch relevant geacht.
Ziekteprogressie op basis van Extended Disability Status Scale (EDSS)
In de systematische review van Sedighiyan (2019) worden studies gepoold in een meta-analyse (figuur 1). Deze is door de werkgroep opnieuw uitgevoerd vanwege de exclusie van Weinstock-Guttman (2005). Uit de meta-analyse blijkt dat er geen verschil is in verandering in EDSS-score tussen suppletie met omega-3 en suppletie met omega 6 (standardized mean difference -0,03; 95% betrouwbaarheidsinterval -0,32 tot 0,26).
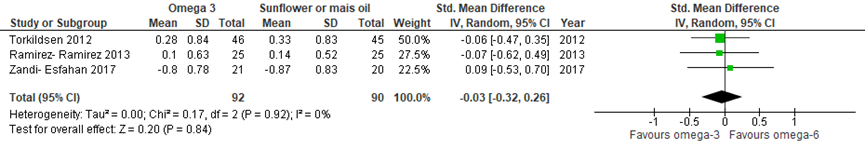
Figuur 1 meta-analyse omega-3 suppletie versus placebo (omega-6)
Ziekteprogressie op basis van aantal relapses
De systematische review van Sedighiyan (2019) rapporteert de uitkomstmaat aantal relapses niet. In Torkildsen (2012) en Ramirez (2013) wordt deze uitkomstmaat wel onderzocht. Torkildsen (2012, n=86) rapporteerde geen significant verschil relapse rate (rate niet gerapporteerd). Ramirez (2013, n=50) rapporteerde een annualized relapse rate van 0,84 ± 0,94 in de interventiegroep en 1 ± 1 in de controlegroep (verschil: 0,16 SD in voordeel van interventiegroep). Dit verschil was niet significant en de werkgroep achtte dit verschil ook niet klinisch relevant.
2. Urineweginfecties (belangrijke uitkomstmaat)
Er is geen literatuur gevonden ten aanzien van de uitkomstmaat urineweginfecties.
3. Bristol-Stool-chart (belangrijke uitkomstmaat)
Er is geen literatuur gevonden ten aanzien van de uitkomstmaat Bristol-Stool-chart.
4. Kwaliteit van leven (belangrijke uitkomstmaat)
De systematische review van Sedighiyan (2019) rapporteert de uitkomstmaat kwaliteit van leven niet. In Torkildsen (2012) wordt deze uitkomstmaat wel onderzocht maar de studie rapporteert geen effectmaat voor het verschil tussen de groepen. Daardoor kan de klinische relevantie niet worden bepaald. Zij rapporteerden alleen dat er geen significant verschil is tussen de groepen. Het aantal patiënten dat wordt meegenomen in deze analyse is niet gerapporteerd.
5. Adverse events
De systematische review van Sedighiyan (2019) rapporteert de uitkomstmaat adverse events niet. In de studies van Torkildsen (2012), Ramirez (2013) en Zandi-Esfahan (2017) wordt deze uitkomstmaat wel onderzocht. De resultaten zijn opgenomen in de meta-analyse in figuur 2. Uit de meta-analyse blijkt dat er geen significant en geen klinisch relevant verschil is in het aantal patiënten met een adverse event voor de groepen (risk difference 0,01; 95% betrouwbaarheidsinterval -0,08 tot 0,10).
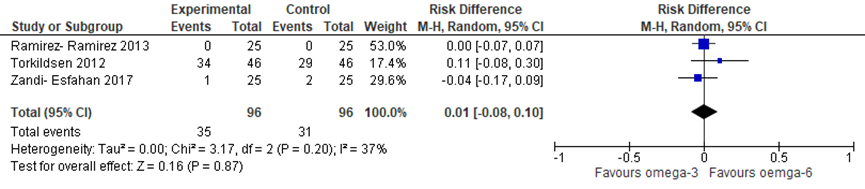
Figuur 2 meta-analyse omega-3 suppletie versus placebo (omega-6)
Bewijskracht
1. Ziekteprogressie (cruciale uitkomstmaat)
De bewijskracht is gebaseerd op gerandomiseerd onderzoek en start hoog. De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van MRI is met twee niveaus verlaagd naar laag: één niveau omdat de gebruikte placebo’s in de beschikbare studies mogelijk werkzame componenten bevatten die geen onderdeel zijn van gebruikelijke zorg (bias ten gevolge van indirectheid) en één niveau vanwege het geringe aantal studies met een klein patiënten aantal.
De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van EDSS is verlaagd naar laag vanwege beperkingen in de onderzoeksopzet: de gebruikte placebocondities in de beschikbare studies mogelijk werkzame componenten bevatten die geen onderdeel zijn van gebruikelijke zorg (bias ten gevolge van indirectheid, één niveau); en vanwege het geringe aantal patiënten (imprecisie, één niveau).
De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van aantal relapses is verlaagd naar laag; één niveau, omdat de gebruikte placebocondities in de beschikbare studies mogelijk werkzame componenten bevatten die geen onderdeel zijn van gebruikelijke zorg (bias ten gevolge van indirectheid); één niveau vanwege het geringe aantal studies met een klein patiënten aantal (imprecisie).
2-3. Urineweginfecties en bristol-stool-chart (belangrijke uitkomstmaten)
De bewijskracht voor de uitkomstmaten urineweginfecties en bristol-stool-chart kan niet worden gegradeerd wegens het ontbreken van studies.
4. Kwaliteit van leven (belangrijke uitkomstmaat)
De bewijskracht voor de uitkomstmaat kwaliteit van leven is verlaagd naar zeer laag: één niveau, omdat de gebruikte placebocondities in de beschikbare studies mogelijk werkzame componenten bevatten die geen onderdeel zijn van gebruikelijke zorg (bias t.g.v. indirectheid); daarnaast is met twee niveaus verlaagd vanwege het geringe aantal studies met een klein patiënten aantal en de onvolledige rapportage van resultaten (imprecisie).
5. Adverse events (belangrijke uitkomstmaat)
De bewijskracht is gebaseerd op gerandomiseerd onderzoek en start hoog. De bewijskracht voor de uitkomstmaat adverse events is verlaagd naar zeer laag vanwege beperkingen in de onderzoeksopzet: de gebruikte placebocondities in de beschikbare studies mogelijk werkzame componenten bevatten die geen onderdeel zijn van gebruikelijke zorg (bias t.g.v. indirectheid, één niveau); inconsistentie in de studieresultaten (één niveau) en vanwege geringe aantallen (imprecisie, één niveau).
Zoekvraag 2: Vitamine D suppletie
Beschrijving studies
Er werd één systematische review geselecteerd waarin twaalf RCT’s worden beschreven waarin het effect van vitamine D suppletie op de ziekteprogressie, kwaliteit van leven en adverse events van patiënten met MS ten opzichte van ‘placebo’ wordt beschreven (Jagannath, 2018). Zes van de geïncludeerde RCT’s (merk op dat geïncludeerde data uit het trial register (Hupperts,2016) later zijn gepubliceerd als Hupperts (2019), welke werd geïncludeerd naar aanleiding van de beschreven search) voldoen aan de inclusiecriteria voor deze module zoals hierboven beschreven. Vitamine D werd al dan niet in combinatie met calcium of interferon bèta-1b of interferon bèta-1a gegeven. De doseringen van vitamine D3 variëren van 10 IU per dag tot 50.000 per 5 dagen. De studieduur varieert van zes maanden tot 96 weken.
Niet elke studie geeft aan uit welke stoffen de placebo tabletten en capsules bestaan, maar in zowel de placeboconditie als in de interventieconditie van de verschillende geïncludeerde studies wordt in sommige gevallen gebruik gemaakt van notenolie. Deze oliën bestaan voor een groot deel uit omega-6 of -9 vetzuren, welke door verschillende studies als placebo-middelen werden gezien (zie ook omega-3).
Aanvullend op de systematic review werd één RCT’s geselecteerd. Camu (2019) onderzocht het effect van 7143 IU vitamine D suppletie per dag op ziekteprogressie, kwaliteit van leven en adverse events ten opzichte van placebo in 129 patiënten met MS die ook interferon bèta-1a kregen toegediend. Het percentage drop-outs in deze studie was groot.
Resultaten
1. Ziekteprogressie (cruciale uitkomstmaat)
Ziekteprogressie op basis van MRI (aantal laesies)
De systematische review van Jagannath (2018) rapporteert de uitkomstmaat aantal nieuwe T1 laesies aan de hand van Hupperts (2019) en Soilu-Hanninen (2012) na ruim 1 jaar vitamine D suppletie. Deze resultaten zijn hieronder gepooled (zie figuur 3) en aangevuld met de resultaten van Camu (2019), die de effecten van vitamine D suppletie op T1 laesies na 2 jaar (96 weken) mat. Er werd geen statistisch significant, danwel klinisch relevant verschil gevonden tussen de interventie- en placebogroep (SMD: -0.21 (95%CI -0.61, 0.18).
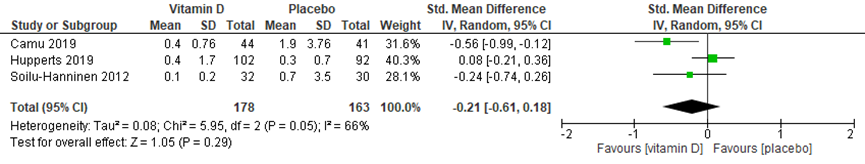
Figuur 3 meta-analyse vitamine D suppletie versus placebo
Ten aanzien van T2 laesies rapporteert Jagannath (2018) geen data. Camu (2020) rapporteert dat er geen significant verschil is in de rate ratio, hoewel op basis van de gerapporteerde data in het trial register wel een statistisch significant (maar niet klinisch relevant: -0,32 SD ten opzichte van de placebogroep) verschil wordt gevonden in aantal nieuw T2 laesies (MD: -1,50 (95%CI: -2,96, -0,04)).
Ziekteprogressie op basis van Extended Disability Status Scale (EDSS)
De systematische review van Jagannath (2018) rapporteert de uitkomstmaat EDSS-score na 26, 52 en 96 weken aan de hand van Achiron (2015), Shaygannejad (2012), Soilu-Hanninen (2012) en Kampman (2012). Camu (2019) rapporteerde de progressie in EDSS-score na 96 weken (interventiegroep: -0.06±0.78; controlegroep: 0.32±0.87; n=onduidelijk; verschil betreft -0.44SD ten opzichte van de placebogroep in het voordeel van de interventiegroep), maar rapporteerde zowel de post-interventie EDSS als het aantal patiënten dat in deze analyse waren meegenomen niet, waardoor deze resultaten niet konden worden meegenomen in de meta-analyse (zie figuur 4). Er werd geen significant, danwel klinisch relevant verschil gevonden tussen de interventie- en placebogroep (SMD: -0.21 (95%CI -0.11, 0.53). Ook voor de individuele meetmomenten werden de verschillen tussen de groepen niet klinisch relevant geacht.
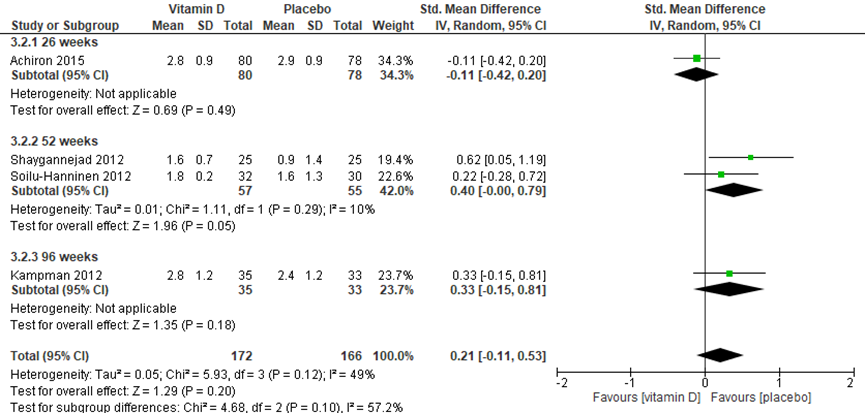
Figuur 4 meta-analyse vitamine D suppletie versus placebo
Ziekteprogressie op basis van aantal relapses
De systematische review van Jagannath (2018) rapporteert de uitkomstmaat annualized relapse rate na 52 en 96 weken aan de hand van Hupperts (2019), Shaygannejad (2012), Soilu-Hanninen (2012) en Kampman (2012). De resultaten zijn hieronder gepooled (figuur 5) en aangevuld met de resultaten van Camu (2019), die de effecten van vitamine D suppletie op de jaarlijkse relapse rate na twee jaar (96 weken) mat. Er werd geen significant, danwel klinisch relevant verschil gevonden tussen de interventie- en placebogroep (RD: -0.04 (95%CI -0.13, 0.05). Deze conclusie kan ook getrokken worden indien beide meetmomenten afzonderlijk worden onderzocht.
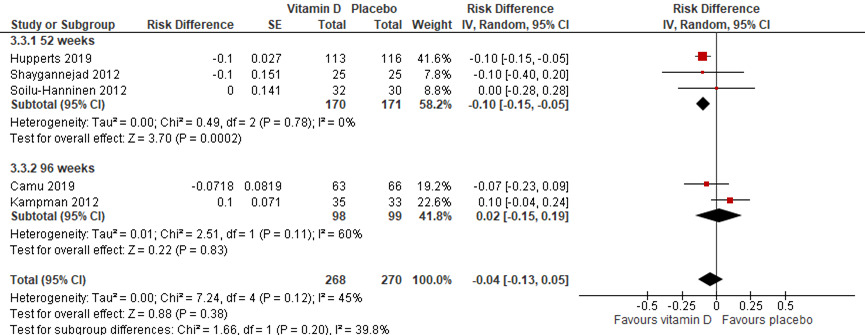
Figuur 5 meta-analyse vitamine D suppletie versus placebo
2. Urineweginfecties (belangrijke uitkomstmaat)
Er is geen literatuur gevonden ten aanzien van de uitkomstmaat urineweginfecties. Hierdoor kunnen geen resultaten beschreven worden en kan geen bewijskracht bepaald worden.
3. Bristol-Stool-chart (belangrijke uitkomstmaat)
Er is geen literatuur gevonden ten aanzien van de uitkomstmaat Bristol-Stool-chart. Hierdoor kunnen geen resultaten beschreven worden en kan geen bewijskracht bepaald worden.
4. Kwaliteit van leven (belangrijke uitkomstmaat)
De systematische review van Jagannath (2018) rapporteert de uitkomstmaat kwaliteit van leven na respectievelijk zes en drie maanden behandeling aan de hand van Ashtari (2016) en Achiron (2015). Deze studies rapporteren de kwaliteit van leven op verschillende domeinen aan de hand van Multiple Sclerosis Quality of Life (MSQOL-54) en de RAYS vragenlijst. Naast Jagannath (2018) rapporteert Camu (2019) de kwaliteit van leven aan de hand van de EuroQol EQ-5D-3L na 96 weken. Jagannath (2018) achtte de in de review opgenomen data niet geschikt om een meta-analyse uit te voeren. Omdat Camu (2019) geen effectmaten rapporteerde, is ook in deze literatuursamenvatting geen meta-analyse opgenomen. De verschillen ten opzichte van de standaarddeviaties zijn opgenomen in tabel 1. Achiron (2015) rapporteerde dat vitamine D suppletie geen effect heeft op de psychosociale en sociale componenten van kwaliteit van leven, maar wel op de fysieke component. Ashtari (2016) en Camu (2019) rapporteert geen verschillen op verschillende domeinen of de totale score van kwaliteit van leven. Op basis van de gerapporteerde data worden de verschillen niet klinisch relevant geacht.
Tabel 1 Overzicht resultaten vitamine D suppletie versus placebo
|
|
Vitamine D: n |
Vitamine D: mean (SD) |
Placebo: |
Placebo: |
Verschil in aantal SDs |
|
Ashtari 2016 – QOL (Physical) |
47 |
71,7 (13,5) |
47 |
69,6 (17,2) |
0,12 |
|
Ashtari 2016 – MSQOL (Mental) |
47 |
62,4 (14) |
47 |
61 (18) |
0,08 |
|
Ashtari 2016 – MSQOL (sexual satisfaction |
47 |
70,8 (33,5) |
47 |
76,1 (28,3) |
-0,19 |
|
Ashtari 2016 – MSQOL (health change) |
47 |
75,7 (25,7) |
47 |
70,6 (26,5) |
0,19 |
|
Achiron 2015 – RAYS Physical |
80 |
13,9 (104,5) |
78 |
7,2 (104,5) |
0,06 |
|
Ashiron 2015 – RAYS Psychological |
80 |
27,2 (69,3) |
78 |
3,5 (69,3) |
0,34 |
|
Ashiron 2015 – RAYS Social |
80 |
31,5 (52,1) |
78 |
14,6 (52,1) |
0,32 |
|
Camu 2019 – EQ-5D-3L |
Not reported |
Not reported |
Not reported |
Not reported |
Not applicable |
Adverse events
De systematische review van Jagannath (2018) rapporteert serious en minor adverse events aan de hand van Achiron (2015), Hupperts (2019), Shaygannejad (2012), Soilu-Hanninen (2012) en Kampman (2012) na vitamine D suppletie. Deze resultaten zijn hieronder gepooled en aangevuld met de resultaten van Camu (2019), die grote adverse events rapporteert na vitamine D suppletie. Er werd geen significant, danwel klinisch relevant verschil gevonden tussen de interventie- en placebogroep (grote adverse events: RD: -0,2 (95%CI -0,04, 0,07); kleine adverse events (RD: 0,03 (95%CI -0,04, 0,07).
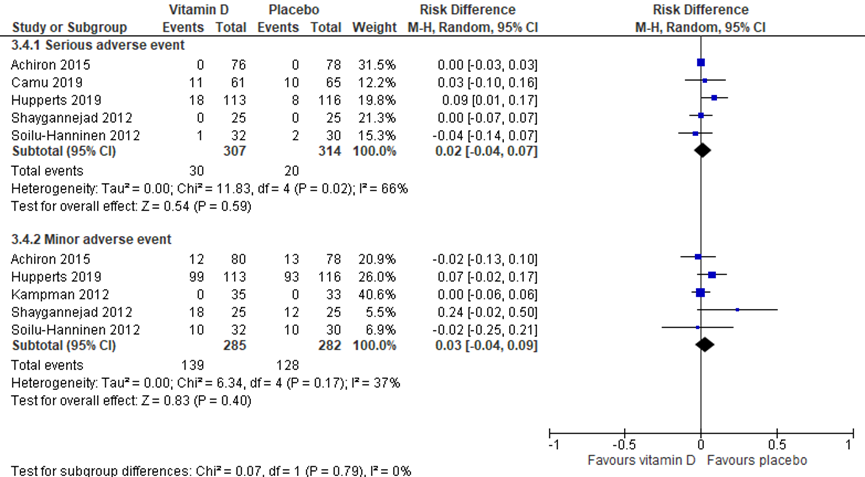
Figuur 6 meta-analyse vitamine D suppletie versus placebo
Bewijskracht
1. Ziekteprogressie (cruciale uitkomstmaat)
De bewijskracht is gebaseerd op gerandomiseerd onderzoek en start hoog. De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van MRI is verlaagd naar zeer laag vanwege beperkingen in de onderzoeksopzet: twee niveaus vanwege risk of bias (zie voor specificatie de risk of bias tabellen en Jagannath (2018)); één niveau vanwege inconsistentie, en één niveau vanwege het kleine aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van EDSS is verlaagd naar zeer laag vanwege beperkingen in de onderzoeksopzet: twee niveaus vanwege risk of bias (zie voor specificatie de risk of bias tabellen en Jagannath (2018)); één niveau vanwege inconsistentie (met name ten aanzien van de uitkomst op 52 weken) en één niveau vanwege de imprecisie.
De bewijskracht voor de uitkomstmaat ziekteprogressie op basis van aantal relapses is verlaagd naar zeer laag vanwege beperkingen in de onderzoeksopzet: twee niveaus vanwege risk of bias (zie voor specificatie de risk of bias tabellen en Jagannath (2018)); één niveau vanwege inconsistentie.
2-3. Urineweginfecties en bristol-stool-chart (belangrijke uitkomstmaten)
De bewijskracht voor de uitkomstmaten urineweginfecties en bristol-stool-chart kan niet worden gegradeerd wegens het ontbreken van studies.
4. Kwaliteit van leven (belangrijke uitkomstmaat)
De bewijskracht voor de uitkomstmaat kwaliteit van leven is verlaagd naar zeer laag vanwege beperkingen in de onderzoeksopzet: twee niveaus vanwege risk of bias (zie voor specificatie de risk of bias tabellen en Jagannath (2018)); één niveau vanwege inconsistentie ten aanzien van het psychologische domein en met één niveau verlaagd vanwege het kleine aantal studies met kleine patiëntaantallen.
5. Adverse events (belangrijke uitkomstmaat)
De bewijskracht voor de uitkomstmaat adverse events is verlaagd naar laag vanwege beperkingen in de onderzoeksopzet: één niveau vanwege risk of bias (zie voor specificatie de risk of bias tabellen en Jagannath (2018)); één niveau vanwege imprecisie in verband met kleine patiëntaantallen.
Zoekvraag 3: Dieet volgens Wahls of Jelinek
Geen enkele studie voldeed aan de inclusiecriteria.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is ervoor gekozen een systematische literatuuranalyse te verrichten naar de effectiviteit van voedingssupplementen (omega-3 en vitamine D) en voedingsinterventies (Wahls en Jelinek) bij de behandeling van MS. Deze keuze is gebaseerd op de verwachting dat er alleen voor deze interventies voldoende homogene studies zijn uitgevoerd om conclusies op te kunnen baseren. Voor de systematische literatuuranalyse zijn de volgende zoekvragen opgesteld:
Deelvraag 1
Wat is de waarde/effectiviteit van omega-3 suppletie bij patiënten met MS?
P: patiënten met MS;
I: voedingsinterventie: omega-3 suppletie;
C: standaard zorg / placebo;
O: ziekteprogressie zoals bepaald met MRI (laesies) of Extended Disability Status Scale (EDSS), of uitgedrukt als het aantal relapses per jaar, urineweginfecties, Bristol-Stool-chart, kwaliteit van leven, adverse events.
Deelvraag 2:
Wat is de waarde/effectiviteit van vitamine D suppletie bij patiënten met MS?
P: patiënten met MS;
I: voedingsinterventie: vitamine D suppletie;
C: standaard zorg / Placebo;
O: ziekteprogressie zoals bepaald met MRI (laesies) of EDSS, of uitgedrukt als het aantal relapses per jaar, urineweginfecties, Bristol-Stool-chart, kwaliteit van leven, adverse events.
Deelvraag 3
Wat is de waarde/effectiviteit van een Wahls of Jelinek dieet bij patiënten met MS?
P: patiënten met MS;
I: voedingsinterventie: Wahls/ Jelinek dieet;
C: standaard zorg / Placebo;
O: ziekteprogressie zoals bepaald met MRI (laesies) of EDSS, of uitgedrukt als het aantal relapses per jaar, urineweginfecties, Bristol-Stool-chart, kwaliteit van leven, adverse events.
Relevante uitkomstmaten
Cruciale uitkomstmaten waren ziekteprogressie (zoals bepaald met MRI, EDSS of uitgedrukt als aantal relapses per jaar). Belangrijke uitkomstmaten waren incidentie van urineweginfecties, stoelgangkwaliteit zoals gemeten met de Bristol-Stool-Chart, kwaliteit van leven en bijwerkingen (adverse events).
De werkgroep definieerde een verschil van 0,5 standardized mean difference (SMD), danwel een risk difference van 5% tussen de groepen als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Ten aanzien van bovenstaande PICO’s zijn drie searches uitgevoerd.
1) In de databases Medline (via OVID) en Embase (via Embase.com) is op 27 augustus 2019 met relevante zoektermen gezocht naar systematische reviews en RCT’s ten aanzien van omega-3 suppletie en Wahls-diëten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 480 treffers op.
2) In aanvulling op de systematische review van Jagannath (2018) is in de databases Medline (via OVID) en Embase (via Embase.com) op 27 augustus 2019 met relevante zoektermen gezocht naar systematische reviews en RCT’s ten aanzien van vitamine D suppletie gezocht met een publicatiedatum van 2017 of later. De literatuurzoekactie leverde 127 treffers op.
3) In de databases Medline (via OVID) en Embase (via Embase.com) is op 27 augustus 2019 met relevante zoektermen gezocht naar systematische reviews en RCT’s ten aanzien van Jelinek-diëten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde geen treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
- De studiepopulatie bestaat uit mensen met vastgestelde MS, minimaal 10 per arm.
- Orale suppletie van vitamine D, orale suppletie van omega-3 (waaronder visolie), of het Jelinek of Wahls dieet (bij naam genoemd).
- De onderzochte interventie wordt vergeleken met placebo, gebruikelijke zorg of geen behandeling.
- Het betreft een randomized controlled trial of een systematische review daarvan.
Op basis van titel en abstract werden in eerste instantie 96 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 85 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en elf studies geïncludeerd. Dit betrof één systematische review en drie RCT’s (ook geïncludeerd in het review) gerelateerd aan omega-3 suppletie en één systematische review en zes RCT’s (waarvan vijf ook geïncludeerd in het review) gerelateerd aan vitamine D suppletie. Over Wahls/Jelinek diëten werd geen relevante literatuur gevonden dat aan de selectiecriteria voldeed.
Referenties
- Ashtari F, Toghianifar N, Zarkesh-Esfahani SH, Mansourian M. Short-term effect of high-dose itamin D on the level of interleukin 10 in patients with multiple sclerosis: a andomized, double-blind, placebo-controlled clinical trial. Neuroimmunomodulation. 2015;22(6):400-404. doi:10.1159/000439278.
- Camu W, Lehert P, Pierrot-Deseilligny C, et al. Cholecalciferol in relapsing-remitting MS: A randomized clinical trial (CHOLINE) (published correction appears in Neurol Neuroimmunol Neuroinflamm. 2019 Nov 15;7(1):). Neurol Neuroimmunol Neuroinflamm. 2019;6(5):e597. Published 2019 Aug 6. doi:10.1212/NXI.0000000000000597.
- Holick, M. F. (2017). The vitamin D deficiency pandemic: approaches for diagnosis, treatment and prevention. Reviews in Endocrine and Metabolic Disorders, 18(2), 153-165.
- Hupperts R. Supplementation of VigantOL® Oil Versus Placebo as Add-on in Patients With Relapsing Remitting Multiple Sclerosis Receiving Rebif® Treatment (SOLAR). https://clinicaltrials.gov/ct2/show/NCT01285401 November 28, 2016(last update posted).
- Hupperts R, Smolders J, Vieth R, et al. Randomized trial of daily high-dose vitamin D3 in patients with RRMS receiving subcutaneous interferon β-1a. Neurology. 2019;93(20):e1906-e1916. doi:10.1212/WNL.0000000000008445.
- Jagannath VA, Filippini G, Di Pietrantonj C, et al. Vitamin D for the management of multiple sclerosis. Cochrane Database Syst Rev. 2018;9(9):CD008422. Published 2018 Sep 24. doi:10.1002/14651858.CD008422.pub3.
- Kampman MT, Steffensen LH, Mellgren SI, Jørgensen L. Effect of vitamin D3 supplementation on relapses, disease progression, and measures of function in persons with multiple sclerosis: exploratory outcomes from a double-blind randomised controlled trial. Mult Scler. 2012;18(8):1144-1151. doi:10.1177/1352458511434607.
- Ramirez-Ramirez V, Macias-Islas MA, Ortiz GG, et al. Efficacy of fish oil on serum of TNF α , IL-1 β , and IL-6 oxidative stress markers in multiple sclerosis treated with interferon beta-1b. Oxid Med Cell Longev. 2013;2013:709493. doi:10.1155/2013/709493.
- Sedighiyan M, Djafarian K, Dabiri S, Abdolahi M, Shab-Bidar S. The Effects of Omega-3 Supplementation on the Expanded Disability Status Scale and Inflammatory Cytokines in Multiple Sclerosis Patients: A Systematic Review and Meta-Analysis. CNS Neurol Disord Drug Targets. 2019;18(7):523-529. doi:10.2174/1871527318666190516083008.
- Shaygannejad V, Janghorbani M, Ashtari F, Dehghan H. Effects of adjunct low-dose vitamin d on relapsing-remitting multiple sclerosis progression: preliminary findings of a randomized placebo-controlled trial. Mult Scler Int. 2012;2012:452541. doi:10.1155/2012/452541.
- Soilu-Hänninen M, Aivo J, Lindström BM, et al. A randomised, double blind, placebo controlled trial with vitamin D3 as an add on treatment to interferon β-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2012;83(5):565-571. doi:10.1136/jnnp-2011-301876.
- Swank, R.L., Dugan, B.B.(1987) The Multiple Sclerosis Diet Book: A Low-fat Diet for the Treatment of M.S. Doubleday.
- Torkildsen O, Wergeland S, Bakke S, et al. ω-3 fatty acid treatment in multiple sclerosis (OFAMS Study): a randomized, double-blind, placebo-controlled trial. Arch Neurol. 2012;69(8):1044-1051. doi:10.1001/archneurol.2012.283.
- Weinstock-Guttman B, Baier M, Park Y, et al. Low fat dietary intervention with omega-3 fatty acid supplementation in multiple sclerosis patients. Prostaglandins Leukot Essent Fatty Acids. 2005;73(5):397-404. doi:10.1016/j.plefa.2005.05.024.
- Zandi-Esfahan S, Fazeli M, Shaygannejad V, et al. Evaluating the effect of adding Fish oil to Fingolimod on TNF-α, IL1β, IL6, and IFN-γ in patients with relapsing-remitting multiple sclerosis: A double-blind randomized placebo-controlled trial. Clin Neurol Neurosurg. 2017;163:173-178. doi:10.1016/j.clineuro.2017.10.004.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Sedighiyan, 2019 |
SR and meta-analysis of RCTs
Literature search up to October 2018
A: Weinstock (2005) C: Ramirez, 2013 D: Zandi, 2017
Study design: RCT A: Parallel
Setting and Country: A: United states
Source of funding and conflicts of interest: No funding, authors declare no conflict of interest
|
Inclusion criteria SR: - published in English
Exclusion criteria SR: - non-clinical trials/studies
4 studies included
Important patient characteristics at baseline:
N, mean age A: 27 patients, 42.5 years B: 91 patients, 38.6 years C: 50 patients, 34.9 years D: 41 patients, 33,3 years
Sex: A: 15% Male B: 35% Male C: 82% Male D: 29% Male
Type of MS A: Relapsing-remitting MS B: Relapsing-remitting MS C: Chronic progressive MS
Groups comparable at baseline? Not reported |
Describe intervention:
A: 15% fat diet with omega-3. Dosage EPA: 1980 mg/d. Dosage DHA: 1320 mg/d B: Interferon β-1a. Dosage EPA: 1350 mg/d. Dosage DHA 850 mg/d. C: Interferon β-1a. Dosage 4 gram fish oil: EPA: 800 mg/d; DHA 1600 mg/d D: Fingolid. Dosage EPA: 180 mg/d. Dosage DHA: 120 mg/d
|
Describe control:
A: 30% fat diet with olive oil B: Interferon β-1a corn oil C: Interferon β-1a sunflower oil D: Fingolid sunflower oil
|
End-point of follow-up:
A: 12 months B: 24 months C: 12 months D: 12 months
For how many participants were no complete outcome data available? (intervention/control) A: not reported B: not reported C: not reported D: not reported
|
Disease progression Defined as EDSS.
Effect measure: mean difference (95% CI): A: -0.42 (-1.01, 0.17) B: -0.05 (-0.39, 0.29) C: -0.04 (-0.36, 0.28) D: 0.07 (-0.42, 0.56)
Pooled effect (random effects model): -0.07 (95% CI -0.27 to 0.13) favoring Omega-3. Heterogeneity (I2): 0%
Results regarding TNF-alpha, IL-1β and IL-6 not noted as not included in PICO
Additional outcome measures extracted from individual studies
Disease progression defined as lesions: A: not reported
Disease progression defined as relapse rate
Effect measure: A: not reported B: 6 months: no effect p=0.54 C: 12 months: no effect p=0.79
Adverse events C: no serious adverse events
Health related quality of life (SF-36)
A: 6 months: clinical benefit intervention group p=0.05 C: not reported
|
Facultative:
Brief description of author’s conclusion: no significant effects of omega-3 supplementation
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question: Heterogeneous interventions are used which results in difficulties pooling estimates.
Level of evidence: GRADE (per comparison and outcome measure) EDSS: Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
Jagannath, 2018 |
SR and meta-analysis of RCTs
Literature search up to October 2017
A: Achiron, 2015 B: Ashtari, 2016 C: Hupperts, 2016 D: Kampman, 2012 E: Shaygannejad, 2012 F: Soilu-Hanninen
Study design:
Setting and Country:
Source of funding and conflicts of interest: (commercial / non-commercial / industrial co-authorship) Odd Fellows, research foundation for multiple sclerosis
|
Inclusion criteria SR:
Exclusion criteria SR:
12 studies included
Important patient characteristics at baseline:
N, mean age A: 158 patients, age not reported B: 94 participants, age not reported C: 232 patients, age not reported D: 71 patients, age not reported
Sex: A: % Male not reported B: % Male not reported C: % Male not reported D: % Male not reported E: % Male not reported F: % Male not reported
Groups comparable at baseline? |
Describe intervention:
A: 1 µg or 40 IU vitamin D3 daily B: 50000 IU vitamin D3 every 5 days + interferon beta C: 6670 IU vitamin D3 daily for 4 weeks, followed by 14007 IU daily for 44 weeks + interferon beta-1a 44mcg 3 times per week subcutaneously D: 20000 IU vitamin D3 once a week + 500 mg calcium daily E: 0.25 µg vitamin D3 daily, increased to 0.5 µg daily (20IU) after 2 weeks) F: 20000 IU vitamin D3 in arachis oil given once weekly plus interferon beta-1b G: H: I: .....
|
Describe control:
A: placebo (matched capsules of arachis oil C: placebo (matching), daily for 38 weeks D: placebo (identical capsules) + 500 mg calcium daily E: placebo F: placebo (matching capsules) plus betaferon
|
End-point of follow-up:
A: 2 months follow-up after 6 months of intervention B: 3 months after 3 months of intervention C: 48 weeks D: 96 weeks E: 12 months F: 12 months
For how many participants were no complete outcome data available? (intervention/control) A: 10%/29% B: 0 C: 15%/25% D: 0%/11% E: 0 F: 5,8%/6,3#
|
Outcome disease progression MRI Defined as number of MRI gadolinium-enhancing T1 lesions
52 weeks Effect measure: mean difference (95% CI): C: 0.11 (-0.25, 0.47)
Pooled effect (random effects model): 0.02. (95% CI -0.45 to0.48) favoring placebo Heterogeneity (I2): 11.96%
T2 lesions not reported
Outcome disease progression EDSS Defined as EDSS score
26 weeks Effect measure: mean difference (95% CI): A: -0.05 (-0.34-0.24)
52 weeks Effect measure: mean difference (95% CI): E: -0.31 (-0.93, 0.31)
96 weeks D: 0.35 (-0.21, 0.91)
Outcome disease progression relapse rate Defined as annualised relapse rate
52 weeks Effect measure: RD (95% CI): C: -0.11 (-0.16, -0.06)
96 weeks D: 0.06 (-0.08. 0.2)
Outcome Quality of life
Effect measure: std. mean difference (95% CI): A:
Outcome adverse events Defined as number of events
Serious adverse events Effect measure: RD (95% CI): A: 0 (-0.03, 0.03)
Minor adverse events A: -0.02 (-0.13, 0.1)
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis)
Included articles that are excluded for guideline: |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Camu, 2019 |
Type of study: RCT
Setting and country:
Funding and conflicts of interest: MedDay Pharmaceuticals, Novartis Pharma, Roche, and Sanofi. P. Lehert reports personal fees from Merck, Biogen, Teva, and Genzyme and grants from Novartis. C. PierrotDeseilligny reports personal fees from Novartis. P. Hautecoeur reports no disclosures. A. Besserve, J. Deleglise, and M. Payet are employees of the sponsor, Merck. E. Thouvenot has received honoraria and travel grants or research grants from the following pharmaceutical companies: Biogen, Genzyme, Merck Serono, Novartis, Roche, and Teva Pharma. J.-C. Souberbielle reports no disclosures. Go to Neurology.org/NN for full disclosures |
Inclusion criteria: - Patients were aged between 18 and 65 years with a diagnosis of RRMS based on the 2005 revised McDonald criteria
- use of drugs affecting vitamin D metabolism other than corticosteroids N total at baseline: Intervention: 63 Control:66
Important prognostic factors: For example age ± SD: I: 38.4 ± 9.31 C: 36.73 ± 8.37
Sex: I: 20.6% M C: 40.9% M
BMI ± SD: I: 24.41 ± 3.99 C: 24.12 ± 3.72
Disease duration in years ± SD: I: 5.13 ± 5.33 C: 5.59 ± 4.83
No of relapses in the last 2 y ± SD: I: 1.94 ± 1.52 C: 1.82 ± 0.98
Groups comparable at baseline? |
Describe intervention (treatment/procedure/test): was an oral solution packaged in 2 mL yellow glass (type III) ampoules with 2 self-breakable tips, containing 2.5 mg of cholecalciferol corresponding to 100,000 IU orally an ampoule every other week (equivalent to a daily dose of 7,143 IU of cholecalciferol) during the 96-week treatment period.
|
Describe control (treatment/procedure/test): Placebo
|
Length of follow-up: 96 weeks
Loss-to-follow-up: Intervention: N=18 (28.6%) Reasons:
Control: N=21 (31.8%) Reasons:
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Intention to treat:
Completers only:
Annualized relapse rate corrected for drug-related drop outs Intention to treat:
Completers only:
New T1 lesions:
https://clinicaltrials.gov/ct2/show/results/NCT01198132 T1 lesions: p = not reported
T2 lesions:
EDSS: QoL:
Treatment emergent adverse event
Severe or life-threatening treatment emergent adverse event |
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Sedighiyan, 2019 |
Yes |
Yes |
Yes Reasons for exclusion are indicated, but not with references |
Yes |
Not appliccable |
Yes |
no |
no |
yes |
|
Jagannath, 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
No |
Yes |
yes |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Camu, 2019 |
randomization number according to a chronological sequential order per site |
Unlikely |
Unlikely |
Unclear (not described) |
Unlikely |
Unlikely |
Likely (many dropouts, results between intention to treat group and ‘completers’ differ) |
Unlikely for annualized relapse rates |
Exclusietabel op basis van full tekst artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abdollahpour, 2018 |
studiedesign |
|
Atkinson, 2020 |
studiedesign |
|
Aximi, 2019 |
Voldoet niet aan PICO (uitkomst) |
|
Bagur, 2017 |
recentere review beschikbaar |
|
Berezowska, 2019 |
kwalitatief betere review (cochrane) beschikbaar, geen aanvullende studies die voldoen aan PICO |
|
Bitarafan, 2013 |
voldoet niet aan PICO (interventie) |
|
Bitarafan, 2015 |
voldoet niet aan PICO (interventie) |
|
Bitarafan, 2016 |
voldoet niet aan PICO (interventie) |
|
Bitarafan, 2019 |
voldoet niet aan PICO (interventie) |
|
Bock, 2018 |
voldoet niet aan PICO (interventie) |
|
Caballero-Villarraso, 2019 |
Kwalitatief betere review (cochrane) beschikbaar, geen aanvullende studies die voldoen aan PICO |
|
Chataway, 2012 |
Comment |
|
Cianferroti, 2017 |
Narratieve review |
|
Coe, 2019 |
voldoet niet aan PICO (interventie) |
|
Darwish, 2017 |
voldoet niet aan PICO (uitkomst) |
|
Derakhshandi, 2013 |
voldoet niet aan PICO (patiënt) |
|
Doosti-Irani, 2019 |
Kwalitatief betere review (cochrane) beschikbaar, geen aanvullende studies die voldoen aan PICO |
|
Dorr, 2020 |
Voldoet niet aan PICO (controle) |
|
Esposito, 2018 |
narratieve review |
|
Etemadifar, 2015 |
betreft subgroep |
|
Faraji, 2019 |
voldoet niet aan PICO (interventie) |
|
Farinotti, 2007 |
update van deze review beschikbaar |
|
Farinotti, 2012 |
recentere review beschikbaar |
|
Fitzgerald, 2017 |
voldoet niet aan PICO (interventie) |
|
Fitzgerald, 2018 |
voldoet niet aan PICO (interventie) |
|
Ghajarzhade, 2019 |
Protocol |
|
Harbige, 2007 |
narratieve review |
|
Hempel, 2017 |
Recentere review beschikbaar |
|
Holmoy, 2017 |
Voldoet niet aan PICO (uitkomst) |
|
Holmoy, 2019 |
Voldoet niet aan PICO (uitkomst) |
|
Holmøy, 2019 |
voldoet niet aan PICO (uitkomst) |
|
Hongell , 2019 |
Studiedesign |
|
Huntley, 2000 |
recentere review beschikbaar |
|
Iacopetta, 2020 |
Kwalitatief betere review (cochrane) beschikbaar, geen aanvullende studies die voldoen aan PICO |
|
Irish, 2017 |
voldoet niet aan PICO (interventie), te weinig geïncludeerde patiënten |
|
Katz Sand, 2018 |
narratieve review |
|
Khalili, 2014a |
voldoet niet aan PICO (interventie) |
|
Khalili, 2014b |
voldoet niet aan PICO (interventie) |
|
Kimball, 2014 |
Comment |
|
Kouchaki, 2018 |
voldoet niet aan PICO (interventie) |
|
Lovera, 2015 |
voldoet niet aan PICO (interventie) |
|
Majdinasab, 2018 |
voldoet niet aan PICO (interventie, uitkomst) |
|
Mauriz, 2013 |
voldoet niet aan PICO (interventie) |
|
McLaughlin, 2017 |
kwalitatief betere review (chochrane) beschikbaar, aanvullende studies als losse RCT geïncludeerd |
|
Mesliniene, 2013 |
recentere review beschikbaar |
|
Mische, 2018 |
narratieve review |
|
NA, 2019 |
Comment |
|
Naghashpour, 2017 |
voldoet niet aan PICO (interventie) |
|
Nicoletti, 2019 |
voldoet niet aan PICO (interventie) |
|
Nourbakhsh, 2016 |
voldoet niet aan PICO (interventie) |
|
Nozari, 2019 |
voldoet niet aan PICO (interventie) |
|
O'Connell, 2017 |
voldoet niet aan PICO (patiënten), <10 per arm |
|
Ozerlat, 2012 |
Comment |
|
Pantzaris, 2013 |
voldoet niet aan PICO (interventie) |
|
Penesova, 2018 |
narratieve review |
|
Pommerich, 2018 |
voldoet niet aan PICO |
|
Pozuelo-Moyano, 2013 |
recentere review beschikbaar |
|
Probst, 2019 |
voldoet niet aan PICO (interventie) |
|
Rezapour-Firouzi, 2013a |
voldoet niet aan PICO (interventie) |
|
Rezapour-Firouzi, 2013b |
voldoet niet aan PICO (interventie) |
|
Rezapour-Firouzi, 2014a |
voldoet niet aan PICO (interventie) |
|
Rezapour-Firouzi, 2014b |
voldoet niet aan PICO (interventie) |
|
Rezapour-Firouzi, 2015 |
voldoet niet aan PICO (interventie) |
|
Rolf, 2017 |
Voldoet niet aan PICO (uitkomst) |
|
Rolf, 2018a |
voldoet niet aan PICO (uitkomst) |
|
Rolf, 2018b |
voldoet niet aan PICO (uitkomst) |
|
Rolf, 2018c |
Voldoet niet aan PICO (uitkomst) |
|
Røsjø, 2017 |
voldoet niet aan PICO (uitkomst) |
|
Salari, 2015 |
voldoet niet aan PICO (uitkomst) |
|
Sanadgol, 2017 |
Recentere review beschikbaar |
|
Shinto, 2016 |
voldoet niet aan PICO (uitkomst) |
|
Sikes, 2018 |
Kwalitatief betere review (cochrane) beschikbaar (geen quality assesment) |
|
Sintzel, 2018 |
narratieve review |
|
Smolders, 2011 |
Protocol |
|
Smolders, 2019 |
narratieve review |
|
Smolders, 2020 |
Voldoet niet aan PICO (outcome) |
|
Solomon, 2011 |
narratieve review |
|
Sorto-Gomez, 2016 |
voldoet niet aan PICO (uitkomst) |
|
Toghianifar, 2015 |
voldoet niet aan PICO (uitkomst) |
|
Torres-Sanchez, 2018 |
voldoet niet aan PICO (uitkomst) |
|
Venasse, 2018 |
recentere review (recentere zoekdatum) beschikbaar, brede inclusie |
|
Wahls, 2019 |
narratieve review |
|
Waslo, 2019 |
voldoet niet aan PICO (interventie) |
|
Weinstock-Guttman, 2005 |
Voldoet niet aan PICO (interventie) |
|
Wingerchuk, 2010 |
Comment |
|
Yadav, 2016 |
voldoet niet aan PICO (interventie) |
|
Zheng, 2018 |
kwalitatief betere review (cochrane) beschikbaar, identieke zoekdatum |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 26-08-2021
Beoordeeld op geldigheid : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Multiple Sclerose (MS).
Werkgroep
- Prof. dr. V. de Groot, revalidatiearts, Amsterdam UMC, locatie VUmc, Amsterdam, VRA (voorzitter)
- Dr. J. van Meeteren, revalidatiearts, Rijndam, locatie Erasmus MC, Rotterdam, VRA (voorzitter)
- Dr. A.C. van Voskuilen, revalidatiearts, Klimmendaal Revalidatiespecialisten, Arnhem, VRA
- Dr. N.F. Kalkers, neuroloog, OLVG, Amsterdam en Amsterdam UMC, locatie VUmc, Amsterdam, NVN
- Drs. C. van Gelder, specialist ouderengeneeskunde, GGzE, Eindhoven, Verenso
- Prof. dr. F.G. Schaafsma, bedrijfsarts, bijzonder hoogleraar arbeid en bedrijfsgeneeskunde Amsterdam UMC, Afdeling Public & Occupational Health, NVAB
- R. Standhardt-Keilman, ergotherapeut, Nieuw Unicum, Zandvoort, EN (tot oktober 2019)
- Dr. I.C.J.M. Eijssen, ergotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, EN (vanaf november 2019)
- Dr. M.B. Rietberg, fysiotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, KNGF
- Dr. R. Kemps, GZ-psycholoog, Prinses Máxima Centrum voor Kinderoncologie, Utrecht, NIP (tot mei 2020 werkgroeplid, vanaf juni 2020 lid klankbordgroep)
- Drs. M.G.E. Huijsmans, GZ-psycholoog, OLVG, Amsterdam en Reade, NIP (vanaf juni 2020)
- K. Harrison, verpleegkundig specialist neurologie, Ter Gooi, locatie Blaricum, V&VN
- J.E. Schoonen-Ouwehand, revalidatie maatschappelijk werker, Basalt Revalidatie, Den Haag, BPSW (tot maart 2020)
- Dhr. R.G. Hoogakker, medisch maatschappelijk werker en aandachtsfunctionaris huiselijk geweld, Amsterdam UMC, locatie VUmc, Amsterdam, BPSW (vanaf maart 2020)
- Drs. L.S. Ruhaak, logopedist, logopediewetenschapper en onderzoeker in opleiding, Amsterdam UMC, locatie VUmc, Amsterdam, (en tot juli 2020 Nieuw Unicum, Zandvoort), NVLF
- E. Kruijver, seksuoloog, PsyQ, Utrecht en De Hoogstraat, Revalidatie, Utrecht, NVVS
- C.E. Helfrich-Smallegange, diëtist, Siza, Arnhem, NVD
- F. Kingma, patiëntvertegenwoordiger, MS Vereniging Nederland
Met ondersteuning van
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S. Van Dijk, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot januari 2019)
- Dr. G. Peeters, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf januari 2019 tot november 2019)
- Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf november 2019)
- Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
- Dr. Mevr. R. Zwarts - van de Putte, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
Met dank aan
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- M. van der Maten MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groot (voorzitter) |
Hoofd afdeling revalidatiegeneeskunde Amsterdam UMC. |
President Rehabilitation in MS (RIMS; onbetaald, tot en met juni 2019). |
Diverse onderzoeksprojecten op het gebied van MS bij MS research en ZonMW. Door eigen wetenschappelijk onderzoek bijgedragen aan kennisvermeerdering.
De activiteiten van RIMS worden gesponsord door Biogen, Roche and Medday. Deze bedrijven produceren ziektemodulerende behandelingen voor MS. Biogen heeft ook symptomatische behandeling voor loopproblemen. |
Geen actie nodig. Ziektemodulerende behandelingen vormen verder geen onderdeel van de richtlijn. |
|
Meeteren (voorzitter) |
Revalidatiearts, Rijndam, locatie Erasmus MC |
Geen |
Geen |
Geen actie nodig |
|
Eijssen (vanaf 11-2019) |
Ergotherapeut, onderzoeker VU medisch centrum |
Lid Ergotherapie Nederland (onbetaald)
Commissielid Adviesraad Onderzoek en Wetenschap - Ergotherapie Nederland (onbetaald)
Lid Rehabilitation in Multiple sclerosis (RIMS) - European Network for best Practice and Research in MS (onbetaald)
Commissielid Wetenschappelijk raad van de RIMS - Special Interest Group Occupation (SIG-Occupation) (onbetaald)
Commissielid MS netwerk Groot Amsterdam (onbetaald) |
In het verleden deelgenomen aan onderzoeksprojecten die gefinancierd werden door ZONmw (>3 jaar geleden) en MS research (afgerond 30-09-2019). Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Harrison |
Verpleegkundig Specialist Neurologie bij Tergooi ziekenhuizen locatie Blaricum |
Werkgroeplid MS richtlijn behandeling (onkostenvergoeding).
MS registratie commissie / wetenschap commissie (onkostenvergoeding).
Bestuurslid Landelijke Vereniging MS verpleegkundigen (onkostenvergoeding). |
Geen |
Geen actie nodig |
|
Helfrich |
SIZA, Arnhem; diëtist: 20 uur per week
Tot 1 mei 2020: Diëtistenpraktijk Corine Helfrich, Maurik: eigen 1e lijnspraktijk: 20 uur per week |
Bestuurslid MDL-netwerk NVD (onbetaald) |
Geen |
Geen actie nodig |
|
Hoogakker (vanaf 01-03-2020) |
Medisch maatschappelijk werker polikliniek Revalidatie, Amsterdam UMC, locatie De Boelelaan. 20 uur per week
Aandachtfunctionaris huiselijk geweld, Amsterdam UMC, locatie De Boelelaan, 16 uur per week |
Voorzitter GZ maatschappelijk werk BPSW (onbetaald) |
Geen |
Geen actie nodig |
|
Huijsmans (vanaf -01-06-2020) |
GZ-psycholoog OLVG en Reade |
Lid CognetMS Docent Rino (betaald): onderwijs aan zorgprofessionals vakgebied neuropsychologie |
Geen |
Geen actie nodig |
|
Kemps (tot 1-5-2020 werkgroeplid, daarna lid klankbordgroep) |
Tot 01-05-2020 GZ-psycholoog, Rijndam Revalidatie, locatie Erasmus MC
Vanaf 01-05-2020 Psycholoog, Prinses Máxima Centrum voor Kinderoncologie |
Docent voor AXON leertrajecten Werkzaamheden (betaald): onderwijs en voorlichting aan zorgprofessionals met betrekking tot de begeleiding van patiënten met niet-aangeboren hersenletsel |
Geen |
Geen actie nodig |
|
Kalkers |
Neuroloog OLVG, 0,7 fte, neuroloog VUmc 0,1 fte |
Secretaris bestuur Nederlandse Vereniging voor Neurologie 0,1 fte (sinds 1-6-2019).
Voorzitter bestuur landelijke MS registratie: 2 vergaderingen per jaar (vacatiegelden) (tot 1-11-2020). |
Geen |
Geen actie nodig |
|
Kingma |
Geen |
Geen |
Geen |
Geen actie nodig |
|
Kruijver |
Seksuoloog NVVS voor Basalt Revalidatie (28 uur p/w tot 01-10-2020)
Seksuoloog NVVS voor PsyQ Utrecht (28 uur p/w vanaf 01-10-2020)
Seksuoloog NVVS voor De Hoogstraat Revalidatie (4 uur p/w) |
Nederlandse wetenschappelijke Vereniging voor Seksuologie: Coördinator NVVS werkgroep Richtlijnen (onbetaald)
Incidenteel gastdocent diverse opleidingen Amstel Academie en Antonius Academie (betaald per lesuur) |
Geen |
Geen actie nodig |
|
Rietberg |
Paramedisch manager (0,56) /Fysiotherapeut (0,33) /Onderzoeker (0,11) Amsterdam UMC, locatie VUmc |
Penningmeester EFOX: European Foundation for Health and Exercise, onbetaald. Voorzitter MS Netwerk Groot Amsterdam, (onbetaald).
Voorzitter F-UMC (fysiotherapie universitair medische centra) (onbetaald).
Consilium KNGF (vacatievergoeding). |
Geen |
Geen actie nodig |
|
Ruhaak |
Logopedist (0,4 fte) en Logopediewetenschapper (0,4 fte) bij Nieuw Unicum tot september 2020
Onderzoeker in opleiding bij Amsterdam UMC, locatie VUMC (Niet in loondienst contract)
|
Voorzitter SIG Communication & Swallowing van Rehabilitation In Multiple Sclerosis (RIMS) (onbetaald): - organiseren van meetings 2 keer per jaar - communicatie met bestuur - communicatie met SIG leden |
Werkt aan onderzoek wat qua onderwerp overeenkomt met enkele richtlijnmodules (bijv. dysartrie). Echter zijn er op dit moment nog geen publicaties verschenen over deze onderzoeken. Het onderzoek wordt gefinancierd door MS research en RIMS, waarbij RIMS geen invloed op het verloop of uitkomsten van de studie.
Heeft onlangs een narratieve review artikel ingediend over communicatie en slikken bij MS (niet gefinancierd). |
Geen actie nodig |
|
Schaafsma |
Bedrijfsarts, senior onderzoeker Amsterdam UMC, 0,8 fte
Bijzonder hoogleraar, NVAB, 0,2 fte |
Commissielid Raad van Toezicht bij Vitaalpunt (betaald).
Plaatsvervangend commissielid Commissie Klachtenafhandeling Aanstellingskeuringen bij SER (vacatiegelden).
Commissielid Commissie Richtlijnontwikkeling en wetenschap voor de NVAB (onbetaald).
Commissielid Burger- Zielhuispenning voor de NVAB (onbetaald). |
Geen. Betrokken bij diverse onderzoeksprojecten die gefinancierd worden door ZONmw, Instituut GAK of UWV. Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Schoonen-Ouwehand (werkgroeplid tot maart 2020) |
Basalt Revalidatie, maatschappelijk werker |
BPSW voorzitter functiegroep gezondheidszorg maatschappelijk werk; aansturen van leden binnen de functiegroep, vallende onder de beroepsvereniging in kader van afstemming en uitzetten beleid. Functiegroepleden uit verpleeghuizen, ziekenhuizen en revalidatie. Vrijwillig |
Geen |
Geen actie nodig |
|
Standhardt-Keilman (werkgroeplid tot oktober 2019) |
Ergotherapeut bij Stichting Nieuw-Unicum |
Geen |
Geen |
Geen actie nodig |
|
Van Gelder |
Specialist oudergeneeskunde Vitalis woonzorggroep tot 1-1-2021, vanaf 1-3-2021 bij GGzE Eindhoven Beoordelingen wilsbekwaamheid voor notarissen en rechtbank Bestuurslid MS zorg Nederland |
"Lid medische adviesraad restless legs stichting onbetaald Maker filmdocumentaire euthanasie en psychiatrische ziekte, euthanasie en dementie onbetaald." |
Geen |
Geen actie nodig |
|
Van Voskuilen |
Revalidatiearts bij Klimmendaal Revalidatiespecialisten. |
Geen |
In 2012 gepromoveerd op Sacrale Neuromodulatie bij lagere urineweg symptomen |
Geen actie nodig |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Tot oktober 2018 Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018-september 2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie nodig |
|
Peeters (tot 11-2019) |
Senior adviseur/teamleider Kennisinstituut van de Federatie Medisch Specialisten |
Senior Atlantic Fellow for Equity in Brain Health, Global Brain Health Institute, Trinity College Dublin (onderzoeker; onbetaald).
Verzorgen van onderwijs voor de epidemiologische onderwerpen in het curriculum voor de eerstejaars fellows in het programma van de Global Brain Health Institute. |
Functie bij het Global Brain Health Institute: Er zijn soms financiële voordelen in de vorm van vergoeding van registratie en reiskosten voor congresbezoek. De lopende onderzoeksprojecten hebben geen connectie met MS.
|
Geen actie nodig. |
|
Maas (vanaf 11-2019) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1-1-2014 tot en met 31-8-2019; Dienstverband Nederlandse Hart Registratie 1-9-2018 tot en met 31-7-2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie nodig. |
|
Zwarts – van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Afronding promotieonderzoek ‘Etiology of the VACTERL association: genetic and non-genetic risk factors’, Radboudumc (onbetaald). |
Geen, promotieonderzoek werd gefinancierd uit een persoonlijke beurs ontvangen vanuit het Radboudumc. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van MS Vereniging Nederland, MS Research en het Nationaal MS Fonds voor de Invitational conference en de afvaardiging van de patiëntenvereniging MS Vereniging Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan MS Vereniging Nederland, MS Research, Nationaal MS Fonds en Patiëntenfederatie Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patienten met MS. Tevens zijn er knelpunten aangedragen door de VRA, IGJ, VIG, ZiNL, MS Research, Nationaal MS Fonds, Nieuw Unicum, NVLF, NVD, MS Zorg Nederland, MS Vereniging Nederland, NVU, NOG, KNGF, EN, NVAB en Archipel tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Hiernaast beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012) op noodzaak tot revisie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Nederlandse Vereniging voor Neurologie (NVN). Richtlijn Multiple sclerose. Utrecht, 2012.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van specifieke voedingsinterventies bij patiënten met MS? |
|
|
Database(s): Medline, Embase |
Datum: 27-08-2019 |
|
Periode: > 2000 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – aug 2019
|
1 exp Multiple Sclerosis/ or Encephalomyelitis, Acute Disseminated/ or exp Myelitis/ (82240) 2 ("multiple scleros*" or "optic neurit*" or "myelooptic neuropath*" or "myelo optico neuropath*" or myelit* or "neuromyelitis optica" or (dissemin* adj3 encephalomyelit*) or "clinically isolated syndrome*" or "transverse myelit*" or "devic disease*" or devics or (demyelinating adj (disease* or disorder*)) or adem).ti,ab,kf. (83702) 3 1 or 2 (113518) 4 exp Diet/ or (nutrition or diet or diets or dietary or caloric* or (vitamin adj2 supplement*) or microbiome* or wahls or jellinek).ti,ab,kf. or (vitamin d or vitamin b12 or omega 3 or omega 6).ti,kf. (771922) 5 3 and 4 (2016) 6 limit 5 to (english language and yr="2000 -Current") (1613) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (409106) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1889980) 10 6 and 7 (73) (aantal systematische reviews) 11 (6 and 8) not 10 (249) (aantal RCT’s) 12 10 or 11 (322)
= 322 (318 uniek) |
480 |
|
Embase (Elsevier) |
('multiple sclerosis'/exp/mj OR 'acute disseminated encephalomyelitis'/exp/mj OR 'myelitis'/mj OR 'poliomyelitis'/exp/mj OR 'multiple scleros*':ti,ab OR 'optic neurit*':ti,ab OR 'myelooptic neuropath*':ti,ab OR 'myelo optico neuropath*':ti,ab OR myelit*:ti,ab OR 'neuromyelitis optica':ti,ab OR ((dissemin* NEAR/3 encephalomyelit*):ti,ab) OR 'clinically isolated syndrome*':ti,ab OR 'transverse myelit*':ti,ab OR 'devic disease*':ti,ab OR devics:ti,ab OR ((demyelinating NEAR/1 (disease* OR disorder*)):ti,ab) OR adem:ti,ab)
AND ('nutrition'/exp/mj OR 'diet'/exp/mj OR nutrition*:ti,ab OR diet:ti,ab OR diets:ti,ab OR dietary:ti,ab OR caloric*:ti,ab OR ((vitamin NEAR/2 supplement*):ti,ab) OR microbiome*:ti,ab OR wahls:ti,ab OR jellinek:ti,ab OR 'vitamin d':ti OR 'vitamin b12':ti OR 'omega 3':ti OR 'omega 6':ti)
AND (english)/lim AND (2000-2019)/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
= 365 (354 uniek) |
|
Richtlijn: Multiple Sclerosis |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van specifieke voedingsinterventies bij patiënten met MS? |
|
|
Database(s): Medline, Embase |
Datum: 6-4-2020 |
|
Periode: 2017 – april 2020 |
Talen: Engels |
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Vitamin D/ or 'vitamin D*'.ti,ab,kf. or cholecalciferol*.ti,ab,kf. or colecalciferol*.ti,ab,kf. or hydroxycholecalciferol*.ti,ab,kf. or ergocalciferol*.ti,ab,kf. or dihydrotachysterol*.ti,ab,kf. or ("25" adj1 hydroxyvitamin*).ti,ab,kf. or 'vitamin d2'.ti,ab,kf. or 'vitamin d3'.ti,ab,kf. or 'calcio*l'.ti,ab,kf. or 'calcifediol*'.ti,ab,kf. or 'calcidiol*'.ti,ab,kf. or 'calcitriol*'.ti,ab,kf. or dihydroxyvitamin.ti,ab,kf. (90846) 2 exp Multiple Sclerosis/ or Encephalomyelitis, Acute Disseminated/ or exp Myelitis/ or ("multiple scleros*" or "optic neurit*" or "myelooptic neuropath*" or "myelo optico neuropath*" or myelit* or "neuromyelitis optica" or (dissemin* adj3 encephalomyelit*) or "clinically isolated syndrome*" or "transverse myelit*" or "devic disease*" or devics or (demyelinating adj (disease* or disorder*)) or adem).ti,ab,kf. (117212) 3 1 and 2 (1394) 4 limit 3 to (english language and yr="2017 -Current") (355) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (439560) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1966815) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3401226) 8 4 and 5 (36) 9 (4 and 6) not 8 (47) 10 (4 and 7) not (8 or 9) (93) 11 8 or 9 or 10 (176) |
|
Richtlijn: Multiple Sclerosis |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van specifieke voedingsinterventies bij patiënten met MS? |
|
|
Database(s): Medline, Embase |
Datum: 27-7-2020 |
|
Periode: 2017 – april 2020 |
Talen: Engels |
|
Database |
Zoektermen |
||||||||||||
|
Embase
|
|
||||||||||||
|
Medline (OVID)
|
1 exp Multiple Sclerosis/ or Encephalomyelitis, Acute Disseminated/ or exp Myelitis/ or ("multiple scleros*" or "optic neurit*" or "myelooptic neuropath*" or "myelo optico neuropath*" or myelit* or "neuromyelitis optica" or (dissemin* adj3 encephalomyelit*) or "clinically isolated syndrome*" or "transverse myelit*" or "devic disease*" or devics or (demyelinating adj (disease* or disorder*)) or adem).ti,ab,kf. (119233) 2 jelinek.ti,ab,kf. (30) 3 1 and 2 (0) |
