Activiteits- en participatieproblemen bij MS
Uitgangsvraag
Welke (screenings)methode moet worden toegepast om problemen bij activiteiten en participatie bij mensen met MS te herkennen en in welke fase van de ziekte?
Aanbeveling
Aanbevolen wordt om bij mensen met MS de voorkeur te geven aan de MSIS-29 of de MSIP voor ziektespecifieke screening op problemen in voor MS relevante domeinen van de ICF.
Overwogen kan worden om bij mensen met MS generieke meetinstrumenten, zoals IMPACT-S, IPA of RAP, te gebruiken voor screening op problemen in de verschillende domeinen van de ICF.
Aanbevolen wordt om bij mensen met MS voor het screenen op problemen in specifieke activiteiten- en participatiegebieden gebruik te maken van specifieke meetinstrumenten, met name screening van slik-, taal-, spraak- en communicatie-problemen ontbreekt in generieke lijsten.
Overwegingen
Hoewel meerdere meetinstrumenten valide en betrouwbaar zijn, zijn de items van de MSIS 29 en de MSIP het meest zorgvuldig gekozen. Beide meetinstrumenten bevatten ook items over lichaamsfuncties. Desondanks ontbreken er relevante items. In de MSIP ontbreekt een item over slikken. In de MSIS-29 ontbreken items over communicatie, slikken en seksualiteit.
Er is gezocht naar ziektespecifieke meetinstrumenten om te screenen op activiteiten- en participatieproblemen bij patiënten met MS. In de literatuur zijn naast deze MS-specifieke meetinstrumenten, generieke meetinstrumenten beschikbaar die klinimetrisch goed onderzocht zijn in andere of gemengde diagnosegroepen. Magasi en Post voerden een review uit naar de klinimetrische eigenschappen van participatiemeetinstrumenten (Magasi 2010). Uit deze review blijkt dat de ICF Measure of Activity and Participation – Screener (IMPACT-S) en de Impact op Participatie en Autonomie vragenlijst (IPA) (Vazirinejad 2003) toepasbaar zijn in Nederland en geschikt lijken voor MS omdat de vragen niet te complex zijn voor patiënten met cognitieve stoornissen. Met het Disability and Impact Profile (DIP) (Laman 1994) en de Canadian Occupational Performance Measure (COPM) (Dedding 2004) kunnen op betrouwbare en valide wijze activiteiten- en participatie-problemen worden gemeten. De domeinen en items van een ander generiek meetinstrument, het Revalidatie Activiteiten Profiel (RAP) (Bennekom 1995a, Bennekom1995b), worden door meerdere revalidatieteams en verpleeghuizen gebruikt om de activiteiten en participatie van een patiënt uit te vragen.
Met deze generieke meetinstrumenten kunnen activiteiten- en participatieproblemen in de volle breedte worden gemeten. Dit heeft als groot voordeel dat ze bij vele aandoeningen gebruikt kunnen worden. Ook voor patiënten met MS met een grote verscheidenheid aan
activiteiten- en participatieproblemen, zijn ze goed bruikbaar. Dit betekent dat in settings, waarin patiënten met verschillende diagnoses worden behandeld, weloverwogen gekozen kan worden voor een generiek meetinstrument dat ook in settings waar relatief weinig patiënten met MS worden behandeld, bruikbaar is.
Door de focus op meetinstrumenten voor screening op activiteiten- en participatieproblemen wordt geen overzicht gegeven van alle bruikbare en geschikte meetinstrumenten op deelgebieden. Het meten op deze deelgebieden kan zeer relevant zijn omdat het deelgebied nauwelijks aandacht krijgt in de generieke meetinstrumenten. Voor vele activiteiten en participatiegebieden zijn klinimetrisch goed onderzochte, gedetailleerde meetinstrumenten beschikbaar. Veelal zijn deze meetinstrumenten in brede populaties toepasbaar. Bij behoefte aan deze meetinstrumenten zal specifiek literatuuronderzoek verricht moeten worden. Omdat de generieke meetinstrumenten het hele spectrum van activiteiten- en participatieproblemen beslaan, kunnen ze in alle fasen van de ziekte en bij alle patiënten met voldoende cognitieve vaardigheden gebruikt worden. Hoewel iedere behandelaar gebruik kan maken van deze meetinstrumenten zullen met name de MS verpleegkundigen, revalidatieartsen en specialisten ouderengeneeskunde gezien hun focus op het functioneren van de patiënten, in brede zin gebaat zijn bij het gebruik.
Onderbouwing
Achtergrond
Bij de zorg voor patiënten met MS zijn meerdere disciplines, die in verschillende settings werken, betrokken. Vanuit deze disciplines bestaat de behoefte om op efficiënte en eenduidige wijze problemen bij het dagelijks functioneren tijdig te onderkennen en er adequaat op te reageren. Een beknopte (screenings)methode, die deze activiteiten- en participatieproblemen in de volle breedte detecteert en bruikbaar is in diverse settings voor verschillende disciplines, voorziet in deze behoefte. Daarom werd gezocht naar een ziektespecifiek meetinstrument dat het gehele spectrum van activiteiten- en participatieproblemen meet. De zoekstrategie werd niet gericht op meetinstrumenten, die focussen op een specifiek activiteiten- of participatieprobleem.
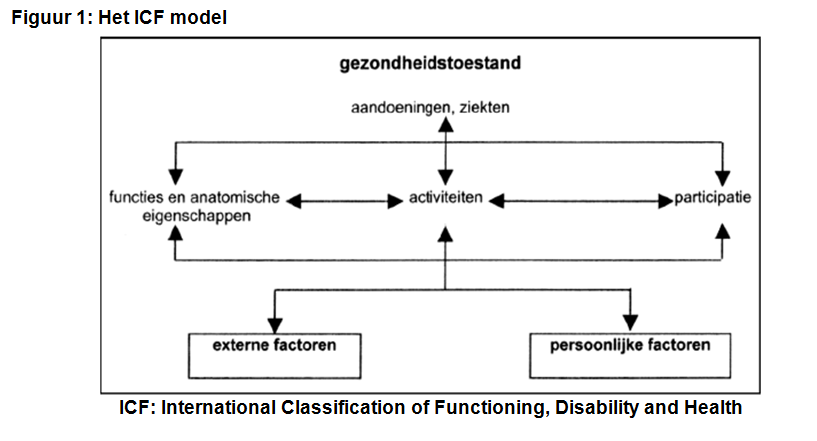
De International Classification of Functioning, Disability and Health (ICF, Fig. 1; World Health Organization 2001) wordt veel gebruikt om dit dagelijks functioneren te begrijpen. De ICF onderscheidt 5 domeinen: lichaamsfuncties & anatomische eigenschappen, activiteiten, participatie, externe - en persoonlijke factoren.
- Lichaamsfuncties zijn de fysiologische en mentale eigenschappen van de patiënt; anatomische eigenschappen betreffen de positie, aanwezigheid, vorm en continuïteit van onderdelen van het menselijke lichaam. Stoornissen zijn afwijkingen in of verlies van functies of anatomische eigenschappen.
- Activiteiten zijn onderdelen van iemands handelen. Beperkingen zijn de moeilijkheden die iemand heeft met het uitvoeren van activiteiten.
- Participatie is iemands deelname aan het maatschappelijke leven.
- Participatieproblemen zijn problemen die iemand heeft met het deelnemen aan het maatschappelijke leven.
- Externe factoren vormen de fysieke en sociale omgeving waarin mensen leven.
- Persoonlijke factoren beschrijft iemands persoonlijke achtergrond.
Het functioneren is hiermee te beschrijven vanuit lichamelijk, individueel en maatschappelijk perspectief. De inhoud van de domeinen Activiteiten en Participatie worden gezamenlijk beschreven. Voor de context zijn er twee extra domeinen: externe en persoonlijke factoren.
In Figuur 1 zijn deze onderlinge relaties schematisch weergegeven.
ICF: International Classification of Functioning, Disability and Health
Conclusies / Summary of Findings
|
Niveau 3 |
Het lijkt waarschijnlijk dat de MSIS-29 valide en intern consistent is bij mensen met MS.
C McGuigan 2004, Hoogervorst 2004, Gray 2009 |
|
Niveau 3 |
Er zijn aanwijzingen dat de FIM intern consistent en valide is, maar dat de hertest betrouwbaarheid op itemniveau sterk wisselt per item.
C Brosseau 1994 |
|
Niveau 3 |
Er zijn aanwijzingen dat de EBI en FIM even valide zijn, maar dat de EBI eenvoudiger is af te nemen en minder tijd kost.
C Marolf 1996 |
|
Niveau 3 |
Er zijn aanwijzingen dat de GNDS een valide en betrouwbaar instrument is om de beperkingen te meten bij mensen met MS.
C Rossier 2002 |
|
Niveau 3 |
Er zijn aanwijzingen dat de MSIP intern consistent en betrouwbaar is.
C Wynia 2008a, Wynia 2008b, Wynia 2009 |
Samenvatting literatuur
De belangrijkste kenmerken van deze meetinstrumenten zijn in tabel 1 samengevat. Zes meetinstrumenten zijn geëxcludeerd omdat daar geen Nederlandse versies van bestaan: MS Symptom and Impact Diary (MSSID), RAYS kwaliteit van leven schaal (RAYS), Patient-Reported outcome Indices for Multiple Sclerosis (PRIMUS), Physical Activity in people with chronic neurological conditions (PADS-R), Impact of Multiple Sclerosis Scale (IMSS), Multiple Sclerosis International Quality of Life (MSQoL). Daarnaast zijn 4 studies geëxcludeerd omdat deze na het lezen van de full-tekst niet relevant bleken te zijn of geen meerwaarde hadden voor de wetenschappelijke onderbouwing (Costelloe 2008, Dallmeijer 2005, Fraser 2007, Van der Linden 2005). Uiteindelijk is de wetenschappelijke onderbouwing gebaseerd op 10 artikelen. De resultaten worden hieronder per screeningsmethode samengevat.
Tabel 1: Instrumenten, activiteiten en participatie MS
|
Beschrijving |
Populaties |
Klinimetrische eigenschappen |
|
(E)BI Extended Barthel Index (Marolf 1996) |
||
|
Domeinen - Basisfuncties - Activiteiten
Items - 16
Itemscores - 1-4
Subschalen - Fysiek (10 items) - Cognitief (6 items)
Totaalscore - Optellen itemscores.
Interpretatie - Hogere score à onafhankelijker en minder behoefte aan hulp. |
N=100 - 53,7 leeftijd (SD 12,0) jaar - 59% vrouwen - 3% RRMS, 72% chronisch progressieve MS, 25 relapsing progressieve MS - EDSS 6,9 (Range 1-9,5) |
Convergente validiteit - EBI met : - FIM: r > 0,97 - EDSS: r = -0,76
Relatieve responsiviteit: - FIM: 68% no change, 25% improved, 7% got worse - EBI: 71% no change, 25% improved, 4% got worse - EDSS: 95% no change, 4% improved, 1% got worse |
|
FIM Functional Independence Measure (Brosseau 1994) |
||
|
Domeinen - Activiteiten
Items - 18
Itemscores - 1-7
Subschalen - Motorisch - Cognitief
Subschaalscore - Optellen itemscores
Totaalscore - Optellen itemscores
Interpretatie - Hogere score à onafhankelijker en minder behoefte aan hulp. |
N=81 - 50,2 leeftijd (SD 13) jaar - 53% vrouwen - 44% outpatients, 56% inpatients - EDSS 6,1 |
Convergente validiteit - Correlatie FIM met - EDSS: r=0,91
Interne consistentie - Cronbach’s alfa: >0,94
Betrouwbaarheid - ICC: 0,83 - Kappa - zelfverzorging 0,56 – 0,7 - sphincter controle 0,5 – 0,62 - mobiliteit 0,54 – 0,63 - communicatie 0,15 – 0,53) - cognitie 0,14 – 0,31
|
|
GNDS Guys Neurological Disorder Scale (Rossier 2002) |
||
|
Domeinen - Lichaamsfuncties - Activiteiten
Items - 12
Itemscores - 0 - 5
Subschalen - 12
Subschaalscore - Itemscore
Totaalscore - Optellen itemscores
Interpretatie - Hogere score à meer problemen |
N=22 - Outpatient rehabilitation centre - 50% vrouwen - Leeftijd 53,7 (SD 7,4) jaar - EDSS 8,3
N=21 - Outpatients - 86% vrouwen - Leeftijd 52,0 (SD 12,8) jaar - EDSS 6,2. |
Convergente validiteit - GNDS met - EDSS: r = 0,64 - BI: r = -0,76
Betrouwbaarheid - Test-hertest: r = 0,69-0,99 |
|
MSIP Multiple Sclerosis Impact Profile (Wynia 2008) http://irs.ub.rug.nl/ppn/30697651X |
||
|
Twee versies: - Functioneringsproblemen (F) versie - Beleving van functioneringsproblemen (PF) versie
Subschalen (beide versies) - Muscle&movement functions - Excretion&reproductive functions - Mental functions - Basic movement activities - ADL - Participation in life situations - Environmental factors Single impairment items (beide versies) - Fatigue - Speech functions - Seeing functions - Pain
Itemscores (beide versies) - 3 of 4
Subschaalscore - Totaal van itemscore
Totaalscore - niet van toepassing Twee onderdelen: - Functioneringsproblemen (F) versie - Beleving van functioneringsproblemen (PF) versie
Interpretatie - Hogere score ernstiger functioneringsprobleem of probleemervaring. |
N=530 - Dwarsdoorsnede populatie MS-centrum UMCG en patiëntenvereniging Noord-Holland - leeftijd gemiddeld 50 (SD 11) jaar - 71% vrouwen - jaren na diagnose: gemiddeld 13 (SD 8) jaar. Range: 1-53 jaar |
Known-groups validiteit - Scores PPMS > RRMS
Convergente en divergente validiteit - diverse generieke en specifieke vragenlijsten*: goed
Interne consistentie - Cronbach’s alfa: 0,49 – 0,91 - Mean Inter-item correlatie: 19 - .65
Betrouwbaarheid - Test-hertest: ICC 0,89 – 0,97 |
|
MSIS: Multiple Sclerosis Impact Scale https://hqlo.biomedcentral.com/articles/10.1186/1477-7525-7-58 |
||
|
Domeinen - Participatie - QoL
Items - 29
Itemscores - 1-5
Subschalen - Fysieke impact - Psychologische impact
Subschaalscore - Optellen itemscores
Totaalscore - Optellen itemscores
Interpretatie - Hogere score à meer impact |
N=172 (McGuigan 2004) - leeftijd 44 (SD 11,6) jaar - 71% vrouwen - 53% RRMS, 32% SPMS, 15% PPMS - EDSS 4,4
N=102 (McGuigan 2004) - 66% vrouwen - 59% RRMS, 36% SPMS, 5% PPMS - EDSS 3,9 (Range 0-7,5)
N= 200 (Hoogervorst 2004) - leeftijd 44,7 (SD 11,2) jaar - 63% vrouwen - 54% RRMS, 31% SPMS, 16% PPMS - EDSS 4,0 (Range 2,5-6,0)
N= 248 (Gray 2009) - leeftijd 49,1 (SD12,4) jaar - 66,7% vrouwen - 58% RRMS, 35% SPMS, 7% PPMS - EDSS 4,6 (Range 0-9,5)
N=214 (Costelloe 2007) - 64,9% RRMS, 31,8% SPMS, 3,3% PPMS - EDSS Range 0-8,5 |
Convergent validiteit - Correlatie MSISfysiek met - EDSS : r=0,63, 0,68, 0,704 - LHS : r=0,843 - MSFC : r=-0,53, 0,577 - GNDS : r=0,79
Divergente validiteit: <0,12 - Correlatie MSISfysiek met - BDI: r=0,399 - Correlatie MSISpsychologisch met - EDSS: r<0,1; 0,12; 0,22 - MSFC: r<0,1; -0,30 - GNDS: r=0,58
Interne consistentie - MSISfysiek - Cronbach’s alfa >0,89, 0,93 - MSISpsychologisch - Cronbach’s alfa 0,93
Betrouwbaarheid - Geen gegevens
Responsiviteit - ∆EDSS vs ∆MSIStotaal r=0,9 - Klinisch relevante verandering - EDSS 0-5: 7 - EDSSS 5,5-8: 8 |
|
(E)BI, Extended Barthel Index; EDSS, Expanded Disability Status Scale; ES, effect sizes; DIP, Disability and Impact Profile; FIM, Functional Independent Measure; GARS, Groningen Activity Restriction Scale; GNDS, Guys Neurological Disorder Scale; IPAQ, Impact on Participation and Autonomy Questionnaire; MS, multiple sclerosis; MSFC, Multiple Sclerosis Functional Composite;
|
MSIP, Multiple Sclerosis Impact Profile; MSIS, Multiple Sclerosis Impact Scale; PPMS, primary progressive MS; QoL, quality of life; ROC, receiver operating characteristic; RRMS, relapsing remitting MS; SD, standard deviatie; SF-36, Medical Outcome study Short Form Questionnaire; SPMS, secondary progressive MS; WHOQOL-BREF, World Health Organization Quality of Life (abbreviation version). |
Extended BI
De Barthel Index is een veelgebruikte schaal om de behoefte aan zorg te meten. Omdat bij de Barthel Index geen communicatieve en cognitieve beperkingen meet en de scores van andere meetinstrumenten, die wel communicatieve en cognitieve beperkingen meten (onder andere de FIM), moeilijk te berekenen zijn, is de Extended Barthel Index ontwikkeld. De eerste 15 items van de EBI zijn identiek aan de FIM, maar het scoresysteem is eenvoudiger (Marolf 1996). Ook is een item over visus/neglect toegevoegd. De klinimetrische eigenschappen van de EBI zijn onderzocht bij 100 personen met MS (Marolf 1996). De convergente validiteit wordt ondersteund. Er zijn geen gegevens over interne consistentie en betrouwbaarheid beschikbaar. Er zijn aanwijzingen dat de schaal veranderingen in de tijd kan meten.
FIM
De FIM evalueert het functioneren van de patiënt in 18 verschillende ADL-activiteiten. Elk item wordt gescoord met een gestandaardiseerd protocol. Brosseau et al (1994) hebben de betrouwbaarheid en validiteit onderzocht van de Functional Independence Measure (FIM) bij 81 mensen met MS. De convergente validiteit wordt ondersteund door de resultaten. De interne consistentie is hoog. Voor de items, met uitzondering van het cognitie-item, is de test-hertest betrouwbaarheid redelijk tot goed.
GNDS
De Guy’s Neurological Disability Scale (GNDS) is ontwikkeld als een eenvoudig, gebruiks-vriendelijk meetinstrument voor het meten van de relevante beperkingen die zich bij MS kunnen voordoen (Sharrack 1996). De klinimetrische eigenschappen zijn onderzocht in twee kleine groepen van 22 en 21 mensen met MS (Rossier 2002). De convergente validiteit wordt door de resultaten ondersteund. De test-hertest betrouwbaarheid lijkt goed.
MSIP
De Multiple Sclerosis Impact Scale (MSIP) is een vragenlijst die vier domeinen van het ICF-model meet (Wynia 2008a). Bij de ontwikkeling zijn items uit bestaande meetinstrumenten verzameld en aangevuld met items, aangedragen door een panel van 98 experts (bestaande uit patiënten en mantelzorgers (1/3 deel) en medische professionals (1/3 deel) en niet-medische professionals geselecteerd uit de volledige versie van de ICF, de Internationale Classificatie van het menselijk functioneren (Wynia 2006). Deze vragenlijst scoort de aanwezigheid van een functioneringsprobleem en vervolgens de beleving hiervan. De finale itemselectie vond plaats met een factoranalyse. De klinimetrische eigenschappen zijn onderzocht bij 530 mensen met MS, zowel voor de versie ‘functioneringsproblemen (Wynia 2008a, Wynia 2008b), als voor de versie ‘beleving van functioneringsproblemen (Wynia 2009). De convergente en divergente validiteit worden ondersteund. De interne consistentie is voldoende tot goed. De test-hertest betrouwbaarheid is goed. Responsiviteit is niet onderzocht.
MSIS-29
De MSIS-29 is een zelfrapportage vragenlijst die de fysieke (MSISfysiek, 20 items) en psychologische impact (MSISpsych, 9 items) van MS meet (Hobart 2001). De 29 items zijn gebaseerd op advies van experts, review van literatuur en interviews met patiënten. De klinimetrische eigenschappen zijn onderzocht in 5 verschillende populaties met in totaal 936 deelnemers (Tabel 1) (McGuigan 2004, Hoogervorst 2004, Costelloe 2007, Gray 2009). Voor de MSISfysiek is de convergente validiteit voldoende aangetoond; de beoordeling van de divergente validiteit niet. Voor de MSISpsych is de divergente validiteit met voldoende aangetoond; voor de beoordeling van de convergente validiteit zijn onvoldoende gegevens voorhanden. De interne consistentie van zowel de MSISfysiek als de MSISpsych is hoog. Voor de beoordeling van de betrouwbaarheid zijn geen gegevens voorhanden. Eén studie heeft gekeken naar de responsiviteit en de minimaal relevante klinische verandering bepaald.
Zoeken en selecteren
Ter beantwoording van deze vraag zijn uit de literatuursearch 20 artikelen geselecteerd op titel en abstract. De wetenschappelijke onderbouwing is gebaseerd op vragenlijsten waar Nederlandse versies van bestaan, namelijk de Extended Barthel Index (EBI), de Functional Independence Measure (FIM), Guy’s Neurological Disability Scale (GNDS), de MS Impact Profile (MSIP) en de Multiple Sclerosis Impact Scale (MSIS).
Referenties
- Bennekom CA van, Jelles F, Lankhorst GJ. (1995). Rehabilitation Activities Profile: the ICIDH as a framework for a problem-oriented assessment method in rehabilitation medicine. Disabil Rehabil 1, 17, 169-175.
- Bennekom CA van, Jelles F, Lankhorst GJ, Bouter LM. (1995). The Rehabilitation Activities Profile: a validation study of its use as a disability index with stroke patients. Arch Phys Med Rehabil , 76, 501-507.
- Brosseau L (1994). W. The inter-rater reliability and construct validity of the functional independence measure for mu, 8 (2), 107-115.
- Costelloe L, O'Rourke K, Kearney H, McGuigan C, Gribbin L, Duggan M, et al. (2007). The patient knows best: significant change in the physical component of the Multiple Sclerosis Impact Scale (MSIS-29 physical). Journal of Neurology, Neurosurgery & Psychiatry, 78 (8), 841-844.
- Costelloe L, O'Rourke K, McGuigan C, Walsh C, Tubridy N, Hutchinson M, et al. (2008). The longitudinal relationship between the patient-reported Multiple Sclerosis Impact Scale and the clinician-assessed Multiple Sclerosis Functional Composite. Multiple Sclerosis, 14 (2), 255-258.
- Dallmeijer AJ, Dekker J, Roorda LD, Knol DL, van Baalen B, de Groot, V, et al. (2005). Differential item functioning of the Functional Independence Measure in higher performing neurological patients. Journal of Rehabilitation Medicine, 37 (6), 346-352.
- DeddingC., Cardol, M., Eyssen, I.C.J.M., Dekker, J., Beelen, A. (2004). Validity of the Canadian occupation performance measure: a client-centred outcome measurement. . Clinical Rehabilitation, 18 (6), 660-667.
- Doward LC, McKenna SP, Meads DM, Twiss J, Eckert BJ, Doward LC, et al. (2009). The development of patient-reported outcome indices for multiple sclerosis (PRIMUS). Multiple Sclerosis, 15 (9), 1092-1102.
- Fraser C, McGurl J, Fraser C, McGurl J. (2007). Psychometric testing of the Americanized version of the Guy's Neurological Disability Scale. Journal of Neuroscience Nursing, 39 (1), 13-19.
- Gray O, McDonnell G, Hawkins S, Gray O, McDonnell G, Hawkins S. (2009). Tried and tested: the psychometric properties of the multiple sclerosis impact scale (MSIS-29) in a population-based study. Multiple Sclerosis, 15 (1), 75-80.
- Greenhalgh J, Ford H, Long AF, Hurst K, Greenhalgh J, Ford H, et al. (2004). The MS Symptom and Impact Diary (MSSID): psychometric evaluation of a new instrument to measure the day to day impact of multiple sclerosis. [see comment]. Journal of Neurology, Neurosurgery & Psychiatry, 75 (4), 577-582.
- Hobart J, Lamping D, Fitzpatrick R et al. (2001). The Multiple Scleoris Impact Scale (MSIS-29): a new patient-based outcome measure. Brain, 124, 692-73.
- Hoogervorst EL, Zwemmer JN, Jelles B, Polman CH, Uitdehaag BM, Hoogervorst ELJ, et al. (2004). Multiple Sclerosis Impact Scale (MSIS-29): relation to established measures of impairment and disability. Multiple Sclerosis, 10 (5), 569-574.
- Kayes NM, Schluter PJ, McPherson KM, Taylor D, Kolt GS, Kayes NM, et al. (2009). The Physical Activity and Disability Survey -- Revised (PADS-R): an evaluation of a measure of physical activity in people with chronic neurological conditions. Clinical Rehabilitation, 23 (6), 534-543.
- Laman H, Lankhorst GJ. (1994). Subjective weighting of disability: an approach to quality of life assessment in rehabilitation. Disabil Rehabil, 16, 198-204.
- Magasi S, Post MW. (2010). A comparative review of contemporary participation measures' psychometric properties and content coverage. Arch Phys Med Rehabil, 91, S17-S28.
- Marolf M V V (1996). Evaluation of disability in multiple sclerosis patients: A comparative study of the functional independence measure, the extended Barthel Index and the Expanded Disability Status Scale. . Clinical Rehabilitation, 10 (4), 309-313.
- McGuigan C, Hutchinson M, McGuigan C, Hutchinson M. (2004). The multiple sclerosis impact scale (MSIS-29) is a reliable and sensitive measure. Journal of Neurology, Neurosurgery & Psychiatry, 75 (2), 266-269.
- McMillan L, Moore KA, McMillan L, Moore KA. (2006). The development and validation of the impact of multiple sclerosis scale and the symptoms of multiple sclerosis scale. Archives of Physical Medicine & Rehabilitation, 87 (6), 832-841.
- Rossier P, Wade DT, Rossier P, Wade DT. (2002). The Guy's Neurological Disability Scale in patients with multiple sclerosis: a clinical evaluation of its reliability and validity. Clinical Rehabilitation, 16 (1), 75-95.
- Rotstein Z, Barak Y, Noy S, Achiron A, Rotstein Z, Barak Y, et al. (2000). Quality of life in multiple sclerosis: development and validation of the 'RAYS' scale and comparison with the SF-36. International Journal for Quality in Health Care, 12 (6), 511-517.
- Simeoni M (2008). C. A. Validation of the multiple sclerosis international quality of life questionnaire. Multiple Sc, 14 (2), 219-230.
- van der Linden FA, Kragt JJ, Klein M, van der Ploeg HM, Polman CH, Uitdehaag BM, et al. (2005). Psychometric evaluation of the multiple sclerosis impact scale (MSIS-29) for proxy use. Journal of Neurology, Neurosurgery & Psychiatry, 76 (12), 1677-1681.
- Vazirinejad R, Lilley JM, Ward CD. (2003). The 'Impact on Participation and Autonomy': acceptability of the English version in a multiple sclerosis outpatient setting. Multiple Scleroris, 9 (6), 612-615.
- Walker N, Mellick D, Brooks CA, Whiteneck GG, Walker N, Mellick D, et al. (2003). Measuring participation across impairment groups using the Craig Handicap Assessment Reporting Technique. American Journal of Physical Medicine & Rehabilitation, 82 (12), 936-941.
- World Health Organization, International Classification of Functioning, Disability and Health (2001). x. WHO, 1, 1-.
- Wynia K, Middel B, Van Dijk JP, De Ruiter H, Lok W, De Keyser JH, et al. (2006). Broadening the scope on health problems among the chronically neurologically ill with the International Classification of Functioning (ICF). Disability and rehabilitation , 28 (23), 1445-1454.
- Wynia K, Middel B, van Dijk JP, De Ruiter H, Lok W, De Keyser JH, et al. (2008). The Multiple Sclerosis impact Profile (MSIP). Development and testing psychometric properties of an ICF-based health measure. . Disability & Rehabilitation, 30 (4), 261-274.
- Wynia K, Middel B, de RH, van Dijk JP, de Keyser JH, Reijneveld SA, et al. (2008). Stability and relative validity of the Multiple Sclerosis Impact Profile (MSIP). Disability & Rehabilitation, 30 (14), 1027-1038.
- Wynia K, Middel B, Dijk JP, Ruiter H, Lok WS, de Keyser JH, et al. (2009). Adding a subjective dimension to an ICF-based disability measure for people with Multiple Sclerosis. Disabil Rehabil, 31 (12), 1008-17.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Uiterlijk in augustus 2016 wordt door de Nederlandse Vereniging voor Neurologie, na raadpleging van of op advies van andere participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zonodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. Het voorstel van de werkgroep is om deze richtlijn in “dynamische vorm” jaarlijks bij te stellen en aan te vullen, terwijl parallel aan implementatie wordt gewerkt.
Algemene gegevens
Deze richtlijn is totstandgekomen met financiële steun van ZonMw in het kader van het programma Kennisbeleid Kwaliteit Curatieve Zorg (KKCZ 2008) en Multipele Sclerose Vereniging Nederland.
Aanleiding
Multipele sclerose (MS) is de meest frequente oorzaak van invaliditeit onder jong volwassenen in de westerse wereld. De ziekte wordt gekenmerkt door toenemende lichamelijke en cognitieve beperkingen.
Op basis van getallen uit omliggende landen en schaarse Nederlandse gegevens schat men dat de ziekte voorkomt bij 1 op de 1000 inwoners. Nederland telt dus ongeveer 17.000 mensen met MS. In 1992 had 55% hiervan ernstige beperkingen (RIVM). De ziekte komt tweeënhalf keer zo vaak voor bij vrouwen als bij mannen. MS treft vooral jonge mensen tussen 20 en 50 jaar; in 90% van de gevallen begint de ziekte tussen het 15e en 50e levensjaar.
Er is geen standaardbehandeling. Dit leidt tot zowel over- als onderconsumptie van beschikbare middelen en tot onduidelijkheid bij patiënten en zorgverleners. Een multi-disciplinaire richtlijn zou hierin verbetering kunnen brengen.
De gevolgen van de ziekte voor de mens met MS zijn levenslang en hebben betrekking op alle aspecten van het leven. De beperkingen hebben grote gevolgen voor de maatschappelijke participatie; mensen met MS doen een groot beroep op de medische zorg en de hulpverlening. Door de veelheid aan betrokken zorgverleners is multidisciplinaire afstemming noodzakelijk om de kans dat de patiënt in de maatschappij kan blijven participeren te maximaliseren en de kwaliteit van leven te behouden. Een integrale aanpak en visie op zorg en behandeling van mensen met MS is een voorwaarde voor het verbeteren van de zorg en om de hoge kosten die gepaard gaan met het hebben van MS in te perken.
Doel en doelgroep
Doelstelling
Bij aanvang van de richtlijnontwikkeling en op basis van een uitgebreide knelpuntenanalyse heeft de werkgroep de volgende doelen geformuleerd voor de richtijn MS:
- Uniforme diagnostiek. Traditioneel werd de diagnose MS gesteld op basis van klinische afwijkingen, eventueel aangevuld met Iiquordiagnostiek. Deze richtlijn sluit aan op nieuwe diagnostische criteria die door het gebruik van MRI van de hersenen en het ruggenmerg veranderd zijn.
- Uniform medicamenteus beleid bij verschillende vormen van MS, vooral ten aanzien van immunomodulerende middelen.
- Een expliciete bijdrage van specialismen die betrokken zijn bij werkhervatting of -handhaving en advisering over het kunnen (blijven participeren) in de maatschappij.
- Het ondersteunen van zorgverleners bij het realiseren van een uniform ‘evidence-based’-beleid bij mensen met MS.
- Samenwerkingsafspraken tussen relevante ziekenhuisspecialismen en eerstelijn gezondheidszorgprofessionals waar behandeling en zorg elkaar raken (medische behandeling en ondersteuning gecombineerd met de benodigde zorg in de thuissituatie ter bevordering van het behoud van de maatschappelijke participatie).
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners die bij de behandeling en begeleiding van MS-patiënten betrokken zijn: huisartsen, neurologen, revalidatieartsen, urologen, oogartsen, verpleegkundigen, fysiotherapeuten, apothekers, ergotherapeuten, psychologen, logopedisten, bedrijfsartsen, specialisten ouderengeneeskunde, verzekeringsartsen, psychiaters, seksuologen en maatschappelijk werkers.
Samenstelling werkgroep
Samenstelling van de werkgroep en de klankbordgroep
Voor het ontwikkelen van deze richtlijn is eind 2008 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle bij de diagnostiek en behandeling van mensen met MS betrokken medische disciplines en het CBO (zie ‘Samenstelling van de werkgroep en klankbordgroep’). Deze werkgroep kwam op 21 januari 2009 voor het eerst bij elkaar.
De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is opvraagbaar bij het CBO.
Werkgroepleden
- G.J. (Bert) Aarts, Multiple Sclerose Vereniging Nederland
- J.L. (Jim) Bender, Nederlandse Vereniging voor Seksuologie
- Dr. Y. (Yvonne) Bol, Nederlands Instituut van Psychologen
- H. (Hanneke) Bolt, Nederlandse Vereniging voor Seksuologie
- Drs. I.J. (Irma) van den Broek - van Lieshout, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- C.E. (Caroline) Bruggeman, Nederlandse Vereniging voor Logopedie en Foniatrie
- E. (Ernst) Evenhuis, Ergotherapie Nederland
- Dr. I. (Isaline) Eyssen, Ergotherapie Nederland
- Dr. J.A.G. (Jan) Geelen, Nederlandse Vereniging voor Neurologie
- Dr. V. (Vincent) de Groot, Nederlandse Vereniging van Revalidatieartsen
- K. (Kitty) Harrison, Landelijke Vereniging MS Verpleegkundigen
- M.A.P. (Marco) Heerings, Landelijke Vereniging MS Verpleegkundigen
- Mw. Dr. D.J. (Thea) Heersema, Nederlandse Vereniging voor Neurologie
- Dr. B. (Brechtje) Jelles, Nederlandse Vereniging voor Neurologie
- Dr. J. (Joep) Killestein, Nederlandse Vereniging voor Neurologie
- F.W. (Floris) Kuipéri, Nederlands Instituut van Psychologen
- Dr. J.R. (Joke) de Kroon, Nederlandse Vereniging van Revalidatieartsen
- A.W. (Bertil) Lenderink, Nederlandse Vereniging van Ziekenhuisapothekers
- I.G.C.M. (Irene) Leijten, Verenso, specialisten in ouderengeneeskunde
- Dr. E.Th.L. (Erik) van Munster, Nederlandse Vereniging voor Neurologie
- Mr. A-E. (Yelle) Nuse, Multiple Sclerose Vereniging Nederland
- R. (Roel) Petter, Nederlandse Vereniging van Maatschappelijk Werkers
- Drs. M.B. (Marc) Rietberg, Koninklijk Nederlands Genootschap voor Fysiotherapie
- J.M. (Jeroen) van Roessel, Nederlandse Vereniging voor Verzekeringsgeneeskunde
- I. (Ingrid) van der Schaaf, Nederlandse Vereniging voor Psychiatrie
- Dr. L.H. (Leo) Visser, Nederlandse Vereniging voor Neurologie, voorzitter richtlijnwerkgroep
- Drs. H. (Haske) van Veenendaal, Managing consultant, CBO
- J. (Jan) Wiersma, Nederlandse Vereniging voor Psychiatrie
- A.F.F. (Anneke) van der Zande, Nationaal MS Fonds
Voorzitter(s)
|
Algemeen voorzitter
Vroege herkenning van MS
Immunomodulerende therapie
Cognitieve stoornissen
Vermoeidheid en conditieverlies
Psychosociale problemen
Arbeid
Activiteiten en participatie
Zorgnetwerk MS |
Dr. L.H. Visser, Nederlandse Vereniging voor Neurologie
Dr. B. Jelles, Nederlandse Vereniging voor Neurologie
Dr. J.A.G. Geelen, Nederlandse Vereniging voor Neurologie
Dr. Y. Bol, Nederlands Instituut van Psychologen
Drs. M.B. Rietberg, Koninklijk Nederlands Genootschap voor Fysiotherapie
I. van der Schaaf & J. Wiersma, Nederlandse Vereniging voor Psychiatrie
Drs. I.J. van den Broek–van Lieshout, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
Dr. V. de Groot, Nederlandse Vereniging van Revalidatieartsen
M.A.P. Heerings, Landelijke Vereniging MS Verpleegkundigen en Mr. A-E. Nuse, Multiple Sclerose Vereniging Nederland |
Inbreng patiëntenperspectief
Patiëntenperspectief
Voor de knelpuntenanalyse hebben de Multiple Sclerose Vereniging Nederland (MSVN) en het Nationaal MS Fonds knelpunten ingebracht tijdens een ‘open space’-bijeenkomst. Een ‘open space’-bijeenkomst is een interactieve bijeenkomst waarbij de inhoudelijke sturing in belangrijke mate wordt bepaald door de deelnemers. Tijdens de bijeenkomst formuleert iedereen deelvragen en lost deze met de aanwezigen op.
De conceptrichtlijn is tevens voorgelegd aan de patiëntenvereniging, de Multiple Sclerose Vereniging Nederland en het Nationaal MS-Fonds. De Multiple Sclerose Vereniging Nederland nam met twee vertegenwoordigers deel aan de werkgroepvergaderingen.
Kwaliteitscriteria vanuit patiëntenperspectief
De Multiple Sclerose Vereniging Nederland heeft, parallel aan de richtlijnontwikkeling in 2011, onderzoek gedaan naar Kwaliteitscriteria vanuit patiëntenperspectief. De resultaten zijn in hoofdstuk 7.6 weergeven. Deze criteria hebben een andere status dan de aanbevelingen in de richtlijn die volgens een evidence-based richtlijnontwikkelproces tot stand zijn gekomen. De criteria geven primair aan wat patiënten als belangrijk ervaren. De Kwaliteitscriteria vanuit patiëntenperspectief zijn opgesteld op basis van een enquête en focusgroepen onder mensen met MS. In de focusgroepen lag het accent op achterliggende motivaties, meningen, wensen en behoeften van de mensen met MS. In de groepsgesprekken is ingegaan op het waarom van heersende meningen en bepaalde gedragingen. De uitkomsten van dit kwantitatieve en kwalitatieve onderzoek zijn besproken door een groep zorgverleners en een groep patiënten. Vervolgens zijn de geprioriteerde onderwerpen omgezet naar concrete concept-criteria, aan de hand van het AIRE-instrument (Appraisal of Indicators through Research and Evaluation). De conceptcriteria zijn wederom besproken met de groep zorgverleners en expertpatiënten volgens de Delphi methode. Als laatste stap zijn de aangepaste criteria voorgelegd aan een leesgroep, bestaande uit zorgverleners. Gedurende het gehele traject heeft adviseur dr. B.A. de Jong het projectteam bijgestaan.
Methode ontwikkeling
Evidence based
Implementatie
Implementatie en evaluatie
Bij de ontwikkeling van de richtlijn is rekening gehouden met de implementatie en de uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder relevante beroepsgroepen en organisaties. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de richtlijn op de CBO-website geplaatst en uitgegeven in boekvorm.
De MS Vereniging Nederland is partner in het samenwerkingsverband ‘MS Nederland Kwaliteit van zorg voor mensen met MS’. Vanuit MS Nederland wordt, op basis van de Richtlijn MS, een zorgmodel voor MS ontwikkeld en geëvalueerd. Om de toepassing en evaluatie van deze richtlijn te stimuleren, zal in een volgende stap de implementatie verder worden opgepakt. Daarnaast worden een samenvattingskaart en een patiëntenversie van de richtlijn te ontwikkeld.
De werkgroep zal stimuleren dat de richtlijn wordt getoetst bij de eindgebruiker in de verschillende regio’s en bij de Wetenschappelijke Verenigingen, bijvoorbeeld via visitaties.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patienten met MS. Tevens zijn er knelpunten aangedragen door de VRA, IGJ, VIG, ZiNL, MS Research, Nationaal MS Fonds, Nieuw Unicum, NVLF, NVD, MS Zorg Nederland, MS Vereniging Nederland, NVU, NOG, KNGF, EN, NVAB en Archipel tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Hiernaast beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012) op noodzaak tot revisie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Nederlandse Vereniging voor Neurologie (NVN). Richtlijn Multiple sclerose. Utrecht, 2012.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
