Niet-medicamenteuze behandeling van vermoeidheid bij MS
Uitgangsvraag
Wat is de waarde van niet-medicamenteuze behandeling van MS-gerelateerde vermoeidheid?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de waarde van een dieetinterventie bij MS-gerelateerde vermoeidheid?
- Wat is de waarde van fysieke training bij MS-gerelateerde vermoeidheid?
- Wat is de waarde van cognitieve gedragstherapie bij MS-gerelateerde vermoeidheid?
- Wat is de waarde van energiemanagement bij MS-gerelateerde vermoeidheid?
- Wat is de waarde van multidisciplinaire revalidatiebehandeling van MS-gerelateerde vermoeidheid?
Aanbeveling
Zoek uit of er sprake is van primaire of secundaire vermoeidheid bij MS (zie module Diagnostiek van vermoeidheid).
Bespreek samen met de patiënt het inzetten van cognitieve gedragstherapie of fysieke training als behandeling voor MS-gerelateerde vermoeidheidsklachten. Informeer de patiënt hierbij over de inhoud en de belasting van de betreffende interventies. Evalueer het effect van de ingezette behandeling na 3 tot 4 maanden.
Besteed tijdens en na afronding van de gekozen interventie aandacht aan het bestendigen van het effect op de langere termijn.
Zet geen dieetinterventie, energiemanagement of multidisciplinaire revalidatiebehandeling in om MS-gerelateerde vermoeidheid te behandelen. Overweeg de principes van energiemanagement alleen in te zetten als er vragen zijn vanuit de patiënt over het verdelen van de activiteiten over de dag.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de literatuursamenvatting blijkt dat zowel fysieke training als cognitieve gedragstherapie (CGT) klinisch relevante effecten zouden kunnen hebben op vermoeidheidsklachten direct na afloop van de interventie. Energiemanagement en multidisciplinaire interventies lijken geen klinisch relevant effect te hebben op vermoeidheidsklachten. De bewijskracht is echter laag.
Er zijn een aantal belangrijke kanttekeningen te maken bij de gevonden studies en resultaten zoals beschreven in de literatuursamenvatting.
Heterogeniteit steekproeven
Een eerste kanttekening betreft de heterogeniteit binnen en tussen de bestudeerde steekproeven.
We zijn voornamelijk geïnteresseerd in de effecten van de behandelingen bij patiënten met primaire vermoeidheid, waarbij primaire vermoeidheid gedefinieerd wordt als vermoeidheid als directe consequentie van de pathofysiologische mechanismen van MS (Chaudhuri, 2004; MacAllister, 2005). Het onderscheid tussen primaire en secundaire vermoeidheid wordt in de literatuur echter vaak niet zo scherp gemaakt en de afwezigheid van secundaire oorzaken van vermoeidheid is in deze literatuurreview dan ook niet als inclusiecriterium gebruikt. Dit betekent dat in de totale bestudeerde steekproef mogelijk zowel patiënten met primaire vermoeidheid als patiënten met secundaire vermoeidheid zijn opgenomen. Het is onbekend of de gevonden resultaten van toepassing zijn voor een patiëntenpopulatie waarbij uitsluitend sprake is van primaire vermoeidheid. In de dagelijkse praktijk is het belangrijk om wel onderscheid tussen primaire en secundaire vermoeidheid te maken, omdat behandeling zich in het geval van secundaire vermoeidheid in eerste instantie zal moeten richten op het identificeren en behandelen van de (beïnvloedbare) oorzaken daarvan.
In deze literatuurreview is wel de aanwezigheid van vermoeidheid als inclusiecriterium gebruikt: bij de patiënten moest de aanwezigheid van vermoeidheid zijn vastgesteld aan de hand van een gevalideerde vermoeidheidsvragenlijst. De gebruikte vragenlijsten en de daarbij gehanteerde cut-off scores verschilden echter aanzienlijk tussen studies, hetgeen de totale bestudeerde steekproef zeer heterogeen maakt. Het blijft daarmee onduidelijk in hoeverre de hier gevonden resultaten van toepassing zijn voor specifieke subgroepen van patiënten (bijvoorbeeld patiënten met matige versus ernstige vermoeidheidsklachten).
Een derde factor die bijdraagt aan de heterogeniteit van de totale bestudeerde steekproef is het feit dat patiënten met sterk uiteenlopende maten van fysieke beperking zijn geïncludeerd: van zeer mild aangedane patiënten tot patiënten die lopen met een loophulpmiddel. Ook hier blijft het dus onduidelijk in hoeverre de gevonden resultaten van toepassing zijn voor specifieke groepen van patiënten (bijvoorbeeld patiënten met matige versus ernstige fysieke beperkingen). Tegelijkertijd worden niet-ambulante patiënten veelal uitgesloten van deelname aan studies, hetgeen de representativiteit van gebruikte steekproeven beperkt en daarmee de mogelijkheden tot generalisatie van deze onderzoeksresultaten.
Heterogeniteit interventies
Een tweede kanttekening betreft de heterogeniteit van de aangeboden interventies. Er was sprake van grote variabiliteit tussen interventies, onder andere in inhoud, vorm, duur, setting en geboden begeleiding. Dit geldt voor alle typen onderzochte interventies: fysieke training, CGT en energiemanagement. In deze literatuurreview is er desondanks voor gekozen om de diverse studies binnen een type interventie te poolen ten behoeve van meta-analyses; de resultaten van deze meta-analyses moeten vanwege de grote variabiliteit echter met de nodige voorzichtigheid geïnterpreteerd worden.
Duurzaamheid effecten
Hoewel direct na afloop van de interventies klinisch relevante positieve effecten worden gezien, lijkt het effect op lange termijn hiervan voor zowel fysieke training als CGT niet aanwezig. Wat nodig is om het positieve effect te bestendigen verdient nadere studie.
Individuele verschillen in geschiktheid
Bij fysieke training moet de patiënt de mogelijkheid hebben om de belasting en het uitvoeren van de training consequent en langdurig aan te kunnen gaan. Daarnaast is doorzettingsvermogen, eventueel ondersteund door coaching, nodig om het trainingsprogramma te kunnen volhouden.
CGT bij MS-gerelateerde vermoeidheid is gericht op het aanpakken van de factoren in het denken en het handelen die de vermoeidheid onderhouden dan wel versterken. Het is van belang dat de patiënt deze uitgangspunten kan herkennen en onderschrijven. Daarnaast is een goed ontwikkeld vermogen om te reflecteren op het eigen denken en handelen van belang. Wanneer aan een van deze twee voorwaarden niet voldaan is, zal de effectiviteit van de behandeling waarschijnlijk beperkt zijn.
Voorstel werkgroep
De behandeling van vermoeidheid begint bij diagnostiek van factoren die een (ondersteunende) rol kunnen spelen in de vermoeidheid en beïnvloedbaar zijn. Te denken valt aan pijn, nycturie, spasticiteit, slaapstoornis, depressie en bijwerking van medicatie. Zie ook de module Diagnostiek van vermoeidheid. Behandelbare factoren moeten behandeld worden conform geldende standaard. Bij niet-behandelbare factoren kan, mede afhankelijk van de voorkeur van patiënt, een keuze gemaakt worden voor de interventie, waarbij CGT en fysieke training het meest aangewezen zijn.
Om een langdurig effect te bewerkstelligen kan het nuttig zijn om aanvullende sessies of gedeeltelijke herhaling aan te bieden. Naast deze interventies kan het, om de participatie te optimaliseren, nuttig zijn om patiënten door een ergotherapeut te laten begeleiden in het oppakken van activiteiten. Hierbij richt de ergotherapeut zich op het uitvoeren van betekenisvolle activiteiten ondanks vermoeidheid. De principes uit de energiemanagement kunnen hierbij van belang zijn.
Gezien de gevonden resultaten in de literatuuranalyse, raadt de werkgroep af om een dieetinterventie, energiemanagement of multidisciplinaire revalidatiebehandeling in te zetten met het doel om MS-gerelateerde vermoeidheid te behandelen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het belangrijkste doel van deze interventies voor de patiënt is zich minder vermoeid te voelen, met het idee dat zij bijvoorbeeld meer activiteiten op een dag kunnen ondernemen en beter kunnen participeren. Fysieke training en CGT lijken te kunnen bijdragen aan vermindering van de vermoeidheid, maar dit betekent niet automatisch dat ze dan ook altijd een verbetering in activiteiten en participatie geven. Beide typen interventies vragen echter een grote investering van tijd en energie van de patiënt. Niet alle patiënten met MS zullen hiertoe bereid en/of in de gelegenheid zijn. Het is mogelijk dat een subgroep van patiënten met MS de voorkeur geeft aan medicamenteuze behandeling dan wel geen behandeling van vermoeidheid.
Kosten (middelenbeslag)
Er is voor deze module geen onderzoek gedaan naar de kosteneffectiviteit van de verschillende interventies. Echter, de werkgroep is van mening dat, indien de patiënt positief effect ervaart, het positieve effect zal opwegen tegen de kosten.
De kosten die de patiënt moet maken zijn afhankelijk van zorgverzekeringsvoorwaarden, noodzaak van gespecialiseerde zorgaanbieder en bereikbaarheid van zorgaanbod (denk aan reiskosten). Elke patiënt moet hierin in overleg met behandelaar individuele afwegingen maken.
Aanvaardbaarheid, haalbaarheid en implementatie
Qua haalbaarheid is er misschien lichte voorkeur voor fysieke training, omdat fysiotherapie meestal dichtbij patiënt bereikbaar is. Hierbij spelen beschikbaarheid, kosten en wachtlijsten een rol. Fysiotherapie is over het algemeen goed toegankelijk in Nederland, hoewel de kosten voor de patiënt afhankelijk zijn van de zorgverzekering. CGT wordt daarentegen gegeven door psycholoog met specifieke vaardigheden, en met mogelijke wachtlijsten, die de beschikbaarheid verlagen.
Zowel fysieke training als CGT vergen een grote investering van tijd en energie van de patiënt. In de geïncludeerde studies was de adherence vaker suboptimaal. Een goede begeleiding van patiënt bij de afwegingen om voor fysieke training of CGT te kiezen, zal aanvaardbaarheid en haalbaarheid mogelijk kunnen verbeteren.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Fysieke training en CGT lijken klinisch relevante positieve effecten op vermoeidheidsklachten te hebben. Echter, beide typen interventies vergen een grote investering van tijd en energie van de patiënt. Het is aannemelijk dat fysieke training langdurig volgehouden moet worden om blijvend effect op vermoeidheid te sorteren. Vanwege de algemene gezondheidseffecten is het stimuleren van gezond beweeggedrag aan te bevelen. Daarnaast lijkt de duurzaamheid van CBT vooralsnog beperkt.
Vanwege bovengenoemde redenen is het goed om samen met de patiënt een keuze te maken, zodat de interventie passend bij (de situatie van) patient is.
Energiemanagement en multidisciplinaire revalidatiebehandelingen lijken geen klinisch relevant effect te hebben op vermoeidheidsklachten. Voor dieetinterventies is het effect op vermoeidheid niet onderzocht. Deze interventies worden derhalve op dit moment niet aangeraden.
Onderbouwing
Achtergrond
Vermoeidheid is een van de meest gerapporteerde en meest belemmerende klachten en de meest belemmerende factor bij MS. Bij de behandeling van vermoeidheid is lange tijd gedacht dat patiënten met MS veel moeten rusten om energie te sparen en toename van vermoeidheid te voorkomen. De laatste jaren wordt er genuanceerder gedacht over de relatie tussen activiteiten en rust, en wordt er actief behandeling ingezet om de vermoeidheid te verminderen of om er beter mee om te (leren) gaan. Er is echter veel praktijkvariatie in de behandeling van MS-gerelateerde vermoeidheid, en onduidelijkheid over de effectiviteit van de geboden behandelingen. Behandeling kan medicamenteus dan wel niet-medicamenteus van aard zijn. In deze analyse richten we ons op niet-medicamenteuze behandeling van MS-gerelateerde vermoeidheid. Zie hiervoor de module ‘Medicamenteuze behandeling van vermoeidheid’.
Conclusies / Summary of Findings
Zoekvraag 1: Wat zijn de (on)gunstige effecten van een dieetinterventie op MS-gerelateerde vermoeidheid?
Er is geen conclusie mogelijk; er zijn geen studies gevonden die deze zoekvraag beantwoorden.
Zoekvraag 2: Wat zijn de (on)gunstige effecten van fysieke training op MS-gerelateerde vermoeidheid?
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Fysieke training lijkt een klinisch relevant effect te hebben op de vermoeidheidsklachten bepaald na afloop van de interventie bij vermoeide patiënten met MS.
Bronnen: (Heine, 2017; Hebert, 2011; Escudero-Uribe, 2017; Turner, 2016, Mäurer, 2018) |
2. Adverse events (belangrijke uitkomstmaat)
|
Zeer laag GRADE |
Het is onduidelijk of fysieke training effect heeft op het aantal adverse events bij vermoeide patiënten met MS.
Gezien het absolute aantal gemelde AE’s lijkt training wel relatief veilig te zijn.
Bronnen: (Heine, 2017; Hebert, 2011; Escudero-Uribe, 2017, Turner, 2016, Mäurer, 2018) |
Zoekvraag 3: Wat zijn de (on)gunstige effecten van CGT op MS-gerelateerde vermoeidheid?
1. Vermoeidheidsklachten (cruciale uitkomstmaat)
|
Laag GRADE |
Cognitieve gedragstherapie lijkt een gunstig klinisch relevant effect te hebben op de vermoeidheidsklachten bepaald na afloop van de interventie van patiënten met MS.
Bronnen: (Moss-Morris, 2012; Pöttgen, 2018; Thomas, 2013; Van den Akker (2017); Van Kessel, 2008; en Van Kessel, 2016) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
In verband met een zeer laag aantal events en de heterogene wijze waarop deze uitkomstmaat is gerapporteerd, is het niet mogelijk om een conclusie te trekken over het effect van cognitieve gedragstherapie ten opzichte van een controleconditie (standaard zorg, wachtlijst controlegroep, actieve controlegroep) op het aantal adverse events.
Het absolute risico op een adverse event is waarschijnlijk beperkt. |
Zoekvraag 4: Wat zijn de (on)gunstige effecten van energiemanagement op MS-gerelateerde vermoeidheid?
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Energiemanagement lijkt geen klinisch relevant effect te hebben op de vermoeidheidsklachten bepaald na afloop van de interventie van patiënten met MS.
Bronnen: (Blikman, 2017; Finlayson, 2011; Kos, 2007 en Mathiowetz, 2005) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
In verband met een zeer laag aantal events is het niet mogelijk om een conclusie te trekken over het effect van energiemanagement ten opzichte van een controleconditie op het aantal adverse events.
Het absolute risico op een adverse event is waarschijnlijk beperkt. |
Zoekvraag 5: Wat zijn de (on)gunstige effecten van een multidisciplinaire revalidatiebehandeling op MS-gerelateerde vermoeidheid?
1. Vermoeidheid (cruciale uitkomstmaat)
|
Laag GRADE |
Een multidisciplinaire poliklinische revalidatiebehandeling lijkt na afloop van de interventie, ten opzichte van begeleiding door een MS-verpleegkundige, geen klinisch relevant effect te hebben op de vermoeidheidsklachten bij patiënten met MS.
Bronnen: (Rietberg, 2014) |
2. Adverse events (belangrijke uitkomstmaat)
|
- GRADE |
In verband met een zeer laag aantal events is het niet mogelijk om een conclusie te trekken over het effect van een multidisciplinaire poliklinische revalidatiebehandeling ten opzichte van begeleiding door een MS-verpleegkundige op het aantal adverse events. |
Samenvatting literatuur
Zoekvraag 1: Wat zijn de (on)gunstige effecten van een dieetinterventie op MS-gerelateerde vermoeidheid?
Er zijn geen studies gevonden die de PICO beantwoorden
Zoekvraag 2: Wat zijn de (on)gunstige effecten van fysieke training op MS-gerelateerde vermoeidheid?
Beschrijving studies
Er konden vijf studies worden geïncludeerd waarbij het effect van fysieke training is onderzocht (Escudero-Uribe, 2017; Hebert, 2011; Heine, 2017; Mäuer, 2017 en Turner, 2016). De specifieke karakteristieken van de vijf studies zijn weergegeven in tabel 1. De onderzochte interventies verschilden sterk in opzet.
Escudero-Uribe (2017) was een pilot RCT naar de effecten van een trainingsprogramma (aerobe training en stretching) inclusief whole-body vibration (n=19) of balanstraining (n=18), ten opzichte van een conditie waarin geen interventie werd aangeboden tijdens de studieperiode (n=18; wachtlijstcontrolegroep). Vijfenvijftig vermoeide patiënten participeerden in de studie (FSS ≥ 4). Zeven patiënten zijn uitgevallen; vier patiënten zijn geëxcludeerd in verband met een relapse, en drie in verband met onvoldoende therapietrouw (< 30% aanwezig bij de trainingssessies). Alle uitvallers kwamen uit één van de twee interventiegroepen. Als uitkomstmaten zijn de Fatigue Severity Scale (FSS) en de Modified Fatigue Impact Scale (MFIS) meegenomen.
Via de Cochrane review van Heine (2015) kon Hebert (2011) worden geïdentificeerd. Hebert (2011) was een Amerikaanse RCT naar het effect van zes weken vestibulaire revalidatie (n=12) of zes weken fysieke training (aerobe training en stretching; n=12) ten opzichte van geen interventie (n=13; wachtlijstcontrolegroep) op onder andere MS gerelateerde vermoeidheid. Patiënten met MFIS score ≥ 45 en beperkte balans namen deel aan de studie. Eén patiënt uit de wachtlijstgroep is uitgevallen wegens ontevredenheid over zijn/haar allocatie. De resultaten van de vestibulaire revalidatie zijn voor deze literatuursamenvatting niet relevant, en worden verder buiten beschouwing gelaten.
Heine (2017) was een Nederlandse multicenter RCT naar het effect van 16 weken aerobe training op vermoeidheidsklachten, en maakte onderdeel uit van de TREFAMS-ACE study. Negentig ambulante patiënten met ernstige vermoeidheidsklachten (CIS20R ≥35; Checklist Individual Strength) namen deel aan de studie. Het interventieprogramma (n=43) bestond uit 12 door de fysiotherapeut begeleide sessies, en 36 niet-gesuperviseerde trainingen thuis. Patiënten in de controleconditie (n=46) werden 3x45 minuten gezien door een MS-verpleegkundige. De groepen waren niet geheel gelijk: De patiënten in de interventieconditie hadden een lagere EDSS-score (Expanded Disability Status Scale; gemiddeld verschil: -0,6), kortere tijd sinds diagnose (-3,7 jaar), waren jonger (-5,1 jaar) en hadden minder last van de beperkingen bij werk/opleiding. Er waren tijdens de interventieperiode vier drop-outs in de interventieconditie (zwangerschap n=1, niet-gerelateerde comorbiditeit n=1, stemmingsproblemen n=1 en behandelintensiteit n=1) en acht in de controleconditie (moeten reizen n=1, niet-gerelateerde comorbiditeit n=1, te intensief n=1, MS-exacerbatie n=2, onbekend n=2 en ontevreden over de allocatie n=1). Hiernaast misten van een aantal patiënten in de interventieconditie de data. In deze studie werd naast het effect van de interventie op vermoeidheid (CIS20R subschaal vermoeidheid (primaire uitkomstmaat), MFIS, FSS) ook het aantal relapses in kaart gebracht. Data werd geanalyseerd middels longitudinale mixed-model analyses. Hiernaast is er een vergelijking tussen de groepen gemaakt in het aantal patiënten met een klinisch relevante verandering in vermoeidheid (≥ 8 punten op de CIS20R subschaal vermoeidheid).
Mäurer (2017) was een Duitse multicenter RCT naar het effect van een gestructureerd online trainingsprogramma (e-training; bestaande uit twee keer per week krachttraining en één keer per week aerobe training onder supervisie via het internet door een fysiotherapeut of ‘exercise therapist’) ten opzichte van geen e-training op vermoeidheidsklachten bij vermoeide patiënten (MFIS ≥ 14) die behandeld werden met fingolimod. De interventie duurde zes maanden, hierna werd het effect van de interventie geëvalueerd en kregen de patiënten in de controlegroep de gelegenheid deel te nemen aan de e-training. Het streefaantal van 226 patiënten is niet gehaald: uiteindelijk zijn 178 patiënten gerandomiseerd in de studie en is de studie gestopt wegens ‘recruitment saturation’. Van de 94 patiënten in de interventiegroep zijn er tien uitgevallen (terugtrekking consent n=6, adverse events n=2, loss to follow-up n=1, meting overgeslagen n=1), terwijl er van 84 patiënten in de controlegroep zes patiënten zijn uitgevallen (terugtrekking consent n=5, adverse events n=1). Vermoeidheid werd bepaald met de MFIS, en adverse events werden nagevraagd tijdens periodiek telefonisch contact. De data is geanalyseerd met ANCOVA, waarbij de allocatie en geslacht als factoren waren meegenomen en er gecorrigeerd is voor de baseline waarden van de MFIS, EDSS en aeroob vermogen. Novartis Pharma GmbH heeft de studie en ‘medical writing support’ gefinancierd. Zes van de acht auteurs hebben (sterke) banden met farmaceutische bedrijven.
Turner (2016) was een RCT waarin een vergelijking is gemaakt tussen een interventie bestaande uit educatie, grafische feedback, telefonische counseling en ‘telehealth’ monitoring (TC), en een controleconditie bestaande uit alleen ‘self directed’ educatie (EC). De educatie bestond uit de verstrekking van een DVD aan alle patiënten. Op deze DVD werden de gezondheidsvoordelen van fysieke activiteit besproken en stonden educatie, demonstratie en verschillende workouts. Zie ook tabel 1 voor een nadere toelichting op de interventies. Vierenzestig vermoeide patiënten (MFIS ≥ 20) die < 300 minuten per week fysiek actief waren werden geïncludeerd. Eenendertig patiënten werden geloot naar de TC en 33 naar de EC. De interventie duurde zes maanden en het effect op vermoeidheid werd in kaart gebracht met de MFIS. Potentiële adverse events werden uitgevraagd met behulp van de aangepaste 13-item versie van de MS-Related Symptom Checklist. Data werdengeanalyseerd met behulp van ANCOVA, waarbij leeftijd, geslacht, opleidingsniveau en de mobility performance score zijn geïncludeerd als covariaten. Er was slechts één deelnemer met missende gegevens.
Tabel 1 Karakteristieken van de studies waarbinnen het effect van fysieke training is onderzocht
|
Studie |
n interventie/ n controle (totaal)
Belangrijkste inclusiecriteria |
Patiënt-karakteristieken, gemiddelde (standaarddeviatie) |
Interventie |
Controle |
Meetinstrumenten voor vermoeidheid |
Follow-up duur |
Opmerkingen |
|
Escudero-Uribe, 2017 |
19/18/18 (55)
Inclusiecriteria * FSS ≥ 4 * EDSS ≤ 4,5
|
Leeftijd: I-1: 43,1 (10,2) I-2: 40,3 (8,9) C: 43,0 (9,3) Geslacht I-1: 63% vrouw I-2: 64% vrouw C: 78% vrouw %Type MS 100% RRMS EDSS: I-1: 3,0 (1,0) I-2: 3,2 (1,1) C: 3,2 (1,1)
|
Twaalf weken, 2x per week fysieke training (15-30 min aerobic training en 15-30 min oefeningen gebruik makend van lichaamsgewicht, coördinatie- en balansoefeningen waarbij er gebruik werd gemaakt van whole body vibration (I-1) of van een Balance Trainer system (I-2) en 15 min stretching. De duur en de intensiteit namen gedurende het programma toe, van 60 min per week naar 100 min per week, RPE van 11-12 tot 13-15).
Setting: Groepsprogramma, 4-8 patiënten begeleid door een fysiotherapeut. |
Wachtlijstcontrolegroep |
Primair: * FSS * MFIS
|
12 weken |
De demografische gegevens zijn de gemiddelde van de patiënten die de studie hebben afgerond. Er zijn 7 patiënten uitgevallen (I-1: 3, I-2: 4); 4 door relapse en 3 door onvoldoende therapietrouw.
De patiënten hebben respectievelijk 80% (I-1) en 79,5% (I-2) van de sessie gevolgd. |
|
Hebert (2011) (Heine, 2015) |
13/13 (38)
Inclusiecriteria * MFIS ≥ 45 * loopafstand ≥ 100 m met of zonder bijv. een kruk. * verminderde balans staand (<72 op de SOT) |
Leeftijd: I:42,6 (10,4) C: 50,2 (9,2) Geslacht: I: 85% vrouw C: 85% vrouw Type MS: I: 85% RRMS, 15% SPMS C: 92% RRMS, 8% SPMS |
Zes weken, 2x per week, ~40 min fysieke training, gericht op 2x 15 min uithoudingsvermogen (65-75% HRpeak; 11-14 RPE) en stretchen. Hiernaast ook thuistraining en 5 min scholing in vermoeidheidsmanagement.
Setting: Poliklinisch. |
Wachtlijstcontrolegroep |
Primair: *MFIS
|
Postinterventie en 2, 4 weken postinterventie |
|
|
Heine (2017) TREFAMS-ACE studie |
43/46 (89)
Inclusiecriteria * CIS20R subschaal vermoeidheid ≥ 35 * EDSS ≤ 6,0
Exclusiecriteria HADS >11.
|
Leeftijd: I: 43,1 (9,8) C: 48,2 (9,2) Geslacht I: 74% vrouw C: 72% vrouw %Type MS I: 72% RRMS, 21% PPMS C:74% RRMS, 15% PPMS EDSS: (Mediaan, IQR) I: 2,5 (2,0-3,5) C: 3,0 (2,0-3,5) ziekteduur (mediaan, IQR): I: 7,0 (2,0-10,0) C: 12,0 (2,0-19,0) |
Zestien weken, 3x per week 30 min aerobic interval training op een fietsergometer. Een training bestond uit 6 intervallen, waarbinnen er 3 min op 40% van Wmax (bepaald tijdens CPET op baseline en na 8 weken) werd gefietst, gevolgd door 1 min op 60% en 1 min op 80%.
Setting: 12 gesuperviseerde trainingen door een fysiotherapeut (polikliniek) en 36 onbegeleide trainingen thuis. |
Zestien weken, drie consulten van 45 minuten bij de MS verpleegkundige. Patiënten kregen onder andere informatie over MS gerelateerde vermoeidheid. Ook werd aangegeven dat de zorgen van de patiënt serieus werden genomen. |
Primair: *CIS20R fatigue subschale
Secundair: * MFIS * FSS * overige schalen van de CIS-20r
|
Postinterventie, 6 en 12 maanden |
De gemiddelde (SD) therapietrouw (adherence) in de interventiegroep was 74% (25) voor het aantal sessies en 71% (25) voor de voorgeschreven intensiteit en tijd. Therapietrouw was lager in de tweede 8 weken van het trainingsprogramma (p<0,05).
87% van de patiënten in de controlegroep heeft de drie sessies bij de MS verpleegkundige gevolgd. |
|
Mäurer, 2017 |
94/84 (178)
Inclusiecriteria * EDSS ≤ 3,5 * stable fingolimod therapy for > 1 month
|
Leeftijd: I: 40,9 (10,4) C: 39,4 (8,7) Geslacht I:68,8 % vrouw C:67,9 % vrouw %Type MS 100% RRMS EDSS: I: 2,2 (1,0) C:2,2 (1,1, Aantal relapses in de laatste 6 maanden: I: 100% 0, 0% 1 C: 95,2 % 0, 4,8% 1
|
Zes maanden, geïndividualiseerd trainingsprogramma, 2x in de week krachttraining en 1x per week training op uithoudingsvermogen. Balans en oefeningen gericht op de ‘core stabiliteit’ konden worden toegevoegd. Het schema werd uitgelegd tijdens een tweedaagse introductie groepssessie. De intensiteit was matig en progressief. Patiënten hielden een beweegdagboek bij en noteerde uitgevoerde oefeningen.
Setting: online, thuis. Begeleiding door een fysiotherapeut of ‘exercise therapist’. |
Wachtlijstcontrolegroep |
Primair: *MFIS
Secundair: * Würzburg Fatigue Inventory for MS scale
|
Postinterventie en na 12 maanden. |
Compliance varieerde tussen de 0 en 442%. 39,8% van de patiënten was niet therapietrouw volgens de gebruikte definities (70% van de sessies gevolgd tussen maand 1 en 6, en meer dan 80% van de sessies in de maanden 5 en 6). |
|
Turner (2016) |
31/33 (64)
Inclusiecriteria * MFIS ≥ 20 * EDSS-S ≤ 6.5 * minder dan 300 minuten per week fysiek actief
|
Leeftijd: I: 52,7 (11,6) C: 53,6 (13,1) Geslacht I: 29% vrouw C: 42% vrouw %Type MS I: 65,5% RRMS C: 69,7% RRMS MS-gerelateerde beperking zoals bepaald met de Mobility performance Scale : I: 2,35 (1,5) C: 2,73 (1,4) Medicatie voor depressie I: 73,3 (22) % ja C: 57,6 (19) % ja
|
Zes maanden. Naast de DVD (zie hiernaast) ook telefonische counseling en telehealth monitoring om fysieke activiteit te promoten. De telefonische counseling bestond uit 6-wekelijkse sessies waarin geïndividualiseerde feedback en ondersteuning werden gegeven, en waarbij gebruik werd gemaakt van de principes van motivational interviewing. Deze counseling had als doel de patiënten te motiveren en vertrouwen te geven. Voor de telehealth monitoring ontvingen de patiënten een ‘apparaat’ dat aangesloten kon worden op de telefoonlijn. De monitor kon een herinneringen geven voor het doen van fysieke activiteit en vroeg de deelnemer elke week naar de gedane fysieke activiteit en de voorgang qua doelen. Patiënten die de doelen niet haalden kregen vragen over de ervaren barrières. Patiënten die de vragen niet invulden of de doelen niet haalden werden gebeld voor extra counseling en waar nodig het oplossen van problemen. |
Alle patiënten ontvingen een DVD waarin de gezondheidsvoordelen van regelmatige fysieke activiteit werden uitgelegd, en waarop ook een educatieprogramma en specifieke workouts stonden. Patiënten werden aangeraden de DVD te bekijken en gebruik te maken van de aanbevelingen op de DVD. |
Primair: * MFIS
|
6 maanden |
99,5% van alle telefonisch counselingsessies zijn doorgegaan, gemiddelde totale tijd van de sessies was 285 min. Gemiddeld is er 1 extra gesprek (gemiddeld 41,8 min) ondernomen.
Percentage dat medicatie tegen depressie neemt: I: 73% C: 58% |
RRMS: relapsing-remitting MS; SPMS: Secondary progressive MS; PPMS: primary-progressive MS; I: Interventie; C: Controleconditie; IQR: interkwartielafstand; EDSS: Expanded Disability Status Scale; SOT: Sensory Organization Test, HRpeak: peak heart rate, RPE: Borg Rating of Perceived exertion, CPET: cardiopulmonary exercise test; HADS: Hospital Anxiety and Depression Schale.
Meetinstrumenten:
MFIS: Modified Fatigue Impact Scale, 21-items, schaal van 0-84, meet de ervaren impact van vermoeidheid. Hogere scores impliceren een grotere impact van de vermoeidheid.
FSS: 9-items, meet de ernst van de vermoeidheid. Hogere scores impliceren meer ernstige vermoeidheid.
CIS-20R fatigue subscale: Checklist Individual Strength fatigue subscale; 8 items op een 7-punt likert schaal, totaalscore tussen 8 en 56 punten, evalueert diverse aspecten van vermoeidheid.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
De resultaten van de individuele studies op vermoeidheid zijn weergegeven in de bijlage (evidencetabellen). De scores op de vermoeidheidsschalen die waren geïncludeerd als primaireuitkomstmaat en zoals bepaald na afloop van de interventie of na gelijke tijd voor de controlegroep, zijn gepoold, zie ook figuur 1. Van Escudero-Uribe (2017) zijn de scores op de FSS van de whole body vibration groep en de controlegroep geïncludeerd. De resultaten van Mäurer (2018) konden niet geïncludeerd worden, aangezien de post-interventie waarden voor de groepen niet zijn gerapporteerd.
De meta-analyse laat zien dat de vermoeidheidsklachten statistisch significant en klinisch relevant minder zijn na afloop van een interventie bestaande uit fysieke training dan na gelijke tijd in een controleconditie (gestandaardiseerd gemiddeld verschil (SMD): -0,51, 95% -0,80 tot -0,23). In Maürer (2018) was er geen statistisch significant verschil en waarschijnlijk ook geen klinisch relevant verschil tussen de groepen gedurende de studieperiode (β=-2,4, 95%BI -5,7 tot 0,92; MFIS); analyses gecorrigeerd voor baseline waarden.
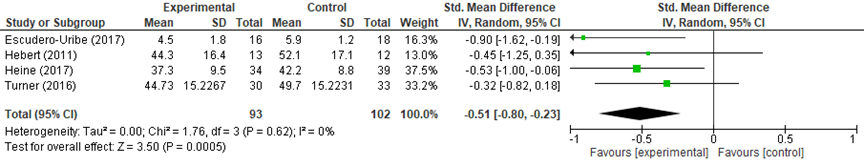
Figuur 1 Het effect van fysieke training/activiteit op vermoeidheidsklachten direct post-interventie
2. Adverse events (belangrijke uitkomstmaat)
Escudero-Uribe (2017) rapporteerde dat er geen sprake was geweest van ongelukken of adverse events gerelateerd aan training.
Hebert (2011) rapporteerde dat één patiënt uit de fysieke training groep door de enkel was gegaan tijdens een training.
Heine (2017) rapporteerde dat de odds voor mensen met relapsing-remitting MS om een relapse te rapporteren 0,3 (95%BI 0,1 tot 0,8) in het voordeel was van de interventiegroep. De odds om voor een relapse behandeld te worden met steroïden voor patiënten met relapsing-remitting MS was 0,9 (95%BI 0,2 tot 3,7; analyses gecorrigeerd voor ziekte-ernst).
Mäurer (2018) rapporteerde een incidentie van AE’s van 58,5% voor de interventiegroep en van 60,7% voor de controlegroep. Er was één SAE in de controlegroep (toename gamma-glutamyl transferase). 89,4% van de patiënten in de interventiegroep en 95,2% in de controlegroep waren ‘relapsvrij’.
Turner (2016) rapporteerde dat er geen statistisch significante verschillen waren in MS-symptomen tussen de groepen tijdens de studieperiode (data verder niet gerapporteerd).
Bewijskracht van de literatuur
RCT’s beginnen op een hoge bewijskracht. De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (geen blindering; risk of bias) en de imprecisie (de grens van klinische relevantie ligt binnen het betrouwbaarheidsinterval). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events is met drie niveaus verlaagd, gezien de beperkingen in de onderzoeksopzet (geen blindering; risk of bias), de imprecisie (beperkte aantal events en de studies zijn niet ontworpen om verschillen in AE’s aan te tonen, waarschijnlijk zijn de studies dus ‘underpowered’ geweest) en de heterogeniteit in hoe deze uitkomstmaat is bepaald in de verschillende studies. De uiteindelijke bewijskracht is zeer laag.
Zoekvraag 3: Wat zijn de (on)gunstige effecten van CGT op MS-gerelateerde vermoeidheid?
Beschrijving studies
In totaal konden voor deze uitgangsvraag vijf RCT’s worden geïncludeerd. Drie van deze RCT’s zijn beschreven in de review van Wendebourg (2016). Deze review en de overige twee RCT’s worden hieronder kort besproken, de studiekarakteristieken zijn verder weergegeven in tabel 2. De onderzochte interventies verschilden sterk in setting en de mate van begeleiding.
Wendebourg (2017) was een systematische review naar het effect van patiënteducatieprogramma’s op vermoeidheid bij MS. PubMed en de Cochrane Library werden met een beperkte zoekstrategie tot januari 2016 doorzocht. RCT’s waarin tenminste 30 patiënten hadden deelgenomen (die niet per se vermoeid waren) en vermoeidheid de primaire uitkomstmaat was, werden geïncludeerd. Een educatieprogramma was gedefinieerd als een interventie waar patiënten informatie of scholing krijgen in strategieën om met de vermoeidheid om te gaan. De Cochrane Risk of Bias tool is gebruikt om het risico op vertekening van de geïncludeerde studies in kaart te brengen.
De drie door Wendebourg (2017) geïncludeerde studies waaraan specifiek patiënten met vermoeidheidsklachten hadden deelgenomen en de interventie specifiek uit CGT bestond zijn onder deze vergelijking opgenomen (Moss-Morris, 2012; Thomas, 2013 en Van Kessel, 2008). Een aantal gegevens over deze studies zijn door Wendebourg (2017) niet beschreven, om de gegevens aan te vullen zijn de methode- en resultatensecties van de individuele studies geraadpleegd.
Pöttgen (2018) was een RCT waarin het effect van een online aangeboden 12 weken durende CGT-interventie (ELEVIDA) werd onderzocht. Patiënten met een score van ≥ 43 op de Fatigue Scale of Motor and Cognition (FSMC) werden na het invullen van de baseline vragenlijsten gerandomiseerd naar de interventie (n=139) of de controlegroep (n=136). De uitval in deze studie was behoorlijk (19%; veelal onbekende redenen) en groter in de interventiegroep (na 12 weken n=36) dan in de controlegroep (na 12 weken n=9). De auteurs rapporteren echter dat de drop-outs vrij extreme toename in vermoeidheid moeten hebben gehad voordat de resultaten qua conclusie op basis van statische significantie zouden veranderen. Het effect van de interventie werd primair geëvalueerd op de Chalder Fatigue scale. Een van de co-auteurs werkt voor het bedrijf dat het programma heeft ontwikkeld en uitgeeft.
Van den Akker (2017), onderdeel van TREFAMS-ACE programma, was een Nederlandse multicenter RCT naar het effect van CGT (n=44) ten opzichte van een controleconditie die bestond uit drie 45 minuten consulten door een verpleegkundige (n=47). Het interventieprogramma duurde vier maanden, en in deze vier maanden werden 12 sessies bij gecertificeerde psychologen aangeboden. Vermoeidheid werd in kaart gebracht met behulp van de CIS20r subschaal vermoeidheid (primaire uitkomstmaat), de FSS en de MFIS. Het aantal uitvallers en het aantal non-responders was na vier maanden groter in de controlegroep (zes non-responders en zes drop-outs) dan in de interventiegroep (twee non-responders en drie drop-outs). Data werd geanalyseerd middels mixed-model analyses. Hiernaast is er een vergelijking tussen de groepen gemaakt in het aantal patiënten met een klinisch relevant verandering in vermoeidheid (≥8 punten op de CIS20R subschaal vermoeidheid).
Tabel 2 Karakteristieken van de studies waarbinnen het effect van CGT is onderzocht
|
Studie |
n interventie/ n controle (totaal)
Belangrijkste inclusiecriteria |
Patiënt-karakteristieken, gemiddelde (standaarddeviatie) |
Interventie |
Controle |
meetinstrumenten voor vermoeidheid |
Follow-up duur |
opmerkingen |
|
Moss-Morris (2012)
|
23/22 (45)
Inclusiecriteria * Fatigue scale ≥4 bij gebruik van binaire scoringsmethode (Chalder) * Ambulant, mogelijkheid om > 100 te lopen met of zonder stok.
|
Leeftijd: I: 40,1 (17,8) C: 41,8 (11,4) Geslacht I: 70% vrouw, C: 94% vrouw Type MS: I: RRMS 43,5%, SPMS 30,4% C: RRMS 70,6%, SPMS 11,8% Time sinds diagnoses in jaren I: 21 (9,1) C:16 (7,9) In staat om 500 m of meer te lopen zonder hulpmiddel of rust: I: 39,1% ja C: 58,8% ja |
Acht tot tien weken durende online interactieve CGT-behandeling (MS Invigor8) met 8 25-50 minuten durende sessies met huiswerkopdrachten. Hiernaast tot 3 30-60 min telefonische sessies ter ondersteuning.
Setting: Online en telefonisch |
Standaardzorg. Deze groep kreeg na de follow-up meting toegang tot het online gedeelte. |
Primair: * Ordinale versie van de Fatigue scale *MFIS
|
10 weken |
Bij 5 patiënten in de controlegroep was er een ‘bug’ die zorgde dat ze al toegang hadden tot het online gedeelte van het programma. Deze patiënten zijn geëxcludeerd.
20 van de 23 patiënten in de interventiegroep en 16 van de 17 patiënten in de controlegroep hebben deelgenomen aan follow-up metingen.
Het gemiddeld aantal gevolgde sessies na 10 weken was 4,9. Slechts 1 patiënt heeft alle 8 de sessies gevolgd en 3 hadden 7 sessies gevolgd. 65-91% van de telefoonsessies zijn uitgevoerd. |
|
Pöttgen (2018) |
139/136 (275)
Inclusiecriteria * Fatigue Scale of Motor and Cognition ≥43
|
Leeftijd: I: 40,8 (11,1) C: 41,9 (9,4) Geslacht: I: 82% vrouw C: 79% vrouw Type MS: I: RRMS 70,5%, SPMS 15,1% C: RRMS 75,0% SPMS 14% Ziekte modificerende behandelingen: I: 30,9% nee C: 16,9% nee Antidepressiva: I: 23,7% ja C: 20,6% ja |
Twaalf weken durend interactief vermoeidheidmanagement programma met huiswerkoefeningen, en dat gebaseerd is op de principes van CGT en gerelateerde psychotherapeutische benaderingen. Patiënten werden aangeraden het programma één of twee keer per week te bezoeken.
Setting: online |
Wachtlijstcontrole, men kreeg na 24 toegang tot het programma. |
Primair * Chalder Fatigue Scale
Secundair * Fatigue Scale for Motor and Cognitive functions |
12 (post interventie) en 24 weken |
Patiënten uit de interventiegroep hebben het programma gemiddeld 14,5 keer geopend. 11% heeft het programma nooit geopend.
|
|
Thomas (2013) |
84/80 (164)
Inclusiecriteria * FSS≥4 * ambulant
|
Leeftijd: I: 48,0 (10,2) C: 50,1 (9,1) Geslacht: I: 73% vrouw C: 73% vrouw Type MS (zelf gerapporteerd): I: RRMS 43%, SPMS: 20% C: RRMS 51%, SPMS 29% |
CGT en energie effectiviteitstraining om vermoeidheidservaringen te normaliseren, behulpzame manieren van denken over vermoeidheid aan te leren en het gebruik van energie meer efficiënt te maken. De interventie bestond uit 6 90 min durende sessies begeleid door 2 zorgverleners (verpleegkundigen, ergotherapeuten of fysiotherapeuten).
Setting: Groepstherapie, n= 6 tot 12. Voornamelijk gegeven in hotels. |
Standaardzorg |
Primair: Global Fatigue Severity subscale van de FAI
secundair: * De overige subschalen van de FAI * Fatigue Symptom Inventory
|
Eén en 4 maanden na het einde van het programma.
1 jaar (Thomas, 2014). |
Aanwezigheid bij de sessies varieerde tussen de 70 en 81%. Tweeënzeventig patiënten hebben tenminste 4 sessies gevolgd. Tien patiënten hebben geen enkele sessie gevolgd. Twee patiënten zijn na de eerste sessie gestopt.
Dertien patiënten uit de interventiegroep hebben niet deelgenomen aan de eerste follow-up meting (non-responders n=7, uitgevallen i.v.m. persoonlijke redenen n=2, niet fit n=1, relapse n=1, longontsteking n=1, vragenlijst kwijt in de post n=1), tegen 5 patiënten in de controlegroep (non-responders n=2, uitgevallen i.v.m. persoonlijke redenen n=1, nieuwe ziekte n=1, te veel op bord n=1). |
|
Van den Akker (2017) |
44/47 (91)
Inclusiecriteria * CIS20r fatigue ≥35 * EDSS≤6
Exclusiecriteria HADS >11 |
Leeftijd: I: 50,6 (8,3) C: 46,4 (11,6) Geslacht: I: 71% vrouw C: 83% vrouw Type MS I: RRMS 73%, SPMS: 11% C: RRMS 75%, SPMS 15% Tijd sinds diagnose, mediaan (IQR): I: 8,2 (2,9-14,2) C:5,2 (2,1-1,5) Mediaan EDSS (IQR): I: 3,0 (2,8-3,6) C: 2,5 (2,3-3,0) HADS depressie I: 5,6 (3,6) C: 4,8 (2,8) |
Zestien weken ‘patiënt tailored’ CGT bestaande uit 12 sessies begeleid door een gecertificeerde psycholoog. Onderdelen waren het geven van informatie, het formuleren van doelen, adresseren van de gedachten en gedragingen die de vermoeidheid in stand houden, het integreren van de opgedane vaardigheden in het dagelijkse leven en het omgaan met teruggekeerde vermoeidheid.
Setting: Individueel, persoonlijk contact |
Drie consulten van 45 min in 16 weken bij de MS verpleegkundige (aandachtcontrole). Patiënten kregen onder andere informatie over MS gerelateerde vermoeidheid. Ook werden de persoonlijke ervaringen van patiënten met het omgaan met vermoeidheid bediscussieerd.
Setting: Individueel, persoonlijk contact |
Primair * CIS-20r fatigue subscale
Secundair * FSS * MFIS * overige schalen van de CIS-20r
|
Postinterventie, (16 weken), half jaar en na 1 jaar
|
64% van de patiënten in de interventiegroep heeft ≥10 sessies gevolgd. 79% van de patiënten in de controlegroep heeft de drie gesprekken bij de verpleegkundige gehad.
|
|
Van Kessel (2008)
|
35/37 (72)
Inclusiecriteria * EDSS≤6 * Fatigue scale ≥4
Exclusiecriteria psychologische aandoeningen waarbij deelname aan de studie ongepast zou zijn.
|
Leeftijd: I:42,9 (9,3) C:47,0 (9,5) Geslacht I: 80% vrouw C: 70% vrouw Type MS: I: RRMS 66%, SPMS: 31% C: RRMS 49%, SPMS 30% Gemiddelde EDSS: I: 3,0 (1,8) C: 3,8 (1,5) |
Acht weken durende CGT, inclusief huiswerkopdrachten, 8 maximaal 50 minuten durende sessies die werden geïndividualiseerd en begeleid door een klinisch psycholoog.
Setting: Persoonlijk (3 sessies) en telefonisch contact (5 sessies) |
Acht weken durende relaxatietraining, 8 maximaal 50 minuten durende sessies, ter controle voor de aandacht en tijd van de behandelaar in de interventiegroep. Doel was dat patiënten leerden hoe bewust te ontspannen en de spierspanning te verlagen.
Setting: zelfde als interventie. |
* Fatigue Scale
|
Postinterventie, 3 en 6 maanden na de behandeling |
De twee interventies werden gegeven door dezelfde psycholoog.
Eén patiënt uit de interventiegroep heeft niet deelgenomen aan de laatste follow-up meting (geen tijd). Twee patiënten uit de relaxatiegroep hebben de interventie niet gekregen (geen tijd, interventie niet nuttig) en (waarschijnlijk dezelfde) 2 patiënten zijn uitgevallen. |
I: Interventie; C: Controleconditie; EDSS: Expanded Disability Status Scale, RRMS: Relapsing-remitting MS; SPMS: Secondary progressive MS; I: Interventie; C: Controleconditie; IQR: interkwartielafstand; CGT: Cognitieve gedragstherapie
*Meetinstrumenten
FAI: Fatigue Assessment Instrument: potentiële range 1-7, hogere scores impliceren een grotere vermoeidheid.
FIS: 40-items, meet de ervaren impact van vermoeidheid. Hogere scores impliceren een grotere impact van de vermoeidheid.
FSS: 9-items, meet de ernst van de vermoeidheid. Hogere scores impliceren meer ernstige vermoeidheid.
MFIS: 21-items, meet de ervaren impact van vermoeidheid. Hogere scores impliceren een grotere impact van de vermoeidheid.
(Chalder) Fatigue scale: 11-items, meet de ernst van de fysieke en mentale vermoeidheid.
work and Social adjustment scale: meet de beperkingen die men ervaart door de vermoeidheid.
CIS-20R: Checklist Individual Strength fatigue subscale; 8 items, totaalscore tussen 8 en 56 punten, evalueert diverse aspecten van vermoeidheid.
GFS: Global Fatigue Severity subscale van de Fatigue Assessment Instrument, range 1-7, hogere scores impliceren ernstigere vermoeidheid.
FSMC: Fatigue Scale for Motor and Cognitive Functions.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
De resultaten van de individuele studies zijn opgenomen in de bijlage (Evidencetabellen). De post-interventie resultaten van de geïncludeerde studies zijn gepooled, zie figuur 2. Moss-Morris (2012) heeft niet specifiek benoemd wat de primaire uitkomstmaat was, voor deze studie zijn de resultaten op de (Chalder) Fatigue Scale geïncludeerd. De resultaten van de studie van Pöttgen (2018) konden niet worden geïncludeerd, aangezien de ruwe data alleen zijn weergegeven in een klein figuur.
CGT had een gunstig effect op de vermoeidheidsklachten in vergelijking tot de geïncludeerde controle condities: SMD: -0,59, 95%BI -1,04 tot -0,13, I2=73% (resultaten niet weergegeven). Zoals in bovenstaande alinea beschreven konden de resultaten van Pöttgen (2018) niet worden geïncludeerd in de analyse, in deze studie werd een statistisch significant verschil gevonden tussen de groepen in scores op de Chalder Fatigue Scale bij het meetmoment na 12 weken, in het voordeel van de interventiegroep (gemiddeld verschil =-2,7, 95%BI -1,2 tot -4,3; analyses met multipele imputaties en gecorrigeerd voor baseline waarden en geslacht).
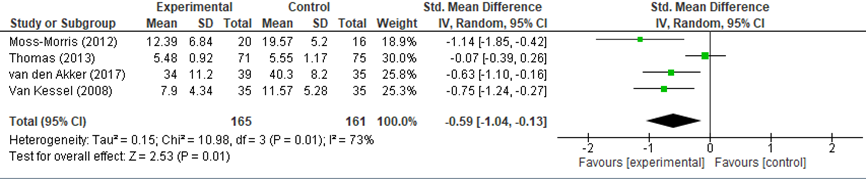
Figuur 2 Het effect van CGT op vermoeidheidsklachten direct post-interventie
2. Adverse events (belangrijke uitkomstmaat)
Moss-Morris (2012) rapporteerde dat er geen adverse events waren gemeld.
Pöttgen (2018) rapporteerde dat één patiënt uit de controlegroep onverwacht was gestorven, er was verder weinig informatie over deze SAE bekend. Verder waren er acht patiënten uit de interventiegroep en 23 in de controlegroep waarbij de vermoeidheid was toegenomen. Elf patiënten (vijf in de interventiegroep en zes in de controlegroep) overschreden gedurende de studie de klinische grens voor depressie (HADS-D>8) en 17 de grens voor angst (respectievelijk zes en 11 patiënten).
Thomas (2013) rapporteerde dat er geen adverse events zich hadden voorgedaan.
Van Kessel (2008) heeft deze uitkomstmaat niet gerapporteerd. Van Kessel (2008) noemt wel dat zeven patiënten een relapse hebben gehad, maar niet de verdeling van deze patiënten over de studie-armen.
Van der Akker (2017) rapporteerde dat zich tijdens de studieperiode één SAE (relaps; met ziekenhuisopname) in de CGT-groep en twee SAE’s in de controlegroep (relaps n=1, galblaasoperatie n=1) hadden voorgedaan.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geen blindering, in sommige studies ook loss to follow-up) en de imprecisie (de grens van klinische relevantie wordt overschreden). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat adverse events is in verband met het lage aantal cases en de heterogeniteit waarop deze uitkomstmaat is bepaald, niet gegradeerd.
Zoekvraag 4: Wat zijn de (on)gunstige effecten van energiemanagement op MS-gerelateerde vermoeidheid?
In totaal konden er vier RCT’s worden geïncludeerd. Drie van deze RCT’s zijn beschreven in de review van Wendebourg (2017). Deze review en de overige RCT worden hieronder kort besproken, de studie karakteristieken zijn verder weergegeven in tabel 3.
Wendebourg (2017) was een systematische review naar het effect van patiënteducatieprogramma’s op vermoeidheid bij MS. PubMed en de Cochrane Library werden met een beperkte zoekstrategie tot januari 2016 doorzocht en RCT’s waarin tenminste 30 patiënten (die niet per se vermoeid waren) hadden deelgenomen en vermoeidheid de primaire uitkomstmaat was geïncludeerd. Een educatieprogramma was gedefinieerd als een interventie waar patiënten informatie of scholing krijgen in strategieën om met de vermoeidheid om te gaan. De Cochrane Risk of Bias tool is gebruikt om het risico op vertekening van de geïncludeerde studies in kaart te brengen.
De drie door Wendebourg (2017) geïncludeerde studies waaraan specifiek patiënten met vermoeidheidsklachten hadden deelgenomen en waarbinnen de interventie specifiek uit energiemanagement of zelfmanagement bestond zijn onder deze vergelijking opgenomen (Finlayson, 2011; Kos, 2007 en Mathiowetz, 2005). Een aantal gegevens over deze studies zijn door Wendebourg (2016) niet beschreven, om de gegevens aan te vullen zijn de methode- en resultatensecties van de individuele studies geraadpleegd.
Blikman (2017), onderdeel van het TREFAMS-ACE-programma, was een Nederlandse multicenter RCT naar het effect van energiemanagement (n=36) ten opzichte van een controleconditie (n=40; zie hieronder). Oorspronkelijk namen 86 patiënten deel. Echter tien patiënten (zes uit de interventiegroep en vier uit de controlegroep) zijn uitgevallen gedurende de interventieperiode, en men heeft deze patiënten verder geëxcludeerd. Het interventieprogramma duurde vier maanden. Patiënten volgden in deze periode 12 sessies bij een ergotherapeut. De patiënten uit de controlegroep volgden drie consulten van 45 minuten bij een verpleegkundige. Vermoeidheid werd in kaart gebracht met behulp van de CIS20r subschaal vermoeidheid (primaire uitkomstmaat), de FSS en de MFIS. Data werden geanalyseerd middels linear mixed-model analyses.
Tabel 3 Karakteristieken van de studies waarbinnen het effect van energiemanagement is onderzocht
|
Studie |
n interventie/ n controle (totaal)
Belangrijkste inclusiecriteria |
Patiënt-karakteristieken, gemiddelde (standaarddeviatie) |
Interventie |
Controle |
Meetinstrumenten voor vermoeidheid |
Follow-up duur |
opmerkingen |
|
Blikman (2017) |
36/40 (86)
inclusiecriteria * CIS20r subschaal vermoeidheid ≥35 * EDSS≤6
Exclusiecriteria HADS >11 |
Leeftijd I: 47,7 (11,0) C: 46,6 (11,5) Geslacht I: 81% vrouw C: 68% vrouw %Type MS I: RRMS 76%, SPMS 17%. C: RRMS 73%, SPMS 16%. EDSS, mediaan (IQR) I: 2,5 (2-4) C: 1.8 (1-4)
|
Energieconservatieprogramma, 12 sessies in 4 maanden door een ergotherapeut.
Setting: individueel |
Drie consulten van 45 minuten in 16 weken bij de MS verpleegkundige. Patiënten kregen onder andere informatie over MS gerelateerde vermoeidheid. |
Primair: CIS-20r subschaal vermoeidheid
secundair: * FSS * MFIS * overige schalen van de CIS-20r
|
Postinterventie (16 weken), na een half jaar en na 1 jaar
|
85% (van de 34 evalueerbare patiënten) had ≥ 6 strategieën geïmplementeerd, met een gemiddelde van 10 strategieën. Deze strategieën werden als effectief gezien (gemiddelde score 7).
Therapietrouw: I: 83% C: 86% |
|
Finlayson (2011)
|
94/96 (190)
Inclusiecriteria * FSS≥4 * Weighted score on the short version of the Blessed Orientation Memory Concentration test ≥12
|
De demografische gegevens zijn alleen voor de gehele groep gegeven.
Leeftijd: 56 (9) geslacht: 79% vrouw Type MS: RRMS 52%, SPMS 22%
“Allocation group comparisons confirmed the success of the random allocation.” |
Zes weken durend vermoeidheidsmanagement-programma. Wekelijks 70 min teleconference begeleid door ergotherapeut. Hiernaast ontvingen de deelnemers een handleiding met een beschrijving van de grote lijnen van de sessies, een ‘worksheet’ en huiswerkopdrachten.
Setting: Groep (n=5-7) |
Wachtlijstcontrole, na eerste meetmoment kreeg deze groep de interventie aangeboden. |
Primair * FIS * FSS |
Zeven weken, en na 6 weken, drie maanden en 6 maanden follow-up. Vergelijking tussen de groepen alleen op 6 weken mogelijk. |
Zevenenzeventig van de 94 patiënten hebben de interventie ontvangen en gevolgd.
Data waren beschikbaar van 89 patiënten in de interventiegroep en 92 in de wachtlijstgroep. |
|
Kos (2007)
|
28/23 (51)
Inclusiecriteria * ≥ 3 op de fatigue subscale of the Guy’s Neurological Disability Scale * ambulant voor >100m zonder hulpmiddel
|
Leeftijd I:42,9 (9,1) C:44,5 (9,9) Geslacht I:71% vrouw C:65% vrouw %Type MS I: RRMS 72% C: RRMS 61% |
Vier weken durend vermoeidheidsmanagement-programma waarin er informatie werd gegeven en er werd gediscussieerd. Vier 2 uur durende sessies. Onderwerpen die bijv. aan bod kwamen: strategieën om met vermoeidheid om te gaan, medicamenteuze behandeling, dieet, het informeren en omgaan met de omgeving, slaap en beweging.
Setting: Groep |
Vier weken placebo (vier 2 uur sessies) en wachtlijstcontrole. Tijdens de placebobehandeling werden onder andere rijvaardigheid, communicatieve vaardigheden en manieren om te tillen besproken. Deze groep kreeg na 6 maanden de interventie aangeboden. |
Primair: MFIS
Secundair: * FSS |
Drie werken en 6 maanden na het programma. |
De uitval was 21%, n=4 in de interventiegroep (toenamen in symptomen n=1, heeft minder dan ¾ van het programma gevolgd n=1, heeft de follow-up metingen niet gedaan n=2) en n=6 in de controlegroep (verlies van interesse na de randomisatie n=4, niet deelgenomen aan de follow-up meting n=1, heeft minder dan ¾ van het programma gevolgd n=2).
52% implementeerde al ≥ 3 strategieën op baseline, 54% rapporteerde de implementatie van ≥ 3 strategieën na de interventie en 48% bij de laatste follow-up. |
|
Mathiowetz (2005)
|
78/91 (169)
Inclusiecriteria * FSS≥4
|
De gegevens zijn alleen voor de gehele groep gegeven. Leeftijd: 48,3 (8,4) Geslacht: 82,8 %vrouw Type MS: RRMS 61,5%, SPMS 18,9%
Other factors affecting fatigue: yes 24,3%#
Er waren geen statistisch significante verschillen in patiëntkarakteristieken per groep. |
Zes weken durend Energieconservatieprogramma. Zes 2 uur durende gestructureerde sessies begeleid door ergotherapeuten. De interventie was gebaseerd op de ‘theory of psychoeducational group development’ en onderdelen die aan bod kwamen waren onder andere het belang van rust gedurende de dag, positieve en effectieve communicatie en prioriteren stellen.
Setting: Groep, bestaande uit 7-10 patiënten. In gemeenschapsgebouwen (onder andere kerken, bibliotheken). |
Wachtlijscontrole. |
*FIS |
7 en 13 weken, maar gezien het design van de studie zijn de resultaten op 13 weken voor deze vergelijking niet interessant. |
N=16 in de interventiegroep en n=22 in de controlegroep hebben de interventie niet ontvangen. 78% van de patiënten participeerden in ≥5 sessies.
De baseline FIS werd ingevuld na allocatie. |
I: Interventie; C: Controleconditie; EDSS: Expanded Disability Status Scale, RRMS: Relapsing-remitting MS; SPMS: Secondary progressive MS; I: Interventie; C: Controle conditie; IQR: interkwartielafstand.
#onduidelijke welke factoren hierbij werden meegenomen.
*Meetinstrumenten
FIS: 40-items, meet de ervaren impact van vermoeidheid. Hogere scores impliceren een grotere impact van de vermoeidheid.
FSS: 9-items, meet de ernst van de vermoeidheid. Hogere scores impliceren meer ernstige vermoeidheid.
MFIS: 21-items, meet de ervaren impact van vermoeidheid. Hogere scores impliceren een grotere impact van de vermoeidheid.
CIS-20R: Checklist Individual Strength, fatigue subscale; 8 items, totaalscore tussen 8 en 56 punten, evalueert diverse aspecten van vermoeidheid.
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
Van slechts twee van de vier studies zijn de resultaten dusdanig gepresenteerd dat deze geïncludeerd zouden kunnen worden in een meta-analyse. We kiezen er daarom voor om hieronder kort de resultaten per studie kort te beschrijven. Een uitgebreidere weergave van resultaten van de studies is te vinden in de bijlage.
Blikman (2017) rapporteerde dat er geen statistisch significante verschillen waren tussen de groepen met betrekking tot de scores op de CIS20r (overall adj β: 0,80, 95%BI -3,73 tot 2,12; 4 maanden (tijdstip na de interventie) adj β: -1,49, 95%BI -5,46 tot 2,48). Ook voor de secundaire uitkomstmaten werden geen statistisch significante verschillen tussen de groepen gevonden (MFIS overall adj β: 0,20, 95%BI -4,17 tot 4,58 en FSS overall adj β: 0,03, 95%BI -0,23 tot 0,28. Analyses zijn gecorrigeerd voor centrum, geslacht, exacerbaties en tijd sinds diagnose.
Kos (2007) heeft de resultaten van de studie slechts beperkt weergegeven. In deze studie werden geen interactie-effecten gevonden, dat wil zeggen dat de scores van beide groepen dus eenzelfde verloop lieten zien gedurende de studie. Een klinische relevante reductie (≥10 punten op de MFIS) was aanwezig bij 17% van de patiënten in de interventiegroep en bij 44% van de patiënten in de placebogroep. De resultaten voor de FSS zijn niet gerapporteerd, er is alleen beschreven dat er geen significante effecten werden gevonden. Door de beperkte rapportage is het niet mogelijk om deze resultaten te poolen in een meta-analyse.
Mathiowetz (2005) heeft om rekening te houden met de drop-outs in de studie de data op drie verschillende manieren geanalyseerd, en rapporteert dat de resultaten van de groepen op de fysieke en sociale subschalen van de FIS bij alle drie methoden statistisch significant van elkaar verschilden. Bij de intention-to-treat analyse waarbij de maximum likelihood methode werd toegepast werden op alle drie de schalen statistisch significante verschillen gevonden (FIS-fysiek: -3,71 (95%BI -6,06 tot -1,37); FIS sociaal: -6,10 (95%BI -10,24 tot -1,95); FIS cognitief: -2,55 (95%BI -4,88 tot -0,21). De ruwe data zijn niet gepresenteerd, deze gegevens konden daarom niet worden opgenomen in een eventuele meta-analyse.
Finlayson (2011) heeft weinig descriptieve gegevens gerapporteerd, maar geeft aan dat er statistisch significante verschillen waren tussen de interventiegroep en wachtlijstcontrolegroep in veranderscores op de FIS subschalen (cognitief -3,1 (6,1), t-test p=0,00; fysiek -2,5 (6,5), t-test p=0,01; sociaal -6,0 (12,1), t-test p=0,00. Er werd geen statistisch significant verschil in de FSS-scores gevonden tussen de groepen (gemiddeld verschil -0,2 (1,0), p=0,24).
Gezien het beperkte aantal studies (n=2) waarvan de resultaten mogelijk konden worden samengenomen, is gekozen om geen meta-analyse uit te voeren. Wel zijn de resultaten van Blikman (2016) en Finlayson (2011) hieronder grafisch weergegeven. Voor Finlayson (2011) zijn de MFIS-resultaten zoals gerapporteerd door Wendebourg (2017) gebruikt.

Figuur 3 Grafische weergave van de post-interventie resultaten op vermoeidheid (Blikman, 2016 en Finlayson, 2011)
2. Adverse events (belangrijke uitkomstmaat)
Blikman (2017) rapporteerde dat zich tijdens de interventieperiode één SEA (relapse) in de interventiegroep en één SEA in de controlegroep (ischemische botziekte) had voorgedaan.
Finlayson (2011) rapporteerde dat er geen adverse events waren gemeld/geïdentificeerd.
Kos (2007) en Mathiowetz (2005) hebben geen informatie over adverse events gerapporteerd (in de resultaten sectie).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vermoeidheid (zowel de ernst als impact van de vermoeidheid) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geen blindering en de beperkte rapportage van de resultaten waardoor het niet mogelijk is om een meta-analyse uit te voeren; -2 niveaus). De uiteindelijke bewijskracht komt uit op laag.
De bewijskracht voor de uitkomstmaat adverse events is in verband met het lage aantal cases, niet gegradeerd.
Zoekvraag 5: Wat zijn de (on)gunstige effecten van een multidisciplinaire revalidatiebehandeling op MS-gerelateerde vermoeidheid?
Er is één studie gevonden die een multidisciplinaire revalidatiebehandeling heeft onderzocht.
Rietberg (2014) was een Nederlandse RCT naar het effect van een multidisciplinaire poliklinische revalidatiebehandeling (interventieconditie) ten opzichte van begeleiding door een MS-verpleegkundige (controleconditie). Achtenveertig patiënten met chronische vermoeidheid (volgens de MSCCPG definitie) namen deel aan de studie. De neuroloog van de deelnemende patiënten nam een gestandaardiseerde screeningsvragenlijst gericht op vermoeidheidsklachten af en vroeg de patiënten naar hun preferenties qua volgorde van behandeling voor de geïdentificeerde problemen. De resultaten van de screening werden besproken in een multidisciplinair team. Hierna werden patiënten geloot naar één van de twee studie-armen. Patiënten in de interventiegroep (n=23) ontvingen naast ‘huiswerk’ opdrachten een op de patiënt afgestemd programma bestaande uit fysiotherapie (12 weken, 2x 45 m per week begeleide aerobic training), ergotherapie (aantal sessies afhankelijk van hulpvraag, minimaal 2 x 1 uur, focus op vermoeidheidmanagement), maatschappelijk werk (psychosociale ondersteuning middels counseling en praktische ondersteuning, minimaal 2 sessies) of een combinatie. De patiënten in de controleconditie (n=25) ontvingen begeleiding van een MS-verpleegkundige (‘huiswerk’ plus 1x 1 uur per drie weken bespreken van planning van activiteiten, prioritering, energieconservatie, hulpacceptatie, gebruik van hulpmiddelen, voedingsadvies en stimulatie van fysieke activiteit). Gebruikte meetinstrumenten waren onder andere de CIS-20R, MFIS en FSS. Veranderscores na 12 weken werden geanalyseerd met behulp van Mann-Whitney U testen. De uitkomsten van het screeningsonderzoek waren redelijk gelijk tussen de groep, behalve dat de interventiegroep ook het verbeteren van de fysieke conditie als prioriteit had. De behandeltijd tussen de groepen verschilde; interventiegroep gemiddeld (SD) 280 (187) min, controlegroep gemiddeld 163 (106) min. Bij meer patiënten in de contolegroep werd de medicatie aangepast (39% versus 19%).
Resultaten
1. Vermoeidheid (cruciale uitkomstmaat)
De door Rietberg (2014) gerapporteerde resultaten zijn weergegeven in tabel 4. Er werden geen statistisch significante en klinisch relevante verschillen tussen de groepen gevonden.
Tabel 4
|
Uitkomstmaat |
Groep |
Verschilscore 0-12 weken, gemiddeld (SD) |
Gemiddeld verschil (p-waarde) tussen de groepen op 12 weken. |
|
CIS-20R |
Interventiegroep |
-0,8 (7,1) |
3.0, p=0.39 |
|
Controlegroep |
2,2 (10,3) |
||
|
FSS |
Interventiegroep |
-1,6 (7,1) |
1.9, p=0.47 |
|
Controlegroep |
0,3 (8,5) |
||
|
MFIS |
Interventiegroep |
-1,2 (9,5) |
0.6, p=0.71 |
|
Controlegroep |
-0,6 (13,8) |
CIS-20R: Checklist Individual Strength, 20 items, totaalscore tussen 20- en 40 punten.
FSS: 9-items, meet de ernst van de vermoeidheid.
MFIS: 21-items, meet de ervaren impact van vermoeidheid.
Hogere scores geven een slechtere uitkomt aan.
2. Adverse events (belangrijke uitkomstmaat)
In beide groepen is er een patiënt uitgevallen in verband met een exacerbatie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vermoeidheid is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geen blindering, -1) en de inclusie van een enkele studie met een beperkt aantal patiënten (imprecisie, -1). De uiteindelijke bewijskracht komt uit op laag.
De bewijskracht voor de uitkomstmaat adverse events is in verband met het lage aantal cases, niet gegradeerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat zijn de (on)gunstige effecten van een dieetinterventie op MS-gerelateerde vermoeidheid?
P: patiënten met MS gerelateerde vermoeidheid;
I: dieetinterventie;
C: standaard zorg, wachtlijst controlegroep of vergelijkbaar;
O: MS gerelateerde vermoeidheid, adverse events.
2. Wat zijn de (on)gunstige effecten van fysieke training op MS-gerelateerde vermoeidheid?
P: patiënten met MS gerelateerde vermoeidheid;
I: fysieke training;
C: standaard zorg, wachtlijst controlegroep of vergelijkbaar;
O: MS gerelateerde vermoeidheid, adverse events.
3. Wat zijn de (on)gunstige effecten van cognitieve gedragstherapie op MS-gerelateerde vermoeidheid?
P: patiënten met MS gerelateerde vermoeidheid;
I: cognitieve gedragstherapie;
C: standaard zorg, wachtlijst controlegroep of vergelijkbaar;
O: MS gerelateerde vermoeidheid, adverse events.
4. Wat zijn de (on)gunstige effecten van energiemanagement op MS-gerelateerde vermoeidheid?
P: patiënten met MS gerelateerde vermoeidheid;
I: energiemanagement;
C: standaard zorg, wachtlijst controlegroep of vergelijkbaar;
O: MS gerelateerde vermoeidheid, adverse events.
5. Wat zijn de (on)gunstige effecten van een multidisciplinaire revalidatiebehandeling op MS-gerelateerde vermoeidheid?
P: patiënten met MS gerelateerde vermoeidheid;
I: multidisciplinaire revalidatiebehandeling;
C: standaard zorg, wachtlijst controlegroep of vergelijkbaar;
O: MS gerelateerde vermoeidheid, adverse events.
Populatie
Studies zijn alleen geselecteerd wanneer er ≥ 10 deelnemers per studiearm en er ≥ 20 deelnemers in totaal waren. Hiernaast zijn alleen studies geïncludeerd waarbij als inclusiecriterium voor de patiëntenpopulatie ‘het hebben van vermoeidheidsklachten’ was opgenomen. Er is gekozen om niet a priori een ondergrens voor de vermoeidheidsklachten te definiëren.
Relevante interventies
Studies zijn alleen geselecteerd wanneer zij de effecten/effectiviteit van een dieetinterventie, fysiek trainingsprogramma, cognitieve gedragstherapie, energiemanagement of multidisciplinaire revalidatiebehandeling onderzochten. Er is gekozen om niet a priori deze interventies verder te definiëren, maar om aan te sluiten bij de beschrijvingen in de artikelen. Studies naar overige type interventies zijn niet meegenomen.
Relevante uitkomstmaten
De werkgroep achtte MS-gerelateerde vermoeidheid een voor de besluitvorming cruciale uitkomstmaat; en adverse events een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde de uitkomstmaat MS gerelateerde vermoeidheid als vermoeidheid zoals vastgesteld met een gevalideerde vragenlijst. Waar mogelijk (> drie studies waarvan de resultaten adequaat zijn weergegeven) werden de resultaten samengenomen in een meta-analyse, hierbij zijn de resultaten voor de primaire uitkomstmaat uit de studie zoals bepaald tijdens het meetmoment direct na de interventie geïncludeerd. Ook de literatuurconclusies zijn gebaseerd op de resultaten verkregen direct na de interventie.
De werkgroep definieerde niet a priori de uitkomstmaat adverse events, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde een verschil > SMD=0,5 of > 0,5 SD als een klinisch (patiënt) relevant verschil voor de uitkomstmaat vermoeidheid. Voor de uitkomstmaat adverse events werden de ‘default grenzen’ van GRADE aangehouden (RR=0,8 en RR 1,25; Schünemann, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Cinahl (via Ebsco) op 22 juli 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerd onderzoek (RCT’s) die zijn verschenen na 2000. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 706 treffers op. In eerste instantie zijn alleen de potentiële systematische reviews (n=119) gescreend. Er is gezocht naar reviews waarbij er tenminste in twee databases is gezocht, er een gedetailleerde zoekstrategie beschikbaar is, een risk of bias beoordeling is uitgevoerd en waarin bovenstaande PICO wordt beantwoord. Op basis van titel en abstract werden in eerste instantie 18 reviews geïdentificeerd die in de afgelopen vijf jaar zijn gepubliceerd. Na raadpleging van de volledige tekst van deze 18 reviews, werd vervolgens één review over patiënteducatie geïncludeerd (Wendebourg, 2017) en de overige reviews geëxcludeerd (zie exclusietabel). Van een aantal reviews (Pommering, 2018; Phyo, 2018; Chalah, 2018; Van den Akker, 2016; Heine 2015) zijn wel de geïncludeerde studies op het inclusiecriterium ‘patiëntenpopulatie’ (> 10 patiënten met MS gerelateerde vermoeidheid zoals bepaald met een gevalideerde vragenlijst) gecontroleerd. Dit leverde uiteindelijk één studie over fysieke training op (Hebert, 2011) en drie aanvullende studies die psychosociale interventies beschrijven (Kos, 2016; Van Kessel, 2016; Van den Akker, 2017).
Vervolgens zijn ook de potentiële RCT’s die zijn verschenen na januari 2014 op basis van hun titel en abstract gescreend. Er is gekozen voor de periode vanaf januari 2014 aangezien de meest recente review over het effect van fysieke training op vermoeidheid de databases tot oktober 2014 heeft doorzocht (Heine, 2015). Aanvullend selectiecriterium voor deze potentiële RCT’s was dat in het abstract moest staan vermeld dat er een vermoeide patiëntenpopulatie geïncludeerd was geweest, of dat bij de werkgroepleden bekend moest zijn dat in betreffend onderzoek vermoeide patiënten waren geïncludeerd. Er werden in eerste instantie 18 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 11 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en zeven studies definitief geselecteerd. In totaal zijn er dus 12 (één systematische review, vier RCT’s op basis van de systematische reviews, en zeven RCT’s) studies geïncludeerd in deze literatuursamenvatting. Er zijn geen studies gevonden die zich richten op dieetinterventies. Vijf studies onderzochten het effect van fysieke training, vijf studies beschreven het effect van cognitieve gedragstherapie, vier studies de effectiviteit van energiemanagement, en in één studie werd een multidisciplinaire revalidatiebehandeling onderzocht.
Resultaten
Twaalf studies, waaronder één systematische review, zijn opgenomen in de literatuuranalyse. De literatuursamenvatting is onderverdeeld naar de vijf zoekvragen: 1) dieetinterventies; 2) fysieke training; 3) (hoofdzakelijk) cognitieve gedragstherapie (CGT); 4) energiemanagement/zelfmanagement; en 5) multidisciplinaire revalidatiebehandeling.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de tabellen 1, 2 en 3. De resultaten van de geïncludeerde studies op de uitkomstmaat vermoeidheid zijn opgenomen in de evidence tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen. Een overzicht van de studies die konden worden geïncludeerd in de meta-analyse is gegeven in de bijlage.
Referenties
- Blikman LJ, van Meeteren J, Twisk JW, et al. Effectiveness of energy conservation management on fatigue and participation in multiple sclerosis: A randomized controlled trial. Mult Scler. 2017;23(11):1527-1541. doi:10.1177/1352458517702751
- Chaudhuri, A., Behan, P.O.. (2004) Fatigue in neurological disorders. Lancet. 363 (9413), 978-88.
- Escudero-Uribe S, Hochsprung A, Heredia-Camacho B, Izquierdo-Ayuso G. Effect of Training Exercises Incorporating Mechanical Devices on Fatigue and Gait Pattern in Persons with Relapsing-Remitting Multiple Sclerosis. Physiother Can. 2017;69(4):292-302. doi:10.3138/ptc.2016-19.
- Finlayson M, Preissner K, Cho C, Plow M. Randomized trial of a teleconference-delivered fatigue management program for people with multiple sclerosis. Mult Scler. 2011;17(9):1130-1140. doi:10.1177/1352458511404272.
- Hebert JR, Corboy JR, Manago MM, Schenkman M. Effects of vestibular rehabilitation on multiple sclerosis-related fatigue and upright postural control: a randomized controlled trial. Phys Ther. 2011;91(8):1166-1183. doi:10.2522/ptj.20100399.
- Heine M, Verschuren O, Hoogervorst EL, et al. Does aerobic training alleviate fatigue and improve societal participation in patients with multiple sclerosis? A randomized controlled trial. Mult Scler. 2017;23(11):1517-1526. doi:10.1177/1352458517696596.
- Kos D, Duportail M, D'hooghe M, Nagels G, Kerckhofs E. Multidisciplinary fatigue management programme in multiple sclerosis: a randomized clinical trial. Mult Scler. 2007;13(8):996-1003. doi:10.1177/1352458507078392.
- Mathiowetz VG, Finlayson ML, Matuska KM, Chen HY, Luo P. Randomized controlled trial of an energy conservation course for persons with multiple sclerosis. Mult Scler. 2005;11(5):592-601. doi:10.1191/1352458505ms1198oa.
- Mäurer M, Schuh K, Seibert S, et al. A randomized study to evaluate the effect of exercise on fatigue in people with relapsing-remitting multiple sclerosis treated with fingolimod. Mult Scler J Exp Transl Clin. 2018;4(1):2055217318756688. Published 2018 Feb 14. doi:10.1177/2055217318756688.
- MacAllister, W.S., Krupp, L.B. (2005) Multiple sclerosis-related fatigue. Phys Med Rehabil Clin N Am. 16(2),483-502.
- Moss-Morris R, McCrone P, Yardley L, van Kessel K, Wills G, Dennison L. A pilot randomised controlled trial of an Internet-based cognitive behavioural therapy self-management programme (MS Invigor8) for multiple sclerosis fatigue. Behav Res Ther. 2012;50(6):415-421. doi:10.1016/j.brat.2012.03.001.
- Pöttgen J, Moss-Morris R, Wendebourg JM, et al. Randomised controlled trial of a self-guided online fatigue intervention in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2018;89(9):970-976. doi:10.1136/jnnp-2017-317463.
- Schünemann, H., Brożek, J., Guyatt, G., et al. (2013) GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Thomas S, Thomas PW, Kersten P, et al. A pragmatic parallel arm multi-centre randomised controlled trial to assess the effectiveness and cost-effectiveness of a group-based fatigue management programme (FACETS) for people with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2013;84(10):1092-1099. doi:10.1136/jnnp-2012-303816.
- Turner AP, Hartoonian N, Sloan AP, et al. Improving fatigue and depression in individuals with multiple sclerosis using telephone-administered physical activity counseling. J Consult Clin Psychol. 2016;84(4):297-309. doi:10.1037/ccp0000086.
- Rietberg MB, van Wegen EE, Eyssen IC, Kwakkel G; MS study group. Effects of multidisciplinary rehabilitation on chronic fatigue in multiple sclerosis: a randomized controlled trial. PLoS One. 2014 Sep 18;9(9):e107710. doi: 10.1371/journal.pone.0107710.
- van den Akker LE, Beckerman H, Collette EH, et al. Cognitive behavioral therapy positively affects fatigue in patients with multiple sclerosis: Results of a randomized controlled trial. Mult Scler. 2017;23(11):1542-1553. doi:10.1177/1352458517709361.
- van Kessel K, Wouldes T, Moss-Morris R. A New Zealand pilot randomized controlled trial of a web-based interactive self-management programme (MSInvigor8) with and without email support for the treatment of multiple sclerosis fatigue. Clin Rehabil. 2016;30(5):454-462. doi:10.1177/0269215515584800.
- van Kessel K, Moss-Morris R, Willoughby E, Chalder T, Johnson MH, Robinson E. A randomized controlled trial of cognitive behavior therapy for multiple sclerosis fatigue. Psychosom Med. 2008;70(2):205-213. doi:10.1097/PSY.0b013e3181643065.
Evidence tabellen
Results on outcome measure ‘Fatigue’
|
Study reference |
Results |
Comments |
|
Physical activity |
||
|
Escudero-Uribe (2017) |
FSS score, mean (SD) whole body vibration (n=16) baseline: 5.9 (0.8) follow-up: 4.5 (1.8) (-24.4%), balance trainer (n=14) baseline: 5.4 (1.0) follow-up: 5.1 (1.4) (-5.3%) Wait list (n=18) baseline 5.7 (0.9) follow-up 5.9 (1.2) (+2.6%).
The difference between the whole body vibration and the wait list control was statistically significant. There were no other statistically significant differences.
MFIS (total score), mean (SD) whole body vibration (n=16) baseline: 49.7 (13.3) follow-up: 41.6 (14.3) (-16.2%) balance trainer (n=14) baseline: 50.6 (17.4) follow-up 42.7 (20,8), (-15.7%) Waitlist (n=18) baseline: 49.0 (11.1) follow-up: 51.3 (18.4), +4.8%,
The difference between the whole body vibration and wait list control group was statistically significant. There were no other statistically significant differences. |
|
|
Hebert (2011) |
MFIS, mean (SD) Intervention: Baseline: 51.0 (8.6) Week 10: 44.3 (16.4) Difference: -6.7 (12.9) 95%CI -14.5 to 1.1. Waitlist baseline: 55.9 (11.6) Week 10: 52.1 (17.1) Difference: 3.8 (11.4) 95%CI -10.6 tot 3.1)
No statistically significant differences between the groups were found. |
23% of the patients in the intervention group and 15% of the patients in the control group had improved ≥15 (MFIS). |
|
Heine (2017) |
CIS20R, mean (SD) Intervention Baseline: 38.5 (9.8) week 16: 37.3 (9.5) Control Baseline: 42.5 (9.1) Week 16: 42.2 (8.8); β=4.7, 95%CI 1.0 tot 8.4)
MFIS Intervention Baseline: 37.3 (12.7) week 16: 38.6 (12.0) Control Baseline: 43.8 (12.2) Week 16: 41.5 (11.9) MD=-1.8 (SE 2.3)
FSS Intervention Baseline: 5.1 (1.1) week 16: 5.1 (0.9) Control Baseline: 5.3 (1.0) Week 16: 5.2 (1.0) MD= -0.0 (SE 0.2) |
Adjusted analyses (sex and EDSS) resulted in similar results.
11 out of 34 patients (32%) in het intervention group and 8 out of 38 patients in the control group (21%) had a clinical relevant decrease in fatigue (NNT 8.9, 95CI%: 3.2 to ∞.
|
|
Turner (2016) |
MFIS, mean (SE) Intervention (TC) baseline: 53.8 (2.7) 6 months: 47.7 (2.8) control (ED) baseline: 49.7 (2.5) 6 months: 49.7 (2.7)
There was a significant interaction effect (F(2,56)=4.97, p=0.01): favoring the intervention group. |
Analyses adjusted for age, sex, eduction, MS related impairment.
33% of the patients in the intervention group and 18% of the patients in the control group had a clinical relevant decrease in fatigue (MFIS>10) |
|
Cognitive behavioral therapy |
||
|
Moss-Morris (2012) |
Fatigue Scale, mean (SD) Intervention Baseline: 21.4 (4.3) week 10: 12.4 (6.8) Control Baseline: 21.5 (3.6) week 10: 19.6 (5.2) There was a significant between-group difference in favor of the intervention group F(1,36)=169.9 p<0.001).
MFIS, mean (SD) Intervention Baseline: 13.2 (3.8) week 10: 9.0 (3.8) Control Baseline: 12.7 (3.9) week 10: 12.8 (3.9) There was a significant between-group difference in favor of the intervention group F(1,36)=169.9 p<0.001). |
|
|
Thomas (2013) |
Global Fatigue Severity Subscale, mean (SD) Intervention baseline: 5.6 (1.0) follow-up: 5.5 (0.9) control baseline: 5.6 (1.0) follow-up: 5.6 (1.2) Mean difference in change scores: 0.03, 95%CI -0.33 to 0.28
After 4 months: there was however a statistical significant difference, mean difference in change scores: -0.36, 95%CI: -0.63 to -0.08. |
40% of the patients in the intervention group and 19% of the patients in the control group had a clinical relevant decrease in fatigue (Global Fatigue Severity subscale >0.5, NNT=5). |
|
Van den Akker (2017) |
CIS20R, mean (SD) Intervention Baseline: 42.9 (8.5) week 16: 34.0 (11.2) Control Baseline: 44.2 (6.0) Week 16: 40.3 (8.2) β: -6.7, 95%CI: -10.7 tot -2.7
FSS, mean (SD) Intervention Baseline: 5.4 (0.7) week 16: 4.5 (1.1) Control Baseline: 5.5 (0.8) Week 16: 5.2 (0.7) β: -0.7 95%CI: -1.1 to -0.3
MFIS, mean (SD) Intervention Baseline: 47.3 (12.5) week 16: 38.7 (16.4) Control Baseline: 47.7 (9.6) Week 16: 41.2 (11.9) β: -3.9 95%CI: -9.2 to 1.3 |
Analyses adjusted for baseline and center.
At 52 weeks, the differences between the groups were no longer significant.
22 of the 39 patients in the intervention group and 9 of the 35 patients in the control group had a clinical relevant decrease in fatigue ≥8 points on the CIS20R), NNT 3.3, 95%CI: 1.9 to 10.6) |
|
Pöttgen (2018) |
Chalder Fatigue Scale Week 12: Mean difference: 2.7, 95%CI: -1.2 to -4.3 Week 24: Mean difference: -2.2, 95%CI: -0.6 to -3.8 The data were only presented in a small figure. |
Analyses with multiple imputations and adjusted for baseline and sex. |
|
Van Kessel (2008) |
Fatigue scale Intervention (CBT) Baseline: 20.9 (4.3) Month 2: 7.9 (4.3) Relaxation Baseline: 20.3 (4.3) Month 2: 11.6 (5.3) p=0.02 |
Analyses adjusted for MS type and EDSS |
|
Van Kessel (2016) |
Chalder Fatigue Scale Intervention (MS Invigor8-plus) Baseline: 22.4 (4.4) week 10: 11.4 (6.2) control (MSInvigor-8-only) Baseline: 20.8 (3.1) week 10: 17.5 (6.4) p<0.01
MFISIntervention (MS Invigor8-plus) Baseline: 13.6 (3.0) week 10: 10.0 (2.7) control (MSInvigor-8-only) Baseline: 13.9 (3.0) week 10: 12.4 (3.7) p<0.02 |
Baseline values were ‘carried forward in patients that dropped out. When only data of completers were included, the differences between the groups were no longer signficant. |
|
Energy management |
||
|
Blikman (2017) |
CIS20R subscale fatigue, mean (SD) Intervention Baseline: 44.6 (7.1) month 4: 38.2 (8.2) Control Baseline: 43.9 (6.9) Month 4: 39.1 (8.5)
Overall adj β: 0.8, 95%CI -3.7 tot 2.1. Month 4: adj β: -1.5, 95%CI -5.5 tot 2.5).
MFIS, mean (SD) Intervention Baseline: 46.5 (10.6) month 4: 41.2 (11.4) Control Baseline: 43.8 (13.3) Month 4: 40.0 (14.5)
Overall adj β: 0.2, 95%CI -4.2 tot 4.6
FSS, mean (SD) Intervention Baseline: 5.3 (0.7) month 4: 5.3 (0.8) Control Baseline: 5.2 (0.8) Month 4: 5.1 (0.7)
Overall adj β: 0.0, 95%CI -0.2 tot 0.3 |
Analyses adjused for center, sex, exacerbations and time since diagnosis. |
|
Kos (2007) |
Limited reporting of the results
“In the compliers group, group A and B showed similar changes in MFIS scores over time (Ftime(4,152)= 3.346, P=0.012; Ftime*group(4,152)=1.094, P=0.361).”
“No significant changes in FSS….in both groups were found” |
“A clinically relevant reduction of MFIS score of 10 points or more was found in 17% of individuals following the MFMP, compared to 44% after the placebo intervention programme (P=0.06).” |
|
Mathiowetz (2005) |
Limited reporting of the results
“For the three subscales of the FIS, all analyses were significant (P<0.05/3) except the cognitive subscale for ITT LOCF and Compliers analyses.”
FIS cognitive: difference: -2.6, 95%CI: -4.9 to -0.2 FIS Physical: difference: -3.8, 95%CI: -6.1 to -1.4 FIS Social: difference: -6.1, 95%CI: -10.2 to -2.0 |
|
|
Finlayson (2011) |
Limited reporting of the results
Within-person differences (week 7-week1) comparing immediate group to wait-list control group – effectiveness analysis.
FIS, mean (SD) Cognitive: -3.1 (6.1), p=0.00 Physical: -2.5 (6.5), p=0.01 Social: -6.0 (12.1), p=0.00
FSS, mean (SD): -0.2 (1.0), p=0.24 |
|
|
Multidisciplinary intervention |
||
|
Rietberg, (2014) |
CIS20R subscale fatigue, mean (SD) Intervention Baseline: 78 (13.5) 12 weeks: 76 (14) Control Baseline: 79 (13) 12 weeks: 79 (12)
Mean difference: 3.0, p=0.39.
MFIS, mean (SD) Intervention Baseline: 43 (18.8) 12 weeks: 42 (42) Control Baseline: 36 (14.5) 12 weeks: 37 (20)
Mean difference: 0.6, p=0.71
FSS, mean (SD) Intervention Baseline: 52 (11.5) 12 weeks: 49 (7.5) Control Baseline: 48 (12) 12 weeks: 50 (13)
Mean difference: 1.9, p=0.47 |
|
MFIS: Modified Fatigue Impact Scale; FSS: Fatigue Severity Scale; CIS-20R fatigue subscale: Checklist Individual Strength fatigue subscale; FIS: Fatigue Impact Scale. See for more information about the study samples and the interventions tabels 3.1, 3.3 and 3.5 in the ‘beschrijving studies’ section
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Physical training |
||||||||
|
Hebert, 2011 (Data from Heine, 2015) |
Not described |
Unlikely, randomization performed by a clinician not involved in the trail. |
Likely, not possible. |
Likely, not possible |
Likely, Self-reported, blinding not possible. |
Unlikely |
unlikely |
Unlikely |
|
Escudero-Uribe (2017) |
“Participants meeting the inclusion creiteria were randomly assigned to one of three groups uning a random numbers table.” And “A second neurologic physical therapist allocated participants to one of the three study groups.” |
Unclear |
Likely, not possible |
Likely, not possible |
Likely, there was a blind assessor, but outcome measures are questionnaires. |
Unlikely |
Likely, only loss to follow-up in the intervention groups. Some patients were excluded because of low compliance. |
Unclear |
|
Heine (2017) |
“Randomization was perfomed by an independent researcher, using an online concealed computer-generated randomization scheme with random variable block sizes.” |
Unlikely |
Likely, not possible |
Likely, not possible |
Likely, there was a blind assessor, but outcome measures included self-reported questionnaires. |
Unlikely |
Unclear, slightly more dropouts in the control condition, but some (number not clear) non-reponders post intervention in the intervention group. |
unlikely |
|
Mäurer, (2018) |
“Randomization was stratified by aerobic capacity. The allocation sequence was created centrally using SAS 9.2 statistical software. The Allocation sequence was concealed for the investigator enrolling and assessing participants in sequentially numbered, sealed, opaque envelopes. Allocation of participants was performed by the investigator at the study centers. “ |
unlikely |
likely |
likely |
likely, outcome measures were questionnaires |
unlikely |
unclear. Consent withdrawn by some. |
Unlikely, but the primary endpoint analyses was based on the modified full analysis set, this consisted of all patients from the FAS (all patients who had at least one post-baseline assessment for mFIS) for whom sufficient exercise compliance was established (>70% of the sessions between months 1-6 and more than 80% during months 5 and 6). |
|
Turner (2016) |
“At conclusion of baseline, participants were individually randomized to TC or self-directed EC via computer algorithm. The assessor did not view the assigned list prior to randomization to ensure concealment of allocation for the trial.” |
unlikely |
likely |
likely |
likely, single blind, but outcome measures were questionnaires |
unlikely |
unlikely |
unlikely |
|
Cognitive behavioral therapy |
||||||||
|
Pöttgen (2018) |
“After completing the last page of the online questionnaire, patients were randomly allocated (1:1, no blocking or stratification) to ELEVIDA or to the waitlist control group using a fully automated computer algorithm (concealed allocation)”. |
Unlikely |
Likely |
Likely |
Likely (self-reported) |
Unlikely |
unclear. Loss to follow-up was high, however the authors reported that the results of the dropouts should increase extremely to turn the results into not statistically significant. |
Unlikely. |
|
Van den Akker (2017) |
“Randomization was performed using concealed computerized block-wise randomization, stratified by treatment center. The block size of 8 was disclosed after finishing all follow-up measurements. An independent investigator, not the assessors, carried out the randomization and informed the patient and therapist about the therapy allocation.” |
Unlikely |
Likely |
Likely |
Likely, the assessor was blinded for treatment allocation, but the outcomes were self-reported questionnaires. |
Unlikely |
Likely, intention to treat analyses, but number of drop-outs and non-responders was higher in the control condition. |
Unlikely |
|
Van Kessel (2016) |
Independent randomization system built into the website. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Likely |
Unlikely |
|
Moss-Morris (2012) (Wendebourg (2017)) |
“They were allocated to MS Invigor8 or a control group by an automated simple randomisation system built into the website” |
unlikely |
Likely |
Likely |
Likely (differs from Wendebourg, (2017) |
Unclear |
Unclear, drop outs in the intervention group were the ones with the lowest number of sessions completed (differs from Wendebourg (2017) |
Unlikely |
|
Thomas (2013) (Wendebourg (2017)) |
Concealed computer generated randomisation: “to ensure good allocation concealment, random allocation was email based and administered by the statistician who was masked to the identity of participants. Randomisation used a computerised random number generator. Once a block of up to 24 participants from a centre had provided informed consent, they were formally entered onto the trial database and an anonymised list of their identification numbers was sent to the statistician who randomly allocated half to the FACETS arm and half to the CLP arm.” |
Unlikely |
Likely |
Likely |
Likely (differs from Wendebourg, (2017) |
Unlikely |
unclear, number of dropouts higher in the intervention group (differs from Wendebourg (2017) |
Unlikely |
|
Van Kessel (2008) (Wendebourg (2017)) |
“After patient inclusion was confirmed, patients were allocated sequentially by block wise randomization (block size of 10) using a computerized randomization programmed to one of two conditions. The allocation was concealed in a series of numbered sealed envelopes, which were handed onto an independent administrator. Each new subject entering the trial was allocated a number before the pretreatment assessment, and this number corresponded with a numbered envelope assigned by the independent administrator, which was opened by the therapist (K.v.K.) immediately before the first therapy session.” |
Unclear, unknown whether the envelopes were opaque. |
Likely (differs from Wendebourg (2017). |
Likely (differs from Wendebourg (2017), interventions provided by the same therapist. |
Likely (differs from Wendebourg, (2017) |
Unlikely |
Unlikely |
Unlikely |
|
Energy conservation therapy or self management |
||||||||
|
Mathiowetz (2005) (Wendebourg (2017)) |
“We randomly assigned individuals who met all of the inclusion criteria for the study to the immediate intervention group or the delayed control group based on a randomly ordered sequence of assignment. We determined the sequence in advance by the flip of a coin. Research assistants in each geographical area assigned eligible participants to groups at the end of the screening period.” |
Unclear |
Likely |
Likely |
likely (differs from Wendebourg (2017)) |
Unlikely |
unclear, loss to follow-up of 23%, no reasons provided. |
Unlikely |
|
Blikman (2017) |
“the randomization was concealed and computer generated with a block size of 8 and stratified by treatment centre. An independent investigator carried out the randomization and informed the patient and the planning bureau of the allocated treatment” |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely, some loss to follow-up, but given the reasons probably low risk of bias. |
Unlikely, Modified intention to treat analysis performed. |
|
Kos (2007) (Wendebourg (2016)) |
“Matched pairs were composed based on the Modified Fatigue Impact Scale score, age, gender and MS-FC score. The identity number of every subject was written down on a paper and put in an envelope together with the other pair member. An independent research assistant separated each pair and divided the individuals over two groups (group A or group B) by random draw.” |
unlikely |
Likely |
Likely |
Likely (differs from Wendebourg (2017)) |
Unclear |
Likely, attrition was 21%. Reasons for dropouts were worsening of symptoms, lack of interest after allocation and not willing to perform the follow up assessment. |
unlikely |
|
Finlayson, 2011 (Wendebourg (2016))
|
“Randomization and allocation were completed by the statistician (CC) using a random permutated block design with each block consisting of four people. Within each block, two participants were allocated to the immediate start group and two to the wait-list control group. Some 140 opaque envelopes were prepared in advance of recruitment and 50 additional ones were prepared approximately 1 year into recruitment. The envelopes were numbered sequentially and a statement indicating the allocation (immediate or wait-list) was placed in each envelope. As consent forms were returned to the study office, they were numbered sequentially and matched to one of the opaque envelopes. When the research assistant contacted the participant, the appropriate envelope was opened and the participant was offered intervention days and times that corresponded with his/her group allocation. Participants were blinded to the group to which they were assigned (i.e. immediate start versus wait-list control).” |
Unlikely |
Likely |
Likely |
Likely (differs from Wendebourg (2017)) |
Unlikely |
Unlikely |
Unlikely |
|
Multidisciplinary intervention |
||||||||
|
Rietberg, 2014 |
“The randomization procedure was concealed and based on computer-generated block randomization with block sizes of 8. No stratification was applied. Implementation of the random allocation was done by means of sequentially numbered sealed opaque envelops.” |
Unlikely |
Likely |
Likely |
Likely, the assessor was blinded for treatment allocation, but the outcomes were self-reported questionnaires. |
Unlikely |
Unlikely |
Unlikely |
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Wendebourg, 2017 |
Yes |
No |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
not of the individual studies |
Exclusietabel - artikelen geëxcludeerd na lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Amatyra, 2019 |
Overzicht van cochrane review, weinig nieuwe inzichten. |
|
Angela, 2019 |
Umbrella review. |
|
Asano, 2015 |
Scoping review. |
|
Asano, 2014 |
Brede review, meer recente reviews beschikbaar. |
|
Bastani, 2015 |
Onderzocht acupressure, past niet binnen de PICO. |
|
Bogosian, 2015 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Carletto, 2016 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Chalah, 2018 |
Review, narratief. Wel twee aangehaalde studies geïdentificeerd: van den Akker (2017) en Hoogerwerf (2017). |
|
Choobforoushzadeh (2015) |
Onderzocht het effect van neurofeedback, past niet binnen de PICO. |
|
Coe, 2017 |
Alleen VAS schaal meegenomen, zeer korte interventie. |
|
Cramer, 2014 |
Review, maar smalle inclusie (alleen Yoga). |
|
Dettmers, 2009 |
Interventie was een add-on, patiënten waren opgenomen gedurende de studieperiode. Onduidelijk wat voor andere behandelingen men heeft gekregen. Een gedeelte van de patiënten blijkt hiernaast onder de zelf gerapporteerde cutoff waarde voor vermoeidheid te scoren. Geen statistische analyses gedaan op de vermoeidheidsdata en ook de ruwe data op follow-up niet vermeld. Onduidelijk hoe men bepaalde of iemand vooruit dan wel achteruit is gegaan. Slechts 19 patiënten die de vragenlijsten hebben ingevuld. |
|
Ehde, 2015 |
Heeft patiënten met vermoeidheid, pijn en/of depressieve klachten geïncludeerd; niet alle patiënten waren vermoeid. Exacte percentage niet te bepalen. |
|
Ehde, 2018 |
Secundaire analyse (moderatie-analyses) van data uit bovenstaande studie. |
|
Ferrucci, 2014 |
Cross-over RCT, randomisatieprocedure niet duidelijk. Wash-out periode lang genoeg? |
|
Fisher, 2015 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Flachenecker, 2017 |
Heeft niet specifiek patiënten met vermoeidheidsklachten volgens gevalideerde vragenlijst geïncludeerd (volgens inclusiecriteria). |
|
Grossman, 2010 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Heine, 2015 |
Slechts twee van de geïncludeerde studies (Dettmers, 2009; Hebert, 2011) hebben patiënten met vermoeidheidsklachten geïncludeerd. Gekozen om van deze potentiële geschikte RCT’s de artikelen op te vragen en te beoordelen op geschiktheid. |
|
Heine, 2016 |
Letter aan de editor. |
|
Hoogerwerf (2017) |
Geen RCT. |
|
Hugos, 2019a |
Vergelijking tussen twee interventies (één educatieprogramma specifiek gericht op vermoeidheid, en één algemeen educatieprogramma), valt buiten PICO. |
|
Hugos, 2019b |
Lange termijn resultaten van Hugos, 2019a |
|
Irish, 2017 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Kessel, 2016 |
Studie kijkt eigenlijk vooral naar het effect van een emailondersteuning door een psycholoog, boven op een CGT interventie. |
|
Khan, 2017 |
Scoping review, geen nieuwe inzichten. |
|
Khan, 2014 |
Brede review, redelijk gedateerd. |
|
Kiropoulos, 2016 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Kos (2016) |
Vergelijking zelfmanagement met relaxatie (geen aandachtscontrole), past niet binnen de PICO. |
|
Kooshiar (2015) |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria) |
|
Mackay, 2015 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Mohr, 2003 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Motl, 2015 |
Narratieve review. |
|
Nazari, 2015 |
Onderzocht het effect van reflexologie en van een ontspanninsgbehandeling. Valt buiten de PICO. |
|
Phyo, 2018 |
Review, onduidelijk of de geïncludeerde studies wel of niet specifiek patiënten met MS gerelateerde vermoeidheid hebben geïncludeerd. Gekozen om van de potentieel geschikte RCT’s (Bogosian, 2015; Carletto, 2016; Ehde, 2015; Fisher, 2015; Grossman, 2010; Kiropoulos, 2016; Kos, 2016; Mackay, 2015; Mohr, 2013; Moss-Morris, 2012; Nazari, 2015; Thomas, 2013; Thomas, 2014; Van Kessel, 2008, Van Kessel, 2016; Vazirinejad, 2016) de artikelen op te vragen en te beoordelen. |
|
Plow, 2009 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Pommerich, 2018 |
Review, onduidelijk of de geïncludeerde studies wel of niet specifiek patiënten met MS gerelateerde vermoeidheid hebben geïncludeerd. Gekozen om van de potentieel geschikte RCT’s (Irish, 2017; Weinstock, 2005, Yadav, 2016) de artikelen op te vragen en te beoordelen. |
|
Safari, 2017 |
Synthese van meta-analyses. |
|
Saiote, 2014 |
Onderzocht effect van gepulste elektromagnetische velden, past niet binnen de PICO. |
|
Sesel, 2018 |
Geen tabellen/beschrijving individuele studies geïncludeerd in het artikel. |
|
Van den Akker (2016) |
Review, focus alleen op CGT. Wendebourg, 2017 is meer recent en bevat uiteindelijk meer voor inclusie geschikte artikelen. Wel aanvullend artikel Plow (2009) geïdentificeerd. |
|
Van Kessel (2008) |
Vergeleek CGT met relaxatie, valt buiten de PICO. |
|
Vazirinejad, 2016 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Weinstock, 2005 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Yadav, 2016 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
|
Young, 2019 |
Heeft niet specifiek patiënten met vermoeidheidsklachten geïncludeerd (volgens inclusiecriteria). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Multiple Sclerose (MS).
Werkgroep
- Prof. dr. V. de Groot, revalidatiearts, Amsterdam UMC, locatie VUmc, Amsterdam, VRA (voorzitter)
- Dr. J. van Meeteren, revalidatiearts, Rijndam, locatie Erasmus MC, Rotterdam, VRA (voorzitter)
- Dr. A.C. van Voskuilen, revalidatiearts, Klimmendaal Revalidatiespecialisten, Arnhem, VRA
- Dr. N.F. Kalkers, neuroloog, OLVG, Amsterdam en Amsterdam UMC, locatie VUmc, Amsterdam, NVN
- Drs. C. van Gelder, specialist ouderengeneeskunde, GGzE, Eindhoven, Verenso
- Prof. dr. F.G. Schaafsma, bedrijfsarts, bijzonder hoogleraar arbeid en bedrijfsgeneeskunde Amsterdam UMC, Afdeling Public & Occupational Health, NVAB
- R. Standhardt-Keilman, ergotherapeut, Nieuw Unicum, Zandvoort, EN (tot oktober 2019)
- Dr. I.C.J.M. Eijssen, ergotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, EN (vanaf november 2019)
- Dr. M.B. Rietberg, fysiotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, KNGF
- Dr. R. Kemps, GZ-psycholoog, Prinses Máxima Centrum voor Kinderoncologie, Utrecht, NIP (tot mei 2020 werkgroeplid, vanaf juni 2020 lid klankbordgroep)
- Drs. M.G.E. Huijsmans, GZ-psycholoog, OLVG, Amsterdam en Reade, NIP (vanaf juni 2020)
- K. Harrison, verpleegkundig specialist neurologie, Ter Gooi, locatie Blaricum, V&VN
- J.E. Schoonen-Ouwehand, revalidatie maatschappelijk werker, Basalt Revalidatie, Den Haag, BPSW (tot maart 2020)
- Dhr. R.G. Hoogakker, medisch maatschappelijk werker en aandachtsfunctionaris huiselijk geweld, Amsterdam UMC, locatie VUmc, Amsterdam, BPSW (vanaf maart 2020)
- Drs. L.S. Ruhaak, logopedist, logopediewetenschapper en onderzoeker in opleiding, Amsterdam UMC, locatie VUmc, Amsterdam, (en tot juli 2020 Nieuw Unicum, Zandvoort), NVLF
- E. Kruijver, seksuoloog, PsyQ, Utrecht en De Hoogstraat, Revalidatie, Utrecht, NVVS
- C.E. Helfrich-Smallegange, diëtist, Siza, Arnhem, NVD
- F. Kingma, patiëntvertegenwoordiger, MS Vereniging Nederland
Met ondersteuning van
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S. Van Dijk, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot januari 2019)
- Dr. G. Peeters, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf januari 2019 tot november 2019)
- Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf november 2019)
- Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
- Dr. Mevr. R. Zwarts - van de Putte, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
Met dank aan
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- M. van der Maten MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groot (voorzitter) |
Hoofd afdeling revalidatiegeneeskunde Amsterdam UMC. |
President Rehabilitation in MS (RIMS; onbetaald, tot en met juni 2019). |
Diverse onderzoeksprojecten op het gebied van MS bij MS research en ZonMW. Door eigen wetenschappelijk onderzoek bijgedragen aan kennisvermeerdering.
De activiteiten van RIMS worden gesponsord door Biogen, Roche and Medday. Deze bedrijven produceren ziektemodulerende behandelingen voor MS. Biogen heeft ook symptomatische behandeling voor loopproblemen. |
Geen actie nodig. Ziektemodulerende behandelingen vormen verder geen onderdeel van de richtlijn. |
|
Meeteren (voorzitter) |
Revalidatiearts, Rijndam, locatie Erasmus MC |
Geen |
Geen |
Geen actie nodig |
|
Eijssen (vanaf 11-2019) |
Ergotherapeut, onderzoeker VU medisch centrum |
Lid Ergotherapie Nederland (onbetaald)
Commissielid Adviesraad Onderzoek en Wetenschap - Ergotherapie Nederland (onbetaald)
Lid Rehabilitation in Multiple sclerosis (RIMS) - European Network for best Practice and Research in MS (onbetaald)
Commissielid Wetenschappelijk raad van de RIMS - Special Interest Group Occupation (SIG-Occupation) (onbetaald)
Commissielid MS netwerk Groot Amsterdam (onbetaald) |
In het verleden deelgenomen aan onderzoeksprojecten die gefinancierd werden door ZONmw (>3 jaar geleden) en MS research (afgerond 30-09-2019). Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Harrison |
Verpleegkundig Specialist Neurologie bij Tergooi ziekenhuizen locatie Blaricum |
Werkgroeplid MS richtlijn behandeling (onkostenvergoeding).
MS registratie commissie / wetenschap commissie (onkostenvergoeding).
Bestuurslid Landelijke Vereniging MS verpleegkundigen (onkostenvergoeding). |
Geen |
Geen actie nodig |
|
Helfrich |
SIZA, Arnhem; diëtist: 20 uur per week
Tot 1 mei 2020: Diëtistenpraktijk Corine Helfrich, Maurik: eigen 1e lijnspraktijk: 20 uur per week |
Bestuurslid MDL-netwerk NVD (onbetaald) |
Geen |
Geen actie nodig |
|
Hoogakker (vanaf 01-03-2020) |
Medisch maatschappelijk werker polikliniek Revalidatie, Amsterdam UMC, locatie De Boelelaan. 20 uur per week
Aandachtfunctionaris huiselijk geweld, Amsterdam UMC, locatie De Boelelaan, 16 uur per week |
Voorzitter GZ maatschappelijk werk BPSW (onbetaald) |
Geen |
Geen actie nodig |
|
Huijsmans (vanaf -01-06-2020) |
GZ-psycholoog OLVG en Reade |
Lid CognetMS Docent Rino (betaald): onderwijs aan zorgprofessionals vakgebied neuropsychologie |
Geen |
Geen actie nodig |
|
Kemps (tot 1-5-2020 werkgroeplid, daarna lid klankbordgroep) |
Tot 01-05-2020 GZ-psycholoog, Rijndam Revalidatie, locatie Erasmus MC
Vanaf 01-05-2020 Psycholoog, Prinses Máxima Centrum voor Kinderoncologie |
Docent voor AXON leertrajecten Werkzaamheden (betaald): onderwijs en voorlichting aan zorgprofessionals met betrekking tot de begeleiding van patiënten met niet-aangeboren hersenletsel |
Geen |
Geen actie nodig |
|
Kalkers |
Neuroloog OLVG, 0,7 fte, neuroloog VUmc 0,1 fte |
Secretaris bestuur Nederlandse Vereniging voor Neurologie 0,1 fte (sinds 1-6-2019).
Voorzitter bestuur landelijke MS registratie: 2 vergaderingen per jaar (vacatiegelden) (tot 1-11-2020). |
Geen |
Geen actie nodig |
|
Kingma |
Geen |
Geen |
Geen |
Geen actie nodig |
|
Kruijver |
Seksuoloog NVVS voor Basalt Revalidatie (28 uur p/w tot 01-10-2020)
Seksuoloog NVVS voor PsyQ Utrecht (28 uur p/w vanaf 01-10-2020)
Seksuoloog NVVS voor De Hoogstraat Revalidatie (4 uur p/w) |
Nederlandse wetenschappelijke Vereniging voor Seksuologie: Coördinator NVVS werkgroep Richtlijnen (onbetaald)
Incidenteel gastdocent diverse opleidingen Amstel Academie en Antonius Academie (betaald per lesuur) |
Geen |
Geen actie nodig |
|
Rietberg |
Paramedisch manager (0,56) /Fysiotherapeut (0,33) /Onderzoeker (0,11) Amsterdam UMC, locatie VUmc |
Penningmeester EFOX: European Foundation for Health and Exercise, onbetaald. Voorzitter MS Netwerk Groot Amsterdam, (onbetaald).
Voorzitter F-UMC (fysiotherapie universitair medische centra) (onbetaald).
Consilium KNGF (vacatievergoeding). |
Geen |
Geen actie nodig |
|
Ruhaak |
Logopedist (0,4 fte) en Logopediewetenschapper (0,4 fte) bij Nieuw Unicum tot september 2020
Onderzoeker in opleiding bij Amsterdam UMC, locatie VUMC (Niet in loondienst contract)
|
Voorzitter SIG Communication & Swallowing van Rehabilitation In Multiple Sclerosis (RIMS) (onbetaald): - organiseren van meetings 2 keer per jaar - communicatie met bestuur - communicatie met SIG leden |
Werkt aan onderzoek wat qua onderwerp overeenkomt met enkele richtlijnmodules (bijv. dysartrie). Echter zijn er op dit moment nog geen publicaties verschenen over deze onderzoeken. Het onderzoek wordt gefinancierd door MS research en RIMS, waarbij RIMS geen invloed op het verloop of uitkomsten van de studie.
Heeft onlangs een narratieve review artikel ingediend over communicatie en slikken bij MS (niet gefinancierd). |
Geen actie nodig |
|
Schaafsma |
Bedrijfsarts, senior onderzoeker Amsterdam UMC, 0,8 fte
Bijzonder hoogleraar, NVAB, 0,2 fte |
Commissielid Raad van Toezicht bij Vitaalpunt (betaald).
Plaatsvervangend commissielid Commissie Klachtenafhandeling Aanstellingskeuringen bij SER (vacatiegelden).
Commissielid Commissie Richtlijnontwikkeling en wetenschap voor de NVAB (onbetaald).
Commissielid Burger- Zielhuispenning voor de NVAB (onbetaald). |
Geen. Betrokken bij diverse onderzoeksprojecten die gefinancierd worden door ZONmw, Instituut GAK of UWV. Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Schoonen-Ouwehand (werkgroeplid tot maart 2020) |
Basalt Revalidatie, maatschappelijk werker |
BPSW voorzitter functiegroep gezondheidszorg maatschappelijk werk; aansturen van leden binnen de functiegroep, vallende onder de beroepsvereniging in kader van afstemming en uitzetten beleid. Functiegroepleden uit verpleeghuizen, ziekenhuizen en revalidatie. Vrijwillig |
Geen |
Geen actie nodig |
|
Standhardt-Keilman (werkgroeplid tot oktober 2019) |
Ergotherapeut bij Stichting Nieuw-Unicum |
Geen |
Geen |
Geen actie nodig |
|
Van Gelder |
Specialist oudergeneeskunde Vitalis woonzorggroep tot 1-1-2021, vanaf 1-3-2021 bij GGzE Eindhoven Beoordelingen wilsbekwaamheid voor notarissen en rechtbank Bestuurslid MS zorg Nederland |
"Lid medische adviesraad restless legs stichting onbetaald Maker filmdocumentaire euthanasie en psychiatrische ziekte, euthanasie en dementie onbetaald." |
Geen |
Geen actie nodig |
|
Van Voskuilen |
Revalidatiearts bij Klimmendaal Revalidatiespecialisten. |
Geen |
In 2012 gepromoveerd op Sacrale Neuromodulatie bij lagere urineweg symptomen |
Geen actie nodig |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Tot oktober 2018 Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018-september 2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie nodig |
|
Peeters (tot 11-2019) |
Senior adviseur/teamleider Kennisinstituut van de Federatie Medisch Specialisten |
Senior Atlantic Fellow for Equity in Brain Health, Global Brain Health Institute, Trinity College Dublin (onderzoeker; onbetaald).
Verzorgen van onderwijs voor de epidemiologische onderwerpen in het curriculum voor de eerstejaars fellows in het programma van de Global Brain Health Institute. |
Functie bij het Global Brain Health Institute: Er zijn soms financiële voordelen in de vorm van vergoeding van registratie en reiskosten voor congresbezoek. De lopende onderzoeksprojecten hebben geen connectie met MS.
|
Geen actie nodig. |
|
Maas (vanaf 11-2019) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1-1-2014 tot en met 31-8-2019; Dienstverband Nederlandse Hart Registratie 1-9-2018 tot en met 31-7-2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie nodig. |
|
Zwarts – van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Afronding promotieonderzoek ‘Etiology of the VACTERL association: genetic and non-genetic risk factors’, Radboudumc (onbetaald). |
Geen, promotieonderzoek werd gefinancierd uit een persoonlijke beurs ontvangen vanuit het Radboudumc. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van MS Vereniging Nederland, MS Research en het Nationaal MS Fonds voor de Invitational conference en de afvaardiging van de patiëntenvereniging MS Vereniging Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan MS Vereniging Nederland, MS Research, Nationaal MS Fonds en Patiëntenfederatie Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patienten met MS. Tevens zijn er knelpunten aangedragen door de VRA, IGJ, VIG, ZiNL, MS Research, Nationaal MS Fonds, Nieuw Unicum, NVLF, NVD, MS Zorg Nederland, MS Vereniging Nederland, NVU, NOG, KNGF, EN, NVAB en Archipel tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Hiernaast beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012) op noodzaak tot revisie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Nederlandse Vereniging voor Neurologie (NVN). Richtlijn Multiple sclerose. Utrecht, 2012.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
