Medicatie bij loopproblemen
Uitgangsvraag
Met welke farmacologische interventies (fampridine) kunnen loopproblemen van patiënten met MS verminderd worden?
Aanbeveling
Overweeg fampridine voor te schrijven omwille van een betere loopcapaciteit, loopsnelheid, functionele inspanning en balans bij patiënten met MS die loopproblemen ervaren (een EDSS 4-7 en minstens 6 seconden nodig hebben om de Timed 25 Foot Walk Test (T25FWT) af te leggen.
Evalueer enkele weken na start van medicatie met een looptest het effect op het lopen.
Evalueer jaarlijks de effectiviteit van fampridine, en doe bij twijfel een stopperiode (“drugholiday”).
Overweeg nogmaals een proefbehandeling met fampridine als de klinische situatie bij de patiënt is gewijzigd en patiënt eerder geen meerwaarde leek te hebben voor fampridine gebruik.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Veel MS patiënten ondervinden loopproblemen. In deze module is middels een systematisch literatuuronderzoek onderzocht of het gebruik van fampridine deze loopproblemen mogelijk kan verminderen in vergelijking met placebo. Er werden drie studies (drie systematische reviews) gevonden gebaseerd op vijf RCTs. De studiepopulaties in de RCTs zijn relatief groot, met enkele methodologische beperkingen (risk of bias, imprecisie). De bewijskracht van de literatuur is hoog voor de cruciale uitkomstmaat 'walking capacity’ en laag voor de belangrijke uitkomstmaten ‘adverse events’ en ‘study drop-out due to any reason’. De overall bewijskracht is dus hoog.
Uit studie data komt naar voren dat ongeveer een derde van de mensen met MS-gerelateerde loopproblemen een verbetering ervaren van minimaal 20% van hun loopproblemen (Goodman, 2010). Deze verbetering van lopen treedt binnen drie weken op, zodat een evaluatie of het bij een individu werkzaam is zinvol en geïndiceerd is ca drie weken na start fampridine.
Er zijn aanwijzingen dat fampridine een verhoogde kans (10%) op urineweginfecties geeft.
Contra-indicaties voor gebruik van fampridine zijn epilepsie in de voorgeschiedenis en matige tot ernstige nierfunctiestoornis (creatinineklaring < 50 ml/min).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten ervaren zelf de meerwaarde op het dagelijks functioneren (lopen) en kunnen hierdoor de werkzaamheid goed inschatten. Indien een patiënt twee a drie weken na start van de proefbehandeling verbetering ervaart én op de T25FWT minimaal 20% verbetering heeft, dan kan de patiënt samen met de behandelend neuroloog een overweging maken rondom het continueren van fampridine. Fampridine is alleen effectief bij loopproblemen; een voorwaarde is dat er nog een loopfunctie is. Redelijk wat mensen twijfelen na verloop van tijd of fampridine nog wel effectief is. Daarom is het belangrijk om minimaal jaarlijks de behandeling van fampridine te evalueren en bij twijfel een stopperiode (“drug-holiday”) te bespreken. Ook is het belangrijk om met de patient een realistisch beeld ten aanzien van de verbetering te bespreken. Tevens kan fampridine opnieuw overwogen worden als de klinische situatie verslechtert en de patiënt voorheen geen voordeel had van fampridine gebruik.
Kosten (middelenbeslag)
Er zijn geen kosteneffectiviteitsstudies voor fampridine bekend bij de werkgroep.
Om te bepalen of het middel werkt bij een MS patiënt is er een 'proefbehandelstrategie' vastgesteld door de MS-werkgroep van de Nederlandse Vereniging voor Neurologie (NVN) (Van Munster, 2020). Patiënten met EDSS 4-7 die minstens 6 seconden nodig hebben om de Timed 25 Foot Walk Test (T25FWT) af te leggen kunnen starten met fampridine op basis van een proefbehandeling die 2 weken duurt. Daarna moet opnieuw de T25FWT gedaan worden. Als de loopsnelheid met ten minste 20% is toegenomen, kan de behandeling voortgezet worden; anders moet deze worden gestaakt. Hierdoor wordt het middel alleen vergoed bij patiënten bij wie het middel een verbetering van loopsnelheid geeft. Uit praktijkervaring blijkt dat patiënten die het middel gebruiken zelf het initiatief nemen om te stoppen als ze zelf geen effect bemerken.
Het toepassen van de aanbevelingen rondom fampridine gebruik zal geen effect hebben op de huidige kosten omdat deze aansluiten op de dagelijkse praktijk.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep is van mening dat de aanbevelingen haalbaar en aanvaardbaar zijn omdat ze aansluiten bij de huidige dagelijkse praktijk.
Onderbouwing
Achtergrond
Loopproblemen worden relatief veel gezien bij patiënten met MS en hebben grote impact op dagelijkse activiteiten en participatie. Het is bekend dat loopcapaciteit (wat een persoon kan doen in een gecontroleerde omgeving), loopprestatie (wat een persoon eigenlijk doet in zijn eigen omgeving) en participatie verminderd zijn bij patiënten met MS. Interventies ter verbetering van loopproblemen voor patiënten met MS zijn meestal primair gericht om de loopcapaciteit te verbeteren. Het middel fampridine blokkeert de kaliumkanalen van neuronen en daardoor de actiepotentiaalvorming in gedemyeliniseerde axonen De hypothese is dat dit de neurologische functie verbetert met een gunstig effect op de loopproblemen. Deze module evalueert de mogelijke effectiviteit van fampridine bij patiënten met MS.
Conclusies / Summary of Findings
1.1 Walking capacity
|
High GRADE |
Use of fampridine results in a better walking capacity when compared with placebo in patients with MS.
Source: Yapundich, 2015; Hupperts, 2016; Hobart, 2016; Goodman, 2010 |
1.2 Walking speed
|
Moderate GRADE |
Use of fampridine likely results in improved walking speed when compared with placebo in patients with MS.
Source:Jacques, 2018; Goodman, 2010; Satchidanad, 2020; Yapundich, 2015 |
1.3 Functional effort
|
Moderate GRADE |
Use of fampridine likely results in a higher functional effort when compared with placebo in patients with MS.
Source: Yapundich, 2015; Jacques, 2018 |
1.4 Balance
|
Low GRADE |
Use of fampridine may result in a better score on the timed-up and go (balance) when compared with placebo in patients with MS.
Source: Brown, 2016; Hupperts, 2016; Pickering, 2017 |
1.5. Adverse events
|
Low GRADE |
Use of fampridine may result in little difference in the incidence of urinary tract infections when compared with placebo in patients with MS.
Source: Goodman, 2010; Goodman, 2009; Hobart, 2016; Hupperts, 2016; Yapundich, 2015 |
1.6. Study drop-out due to any reason
|
Low GRADE |
Use of fampridine may result in little to no difference in study drop-out when compared with placebo in patients with MS.
Source: Goodman, 2010; Hobart, 2016; Hupperts, 2016; Jacques, 2018; Yapundich, 2015; Satchidanand, 2020 |
Samenvatting literatuur
Description of studies
Zhang (2021) performed a systematic review and meta-analysis of RCTs to evaluate the safety and benefits of fampridine versus placebo in patients with MS. MS patients were diagnosed according to McDonalds criteria, were ≥18 years of age, and all subgroups of MS were included (relapsing-remitting, secondary-progressive, primary-progressive, and progressive-relapsing), regardless of sex, degree of disability (average EDSS score), and disease duration of the individual. Authors performed a systematic literature search in Medline, Embase, Cochrane Central Register of Controlled Trials, and ClinicalTrials.gov (until Augustus 2020). Nine RCTs were included involving 1691 participants (range sample size: 21 to 633; range age: 39.5 to 54.0 years; range EDSS score: 4.8 to 5.9).
The fampridine-group received a dose of fampridine between 5 and 10 mg taken orally twice daily and the control group received placebo. Treatment duration ranged between 4 and 24 weeks. The Cochrane Handbook for Systematic Reviews of Interventions was used to assess the quality of the studies. Outcomes reported were walking capacity (MSWS-12, T25FW, 6-MWT) and adverse events (any adverse event).
Valet (2021) performed a systematic review and meta‐analysis to evaluate the effect of fampridine in patients with MS. Authors performed a systematic literature search in various databases (Pubmed, Scopus, PsycINFO) until January 2019. Twenty RCTs involving 2616 patients were included (mean age ranged from 43.2 to 54.4 years). The methodological quality of the studies was assessed using the Downs and Black checklist. Outcomes reported were walking capacity (TUG test).
Shi (2019) performed a systematic review to evaluate the efficacy and safety of Dalfampridine (DAP) in the treatment of mobility disability in patients with MS. Authors performed a systematic literature search in various databases (Embase, Pubmed, Cochrane, Web of Knowledge, and Clinical Trials.gov) until March 2019. Ten RCTs involving 2100 patients were included (mean age ranged from 47.5 to 52.6 years). The methodological quality of the studies was assessed using the Cochrane risk of bias tool. The outcome of interest for the present analysis was the incidence of urinary tract infections.
Results
1. Walking capacity
1.1 Walking ability
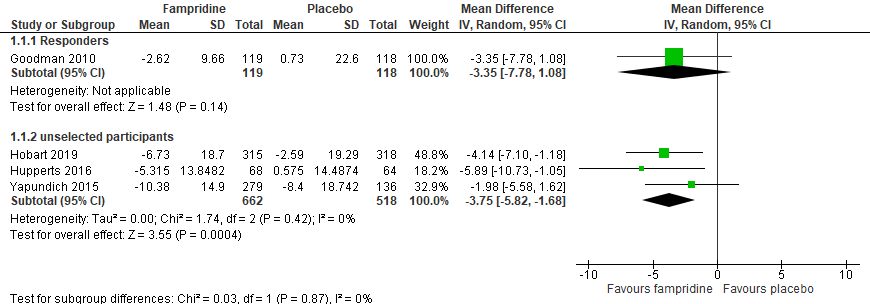
Four RCTs (Yapundich, 2015; Hupperts, 2016; Hobart, 2016; Goodman, 2010) reported walking ability, by the MSWS-12 change score from baseline in the fampridine versus placebo-group. Goodman (2010) was represented as a subgroup as it had selected timed walked responders. The other studies did not select responders and were a separate subgroup; in total 662 patients were included in the fampridine-group and 518 patients in the placebo-group.
The relative risk was -3.75 (95%CI -5.82 to -1.68), see figure 1.1 The decrease in MSWS-12 was a clinically relevant difference, favouring the fampridine group. Results for Goodman (2010) were comparable with a relative risk of -3.35 (95%CI -7.78 to 1.08).
Figure 1.1 Forest plot of the MSWS-12 score change from baseline for fampridine versus placebo.
1.2 Walking speed
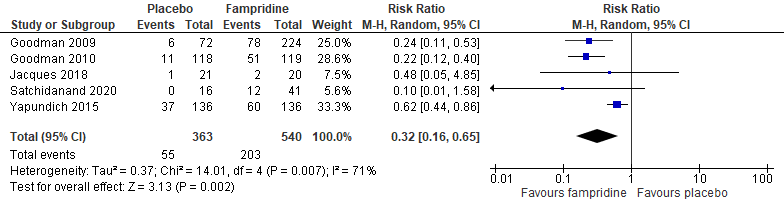
Five studies (Goodman, 2009; Goodman, 2010; Jacques, 2018; Satchidanand, 2020; Yapundich, 2015) reported walking speed by using the T25FW. Response was defined as consistent improvement on the T25FW, with percentage of timed walk responders in each treatment group. In total 540 patients were included in the fampridine-group and 363 patients in the placebo control group. The relative risk was 0.32 (95%CI [0.16 to 0.65], p=0.07), see figure 1.2. The improvement in the clinical response to T25FW was a clinically relevant difference, favouring the fampridine group.
Figure 1.2 Forest plot of response to T25FW for fampridine versus placebo.
1.3 Functional effort
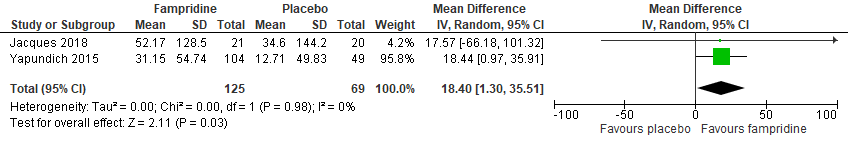
Two studies (Yapundich 2015, Jacques 2018) reported the functional effort, based on the 6-MWT. In total, 125 patients were included in the fampridine-group and 69 in the placebo control group. The mean change in 6-MWT was higher in the fampridine compared to the control group, resulting in a relative risk of 18.4 (95%CI: 1.30 to 35.51), see figure 1.3. The improvement in the clinical response to 6MWT was a clinically relevant difference, favouring the fampridine group.
Figure 1.3 Forest plot of the 6-MWT change from baseline for fampridine versus placebo.
1.4 Balance
Three studies (Brown 2016, Hupperts 2016, Pickering 2017) in the systematic reviews of Valet (2021) reported on balance by using the TUG. Results could not be pooled due to heterogeneity in how the data was presented.
Brown (2016) reported the TUG among 21 patients in the intervention group and 21 in the placebo control group. The least square mean (LSM) (SD) reported as difference in change from baseline was -0.6 (SD: 1.74) and 0.4 (SD: 1.74) for the fampridine-group and placebo-group, respectively. The difference in LSM was statistically significant (p-value: 0.042), favoring the fampridine-group.
Hupperts 2016 reported that a higher proportion of patients receiving fampridine (60.3%) versus placebo (34.9%) met the 10% threshold of improvement in the TUG test form baseline. Pickering 2017, reported TUG improvement after three months in 17 (74%) and 18 (78%) in the fampridine and placebo control group, respectively.
2. Walking achievement
None of the included studies reported on walking achievement of fampridine compared to placebo.
3. Participation
None of the included studies reported on participation of patients, when fampridine is compared to placebo.
4. Adverse events
4.1 Adverse events about sleep
Adverse events about sleep were not reported.
4.2 Adverse events urinary tract infections
Adverse events infections were only reported by Shi (2019). Five research papers and one RCT reported on urinary tract infections. There were 1177 patients in the fampridine test group and 764 patients in the placebo control group. Results were comparable regarding the incidence of urinary tract infections [RR = 1.30, 95 %CI (1.00, to 1.71), I2 = 34.8%].
5. Drop-out due to any reason
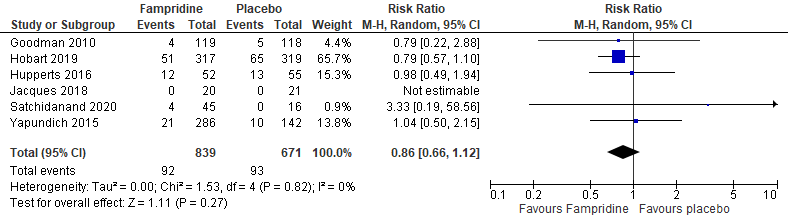
Six studies reported on drop out due to any reason (Goodman, 2010; Hobart, 2019; Hupperts, 2016; Jacques, 2018; Satchidanand, 2020; Yapundich, 2015), see figure 1.4. There were 839 patients in the fampridine-group and 671 patients in the placebo-group. Results were comparable regarding the incidence of drop out due to any reason ( [RR = 0.86, 95%CI ([0.66 to 1.12]), I2 = 0%].
Figure 1.4 Forest plot of drop-out due to any reason for fampridine versus placebo
Level of evidence of the literature
1. Walking capacity
1.1 Walking ability
The level of evidence regarding the outcome measure walking ability starts at high as it is based on RCTs for unselected participants. There were no reasons for downgrading.
1.2 Walking speed
The level of evidence regarding the outcome measure walking speed starts at high as it is based on RCTs and was downgraded by one level to moderate because of overlap with the boundary(s) for clinical relevance (imprecision, -1).
1.3. Functional effort
The level of evidence regarding the outcome measure functional effort starts at high as it is based on RCTs and was downgraded by one level to moderate because of overlap with the boundary(s) for clinical relevance.
1.4 Balance
The level of evidence regarding the outcome measure balance starts at high as it is based on RCTs was downgraded two levels to low due to risk of bias and heterogeneity on how the outcome was reported and duration of follow-up).
4. Adverse events
4.2 Urinary tract infections
The level of evidence regarding the outcome measure incidence of urinary tract infections is low. The level of evidence for RCT’s starts high, but was downgraded by two levels due to imprecision (overlap with the boundary(s) for clinical relevance) (imprecision, -2).
6. Study drop-out due to any reason
The level of evidence regarding the outcome measure drop-out due to any reason is low. The level of evidence for RCT’s starts high, but was downgraded to low by 2 levels due to imprecision (-2, overlap with the boundary(s) for clinical relevance and no effect).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effectiveness of fampridine on walking problems in patients with MS?
P: Patients with MS
I: Intervention fampridine
C: Placebo
O: Walking capacity (walking ability, walking speed, functional effort, balance), walking achievement, participation, adverse events (urinary tract infections, sleep problems, incidence of falls), and study drop-out due to any reason
Relevant outcome measures
The guideline development group considered walking capacity as a critical outcome measure for decision making; and walking achievement, participation, adverse events, and study drop-out due to any reason as important outcome measures for decision making.
The following instruments were used for measuring the outcome walking capacity:
- Walking ability: 12-item MS walking scale (MSWS-12). The MSWS-12 is a self-report measure of the impact of MS on patients walking ability. Low scores indicate low limitation whereas high scores indicate higher limitation in walking capacity. The working group defined a difference of ≥20% in mean difference (MD) between the groups as a minimal clinically (patient) important difference.
- Walking speed: Timed 25-Foot Walk test (T25FW). T25FW is a test of maximum walking speed on a short distance. The working group defined a difference of 0.75 or 1.25 as a minimal clinically (patient) important difference.
- Functional effort: 6-Minute Walk Test (6MWT). The 6-MWT is used to measure functional capacity and is defined as the number of meters a patient can walk in 6 min. An increase in the distance walked indicates improvement in basic mobility. The working group defined a difference of ≥20% in mean difference (MD) between the groups as a minimal clinically (patient) important difference.
- Balance: Timed Up and Go test (TUG). TUG test is used to assess patient’s balance capacity. A faster time indicates a better functional/balance performance. The working group defined a difference of ≥20% in mean difference (MD) between the groups as a minimal clinically (patient) important difference.
- Walking achievement as measured by step counter or questionnaire.
- Participation as measured by participation questionnaire.
Adverse events was defined as sleep problems, urinary tract infections and problems, falls measured by Falls Efficacy Scale-International (FES-I), and the incidence of falls. Study drop-out due to any reason was reported as presented in the studies.
The working group defined a difference of ≥20% in mean difference (MD) between the groups as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 December 2021 resulting in 100 hits. This was an update of a search until 24 October 2019 that had resulted in 733 hits. The detailed search strategy is depicted under the tab Methods. Studies for this module were selected based on the following criteria:
- systematic reviews (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available) and randomized controlled trials;
- full-text English language publication;
- adults aged ≥ 18 years;
- studies including ≥ 20 (ten in each study arm) patients; and
- studies according to the PICO.
Forty-one studies were initially selected based on title and abstract screening. After reading full text, 38 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three systematic reviews (Zhang, 2021; Shi, 2019; Valet, 2019) were included.
Results
Three systematic reviews were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Goodman, A. D., Brown, T. R., Krupp, L. B., Schapiro, R. T., Schwid, S. R., Cohen, R., Marinucci, L. N., Blight, A. R., & fampridine MS-F203 Investigators (2009). Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. Lancet (London, England), 373(9665), 732-738.
- Goodman, A. D., Brown, T. R., Edwards, K. R., Krupp, L. B., Schapiro, R. T., Cohen, R., Marinucci, L. N., Blight, A. R., & MSF204 Investigators (2010). A phase 3 trial of extended release oral dalfampridine in multiple sclerosis. Annals of neurology, 68(4), 494-502.
- Goodman, A. D., Bethoux, F., Brown, T. R., Schapiro, R. T., Cohen, R., Marinucci, L. N., Henney, H. R., 3rd, Blight, A. R., & MS-F203, MS-F204, and Extension Study Investigators (2015). Long-term safety and efficacy of dalfampridine for walking impairment in patients with multiple sclerosis: Results of open-label extensions of two Phase 3 clinical trials. Multiple sclerosis (Houndmills, Basingstoke, England), 21(10), 1322-1331.
- Hobart, J., Ziemssen, T., Feys, P., Linnebank, M., Goodman, A. D., Farrell, R., Hupperts, R., Blight, A. R., Englishby, V., McNeill, M., Chang, I., Lima, G., Elkins, J., & ENHANCE study investigators (2019). Assessment of Clinically Meaningful Improvements in Self-Reported Walking Ability in Participants with Multiple Sclerosis: Results from the Randomized, Double-Blind, Phase III ENHANCE Trial of Prolonged-Release fampridine. CNS drugs, 33(1), 61-79.
- Hupperts, R., Lycke, J., Short, C., Gasperini, C., McNeill, M., Medori, R., Tofil-Kaluza, A., Hovenden, M., Mehta, L. R., & Elkins, J. (2016). Prolonged-release fampridine and walking and balance in MS: randomised controlled MOBILE trial. Multiple sclerosis (Houndmills, Basingstoke, England), 22(2), 212-221.
- Jacques, F., Schembri, A., Nativ, A., Paquette, C., & Kalinowski, P. (2018). Prolonged-Release fampridine as Adjunct Therapy to Active Motor Training in MS Patients: A Pilot, Double-Blind, Randomized, Placebo-Controlled Study. Multiple sclerosis journal - experimental, translational and clinical, 4(1), 2055217318761168.
- van Munster CEP, Kaya L, Lam KH, Kalkers NF, Killestein J, Uitdehaag BMJ. Responder rates to fampridine differ between clinical subgroups of MS patients and patient reported outcome influences treatment decision making. Mult Scler Relat Disord. 2020.
- Satchidanand, N., Drake, A., Smerbeck, A., Hojnacki, D., Kolb, C., Patrick, K., Weinstock-Guttman, B., Motl, R., & Benedict, R. H. (2020). Dalfampridine benefits ambulation but not cognition in multiple sclerosis. Multiple sclerosis (Houndmills, Basingstoke, England), 26(1), 91-98.
- Shi J, Wu X, Chen Y. Study on Dalfampridine in the treatment of Multiple Sclerosis Mobility Disability: A meta-analysis. PLoS One. 2019 Sep 12;14(9):e0222288. doi: 10.1371/journal.pone.0222288. PMID: 31513613; PMCID: PMC6742383.
- Valet M, Quoilin M, Lejeune T, Stoquart G, Van Pesch V, El Sankari S, Detrembleur C, Warlop T. Effects of fampridine in People with Multiple Sclerosis: A Systematic Review and Meta-analysis. CNS Drugs. 2019 Nov;33(11):1087-1099. doi: 10.1007/s40263-019-00671-x. PMID: 31612418.
- Yapundich, R., Applebee, A., Bethoux, F., Goldman, M. D., Hutton, G. J., Mass, M., Pardo, G., Klingler, M., Henney, H. R., 3rd, Blight, A. R., & Carrazana, E. J. (2015). Evaluation of Dalfampridine Extended Release 5 and 10 mg in Multiple Sclerosis: A Randomized Controlled Trial. International journal of MS care, 17(3), 138-145.
- Zhang E, Tian X, Li R, Chen C, Li M, Ma L, Wei R, Zhou Y, Cui Y. Dalfampridine in the treatment of multiple sclerosis: a meta-analysis of randomised controlled trials. Orphanet J Rare Dis. 2021 Feb 15;16(1):87. doi: 10.1186/s13023-021-01694-8. PMID: 33588903; PMCID: PMC7885571.
Evidence tabellen
|
Study reference |
Study characteristic |
Patient characteristics |
Intervention (I)
|
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Zhang 2021, study characteristics and results are extracted from the SR
Funding and conflicts of interest: Sources of support: The National Science and Technology Major Project for Significant New Drugs Development, Platform for Postmarketing Evaluation of New Drugs for Rare Diseases. |
Type of study: Systematic Review and meta-analysis
Literature search until augustus 2020
9 RCT studies included
A: Hobart (2019) B: Jacques (2018) C: Hupperts (2016) D: Jensen (2016) E: Yapundich (2015) F: Goodman (2010) G: Mora (2019) H: De Giglio (2019) I:Marion (2020)
Setting and country: A: multi-center in 11 countries B: multi-center in 6 countries C: multi-center in 6 countries D: SR E: USA F: USA and Canada G: Mexico I: Australia
No conflicts of interest. |
Inclusion criteria: (1) RCTs; (2) patients with MS diagnosis according to the McDonald’s criteria, > 18 y, any score on EDSS; (3) all subgroups of MS; (4) outcomes: MSWS-12; responders to treatment based on≥20% improvement in walking speed, as measured by the T25FW; 6-MW, defined as the number of meters a patient can walk in 6 min; Exclusion criteria: not English; the intervention of original research was not fampridine or other forms of fampridine; and the research data were missing too much or were not available.
N total at baseline: 1384
Important prognostic factors2: Mean age range in the included studies 39.3-54.05
|
Describe intervention (treatment/procedure/test):
A: Dalfampridine 10 mg twice daily B: Dalfampridine 10 mg twice daily C: Dalfampridine 10 mg twice daily D: Dalfampridine 10 mg twice daily E: Dalfampridine 5mg, 10 mg twice daily G: Dalfampridine 10 mg twice daily I: Dalfampridine 10 mg twice daily
Concomitant DMTs were allowed if they were used equally in all intervention groups in the trial. |
Describe comparison (treatment/procedure/test):
A: Placebo B: Placebo C: Placebo D: Placebo E: Placebo G: Placebo H: Placebo I: Placebo
Concomitant DMTs were allowed if they were used equally in all intervention groups in the trial. |
Length of treatment course:
A:24 weeks B:14 weeks C:24 weeks D:26-28 days E: 4 weeks G:20 weeks H:12 weeks I:8 weeks |
Outcome measures and effect size (include 95%CI and p-value if available):
MSWS‐12 Mean difference intervention vs control (95% CI) A:-4.14 (-7.10—1.18) C:-5.89 (-10.73—1.05) E:-1.98 (-5.58-1.62) F:-3.35 (-7.78-1.08)
T25FW, RR (95% CI) B:2.10 (0.21-21.39) E:1.62 (1.16-2.26) F:4.60 (2.52-8.37)
6MWT Mean difference intervention vs control (95% CI)
B:17.57 (-66.18-101.32) E:18.44 (0.97-35.91)
Adverse events Fall events, RR (95% CI) A:1.28 (0.71-2.28) C:0.47 (0.15-1.49) F:1.42 (0.75-2.67) H:1.00 (0.19-4.23) |
Dalfampridine has a positive effect on walking ability |
|
Vale 2021,
The three individual studies that were extracted from Vale et., A:Brown (2016), B: Pickering (2017), C: Hupperts (2016)
|
Type of study: SR
3 RCT studies included
Setting and country: A: USA B: Australia C: multi-centre: Canada, Italy, The Netherlands, Sweden, UK, USA
Funding: Fondation pour l’aide à la recherche sur la sclérose en plaques (ARSEP), the Fondation Saint-Luc, Bourse de mobilité Sofmer-Allergan, and the Fonds de la Recherche Scientifique-FNRS while designing, conducting, and report- ing the present work. No conflicts of interest.
|
Inclusion criteria: Patients with definite MS who were aged over 18 years. And RCTs that used PR fampridine as the intervention and placebo as the comparator were included. Also, studies adding other interven- tions (e.g., physiotherapy) were included if this interven- tion was applied to both groups. Original peer-reviewed articles published in English, French, Spanish, and Dutch were considered Exclusion criteria: None reported.
N total at baseline: 2616
Important prognostic factors2: Mean age range in the included studies 43.2-54.2 |
Describe intervention (treatment/procedure/test):
A: 10 mg Dalfampridine B: 10 mg fampridine C: 10 mg fampridine |
Describe comparison (treatment/procedure/test):
A/B/C: Placebo |
Length of treatment course:
A: 4 weeks B: 12 weeks C:24 weeks |
Outcome measures and effect size (include 95%CI and p-value if available):
TUG A: Least square means (SD) reported as difference in change from baseline. Intervention: -0.6 (1.74) Control: 0.4 (1.74) B: % improvement in TUG Intervention:74% Control:78% C: 10% threshold of improvement from baseline Intervention: 60.3% Control: 34.9%, p-value= 0.0021 |
fampridine therapy has an early and sustained improvements on balance over six months |
Risk of bias table
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Zhang (2021) |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Vale 2019 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Al Bawab, 2019 |
Other PICO, bio-equivalence |
|
Applebee, 2015 |
In review Valet |
|
Arreola-Mora, 2019 |
Other outcome measures |
|
Askari, 2021 |
Scoping review |
|
Behm, 2018 |
Older systematic review |
|
Broicher, 2018 |
Open label RCT, other outcome measures |
|
Brown, 2016 |
Only 4 weeks of intervention |
|
Chen, 2020 |
Cognition |
|
De Giglio, 2019 |
Other outcome measures |
|
Fili, 2017 |
In review Zhang |
|
Filli, 2019 |
Other outcome measures |
|
Gasperini, 2016 |
In review Valet |
|
Goodman, 2010 |
In review Zhang en Shi |
|
Goodman, 2015 |
Open label |
|
Heesen, 2016 |
Algemeen overzichtsartikel |
|
Hobart, 2019 |
In review Zhang and Shi |
|
Horton, 2013 |
Vision |
|
Hupperts, 2016 |
In review Zhang and Shi |
|
Husseini, 2010 |
Niet conform PICO |
|
Jacques, 2018 |
In review Zhang, Shi and Valet |
|
Jensen, 2014 |
Algemeen en oud |
|
Kanhai, 2019 |
Andere vraag, ophtalmoparesis |
|
Lecat 2017 |
Systematic review, unclear |
|
Limone, 2013 |
Health utility |
|
Marion, 2020 |
In review Zhang |
|
Morrow, 2017 |
Cognition |
|
Motavalli, 2020 |
Cognition |
|
Pavsic, 2015 |
Geen controlegroep |
|
Pickering, 2017 |
In review Valet |
|
Pozzilli, 2021 (2x) |
2x Post hoc analyse |
|
Prosperini, 2020 |
Other outcome measures |
|
Rocca, 2021 |
Fatigue |
|
Satchidanand, 2020 |
In review Shi |
|
Valet, 2021 |
Gaat over responders |
|
Weller, 2020 |
Andere uitkomsten |
|
Yapundich, 2015 |
In review Zhang |
|
Zörner, 2016 |
Gegevens alleen uit figuur af te lezen, niet kwantitatief beschreven |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de modules voor het addendum is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de indicatiestelling en monitoring van ziektemodulerende therapie bij mensen met MS (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Mevr. dr. B.A. de Jong, neuroloog, NVN (voorzitter)
- Mevr. B. Bakker, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. drs. R. Haenen, revalidatiearts, VRA
- Mevr. K. Harrison, verpleegkundig specialist, V&VN
- Dhr. drs. B.J.A. van Hoeve, neuroloog, NVN
- Mevr. dr. E. Hoitsma, neuroloog, NVN
- Dhr. prof. dr. J. Killestein, neuroloog, NVN
- Dhr. drs. J.B. Masselink, ziekenhuisapotheker, NVZA
- Dhr. dr. B. Moraal, radioloog, NVVR
- Dhr. dr. J. Mostert, neuroloog, NVN
- Dhr. dr. J. Murk, arts-microbioloog, NVMM
- Mevr. M. Pippel, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. dr. J. Smolders, neuroloog, NVN
- Dhr. dr. M.T. Wijburg, AIOS neurologie, NVN
- Mevr. Dr. A. Coumans, Gynaecoloog, NVOG
Met dank aan:
- Dhr. Dr. Ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog
- Mevr. dr. S. Huygens, gezondheidseconoom, Huygensandversteegh.com
- Dhr. dr. M. Versteegh, gezondheidseconoom, Huygensandversteegh.com
Met ondersteuning van:
- Mevr. dr. C.T.J. Michels, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
BelandenCie |
|
Bakker |
MS Patiënt vertegenwoordiger MSVN |
Functionel tester software Thunderbyte AI |
geen |
Geen restrictie |
|
Coumans |
Gynaecoloog |
Geen |
geen |
Geen restrictie |
|
De Jong (voorzitter) |
Functie: neuroloog |
Voorzitter commissie Addendum MS richtlijn van NVN (onbetaald). Voorzitter commissie MS registratie van NVN (onbetaald). Lid van wetenschappelijk adviesraad van Prinses Beatrixfonds (onbetaald) Lid van het PROMS initiative, onderdeel van Global MSIF Movement (onbetaald) |
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI*).
*TKI: Dit is een studie gesponsord door Sanofi, het gaat om een Bruton’s tyrosine kinase inhibitor: tolebrutinib (komt niet voor in richtlijn).
Dit zijn deels wel en niet persoonsgebonden subsidies (= deels contractonderzoek). Subsidies van instanties zoals MS research, ZonMw, hersenstichting zijn allemaal persoonsgebonden maar hierbij ik ben hierbij geen PI. Ik ben wel PI bij: - subsidie van ZN om onderzoek te doen met de landelijke MS registratie. - fase IV studie waarbij observationeel de kwaliteit en veiligheid van alemtuzumab (Sanofi Genzyme) gemonitord wordt (zit niet in adviesraad, krijg er geen geld voor). Studie gaat over post-surveillance en houdt geen relatie met indicatiestelling. - fase III studie naar tyrosine kinase inhibitors bij MS (dit middel staat niet in de richtlijn en komt naar verwachting niet op korte termijn op de markt).
Ontvangen onderzoekssubsidie van MS Vereniging Nederland in 2022: “Prevalentie van MS in Nederland” met een bedrag €60.167 Ontvangen onderzoekssubsidie van Stichting MS Research in 2016: "Improving cognitieve functioning among patients with multiple sclerosis by cognitive rehabilitation therapy or mindfulness based cognitive therapy: a dual-center, investigator-blinded, parallel group randomized controlled trial" met een bedrag van € 250.000.
|
Restrictie als TKIs ter sprake komt in een module. |
|
Haenen |
Functie: revalidatiearts |
Geen |
Geen |
Geen restrictie. |
|
Harrisson |
Functie: Verpleegkundig Specialist Werkgever: Tergooi ziekenhuis |
Richtlijn Revalidatie bij MS, vergoeding van gemaakte uren. |
Geen |
Geen restrictie. |
|
Hoitsma |
Functie: neuroloog |
Voorzitter landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
Betreft bij allen betaling onderzoeksactiviteiten. |
Geen restrictie. |
|
Killestein |
Functie: neuroloog (hoogleraar MS) |
Adviseur Springer Healthcare - Mednet Neurologie (betaald). Hoofdredacteur Tijdschrift voor Neurologie en Neurochirurgie (TNN), tot februari 2021, (betaald).
Voorzitter Horizonscan geneesmiddelen Zorginstituut Nederland. Werkgroep Neurologische aandoeningen inclusief gedrag (onbetaald). Lid Wetenschappelijke Adviesraad Stichting MS Research (onbetaald). Lid editorial board Neurology (onbetaald). Lid editorial board MS Journal (onbetaald).
|
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Immunic Therapeutics, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI)
1. Principle investigator NEXT-MS -natalizumab extended dosing bij MS -NCT04225312. Sponsor: Hersenstichting en Stichting MS Research. 2. Principle investigator DOT-MS - discontinuation of therapy in MS, NCT04260711- Sponsor: ZonMW en Stichting MS research 3. Principle investigator BLOOMS trial: efficacy, safety and cost-effectiveness of B cell tailored ocrelizumab versus standard ocrelizumab in RRMS - Sponsor: ZonMW en Treatmeds, moet nog starten. 4. Principle investigator Apps-MS studie - Sponsor: Stichting MS-Research en Health~Holland TKI. 5. Principle investigator Blood platelet-based liquid biopsies for optimization of diagnosis and treatment of patients with multiple sclerosis - Sponsor Merck. à Merck maakt medicatie die gebruikt wordt bij MS, Rebif en Mavencla. Betrfet onderzoek m.b.t. diagnostische biomarker (wel/geen MS). Geen enkele bemoeienis van Merck met de inhoud. 6. Deelname RELAMS - onderzoek naar relapses en pseudorelapses bij MS. 7. Deelname RAM-MS trial: Randomized Autologous heMatopoietic stem cell transplantation versus alemtuzumab, cladribine or ocrelizumab for patients with RRMS. EudraCT Number: 2017-001362-25 Sponsor: Stichting MS Research en Nationaal MS fonds. 8. Lid Steering Committee Ensemble trial Roche, vergoeding naar VUmc. 9. Lid Steering Committee Liberto trial Roche, vergoeding naar VUmc. 10. Lid Steering Committee NOVA trial Biogen, vergoeding naar VUmc. 11. Lid Adjudication Committee Immunic Calliper Phase II trial, vergoeding naar VUmc |
Geen restrictie. |
|
Masselink |
Functie: ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
Lid werkgroep neurologische aandoeningen (incl. gedrag) Horizonscan Geneesmiddelen, |
Geen |
Geen restrictie. |
|
Mostert |
Functie: neuroloog |
Lid hoofdredactieraad Tijdschrift voor Neurologie en Neurochirurgie (onbetaald).
Tot mei 2021: 1.5 jaar voorzitter en daarvoor 2 jaar secretaris van de landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
De financiering op contractbasis (per verrichting vergoeding). |
Bij wijzigingen, graag contact opnemen met belangencie (n.a.v. non-inferiority study) |
|
Murk |
Functie: arts-microbioloog Werkgever: Elisabeth-Tweesteden ziekenhuis Tilburg |
Redactielid tijdschrift infectieziekten (onbetaald)
Sectielid infectieziektenserologie SKML, coördinator rondzending H. pylori serologie (Nederlandse organisatie die externe kwaliteitsrondzendingen voor laboratoria organiseert) (onbetaald)
|
Ik werk als arts-microbioloog in vrije vestiging. Het verrichten van laboratoriumdiagnostiek is een onderdeel van de werkzaamheden waardoor een vrijgevestigde arts-microbioloog gefinancierd wordt. |
Geen restrictie. |
|
Pippel |
Functie: Gemeentesecretaris Werkgever: Gemeente Zandvoort |
Lid Adviesplatform MS vereniging |
Geen |
Geen restrictie. |
|
Smolders |
Neuroloog, 0.8 FTE afdeling Neurologie, Erasmus Medisch Centrum Rotterdam |
Bestuurslid MS werkgroep (onbetaald).
Kosteneffectiviteitsonderzoek MS in samenwerking met het bedrijf Huygens & Versteegh |
Onderzoek wordt gefinancierd door de MS research stichting (Voorschoten), het Nationaal MS fonds (Rotterdam) en de Erasmus Foundation (Rotterdam) Van de collectebusfondsen-studies ben ik PI. De bedrijven betreft onderzoeksprojecten met het centrum, waarbij ik niet als PI fungeer. Onderzoeksprojecten binnen MS centrum ErasMS worden gefinancierd door Merck (BTK inhibitor), Idorsia (preklinisch onderzoek compound), GSK (preklinisch onderzoek compound) en Roche (federated learning project).
In verleden:
|
Geen restrictie. |
|
Van Hoeve |
Functie: neuroloog Werkgever: ZorgSaam Zeeuws-Vlaanderen, Terneuzen |
Lid van MS zorg Zuid Zuid West, regionaal samenwerkingsverband tussen neurologen uit verschillende ziekenhuis, met MS als aandachtsgebied (onbetaald). |
April 2023: Binnenkort deelnemend centrum aan SPIN-P studie (gericht op o.a. etiologische/ prognostische factoren m.b.t. primair progressieve MS). Deelname Ectrims congres (oktober 2023) op uitnodiging Merck |
Geen restrictie. |
|
Wijburg |
Functie: AIOS Neurologie, Werkgever: Amsterdam UMC |
Geen |
Geen |
Geen restrictie.
|
|
Huygens (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
|
Versteegh (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) Editorial board member Medical Decision Making (onbetaald) Lid EuroQoL research foundation (onbetaald maar met vergoeding reiskosten en congresbezoek) Columnist NTvG (onbetaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de MS-patiënten Vereniging Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door twee afgevaardigden van de MS-patiënten Vereniging Nederland. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en MS-patiënten Vereniging Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met MS. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012; NVN, 2020) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen via een schriftelijke knelpunteninventarisatie. Een rapportage hiervan kan worden aangevraagd via de Richtlijnendatabase. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.