Cognitieve revalidatie bij MS
Uitgangsvraag
Hoe dienen MS-gerelateerde cognitieve stoornissen behandeld te worden?
Aanbeveling
Aanbeveling 1: Herkennen, erkennen en monitoren
Wees bewust van de cognitieve problematiek die kan optreden bij patiënten met MS en vraag regelmatig naar het cognitieve functioneren.
Informeer patiënten en hun omgeving tijdig over mogelijke cognitieve stoornissen (psycho-educatie).
Aanbeveling 2: Andere factoren die de cognitie beïnvloeden
Onderzoek of er andere factoren aanwezig zijn die de cognitieve klachten kunnen verklaren.
Indien aanwezig, richt behandeling in eerste instantie op deze factoren. Schakel bij meervoudige problematiek een multidisciplinair team in.
Aanbeveling 3: Doorverwijzen bij klachten en aanvullende diagnostiek
Verwijs patiënten met klachten of patiënten waarbij mogelijk sprake is van verminderd cognitief functioneren door voor aanvullende diagnostiek, bijvoorbeeld een neuropsychologisch onderzoek door de neuropsycholoog en/of onderzoek door de ergotherapeut.
Aanbeveling 4: Behandeling van cognitieve stoornissen
Kijk naar hoe cognitieve klachten en/of cognitieve stoornissen het functioneren in het dagelijks leven beïnvloeden.
Gebruik voor patiënten met MS cognitieve revalidatieprogramma’s die ontwikkeld zijn voor patiënten met niet aangeboren hersenletsel in bredere zin.
Draag zorg voor een gepersonaliseerde aanpak die aansluit bij de leefwereld van de patiënt.
Overwegingen
Zeer recent na de afronding van de literatuursamenvatting zijn de resultaten gepubliceerd van een grote gerandomiseerde studie (RCT) naar de effectiviteit van een cognitieve (groeps)interventie voor aandacht en geheugen bij 449 patiënten (245 patiënten in de interventiegroep en 204 in de controlegroep (standaard zorg) (Lincoln, 2020). Deze resultaten zijn niet meegenomen in de literatuuranalyse. Voor de volledigheid beschrijven wij hier kort de bevindingen van deze RCT.
Alle deelnemende patiënten hadden subjectieve cognitieve klachten (MSNQ-score > 27) én scoorden 1SD afwijkend op één van de neuropsychologische testen van de Brief Repeatable Battery of Neuropsychological Tests (BRB-N). Zes maanden na de interventie waren er kleine significante verbeteringen in de kwaliteit van leven in het voordeel van de interventiegroep en zowel op zes als 12 maanden na de interventie waren er klinisch relevante verbeteringen te zien op stemming en subjectieve geheugenfunctie in het voordeel van de interventiegroep. Kwaliteit van leven was 12 maanden na de interventie niet significant verbeterd in de interventiegroep ten opzichte van de controlegroep. Deze bevindingen zijn deels in lijn met de meta-analyse, maar geven een positiever beeld van de meerwaarde van cognitieve revalidatie dan de huidige literatuurreview (mogelijk dankzij het adequate aantal deelnemers in deze studie).
Voor- en nadelen van cognitieve interventies en de kwaliteit van het bewijs
Veel patiënten met MS ondervinden cognitieve klachten en/of stoornissen, met een grote negatieve impact op het dagelijks leven. Er is een literatuuronderzoek verricht naar de effectiviteit van verschillende cognitieve interventies op zelf-gerapporteerd cognitief functioneren en kwaliteit van leven van patiënten met MS.
Op basis van de geselecteerde literatuur blijft het onduidelijk of cognitieve interventies een gunstig effect hebben op het zelf-gerapporteerde cognitieve functioneren van patiënten met MS. Ook blijft het onduidelijk of cognitieve interventies een gunstig effect hebben op zelf-gerapporteerde kwaliteit van leven van patiënten met MS.
Er lijkt een positief effect te zijn na het geven van de interventies, echter, de bewijskracht voor deze conclusies uit de literatuursamenvatting is zeer laag. Dit wordt veroorzaakt door de matige methodologische kwaliteit van de betreffende studies: patiënten waren vaak niet geblindeerd en analyses waren regelmatig niet verricht volgens het intention-to-treat protocol. Bij twee studies werden bovendien verschillen in baseline scores waargenomen tussen de behandel- en de interventiegroep op de belangrijkste uitkomstmaten. Tevens zijn de in deze richtlijn geselecteerde uitkomstmaten (zelf-gerapporteerd cognitief functioneren en kwaliteit van leven) vaak niet de primaire uitkomstmaat van de studies. Hierdoor zijn deze resultaten vaak beknopt beschreven en is de power inadequaat. Er is behoefte aan methodologisch goed opgezette studies in grotere studiepopulaties, met primaire uitkomstmaten die relevant zijn voor het dagelijks leven van de MS-patiënt.
Naast deze methodologische kanttekeningen zijn er ook een aantal belangrijke inhoudelijke kanttekeningen te maken bij de resultaten van deze literatuurstudie:
Heterogeniteit steekproeven
Een eerste kanttekening betreft de heterogeniteit tussen de bestudeerde steekproeven van patiënten. In deze literatuurstudie is de aanwezigheid van een geobjectiveerde cognitieve stoornis als inclusiecriterium gebruikt: bij de patiënten moest een cognitieve stoornis zijn vastgesteld aan de hand van neuropsychologisch testonderzoek. De gebruikte neuropsychologische tests en de daarbij gehanteerde cut-off scores verschilden echter aanzienlijk tussen studies, hetgeen de bestudeerde steekproef zeer heterogeen van aard maakt. Het blijft daarmee onduidelijk in hoeverre de hier gevonden resultaten van toepassing zijn voor specifieke subgroepen van patiënten (bijvoorbeeld patiënten met matige versus ernstige cognitieve stoornissen).
Heterogeniteit interventies
Een tweede kanttekening betreft de heterogeniteit van de aangeboden interventies. Er was sprake van grote variabiliteit tussen interventies, onder andere qua duur, intensiteit, vorm (individuele behandeling, groepsbehandeling), inhoud (gedragsmatige interventies, computertraining) en cognitieve domeinen waarop de interventie zich richt (enkel domein, meerdere domeinen). Ook waren er aanzienlijke verschillen tussen de studies in de opzet van de controlecondities en in de timing van de follow-up metingen. In de literatuurstudie is het cognitief functioneren op de langstdurende follow-up geincludeerd. Dit is echter variabel tussen studies en het onderscheid tussen directe effecten en uitgestelde effecten kan niet meer worden gemaakt. Het is goed mogelijk dat deze heterogeniteit heeft bijgedragen aan het beperkte ‘overall’ effect.
One size fits all?
In alle studies in dit literatuuronderzoek werden de betreffende interventies in standaardvorm aangeboden aan alle deelnemende patiënten. Mogelijk is deze ‘one-size-fits-all´ aanpak niet geschikt als het gaat om cognitieve interventies. Wellicht zijn cognitieve interventies ´op maat´ - dat wil zeggen aangepast aan de specifieke sterktes en zwaktes in het cognitieve profiel van de patiënt – effectiever (De Meo, 2021) en zou er ook onderscheid gemaakt moeten worden tussen patienten die lichte en ernstige cognitieve problematiek hebben.
Cognitieve stoornissen versus cognitieve klachten - inclusie
In deze literatuurstudie is de aanwezigheid van een geobjectiveerde cognitieve stoornis als inclusiecriterium gebruikt. Naast patiënten met geobjectiveerde cognitieve stoornissen is er echter een aanzienlijke groep patiënten die wel duidelijk cognitieve klachten ervaart, maar waarbij neuropsychologisch onderzoek geen of enkel lichte cognitieve stoornissen laat zien (Schependom, 2014). Bij sommige patiënten ligt de verklaring hiervoor in het feit dat er sprake is van cognitieve achteruitgang ten opzichte van het eigen premorbide functioneren, maar dat de cognitieve prestaties desondanks nog binnen de normale range vallen. Bij andere patiënten is er geen sprake van cognitieve stoornissen of cognitieve achteruitgang, maar komen de cognitieve klachten voort uit andere problematiek, bijvoorbeeld vermoeidheid of depressie. Om de heterogeniteit binnen deze literatuurstudie te beperken zijn studies met patiënten met cognitieve klachten maar zonder geobjectiveerde cognitieve stoornissen uitgesloten. Het is echter de ervaring van de werkgroep dat ook deze groep wel degelijk baat kan hebben bij cognitieve interventies. Als factoren als vermoeidheid of depressie duidelijk op de voorgrond staan, dient behandeling zich primair te richten op de aanpak van deze problematiek; cognitieve interventies kunnen echter vervolgens alsnog ingezet worden en van meerwaarde zijn.
Cognitieve stoornissen versus cognitieve klachten - uitkomstmaten
In het huidige literatuuronderzoek is gekeken naar het effect van interventies op het ervaren cognitief functioneren (zelfrapportage). Een aanzienlijk deel van de wetenschappelijke studies naar cognitieve revalidatie bij MS is niet meegenomen in de analyse, aangezien in deze studies objectief cognitief functioneren (testprestaties op neuropsychologisch onderzoek) als uitkomstmaat werd gebruikt. In de klinische praktijk is het van belang dat de interventie de participatie en/of de kwaliteit van leven van de MS-patiënt vergroot. Minder relevant voor de kliniek is een verbetering van een x-aantal punten op een x-aantal tests van het neuropsychologisch onderzoek (NPO), zonder dat deze verbetering samengaat met een ervaren verbetering in het dagelijks functioneren (zelf-gerapporteerd cognitief functioneren of kwaliteit van leven). De resultaten van studies waarin gebruik gemaakt wordt van objectief cognitief functioneren als uitkomstmaat lijken veelbelovend met betrekking tot de effectiviteit van cognitieve interventies (Cerasa, 2013 voor een review; zie Goverover, 2018). Echter, de generalisatie van de effecten van deze (veelal stoornisgerichte) interventies naar het dagelijks functioneren lijkt voorlopig beperkt. Het is daarom van belang om behandeling ook te richten op de ervaren cognitieve klachten en hierbij gericht de juiste uitkomstmaten te kiezen. Er is behoefte aan onderzoek naar de samenhang (of het gebrek daaraan) tussen objectief en subjectief cognitief functioneren. Daarnaast is er behoefte aan nieuwe uitkomstmaten die het cognitief functioneren in het dagelijks leven goed in kaart brengen.
Functietraining versus compensatietraining
Het onderscheid tussen functietraining (gericht op het verbeteren van de aangedane cognitieve functie) en compensatietraining (gericht op het aanleren van strategieën om zo goed mogelijk te compenseren voor de aangedane cognitieve functie) was voor de in deze literatuursamenvatting geïncludeerde studies niet altijd goed te maken; vaak was er sprake van mengvormen. In de huidige klinische praktijk wordt voornamelijk gebruik gemaakt van compensatietraining. Patiënten kunnen door cognitieve training compensatietechnieken aanleren die leiden tot meer functionele onafhankelijkheid in het dagelijks leven (Maitra, 2010; Mendoza & Pittenger, 2003; Tate, 1997). Hierbij is het van belang aan te sluiten bij de uitgangspunten van betekenisvol handelen. Ook is het van belang aan te sluiten bij de reeds ontwikkelde compensatietechnieken, leerstijl en copingstijl en de persoonlijke interesses van de patiënt (Finlayson, 2012, zie ook ergotherapierichtlijn MS).
Screening en monitoring
De Internationale MS and Cognition Society (IMSCOGS) geeft als aanbeveling om bij alle MS-patiënten, op baseline, een screenend NPO af te nemen. Onder een screenend NPO wordt verstaan: een korte testbatterij van tenminste een enkele test (Symbol Digit Modalities Test, 90 seconden, Benedict 2017) tot een drietal tests (BICAMS, 15 minuten, Langdon, 2012). Dit screenend NPO zou idealiter ten tijde van diagnose, bij stabiele ziekte, worden afgenomen. Daarnaast is de andere aanbeveling van IMSCOGS om patiënten een- of tweejaarlijks met dit screenend NPO te volgen (Kalb, 2018). Een voordeel van het afnemen van een screenend NPO is dat het cognitief functioneren van de patiënt op een later moment in de tijd beoordeeld kan worden in licht van zijn/haar eigen functioneren op een eerder moment. Dit is waarschijnlijk preciezer en informatiever dan een vergelijking met normscores. Daarnaast zou een screenend NPO na diagnose en een- of tweejaarlijkse monitoring kunnen bijdragen aan een tijdige detectie van cognitieve achteruitgang. Indien de genoemde tests niet beschikbaar zijn, kunnen alternatieve tests voor informatie verwerkingssnelheid en verbaal- en visuospatieel geheugen gebruikt worden. Het wordt sowieso aangeraden om altijd naar het cognitieve functioneren te informeren (Van der Hiele, 2019).
Waarden en voorkeuren van patiënten en hun systeem
Cognitieve problemen hebben een zeer grote impact op de kwaliteit van leven van patiënten. Daarom is vroegtijdige herkenning, erkenning en psychoeducatie erg belangrijk voor de patiënt zelf maar ook voor diens systeem; dit kan bijdragen aan meer functionele onafhankelijkheid in het dagelijks leven.
Kennis over cognitieve symptomen en self-efficacy met betrekking tot het managen van cognitieve klachten kan worden vergroot door een cognitief zelfmanagement programma. Patiënten geven aan dat vooral ondersteuning in het toepassen van aangeleerde strategieën (in meerdere situaties) effectief is (Finlayson, 2012; Shevil & Finlayson, 2010).
De omgeving van patiënten met MS is zich niet altijd bewust dat MS cognitieve veranderingen tot gevolg kan hebben. Door de omgeving (inclusief werk), waar dit zinvol en mogelijk is, bij de behandeling te betrekken kan begrip worden vergroot en kan de omgeving de cliënt ondersteunen in het managen van ervaren problemen (Finlayson, 2012) waardoor participatie wordt vergroot. Zie ook de module Sociale participatie en Arbeidsparticipatie.
Kosten (middelenbeslag)
Er is voor deze module geen onderzoek gedaan naar de kosteneffectiviteit van de verschillende cognitieve interventies. Echter, de werkgroep is van mening dat positieve effecten in de vorm van betere kwaliteit van leven, beter dagelijks functioneren en/of betere participatie zullen opwegen tegen de kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
De onderzochte interventies in de literatuurreview zijn vanwege de lage bewijskracht niet aanvaardbaar en niet haalbaar. Vanuit het oogpunt van de patiënt vergen de interventies een aanzienlijke inspanning, tijdsinvestering en discipline. Voor sommige interventies is de beschikbaarheid van een computer en digitale vaardigheden noodzakelijk. Vanuit het oogpunt van de behandelaar zijn veel van de in de literatuur beschreven computertrainingen (nog) niet beschikbaar in de klinische praktijk.
Het implementeren van een screenend NPO is aanvaardbaar en haalbaar met een geringe inspanning (de minste inspanning is een SDMT van 90 seconden, of als alternatief de WAIS-subtest Symbool Substitutie Coderen). Dit screenend NPO zou eventueel door een getrainde (MS-)verpleegkundige afgenomen kunnen worden. Indien er meer tijd beschikbaar is, kan voor de BICAMS (of soortgelijke tests) gekozen worden (15 minuten).
Het geven van (tijdige) psychoeducatie en het aanbieden van interventies bij cognitieve problematiek is aanvaardbaar en haalbaar (met in achtneming van de reguliere en lokale wachtlijsten). Het is belangrijk om per probleem goed te beoordelen naar welk specialisme moet worden doorverwezen.
Rationale van de aanbeveling
Aanbeveling 1: Herkennen, erkennen en monitoren
De werkgroep is van mening dat het essentieel is om aandacht te hebben voor het cognitief functioneren bij patiënten met MS ongeacht of hier door de patiënt om gevraagd wordt of aanleiding toe gegeven wordt. Het cognitief functioneren moet altijd goed uitgevraagd worden in de anamnese, maar ook in de heteroanamnese. Dit omdat de naaste soms een beter en/of aanvullend beeld heeft van het cognitief functioneren.
Ook is het van belang om patiënten en hun omgeving (bijvoorbeeld partner, kinderen, werkgever) vroegtijdig te informeren (psychoeducatie) over mogelijke cognitieve functiestoornissen omdat cognitieve stoornissen bij sommige patiënten al vroeg in de ziekte ontstaan (zoals reeds vermeld in de richtlijn Cognitieve stoornissen bij MS 2012).
Adequate monitoring van de cognitieve functies, waarbij het functioneren van de patiënt in de tijd gevolgd wordt, is van belang voor het vroeg herkennen van cognitieve achteruitgang en het kunnen inzetten van passende (psychosociale) ondersteuning (bijvoorbeeld door een sociaal werker gezondheidszorg/medisch maatschappelijk werker of anderszins). Hiervoor kan een screenend NPO worden gebruikt dat eventueel door een getrainde (MS-)verpleegkundige afgenomen kan worden. Follow-up screenend NPO kan een- of tweejaarlijks worden uitgevoerd, of indien de patiënt klachten rapporteert. Het vastleggen van de uitgangspositie (aan het begin van de ziekte) is zeer van belang.
Om ervoor te zorgen dat patiënten adequate diagnostiek krijgen voor hun cognitief functioneren kan het helpen om met de betrokken behandelaars afspraken te maken over wie verantwoordelijk is voor het monitoren hiervan.
Aanbeveling 2: Andere factoren die de cognitie beïnvloeden
Ondanks dat deze module zich primair richt op de behandeling van patiënten met MS met objectiveerbare cognitieve stoornissen, vind de werkgroep het belangrijk te benoemen dat het belangrijk is om zorgvuldig uit te zoeken wat de meest waarschijnlijke onderliggende oorzaak van de cognitieve klachten en/of stoornissen is. Denk hierbij aan factoren als vermoeidheid, emotionele klachten (bijvoorbeeld depressie, angst), fysieke beperkingen, pijn en medicamenteuze behandelingen die de cognitieve functies ook kunnen beïnvloeden. Als dergelijke factoren op de voorgrond staan, dient de behandeling in eerste instantie op deze factoren te worden gericht. Hierdoor kunnen de cognitieve klachten verbeteren of zelfs verdwijnen. Indien dit niet het geval is, kan in tweede instantie aanbeveling vier worden opgevolgd, al dan niet binnen de context van multidisciplinaire revalidatie.
Aanbeveling 3: Doorverwijzen bij klachten en aanvullende diagnostiek
Indien er sprake is van cognitieve klachten is het van belang dat er een verwijzing volgt naar (neuro)psycholoog of ergotherapeut (bij voorkeur met deskundigheid op het gebied van cognitieve revalidatie) voor het verder in kaart brengen van het probleem op basis van een gerichte vraagstelling (zoals reeds vermeld in de richtlijn cognitieve stoornissen bij MS 2012).
Als een NPO gewenst is, wordt het aanbevolen om een testbatterij te gebruiken die een beeld geeft van tenminste de volgende cognitieve domeinen: snelheid van informatieverwerking, leren en geheugen, aandacht, executief functioneren, visuospatiële waarneming en woordvloeiendheid. Het is belangrijk om de uitkomsten van het NPO te bespreken met de patiënt.
Het is van belang om in de aanvullende diagnostiek ook aandacht te besteden aan andere factoren dan cognitieve functiestoornissen die de cognitie kunnen beïnvloeden, zie aanbeveling 2.
Aanbeveling 4: Behandeling van cognitieve stoornissen
Het is essentieel om een vertaalslag te maken van de klachten en stoornissen van de patiënt en/of de resultaten van het NPO naar het functioneren in het dagelijks leven. Patiënten hebben behoefte aan handvatten om in het dagelijks leven beter om te gaan met de klachten die zij ervaren. Een ergotherapeut (bij voorkeur met deskundigheid op het gebied van cognitieve revalidatie)is hierbij een belangrijke speler die op individuele basis ondersteuning en zorg op maat kan bieden.
Ondanks de ontbrekende bewijskracht voor cognitieve interventeis is het de ervaring van de werkgroep dat patiënten over het algemeen aangeven veel baat te hebben bij cognitieve revalidatieprogramma’s. Dit gaat niet altijd samen met een reductie van cognitieve klachten; soms worden patiënten zich door de interventie juist bewuster van hun cognitieve problemen, hetgeen kan resulteren in een toename van gerapporteerde klachten, maar óók in een betere aanpassing aan en omgang met cognitieve problemen.
Met betrekking tot cognitieve revalidatieprogramma’s zijn er vooral positieve ervaringen met compensatoire strategietrainingen. Dergelijke interventies zijn gericht op het verminderen van de negatieve gevolgen van de stoornissen en niet op het herstellen van de cognitieve functies zelf. De in de revalidatie gebruikte protocollen ‘Geheugenstrategietraining’, ‘Omgaan met tijddruk’ en ‘Behandeling van executieve functiestoornissen’ kunnen ook worden overwogen bij de groep patiënten met MS, evenals het Niet Rennen maar Plannen programma (Baars-Eslinga, 2013). Het is hierbij essentieel dat het programma op maat gemaakt wordt voor de patiënt met MS, zodat het aansluit bij diens specifieke wensen en leefomgeving.
Voor meer informatie over cognitieve revalidatie:
- Richtlijn neuropsychologische revalidatie (2017).
- (Neuro)psychologische behandeling, Ponds (2010). en
- (Evidence-based) protocollen zijn te verkrijgen via: www.neuropsychologischebehandeling.nl.
Onderbouwing
Achtergrond
Veel patiënten met MS ervaren cognitieve klachten al dan niet als gevolg van cognitieve functiestoornissen, zoals stoornissen in de snelheid van informatieverwerking, aandacht, visuospatiële vaardigheden, geheugen of executief functioneren. Cognitieve klachten (ervaren klachten door de patient) en cognitieve stoornissen (afwijkende prestaties op het neuropsychologisch onderzoek) kunnen leiden tot beperkingen in het dagelijks leven en een verminderde kwaliteit van leven. Er is in de klinische praktijk steeds meer aandacht voor de mogelijke aanwezigheid van cognitieve klachten en stoornissen. Er is echter veel praktijkvariatie in de screening op deze problematiek en de behandeling hiervan en er heerst onduidelijkheid over de effectiviteit van de geboden behandelingen.
Wetenschappelijk onderzoek naar de behandeling van cognitieve klachten (in de afwezigheid van cognitieve stoornissen) is niet beschikbaar. Deze module richt zich daarom op de behandeling van cognitieve stoornissen. In de behandeling van cognitieve stoornissen, bieden medicamenteuze behandelingen geen uitkomst. De effecten van ziekte-modulerende behandeling bij MS op de cognitieve functies zijn klein en voorzichtig positief. Echter, deze (kleine) effecten zijn niet bepalend voor de te kiezen behandelstrategie (Benedict, 2020; Kalincik, 2017). Bewezen medicamenteuze behandelingen specifiek gericht op het behandelen van cognitieve stoornissen bij MS zijn er op dit moment niet (Cotter, 2018). Dit is de reden waarom deze literatuuranalyse op niet-medicamenteuze behandelingen voor cognitieve stoornissen bij MS gericht is. Het gaat hier om behandelingen die primair gericht zijn op het verbeteren van het cognitief functioneren (zoals bijvoorbeeld het aanleren van compensatoire strategieën), vanaf hier aangeduid als cognitieve interventies[1]. De aanbevelingen van de richtlijn uit 2012 zijn grotendeels nog up to date, en daarom geïntegreerd in deze module.
[1] Uit wetenschappelijk onderzoek blijkt dat fysieke beweging gunstige effecten heeft op de hersenen. Indirect zou dit ook de cognitie positief kunnen beïnvloeden. Deze interventies zijn niet meegenomen in deze richtlijn.
Conclusies / Summary of Findings
1. Zelf-gerapporteerd cognitief functioneren
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van cognitieve interventies op het zelf-gerapporteerd cognitief functioneren van patiënten met MS.
Bronnen: (Campbell, 2016; De Giglio, 2015; Mousavi, 2020; Perez-Martin, 2017; Rosti-Otajarvi, 2013, Solari, 2004) |
2. Zelf-gerapporteerde kwaliteit van leven
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van cognitieve interventies op zelf-gerapporteerde kwaliteit van leven van patiënten met MS.
Bronnen: (Campbell, 2016; Chiaravalloti, 2013; De Giglio, 2015; Goverover, 2018; Mattioli, 2012; Mattioli, 2015; Perez-Martin, 2017; Rosti-Otajarvi, 2013) |
Samenvatting literatuur
Beschrijving studies
De veertien studies onderzoeken een grote verscheidenheid aan cognitieve interventies. Er zijn zowel individuele als groepsinterventies opgenomen. Verder zijn er zowel gedragsmatige interventies (bijvoorbeeld compensatietraining, dat wil zeggen training gericht op het aanleren van compensatoire strategieën) opgenomen als interventies waarbij het doel het verbeteren van de hersenfunctie is (functietraining, dat wil zeggen training gericht op het verbeteren van één of meer cognitieve functies). Vijf interventies richtten zich op één cognitief domein, waar de negen andere interventies zich richtten op het verbeteren van meerdere cognitieve domeinen tegelijkertijd. Interventies duurden vijf tot 24 weken en sessies vonden één tot vijf keer per week plaats. De duur van de sessies van de interventies varieerde van 30 tot 75 minuten per sessie. De gemiddelde leeftijd van de patiënten varieert van 40,6 tot 59,1 jaar. Vier studies includeerden uitsluitend mensen met relapsing-remitting MS.
Voor alle studies zijn de baseline scores vergeleken met de scores na afloop van de interventie (follow-up meting). De tijd tussen het beëindigen van de interventie en de follow-up meting varieert per studie (gemiddeld 14 weken, variërend van nul weken tot negen maanden). Zes studies hebben meerdere follow-up metingen, in deze gevallen is altijd de laatste follow-up meting in de analyse meegenomen.
Studiekwaliteit
Twee studies hanteerden mogelijk geen adequate randomisatiemethode en worden daarom beschouwd als quasi-RCT. De overige studies beschreven een adequaat RCT studiedesign. Zes studies hanteerden een adequate maskering van randomisatie. Bij de overige acht studies was de maskering van randomisatie inadequaat uitgevoerd of niet beschreven. Vijf studies beschreven blindering van patiënten; in de overige negen studies waren patiënten niet geblindeerd (zes studies) of was de blindering niet beschreven in het artikel (drie studies). Twee studies hebben een intention-to-treat protocol gevolgd. Voor de andere studies is onduidelijk hoe is omgegaan met uitval van participanten en volgens welk protocol de analyses zijn uitgevoerd.
Per uitkomstmaat staat de studiekwaliteit van de geïncludeerde studies nader beschreven.
Tabel 1 Kenmerken studies en studiepopulaties
|
Studie |
Gemiddelde leeftijd % vrouw Tijd sinds diagnose |
% type MS;
|
Objectieve stoornis*
|
Interventie Aantal participanten (N), type intervention, getarget cognitief domein, karakteristieken (duur en frequentie van sessies, aantal sessies per week) |
Controle Aantal participanten (N), beschrijving van controle conditie |
|
Amato, 2014 (quasi-RCT) Geen data gerapporteerd |
Leeftijd: 40,9j (11,5) Vrouw: 78,4% Diagn: 13,0j (8,7) |
100% RR_MS |
≥1.5 SD onder norm op twee of meer aandachtstaken (Rao’s Brief Repeatable Battery) |
N=55 Training m.b.v computer, ‘Attention Processing Training’ Domain: aandacht Session: 60 minuten Frequentie: 2/wk Weken: 12 |
N=33 Aspecifieke training |
|
Campbell, 2016 |
Leeftijd: 47,37j (8,23) Vrouw: 71,7% Diagn: 11,61j (8,2) |
71% RR-MS 29% SP-MS |
Score <5e percentiel gecorrigeerd voor leeftijd/geslacht/educatie op één of meer tests van de ‘Brief International Cognitive Assessment for MS’ (BICAMS) |
N=17 RehaCom, thuis Domein: multidomein Session: 45 minuten Frequentie: 3/wk Weken: 6 |
N=18 Natuur films, DVDs |
|
Chiaravalotti, 2013 |
I: Leeftijd: 48,13j (10,17) Vrouw: 76% Diagn: 170,87m (120,51) C: Leeftijd: 49,32j (8,47) Vrouw: 76% Diagn: 173,37m (103,44) |
I: 73% RR-MS 2% PP-MS 13% SP-MS 2% PR-MS 9% unknown |
Inprentings stoonis, ≥1.5 SD lager dan het gemiddelde van de controle groep op de ‘Open Trial Selective Reminding Test’* |
N=45 Modified Story Memory Technique Domein: memory Session: 45-60 minuten Frequentie: 2/wk Weken: 5 |
N=41 Placebo controle; groepstherapie voor training in aspecifieke taken |
|
Chiaravalloti, 2020 |
I: Leeftijd: 55,2j (9,13) Vrouw: 73% Diagn: 204,07m (143,16) C: Leeftijd: 53,31j (10,74) Vrouw: 54% Diagn: 191,08m (84,90) |
I: 20% PP-MS 7% PR-MS C: 54% PP-MS 0% PR-MS
|
Inprentings stoornis en geheugenstoornis (≥1.5 SD lager dan norm op de ‘Open Trial Selective Reminding Test’) |
N=15 Sessie met trainer; aangepaste Story Memory Technique Domein: geheugen Session: 45-60 minuten Frequentie: 2/wk Weken: 5 |
N=13 Placebo groups; sessies voor training in aspecifieke taken |
|
De Giglio, 2015 |
I: Leeftijd: 44,64j Vrouw: 78% Diagn: 13,28j (8,28) C: Leeftijd: 42,99j Vrouw: 71% Diagn: 11,4j (7,45) |
100% RR-MS |
Score onder afkapwaarde op minimaal één van de drie tests: Stroop Test (ST): equivalent score <3, (Paced Auditory Serial Addition Test (PASAT) 3-s presentation rate, and Symbol Digit Modalities Test (SDMT): score <5th percentiel van normscore |
N=18 Dr. Kawashima’s Brain Training: videospel, thuis Domein: aandacht, werkgeheugen, verwerkingssnelheid Sessie: 30 minuten Frequentie: 5/wk Weken: 8 |
N=17 Wachtlijst |
|
Gich, 2015 |
I: Leeftijd: 45,5j (9,6) Vrouw: 73% Diagn: 9,8j (6,2) C: Leeftijd: 44,0j (8,3) Vrouw: 62% Diagn: 10,7j (6,8)
|
I: 96% RR-MS, 5% SP-MS C: 81% RR-MS, 19% SP-MS
|
Milde cognitive stoornis: score 1.5 SD lager dan norm score op een neuropsychologisch testonderzoek (BRB-NT + aanvullende tests) |
N=22 Computer programma MS-LINE!: pen-en-papier oefeningen en computeroefeningen + korte dagelijkse cognitieve oefening thuis met familielid Domein: multidomein Sessie: 75 minuten Frequentie: 2/wk Weken: 24 (6 maanden) |
N=21 Geen interventie |
|
Goverover, 2018 |
I: Leeftijd: 50,15j (9,12) Vrouw: 70% Diagn: 11,1j (6,5) C: Leeftijd: 48,50j (8,8) Vrouw: 80% Diagn: 11,4j (7,1) |
I: 63% RR-MS 11% SP-MS 26% PP-MS C: 75% RR-MS 13% SP-MS 13% PP-MS |
Geheugenstoornis, gemeten op de ‘selective memory test (SRT)’; score ≥0.5 SD onder het gemiddelde van de gezonde controles |
N=19 Individuele sessie; ‘self-GEN treatment’ Domein: geheugen Sessie: 60 minuten Frequentie: 2/wk Weken: 3 |
N=16 Sessies, maar zonder actieve ingredienten |
|
Grasso, 2017 |
I: Leeftijd: 59,55j (7,2) Vrouw: 65% Diagn: 21,64j (9,4) C: Leeftijd: 58,67j (10,3) Vrouw: 65% Diagn: 21,9j (6,9) |
47% RR-MS 9% PP-MS 44% SP-MS |
MMSE ≤24 |
N=17 ‘Attention Processing Training’ + fysiotherapie, gesuperviseerd Domein: multidomein Sessie: 60 minuten Frequentie: 3/wk Weken: 12 |
N=17 Niet-specifieke gecomputeriseerde activiteiten en fysiotherapie |
|
Mattioli, 2012 (quasi-RCT)
= Mattioli 2010 follow-up + 3 extra subjects |
I: Leeftijd: 45,46j (10,48) Vrouw: NR Diagn: 16,69j (7,76) C: Leeftijd: 46,90j (10,24) Vrouw: NR Diagn: 20,00j(8,91) |
100% RR-MS
|
Z score < -1.5 op de PASAT (200 of 300 interval) en T score <35 voor de WCST op één van de tests: total aantal fouten (WCST te), aantal foute perseveraties(WCST pe) en aantal respons perseveraties (WCST pr)
|
N=13 Rehacom; gecomputeriseerd Domein: aandacht, verwerkingssnelheid en geheugen Sessie: 60 minuten Frequentie: 3/wk Weken: 12 |
N=11 Geen revalidatie |
|
Mattioli, 2015 |
Median, (IQR) I: 45y (38-50) Vrouw: 59% Diagn: 23,5m (12-120) C: 43j (34-53) Vrouw: 58% Diagn: 36m (12-96) |
100% RR-MS
|
Stoornis (leeftijd corrected z-score ≤1.5 SD onder normscore) op één of meer tests van de Rao’s Brief Repeatable Battery |
N=22 RehaCom, gecomputeriseerd, thuis Domein: aandacht, verwerkingssnelheid en geheugen Sessie: 60 minuten Frequentie: 2/wk Weken: 15 (4 months) |
N=19 Aspecifieke interventie; psychologische behandeling |
|
Mousavi, 2020 Npsy Rehab. |
I: 40,55j Diagn: 6,20j C+P: 40.95j Diagn: 7,18j
Vrouw overall: 58% |
82% RR-MS 18% SP-MS |
Cognitieve problemen: ≥2 SDs onder het gemiddelde van gezonde participanten op de BRBN test |
N=20 Cognitieve revalidatie (compensatiestrategie, memory problems adaptation methods); sessie met trainer en huiswerk Domein: geheugen Sessie: 60 minuten Frequentie: 1/wk Weken: 8 |
N=40 (20 placebo: ontspanningstechnieken techniques; 20 control: standaard zorg en informatie) |
|
Perez-Martin, 2017 |
I: Leeftijd: 44,93j (9,89) Vrouw: 56% Diagn: 11,50j (8,05) C: Leeftijd: 40,88j (8,50) Vrouw: 77% Diagn: 9,59j (7,40) |
92% RR-MS 5% PP-MS 3% SP-MS |
≥1,5 SD onder het gemiddelde van de controle groep op ten minste twee cognitieve tests van het neuropsychologisch onderzoek |
N=30 Gesuperviseerde gecomputeriseerde cognitieve training + pen-en-papier huiswerk Domein: multidomein Sessie: 60-75 minuten Frequentie: 1/wk Weken: 12 |
N=32 Passief (wachtlijst) |
|
Rosti-Otajarvi, 2013
= follow-up of Mäntynen, 2014
|
I: Leeftijd: 43,5j Vrouw: 78% Diagn: 9,2j (6,6) C: Leeftijd: 44,1j Vrouw: 78% Diagn: 10,1j(7.1) |
100% RR-MS |
Stoornis in aandacht en verwerkingssnelheid: Symbol Digit Modalities Test total score ≤50 |
N=60 Gecomputeriseerde aandacht en werkgeheugen training, stellen van doelen en psychoeducatie Domein: multidomein Sessie: 60 minuten Frequentie: 1/wk Weken: 13 |
N=42 Geen interventie |
|
Solari, 2004 |
I: Leeftijd: 46.2j(9.2) Vrouw: 65% Leeftijd eerste symptomen: 31,0y (9,1) C: Leeftijd: 41,2j (10,6) Vrouw: 62% Leeftijd eerste symptomen: 27,7j (10,4)
|
51% RR-MS 45% PP-MS 4% SP-MS |
Score <80e percentiel op tenminste twee componenten van de ‘Brief Repeatable Battery of Neuropsychological Tests’ (BRB-NT) |
N=40 RehaCom: gecomputeriseerd, gesuperviseerd Domein: multidomein Sessie: 45 minuten Frequentie: 2/wk Weken: 8 |
N=37 Non-adaptieve sham conditie |
SD: standaard deviatie; j: jaren; m: maanden; diagn.: Jaren (j) of maanden (m) sinds diagnose; CCT: computerized cognitive training; ITT: intention-to-treat analyse; MS, multiple sclerosis; PP, primair progressief; RR, relapsing-remitting; SP, secondair progressief, PR: progressief relapsing.
*: Informatie over studies die zijn beschreven in een geïncludeerd review, is uit de originele publicatie gehaald.
Resultaten
1. Zelf-gerapporteerd cognitief functioneren (cruciale uitkomstmaat)
Zes studies (Campbell, 2016; De Giglio, 2015; Mousavi, 2018; Perez-Martin, 2017; Rosti-Otajarvi, 2013; Solari, 2004) rapporteerden de uitkomsten van een vragenlijst naar zelf-gerapporteerd cognitief functioneren.
Vier studies hanteerden een adequate manier voor randomisatie. Voor 2 studies (Mousavi, 2018; Perez-Martin, 2017) was de methode en maskering voor randomisatie niet beschreven. Voor de meeste studies waren de deelnemers niet geblindeerd of was het onduidelijk of blindering plaatsvond. De studies hebben analyses niet volgens intention-to-treat protocol uitgevoerd en/of hebben niet beschreven hoe missing data verwerkt is in de analyses.
Twee studies (De Giglio, 2015; Solari, 2004) gebruikten de cognitieve schaal van de Multiple Sclerosis Quality of Life-54 (MSQOL-54). Een hogere score op deze lijst geeft een beter subjectief cognitief functioneren weer. Drie studies gebruikten de Multiple Sclerosis Neuropsychological (Screening) Questionnaire (MSNQ; Campbell, 2016; Perez-Martin, 2017; Rosti-Otajarvi, 2013) en één studie (Mousavi, 2020) gebruikte de Everyday Memory Questionnaire. Een hogere score op deze lijsten duidt op meer cognitieve klachten. De resultaten van deze studies zijn omgescoord in de meta-analyse, zodat een hogere score overeenkomt met een beter subjectief cognitief functioneren.
Vijf studies rapporteerden de gemiddelde score en SD. Deze resultaten zijn gepoold in een meta-analyse (Figuur 1). De SMD was 0,18 (95% BI -0,08 tot 0,45), ten gunste van de interventiegroep. Dit is geen klinisch relevant verschil.
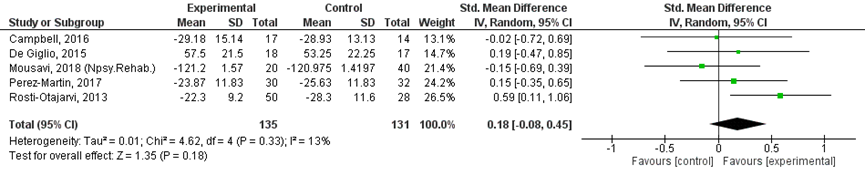
Figuur 1 Zelf-gerapporteerd cognitief functioneren na cognitieve interventie versus controle conditie
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Follow up periode: Campbell 2016: 12 weken na 6-weekse training; De Giglio (2015): binnen 3 dagen na 8-weekse training; Mousavi (2020): 5 weken na 8-weekse training; Perez-Martin (2017): na training van 3 maanden; Rosti-Otajarvi (2013): 9 maanden na training van 3 maanden
In één studie (Solari, 2004) werd een grotere verbetering gerapporteerd in de controlegroep (+55,9 (SE23) ten opzichte van de interventiegroep (+42,7 (SE 20)). Dit verschil van 13,2 punten is klinisch relevant, maar niet in het voordeel van de interventie. Patiënten in de interventiegroep werden niet slechter, maar verbeterden minder sterk dan de patiënten in de controlegroep. Dit resultaat is niet in lijn met de meta-analyse waarbij de interventiegroep (hoewel niet klinisch relevant) betere scores liet zien dan de controlegroep.
2. Zelf-gerapporteerde kwaliteit van leven (belangrijke uitkomstmaat)
Zelf-gerapporteerde kwaliteit van leven werd beschreven in acht studies (Campbell, 2016, Chiaravalloti 2013, De Giglio 2015, Goverover 2018, Mattioli 2012, Mattioli 2015, Perez-Martin 2017, Rosti-Otajarvi 2013).
Het merendeel van deze studies hanteerde adequate randomisatie procedures. Eén studie beschreef de methode van randomisatie niet duidelijk (Perez-Martin, 2017) en voor twee studies was onduidelijk of randomisatie adequaat verhuld werd (Perez-Martin, 2017; Goverover, 2018). Bij twee studies was een verschil aanwezig op baseline in scores op zelf-gerapporteerde kwaliteit van leven (Campbell, 2016 en Perez-Martin, 2017). Dit is van invloed op de post-scores zoals gebruikt in de gepoolde analyse. Bij beide studies hadden de controle groepen een hogere kwaliteit van leven op de baseline meting, maar was de verschilscore in kwaliteit van leven van de interventiegroep groter. In de helft van de studies waren de deelnemers niet geblindeerd voor de behandeling. Twee studies hebben analyses volgens een intention-to-treat protocol uitgevoerd, vier studies deden dit niet en de resterende twee studies beschreven niet hoe analyses zijn uitgevoerd.
Vier studies (De Giglio, 2015; Mattioli, 2012; Mattioli, 2015; Perez-Martin, 2017) gebruikten de Multiple Sclerosis Quality of Life-54 (MSQL-54). Drie studies (Campbell, 2016; Chiaravalloti, 2013; Goverover, 2018) gebruikten de Functional Assessment of MS (FAMS) en één studie (Rosti-Otajarvi, 2013) gebruikte de WHO Quality Of Life assessment instrument (WHOQOL-BREF). Voor alle uitkomsten duidt een hogere score op een betere subjectieve kwaliteit van leven.
Zes studies rapporteren een gemiddelde score en SD of deze konden met Review Manager berekend worden. De resultaten zijn gepoold in een meta-analyse (Figuur 2).
De SMD was 0,03 (95% BI -0,31 tot 0,36) ten gunste van de experimentele groep. Dit is geen klinisch relevant verschil.
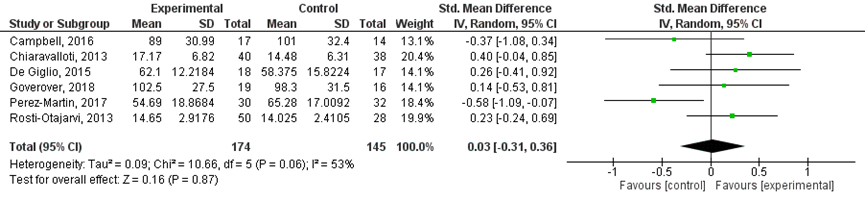
Figuur 2 Zelf-gerapporteerde kwaliteit van leven na cognitieve interventie versus controle conditie
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Follow up periode: Campbell (2016): 12 weken na 6-weekse training; Chiaravalloti, (2013): 6 maanden na 5-weekse training; De Giglio (2015): binnen 3 dagen na 8-weekse training; Goverover (2018): na 3-weekse training; Perez-Martin (2017): na training van 3 maanden; Rosti-Otajarvi (2013): 9 maanden na training van 3 maanden
Twee studies (Mattioli, 2012 en Mattioli, 2015) rapporteerden de verschilscores van de mediaan met bijbehorende interkwartielrange (IQR) op de MSQoL vragenlijst. Mattioli (2012) rapporteert een verschilscore als mediaan van +33 (IQR -17 tot 104) voor de interventiegroep en -13 (-22,5 tot 46) voor de controle groep. Dit is een klinisch relevant verschil, ten gunste van de interventiegroep. Mattioli (2015) rapporteert een verschilscore in mediaan van 0 (IQR -12 tot 9) voor de interventiegroep en verschilscore in mediaan van 1 (IQR -9 tot 7) voor de controle groep. Dit is geen klinisch relevant verschil. Deze laatste bevindingen zijn in lijn met de meta-analyse.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat zelf-gerapporteerd cognitief functioneren begon op hoog, omdat de studies allen RCT’s waren. Het niveau is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, -1), tegenstrijdige resultaten (inconsistentie, -1) en relatief lage aantallen patiënten (imprecisie, -1). Daarmee komt de bewijskracht voor ‘zelf-gerapporteerd cognitief functioneren’ op zeer laag.
De bewijskracht voor de uitkomstmaat ‘zelf-gerapporteerde kwaliteit van leven’ begon op hoog, omdat de studies allen RCT’s waren. Het niveau is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, -2) en relatief lage aantallen patiënten (imprecisie, -1). Daarmee komt de bewijskracht voor ‘zelf-gerapporteerde kwaliteit van leven’ op zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de effecten van cognitieve interventies op subjectief cognitief functioneren en kwaliteit van leven bij patiënten met MS?
P: patiënten met MS-gerelateerde cognitieve functiestoornissen;
I: cognitieve interventie;
C: geen interventie, wachtlijst controlegroep, placebo interventie (aspecifieke interventie);
O: zelf-gerapporteerd cognitief functioneren en/of zelf-gerapporteerde kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte zelf-gerapporteerd cognitief functioneren een voor de besluitvorming cruciale uitkomstmaat en zelf-gerapporteerde kwaliteit van leven een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde zelf-gerapporteerd cognitief functioneren als informatie over het cognitief functioneren verzameld met zelf-rapportage vragenlijsten. De werkgroep definieerde zelf-gerapporteerde kwaliteit van leven als informatie over kwaliteit van leven verzameld met zelf-rapportage vragenlijsten.
De werkgroep definieerde voor standardized mean differences (SMD) 0,5 als een klinisch (patiënt) relevant verschil. Voor overige continue uitkomstmaten werd een verschil van 0,5 SD aangehouden als grens.
Zoeken en selecteren (Methode)
In de databases (Medline (via OVID) en Embase (via Embase.com)) is op 7 november 2019 met relevante zoektermen gezocht naar systematische reviews en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 59 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
1) studie design (quasi-) RCT, 2) minimaal 10 patiënten in elke studie arm, 3) studiepopulatie met een geobjectiveerde cognitieve stoornis op basis van neuropsychologisch testonderzoek, 4) zelf-gerapporteerde scores voor cognitief functioneren en/of kwaliteit van leven gerapporteerd voor aanvang en na afloop van de interventie.
Op basis van titel en abstract werden in eerste instantie 59 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden in totaal 36 studies definitief geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording). Er werd 1 extra studie geïdentificeerd op basis van de referentielijst. Uiteindelijk werden 14 studies definitief geïncludeerd in deze systematische literatuuranalyse.
Resultaten
Veertien onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten van de studie zijn opgenomen in Tabel 1. De resultaten van de geïncludeerde studies op de uitkomstmaat zelf-gerapporteerd cognitief functioneren en kwaliteit van leven zijn opgenomen in de evidence tabel (Tabel 1). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Amato, M. P., Goretti, B., Viterbo, R. G., Portaccio, E., Niccolai, C., Hakiki, B., Iaffaldano, P., & Trojano, M. (2014). Computer-assisted rehabilitation of attention in patients with multiple sclerosis: results of a randomized, double-blind trial. Multiple sclerosis (Houndmills, Basingstoke, England), 20(1), 91–98. https://doi.org/10.1177/1352458513501571.
- Baars-Elsinga, A., Geusgens, C., van Heugten, C. M., & Visser-Meily, A. (2013). Niet rennen maar plannen, een poliklinisch cognitief behandelprogramma. Ned Tijdschrift voor Revalidatiegeneeskunde, (1), 29-30.
- Benedict, R. H., Amato, M. P., DeLuca, J., & Geurts, J. J. (2020). Cognitive impairment in multiple sclerosis: clinical management, MRI, and therapeutic avenues. The Lancet Neurology, 19(10), 860-871.
- Benedict, R. H., J. DeLuca, G. Phillips, N. LaRocca, L. D. Hudson, R. Rudick, and Consortium Multiple Sclerosis Outcome Assessments. (2017). 'Validity of the Symbol Digit Modalities Test as a cognition performance outcome measure for multiple sclerosis', Mult Scler, 23: 721-33.
- Campbell, J., Langdon, D., Cercignani, M., & Rashid, W. (2016). A RandomisedControlled Trial of Efficacy of Cognitive Rehabilitation in Multiple Sclerosis: A Cognitive, Behavioural, and MRI Study. Neural plasticity, 2016, 4292585. https://doi.org/10.1155/2016/4292585
- Cerasa A, Gioia M.C., Valentino P, Nisticò R, Chiriaco C, Pirritano D, Tomaiuolo F, Mangone G, Trotta M, Talarico T, Bilotti G, Quattrone A. (2013). Computer-assisted cognitive rehabilitation of attention deficits for multiple sclerosis: a randomized trial with fMRI correlates. Neurorehabil Neural Repair. 27(4):284-95. doi: 10.1177/1545968312465194.
- Chiaravalloti, N. D., Moore, N. B., Nikelshpur, O. M., & DeLuca, J. (2013). An RCT to treat learning impairment in multiple sclerosis: The MEMREHAB trial. Neurology, 81(24): 2066–2072. https://doi.org/10.1212/01.wnl.0000437295.97946.a8
- Chiaravalloti, N. D., Moore, N. B., & DeLuca, J. (2020). The efficacy of the modified Story Memory Technique in progressive MS. Multiple sclerosis (Houndmills, Basingstoke, England), 26(3): 354–362. https://doi.org/10.1177/1352458519826463
- Cotter, J., N. Muhlert, A. Talwar and K. Granger (2018). "Examining the effectiveness of acetylcholinesterase inhibitors and stimulant-based medications for cognitive dysfunction in multiple sclerosis: A systematic review and meta-analysis." Neurosci Biobehav Rev 86: 99-107.
- De Giglio, L., De Luca, F., Prosperini, L., Borriello, G., Bianchi, V., Pantano, P., & Pozzilli, C. (2015). A low-cost cognitive rehabilitation with a commercial video game improves sustained attention and executive functions in multiple sclerosis: a pilot study. Neurorehabilitation and neural repair, 29(5): 453–461. https://doi.org/10.1177/1545968314554623
- De Meo, E., Portaccio, E., Giorgio, A., Ruano, L., Goretti, B., Niccolai, C., ... & Amato, M. P. (2020). Identifying the Distinct Cognitive Phenotypes in Multiple Sclerosis. JAMA neurology.
- Finlayson, M., K. Preissner, and C. Cho. (2012) 'Outcome moderators of a fatigue management program for people with multiple sclerosis', Am J Occup Ther, 66: 187-97.
- Fuchs, T. A., S. Ziccardi, M. G. Dwyer, L. E. Charvet, A. Bartnik, R. Campbell, J. Escobar, D. Hojnacki, C. Kolb, D. Oship, J. Pol, M. T. Shaw, C. Wojcik, F. Yasin, B. Weinstock-Guttman, R. Zivadinov, and R. H. B. Benedict. (2019) 'Response heterogeneity to home-based restorative cognitive rehabilitation in multiple sclerosis: An exploratory study', Mult Scler Relat Disord, 34: 103-11.
- Fuchs, Tom A., Stefano Ziccardi, Ralph H. B. Benedict, Alexander Bartnik, Amy Kuceyeski, Leigh E. Charvet, Devon Oship, Bianca Weinstock-Guttman, Curtis Wojcik, David Hojnacki, Channa Kolb, Jose Escobar, Rebecca Campbell, Hoan Duc Tran, Niels Bergsland, Dejan Jakimovski, Robert Zivadinov, and Michael G. Dwyer. (2020b) 'Functional Connectivity and Structural Disruption in the Default-Mode Network Predicts Cognitive Rehabilitation Outcomes in Multiple Sclerosis', Journal of Neuroimaging, n/a.
- Gich, J., Freixanet, J., García, R., Vilanova, J. C., Genís, D., Silva, Y., Montalban, X., & Ramió-Torrentà, L. (2015). A randomized, controlled, single-blind, 6-month pilot study to evaluate the efficacy of MS-Line!: a cognitive rehabilitation programme for patients with multiple sclerosis. Multiple sclerosis (Houndmills, Basingstoke, England), 21(10): 1332–1343. https://doi.org/10.1177/1352458515572405
- Goverover, Y., Chiaravalloti, N., Genova, H., & DeLuca, J. (2018). A randomized controlled trial to treat impaired learning and memory in multiple sclerosis: The self-GEN trial. Multiple sclerosis (Houndmills, Basingstoke, England), 24(8): 1096–1104. https://doi.org/10.1177/1352458517709955
- Goverover Y, Chiaravalloti N.D., O'Brien A.R., DeLuca J. (2018). Evidenced-Based Cognitive Rehabilitation for Persons With Multiple Sclerosis: An Updated Review of the Literature From 2007 to 2016. Arch Phys Med Rehabil. 99(2):390-407. doi: 10.1016/j.apmr.2017.07.021.
- Grasso, M. G., Broccoli, M., Casillo, P., Catani, S., Pace, L., Pompa, A., Rizzi, F., & Troisi, E. (2017). Evaluation of the Impact of Cognitive Training on Quality of Life in Patients with Multiple Sclerosis. European neurology, 78(1-2): 111–117. https://doi.org/10.1159/000478726
- van der Hiele, K., E. L. J. Hoogervorst, and H. E. Hulst. (2019) '(The invisible burden of cognitive problems in patients with multiple sclerosis)', Ned Tijdschr Geneeskd, 163.
- Kalb, R., M. Beier, R. H. Benedict, L. Charvet, K. Costello, A. Feinstein, J. Gingold, Y. Goverover, J. Halper, C. Harris, L. Kostich, L. Krupp, E. Lathi, N. LaRocca, B. Thrower, and J. DeLuca. (2018). 'Recommendations for cognitive screening and management in multiple sclerosis care', Mult Scler, 24: 1665-80.
- Kalincik, T., Manouchehrinia, A., Sobisek, L., Jokubaitis, V., Spelman, T., Horakova, D., ... & Butzkueven, H. (2017). Towards personalized therapy for multiple sclerosis: prediction of individual treatment response. Brain, 140(9), 2426-2443.
- Langdon, D. W., M. P. Amato, J. Boringa, B. Brochet, F. Foley, S. Fredrikson, P. Hamalainen, H. P. Hartung, L. Krupp, I. K. Penner, A. T. Reder, and R. H. Benedict. (2012) 'Recommendations for a Brief International Cognitive Assessment for Multiple Sclerosis (BICAMS)', Mult Scler, 18: 891-8.
- Lincoln NB, Bradshaw LE, Constantinescu CS, Day F, Drummond AER, Fitzsimmons D, Harris S, Montgomery AA, das Nair R, on behalf of the CRAMMS Trial Collaborative Group. (2020). Cognitive rehabilitation for attention and memory in people with multiple sclerosis: a randomized controlled trial (CRAMMS). Clinical Rehabilitation. Vol 34(2): 229-241. https://doi.org/10.1177/0269215519890378
- Maitra, K., C. Hall, T. Kalish, M. Anderson, E. Dugan, J. Rehak, V. Rodriguez, J. Tamas, and D. Zeitlin. (2010) 'Five-year retrospective study of inpatient occupational therapy outcomes for patients with multiple sclerosis', Am J Occup Ther, 64: 689-94.
- Mattioli, F., Stampatori, C., Scarpazza, C., Parrinello, G., & Capra, R. (2012). Persistence of the effects of attention and executive functions intensive rehabilitation in relapsing remitting multiple sclerosis. Multiple Sclerosis and Related Disorders, 1(4): 168–173. https://doi.org/10.1016/j.msard.2012.06.004
- Mattioli, F., Stampatori, C., Bellomi, F., Danni, M., Compagnucci, L., Uccelli, A., Pardini, M., Santuccio, G., Fregonese, G., Pattini, M., Allegri, B., Clerici, R., Lattuada, A., Montomoli, C., Corso, B., & Capra, R. (2015). A RCT Comparing Specific Intensive Cognitive Training to Aspecific Psychological Intervention in RRMS: The SMICT Study. Frontiers in neurology, 5: 278. https://doi.org/10.3389/fneur.2014.00278
- Mendoza, R. J., and D. J. Pittenger. (2003) 'Mental health services for patients with multiple sclerosis residing in long-term skilled nursing facilities: problems and recommendations', Adm Policy Ment Health, 31: 171-80.
- Mousavi S, Zare H, Etemadifar M. Evaluating the effectiveness of cognitive rehabilitation on everyday memory in multiple sclerosis patients (2020) Neuropsychol Rehabil. 30(6):1013-1023. doi:10.1080/09602011.2018.1536608 (Epub 2018)
- Pérez-Martín, M. Y., González-Platas, M., Eguía-Del Río, P., Croissier-Elías, C., & Jiménez Sosa, A. (2017). Efficacy of a short cognitive training program in patients with multiple sclerosis. Neuropsychiatric disease and treatment, 13: 245–252. https://doi.org/10.2147/NDT.S124448
- Prouskas, S.E., Steenwijk M.D., Gehring K. , Huiskamp, M., de Jong, B.A., Geurts, J.J.G., Sitskoorn, M.M., Schoonheim, M.M., Hulst, H.E. (2019) 'Different network functional connectivity characteristics of responders and non-responders to attention training in MS', IMSCOGS 2019, platform presentation.
- Rosti-Otajärvi, E., Mäntynen, A., Koivisto, K., Huhtala, H., & Hämäläinen, P. (2013). Neuropsychological rehabilitation has beneficial effects on perceived cognitive deficits in multiple sclerosis during nine-month follow-up. Journal of the neurological sciences, 334(1-2): 154–160. https://doi.org/10.1016/j.jns.2013.08.017
- Van Schependom J , D'hooghe M.B , De Schepper M, Cleynhens K, D'hooge M, Haelewyck M, De Keyser J, Nagels G. (2014). Relative contribution of cognitive and physical disability components to quality of life in MS. J Neurol Sci. 15;336(1-2):116-21. doi: 10.1016/j.jns.2013.10.020.
- Shevil, E., and M. Finlayson. 2010. 'Pilot study of a cognitive intervention program for persons with multiple sclerosis', Health Educ Res, 25: 41-53.
- Solari, A., Motta, A., Mendozzi, L., Pucci, E., Forni, M., Mancardi, G., Pozzilli, C., & CRIMS Trial (2004). Computer-aided retraining of memory and attention in people with multiple sclerosis: a randomized, double-blind controlled trial. Journal of the neurological sciences, 222(1-2): 99–104. https://doi.org/10.1016/j.jns.2004.04.027
Evidence tabellen
Evidence table for intervention studies
Note: Zes studies hebben meerdere follow-up metingen, in deze gevallen is altijd de laatste follow-up meting in de analyse meegenomen
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Amato, 2014 |
Computer-generated list
“Randomization was performed at the Florence center by an independent researcher on the basis of a computerized list of random numbers” |
Likely
List implies that allocation was not concealed upon randomization |
Unclear
Not described; trial is named ‘double-blinded’ |
Likely
“an independent psychologist, who was not blind to the study, was responsible for setting up the ST and n-ST programs, explaining the training procedure and supervising the training program” |
Unlikely
“psychologist, blind to the study, was responsible for administering and evaluating the neuropsychological tests” |
Unlikely
Relevant outcomes reported. No trial register reported. |
Likely
8/63 and 6/39 drop-outs; reasons except exacerbation (n=3) not described for n=11. |
Likely
No ITT analysis performed; 8+6 lost to follow-up; participants not included in analyses |
|
Campbell, 2016 |
Computerized
“Randomisation was performed using a random number generator and allocations were placed inside sealed folders.” |
Unlikely
Adequate concealment;
|
Unclear
Not described |
Unlikely
Computerized training at home |
Likely
Assessor not blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. Trial register reported. |
Likely
2/19 and 5/19 drop-outs; reasons not described. |
Likely
No ITT analysis performed; 2+5 lost to follow-up; participants not included in analyses |
|
Chiaravalloti, 2013 |
Computerized
“Using a computerized random number generator, a total of 200 participants were randomized to the treatment or placebo control group before beginning data collection.” |
Unlikely
Adequate concealment; “Treatment allocation was concealed.” |
Unlikely
Participants blinded |
Unlikely
The treatment was administered by an RA who was blinded to assessment results and unaware of the study hypotheses. |
Unlikely
Assessors blinded, however, only self-report outcomes included in this analysis |
Unlikely
Important measures are described. ‘Subjective report of overall functioning’ is mentioned in the Method section, but not in Results section |
Unlikely
Numbers and reasons for discontinuation plausible and comparable between groups |
Likely
No ITT analysis performed: 1+3 lost to follow-up; participants not included in analyses |
|
Chiaravalloti, 2019 |
Computerized
“Using a computerized random number generator, 48 randomized assignments to TX or CTL were created before data collection.” |
Unlikely
“Treatment allocation was concealed.“ |
Unlikely
Participants blinded |
Likely
No blinding of provider of intervention
|
Unlikely
Assessors blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. Trial registered. |
Unlikely
Numbers and reasons for discontinuation plausible and comparable between groups |
Likely
No ITT analysis performed; 3 patients in both groups lost to follow up |
|
De Giglio, 2015 |
Computerized
“The randomization procedure was performed using computer-generated random numbers by an operator (LP) who was not involved in study measurements.” |
Unlikely
Adequate concealment |
Likely
Participants not blinded; self-report outcomes |
Unlikely
Computerized training at home |
Unlikely
Assessors blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported. |
Unlikely
|
Likely
No ITT analysis performed; 1 patient moved to other centre and was excluded from analysis |
|
Gich, 2015 |
Not specified
“Participants were randomly assigned to one of the two arms in a 1:1 ratio. The randomization was stratified to avoid possible confounding variables, using the level of cognitive impairment as strata.“ |
Unclear
Not specified |
Likely
Participants not blinded; self-report outcomes |
Likely
No blinding of provider of intervention
|
Unlikely
Assessors blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported. |
Unlikely
Numbers and reasons for discontinuation plausible and comparable between groups |
Likely
No ITT analysis performed; 1 patient in each group discontinued study and was excluded from analysis |
|
Goverover, 2018 |
Random number table
“Participants then completed baseline testing after which, using a randomized number table, participants were randomized to either the treatment or control group. Note that the individual responsible for group assignment was not involved in data collection.“ |
Unclear
Concealment not specified |
Unlikely
Participants blinded |
Likely
No blinding of provider of intervention
|
Unlikely
Assessor not blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. Trial registered. |
Unlikely
No loss to follow-up |
Unlikely
ITT not mentioned specifically, but all randomized participants included in analysis in group of randomization |
|
Grasso, 2017 |
Computerized
“were randomly allocated (according to 2 blocked randomization lists, generated electronically by www.random.org)” |
Unclear
Concealment not specified |
Unclear
Not described |
Unlikely
sessions were performed by 2 blinded trained psychologists |
Unlikely
Assessors blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported. |
Unlikely
1 participant of intervention group dropped out at late FU; reason not described |
Unclear
N=1 loss to follow-up reported; not clear whether participants was included in analysis |
|
Mattioli, 2012 = Mattioli 2010 FU + 3 extra subjects |
Alternation assignment
“were alternatively assigned by a neurologist to either a study group (SG) or a control group (CG)” |
Likely
Inadequate concealment |
Likely
Participants not blinded; self-report outcomes |
Unclear
No blinding of provider of intervention; computer-assisted program |
Unlikely
Assessor blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported |
Unclear
Loss to follow-up not reported |
Unclear
Loss to follow-up not reported and ITT not specified |
|
Mattioli, 2015 |
Computer-generated list
“Randomization (according to a computer-generated list of random number).” |
Unclear
Concealment not specified |
Likely
Participants not blinded; self-report outcomes |
Unclear
Not described |
Unlikely
Not described |
Unlikely
Relevant outcomes reported. Trial registered. |
Unlikely
No loss to follow-up |
Unlikely
ITT not mentioned specifically, but all randomized participants included in analysis in group of randomization |
|
Mousavi, 2018 Npsy Rehab. |
Computerized
“Participants were randomly assigned to three groups namely, experimental (n = 20), placebo (n = 20) and control (n = 20) with the help of random allocation software.” |
Unclear
Concealment not described |
Unlikely
Participants blinded |
Likely
No blinding of provider of intervention
|
Likely
Assessor not blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported |
Unclear
Loss to follow-up not reported |
Unclear
Loss to follow-up not reported and ITT not specified |
|
Perez-Martin, 2017 |
Unclear
“were randomly assigned to either the intervention group or the CG.” |
Unclear
Concealment not described |
Likely
Participants not blinded; self-report outcomes |
Unclear
Not described; computer-assisted program |
Unlikely
Assessor blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported |
Unclear
Loss to follow-up not reported |
Unclear
Loss to follow-up not reported and ITT not specified |
|
Rosti-Otajarvi, 2013
=FU of Mäntynen, 2014
|
Computerized
“… using a computer-generated random number table and stratified randomisation according to …… by an independent statistician with no information about the patients and no influence on the decision about the eligibility of the patients.” |
Unlikely
Adequate concealment |
Likely
Participants not blinded; self-report outcomes |
Likely
No blinding of provider of intervention
|
Unlikely
“The allocation sequence was concealed from the assessing neuropsychologist.” |
Unlikely
Relevant outcomes reported. No trial register reported. |
Unlikely
Reasons for discontinuation described; rate of drop-out somewhat higher in control group |
Likely
No ITT analysis; participants lost to follow up not included in analysis |
|
Solari, 2004 |
Computerized
“by an independent randomization unit, using a computer-generated, site-stratified, randomization schedule” |
Unlikely
At randomization, the clinician contacted the randomization unit for randomization information of specific participant |
Unlikely
Sham intervention described |
Unclear
No blinding of assisting psychologist; computer-assisted program |
Unlikely
Assessor blinded, however, only self-report outcomes included in this analysis |
Unlikely
Relevant outcomes reported. No trial register reported. |
Unlikely
Numbers and reasons for discontinuation comparable between groups |
Likely
No ITT analysis; participants lost to follow up not included in analysis |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Bove, 2018 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Carr, 2014 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Cerasa, 2013 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Charvet, 2017 |
Niet voldoende participanten per arm |
|
Chiaravalloti, 2018 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Das Nair, 2012 |
Participanten zijn mensen met hersenbloeding en TBI als MS; geen aparte rapportage voor patiënten met MS |
|
Das Nair, 2016 |
Review met niet alle benodigde info |
|
Dardiotis, 2018 |
Sluit niet aan bij PICO: objectief cognitief functioneren als uitkomstmaat |
|
De Luca, 2019 |
Sluit niet aan bij PICO: controle conditie is actieve interventie |
|
Dobryokova,2014 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Ernst, 2015 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Ernst 2018 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Filippi, 2012 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Goodwin, 2017 |
Review met niet alle benodigde info |
|
Goverover, 2018 |
Individuele studies geïncludeerd |
|
Gromisch, 2018 |
Review met niet alle benodigde info |
|
Hanssen, 2016 |
Sluit niet aan bij PICO: patiënten geen objectieve cognitieve stoornis |
|
Janssen, 2015 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Lampit, 2019 |
Individuele studies geïncludeerd |
|
Leavitt, 2012 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Mani, 2018 |
Sluit niet aan bij PICO: niet duidelijk of patiënten cognitieve stoornis hadden |
|
Mantynen, 2014 |
Follow-up studie geïncludeerd |
|
Mattioli, 2010 |
Follow-up studie geïncludeerd |
|
Mattioli, 2014 |
Sluit niet aan bij PICO: objectief cognitief functioneren als uitkomstmaat |
|
McKeever, 2019 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Messinis, 2017 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Mitolo, 2015 |
Review met niet alle benodigde info |
|
Moore, 2008 |
Sluit niet aan bij PICO: controle conditie is actieve interventie |
|
Mousavi, 2018 |
Sluit niet aan bij PICO: objectief cognitief functioneren als uitkomstmaat |
|
Pedulla, 2016 |
Sluit niet aan bij PICO: geen zelf-gerapporteerde uitkomstmaten |
|
Pusswald, 2014 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Rilo, 2018 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Rosti-Otajarvi, 2014 |
Review met niet alle benodigde info |
|
Sharifi, 2019 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Stuifbergen, 2012 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
|
Stuifbergen, 2018 |
Sluit niet aan bij PICO: patiënten niet geselecteerd op cognitieve stoornis |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Multiple Sclerose (MS).
Werkgroep
- Prof. dr. V. de Groot, revalidatiearts, Amsterdam UMC, locatie VUmc, Amsterdam, VRA (voorzitter)
- Dr. J. van Meeteren, revalidatiearts, Rijndam, locatie Erasmus MC, Rotterdam, VRA (voorzitter)
- Dr. A.C. van Voskuilen, revalidatiearts, Klimmendaal Revalidatiespecialisten, Arnhem, VRA
- Dr. N.F. Kalkers, neuroloog, OLVG, Amsterdam en Amsterdam UMC, locatie VUmc, Amsterdam, NVN
- Drs. C. van Gelder, specialist ouderengeneeskunde, GGzE, Eindhoven, Verenso
- Prof. dr. F.G. Schaafsma, bedrijfsarts, bijzonder hoogleraar arbeid en bedrijfsgeneeskunde Amsterdam UMC, Afdeling Public & Occupational Health, NVAB
- R. Standhardt-Keilman, ergotherapeut, Nieuw Unicum, Zandvoort, EN (tot oktober 2019)
- Dr. I.C.J.M. Eijssen, ergotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, EN (vanaf november 2019)
- Dr. M.B. Rietberg, fysiotherapeut, Amsterdam UMC, locatie VUmc, Amsterdam, KNGF
- Dr. R. Kemps, GZ-psycholoog, Prinses Máxima Centrum voor Kinderoncologie, Utrecht, NIP (tot mei 2020 werkgroeplid, vanaf juni 2020 lid klankbordgroep)
- Drs. M.G.E. Huijsmans, GZ-psycholoog, OLVG, Amsterdam en Reade, NIP (vanaf juni 2020)
- K. Harrison, verpleegkundig specialist neurologie, Ter Gooi, locatie Blaricum, V&VN
- J.E. Schoonen-Ouwehand, revalidatie maatschappelijk werker, Basalt Revalidatie, Den Haag, BPSW (tot maart 2020)
- Dhr. R.G. Hoogakker, medisch maatschappelijk werker en aandachtsfunctionaris huiselijk geweld, Amsterdam UMC, locatie VUmc, Amsterdam, BPSW (vanaf maart 2020)
- Drs. L.S. Ruhaak, logopedist, logopediewetenschapper en onderzoeker in opleiding, Amsterdam UMC, locatie VUmc, Amsterdam, (en tot juli 2020 Nieuw Unicum, Zandvoort), NVLF
- E. Kruijver, seksuoloog, PsyQ, Utrecht en De Hoogstraat, Revalidatie, Utrecht, NVVS
- C.E. Helfrich-Smallegange, diëtist, Siza, Arnhem, NVD
- F. Kingma, patiëntvertegenwoordiger, MS Vereniging Nederland
Met ondersteuning van
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S. Van Dijk, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot januari 2019)
- Dr. G. Peeters, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf januari 2019 tot november 2019)
- Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf november 2019)
- Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
- Dr. Mevr. R. Zwarts - van de Putte, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf augustus, 2020)
Met dank aan
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- M. van der Maten MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groot (voorzitter) |
Hoofd afdeling revalidatiegeneeskunde Amsterdam UMC. |
President Rehabilitation in MS (RIMS; onbetaald, tot en met juni 2019). |
Diverse onderzoeksprojecten op het gebied van MS bij MS research en ZonMW. Door eigen wetenschappelijk onderzoek bijgedragen aan kennisvermeerdering.
De activiteiten van RIMS worden gesponsord door Biogen, Roche and Medday. Deze bedrijven produceren ziektemodulerende behandelingen voor MS. Biogen heeft ook symptomatische behandeling voor loopproblemen. |
Geen actie nodig. Ziektemodulerende behandelingen vormen verder geen onderdeel van de richtlijn. |
|
Meeteren (voorzitter) |
Revalidatiearts, Rijndam, locatie Erasmus MC |
Geen |
Geen |
Geen actie nodig |
|
Eijssen (vanaf 11-2019) |
Ergotherapeut, onderzoeker VU medisch centrum |
Lid Ergotherapie Nederland (onbetaald)
Commissielid Adviesraad Onderzoek en Wetenschap - Ergotherapie Nederland (onbetaald)
Lid Rehabilitation in Multiple sclerosis (RIMS) - European Network for best Practice and Research in MS (onbetaald)
Commissielid Wetenschappelijk raad van de RIMS - Special Interest Group Occupation (SIG-Occupation) (onbetaald)
Commissielid MS netwerk Groot Amsterdam (onbetaald) |
In het verleden deelgenomen aan onderzoeksprojecten die gefinancierd werden door ZONmw (>3 jaar geleden) en MS research (afgerond 30-09-2019). Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Harrison |
Verpleegkundig Specialist Neurologie bij Tergooi ziekenhuizen locatie Blaricum |
Werkgroeplid MS richtlijn behandeling (onkostenvergoeding).
MS registratie commissie / wetenschap commissie (onkostenvergoeding).
Bestuurslid Landelijke Vereniging MS verpleegkundigen (onkostenvergoeding). |
Geen |
Geen actie nodig |
|
Helfrich |
SIZA, Arnhem; diëtist: 20 uur per week
Tot 1 mei 2020: Diëtistenpraktijk Corine Helfrich, Maurik: eigen 1e lijnspraktijk: 20 uur per week |
Bestuurslid MDL-netwerk NVD (onbetaald) |
Geen |
Geen actie nodig |
|
Hoogakker (vanaf 01-03-2020) |
Medisch maatschappelijk werker polikliniek Revalidatie, Amsterdam UMC, locatie De Boelelaan. 20 uur per week
Aandachtfunctionaris huiselijk geweld, Amsterdam UMC, locatie De Boelelaan, 16 uur per week |
Voorzitter GZ maatschappelijk werk BPSW (onbetaald) |
Geen |
Geen actie nodig |
|
Huijsmans (vanaf -01-06-2020) |
GZ-psycholoog OLVG en Reade |
Lid CognetMS Docent Rino (betaald): onderwijs aan zorgprofessionals vakgebied neuropsychologie |
Geen |
Geen actie nodig |
|
Kemps (tot 1-5-2020 werkgroeplid, daarna lid klankbordgroep) |
Tot 01-05-2020 GZ-psycholoog, Rijndam Revalidatie, locatie Erasmus MC
Vanaf 01-05-2020 Psycholoog, Prinses Máxima Centrum voor Kinderoncologie |
Docent voor AXON leertrajecten Werkzaamheden (betaald): onderwijs en voorlichting aan zorgprofessionals met betrekking tot de begeleiding van patiënten met niet-aangeboren hersenletsel |
Geen |
Geen actie nodig |
|
Kalkers |
Neuroloog OLVG, 0,7 fte, neuroloog VUmc 0,1 fte |
Secretaris bestuur Nederlandse Vereniging voor Neurologie 0,1 fte (sinds 1-6-2019).
Voorzitter bestuur landelijke MS registratie: 2 vergaderingen per jaar (vacatiegelden) (tot 1-11-2020). |
Geen |
Geen actie nodig |
|
Kingma |
Geen |
Geen |
Geen |
Geen actie nodig |
|
Kruijver |
Seksuoloog NVVS voor Basalt Revalidatie (28 uur p/w tot 01-10-2020)
Seksuoloog NVVS voor PsyQ Utrecht (28 uur p/w vanaf 01-10-2020)
Seksuoloog NVVS voor De Hoogstraat Revalidatie (4 uur p/w) |
Nederlandse wetenschappelijke Vereniging voor Seksuologie: Coördinator NVVS werkgroep Richtlijnen (onbetaald)
Incidenteel gastdocent diverse opleidingen Amstel Academie en Antonius Academie (betaald per lesuur) |
Geen |
Geen actie nodig |
|
Rietberg |
Paramedisch manager (0,56) /Fysiotherapeut (0,33) /Onderzoeker (0,11) Amsterdam UMC, locatie VUmc |
Penningmeester EFOX: European Foundation for Health and Exercise, onbetaald. Voorzitter MS Netwerk Groot Amsterdam, (onbetaald).
Voorzitter F-UMC (fysiotherapie universitair medische centra) (onbetaald).
Consilium KNGF (vacatievergoeding). |
Geen |
Geen actie nodig |
|
Ruhaak |
Logopedist (0,4 fte) en Logopediewetenschapper (0,4 fte) bij Nieuw Unicum tot september 2020
Onderzoeker in opleiding bij Amsterdam UMC, locatie VUMC (Niet in loondienst contract)
|
Voorzitter SIG Communication & Swallowing van Rehabilitation In Multiple Sclerosis (RIMS) (onbetaald): - organiseren van meetings 2 keer per jaar - communicatie met bestuur - communicatie met SIG leden |
Werkt aan onderzoek wat qua onderwerp overeenkomt met enkele richtlijnmodules (bijv. dysartrie). Echter zijn er op dit moment nog geen publicaties verschenen over deze onderzoeken. Het onderzoek wordt gefinancierd door MS research en RIMS, waarbij RIMS geen invloed op het verloop of uitkomsten van de studie.
Heeft onlangs een narratieve review artikel ingediend over communicatie en slikken bij MS (niet gefinancierd). |
Geen actie nodig |
|
Schaafsma |
Bedrijfsarts, senior onderzoeker Amsterdam UMC, 0,8 fte
Bijzonder hoogleraar, NVAB, 0,2 fte |
Commissielid Raad van Toezicht bij Vitaalpunt (betaald).
Plaatsvervangend commissielid Commissie Klachtenafhandeling Aanstellingskeuringen bij SER (vacatiegelden).
Commissielid Commissie Richtlijnontwikkeling en wetenschap voor de NVAB (onbetaald).
Commissielid Burger- Zielhuispenning voor de NVAB (onbetaald). |
Geen. Betrokken bij diverse onderzoeksprojecten die gefinancierd worden door ZONmw, Instituut GAK of UWV. Er zijn geen belangen voor de adviezen van de richtlijn. |
Geen actie nodig |
|
Schoonen-Ouwehand (werkgroeplid tot maart 2020) |
Basalt Revalidatie, maatschappelijk werker |
BPSW voorzitter functiegroep gezondheidszorg maatschappelijk werk; aansturen van leden binnen de functiegroep, vallende onder de beroepsvereniging in kader van afstemming en uitzetten beleid. Functiegroepleden uit verpleeghuizen, ziekenhuizen en revalidatie. Vrijwillig |
Geen |
Geen actie nodig |
|
Standhardt-Keilman (werkgroeplid tot oktober 2019) |
Ergotherapeut bij Stichting Nieuw-Unicum |
Geen |
Geen |
Geen actie nodig |
|
Van Gelder |
Specialist oudergeneeskunde Vitalis woonzorggroep tot 1-1-2021, vanaf 1-3-2021 bij GGzE Eindhoven Beoordelingen wilsbekwaamheid voor notarissen en rechtbank Bestuurslid MS zorg Nederland |
"Lid medische adviesraad restless legs stichting onbetaald Maker filmdocumentaire euthanasie en psychiatrische ziekte, euthanasie en dementie onbetaald." |
Geen |
Geen actie nodig |
|
Van Voskuilen |
Revalidatiearts bij Klimmendaal Revalidatiespecialisten. |
Geen |
In 2012 gepromoveerd op Sacrale Neuromodulatie bij lagere urineweg symptomen |
Geen actie nodig |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Tot oktober 2018 Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018-september 2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie nodig |
|
Peeters (tot 11-2019) |
Senior adviseur/teamleider Kennisinstituut van de Federatie Medisch Specialisten |
Senior Atlantic Fellow for Equity in Brain Health, Global Brain Health Institute, Trinity College Dublin (onderzoeker; onbetaald).
Verzorgen van onderwijs voor de epidemiologische onderwerpen in het curriculum voor de eerstejaars fellows in het programma van de Global Brain Health Institute. |
Functie bij het Global Brain Health Institute: Er zijn soms financiële voordelen in de vorm van vergoeding van registratie en reiskosten voor congresbezoek. De lopende onderzoeksprojecten hebben geen connectie met MS.
|
Geen actie nodig. |
|
Maas (vanaf 11-2019) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1-1-2014 tot en met 31-8-2019; Dienstverband Nederlandse Hart Registratie 1-9-2018 tot en met 31-7-2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie nodig. |
|
Zwarts – van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Afronding promotieonderzoek ‘Etiology of the VACTERL association: genetic and non-genetic risk factors’, Radboudumc (onbetaald). |
Geen, promotieonderzoek werd gefinancierd uit een persoonlijke beurs ontvangen vanuit het Radboudumc. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van MS Vereniging Nederland, MS Research en het Nationaal MS Fonds voor de Invitational conference en de afvaardiging van de patiëntenvereniging MS Vereniging Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan MS Vereniging Nederland, MS Research, Nationaal MS Fonds en Patiëntenfederatie Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patienten met MS. Tevens zijn er knelpunten aangedragen door de VRA, IGJ, VIG, ZiNL, MS Research, Nationaal MS Fonds, Nieuw Unicum, NVLF, NVD, MS Zorg Nederland, MS Vereniging Nederland, NVU, NOG, KNGF, EN, NVAB en Archipel tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Hiernaast beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012) op noodzaak tot revisie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Nederlandse Vereniging voor Neurologie (NVN). Richtlijn Multiple sclerose. Utrecht, 2012.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
