Regieondersteuning voor patiënten bij multimorbiditeit en regie in het ziekenhuis
Uitgangsvraag
Welke patiënten met multimorbiditeit in het ziekenhuis zijn gebaat bij regieondersteuning?
Aanbeveling
Overweeg regieondersteuning aan te bieden bij patiënten met (een combinatie van):
Medische complexiteit door:
- een hoger aantal chronische ziektes (en/of veel betrokken medisch specialisten en/of
- polyfarmacie en/of zorg door verschillende ziekenhuizen);
- discordante multimorbiditeit;
- hoge zorgconsumptie;
EN
Complexiteit van de patiënt door overige patiëntgebonden factoren zoals:
- lagere gezondheidsvaardigheden
- hogere leeftijd
- functionele beperkingen
- kwetsbaarheid
- afwezig steunsysteem
- cognitieve stoornissen
Hoe meer risicofactoren, hoe sterker de behoefte aan regieondersteuning zou kunnen zijn.
Overwegingen
Er zijn aanwijzingen dat het hebben van een (hoger) aantal chronische ziektes onafhankelijk geassocieerd is met veel zorgverbruik zoals ziekenhuisopname, spoedeisende hulp bezoeken, doktersafspraken en zorgkosten. Enkele geïncludeerde studies onderzochten ook de relatie tussen specifieke ziekteclusters en zorgverbruik (Abernathy, 2016; Kennedy, 2017; Teh 2018) en vonden daarbij hogere odds en rate ratios voor hoog zorgverbruik bij specifieke ziekteclusters. De kwaliteit van deze studies geeft echter onvoldoende bewijskracht om zeker te kunnen zijn van een onafhankelijke associatie. Ook voor verschillende andere patiënt-, socio-economische en zorgkarakteristieken werden (iets) hogere odds en risk ratios gezien op hoog zorgverbruik, maar is ook hierbij de kwaliteit van deze studies vaak onvoldoende om vast te kunnen stellen dat iedere factor onafhankelijk geassocieerd is met hoog zorgverbruik.
Binnen de gekozen zoek- en selectiestrategie werden alleen studies geïncludeerd die niet vanuit één specifieke ziekte de geassocieerde factoren voor hoog zorgverbruik onderzochten. Omdat veel medisch wetenschappelijk onderzoek vaak één ziekte of één probleem (hoge zorgkosten, veel gebruik) onderzoekt, vermoedt de werkgroep dat veel studies niet geïncludeerd zijn door de huidige zoek- en selectiestrategie. Zo zijn bijvoorbeeld de individuele studies van de review van Wammes (2018) niet gevonden. De werkgroep is zich ervan bewust dat er waarschijnlijk nog veel extra informatie over onafhankelijk geassocieerde factoren voor hoog zorgverbruik, zoals ziekenhuisopnames, spoedeisende hulpbezoeken, doktersbezoeken en zorgkosten, te vinden is in de studies die vanuit één ziekte of probleem onderzoeken.
Er werden geen artikelen gevonden die patiënttevredenheid als uitkomstmaat hadden gedefinieerd. Bovendien had de werkgroep ook verwacht om patiëntkarakteristieken zoals gezondheidsstatus, gezondheidsvaardigheden, kwaliteit van leven en prognose maar ook andere zorgkarakteristieken zoals (eerder) zorgverbruik (aantal betrokken medisch specialisten, aantal eerdere spoedeisende hulpbezoeken en aantal eerdere ziekenhuisopnames) te identificeren. De zoekstrategie heeft hier mogelijk aan bijgedragen (deze was zeer breed opgezet, met alleen generieke zoektermen als “healthcare utilization” en “patiënt satisfaction”). Daarnaast zullen mogelijk ook de selectiecriteria een rol hebben gespeeld: alleen wanneer er in het algemeen naar een populatie of multimorbiditeit werd gekeken, werd deze studie meegenomen. Omdat veel wetenschappelijk onderzoek zich vaak ook hoofdzakelijk op één ziekte concentreert, vielen veel studies hierdoor buiten de scope van deze zoekvraag.
Hoog zorgverbruik kan gezien worden als basiskenmerk van patiënten met mutimorbiditeit, aangezien veel van deze patiënten routinematig meer zorgverleners zien. Hoog zorgverbruik door spoedeisende hulpbezoeken, ziekenhuisopnames, of veel doktersbezoeken wordt daarnaast waarschijnlijk beïnvloed door een complexe interactie van demografische, socio-economische, gedrags en fysieke factoren (Amerikaanse National Academies of Sciences, Engineering, and Medicine, 2018). De werkgroep koos hoog zorgverbruik als uitkomstmaat omdat zowel acuut zorgverbruik als meer doktersbezoeken een hoger risico op fragmentatie van zorg kunnen geven. Deze patiënten zouden mogelijk baat kunnen hebben bij regieondersteuning om zorg beter af te stemmen en coördineren en zo potentieel vermijdbare zorg(uitkomsten) te voorkomen.
De hypothese is dat ook andere patiënt-, socio-economische en zorgkarakteristieken bijdragen aan de behoefte aan ondersteuning bij regie. Niet iedere patiënt met multimorbiditeit heeft behoefte aan uitgebreide ondersteuning bij regie (wil daarin ook eigen regie/keuzes maken), terwijl er waarschijnlijk ook patiënten zijn met ‘slechts’ een paar chronische ziektes die toch regieondersteuning nodig hebben (zie ook bijlage 8. verslag Invitational Conference patiëntenorganisaties). De verwachting is dat in bepaalde specifieke populaties gemiddeld meer patiënten zijn die behoefte hebben aan regieondersteuning, afhankelijk van het aantal ziektes en de complexiteit van multimorbiditeit in combinatie met de complexiteit van de patiënten.
Complexiteit van multimorbiditeit
De waarschijnlijk onafhankelijke associatie van het aantal chronische ziektes met hoog zorgverbruik op al deze gebieden maakt dat starten met het identificeren van patiënten door middel van het aantal chronische ziektes een goede eerste stap zou kunnen zijn. Het aantal chronische ziektes van een patiënt is uit de voorgeschiedenis te halen. Een aantal studies onderzocht ook de associatie tussen specifieke clusters van meerdere ziektes en hoog zorgverbruik, maar de kwaliteit was onvoldoende om daar een uitspraak over te doen. Dit betreft dus een kennislacune en zou verder uitgezocht moeten worden door middel van wetenschappelijk onderzoek.
Er zijn reeds meerdere studies gedaan naar clusters van ziektes bij patiënten met multimorbiditeit (Prados-Torres, 2014), waarin verschillende patronen van meerdere chronische ziektes werden herkend. Deze clusters van ziektes die vaak samen vóórkomen worden ook wel concordante multimorbiditeit (of co-morbiditeiten) genoemd: de aanwezigheid van ziektes die (waarschijnlijk) gedeelde pathofysiologische mechanismen hebben. In de systematische review van Valderas (2019) over kwaliteit van zorg voor patiënten met multimorbiditeit werden studies beschreven die vonden dat de kwaliteit van zorg beter is voor concordante multimorbiditeit (die vaker baat hebben bij dezelfde klinische behandelingen, zoals hypertensie, ischemische hartziekte en diabetes) dan voor discordante multimorbiditeit (aandoeningen die geen gedeelde pathofysiologische mechanismen hebben, zoals COPD en diabetes). Rondom sommige clusters zijn in de huidige medisch-specialistische praktijk reeds organisatievormen ontstaan, omdat medisch specialisten elkaar vaak tegenkwamen bij de zorg voor dezelfde patiënt. Zo zijn er bijvoorbeeld ziekenhuizen met een cardiorenaal overleg (met internist-nefroloog en cardioloog) of met een dyspneu-poli (met cardioloog en longarts). Voor oudere patiënten met discordante multimorbiditeit die heeft geleid tot of gelijktijdig samen voorkomt met kwetsbaarheid wordt in Nederland al vaak verwezen naar de klinisch geriater of internist-ouderengeneeskunde. (zie bijlage 6 resultaten enquête medisch specialisten en bijlage 11 geanonimiseerd overzicht van reactie medische staven huidige praktijk)
Niet alle patiënten zullen regieondersteuning vanuit het ziekenhuis nodig hebben of willen. Patiënten met één belangrijke ziekte, al dan niet met risicofactoren en/of een milde complicatie, die verder hoofdzakelijk in de eerste lijn worden behandeld, zullen zich over het algemeen redden met de huidige structuren, waarbij de huisarts waar nodig met hen het overzicht bewaart en ondersteunt. De redenering van de werkgroep is dat hoe complexer de multimorbiditeit (en de behandeling) in het ziekenhuis is, hoe complexer het wordt voor de patiënt om (al dan niet samen met de huisarts) tot een overkoepelende en afgestemde behandeling te komen waarin de interacties en gevolgen van alle ziektes en behandelingen worden gewogen in het licht van de wensen en de voorkeuren van de patiënt. De complexiteit van de multimorbiditeit heeft waarschijnlijke grote invloed op de behoefte aan regieondersteuning. Echter, ook de persoonlijke situatie en vaardigheden van een patiënt kunnen het behoud van regie meer of minder ‘complex’ maken.
Complexiteit van patiënten
Patiënten(organisaties) gaven aan dat de behoefte aan ondersteuning ook afhankelijk is van in hoeverre de patiënt zelf overzicht heeft, wil en kan houden (evt. met de naasten), en hoe de band met de huisarts is. Kortom, de behoefte aan regieondersteuning vanuit het ziekenhuis is ook afhankelijk van of patiënten zich zelf voldoende vaardig voelen om de organisatie en zelfmanagement voor hun chronische ziektes uit te voeren (al dan niet met ondersteuning van naast(n) en/of huisarts). De werkgroep herkent uit de praktijk maar ook op grond van de interviews dat vooral mensen met cognitieve problemen, beperkte gezondheidsvaardigheden en/of een beperkt steunsysteem hier meer moeite mee hebben. Het NIVEL publiceerde in 2014 een rapport over het belang van gezondheidsvaardigheden voor zelfmanagement door patiënten met chronische ziektes. (Heijmans, 2014) Zij citeerden als definitie van gezondheidsvaardigheden ‘de vaardigheden van mensen om informatie over gezondheid te verkrijgen, te begrijpen, te beoordelen en te gebruiken bij het nemen van gezondheidsgerelateerde beslissingen’. De auteurs noemden ook voorbeelden van chronisch zieken die zich minder gezondheidsvaardig voelen: ouderen, chronisch zieken met een lagere opleiding of lager inkomen en chronisch zieken met multimorbiditeit en/of lichamelijke beperkingen.
Gezondheidsvaardigheden werd in geen van de gevonden studies uit onze literatuuranalyse als variabele geïncludeerd. In een recente studie waarin tien onderzoeken uit Nederland werden samengevat, werd echter gerapporteerd dat patiënten met lagere gezondheidsvaardigheden over het algemeen slechtere uitkomsten hadden en minder actief waren in hun eigen zorgproces. (Sørensen, 2020) Om in de praktijk patiënten met multimorbiditeit te herkennen die mogelijk baat hebben bij regieondersteuning door niet-medische factoren, zal een zorgprofessional moeten achterhalen in hoeverre de patiënt overzicht heeft, wil en kan houden, door bijvoorbeeld ook gezondheidsvaardigheden mee te nemen in de beoordeling. De karakteristieken van de chronisch zieken die zich minder gezondheidsvaardig voelen, zijn ook karakteristieken die (gecombineerd) geassocieerd bleken met slechtere uitkomsten. (Leigh-Hunt, 2017; Marengoni, 2011) Ook al kwamen de ‘losse’ factoren niet uit onze literatuuranalyse naar voren, denkt de werkgroep dat hoe meer van deze factoren aanwezig zijn bij een patiënt, hoe ‘complexer’ de situatie van de patiënt is. Deze complexiteit kan er ook toe leiden dat er meer behoefte is aan regieondersteuning.
Behoefte aan regieondersteuning: combinatie complexiteit multimorbiditeit en patiënt
De interactie tussen alle verschillende factoren laat zich niet vangen in een éénduidige uitspraak over wie gebaat is bij regieondersteuning. De werkgroep concludeert dat de behoefte waarschijnlijk bepaald wordt door een combinatie van de complexiteit van de multimorbiditeit (die afhankelijk van het aantal wel of niet-gerelateerde aandoeningen toeneemt) en de complexiteit van de patiënt (die bepaalt in hoeverre een patiënt zelf overzicht heeft, wil en kan houden). In figuur 2 op de volgende pagina is deze fictieve drempelwaarde voor regieondersteuning schematisch weergegeven.
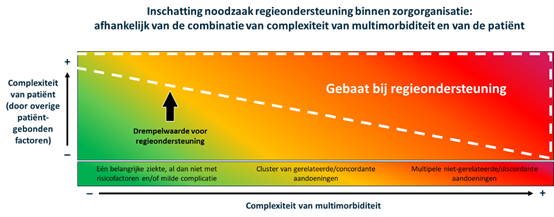
Figuur 2 Schematische weergave van de drempelwaarde voor ondersteuning bij regie, die waarschijnlijk afhankelijk is van een combinatie van complexiteit van multimorbiditeit (hoeveelheid chronische ziektes, cluster van gerelateerde/concordante aandoeningen of multipele niet gerelateerde discordante aandoeningen) en complexiteit van patiënt (dagelijks functioneren, cognitie, gezondheidsvaardigheden, kwetsbaarheid, mantelzorg/steunsysteem). Wanneer een patiënt boven de witte stippellijn uitkomt, heeft hij/zij mogelijk baat bij ondersteuning van regie. Dit kan in deze schematische weergave dus wanneer de patiënt discordante multimorbiditeit (multipele niet-gerelateerde aandoeningen) heeft zonder andere factoren die de patiënt complex maken. Maar de drempelwaarde kan ook al gepasseerd worden wanneer een patiënt één belangrijke ziekte heeft met risicofactoren en/of milde complicaties en een combinatie van veel factoren die de patiënt complex maken. De grenzen zijn niet heel duidelijk en zullen in de praktijk ook niet altijd even duidelijk zijn.
Onderbouwing
Achtergrond
Ondersteuning van regie voor patiënten met multimorbiditeit heeft als doel het afstemmen van de zorg op de algehele situatie en wensen van de patiënt nu en voor de toekomst. Gezien de brede onderliggende uitkomst en multifactoriële interventie bij een heterogene groep was de verwachting dat deze vraag niet rechtstreeks en eenduidig beantwoord zou kunnen worden met een passende literatuursearch. Het zorgverbruik van een patiënt met multimorbiditeit is één van de factoren die potentieel kan worden beïnvloed door betere afstemming (bijvoorbeeld door het voorkómen van potentieel vermijdbare ongewenste uitkomsten, zoals spoedopnames of (gevolgen van) interacties van medicatie). Daarnaast kan hoog zorgverbruik ook een aanwijzing zijn dat afstemming nodig zou kunnen zijn. Door te beschrijven welke patiënt-, socio-economische en zorgkarakteristieken geassocieerd zijn met hoog zorgverbruik of met een lage patiënttevredenheid over de zorg voor chronische ziektes/continuïteit van zorg/zorgcoördinatie was de verwachting van de werkgroep een indruk te kunnen krijgen voor welke patiënten ondersteuning van regie mogelijk van meerwaarde kan zijn.
Conclusies / Summary of Findings
Aantal chronische ziektes
|
redelijk GRADE |
Het aantal chronische ziektes is waarschijnlijk onafhankelijk geassocieerd met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Abernathy, 2016; Agborsangaya, 2013; Bazargan, 2019; Bock, 2014; van den Bussche, 2011; Cunningham, 2017; Ensrud, 2018; Glynn, 2011; Hull, 2018; Ilinca, 2015; Kennedy, 2017; Lehnert, 2011; Milani, 2016; Nägga, 2012; Palladino, 2016; Teh, 2018; Wagner, 2019; Wammes, 2018 |
Specifieke clusters van multimorbiditeit en acuut zorgverbruik/doktersbezoeken
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van specifieke clusters van multimorbiditeit met acuut zorgverbruik (ziekenhuisopnames en/of SEH-bezoeken) en met meer doktersbezoeken, wanneer is gecorrigeerd voor andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Abernathy, 2016; Kennedy, 2017; Teh, 2018 |
Geslacht en acuut zorgverbruik
|
laag GRADE |
Mannelijk geslacht zou mogelijk onafhankelijk geassocieerd kunnen zijn met hoger acuut zorgverbruik (SEH-bezoeken en ziekenhuisopnames), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Abernathy, 2016; Bazargan, 2019; Hull, 2018; Ilinca, 2015 |
Geslacht en aantal doktersbezoeken
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van geslacht met het aantal doktersbezoeken, wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: van den Bussche, 2011; Ilinca, 2015; Kennedy, 2017 |
Geslacht en zorgkosten
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van geslacht met de zorgkosten, wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Bock, 2014; Wammes, 2018 |
Leeftijd
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van een hogere leeftijd met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Abernathy, 2016; Bazargan, 2019; Bock, 2014; van den Bussche, 2011; Cunningham, 2017; Hull, 2018; Ilinca, 2015; Wammes, 2018 |
Etniciteit
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van etniciteit met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: Abernathy, 2016; Cunningham, 2017; Hull, 2018; Wammes, 2018 |
Dagelijks functioneren en ziekenhuisopnames/aantal doktersbezoeken
|
laag GRADE |
Verminderd dagelijks functioneren (ADL beperkingen/zorgafhankelijkheid) zou mogelijk onafhankelijk geassocieerd kunnen zijn met een hoger aantal ziekenhuisopnames en hoger aantal doktersbezoeken wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: van den Bussche, 2011; Ilinca, 2015; Ensrud, 2018; Nägga, 2012 |
Dagelijks functioneren en SEH-bezoeken/zorgkosten
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van verminderd dagelijks functioneren (ADL beperkingen/zorgafhankelijkheid) met SEH-bezoeken en zorgkosten, wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bronnen: van den Bussche, 2011; Ilinca, 2015; Ensrud, 2018; Nägga, 2012; Wammes, 2018 |
Dagelijks functioneren en doktersbezoeken
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van polyfarmacie met een hoger aantal doktersbezoeken, wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Kennedy, 2017 |
Kwetsbaarheid en ziekenhuisopname/aantal doktersbezoeken
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie van kwetsbaarheid is met een hoger aantal ziekenhuisopnames en hoger aantal doktersbezoeken, wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Ilinca, 2015 |
Opleidingsniveau
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van opleidingsniveau met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Ilinca, 2015; Kennedy, 2017; Bazargan, 2019; Bock, 2014; Wammes, 2018 |
Socio-economische status
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van socio-economische status met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Abernathy, 2016; Bazargan, 2019; Bock, 2014; Hull, 2015; Ilinca, 2015; Wammes, 2018 |
Burgerlijke staat
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van burgerlijke staat met hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten), wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Abernathy, 2016; Bazargan, 2019; Bock, 2014; Ilinca, 2015 |
Verzekering en acuut zorgverbruik/aantal doktersbezoeken
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van het hebben van een zorgverzekering met acuut zorgverbruik (spoedeisende hulpbezoeken en ziekenhuisopnames) en doktersbezoeken wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Abernathy, 2016; Kennedy, 2017; Wammes, 2018 |
Aantal doktersbezoeken en acuut zorgverbruik
|
zeer laag GRADE |
Het is onduidelijk of er een onafhankelijke associatie is van aantal doktersbezoeken met acuut zorgverbruik (spoedeisende hulpbezoeken en ziekenhuisopnames) wanneer is gecorrigeerd voor aantal chronische ziektes en andere patiënt-, socio-economische en zorgkarakteristieken.
Bron: Cunningham, 2017; Hull, 2018; Nägga, 2012 |
Samenvatting literatuur
Beschrijving studies
Alle zestien observationele studies rapporteerden een associatie tussen multimorbiditeit/meerdere chronische ziektes en een hoger zorgverbruik. In studies die een populatie hadden met variabele leeftijd en geslacht werden deze factoren altijd onderzocht in de multivariabele modellen. Ook socio-economische status (inclusief armoede, inkomen en werk) en dagelijks functioneren (inclusief ADL beperkingen, zorgafhankelijkheid en mobiliteit) werden relatief vaak (respectievelijk in elf en zes van de 16 studies) in de modellen meegenomen. Andere karakteristieken werden minder dan vijf keer geïncludeerd in de analyse. De systematische review van Lehnert (2011) gaf een overzicht van observationele studies die een associatie tussen multimorbiditeit/meerdere chronische ziektes en zorgverbruik/zorgkosten rapporteerden. De systematische review van Wammes (2018) gaf een overzicht van observationele studies die rapporteerden over de patiëntkarakteristieken en zorgverbruik in een specifieke patiëntpopulatie met top-X% zorgkosten.
Uiteindelijk zijn de volgende vooraf gedefinieerde karakteristieken gevonden in de modellen van de observationele studies en de systematische reviews:
Patiëntkarakteristieken: leeftijd, geslacht, etniciteit, aantal chronische ziektes, aantal medicijnen (in de vorm van polyfarmacie), dagelijks functioneren, aanwezigheid van specifieke chronische ziekte cluster
Socio-economische karakteristieken: socio-economische status, werkstatus, inkomen (alle drie meegenomen als maat voor socio-economische status), leefsituatie, burgerlijke staat, opleidingsniveau
Zorgkarakteristieken: aantal consulten met medisch specialisten, aantal consulten met huisarts
De volgende karakteristieken zijn niet gevonden in de modellen: Gezondheidsstatus, gezondheidsvaardigheden, kwaliteit van leven, prognose, aantal betrokken medisch specialisten, aantal eerdere spoedeisende hulpbezoeken, aantal eerdere ziekenhuisopnames. Er werden tevens geen studies gevonden met patiënttevredenheid als uitkomstmaat.
De studies zullen beschreven worden per uitkomstmaat.
Welke patiënt-, socio-economische en zorgkarakteristieken zijn geassocieerd met spoedeisende hulpbezoeken?
Spoedeisende hulpbezoeken (SEH-bezoeken) en multimorbiditeit
Zeven studies (Hull, 2018; Agborsangaya, 2013; Milani, 2016; Bazargan, 2019; Wagner, 2019; Cunningham, 2017; Abernathy, 2016) rapporteren multivariabele modellen met als uitkomstmaat SEH-bezoek (er werden verschillende definities gebruikt: aantal of 1 SEH-bezoek, regelmatig SEH-bezoek of acuut zorggebruik). Alle studies, op één na (Abernathy, 2016) beschreven een hogere odds voor SEH-bezoeken bij een toenemend aantal chronische condities, gecorrigeerd voor leeftijd en geslacht (zie Tabel 1; Cunningham (2017) corrigeerde niet voor geslacht). Abernathy (2016) rapporteerde een hogere rate ratio (RR) voor patiënten uit het meerdere chronische condities cluster, maar ook voor de andere specifieke multimorbiditeitsclusters (Cancer; COPD; Mental Health; Renal disease). De systematische review van Lehnert (2011) rapporteerde vier studies die een associatie tussen meerdere chronische ziektes en spoedeisende hulpbezoek lieten zien (één studie met een multivariabel model en drie studies waarvan onbekend was of dit een multivariabele of univariate analyse betrof). In tabel 1 staan de gerapporteerde OR/RR voor SEH-bezoeken bij een toenemend aantal chronische condities per studie opgenomen.
Tabel 1 Gerapporteerde associaties tussen multimorbiditeit/meerdere chronische ziektes en SEH-bezoeken
|
Emergency department visits |
||||
|
Study |
Population |
Outcome |
Measure of multimorbidity/multiple chronic conditions |
Association with multimorbidity/multiple chronic conditions |
|
Abernathy, 2016 |
18+ who were seen at least twice at Internal Medicine primary care clinic |
Count of any acute care use (hospital or emergency department [ED]) |
Multiple chronic conditions (MCC) cluster (as defined in the article) Interaction effect: MCC cluster + Mental Health
Mental Health cluster Cancer cluster Interaction effect: Cancer cluster + Mental Health COPD cluster Interaction effect: COPD cluster + Mental Health Renal disease cluster Interaction effect: Renal disease cluster + Mental Health |
Rate Ratio (95% CI) 1.80 (1.70-1.90)
1.34 (1.22-1.47)
1.41 (1.30-1.53) 1.82 (1.63-2.03) 1.11 (0.94-1.31)
1.50 (1.38-1.64) 1.2 (1.06-1.36),
2.57 (2.40-2.75) 1.27 (1.15-1.40) |
|
Agborsangaya, 2013 |
Age 18+ |
ED visit in previous year |
Morbidity status 0 conditions (ref) 1 condition 2 conditions 3 conditions 4 conditions ≥ 5 conditions Multimorbidity (2 or more chronic conditions) |
OR (95% CI) 1 (ref) 1.8 (1.4-2.3) 1.6 (1.2-2.2) 2.7 (1.8-4.0) 1.9 (1.2-3.0) 2.5 (1.6-3.9) 1.8 (1.4-2.2) |
|
Bazargan, 2019 |
African-Americans, aged 65 years or over |
ED visits (OR (95% CI), p-values only reported as significant or not significant |
Number of chronic Medical Conditions (CMCs) (0-2 and 3-5 chronic conditions) ≥ 6 chronic medical conditions: 1 (reference)
3-5 chronic medical conditions: - no visit (vs 2+visits) - 1 visit(vs 2+ visits)
0-2 chronic medical conditions: - no visit (vs 2+visits) -1 visit(vs 2+ visits) |
OR (95% CI)
- 1.70 (0.92-3.13) - 1.51 (0.78-2.94)
-2.61 (1.03-6.59) -1.87 (0.68-5.13) |
|
Cunningham, 2017 |
18+ patients in ED waiting rooms and exam rooms |
Frequent ED visitor in the previous year (adult patients in ED waiting/exam rooms) |
Number of chronic conditions Every chronic condition extra |
OR (95% CI) 1.43 (1.29-1.59) |
|
Hull, 2018 |
Age 18+, registered at GP practice |
Emergency department (ED) attendance during study period |
Nr of long-term conditions 0 conditions (ref) 1 condition 2 conditions 3 conditions ≥ 4 conditions |
OR (95% CI) 1 (ref) 1.12 (1.10-1.13) 1.28 (1.25-1.31) 1.65 (1.59-1.71) 2.55 (2.44-2.66) |
|
Lehnert, 2011 |
Four studies with an association between number of chronic conditions and ED visit (one multivariable model and three studies with unclarity whether model was uni-/multivariable |
|||
|
Milani, 2016 |
Age 18+, who completed HealthStreet Intake From (community outreach engagement program) |
Frequent ED visits in previous six months |
- Males with 1-2 Chronic Diseases Compared to None - Males with 3-5 Chronic Diseases Compared to None - Females with 1-2 Chronic Diseases Compared to None - Females with 3-5 Chronic Diseases Compared to None
|
OR (95% CI) - 1.58 (1.2, 2.0)
- 4.98 (2.9, 8.6)
- 1.61 (1.3, 1.9)
-2.49 (1.7, 3.6) |
|
Wagner, 2019 |
Decedents 18+, with specific care use in years before death |
Any ED-visit in last 30 days |
Number of chronic conditions 1 chronic condition (ref) 2 chronic conditions 3+ chronic conditions
|
OR (95% CI) 1 (ref) 1.67 (1.36-2.05) 2.15 (1.74-2.66) |
SEH-bezoeken en andere patiëntkarakteristieken
Drie van de zeven studies onderzochten de associatie tussen geslacht en SEH-bezoek en één studie rapporteerde een subgroupanalyse op basis van geslacht. Hull (2018) rapporteerde een OR van 0,92 (95% BI 0,90 tot 0,93) voor SEH bezoek voor vrouwen ten opzichte van mannen. Bazargan (2019) rapporteerde dat mannen een lagere odds hadden op geen (OR 0,50 (95% BI 0,29 tot 0,85) of één SEH-bezoek (OR 0,45 (95% BI 0,25 tot 0,82) dan op meer dan 2 bezoeken, vergeleken met vrouwen. Daarnaast rapporteerde ook Abernathy (2016) een hogere rate ratio (1,12 (95% BI 1,09 tot 1,16) voor mannen. Milani (2016) deed een subgroepanalyse o.b.v. geslacht (omdat geslacht een significante effect modificator was), waarbij ze rapporteerden dat de odds ratio voor mannen met 3-5 chronische ziektes bijna dubbel zo groot was als de odds ratio voor vrouwen met 3-5 chronische ziektes (4,98 tegenover 2,49, zie tabel 1). Twee studies (Agborsangaya, 2013 en Wagner, 2019) namen geslacht mee als effectmodificator/ confounder en rapporteerden geen resultaten over deze variabele. Cunningham (2017) includeerde geslacht niet in de analyse.
In drie studies (Hull, 2018; Abernathy, 2016; Cunningham, 2017) die een associatie van hogere leeftijd met SEH-bezoek onderzochten werden lagere odds en rate ratios gevonden. Bij de resultaten van Hull (2018) gold dit alleen voor de leeftijdsgroepen tot 74 jaar vergeleken met de referentiegroep van 18-34 jaar (de odds ratio van de leeftijdsgroep 75 jaar en ouder verschilde niet significant van die van de referentiegroep). Bazargan (2019) vergeleken de leeftijdsgroep 65-75 jaar met de leeftijdsgroep 75 jaar en ouder en vonden een OR van 1,18 (95% BI 0,68 tot 2,04) voor 65-75 jarigen en geen SEH-bezoek (vergeleken met 2 SEH bezoeken). Dit resultaat was echter niet significant. Agborsangaya (2013), Milani (2016) en Wagner (2019) includeerden leeftijd als effectmodificator/ confounder, maar rapporteerden geen resultaten hiervan.
Hull (2018), Abernathy (2016) en Cunningham (2017) rapporteerden allen ook een associatie met etniciteit, waarbij ze alle drie hogere OR lieten zien voor niet-witte of zwarte patiënten vergeleken met witte patiënten (Cunningham (2017) – 2,06 (95% BI 1,17 tot 3,63; Hull (2018) – 1,08 (95% BI 1,06 tot 1,10); Abernathy (2016) – 1,35 (95% BI 1,30 tot 1,40)). Hull 2018 rapporteerde tevens een lagere OR voor Zuid-Aziatische patiënten (0,90 (95% BI 0,89 tot 0,92). Wagner (2019) includeerde etniciteit als effectmodificator/ confounder, maar rapporteerde geen resultaten hiervan.
Bazargan (2019) includeerde ook dagelijks functioneren in het model, maar vond geen significante associatie. Hull (2018) includeerde als enige studie leefsituatie (zelfstandig, aan huis gebonden of verpleeghuis) als variabele, en vond een significante associatie (aan huis gebonden: OR 2,01 (95% BI 1,86 tot 2,18); verpleeghuis: OR 1,20 (95% BI 1,02 tot 1,41))
SEH-bezoeken en socio-economische karakteristieken
Hull (2018) en Abernathy (2016) rapporteerden beide ook een associatie tussen socio-economische status (waaronder ook armoede, inkomen en werk werden gerekend als variabelen). Hull (2018) rapporteerde een OR die opliep tot 1,15 (95% BI 1,12 tot 1,18) voor de groep met de meeste armoede. Abernathy (2016) rapporteerde een RR van 1,13 (95% BI 1,10 tot 1,16, p<0.001) voor patiënten uit een postcode gebied waar meer dan 25% van de populatie onder de armoedegrens leeft. Bazargan (2019) rapporteerde geen significante associatie met financiële moeilijkheden. Agborsangaya (2013) en Milani (2016) includeerde socio-economische status in hun model als effectmodificator/ confounder, maar rapporteerden geen resultaten hiervan.
Abernathy (2016) vond ook een associatie met burgerlijke staat en verzekering. Patiënten die ongehuwd waren, hadden een 1,12 (95% BI 1,09 tot 1,16) keer hogere odds op acuut zorggebruik dan getrouwde patiënten. Bazargan (2019) vond geen significante associatie met burgerlijke staat. Milani (2016) includeerde burgerlijke staat als effectmodificator/confounder, maar rapporteerde geen resultaten hiervan.
Daarnaast hadden publiek verzekerde patiënten in de studie van Abernathy (2016) een OR van 1,56 (95% BI 1,49 tot 1,64) vergeleken met privaat verzekerde patiënten. Voor onverzekerde patiënten werd geen significante associatie gevonden. Wagner (2019) includeerde verzekering als effectmodificator/confounder, maar rapporteerde geen resultaten hiervan.
Bazargan (2019) includeerde ook opleidingsniveau in hun model, maar vond geen significante associatie. Wagner (2019) includeerde opleidingsniveau als effectmodificator/ confounder, maar rapporteerde geen resultaten hiervan.
SEH-bezoeken en zorgkarakteristieken
De associatie van het aantal huisarts-/doktersafspraken met SEH-bezoeken werd maar in 2 studies onderzocht. Hull (2018) vond een odds ratio van 2,44 (95% BI 2,40 tot 2,48) voor de groep patiënten met gemiddeld 2,5 huisartsbezoeken vergeleken met de groep patiënten met 0,5-2 huisartsbezoeken in één jaar. Bovendien vond Hull (2018) dat patiënten met géén huisartsbezoek significant lagere odds (OR 0,29, 95% BI 0,28 tot 0,29) hadden op een SEH bezoek vergeleken met de groep met gemiddeld 0,5-2 huisartsbezoeken. Cunningham (2017) vond een odds ratio van 1,14 (1,05-1,22) per extra bezoek aan de eerste lijn arts.
Overzicht van alle variabelen die zijn meegenomen in de modellen die kijken naar de uitkomst SEH-bezoeken
Tabel 2 geeft een overzicht van de verschillende variabelen, in welk model deze zijn opgenomen, inclusief de richting van de gerapporteerde associaties. Alle zeven studies die SEH-bezoeken als uitkomstmaat hadden gedefinieerd, onderzochten de associatie met het aantal chronische ziektes en leeftijd. Een groter aantal chronische ziektes werd in alle studies geassocieerd met (meer) SEH-bezoeken. In drie van de vier studies die effectmaten rapporteerden voor leeftijd werd een significante associatie gevonden tussen een lagere leeftijd en een (meer) SEH-bezoeken. Drie van de zes studies die de associatie met geslacht onderzochten rapporteerde effectmaten, en zagen een significante associatie tussen vrouwelijk geslacht en minder SEH-bezoek. Voor alle overige variabelen werden ook significante associaties gevonden in minimaal 1 studie, behalve voor dagelijks functioneren.
Tabel 2 Overzicht van de verschillende geïncludeerde variabelen in de modellen en de associatie met SEH-bezoeken als uitkomst
|
Author N |
Outcome |
|
|
Independent variables |
||||||||||||||||||||
|
Patient characteristics |
Socio-economic characteristics |
Care characteristics |
||||||||||||||||||||||
|
Sex (female) |
Age (older) |
Ethnicity |
Nr of chronic conditions (higher) or multimorbidity |
ADL limitations/ nursing dependency |
Specific cluster of chronic conditions |
Mental health (cluster) |
Residential status (home-bound/care home)
↑ Not in analysis Not in analysis Not in analysis Not in analysis Not in analysis Not in analysis 1 |
Education |
Social economic status/ deprivation/income/ |
Marital status/living with partner |
Insurance |
Nr of consultations |
Nr of GP consultations |
|||||||||||
|
Abernathy, 2016 10.408 |
Any acute care use |
↓ |
↓ |
= (white), ↑ (non-white) |
↑ |
Not in analysis |
↑ |
↑ |
Not in analysis |
Not in analysis |
↑ |
↑ |
–(uninsured), ↑ (public insured) |
Not in analysis |
Not in analysis |
|||||||||
|
Agborsangaya, 2013 4.946 |
ED visit in previous year |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||
|
Bazargan, 2019 609 |
ED visits |
↓ |
– |
Not in analysis |
↑ |
– |
Not in analysis |
Not in analysis |
Not in analysis |
– |
– |
– |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||
|
Cunningham, 2017 1.113 |
Frequent ED visitor in the previous year |
Not in analysis |
↓ |
= (Other), ↑ (African American) |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
Not in analysis |
|||||||||
|
Hull, 2018 626.395 |
ED atten-dance during study period |
↓ |
↓ |
↓ (South-Asian), = (White), |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
|||||||||
|
Milani, 2016 7.143 |
Frequent ED visits in previous six months |
Sub-group |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||
|
Wagner, 2019 22.068 |
Any ED-visit in last 30 days before death |
Eff. mod./ conf. |
Age at death Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Eff. mod./ conf.. |
Not in analysis |
Not in analysis |
|||||||||
|
Variable included in |
6 |
7 |
4 |
7 |
1 |
1 |
1 |
1 |
1 |
5 |
3 |
2 |
1 |
1 |
||||||||||
|
Legend: |
|
|
|
|
|
|
|
|||||||||||||||||
|
↓ |
|
Significant association with lower RR/OR or negative regression coefficient |
|
|||||||||||||||||||||
|
↑ |
|
Significant association with higher RR/OR or positive regression coefficient |
|
|||||||||||||||||||||
|
– |
|
No significant association |
|
|||||||||||||||||||||
|
eff. mod. / conf. |
|
Effect modifier / confounder, no results reported |
|
|||||||||||||||||||||
Welke patiënt-, socio-economische en zorgkarakteristieken zijn geassocieerd met ziekenhuisopnames?
Ziekenhuisopnames en multimorbiditeit
Agborsangaya (2013), Ilinca (2015), Palladino (2016), Glynn (2011), Ensrud (2018), Nägga (2012) en Wagner (2019) rapporteerde hogere odds ratios (tot 4,51 keer hoge odds voor patiënten met meer dan vier chronische condities) voor ziekenhuisopnames (vóórkomen van een ziekenhuisopname, aantal ziekenhuisopnames, duur van ziekenhuisopname of IC-opname) bij meerdere chronische ziektes/multimorbiditeit. Teh (2018) rapporteerde een hogere hazard ratio voor een ziekenhuisopname binnen 2 jaar bij de aanwezigheid van 3 of meer chronische ziektes, maar dit resultaat was niet significant. Alleen het ‘Depressie en Artritis’ cluster liet een significant hogere hazard (1.48 (95% BI 1.03-2.12)) zien voor een ziekenhuisopname binnen 2 jaar. Ook de review van Lehnert (2011) rapporteerde in negen studies een significante associatie tussen meerdere chronische ziektes en ziekenhuisopname (vier multivariabele studies, één studie die zowel positieve als negatieve associaties rapporteerde afhankelijk van leeftijdsgroep en ziektelast en vier studies waarvan onduidelijk was of dit multivariabele modellen betrof). In Tabel 3 staan alle gerapporteerde OR/RR voor ziekenhuisopnames bij een toenemend aantal chronische condities per observationele studie opgenomen.
Tabel 3 Gerapporteerde associaties tussen multimorbiditeit/meerdere chronische ziektes en ziekenhuisopname
|
Hospitalizations |
||||
|
Study |
Population |
Outcome |
Measure of multimorbidity/multiple chronic conditions |
Association with multimorbidity/multiple chronic conditions |
|
Agborsangaya, 2013 |
Age 18+ |
Hospitalization in previous year (entire population) |
Morbidity status 0 conditions (ref) 1 condition 2 conditions 3 conditions 4 conditions ≥ 5 conditions Multimorbidity (2 or more chronic conditions) |
OR (95% CI) 1 (ref) 1.2 (0.9-1.7) 1.8 (1.2-2.7) 2.3 (1.4-3.7) 2.9 (1.7-5.0) 3.2 (1.9-5.3) 2.2 (1.7-2.9) |
|
Ensrud, 2018 |
Male participants of osteoporosis study aged 65+ |
Hospitalization
Inpatient and Post-Acute Care (PAC) facility days among those hospitalized |
Multimorbidity None (0–1 conditions) Mild–moderate (2–4 conditions) High (≥5 conditions)
Multimorbidity None (0–1 conditions) Mild–moderate (2–4 conditions) High (≥5 conditions)
|
OR (95% CI) 1 (ref) 1.62 (1.16–2.27)
2.86 (1.92–4.26)
RR (95% CI) 1 (ref) 1.51 (0.92–2.34)
1.71 (1.02–2.77) |
|
Glynn, 2011 |
Age 50+ (with two or more consultation in previous 2 years) |
Hospital admissions in the previous 12 months |
Nr of chronic conditions 0 conditions (ref) 1 condition 2 conditions 3 conditions 4 conditions >4 conditions |
Odds ratio (95% CI) 1 (ref) 1.16 (0.71–1.89) 1.86 (1.18–2.94) 2.12 (1.33–3.38) 3.80 (2.35–6.12) 4.51 (2.79–7.29) |
|
Ilinca, 2015 |
Age 50+ |
Hospitalization in the 12 months prior to the study |
Multimorbidity (two or more chronic conditions) |
OR (conditional logit) no CIs reported) 1.434, p-value <0.001 |
|
Lehnert, 2011 |
Nine studies found an association between multiple chronic conditions and hospitalizations (four multivariable models, one with both negative and positive associations, depending the age group and disease burden and four studies with unclarity whether model was uni- or multivariable. |
|||
|
Nägga, 2012 |
Age 85 years |
Hospitalization in preceding 12 months |
Multimorbidity (2 or more chronic diseases)
|
OR (95% CI) 1.9 (1-3.5) |
|
Palladino, 2016 |
Age 50+ |
Being hospitalized
Number of hospitalizations
Length of hospital stay |
Increasing number of chronic conditions (CDs)
Increasing number of CDs
Increasing number of CDs |
OR (95% CI) 1.49 (1.42–1.55)
Incidence Risk Ratio (IRR) (95%CI): 1.419 (1.363–1.492)
(1–5)Incidence Risk Ratio (IRR) (95%CI) IRR 1.632 (1.537–1.733)) |
|
Teh, 2018 |
Non-Maori aged 85 years |
48-month any hospitalisation
Pre 12-month admission |
Multimorbidity (≥3 conditions) <3 conditions (ref) ≥3 conditions
Specific clusters Cluster 1 ‘Well’ (ref) Cluster 2 ‘CHF and AF’ Cluster 3 ‘Depression and Arthritis’ Cluster 4 ‘Cancer’ Cluster 5 ‘Respiratory and Diabetes’ Cluster 6 ‘Stroke’
Specific clusters Cluster 1 ‘Well’ (ref) Cluster 2 ‘CHF and AF’ Cluster 3 ‘Depression and Arthritis’ Cluster 4 ‘Cancer’ Cluster 5 ‘Respiratory and Diabetes’ Cluster 6 ‘Stroke’
|
HR (95%CI)
1 (ref) 1.10 (0.88-1.36)
HR (95%CI) 1 (ref) 1.32 (0.90-1.94) 1.48 (1.03-2.12)
1.11 (0.75-1.65) 1.30 (0.92-1.83)
1.34 (0.94-1.92)
OR (95% CI), p-value 1 (ref) 1.98 (1.13-3.47) 1.68 (0.95-2.96)
1.59 (0.87-2.91) 1.82 (1.06-3.11)
2.72 (1.63-4.53) |
|
Wagner, 2019 |
Decedents 18+, with specific care use in years before death |
Any inpatient care in last 30 days
Any ICU care in last 30 days |
Number of chronic conditions 1 chronic condition (ref) 2 chronic conditions 3+ chronic conditions
Number of chronic conditions 1 chronic condition (ref) 2 chronic conditions 3+ chronic conditions |
OR (95% CI)
1 (ref) 1.75 (1.61-1.90) 2.80 (2.57-3.05)
OR (95% CI)
1 (ref) 1.81 (1.64-2.01) 3.08 (2.78-3.41) |
Ziekenhuisopnames en andere patiëntkarakteristieken
Leeftijd en geslacht werden door zeven studies meegenomen in hun model (Agborsangaya, 2013; Ilinca, 2015; Palladino, 2016; Glynn, 2011; Ensrud, 2018; Teh, 2018 en Wagner, 2019). Alleen Ilinca 2015 rapporteerde een significante associatie met geslacht (hogere OR voor mannen: 1,282, geen 95% BI gerapporteerd, p<0.001) en geen significante associatie met leeftijd (OR 1,059 tot 1,296 in oplopende leeftijdsgroepen vergeleken met leeftijdsgroep 50-59 jaar), maar allen niet significant gerapporteerd). De andere zes studies includeerden leeftijd en geslacht als effectmodificator/confounder, maar rapporteerden geen resultaten hiervan.
Vier studies includeerde dagelijks functioneren in hun model, waarvan drie (Ilinca, 2015; Ensrud, 2018 en Nägga, 2012) een significante associatie vonden en één (Teh, 2018) geen significante associatie vond. Ilinca 2015 vond een Incidence Rate Ratio(IRR) voor een ziekenhuisopname in de 12 maanden voorafgaand aan de studie van 1,037 (geen 95% BI gerapporteerd, p<0.05) per punt meer op de KATZ-ADL 6 score, gecorrigeerd voor kwetsbaarheid, leeftijd en aantal chronische ziektes. Voor kwetsbaarheid rapporteerde Ilinca (2015) een IRR van 1,169 (geen 95% BI gerapporteerd, p<0.001) voor pre-kwetsbare (prefrail) en 1,452 (geen 95% BI gerapporteerd, p<0.001) voor kwetsbare (frail) patiënten, met een interactie-effect voor de kwetsbare groep met multimorbiditeit. Ensrud (2018) vond dat mannen van 65 jaar en ouder met slechte mobiliteit (OR 1,61 (95% BI 1,05 tot 2,47) een grotere odds hadden op een ziekenhuisopname, maar vond geen verschil in risk ratio voor het aantal opnamedagen (RR 1,46 (0,79 tot 2,44)). Beide resultaten werden gecorrigeerd voor meerdere chronische aandoeningen en leeftijd, maar niet voor kwetsbaarheid. Nägga (2012) rapporteerde een 1,2 (95% BI 1,1-1,4) en 1,9 (95 %BI 1,1-3,2) keer hogere odds voor patiënten met respectievelijk een hoger aantal hulpmiddelen en met meer ondersteuning (community assistance), in vergelijking met patiënten zonder deze ondersteuning. In het model van Nägga (2012) waren alleen multmorbiditeit en aantal huisartsbezoeken als andere variabelen opgenomen, socio-economische status en leefsituatie waren wel geïncludeerd in de analyse, maar werden uiteindelijk niet meegenomen in het model.
Eén studie includeerde etniciteit in het onderzochte model: Wagner (2019) nam etniciteit mee als effectmodificator/confounder, maar hiervan werden geen resultaten gerapporteerd.
Ziekenhuisopnames en socio-economische karakteristieken
Ten aanzien van socio-economische karakteristieken rapporteerde alleen Ilinca (2015) geen significante associaties (opleiding (middelbare school IRR 1,015; tertiare opleiding IRR 0, p-waarde niet significant); socio-economische status (2de kwartiel IRR 1,053; 3de kwartiel IRR 0,971; 4de kwartiel IRR 1,153, p-waarde niet significant); burgerlijke staat (samenwonend met partner: IRR 1,240, p-waarde niet significant). Andere studies namen socio-economische karakteristieken mee als effectmodificator/confounder, maar rapporteerden geen resultaten.
Ziekenhuisopnames en zorgkarakteristieken
Alleen Nägga (2012) includeerde het aantal huisartsbezoeken in hun model en rapporteerde een significante associatie: de odds op een ziekenhuisopname in de voorafgaande 12 maanden was 1,3 (95 % BI 1,2-1,5) keer hoger per extra huisartsbezoek.
Overzicht van alle variabelen die zijn meegenomen in de modellen over ziekenhuisopnames
Tabel 4 geeft een overzicht van de verschillende variabelen, in welk model deze zijn opgenomen, inclusief de richting van de gerapporteerde associaties. Zeven van de acht studies die de associatie met chronische ziektes onderzochten vonden een significante associatie tussen (meerdere) chronische ziektes en ziekenhuisopname. Leeftijd en geslacht werd vaak meegenomen in modellen als effectmodificatoren/confounders, maar er werden geen resultaten van gerapporteerd. Alleen Ilinca (2015) rapporteerde geen associatie met hogere leeftijd en een significante negatieve associatie met het vrouwelijk geslacht. De overige variabelen werden minimaal één keer geïncludeerd in een model, maar vaak zonder significante associatie of zonder gerapporteerde resultaten omdat de variabele werd meegenomen als effect modificator/confounder.
Tabel 4 Overzicht van de verschillende geïncludeerde variabelen in de modellen en de associatie met ziekenhuisopname
|
Author N |
Outcome |
|
|
Independent variables |
||||||||||||||||||||||||
|
Patient characteristics |
Socio-economic characteristics |
Care ch. |
||||||||||||||||||||||||||
|
Sex (female) |
Age (older) |
Ethnicity |
Nr of chronic conditions (higher) or multimorbidity |
ADL limitations/ nursing dependency |
Frailty |
Specific cluster of chronic conditions |
Mental health (cluster) |
Residential status (home-bound/care home) |
Education |
Social economic status/ eprivation/income/ |
Marital status/living with partner |
Children |
Insurance |
Nr of GP consultations |
||||||||||||||
|
Agborsangaya, 2013 4.946 |
Hospitalization in previous year |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
||||||||||||
|
Ensrud 2018 1.701 |
Hospitalization |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
↑ |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
||||||||||||
|
Inpatient and Post-Acute Care (PAC) facility days among those hospitalized |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
– |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||||||
|
Glynn, 2011 3.309 |
Hospital admissions in the previous 12 months |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
||||||||||||
|
Ilinca, 2015 50.967 |
Hospitalization in 12 months prior to the study |
↓ |
– |
Not in analysis |
↑ |
↑ |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
– |
– |
– |
– |
Not in analysis |
Not in analysis |
||||||||||||
|
Nägga, 2012 496 |
48 month any hospitalization |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not included in the model |
Not in analysis |
Not included in the model |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
||||||||||||
|
Palladino, 2016 56.427 |
Being hospitalized |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Eff. mod./ conf. |
One effect modifier/confounder (nr of people in household), not reported |
Not in analysis |
Not in analysis |
|||||||||||||
|
Number of hospitalizations |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Eff. mod./ conf. |
One effect modifier/confounder (nr of people in household), not reported |
Not in analysis |
Not in analysis |
||||||||||||||
|
Length of hospital stay |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Eff. mod./ conf. |
One effect modifier/confounder (nr of people in household), not reported |
Not in analysis |
Not in analysis |
||||||||||||||
|
Teh, 2018 501 |
Pre 12 month admission |
Eff. mod./ conf. |
Eff. mod./ conf. |
Subgroup analysis non-Maori |
– |
Not in analysis |
Not in analysis |
↑ / no significant association some clusters |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
||||||||||||
|
48 month any hospitalization |
Eff. mod./ conf. |
Eff. mod./ conf. |
Subgroup analysis non-Maori |
– |
Not in analysis |
Not in analysis |
↑ / no significant association some clusters |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||||||
|
Wagner, 2019 22.068 |
Any ICU care in last 30 days before death |
Eff. mod./ conf. |
Age at death Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
||||||||||||
|
Any inpatient care in last 30 days before death |
Eff. mod./ conf. |
Age at death Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
|||||||||||||
|
Variable included in |
7 |
7 |
2 |
8 |
4 |
1 |
1 |
1 |
2 |
2 |
5 |
3 |
2 |
2 |
1 |
|||||||||||||
|
Legend: |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
↓ |
|
Significant association with lower RR/OR or negative regression coefficient |
|
|||||||||||||||||||||||||
|
↑ |
|
Significant association with higher RR/OR or positive regression coefficient |
|
|||||||||||||||||||||||||
|
– |
|
No significant association |
|
|||||||||||||||||||||||||
|
eff. mod. / conf. |
|
Effect modifier / confounder, but results reported |
|
|||||||||||||||||||||||||
Welke patiënt-, socio-economische en zorgkarakteristieken zijn geassocieerd met doktersbezoeken?
Doktersbezoeken en multimorbiditeit
Ilinca (2015), Palladino (2016), Glynn (2011), Kennedy (2017) en van den Bussche (2011) rapporteerden een associatie tussen multimorbiditeit/meerdere chronische ziektes en doktersbezoeken of aantal bezochte dokters (Tabel 5). Het aantal doktersbezoeken loopt op met meer dan 1 extra doktersbezoek per extra chronische ziekte, rapporteerden Ilinca (2015), Palladino (2016) en van den Bussche (2011). Het aantal verschillende bezochte artsen liep in de studie van van den Bussche (2011) echter maar op met 0,24 per extra chronische ziekte. In de systematische review van Lehnert (2011) werden zes studies gevonden die een associatie tussen meerdere chronische ziektes en het aantal doktersbezoeken rapporteerden (twee multivariabele modellen en vier studies waarbij onduidelijk was of het een multivariabel of univariaat model betrof).
Tabel 5 Gerapporteerde associaties tussen multimorbiditeit/meerdere chronische ziektes en doktersbezoeken
|
Doktersbezoeken / aantal bezochte dokters |
||||
|
Study |
Population |
Outcome |
Measure of multimorbidity/multiple chronic conditions |
Association with multimorbidity/multiple chronic conditions |
|
Glynn, 2011 |
Age 50+ (with two or more consultation in previous 2 years) |
Hospital out-patient visits in the previous 12 months |
Nr of chronic conditions 0 conditions (ref) 1 condition 2 conditions 3 conditions 4 conditions >4 conditions |
Adjusted mean difference (95% CI) 0.63 (0.52–0.73) (ref) 1.17 (1.04–1.30) 1.43 (1.29–1.57) 1.92 (1.71–2.12) 2.42 (2.10–2.75) 3.58 (3.11–4.06 |
|
Ilinca, 2015 |
Age 50+ |
Number of doctor visits in the 12 months prior to the study |
Multimorbidity (two or more chronic conditions) |
Incidence Rate Ratios (fixed effects), No CIs reported 1.228, p-value <0.001 |
|
Kennedy, 2017 |
Age 50+ |
Having an outpatient visit in the last 12 months |
Number of chronic conditions None (ref) One Two or more |
OR (95% CI) 1 (ref) 1.98 (1.96-2.00) 2.97 (2.93-3.00) |
|
Lehnert, 2011 |
Six studies found an association between multiple chronic conditions and number of doctor visits (two multivariable models, four studies with unclarity whether model was uni- or multivariable) |
|||
|
Palladino, 2016 |
Age 50+ |
Number of medical doctor visits |
Increasing number of CDs |
Incidence Risk Ratio (IRR) (95%CI) 1.336 (1.310–1.350) |
|
Van den Bussche, 2011 |
Age 65+ |
Number of contacts with ambulatory care physician
Number of different physicians contacted within the year |
Number of chronic conditions
Number of chronic conditions |
Beta regression coefficient (95% CI), p-value 2.33 (2.28-2.38), p-value <0.0001 Log scale: 1.62 (1.57-1.67), p-value<0.0001
Beta regression coefficient (95% CI), p-value 0.24 (0.23-0.24), p-value<0.0001 Log scale: 0.25 (0.24-0.26), p-value<0.0001 |
Doktersbezoeken en andere patiëntkarakteristieken
Leeftijd en geslacht werd door alle vijf studies meegenomen in de modellen (Ilinca, 2015; Palladino, 2016; Glynn, 2011; Kennedy, 2017; van den Bussche, 2011). Van den Bussche 2011 rapporteerde significant meer verschillende betrokken dokters bij vrouwelijke patiënten (beta regressiecoëfficiënt 0,16 (95% BI 0,12 tot 0.19), p <0.0001), maar zagen geen verschillen tussen geslacht ten aanzien van het aantal doktersbezoeken (beta regressiecoëfficiënt 0,05 (95% BI -0,17 tot 0,28), p=0.6317). Kennedy 2017 rapporteerde voor vrouwen een lagere odds ratio voor het rapporteren van minimaal één polikliniekbezoek in de afgelopen 12 maanden ten opzichte van mannen.
Van den Bussche (2011) vond ook dat in de populatie van 65 jaar en ouder, dat oudere patiënten significant minder doktersbezoeken hadden (beta regressiecoëfficient -0,03 (95% BI -0,01 tot 0,05), p=0.0031) en significant minder verschillende dokters bezochten (beta regressiecoëfficient -0,05 (95% BI -0,05 tot -0,05), p<0.0001). Ilinca (2015) rapporteerde geen significante associatie tussen leeftijd of geslacht en het aantal doktersbezoeken in de 12 maanden voorafgaand aan het onderzoek, in hun populatie van 50 jaar en ouder. Palladino (2016) en Glynn (2011) namen leeftijd en geslacht mee, Kennedy 2017 alleen leeftijd, als effectmodificator/confounder, maar rapporteerden geen resultaten.
Twee studies (Ilinca, 2015; van den Bussche, 2011) rapporteerden een associatie tussen dagelijks functioneren en het aantal doktersbezoeken: hoe meer functionele beperkingen/ zorgafhankelijkheid, hoe meer doktersbezoeken (IRR 1,037, p<0.05; beta regressie coëfficient 10,37 (95% BI 10,01 tot 10,72), p-value <0.0001). Van den Bussche (2011) rapporteerde ook een associatie tussen dagelijks functioneren en het aantal bezochte dokters. De aanwezigheid van zorgafhankelijkheid was geassocieerd met een minder aantal bezochte dokters (beta regressiecoëfficient -0,20 (95% BI -0,28 tot -0,14), p<0.0001).
Doktersbezoeken en socio-economische karakteristieken
Kennedy (2017) rapporteerde een significante associatie tussen het aantal doktersbezoeken/aantal bezochte dokters met de soort verzekering die patiënten hebben. Patiënten met een private verzekering of een gesubsidieerde verzekering hadden hogere odds voor het rapporteren van een polikliniekbezoek in de afgelopen 12 maanden (Private Health: OR 1,15 (95% BI 1,14 tot 1,16); Government-funded medical care (GMS) / free visits to GP – Docter Visit Card (DVC): OR 1,02 (95% BI 1,01 tot 1,03)). Glynn (2011) nam de soort verzekering mee als effectmodificator/confounder, maar rapporteerde geen resultaten. Ilinca 2015 rapporteerde geen significante associatie tussen sociaal-economische status (gedefinieerd als inkomen van huishouden), alsmede woonsituatie met partner en/of kinderen, en/of verpleeghuis, en het aantal doktersbezoeken in de voorafgaande 12 maanden. Palladino (2016) nam sociaal-economische status, alsmede het aantal mensen in het huishouden, mee als effectmodificators/confounders, maar rapporteerde geen resultaten.
Kennedy (2017) rapporteerde daarnaast een significante associatie met opleidingsniveau, een hoger opleidingsniveau was geassocieerd met hogere odds voor het rapporteren van een polikliniekbezoek in de afgelopen 12 maanden (Secondary: OR 1,11 (95% BI 1,10-1,12), Tertiary: OR 1,31 (95% BI 1,29 tot 1,32)). Ilinca (2015) rapporteerde geen significante associatie tussen opleidingsniveau en het aantal doktersbezoeken in de voorafgaande 12 maanden.
Doktersbezoeken en zorgkarakteristieken
Zorgkarakteristieken werden door geen enkele studie meegenomen.
Overzicht van alle variabelen die zijn meegenomen in de modellen over aantal doktersbezoeken/aantal bezochte dokters
Tabel 6 geeft een overzicht van de verschillende variabelen, in welk model deze zijn opgenomen, inclusief de richting van de gerapporteerde associaties. Alle vijf studies rapporteerden een significante associatie tussen (meerdere) chronische ziektes en het aantal doktersbezoeken. Twee studies rapporteerden een significante associaties tussen dagelijks functioneren en aantal doktersbezoeken, waarvan één studie ook een significante (negatieve associatie) zag tussen dagelijks functioneren en het aantal bezochte artsen. De overige variabelen werden minimaal één keer geïncludeerd in een model, met wisselende resultaten.
Tabel 6 Overzicht van de verschillende geïncludeerde variabelen in de modellen en de associatie met aantal doktersbezoeken/aantal bezochte dokters
|
Author N |
Outcome |
|
Independent variables |
||||||||||||||||||||
|
Patient characteristics |
Socio-economic characteristics |
||||||||||||||||||||||
|
Sex (female) |
Age (older) |
Nr of chronic conditions (higher) or multimorbidity |
Polypharmacy |
ADL limitations/ nursing dependency |
Farilty |
Pain (cluster) |
Residential status (home-bound/care home) |
Education |
Social economic status/ deprivation/income/employment |
Marital status/living with partner |
Children |
Insurance |
|||||||||||
|
Glynn, 2011 3.309 |
Hospital outpatient visits in previous 12 months |
Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
|||||||||
|
Ilinca, 2015 50.967 |
Number of doctor visits in the 12 months prior to the study |
– |
– |
↑ |
Not in analysis |
↑ |
↑ |
Not in analysis |
Not in analysis |
– |
– |
– |
– |
Not in analysis |
|||||||||
|
Kennedy, 2017 8.171 |
Having an outpatient visit in the last 12 months |
↓ |
Eff. mod./ conf./ |
↑ |
↑ |
Not in analysis |
Not in analysis |
↑ |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
↑ |
|||||||||
|
Palladino, 2016 56.427 |
Number of medical doctor visits (GP + ED + outpatient visits) during last year |
Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
Not in analysis |
Eff. mod./ conf. |
One effect Eff. mod./conf.(nr of people in household), not reported |
Not in analysis |
||||||||||
|
Van den Bussche, 123.224 |
Number of contacts with ambulatory care physician |
– |
↓ |
↑ |
Not in analysis |
↑ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
|||||||||
|
Number of different physicians contacted within the year |
↑ |
↓ |
↑ |
Not in analysis |
↓ |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
Not in analysis |
||||||||||
|
Variable included in |
5 |
5 |
5 |
1 |
3 |
1 |
1 |
1 |
1 |
2 |
2 |
2 |
2 |
||||||||||
|
Legend: |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
↓ |
|
Significant association with lower RR/OR or negative regression coefficient |
|
|
|
||||||||||||||||||
|
↑ |
|
Significant association with higher RR/OR or positive regression coefficient |
|
|
|
||||||||||||||||||
|
– |
|
No significant association |
|
|
|||||||||||||||||||
|
eff. mod. / conf. |
|
Effect modifier / confounder, no results reported |
|
|
|||||||||||||||||||
Welke patiënt-, socio-economische en zorgkarakteristieken zijn geassocieerd met zorgkosten?
Zorgkosten en multimorbiditeit
Glynn (2011) en Bock (2014) rapporteerden een associatie van een hoger aantal chronische ziektes met hogere zorgkosten. Bock (2014) keek hierbij ook naar verschillende zorgonderdelen en rapporteerde een significante associatie tussen hogere comorbiditeitsscore en hogere totale zorgkosten, hogere arts-gerelateerde kosten en hogere farmaceutische kosten. Daarnaast rapporteerde Bock 2014 ook significant hogere totale en farmaceutische zorgkosten voor patiënten uit het depressiecluster (zie Evidencetabel: Welke patiënten met multimorbiditeit in het ziekenhuis zijn gebaat bij regieondersteuning in bijlage 14).
De review van Wammes (2018) rapporteerde de karakteristieken van patiënten uit de top 5% of top 10% zorgkosten in 55 artikelen. Hierbij werd geen onderscheid gemaakt tussen artikelen die uitsluitende descriptieve factoren omschreven en multivariabele modellen waarbij werd gecorrigeerd voor effectmodificatoren/confounders. Er werden 31 studies en 22 studies gevonden met multimorbiditeit respectievelijk chronisch ziek zijn als karakteristiek van patiënten in de top 5% of top 10% zorgkosten.
De review van Lehnert (2011) rapporteerde het aantal studies dat een associatie rapporteerde tussen meerdere chronische ziektes en de zorgkosten. Zij vonden acht studies die een associatie rapporteerde tussen meerdere chronische condities en jaarlijkse onkosten (één adjusted multivariabel model, één adjusted multivariabel model met uitsluitend medicatie-onkosten als uitkomstvariabele en zes studies waarbij onduidelijk was of het een gecorrigeerd model betrof). Daarnaast rapporteerde negen studies een associatie tussen meerdere chronische ziektes en jaarlijkse zorgkosten, waarbij één studie rapporteerde dat het effect verdween na correctie met de multivariabele analyse. Van de overige acht studies was onduidelijk of dit multivariabele modellen betrof. Als laatste rapporteerde Lehnert (2011) ook vijf studies die een associatie zagen tussen meerdere chronische ziektes en jaarlijkse medicijnkosten (één gecorrigeerde, multivariabele analyse en vier studies waarbij onduidelijk was of het een multivariabel model betrof).
Zorgkosten en andere patiëntkarakteristieken
Bock (2014) vond ook significant hogere kosten voor specifieke zorgonderdelen afhankelijk van leeftijd en geslacht. De totale zorgkosten verschilden niet significant tussen geslacht of leeftijd, maar een hogere leeftijd was wel geassocieerd met significant iets hogere zorgkosten voor verpleging (“nursing care”, 10,90 euro (SE 2,8, p<0.001) euro per 6 maanden per stijging van leeftijd met 1 jaar). Bock (2014) rapporteerde daarnaast dat vrouwen ten opzichte van mannen hogere kosten maakten voor niet-arts gerelateerde zorg (69,90 euro (SE 15,4, p<0.001) euro hoger per 6 maanden). Glynn (2011) includeerde leeftijd en geslacht als effectmodificators/confounders, maar rapporteerde geen resultaten.
Bock (2014) rapporteerde ook dat beter dagelijks functioneren (gemeten met de Barthel index) geassocieerd was met minder totale zorgkosten (-519,70 euro (SE 68,9), p<0.001), minder niet-arts gerelateerde zorgkosten (-7,40 euro (SE 2,1), p<0.001), minder farmaceutische kosten (-11,40 euro (3,9), p<0.01), minder zorgkosten voor verpleging (“nursing care”, -15,90 euro (5,9), p<0.01), en minder kosten voor mantelzorg (“informal care”, -417,30 euro (SE 62,0), p<0.001).
In de review van Wammes (2018) werden met name leeftijd (32 studies), en mentale gezondheid (32 studies) gevonden als karakteristieken die veel voorkwamen bij de patiënten met de top 5 tot 10-% zorgkosten. De andere karakteristieken kunnen worden gevonden in de evidencetabel.
Zorgkosten en socio-economische karakteristieken
Bock (2014) rapporteerde daarnaast dat weduwen 120,20 euro(SE 42,0, p<0.01) euro per 6 maanden meer zorgkosten maakten voor verpleging (“nursing care”) ten opzichte van getrouwde personen. Ook rapporteerde Bock (2014) dat een hoger inkomen geassocieerd was met hogere niet-arts gerelateerde zorgkosten (32,30 euro (SE 11,9, p<0.01) euro per 6 maanden). Als laatste zag Bock (2014) ook dat mensen met een gemiddeld opleidingsniveau significant meer zorgkosten maakten voor niet-arts gerelateerde zorg (44,20 euro (SE 17,5, p<0.05) en hoger opgeleiden significant minder zorgkosten maakten voor medische hulpmiddelen (-67,40 euro (SE 33,6, p<0.05), vergeleken met laag opgeleiden. Glynn (2011) nam als enige studie de soort verzekering mee als effecmodificator/confounder, maar rapporteerde geen resultaten.
Overzicht van alle variabelen die zijn meegenomen in de modellen over zorgkosten
Tabel 7 geeft een overzicht van de verschillende variabelen, in welk model deze zijn opgenomen, inclusief de richting van de gerapporteerde associaties.
Tabel 7 Overzicht van de verschillende geïncludeerde variabelen in de modellen en de associatie met zorgkosten
|
Author N |
Outcome |
Independent variables |
|||||||||
|
Patient characteristics |
Socio-economic characteristics |
||||||||||
|
Sex (female) |
Age (older) |
Nr of chronic conditions (higher) or multimorbidity |
ADL limitations/ nursing dependency |
Social economic status/ deprivation/income/ |
Insurance |
||||||
|
Bähler, 2015 229.493 |
Healthcare costs |
Not compared directly, but used as subgroups. |
↑ (for men), ↓ (for women >75). |
↑ |
↑ |
↓ |
↓ |
||||
|
Glynn, 2011 3.309 |
Healthcare costs |
Eff. mod./ conf. |
Eff. mod./ conf. |
↑ |
Not in analysis |
Not in analysis |
Eff. mod./ conf. |
||||
|
Variable included in |
2 |
2 |
2 |
1 |
1 |
2 |
|||||
|
Legend: |
|
|
|
|
|
|
|||||
|
↓ |
Significant association with lower RR/OR or negative regression coefficient |
||||||||||
|
↑ |
Significant association with higher RR/OR or positive regression coefficient |
||||||||||
|
– |
No significant association |
||||||||||
|
eff. mod. / conf. |
Effect modifier / confounder, no results reported |
||||||||||
Bewijskracht van de literatuur
De onderliggende vraag (indicatiestelling: welke patiënt is gebaat bij regieondersteuning?) is een therapeutische vraag, op basis van de karakteristieken zou men immers indien mogelijk een beslissing willen nemen om wel of geen regieondersteuning aan te bieden. Om de vraag te beantwoorden moeten de belangrijkste prognostische factoren in kaart worden gebracht. De bewijskracht is gebaseerd op observationeel onderzoek en systematische reviews van observationeel onderzoek en start derhalve op laag.
Aantal chronische ziektes
De bewijskracht voor de associatie van aantal chronische ziektes met de uitkomstmaat hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten) is niet met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), omdat de risk of bias reeds verwerkt is in het startpunt van de bewijskracht (laag).
De bewijskracht voor de associatie van aantal chronische ziektes met de uitkomstmaat hoog zorgverbruik is met 1 niveau verhoogd gezien het consistente, grote effect in verschillende studies met gezamenlijk een grote hoeveelheid patiënten.
Specifieke clusters multimorbiditeit
De bewijskracht voor de associatie van specifieke clusters multimorbiditeit met de uitkomstmaat acuut zorgverbruik (ziekenhuisopnames en SEH-bezoeken) en doktersbezoeken is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) vanwege missende confounders en beperkingen in de statistische analyse.
Geslacht
De bewijskracht voor de associatie van geslacht met de uitkomstmaat hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten) is niet nogmaals met 1 niveau verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias), omdat de beperkingen zeer waarschijnlijk geen vertekening hebben gegeven van het effect van geslacht op de uitkomstmaat hoog zorgverbruik. De bewijskracht voor de uitkomstmaat aantal doktersbezoeken is apart met 1 niveau verlaagd gezien de tegenstrijdige resultaten (inconsistentie).
Leeftijd
De bewijskracht voor de associatie van leeftijd met de uitkomstmaat hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten) is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) van sommige studies: er werd niet gecorrigeerd voor eventuele aanwezigheid van kwetsbaarheid (frailty) en/of beperkingen in het dagelijks functioneren. Daarnaast was er sprake van tegenstrijdige resultaten (inconsistentie).
Etniciteit
De bewijskracht voor de associatie van etniciteit met de uitkomst hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten) is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), vanwege beperkingen in de statistische analyse in 1 onderzoek en onvoldoende corrigeren voor confounders van het effect van etniciteit.
Dagelijks functioneren (ADL beperkingen /zorgafhankelijkheid)
De bewijskracht voor de associatie van dagelijks functioneren (ADL beperkingen/ zorgafhankelijkheid) met de uitkomst acuut zorgverbruik door ziekenhuisopnames en doktersbezoeken is niet met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), er werd niet in alle studies gecorrigeerd voor kwetsbaarheid (frailty) maar wel voor leeftijd en aantal chronische ziektes. Daarnaast kan door andere beperkingen in de onderzoeksopzet (zelfgerapporteerd aantal chronische ziektes, overrepresentatie van mannen en respons op een enquête per post) het effect onderschat zijn, terwijl er toch een effect gemeten werd in studies met voldoende aantallen.
De bewijskracht voor de associatie van dagelijks functioneren (ADL beperkingen/ zorgafhankelijkheid met de uitkomst hoog zorgverbruik door SEH-bezoeken en zorgkosten is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, zie reden hierboven) en het geringe aantal patiënten (imprecisie).
Polyfarmacie
De bewijskracht voor de associatie van polyfarmacie met doktersbezoeken is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), vanwege niet corrigeren voor confounders kwetsbaarheid (frailty) en dagelijks functioneren, en het geringe aantal patiënten (imprecisie).
Kwetsbaarheid
De bewijskracht voor de associatie van kwetsbaarheid (frailty) met de uitkomst acuut zorgverbruik door ziekenhuisopnames en doktersbezoeken is met 1 niveau verlaagd, gezien beperkingen in de onderzoeksopzet (risk of bias) had vanwege zelfrapportage van chronische ziektes (potentiële onderschatting van aantal chronische ziektes) en zelfrapportage van doktersbezoeken (met potentiële onder- of overschatting van aantal doktersbezoeken).
Opleidingsniveau
De bewijskracht voor de associatie van opleidingsniveau met de uitkomst hoog zorgverbruik (ziekenhuisopnames, spoedeisende hulpbezoeken, aantal doktersbezoeken en zorgkosten) is met 2 niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en het geringe aantal patiënten (imprecisie).
Socio-economische status (inclusief armoede/inkomen/werkstatus)
De bewijskracht voor de associatie van socio-economische status met acuut zorgverbruik (spoedeisende hulpbezoeken en ziekenhuisopnames) is met 1 niveau verlaagd gezien tegenstrijdige resultaten (inconsistentie). De bewijskracht voor de associatie van socio-economische status met hoog zorgverbruik (doktersbezoeken/zorgkosten) is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, bij doktersbezoeken) en het geringe aantal patiënten (imprecisie, bij zorgkosten).
Burgerlijke staat
De bewijskracht voor de associatie van burgerlijke staat met hoog zorgverbruik is met 1 niveau verlaagd gezien beperkingen het geringe aantal patiënten (imprecisie).
Verzekering
De bewijskracht voor de associatie van burgerlijke staat met de uitkomstmaat doktersbezoeken is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie). De bewijskracht voor de associatie van burgerlijke staat met uitkomstmaat acuut zorgverbruik (spoedeisende hulpbezoeken en ziekenhuisopnames) is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias).
Aantal doktersbezoeken
De bewijskracht voor de associatie van aantal doktersbezoeken met de uitkomstmaat acuut zorgverbruik (spoedeisende hulpbezoeken en ziekenhuisopnames) is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), door onvoldoende corrigeren voor confounders voor doktersbezoeken, het zelf rapporteren van aantal doktersbezoeken door patiënten en beperkingen doordat het tijdstip van het meten van predictor/outcome onduidelijk was.
Zoeken en selecteren
Om de deelvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar observationele studies met de volgende zoekvraag:
Welke patiënt-, socio-economische en zorgkarakteristieken zijn geassocieerd met hoog zorgverbruik of lage patiënttevredenheid?
Patiënt: Volwassen patiënten (18 jaar en ouder) die gebruik maken van ziekenhuiszorg in een land met een hoog inkomen economie
Exposure:
Patiëntkarakteristieken: leeftijd, geslacht, etniciteit, aantal chronische ziektes, aantal medicijnen, dagelijks functioneren, gezondheidsstatus, gezondheidsvaardigheden, kwaliteit van leven, aanwezigheid van specifiek chronische ziekte cluster, levensverwachting
Socio-economische karakteristieken: socio-economische status, werkstatus, leefsituatie, burgerlijke staat, opleidingsniveau, inkomen
Zorgkarakteristieken: aantal betrokken medisch specialisten, aantal consulten met medisch specialisten, aantal consulten met huisarts, aantal spoedeisende hulpbezoeken, aantal ziekenhuisopnames
Outcome: Veel zorgverbruik of lage patiënttevredenheidsscore over de zorg voor chronische ziektes / continuïteit van zorg / zorgcoördinatie
* Onder veel zorgverbruik kan verstaan worden aantal polikliniekbezoeken bij medisch specialisten, overmatige, onnodige of dubbele diagnostiek/afspraken, aantal spoedeisende hulpbezoeken, aantal en duur van ziekenhuisopnames en hogere kosten. De werkgroep definieerde niet a priori wat verstaan werd onder veel zorgverbruik, maar hanteerde de in de studies gebruikte definities of verschillen. Bij de selectie werd echter niet beperkend geselecteerd op deze onderdelen.
Om aanbevelingen te kunnen formuleren hoe patiënten met multimorbiditeit die mogelijk baat zouden hebben bij regieondersteuning herkend zouden kunnen worden, koos de werkgroep voor hoog zorgverbruik als uitkomstmaat. Hoog zorgverbruik kan namelijk als aanwijzing worden gezien dat er mogelijk behoefte zou kunnen zijn aan regieondersteuning om zorg beter af te stemmen en coördineren en zo potentieel vermijdbare zorg(uitkomsten) te voorkomen. Deze aanwijzing werkt meerdere kanten op: acuut zorgverbruik is een ongewenste uitkomst waarvan je het risico erop wil verlagen, acuut zorgverbruik en meer doktersbezoeken geven een hoger risico op fragmentatie van zorg en hoog zorgverbruik in het algemeen geeft hogere zorgkosten.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 14 mei 2019 met relevante zoektermen gezocht naar (systematische reviews van) observationeel onderzoek, waarbij werd gekozen om te zoeken op de uitkomstmaten plus multimorbiditeit. De zoekverantwoording is weergegeven in bijlage 12. De literatuurzoekactie leverde 310 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- (Systematische review van) observationeel onderzoek met een multivariaat model;
- Volwassen patiënten (18 jaar en ouder) die ziekenhuiszorg verbruiken (algemene populatie zonder gespecificeerde ziekte, of specifieke populatie gebaseerd op leeftijd, zorgverbruik of aanwezigheid van chronische ziektes (zonder 1 specifieke index-ziekte));
- Onderzoek uit een land met een hoog-inkomen economie (zoals gedefinieerd door The World Bank, https://data.worldbank.org/country/XD);
- Tenminste meerdere (chronische) ziektes of multimorbiditeit als populatiebeschrijving (zonder 1 specifieke index-ziekte) of als exposure;
- Tenminste één van de genoemde uitkomstmaten wordt gerapporteerd.
- Geschreven in het Nederlands of Engels.
Op basis van titel en abstract werden in eerste instantie 67 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 51 studies geëxcludeerd (zie exclusietabel in bijlage 13), en 18 studies definitief geselecteerd. Twee studies rapporteerden over dezelfde populatie en zijn meegenomen als 1 studie.
Resultaten
Achttien studies zijn opgenomen in de literatuuranalyse. Twaalf studies zijn observationele studies die een algemene populatie includeerden, vier observationele studies en twee systematische reviews selecteerden een populatie met specifiek zorgverbruik of met multimorbiditeit/meerdere chronische ziektes zonder één specifieke index-ziekte. Met een populatie met meerdere chronische ziektes zonder één specifieke index-ziekte werd bedoeld een populatie die werd geselecteerd op het aantal chronische ziektes, maar waarbij niet geselecteerd werd vanuit de aanwezigheid van een specifieke aandoening.
Van de twaalf observationele studies die een algemene populatie includeerden, includeerden twee studies patiënten van 18 jaar en ouder (Agborsangaya, 2013; Milani, 2016). Vier studies includeerden patiënten van 50 jaar en ouder (Ilinca, 2015; Palladino, 2016; Glynn, 2011; Kennedy, 2017), één studie includeerde personen van 65 jaar en ouder (van den Bussche, 2011), één studie includeerde alleen Afrikaans-Amerikaanse personen van 65 jaar en ouder (Bazargan, 2019), één studie includeerde alleen mannen van 65 jaar en ouder die meededen aan een osteoporose-onderzoek (Ensrud, 2018), één studie uit Nieuw-Zeeland (Teh, 2018) includeerde personen van Maori afkomst van 80-90 jaar of van precies 85 jaar (non-Maori) en één studie includeerde ouderen van 85 jaar en ouder (Nägga, 2012). Eén studie uit het Verenigd Koninkrijk (Hull, 2018) includeerde alle patiënten met gelinkte data uit de eerste lijn en de spoedeisende hulp in het ziekenhuis, ongeacht de leeftijd en het zorgverbruik. Ondanks dat deze studie kinderen includeerde, is deze toch meegenomen omdat de voorspellende factoren apart voor volwassenen en voor kinderen zijn geanalyseerd.
Er werden vier observationele studies en twee systematische reviews van observationele studies geselecteerd die een populatie hebben geïncludeerd met een specifiek zorgverbruik of specifiek met chronische ziektes zonder één indexziekte te selecteren. Eén studie uit de Verenigde Staten (Abernathy, 2016) includeerde alle patiënten met minimaal twee bezoeken aan een eerstelijns arts. Wagner (2019) includeerde alle overleden patiënten met ten minste één chronische ziekte. Bock (2014) includeerde oudere patiënten (tussen 65-85 jaar) met drie of meer chronische ziektes. Eén studie includeerde alle SEH-bezoekers (Cunningham, 2017). De systematische review van Wammes (2018) includeerde alleen de studies met patiënten met hoge zorgkosten. De systematische review van Lehnert (2011) includeerde studies met een oudere populatie, multimorbiditeit als verklarende variabele en zorgverbruik als primaire uitkomst.
De geselecteerde studies observeerden dus verschillende subgroepen binnen de algemene populatie. Deze verschillende subgroepen overlappen met elkaar en representeren verschillende benaderingen die de onderzoekers hebben gebruikt. In figuur 1 is een visuele simulatie van de overlap opgenomen, inclusief het aantal studies dat is gevonden.
Figuur 1. Gesimuleerde overlap tussen de subgroepen in de verschillende studies. NB.: de overlap tussen de groepen komt niet overeen met daadwerkelijke cijfers of verhoudingen, dit is een visuele weergave om te laten zien dát er overlap is, niet hoeveel.
Er werden geen studies gevonden die rapporteerden over de associatie van patiënt, socio-economische en zorgkarakteristieken met lage patiënttevredenheid.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Abernathy, K., Zhang, J., Mauldin, P., Moran, W., Abernathy, M., Brownfield, E., & Davis, K. (2016). Acute Care Utilization in Patients With Concurrent Mental Health and Complex Chronic Medical Conditions. Journal of Primary Care & Community Health, 7(4), 226–233. https://doi.org/10.1177/2150131916656155
- Agborsangaya, C. B., Lau, D., Lahtinen, M., Cooke, T., & Johnson, J. A. (2013). Health-related quality of life and healthcare utilization in multimorbidity: Results of a cross-sectional survey. Quality of Life Research, 22(4), 791–799. https://doi.org/10.1007/s11136-012-0214-7
- Bazargan, M., Smith, J. L., Cobb, S., Barkley, L., Wisseh, C., Ngula, E., Thomas, R. J., & Assari, S. (2019). Emergency Department Utilization among Underserved African American Older Adults in South Los Angeles. International Journal of Environmental Research and Public Health, 16(7). https://doi.org/10.3390/ijerph16071175
- Bock, J. O., Luppa, M., Brettschneider, C., Riedel-Heller, S., Bickel, H., Fuchs, A., Gensichen, J., Maier, W., Mergenthal, K., Schäfer, I., Schön, G., Weyerer, S., Wiese, B., Van Den Bussche, H., Scherer, M., & König, H. H. (2014). Impact of depression on health care utilization and costs among multimorbid patients—Results from the multicare cohort study. PLoS ONE, 9(3). https://doi.org/10.1371/journal.pone.0091973
- Cunningham, A., Mautner, D., Ku, B., Scott, K., & LaNoue, M. (2017). Frequent emergency department visitors are frequent primary care visitors and report unmet primary care needs. Journal of Evaluation in Clinical Practice, 23(3), 567–573. https://doi.org/10.1111/jep.12672
- Ensrud, K. E., Lui, L. Y., Langsetmo, L., Vo, T. N., Taylor, B. C., Cawthon, P. M., Kilgore, M. L., McCulloch, C. E., Cauley, J. A., Stefanick, M. L., Yaffe, K., Orwoll, E. S., Schousboe, J. T., & Osteoporotic Fractures in Men Study, G. (2018). Effects of Mobility and Multimorbidity on Inpatient and Postacute Health Care Utilization. Journals of Gerontology Series A-Biological Sciences & Medical Sciences, 73(10), 1343–1349. https://doi.org/10.1093/gerona/glx128
- Glynn, L. G., Valderas, J. M., Healy, P., Burke, E., Newell, J., Gillespie, P., & Murphy, A. W. (2011). The prevalence of multimorbidity in primary care and its effect on health care utilization and cost. Family Practice, 28(5), 516–523. https://doi.org/10.1093/fampra/cmr013
- Heijmans, M., & Waverijn, G. (2014). Gezondheidsvaardigheden van chronische zieken belangrijk voor zelfmanagement. NIVEL. https://www.nivel.nl/sites/default/files/bestanden/Gezondheidsvaardigheden_chronische_zieken_belangrijk_zelfmanagement.pdf
- Hull, S. A., Homer, K., Boomla, K., Robson, J., & Ashworth, M. (2018). Population and patient factors affecting emergency department attendance in London: Retrospective cohort analysis of linked primary and secondary care records. British Journal of General Practice, 68(668), e157–e167. https://doi.org/10.3399/bjgp18X694397
- Ilinca, S., & Calciolari, S. (2015). The patterns of health care utilization by elderly Europeans: Frailty and its implications for health systems. Health Services Research, 50(1), 305–320. https://doi.org/10.1111/1475-6773.12211
- Kennedy, N., O’Sullivan, K., Hannigan, A., & Purtill, H. (2017). Understanding pain among older persons: Part 2-the association between pain profiles and healthcare utilisation. Age and Ageing, 46(1), 51–56. https://doi.org/10.1093/ageing/afw128
- Lehnert, T., Heider, D., Leicht, H., Heinrich, S., Corrieri, S., Luppa, M., Riedel-Heller, S., & Konig, H. H. (2011). Review: Health care utilization and costs of elderly persons with multiple chronic conditions. Medical Care Research & Review, 68(4), 387–420. https://doi.org/10.1177/1077558711399580
- Leigh-Hunt, N., Bagguley, D., Bash, K., Turner, V., Turnbull, S., Valtorta, N., & Caan, W. (2017). An overview of systematic reviews on the public health consequences of social isolation and loneliness. Public Health, 152, 157–171. https://doi.org/10.1016/j.puhe.2017.07.035
- Marengoni, A., Angleman, S., Melis, R., Mangialasche, F., Karp, A., Garmen, A., Meinow, B., & Fratiglioni, L. (2011). Aging with multimorbidity: A systematic review of the literature. Ageing Research Reviews, 10(4), 430–439. https://doi.org/10.1016/j.arr.2011.03.003
- Milani, S. A., Crooke, H., Cottler, L. B., & Striley, C. W. (2016). Sex differences in frequent ED use among those with multimorbid chronic diseases. American Journal of Emergency Medicine, 34(11), 2127–2131. https://doi.org/10.1016/j.ajem.2016.07.059
- Nägga, K., Dong, H. J., Marcusson, J., Skoglund, S. O., & Wressle, E. (2012). Health-related factors associated with hospitalization for old people: Comparisons of elderly aged 85 in a population cohort study. Archives of Gerontology and Geriatrics, 54(2), 391–397. https://doi.org/10.1016/j.archger.2011.04.023
- National Academies of Sciences, Engineering, and Medicine, Health and Medicine Division, Board on Health Care Services, & Committee on Health Care Utilization and Adults with Disabilities. (2018). Health-Care Utilization as a Proxy in Disability Determination. National Academies Press (US). http://www.ncbi.nlm.nih.gov/books/NBK500102/
- Palladino, R., Tayu Lee, J., Ashworth, M., Triassi, M., & Millett, C. (2016). Associations between multimorbidity, healthcare utilisation and health status: Evidence from 16 European countries. Age & Ageing, 45(3), 431–435. https://doi.org/10.1093/ageing/afw044
- Prados-Torres, A., Calderón-Larrañaga, A., Hancco-Saavedra, J., Poblador-Plou, B., & van den Akker, M. (2014). Multimorbidity patterns: A systematic review. Journal of Clinical Epidemiology, 67(3), 254–266. https://doi.org/10.1016/j.jclinepi.2013.09.021
- Sørensen, K., Maindal, H. T., Heijmans, M., & Rademakers, J. (2020). Work in Progress: A Report on Health Literacy in Denmark and the Netherlands. Studies in Health Technology and Informatics, 269, 202–211. https://doi.org/10.3233/SHTI200033
- Valderas, J. M., Gangannagaripalli, J., Nolte, E., Boyd, C., Roland, M., Sarria‐Santamera, A., Jones, E., & Rijken, M. (2019). Quality of care assessment for people with multimorbidity. Journal of Internal Medicine. https://doi.org/10.1111/joim.12881
- van den Bussche, H., Schön, G., Kolonko, T., Hansen, H., Wegscheider, K., Glaeske, G., & Koller, D. (2011). Patterns of ambulatory medical care utilization in elderly patients with special reference to chronic diseases and multimorbidity–results from a claims data based observational study in Germany. BMC Geriatrics, 11, 54. https://doi.org/10.1186/1471-2318-11-54
- Wagner, E., Patrick, D. L., Khandelwal, N., Brumback, L., Starks, H., Fausto, J., Dunlap, B. S., Lober, W., Sibley, J., Loggers, E. T., Curtis, J. R., & Engelberg, R. A. (2019). The Influence of Multimorbidity on Health Care Utilization at the End of Life for Patients with Chronic Conditions. Journal of Palliative Medicine. https://doi.org/10.1089/jpm.2018.0349
- Wammes, J. J. G., van der Wees, P. J., Tanke, M. A. C., Westert, G. P., & Jeurissen, P. P. T. (2018). Systematic review of high-cost patients’ characteristics and healthcare utilisation. BMJ Open, 8(9), e023113. https://doi.org/10.1136/bmjopen-2018-023113
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-04-2021
Algemene gegevens
De ontwikkeling van dit adviesrapport werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van het adviesrapport is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die vaak betrokken zijn bij de zorg voor patiënten met multimorbiditeit in het ziekenhuis.
Werkgroep:
- Mw. prof. dr. B.C. van Munster, internist-geriater, voorzitter, namens de Nederlandse Internisten Vereniging (NIV), sectie ouderengeneeskunde
- Mw. drs. O.M. Smit, internist-ouderengeneeskunde, voorzitter, namens de Nederlandse Internisten Vereniging (NIV), sectie ouderengeneeskunde
- Dhr. drs. A.J. Arends, klinisch geriater bij Havenue/Maasstadziekenhuis, voorzitter Nederlandse Vereniging voor Klinische Geriatrie (NVKG) namens de NVKG
- Mw. W.M.E. Bil, MANP, verpleegkundig specialist AGZ, namens de Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Mw. drs. A.M.J. Coremans, internist, namens de Nederlandse Internisten Vereniging (NIV)
- Dhr. drs. C. van Daelen, adviseur Patiëntbelang, namens de Patiëntenfederatie Nederland (PFNL)
- Mw. drs. M. Maas, revalidatiearts, namens de Nederlandse Vereniging van Revalidatiesartsen (VRA)
- Mw drs. E.M. Meulenberg, klinisch geriater Elisabeth-Tweesteden Ziekenhuis, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
Met ondersteuning van:
- Mw. M. Verhoeff, MSc., adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dhr. Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Mw. D. Tennekes, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Bij het opstellen van dit document heeft de volgende persoon namens zijn partij meegelezen als agendalid:
- Dhr. prof. dr. J.S. Burgers, hoofd afdeling Richtlijnontwikkeling & Wetenschap Nederlands Huisartsen Genootschap (NHG), Bijzonder hoogleraar ‘Promoting Personalised Care in Clinical Practice Guidelines’ aan de Faculty of Health, Medicine and Life Sciences (FHML) van de Universiteit Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Meijer-Smit* |
Internist ouderengeneeskunde, Zaans Medisch Centrum |
Bestuurslid NIV Ouderengeneeskunde |
Geen |
Geen actie |
|
04/2015 - heden: Universitair Medisch Centrum Groningen te Groningen (20%), vanaf 2019 fulltime 2019 - heden: Hoogleraar Interne Geneeskunde, ihb. Ouderengeneeskunde/Geriatrie 2019 - heden: Plaatsvervangend opleider geriatrie 2010 – 2019 Afdeling Geriatrie, Gelre Ziekenhuizen te Apeldoorn (80%): 2017 - 2019: Voorzitter expertise centrum ouderengeneeskunde (ECO) 2017 - 2019: Opleider stage interne ouderengeneeskunde 2016 - 2017: Voorzitter werkgroep toekomstgerichte chronische zorg 2014 - 2019 Medisch manager vakgroep geriatrie 2014 - 2019 Bestuurslid Commissie chronische zorg 2010 - 2019 Wetenschappelijke Advies Raad, vanaf 2018 voorzitter• 2017 - 2019: Opleider stage interne ouderengeneeskunde |
Onbetaalde nevenwerkzaamheden: 2020 - heden Voorzitter Alzheimer Centrum Groningen 2020 - heden Afgevaardigde NIV DHFA 2020 - heden Board member ‘European Academy of Medicine of Ageing’ 2019 - heden Expertgroep ‘Aging Academy' 2016 - heden Voorzitter (2019 lid) werkgroep kwaliteit en richtlijnen, kerngroep ouderengeneeskunde 2016 - heden Redacteur 'Tijdschrift gerontologie en geriatrie' 2017 - heden Lid platform kwaliteit NIV namens kerngroep ouderengeneeskunde 2015 - heden Lid werkgroep wetenschap Nederlandse Vereniging Klinische Geriatrie |
Regievoering bij multimorbiditeit is een van mijn aandachtsgebieden binnen de zorg en mijn onderzoekslijn |
Geen actie |
|
|
Bil |
Verpleegkundig specialist AGZ, fulltime werkzaam bij OLVG sinds 2018 (2011-2018 MC Slotervaart) |
Gastdocent (betaald) Lid-beroepsgenoot Regionaal Tuchtcollege voor de Gezondheidszorg te Den Haag (betaald) Lid Landelijk Netwerk Klinische Geriatrie (V&VN) Onbetaald Lid/vicevoorzitter Landelijk Verpleegkundig Specialisten Klinische Geriatrie (V&VN VS) (onbetaald) Lid werkgroep/lid begeleidingscommissie Doorontwikkeling signaleringsinstrument oudermishandeling (VWS) (vacatiegelden) Lid Codecommissie geneesmiddelen en hulpmiddelen (GMH) (vactiegelden) Lid Kamer Verpleegkundig specialisten Capaciteitsorgaan (vacatiegelden) |
Geen |
Geen actie |
|
klinisch geriater, Maasstadziekenhuis en medisch manager |
voorzitter NVKG (vacatiegelden) vanaf 5-2-2019 secretaris kwaliteit NVKG (vacatiegelden) tot 5-2-2019 Secretaris bestuur Dutch Hip Fracture Audit (vacatiegelden) voorzitter project Modulair onderhoud (vacatiegelden) tot 31-12-2020 |
Geen |
Geen actie |
|
|
Van Daelen |
Programma-coördinator Kwaliteitsgelden Patiëntenfederatie bij Patiëntenfederatie Nederland (ca 28 uur/week) Adviseur Patiëntenbelang bij Patiëntenfederatie Nederland (ca. 4 uur/week) |
Geen |
Geen |
Geen actie |
|
Coremans |
Internist MedischLeider Chronische Zorg |
Geen |
In Bernhoven betrokken bij het opzetten van een poli Intensieve Chronische Zorg |
Geen actie |
|
Maas |
Revalidatiearts, contract bij klimmendaal. Volledig gedetacheerd naar Gelre ziekenhuizen |
Lid VRA, Werkgroep WCN, bijeenkomst ziekenhuis revalidatie (allemaal ontbetaald) |
Geen |
Geen actie |
|
Meulenberg |
Klinisch geriater, Elisabeth TweeSteden ziekenhuis |
Detachering vanuit ETZ naar NVKG, kwaliteitszaken |
Geen |
Geen actie |
|
Verhoeff |
Adviseur bij het Kennisinstituut van Federatie Medisch Specialisten |
Promotieonderzoek naar multimorbiditeit, regie en zorgorganisatie in het ziekenhuis (gefinancierd door het Kennisinstituut) |
Geen |
Geen actie |
|
Barneveld |
Algemeen Directeur Kennisinstituut van de Federatie Medisch Specialisten |
Raad van Advies SKML |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een invitational conference voor patiëntenverenigingen in samenwerking met de Patiëntenfederatie Nederland, een focusgroep, een afgevaardigde patiëntenvereniging in de werkgroep en een schriftelijke inventarisatie door de Patiëntenfederatie Nederland. De verslagen hiervan [zie bijlagen] zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. Het concept adviesrapport is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een enquête onder medisch specialisten en een schriftelijke inventarisatie onder patiëntenorganisaties. Tevens zijn er knelpunten aangedragen via invitational conferences voor wetenschappelijke verenigingen en patiëntenorganisaties. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
