Overkoepelende en afgestemde behandeling bij multimorbiditeit en regie in het ziekenhuis
Uitgangsvraag
Hoe bereik je een overkoepelende en afgestemde behandeling voor patiënten met multimorbiditeit die bij meerdere specialisten in het ziekenhuis komen?
Aanbeveling
Overweeg, om een overkoepelende en afgestemde behandeling te bereiken bij patiënten met behoefte aan regieondersteuning, de volgende organisatorische interventie:
- het verbeteren of bevorderen van de interdisciplinaire aanpak (bijv. meer multidisciplinaire zorg/samenwerking)
en/of
- het aanbieden van een meer patiëntgerichte aanpak (bijv. individueel behandelplan, holistisch assessment)
Zorg er bij een overkoepelende en afgestemde behandeling voor dat:
- Het duidelijk is welke haalbare doelen worden nagestreefd;
- Alle voor en tegens van de verschillende ingezette behandelingen (inclusief medicatie) zijn afgewogen in het licht van de doelen, voorkeuren, behoeften en omstandigheden van de patiënt (volgens het model van samen beslissen);
- Indien er potentiële interacties van ziektes, medicatie en/of leefstijladviezen zijn, duidelijk is welke dat zijn, deze zijn afgewogen en een helder besluit hierover is genomen;
- Er een duidelijk plan is voor de toekomstige, geplande zorg, inclusief reden (van bijvoorbeeld controle/follow-up of behandeling) en de nagestreefde doelen;
- Er onderlinge afstemming is geweest onder de diverse behandelaren.
N.B. De behandelaar die zorg draagt voor de overkoepelende en afgestemde behandeling neemt het voortouw in de afstemming van alle behandelingen, maar neemt niet standaard de inhoud van alle behandelingen over. Iedere betrokken behandelaar blijft verantwoordelijk voor zijn eigen deel en inhoud van de behandelingen en de afstemming daarover met andere behandelaren.[1]
Evalueer de effectiviteit van een overkoepelende en afgestemde behandeling niet alleen op basis van ziekte-gerelateerde uitkomstmaten, maar ook op basis van de verwachte opbrengst ten aanzien van:
- Patiënt- en zorgverlenerstevredenheid over de afstemming van de zorg;
- Gepaster zorgverbruik (bijv. door minder over-/onderbehandeling) en advance care planning;
- Verminderde kans op farmacotherapie-gerelateerde problemen en de verandering in medicatie, aantal medicijnen en doseringen;
- Duidelijkheid over de rol van iedere behandeling en iedere behandelaar in het geheel
[1] De werkgroep heeft bewust gekozen voor de term regieondersteuning (mede op basis van input vanuit patiënten(organisaties)) en de verschillende rollen en doelen die hierbij passend zijn. De juridische inpassing van regieondersteuning in het Nederlandse zorglandschap en de consequenties voor termen als ‘hoofdbehandelaar’ en ‘regiebehandelaar’ zal moeten volgen.
Overwegingen
Uit de literatuur weten we dat patiënten met multimorbiditeit gemiddeld genomen een groter risico hebben op een lagere kwaliteit van leven, verminderd dagelijks functioneren en mortaliteit. (Makovski, 2019; Marengoni, 2011) De relatie tussen de kwaliteit van zorg en multimorbiditeit is echter complex, en lijkt afhankelijk van verschillende factoren, zoals onder andere het “soort” multimorbiditeit. (Valderas, 2019) Voor verschillende enkelvoudige chronische ziektes is de effectiviteit van geïntegreerde zorgprogramma’s (in Nederland beter bekend als ketenzorg) reeds aangetoond (Kruis, 2013; Peytremann-Brideveaux, 2015; Pimouguet, 2011). Deze zorgprogramma’s passen echter niet volledig bij de zorgbehoeftes van de patiënt met multimorbiditeit, omdat deze programma’s nog steeds de focus leggen op slechts één ziekte. (Nolte, 2012) Geïntegreerde zorg voor patiënten met multimorbiditeit in het ziekenhuis betekent onder andere dat er ook overkoepelend naar behandelingen gekeken zou moeten worden, naar mogelijke interacties tussen ziektes, medicijnen en behandelingen, en dat er prioriteiten gesteld worden op basis van op de patiënt afgestemde, haalbare doelen. (AGS, 2012)
Overkoepelende effectiviteit van organisatorische interventies met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit
De NICE-richtlijn van Barnett (2016), de Cochrane review van Smith (2016) en de RCT van Salisbury (2018) onderzochten de effectiviteit van organisatorische interventies met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg maar laten geen eenduidig bewijs zien voor effectiviteit op alle uitkomstmaten. Alleen de onderzoeken naar patiënttevredenheid laten allen dezelfde positieve richting zien voor het effect van de interventies. Voor andere uitkomstmaten werden wisselende effecten gerapporteerd. Verbeterde uitkomstmaten werden met name gezien bij interventies die zich specifiek richtten op het verbeteren van deze uitkomstmaat (zoals depressieve symptomen bij co-morbide depressie) of bij interventies die zich specifiek richtten op een populatie met een verhoogd risico op een uitkomstmaat (zoals verminderd dagelijks functioneren bij ouderen van 80 jaar en ouder of van 65 jaar met ADL beperking in 1 domein).
In de door de werkgroep gevonden studies werd voor de belangrijke (ziekte-gerelateerde) uitkomstmaten als dagelijks functioneren, mentale gezondheid, kwaliteit van leven en mortaliteit weinig bewijs gevonden voor de effectiviteit van een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit. Het is echter de vraag of de verwachting juist is dat ziekte-gerelateerde uitkomstmaten en kwaliteit van leven voor de gehele groep patiënten met multimorbiditeit direct significant verbeterd kunnen worden door een enkele organisatorische interventie.
De denkstappen uit de Logical Framework Approach (Nancholas, 1998) helpen om het antwoord op deze vraag te formuleren. De Logical Framework wordt gebruikt voor projectplanning, om van het overkoepelende naar het specifieke toe te werken. Een belangrijk onderscheid dat hierbij gemaakt wordt is het onderscheid tussen het overkoepelende doel van het project en het specifieke doel/de specifieke doelen van het project, en daaraan gekoppeld de objectief meetbare indicatoren (Objectively Verifiable Indicators (OVI)). Het overkoepelende doel van de projecten rondom multimorbiditeit is ‘geïntegreerde zorg’, wat resulteert in verbeterde kwaliteit van zorg en kwaliteit van leven voor deze patiënten. Een organisatorische interventie zoals een overkoepelende en afgestemde behandeling is één van de specifieke doelen die kunnen bijdragen aan het bereiken van dit overkoepelende doel. Maar volgens het Logical Framework moet voor een specifiek doel ook specifieke opbrengst (gemeten met eigen objectief meetbare indicatoren) worden geformuleerd om het succes van een project te evalueren. Het specifieke doel draagt bij aan het overkoepelende doel, maar het overkoepelende doel wordt niet altijd direct binnen het project behaald en gemeten aan de hand van indicatoren die voor het overkoepelende resultaat zijn geformuleerd. Figuur 2 geeft de verhouding tussen het overkoepelend doel en resultaat en de verschillende specifieke doelen met hun eigen directe opbrengst, op basis van de Logical Framework Approach.
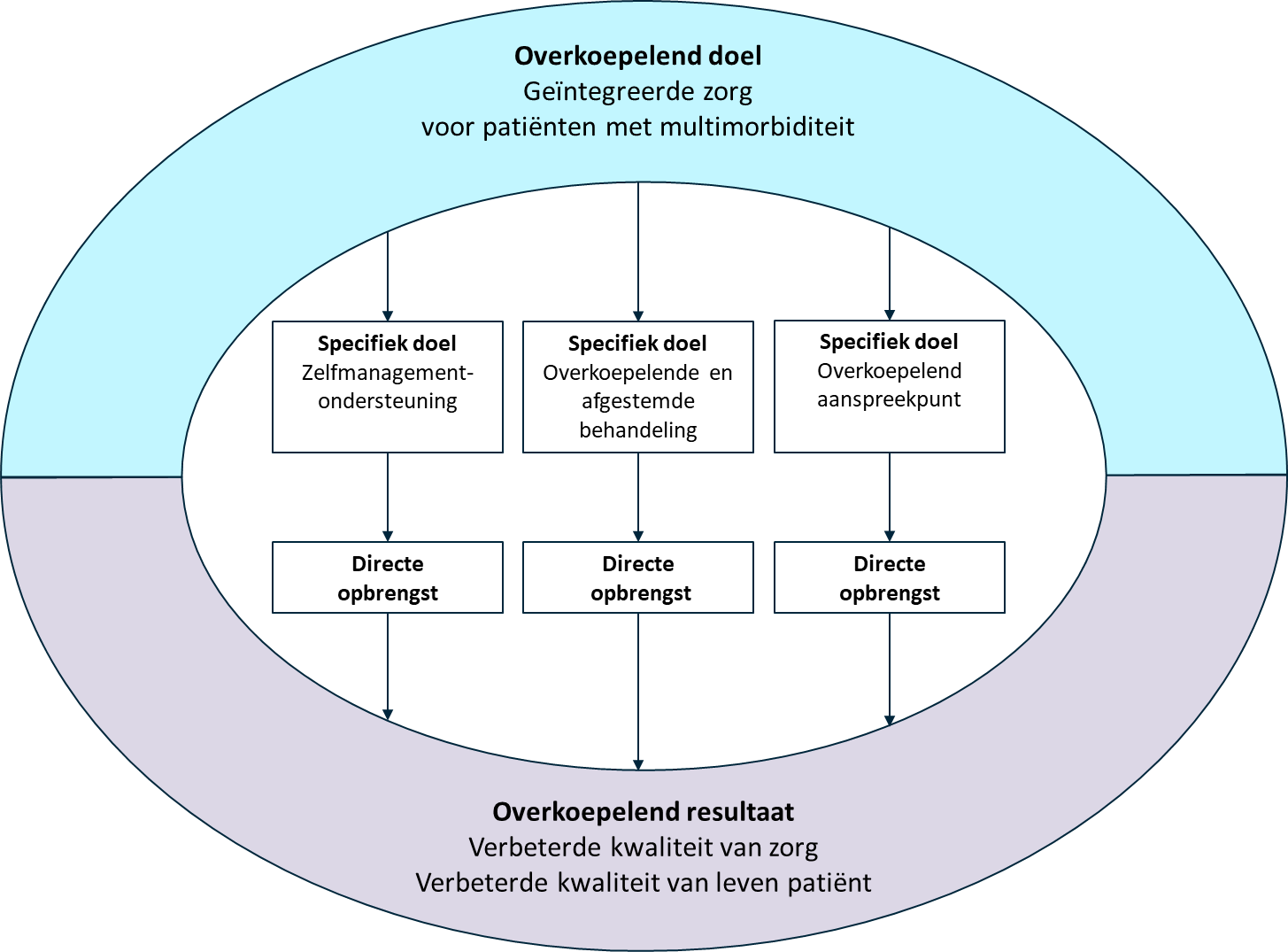
Figuur 2. Verhouding tussen het overkoepelend doel ‘Geïntegreerde zorg voor patiënten met multimorbiditeit’, de specifieke doelen met hun eigen directe opbrengst en het overkoepelend resultaat, gebaseerd op de Logical Framework Approach (Nancholas, 1998).
Een organisatorische interventie heeft primair als doel de zorgorganisatie te verbeteren. De aanname is dat een verbeterde zorgorganisatie voor patiënten met multimorbiditeit in eerste instantie zal leiden tot meer tevredenheid over de zorg, meer doelmatige zorg en meer passend zorgverbruik als specifieke opbrengst. Waarschijnlijk zal een verbeterde zorgorganisatie voor patiënten met multimorbiditeit ook leiden tot verbeterde ziekte-gerelateerde uitkomstmaten (kwaliteit van zorg) en verbeterde kwaliteit van leven, maar dit is een overkoepelend resultaat wat niet direct beïnvloedbaar is en van veel meer factoren afhankelijk is. Om een overkoepelend resultaat te bereiken, zijn waarschijnlijk nog vele andere specifieke doelen te stellen om andere factoren van invloed verder te verbeteren. Gebaseerd op bovenstaande gedachtegang concludeerde de werkgroep dat in de gevonden literatuur belangrijke informatie mist, namelijk wat de directe opbrengst is van een organisatorische interventie ten aanzien van de zorgorganisatie en geleverde zorg.
De organisatorische interventies uit de studies waren bovendien heterogeen: er werd door middel van een combinatie van verschillende onderdelen nagestreefd meer geïntegreerde zorg te leveren. De verschillende onderdelen van de interventies streefden volgens de werkgroep verschillende specifieke doelen na. De werkgroep deelde deze onderdelen in vier categorieën in, en concludeerde dat het ‘verbeteren of bevorderen van interdisciplinaire aanpak’ en het aanbieden van een ‘meer patiëntgerichte aanpak’ de twee categorieën waren die direct als doel hadden een overkoepelende en afgestemde behandeling te bereiken. De andere twee categorieën pasten volgens de werkgroep meer bij de andere twee elementen van regieondersteuning (bij case/care management is het primaire doel een (coördinerend) aanspreekpunt en bij zelfmanagement-ondersteuning en educatie is het doel het ondersteunen van organisatie en zelfmanagement).
De directe opbrengst van een overkoepelende en afgestemde behandeling
De werkgroep formuleerde dat een ‘overkoepelende en afgestemde behandeling’ bereiken één van de specifieke doelen kan zijn van een organisatorische interventie voor patiënten met multimorbiditeit in het ziekenhuis. De werkgroep heeft op grond van bestaande literatuur in verschillende vergaderingen nagedacht over wat een overkoepelende en afgestemde behandeling behelst en kwam daarbij tot de volgende onderdelen:
- Het duidelijk is welke haalbare doelen worden nagestreefd;
- Alle voor en tegens van de verschillende ingezette behandelingen (inclusief medicatie) zijn afgewogen in het licht van de doelen, voorkeuren, behoeften en omstandigheden van de patiënt (volgens het model van samen beslissen);
- Indien er potentiële interacties van ziektes, medicatie en/of leefstijladviezen zijn, duidelijk is welke dat zijn, deze zijn afgewogen en een helder besluit hierover is genomen;
- Er een duidelijk plan is voor de toekomstige, geplande zorg, inclusief reden (van bijvoorbeeld controle/follow-up of behandeling) en de nagestreefde doelen;
- Er onderlinge afstemming is geweest onder de diverse behandelaren.
Bij een overkoepelende en afgestemde behandeling is alle ingezette zorg afgestemd op de gehele situatie van de patiënt en met alle betrokken zorgprofessionals. De werkgroep denkt dat een overkoepelende en afgestemde behandeling in eerste instantie vier dingen zou kunnen opleveren:
- Patiënt- en zorgverlenerstevredenheid over de afstemming van de zorg;
- Gepaster zorgverbruik (bijv. door minder over-/onderbehandeling);
- Verminderde kans op farmacotherapie-gerelateerde problemen en de verandering in medicatie, aantal medicijnen en doseringen;
- Duidelijkheid over de rol van iedere behandeling en iedere behandelaar in het geheel.
Dit is de directe opbrengst van een overkoepelende en afgestemde behandeling. Vervolgens heeft deze opbrengst hopelijk voor sommige patiënten weer tot gevolg dat ook de ziekte-gerelateerde uitkomstmaten verbeteren.
In Figuur 3 is bovenstaande nog eens schematisch weergegeven.
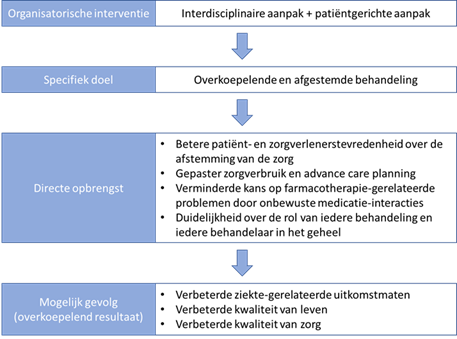
Figuur 3. Schematische weergave van doel, opbrengst en gevolg van een organisatorische interventie. In de gevonden literatuur werd dit onderscheid niet duidelijk gemaakt, waardoor de effectiviteit van een interventie hoofdzakelijk werd beoordeeld op basis van de patiëntuitkomsten, maar er geen informatie beschikbaar was over of de opbrengst wel voldoende werd gerealiseerd.
Betere patiënt- en zorgverlenerstevredenheid over de afstemming van de zorg
Tevredenheid met de zorg (van patiënt) is de enige cruciale uitkomstmaat waarop alle studies, die deze variabele meenamen, een positief effect zagen. De tevredenheid van artsen over de geleverde zorg werd in geen van de gevonden studies onderzocht. De studie van Rodriquez-Blazquez (2020), waarin de implementatie van een geïntegreerd zorgmodel voor verschillende groepen patiënten met multimorbiditeit uit meerdere Europese landen werd geëvalueerd liet ook significante toename van patiënt- maar ook zorgteamtevredenheid zien voor vrijwel alle implementatielocaties. Ook bij de evaluatie van de nieuwe ketenzorg voor patiënten met één chronische ziekte, werd een significante verbetering in patiënt- en zorgteamtevredenheid gezien (Cramm, 2013). Concluderend zijn er aanwijzingen dat een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg in ieder geval de patiënt- en zorgteamtevredenheid met de zorg kan verbeteren. Dit is een kennislacune die verder onderzocht zou moeten worden, maar deze uitkomstmaat is, mede op basis van de inventarisaties die zijn gedaan in dit project, van toegevoegde waarde om mee te blijven nemen in evaluaties van nieuwe implementaties.
Gepaster zorgverbruik
Bij de cruciale uitkomstmaat zorgverbruik werden wisselende effecten van de interventies uit de literatuuranalyse gerapporteerd. Zorgverbruik werd slechts in enkele studies verminderd, en bleef in de meeste studies gelijk tussen interventie- en controlegroep. Bij een overkoepelende en afgestemde behandeling is het primaire doel niet om zorgverbruik te verminderen, maar om de zorg af te stemmen tussen zorgprofessionals en op de algehele situatie, wensen en behoeftes van de patiënt. Patiënten die meer gefragmenteerde zorg ontvangen, hebben namelijk een grotere kans op overbehandeling, overdiagnostiek en slechtere zorguitkomsten. (Hussey, 2014; Kern, 2017; Nyweide, 2013; Romano, 2015) Logischerwijs is de verwachting dat minder fragmentatie, bijvoorbeeld door te zorgen voor een overkoepelende en afgestemde behandeling, leidt tot minder overbehandeling en overdiagnostiek. Ook zou minder fragmentatie in theorie tot betere zorguitkomsten kunnen leiden, zoals bijvoorbeeld minder medicatie-gerelateerde ziekenhuisopnames. Dit zorgverbruik had potentieel voorkómen kunnen worden.
De moeilijkheid zit in het onderscheid tussen zorgverbruik dat voorkomen had kunnen worden en zorgverbruik dat niet voorkomen had kunnen worden omdat het een gevolg is van bijvoorbeeld (verslechtering van) de ziektes zelf. Daarnaast speelt mee dat een overkoepelende en afgestemde behandeling niet altijd zorgverbruik op de korte termijn zal verminderen: er kan ook vastgesteld worden dat er sprake is van onderbehandeling, waardoor meer inzet van zorg het gevolg is. Dit was ook zichtbaar in één studie uit de literatuuranalyse. Deze studie rapporteerde dat patiënten (met depressie en diabetes en/of ischemische hartziekte) uit de interventiegroep veel vaker verwezen werden voor hun mentale gezondheid en voor bewegingsprogramma’s. Daarnaast kan de interventie zelf ook leiden tot meer zorgverbruik. Zo rapporteerde één studie in de literatuuranalyse dat patiënten uit de interventiegroep significant meer afspraken hadden bij de verpleegkundige uit de huisartsenpraktijk dan de controlegroep. Enkel het effect meten op (verminderen van) zorgverbruik doet geen recht aan de opbrengst van de overkoepelende en afgestemde behandeling, namelijk dat het zorgverbruik gepaster is. Dit is een extra argument om bij de evaluatie van de effectiviteit van een overkoepelende en afgestemde behandeling ook de opbrengst in kaart te brengen.
Verminderde kans op farmacotherapie-gerelateerde problemen door medicatie-interacties
De cruciale uitkomstmaat geneesmiddel gerelateerde schade (adverse drug events) werd niet direct meegenomen in de studies, maar één studie rapporteerde een groot positief effect op het aantal farmacologische problemen in een geselecteerde populatie met minimaal vier medicamenten. Een andere studie, waarin de populatie niet geselecteerd werd op medicatiegebruik, vond geen significant verschil in het aantal hoog-risico medicamenten. Beide interventies bevatten o.a. een medicatiebeoordeling, uitgevoerd door een apotheker. Bij een overkoepelende en afgestemde behandeling is één van de doelen het verminderen van het risico op farmacotherapie-gerelateerde problemen (FTP) door onbewuste medicatie-interacties. Hoog-risico medicijnen en medicatie-interacties kunnen nog steeds aanwezig zijn, maar het verschil is dat zowel patiënt als betrokken zorgprofessionals zich hiervan bewust zijn en in afstemming keuzes hierover hebben gemaakt. Voor alle patiënten met multimorbiditeit en medicijnen is het belangrijk om overkoepelend en in afstemming met betrokken zorgprofessionals bewuste keuzes te maken over al dan niet starten/stoppen/continueren van (chronische) medicatie.
Echter zal niet iedere patiënt met multimorbiditeit hoog-risico medicijnen of medicijnen die interacteren gebruiken, dus alleen bij de groep patiënten waar dit wel zo is, zullen mogelijk farmacotherapie-gerelateerde problemen voorkómen kunnen worden door een medicatiebeoordeling. Een systematische review van Huiskes (2017) beschrijft het effect van een medicatiebeoordeling in 31 studies in populaties met een gemiddelde leeftijd van 51,4 tot 87,0 jaar en vier tot veertien medicijnen. Overkoepelend trekt Huiskes (2017) de conclusie dat een medicatiebeoordeling met name effect heeft op farmacotherapie-gerelateerde problemen (FTP), en verandering in medicatie, aantal medicijnen en doseringen bewerkstelligt. Dit effect is logischerwijs waarschijnlijk alleen aanwezig voor patiënten die een bepaald aantal medicijnen gebruiken. Ook ander Nederlands onderzoek dat wordt geciteerd in de NVKG richtlijn Polyfarmacie bij Ouderen beschrijft dat het aantal potentiële FTP’s en het aantal gebruikte geneesmiddelen veelal afneemt door een medicatiebeoordeling. Ze concludeerden echter ook dat een jaarlijkse medicatiebeoordeling bij de volledige populatie ouderen met chronische polyfarmacie (gebruik van 5 of meer geneesmiddelen) en 1 risicofactor voor FTP binnen het huidige zorgsysteem niet effectief en niet haalbaar is. Polyfarmacie hangt sterk samen met multimorbiditeit. (Huiskes, 2017) Een medicatiebeoordeling als onderdeel van een overkoepelende en afgestemde behandeling zou bij patiënten met multimorbiditeit en polyfarmacie effect kunnen hebben op farmacotherapie-gerelateerde problemen (FTP), en verandering in medicatie, aantal medicijnen en doseringen bewerkstelligen. Medicatiebeoordeling en de te verwachten effecten werden echter zeer weinig geïncludeerd en geëvalueerd in de door ons gevonden studies. Bij de evaluatie van de opbrengst van een overkoepelende en afgestemde behandeling zouden deze onderdelen ook in kaart gebracht moeten worden om een volledig overzicht van de effectiviteit te krijgen.
Duidelijkheid over de rol van iedere behandeling en iedere behandelaar in het geheel
Voor niet alle patiënten is het altijd (volledig) duidelijk wat het doel is van ieder medicijn, iedere behandeling en iedere afspraak bij een zorgprofessional. (Pérez-Jover, 2018; Verhoeff, 2018) De behoefte aan informatie hierover verschilt tussen patiënten. (Van Dijk, 2016) Desalniettemin is deze informatie van groot belang wanneer een zorgprofessional samen met een patiënt met multimorbiditeit moet beslissen over aanpassen, starten, stoppen of continueren van behandelingen en afspraken. Ook kan overleg tussen zorgprofessionals over indicaties en prioriteiten van behandelingen in het licht van de actuele situatie van de patiënt leiden tot andere besluiten, zoals het uitstellen van (intensieve) behandelingen die op dat moment geen prioriteit hebben. (Invitational Medisch Specialisten)
Een overzicht van alle zorg, inclusief de indicaties voor betrokken zorgprofessionals, medicijnen en behandelingen, is de basis die nodig is om tot een overkoepelende en afgestemde behandeling te komen. Uit een overzicht zou duidelijk moeten worden (voor zowel patiënt als andere betrokken zorgverleners) wat de actuele problemen zijn van een patiënt, wat het doel en plan is ten aanzien van iedere behandeling en welke rol iedere behandelaar hierin speelt. Dit vormt bij patiënten met multimorbiditeit de basis voor het gesprek en samen beslissen. Samen beslissen is het model dat uitgaat van “het principe dat als patiënten goed geïnformeerd worden door artsen, en zelf actief betrokken worden bij de besluitvorming rond hun behandeling ze samen de best passende behandeloptie kiezen”. Echter, veel samen beslissen modellen richten zich namelijk vooral op technische mogelijkheden bij enkelvoudige aandoeningen. (van de Pol, 2017) Van de Pol (2017) beschreef naar aanleiding van hun Delphi-studie een dynamisch model voor samen beslissen bij oudere patiënten met multimorbiditeit. Dit dynamische model is volgens de werkgroep geschikt voor alle patiënten met multimorbiditeit.
Het model beschrijft de volgende stappen:
1. Voorbereiding
- Is er eerder gesproken over een behandelbeleid?
- Wat zijn alle actuele problemen?
2. Doelen bespreken
- Welke rol nemen de patiënt, eventuele toehoorders en de arts bij de besluitvorming?
- Wat zijn de waardes en doelen (inclusief niet strikt medische doelen) van de patiënt?
3. Keuze bespreken
- Aangeven dat de patiënt meer dan één optie heeft en dat hij daar een stem in heeft.
4. Opties bespreken
- voor- en nadelen en risico’s van de opties;
- verwachte uitkomsten van de opties;
- de voorkeuren, behoeften en omstandigheden van de patiënt;
- de mogelijke invloed van de opties op diens persoonlijke situatie.
5. Keuze maken
- Samen komen tot een beslissing over het te volgen beleid.
De laatste drie stappen komen overeen met de stappen zoals beschreven in het FMS Visiedocument Samen beslissen (2019). Echter, juist stap 1 en stap 2 waarbij de actuele problemen maar ook de waardes en doelen van een patiënt in kaart worden gebracht zijn zo belangrijk om te beoordelen of behandelingen aansluiten bij de individuele patiënt. Per ziekte of specialisme weet de individuele behandelaar wel wat het eigen plan is voor zijn/haar patiënt. Overkoepelend afstemmen en prioriteren van behandelingen bij patiënten met multimorbiditeit in het ziekenhuis op basis van de patiënts waardes en doelen is niet standaard belegd. Hierdoor blijven het overkoepelende behandeldoel en eventuele niet strike medische doelen vaak onduidelijk en is het niet altijd helder hoe ieders behandeling en betrokkenheid bijdragen aan het geheel. Duidelijkheid over de rol van iedere behandeling en iedere behandelaar in het geheel is daarom een belangrijke opbrengst van een overkoepelende en afgestemde behandeling.
Onderbouwing
Achtergrond
Bij de zorg voor patiënten met multimorbiditeit in het ziekenhuis zijn vaak meerdere behandelaars tegelijkertijd betrokken, maar over de disciplines heen prioriteren, afstemmen en doordachte keuzes maken (wat wel en wat niet) is niet altijd goed belegd. Dit kan leiden tot verlies van overzicht (voor zowel patiënt als zorgprofessionals), tegenstrijdige adviezen en ongewenste zorguitkomsten. Een overkoepelende en afgestemde behandeling houdt in dat er samen met de patiënt en zijn/haar naaste(n) prioriteiten zijn gesteld en keuzes zijn gemaakt over de zorg, waarbij haalbare doelen zijn geformuleerd en duidelijkheid is gecreëerd over welke rol iedere zorgprofessional, behandeling en afspraak speelt bij het behalen van deze doelen. Een overkoepelende en tussen de verschillende zorgverleners afgestemde behandeling is door de werkgroep benoemd als een belangrijk onderdeel om de regie te ondersteunen en de kwaliteit van zorg voor deze patiënten verbeteren, omdat het geïntegreerde zorg kan verbeteren.
Deze module omschrijft de effectiviteit van verschillende organisatorische interventies met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit. Door de effectiviteit van deze interventies, maar ook de verschillende elementen van deze organisatorische interventies in kaart te brengen, hoopt de werkgroep aanbevelingen te kunnen opstellen hoe men een overkoepelende en afgestemde behandeling zou kunnen bewerkstelligen voor patiënten met multimorbiditeit die bij meerdere specialisten in het ziekenhuis komen.
Conclusies / Summary of Findings
Tevredenheid van patiënt, naaste(n) en/of zorgverlener
|
Laag GRADE |
Een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit zou de patiënttevredenheid ten aanzien van de zorg kunnen verbeteren. Er werd geen literatuur gevonden die tevredenheid van de zorgverlener heeft meegenomen als uitkomstmaat.
Bronnen: Boult, 2008; Coventry, 2015; Katon, 2010; Naylor, 2004; Salisbury, 2018 |
Ervaren zorglast van patiënt/mantelzorger (inclusief continuïteit van zorg)
|
Zeer laag (zorglast) / laag (continuïteit) GRADE |
Het is onduidelijk of een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit effect heeft op de zorglast van patiënten ten aanzien van hun ziektes.
Er zijn aanwijzingen dat de interventie de continuïteit van de zorg zou kunnen verbeteren.
Bronnen: Barley, 2014; Boult, 2008; Coventry, 2015; Hogg, 2009; Salisbury, 2018; Wakefield, 2012 |
Acuut zorgverbruik in specifieke populatie
|
laag GRADE |
Een organisatorische interventie ondergaan met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit zou een positief effect kunnen hebben op het risico op een spoed(her)opname in het ziekenhuis of een spoedeisende hulpbezoek, in een specifieke populatie (populatie opgenomen patiënten (3 studies) of met ADL-beperkingen (1 studie)).
Bronnen: Courtney, 2009; Legrain, 2011; Slaets, 1997; Sommers, 2000 |
Zorgverbruik in algemene populatie
|
laag GRADE |
Een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit lijkt minimaal tot géén effect te hebben op het verminderen van zorgverbruik in een algemene populatie. Twee studies suggereren een toename van het zorgverbruik.
Bronnen: Beck, 1997; Bouman, 2008; Boult, 2008; Hogg, 2009; Katon, 2010; Morgan, 2013; Salisbury, 2018; Sandberg, 2015 |
Geneesmiddel gerelateerde schade
|
geen GRADE |
Vanwege het lage aantal studies en vanwege de heterogeniteit is het helaas niet mogelijk een conclusie op te stellen over het effect van een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit op geneesmiddel gerelateerde schade. |
Kwaliteit van leven
|
laag GRADE |
Een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit lijkt geen eenduidig effect te hebben op kwaliteit van leven.
Bronnen: Barley, 2014; Behm, 2014; Boult, 2008; Chow, 2014; Coventry, 2015; Ell, 2010; Hogg, 2009; Katon, 2010; Martin, 2013; Naylor, 2004; Salisbury, 2018 |
Dagelijks functioneren
|
Laag/zeer laag GRADE |
Een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit lijkt het dagelijks functioneren niet te verbeteren.
Het is onduidelijk of een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg effect heeft op het dagelijks functioneren van patiënten van 80 jaar of ouder of 65 tot 79 jaar met ten minste één chronische ziekte en afhankelijk in tenminste één ADL domein.
Bronnen: Coventry, 2015; Ell, 2010; Eklund, 2013; Gitlin, 2006; Katon, 2010; Metzelthin, 2013; Morgan, 2013; Naylor, 2004 |
Mentale gezondheid
|
redelijk GRADE |
Een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg en verbeteren van depressieve symptomen zou de mentale gezondheid kunnen verbeteren van patiënten met multimorbiditeit bestaande uit depressie en tenminste één andere chronische ziekte.
Bronnen: Barley, 2014; Bogner 2008; Coventry, 2015; Martin, 2013; Morgan, 2013 |
|
zeer laag GRADE |
Het is onduidelijk of een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit effect heeft op mentale gezondheid.
Bronnen: Behm, 2014; Boult, 2008; Chow, 2014; Ell, 2010; Hogg, 2009 |
Mortaliteit
|
Laag GRADE |
Er is geen eenduidig bewijs dat een organisatorische interventie met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit effect zou kunnen hebben op mortaliteit.
Bronnen: Alkema, 2007; Beck, 1997; Berglund, 2015; Bouman, 2008; Eklund, 2013; Hogg, 2009; Naylor, 2004; Sandberg, 2015; Slaets, 1997; Sommers, 2000; Boult, 2008; Coburn, 2012; Gitlin, 2006; Legrain, 2011 |
Samenvatting literatuur
Beschrijving studies
NICE guideline – chapter 10: Interventions to improve care for people with multimorbidity (Barnett, 2016)
Barnett (2016) beschrijft in een systematische review interventies die gericht waren op het verbeteren van uitkomsten en continuïteit van zorg voor patiënten met multimorbiditeit. RCT’s of systematische reviews van RCT’s met volwassen patiënten (18 jaar en ouder) met multimorbiditeit gepubliceerd tussen 2011 en januari 2016 werden geïncludeerd. Multimorbiditeit werd gedefinieerd als “people with multiple conditions where these present significant problems to everyday functioning or where the management of their care has become burdensome to the patient and/or involves a number of services working in an uncoordinated way”. Patiënten met één of meerdere psychiatrische aandoeningen maar geen somatische aandoening werden niet geïncludeerd. Ze gebruikten hiervoor een update van de zoekstrategie van de Cochrane review van Smith (2012). De interventies werden vergeleken met de reguliere zorg (‘usual care’). Kritieke uitkomstmaten waren gezondheids-gerelateerde kwaliteit van leven, mortaliteit, functionele uitkomsten, patiënt- en mantelzorgertevredenheid, duur van ziekenhuisopname, ongeplande zorg of opname in een zorginstelling. Belangrijke uitkomstmaten waren continuïteit van zorg en patiënts en mantelzorgers belasting van behandeling (‘treatment burden’).
Er werden 20 RCT’s geïncludeerd die allen complexe interventies evalueerden. Van deze RCTs werden tien studies uitgevoerd in de Verenigde Staten of Canada, acht in Europa, één in Australië en één in Hong Kong. De studies werden door de richtlijnwerkgroep van NICE gescoord op de aanwezigheid van verschillende elementen van de complexe interventies. Ze scoorden de volgende elementen (tussen haakjes staat in hoeveel studies deze elementen voorkwamen): multidisciplinaire zorg (7x), holistisch assessment (11x), een zorgplan (11x), zorgcoördinatie (10x), telefonische follow-up (11x), follow-up bij patiënt thuis (11x), zelf-management promotie (7x) en een vorm van medicatie management (3x). Als kanttekening geeft de NICE richtlijnwerkgroep aan dat er geen vastomlijnde definities van de beschreven elementen zijn, waardoor andere onderzoeksgroepen of zorgprofessionals de betekenis van de elementen anders zouden kunnen hebben geïnterpreteerd.
Cochrane review: Interventions for improving outcomes in patients with multimorbidity in primary care and community setting (Smith, 2016)
Smith (2016) betreft een systematische Cochrane review van gezondheidszorg en patiënt-georiënteerde interventies die gericht waren op het verbeteren van uitkomsten van zorg voor patiënten met multimorbiditeit in de eerste lijn en de algemene maatschappij. RCTs, non-randomised clinical trials (NRCTs), controlled before-after studies (CBAs) and interrupted time series analyses (ITS) met volwassen patiënten (18 jaar en ouder), gepubliceerd tot september 2015, werden geïncludeerd. Multimorbiditeit werd gedefinieerd als “the coexistence of multiple chronic diseases and medical conditions in the same individual, usually defined as two or more conditions.” Studies waarin werd aangenomen dat patiënten multimorbiditeit hadden op basis van bijvoorbeeld hoge leeftijd werden niet geïncludeerd omdat de interventies niet specifiek gericht waren op multimorbiditeit. Interventies werden geïncludeerd als ze specifiek gericht waren op patiënten met multimorbiditeit en werden uitgevoerd in de eerste lijn of de algemene maatschappij. Eerste lijns zorg werd gedefinieerd als “geïntegreerde, makkelijk toegankelijke gezondheidszorg door zorgverleners die verantwoordelijk zijn voor zorg voor een groot deel van de persoonlijk gezondheidszorg behoeftes, …”. De interventies werden vergeleken met “gewone zorg”. Bovendien maakte Smith (2016) onderscheid tussen interventies die zich specifiek richten op co-morbide aandoeningen (een “bekende” combinatie van ziektes) en interventies die zich richten op “algemene” multimorbiditeit.
Er werden 18 (cluster-) RCTs en pilot RCTs geïncludeerd. Van deze RCTs werden elf studies uitgevoerd in de Verenigde Staten of Canada, vijf in Europa (Verenigd Koninkrijk of Ierland) en twee in Australië. Smith (2016) gebruikte de Effective Practice and Organisation of Care (EPOC) taxonomie om de interventies te omschrijven en categoriseren. Voor de review werden ze door de werkgroep in twee hoofdgroepen ingedeeld: 12 van de 18 interventies waren hoofdzakelijk organisatorische interventies, zoals case-management. De overige zes studies waren hoofdzakelijk patiënt-georiënteerde interventies, zoals zelfmanagement steungroepen. Er was tevens overlap van elementen van beide interventies in sommige studies.
De twee systematische reviews die werden geïncludeerd lieten weinig overlap zien in de inclusie van verschillende studies. Dit had te maken met verschil in inclusiecriteria, Barnett (2016) excludeerde bijvoorbeeld studies die binnen de interventie ziekte-specifieke doelen of uitkomstmaten hadden. Smith (2016) excludeerde bijvoorbeeld studies die hun onderzoekspopulatie niet expliciet gedefinieerd hadden als ‘patiënten met multimorbiditeit’, waar Barnett (2016) ook studies includeerde als aannemelijk werd uit de inclusie of uit de populatieomschrijving dat het (hoofdzakelijk) patiënten met multimorbiditeit betrof. Barnett (2016) includeerde vier RCTs die ook door Smith (2016) werden geïncludeerd.
Indeling van elementen van organisatorische interventies
Barnett (2016) en Smith (2016) maakten allebei een indeling van de studies gebaseerd op de verschillende elementen van de interventie. De werkgroep heeft deze indelingen gecombineerd tot de indeling die is gebruikt bij de uitwerking van deze uitgangsvraag.
De Cochrane review van Smith (2016) onderscheidde twee hoofdgroepen: organisatorische en patiënt-georiënteerde interventies. De patiënt-georiënteerde interventies richtten zich met name op zelfmanagement en educatie van de patiënt, en zijn niet geïncludeerd in deze literatuursamenvatting als dat het enige element van de interventie was.
De NICE richtlijn van Barnett (2016) onderscheid verschillende onderdelen: multidisciplinaire zorg, holistisch assessment, een zorgplan, zorgcoördinatie, telefonische follow-up, follow-up bij patiënt thuis, zelfmanagement promotie en een vorm van medicatie management (zoals bijv. een medicatiebeoordeling).
De werkgroep heeft bovenstaande onderdelen gecombineerd tot een vierdelige indeling om de onderdelen van de losse studies in te delen:
- Een meer patiëntgerichte aanpak: holistisch assessment, individueel zorgplan, medicatiebeoordeling (organisatorische interventie gericht op zorgprofessionals, maar ook op ondersteuning van patiënt);
- Verbeteren of bevorderen van interdisciplinaire aanpak: multidisciplinaire zorg/samenwerking (organisatorische interventie gericht op zorgprofessionals);
- Case/care management: zorgcoördinatie, inclusief telefonische follow-up en follow-up bij patiënt thuis (organisatorische interventie gericht op ondersteuning van patiënt);
- Zelfmanagement-ondersteuning en educatie (individuele, patiënt-georiënteerde interventie en niet meegenomen indien dit het enige element was waar de interventie zich op richtte).
Tabel 1 laat de indeling van de werkgroep in vergelijking met de indeling van Smith (2016) en Barnett (2016) zien.
Tabel 1 Indeling van verschillende onderdelen van de interventies per originele studie. De indeling van Smith (2016) en Barnett (2016) zijn geïntegreerd tot een indeling van de werkgroep.
|
|
Indeling Smith (2016) |
Organisatorische interventies |
Patiënt-georiënteerde interventie |
||||
|
|
Indeling Barnett (2016) |
Holistisch assessment |
Individueel zorgplan |
Medicatiebeoordeling |
Multidisciplinaire zorg |
Zorgcoördinatie /follow-up |
Zelfmanagement |
|
|
Indeling werkgroep |
Meer patiëntgerichte aanpak van zorg |
Verbeteren inter-disciplinaire aanpak |
Case- of zorg-management |
Zelfmanagement ondersteuning |
||
|
Auteur |
|
|
|
|
|
|
|
|
BARNETT 2016 |
|
|
|
|
|
|
|
|
Alkema 2007 |
|
● |
|
|
|
● |
|
|
Beck 1997 |
|
|
|
|
● |
|
|
|
Berglund 2015 |
|
● |
● |
|
● |
● |
|
|
Bouman 2008 |
|
● |
● |
|
|
|
|
|
Courtney 2009 |
|
● |
● |
|
|
|
|
|
Eklund 2013 |
|
● |
● |
|
● |
● |
|
|
Ell 2013 |
|
|
|
|
|
● |
|
|
Hogg 2009 |
|
|
|
● |
● |
● |
|
|
Metzelthin 2013 |
|
● |
● |
|
|
● |
|
|
Naylor 2004 |
|
|
|
|
|
● |
|
|
Sandberg 2015 |
|
● |
● |
|
|
● |
|
|
Slaets 1997 |
|
● |
● |
|
● |
● |
|
|
Sommers 2000 |
|
|
|
|
● |
|
|
|
Boult 2008 |
|
● |
● |
|
|
● |
● |
|
Behm 2014 |
|
|
|
|
● |
|
● |
|
Chow 2014 |
|
● |
|
|
|
● |
● |
|
Coburn 2012 |
|
● |
● |
|
|
● |
● |
|
Gitlin 2006 |
|
|
● |
|
|
|
● |
|
Katon 2010 |
|
|
● |
● |
|
|
● |
|
Legrain 2011 |
|
|
|
● |
|
|
● |
|
|
|
|
|
|
|
|
|
|
SMITH 2016 |
|
|
|
|
|
|
|
|
Barley 2014 |
|
|
● |
|
● |
● |
|
|
Eakin 2007 |
|
|
|
|
|
|
● |
|
Garvey 2015 |
|
|
|
|
|
|
● |
|
Hochhalter 2010 |
|
|
|
|
|
|
● |
|
Kennedy 2013 |
|
|
|
|
|
|
● |
|
Krska 2001 |
|
|
|
● |
|
● |
|
|
Lorig 1999 |
|
|
|
|
|
|
● |
|
Lynch 2014 |
|
|
|
|
|
|
● |
|
Martin 2013 |
|
|
● |
|
|
|
● |
|
Sommers 2000 |
|
|
● |
|
● |
● |
|
|
Wakefield 2012 |
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
SALISBURY 2018 |
● |
● |
● |
|
● |
● |
|
* grijsgekleurde studies zijn geëxcludeerd uit de literatuuranalyse omdat dit interventies met alleen zelfmanagement-ondersteuning betrof
Resultaten
Effect van organisatorische interventies op de tevredenheid met de zorg (van naaste(n) en/of arts) van patiënten met multimorbiditeit
Vijf studies rapporteerden het effect van hun interventie op de patiënttevredenheid (Naylor, 2004; Boult, 2008; Katon, 2010; Coventry, 2015; Salisbury, 2018). Aangezien patienttevredenheid op verschillende wijze gemeten kan worden, is ervoor gekozen de resultaten in tabel weer te geven en niet te poolen (zie Tabel 2). In vier van de vijf studies werd een significante stijging gezien van de patiënttevredenheidsscore of het aantal patiënten dat tevreden was over de zorg (Naylor, 2004; Boult, 2008; Katon, 2010; Salisbury, 2018). Coventry (2015) rapporteerde ook een hoger gemiddelde patiënttevredenheidsscore voor de interventiegroep ten opzichte van de controlegroep, maar dit verschil was niet significant. Salisbury (2018) rapporteerde daarnaast een significant hogere score voor de beoordeling van het consult (gemeten door middel van de Consultation and Relation Empathy (CARE) measure). Ook rapporteerde Salisbury hogere odds voor de interventiegroep om te rapporteren dat zij de problemen hebben besproken die het meest belangrijk zijn voor hen (OR 1,85; 95% BI 1,44 tot 2.38), dat de ondersteuning en zorg passend was (OR 1,48; 95% BI 1,18 tot 1,85), dat ze tevreden waren met de zorg (OR 1,57; 95% BI 1,19 tot 2,08) en dat ze een geschreven zorgplan, gezondheidsplan of behandelplan hadden (OR 1,97; 95% BI 1,32 tot 2,95). Geen van de studies nam de tevredenheid van de arts mee als uitkomstmaat.
Tabel 2 Overzicht van interventie-studies en het effect op tevredenheid met de zorg (van patiënt, naaste(n) en/of arts)
|
1st author, year
N
(herkomst) |
Population |
Elements of organizational intervention |
Measurement of patient satisfaction |
Effect |
|
Boult, 2008
N= 904
(NICE guideline, Cochrane review) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
Self-management support |
Patient satisfaction, Patient and assessment of Chronic Illness (PACIC))
(scale not reported, in general PACIC is scored from 1 to 5, higher scores = better outcomes) |
Mean + 0.27 (+0.08 to +0.46 higher) |
|
Coventry, 2015
N=387
(Cochrane review) |
Participants with depression and diabetes and/or ischaemic heart disease |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (individualized care plan; medication review);
self-management support |
Patient satisfaction, Patient and assessment of Chronic Illness (PACIC))
(scale not reported, in general PACIC is scored from 1 to 5, higher scores = better outcomes) |
Mean + 0.39, Int 2.37 (SD 1.1) Con 1.98 (SD 1.0) Not significant
|
|
Naylor, 2004
N= 239
(NICE guideline) |
Adults (aged 65 year or over) |
Case- or care management (care coordination) |
The Patient Satisfaction Score at 6 weeks
(scored 44 to 100, higher scores = better outcomes) |
Mean + 5.3 (+2.28 to +8.32 higher) |
|
Katon, 2010
N= 214
(NICE guideline) |
Patients with poorly controlled diabetes, coronary heart disease, or both and coexisting depression |
Patient-oriented approach (individualized care plan, medication review);
Self-management support |
Number of patients satisfied with care for diabetes, heart disease or both |
RR 1.22 (1.04 to 1.43) |
|
Salisbury, 2018
N= 1.546
(original) |
Adult patients with at least three chronic conditions |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan, medication review);
Case- or care management (care coordination);
self-management support |
- Patient satisfaction, Patient and assessment of Chronic Illness (PACIC))
(scale not reported, in general PACIC is scored from 1 to 5, higher scores = better outcomes)
- the Consultation and Relational Empathy (CARE) measure of relational empathy
(scale not reported, in general CARE is scored from 10 to 50, higher scores = better outcomes)
- Patients reporting they almost always discuss the problems most important to them in managing their own health
- Patients reporting that support and care is almost always joined-up
- Patients reporting being very satisfied with care
- Patients reporting having a written care plan, health plan, or treatment plan |
- Adjusted difference in means (95% CI); 0.29 (0.16 to 0.41);
- Mean CARE doctor score Adjusted difference in means (95% CI) 1.20 (0.28 to 2.13)
Mean CARE nurse score: Adjusted difference in means (95% CI) 1.11 (0.03 to 2.19)
- Adjusted OR (95% CI) 1.85 (1.44 to 2.38)
-Adjusted OR (95% CI) 1.48 (1.18 to 1.85);
-Adjusted OR (95% CI) 1.57 (1.19 to 2.08);
- Adjusted OR (95% CI) 1.97 (1.32 to 2.95); |
Effect van organisatorische interventies op ervaren zorglast van patiënt/mantelzorger (inclusief continuïteit van zorg)
Vijf studies rapporteerden het effect van hun interventie op de ervaren zorglast van patiënt/mantelzorger, gemeten met verschillende meetinstrumenten (Hogg, 2009; Boult, 2008; Barley, 2014; Coventry, 2015; Salisbury, 2018). Continuïteit van zorg werd hierbij ook meegenomen, omdat de hypothese was dat ook verminderde continuïteit van zorg bijdraagt aan de zorglast. Hogg (2009) vond in de interventiegroep een significant slechtere score (+ 5 (95% BI + 1.41 to + 8.6) op de ‘patient/carer treatment burden (caregiver burden) scale’. Barley (2014) vond een niet-significante, iets lagere gemiddelde score op de ziekte-perceptiesvragenlijst (BIPQ), net zoals Coventry (2015) op de multimorbiditeits ziekteperceptie vragenlijst en Salisbury (2018) op het ‘Bayliss’ meetinstrument over hoeveel de ziektes het leven van de patiënt beïnvloeden en het multimorbditeit zorglast meetinstrument. Als laatste vond Barley (2014) een minimaal, niet-significant verschil in patiënt gerapporteerde behoeftes.
Boult (2008) vond een niet-significante hogere continuïteit van zorg score (zowel op de integratie- als op de communicatieschaal); Salisbury (2018) vond een significant hogere gemiddelde continuïteitsscore voor de interventiegroep en niet-significant lagere gemiddelde score bezoek-entropie (een maat voor de verspreiding van de verschillende bezoeken, waarbij een lagere score meer georganiseerde zorg weerspiegelde) voor de interventiegroep. Ook vond Boult (2008) een niet-significant hogere odds voor de interventiegroep op toegang tot de huisarts op de zelfde dag (OR 1,20; 95% BI 0,65 tot 2,22).
Tabel 3 Overzicht van interventie-studies en het effect op ervaren zorglast van patiënt/mantelzorger (inclusief continuïteit van zorg)
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Treatment burden measurement |
Effect |
|
Barley, 2014
N= 81
(Cochrane review) |
Participants with coronary heart disease (with current chest pain) and depression (identified using two stage screening process to confirm diagnosis) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Illness perceptions (BIPQ) High scores = more threatening view of illness
Patient-reported needs (PSYCHLOPS) |
Int 40 (SD 14.8) Con 43(SD 31.1) Absol diff 3, Rel % diff 7% Not significant
Int 13.6 (SD 5.1) Con 13.4 (SD 5.4) Absol diff 0.2, Rel % diff 1.5% Not significant |
|
Boult, 2008
N=904
(NICE guideline, Cochrane review)
*Boyd 2010 *Boult 2011 *Boult 2013 |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
Mean continuity of care (integration subscale) Scale not reported.
Mean continuity of care (communication subscale) Scale not reported
Mean continuity of care (same day access to GP when sick) Scale not reported |
+ 2.79 (- 0.97 to + 6.55)
+ 2.97 (- 0.68 to + 6.62)
OR 1.20 (0.65 to 2.22) |
|
Coventry, 2015
N= 387
(Cochrane review) |
Participants with depression and diabetes and/or ischaemic heart disease |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (individualized care plan; medication review);
self-management support |
Multimorbidity illness perception scale
|
Int 2.1 (SD 0.9) Con 2.28 (SD 0.9) Absol diff 0.18, Rel % diff 8% Not significant
|
|
Hogg, 2009
N=241
(NICE guideline, Cochrane review) |
Adults (aged 50 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (medication review);
Case- or care management (care coordination). |
Patient/carer treatment burden (caregiver burden) at 15 months. Scale (unspecified) from: 0 to 88, high scores = poor outcome. |
+ 5 (+ 1.41 to + 8.6) |
|
Salisbury, 2018
N= 1.546
(Original) |
Adult patients (aged 18 years or over) with at least three chronic conditions |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan, medication review);
Case- or care management (care coordination);
self-management support |
Bayliss measure of how much illness affects the individual’s life
Mean Multimorbidity Treatment Burden Score
Mean Continuity of Care Index
Mean Visit Entropy |
Adjusted difference(95% CI); –0·64 (–1·54 to 0·27)
Adjusted difference (95% CI); –0·46 (–1·78 to 0·86)
Adjusted difference (95% CI); 0·08 (0·02 to 0·13)
Adjusted difference (95% CI); - 8·76 (–18·07 to 0·55);
|
Effect van organisatorische interventies op zorgverbruik van patiënten met multimorbiditeit
Twaalf studies rapporteerden het effect van hun interventie op het zorgverbruik (Beck, 1997; Bouman, 2008; Courtney, 2009; Hogg, 2009; Sandberg, 2015; Slaets, 1997; Sommers, 2000; Boult, 2008; Katon, 2010; Legrain, 2011; Morgan, 2013; Salisbury, 2018). In Tabel 4 staat een overzicht van alle resultaten van de studies met de uitkomstmaat zorgverbruik. Zes van de twaalf studies vonden slechts kleine, niet-significante verschillen tussen de groepen ten aanzien van het gemiddelde (mean/median), odds of risk ratio op zorgverbruik (Beck, 1997; Bouman, 2008; Hogg, 2009; Sandberg, 2015; Boult, 2008; Katon, 2010). Deze studies includeerde een algemene populatie vanuit de thuissituatie, waarbij de interventie vaak een huisbezoek of een interventie met structurele groepsbijeenkomsten betrof.
Legrain (2011) onderzocht een geriatrische interventie voor opgenomen patiënten met multimorbiditeit van 70 jaar en ouder, gericht op drie risicofactoren voor heropname, maar vond een minimaal, niet significant verschil in risico op spoed-heropname (RR 0,85; 95% BI 0,69 tot 1,05) en spoedeisende hulpbezoek (RR 0,95; 95% BI 0,52 tot 1,72) tussen de interventie- en controlegroep. Courtney (2009) rapporteerde een relatief risico van 0,38 (95% BI 0,24 tot 0,61) op een spoedbezoek aan de huisarts en 0,14 (95% BI 0,04 tot 0,45) keer lagere odds op een spoed-heropname in het ziekenhuis voor de interventiegroep in hun onderzoek bij volwassenen van 65 jaar en ouder, die een comprehensive assessment door een verpleegkundige en fysiotherapeut kregen tijdens ziekenhuisopname, met het opstellen van een persoonlijk behandelplan. Slaets (1997) vond een relatief risico van 0,58 (95% BI 0,36 tot 0,93) voor een heropname in het ziekenhuis voor de volwassenen van 75 jaar en ouder in hun studie die een psycho-geriatrische multidisciplinaire behandeling kregen tijdens hun ziekenhuisopname. Sommers (2000) includeerde volwassenen van 65 jaar en ouder die afhankelijk van zorg waren en vond een 0,63 (95% BI 0,41 tot 0,96) keer lagere odds op een ziekenhuisopname voor de interventiegroep die multidisciplinaire zorg kregen met een geriatrische focus, met huisbezoeken en een risico-reductieplan en follow-up door een verpleegkundige/sociaal werker. Salisbury (2018) includeerde patiënten uit de eerste lijn met minimaal drie chronische ziektes, en bood een uitgebreid, multidisciplinair “3D-review” aan de interventiegroep aan, maar vond een minimaal, niet-significant verschil in het gemiddeld aantal ziekenhuisopnames of polikliniekbezoeken tussen interventie- en controlegroep (respectievelijk een mediaan verschil van 1,04 (95% BI 0,84 tot 1,30, p-waarde 0.71) en 1,02 (95% 0,92 tot 1,14, p-waarde 0.72)). Wel zagen ze dat de interventiegroep significant iets meer huisarts- en verpleegkundige bezoeken hadden (respectievelijk een mediaan verschil van 1,13 (95% BI 1,02 tot 1,25, p-waarde 0.0209) en 1,37 (95% BI 1,17 tot 1,6), p-waarde 0,0001)). Morgan (2013) deed een studie waarbij volwassen patiënten (18 jaar en ouder) met depressie en diabetes en/of ischemische hartziekte werden geïncludeerd en rapporteerde dat er in de interventiegroep 300% en 75% meer verwijzingen waren voor respectievelijk de mentale gezondheid en een bewegingsprogramma.
Tabel 4 Overzicht van effect organisatorische interventies op zorgverbruik
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Type of healthcare utilization |
Effect |
|
Beck, 1997
N= 321
(NICE guideline) |
Adults (aged 65 year or over) |
Improving interdisciplinary approach (multidisciplinary care) |
Urgent care visits per patient at 12 months
Emergency care visits per patient at 12 months
Proportion of patients hospitalised at 12 months |
Mean -0.06 (-0.23 to +0.11)
Mean -0.26 (-0.54 to +0.02)
Mean -0.07 (-0.14 to no difference)
|
|
Boult, 2008
N= 904
(NICE guideline, Cochrane review) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
Emergency department visits
|
OR 1.04 (0.81 to 1.34) |
|
Bouman, 2008
N=330
(NICE guideline) |
Adults (aged 70-84 years) |
Patient-oriented approach (holistic assessment, individualized care plan) |
Length of hospital stay (days per patient) at 18 months
Hospital admissions at 18 months |
Mean -0.40 (-4.3 to +3.5)
RR 0.97 (0.42 to 2.21) |
|
Courtney, 2009
N=128
(NICE guideline) |
Adults (aged 65 years or over), admitted to a hospital |
Patient-oriented approach (holistic assessment, individualized care plan) |
Unscheduled care (emergency hospital readmission) at 6 months
Unscheduled care (emergency GP visits) at 6 months |
OR 0.14 (0.04 to 0.45)
RR 0.38 (0.24 to 0.61) |
|
Hogg, 2009
N=241
(NICE guideline, Cochrane review) |
Adults (aged 50 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (medication review);
Case- or care management (care coordination). |
Average no of ED visits at 15 months
Average no of hospital admissions at 15 months
|
Mean -0.1 (-0.37 to +0.17)
Mean -0.06 (-0.31 to +0.19) |
|
Katon, 2010
N=214
(NICE guideline) |
Patients with poorly controlled diabetes, coronary heart disease, or both and coexisting depression |
Patient-oriented approach (individualized care plan, medication review);
self-management support |
Proportion hospitalised at least once
|
RR 1.20 (0.73 to 1.95) |
|
Legrain, 2011
N=665
(NICE guideline) |
Adults (aged 70 years or over), being discharged from the hospital |
Patient-oriented approach (medication review);
self-management support |
Emergency department visit
Emergency hospital readmission
|
RR 0.95 (0.52 to 1.72)
RR 0.85 (0.69 to 1.05) |
|
Morgan, 2013
N= 400
(Cochrane review) |
Adults (18 years and over) with depression and diabetes and/or ischaemic heart disease |
Patient-oriented approach (individualized care plan, medication review);
self-management support |
% Referred to mental health
%Referred to exercise programme
|
Relative difference +300%, significant
Relative difference +71 %, significant |
|
Salisbury, 2018
N=1.546
(Original) |
Adults (18 years and over) with at least three chronic conditions |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan, medication review);
Case- or care management (care coordination); self-management support |
Median number of primary care physician consultations
Median number of nurse consultations
Median number of hospital admissions
Median number of hospital outpatient attendances
|
Adjusted difference (95% CI) + 1.13 (+ 1.02 to + 1.25)
Adjusted difference (95% CI) + 1·37 (+ 1.17 to + 1.61)
Adjusted difference (95% CI) 1.04 (0.84 to 1.30)
Adjusted difference (95% CI) 1.02 (0.92 to 1.14) |
|
Sandberg, 2015
N=153
(NICE guideline) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Hospital admissions per patient at 12 months
|
Mean -0.01 (-0.25 to 0.27 higher) |
|
Slaets, 1997
N=237
(NICE guideline) |
Adults (aged 75 years or over), admitted to the hospital |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Hospital readmission
|
RR 0.58 (0.36 to 0.93) |
|
Sommers, 2000
N= 734
(NICE guideline, Cochrane review) |
Adults (aged 65 years or over) living in the community, with difficulties living independently |
Improving interdisciplinary approach (multidisciplinary care) |
Hospital admission at 6 months
|
OR 0.63 (0.41 to 0.96) |
Effect van organisatorische interventies op geneesmiddel gerelateerde schade (adverse drug events) bij patiënten met multimorbiditeit
Geen van de gevonden studies rapporteerde “adverse drug events” als uitkomstmaat. Vijf studies rapporteerden uitkomstmaten rakend aan geneesmiddel gerelateerde schade. Zo rapporteerde de studie van Krska (2001), waarin bij patiënten van 65 jaar en ouder met minimaal 2 chronische ziektes en tenminste vier medicijnen een medicatiereview werd gedaan, een groot, significant verschil in het percentage farmaceutische zorgproblemen die waren opgelost ten opzichte van de baseline (102 % meer in de interventiegroep). Salisbury (2018) vond geen verschil tussen interventie- en controlegroep in het mediaan aantal indicatoren voor hoog-risico voorschrijven (mediaan verschil 1,04; 95% BI 0,87 tot 1,25), na het aanbieden van een “3D-review” met o.a. een medicatiereview door een apotheker aan de interventiegroep. Salisbury (2018) en Wakefield (2012) vonden daarnaast een niet-significant verschil in scores ten aanzien van medicatietrouw. Bogner (2008) vond wel een significant hoger aantal patiënten in de interventiegroep dat 80% of hoger scoorde op de medicatietrouw-score (antidepressieve medicatie: relatief verschil 132%; anti-hypertensieve medicatie: relatief verschil 152%).
Effect van organisatorische interventies op kwaliteit van leven van patiënten met multimorbiditeit
Elf studies onderzochten het effect van hun interventie op de gerapporteerde, gezondheidsgerelateerde kwaliteit van leven (Ell, 2010; Hogg, 2009; Naylor, 2004; Behm, 2014; Boult, 2008; Chow, 2014; Katon, 2010; Barley, 2014; Coventry, 2015; Martin, 2013; Salisbury, 2018). Behm (2014) onderzocht achteruitgang in zelf-gerapporteerde gezondheid en tevredenheid met fysieke gezondheid gemeten met de SF-36 voor twee verschillende interventies (enkele afspraak of groepsbijeenkomsten versus controlegroep), en vond niet-significante lagere odds voor de interventiegroepen ten aanzien van de achteruitgang van de zelf-gerapporteerde gezondheid (enkele afspraak: OR 0,64 (95% BI 0,38 tot 1,07); groepsbijeenkomsten: OR 0,95 (95% BI 0,57 tot 1,57)). Daarnaast vonden zij significant lagere odds voor de interventiegroepen ten aanzien van de achteruitgang van de fysieke gezondheid subschaal (enkele afspraak: OR 0,43 (95% BI 0,22 tot 0,84); groepsbijeenkomsten: OR 0,28 (95% BI 0,14 tot 0,59)).
De overige tien studies rapporteerden geen verschil in de gemiddelde kwaliteit van leven scores (algemeen of fysieke subschaal) (Ell, 2010; Hogg, 2009; Naylor, 2004; Boult, 2008; Chow, 2014; Katon, 2010; Barley, 2014; Coventry, 2015; Marin, 2013; Salisbury, 2018). Voor een overzicht van de gerapporteerde resultaten, zie Tabel 5.
Tabel 5 Overzicht van effect organisatorische interventies op kwaliteit van leven
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Quality of life measurement |
Effect |
|
Barley, 2014
N= 81
(Cochrane review) |
Participants with coronary heart disease (with current chest pain) and depression (identified using two stage screening process to confirm diagnosis) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Well-being scores (WEMBWBS)
Mean Health-related Quality of Life (Physical subscale) |
Int 40.6 (SD 11.2) Con 39.6 (SD 12.3) Absol diff 1, Rel % diff 2.5% Not significant
Int 32.4 (SD10.7) Con 33.3 (SD 9.2) Absol diff 0.7, Rel % diff 2% Not significant
|
|
Behm, 2014
N= 459
(NICE guideline) |
Adults (aged 80 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
self-management support |
Single visit vs control - deterioration in self-rated health by SF-36
Single visit vs control - deterioration in satisfaction with physical health
Group meetings vs control - deterioration in self-rated health by SF-36
Group meetings vs control - deterioration in satisfaction with physical health |
OR 0.64 (0.38 to 1.07)
OR 0.43 (0.22 to 0.84)
OR 0.95 (0.57 to 1.57)
OR 0.28 (0.14 to 0.59)
|
|
Boult, 2008
N=904
(NICE guideline, Cochrane review)
*Boyd 2010 *Boult 2011 *Boult 2013 |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
Mean HRQOL SF-36 - physical. Scale from: 0 to 100. High scores = better outcome. |
- 1.31 (-3.02 to +0.4) |
|
Chow, 2014
N=312
(NICE guideline) |
Adults (aged 65 years or over (however patients of age 60 were included according to the results) |
Patient-oriented approach (holistic assessment); Case- or care management (care coordination); self-management support |
Intervention 1: Case management with home visits. Mean HRQOL SF-36 - physical.
Intervention 2: Case management with phone follow-up. Mean HRQOL SF-36 - physical. |
+3.1 (-1.0 to +5.2)
-0.2 (-2.4 to +2.0) |
|
Coventry, 2015
N= 387
(Cochrane review) |
Participants with depression and diabetes and/or ischaemic heart disease |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (individualized care plan; medication review);
self-management support |
WHOQOL-BREF |
Int 2.99 (SD 0.6) Con 2.91 (SD 0.6) Absol diff 0.08, Rel % diff 3% Significant*
|
|
Ell, 2010
N= 781
(NICE guideline) |
Adults (aged 18 years or over) |
Case- or care management (care coordination) |
Mean difference HRQOL SF12 – physical High scores = better outcome. |
-1.28 (- 3.53 to +0.97) |
|
Hogg, 2009
N=241
(NICE guideline, Cochrane review) |
Adults (aged 50 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (medication review);
Case- or care management (care coordination). |
Mean difference HRQOL SF 36 - physical Scale from: 0 to 100. High scores = better outcome.
Mean difference number of days unhealthy in last 30 days at 15 months |
+ 1.6 (- 0.85 to + 4.05)
- 1.4 (- 4.54 lower to +1.74)
|
|
Katon, 2010
N= 214
(NICE guideline) |
Patients with poorly controlled diabetes, coronary heart disease, or both and coexisting depression |
Patient-oriented approach (individualized care plan, medication review);
self-management support |
Mean global quality of life rating at 12 months. Scale from: 0 to 10. High scores = poor outcome. |
+ 0.8 (- 3.11 to + 4.71) |
|
Martin, 2013
N= 66
(Cochrane review)
* Martin 2015 |
Patients with depression and headache (migraine (66%); and tension-type headache (33%)) |
Patient-oriented approach (individualized care plan);
self-management support |
AQOL |
Int 26.3 (SD 4.76) Con 28.4 (SD 4.97) Absol diff 2.1, Rel % diff 7 % Significant* |
|
Naylor, 2004
N=239
(NICE guideline) |
Adults (aged 65 years or over) identified as inpatients, hospitalized with heart failure, intervention planned discharge to community |
Case- or care management (care coordination) |
Minnesota Living with Heart Failure Questionnaire at 12 months Scale from: 0 to 105. High scores = poor outcome. |
+ 0.2 (- 0.36 lower to + 0.76 higher)
|
|
Salisbury, 2018
N= 1.546
(Original) |
Adult patients (aged 18 years or over) with at least three chronic conditions |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan, medication review);
Case- or care management (care coordination);
self-management support |
HRQoL (EQ-5D-5L)
|
Adjusted difference in means (95% CI) 0·00 (–0·02 to 0·02) |
* het is niet te herleiden hoe Smith (2016) heeft berekend dat dit effect significant is, daarom kan men twijfelen over de conclusie dat er een significant effect is.
Effect van organisatorische interventies op dagelijks functioneren van patiënten met multimorbiditeit
Acht studies onderzochten het effect van hun interventie op het dagelijks functioneren (Eklund, 2013; Ell, 2010; Metzelthin, 2013; Naylor, 2004; Gitlin, 2006; Katon, 2010; Coventry, 2015; Morgan, 2013). Eklund (2013) zag een positief effect, patiënten uit de interventiegroep die een geriatrisch assessment gevolgd door zorgcoördinatie, zorgplanning en follow-up thuis kregen hadden een relatief risico van 1,64 (95% BI 1,01 tot 2,66) op verbetering van ADL. Patiënten uit de interventiegroep hadden ook een iets verlaagd, maar niet significant, relatief risico op achteruitgang in de ADL (RR 0,79, 95% BI 0,55 tot 1,14). Morgan (2013) rapporteerde 106% meer mensen in de interventiegroep die 5 dagen in de week minimaal 30 minuten bewogen, nadat deze volwassenen (18 jaar en ouder) met depressie en diabetes en/of ischemische hartziekte een interventie aangeboden hadden ondergaan met o.a. een verpleegkundig casemanager, 3-maandelijkse 45 minuten reviews met de verpleegkundig casemanager over leefstijlrisicofactoren en zelfmanagement ondersteuning gevolgd door een afspraak bij de huisarts.
Zes studies rapporteerden minimale, niet-significante verschillen ten aanzien van het dagelijks functioneren (Coventry, 2015; Ell, 2010; Metzelthin, 2013; Naylor, 2004; Gitlin, 2006; Katon, 2010).
Tabel 6 Overzicht van effect organisatorische interventies op dagelijks functioneren
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Functional status measurement |
Effect |
|
Coventry, 2015
N= 387
(Cochrane review) |
Participants with depression and diabetes and/or ischaemic heart disease |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (individualized care plan; medication review);
self-management support |
Sheehan Disability Score |
Int 5.73 (SD 2.8) Con 5.83 (SD 2.8) Absol diff 0.1, Rel % diff 2% Significant* |
|
Eklund, 2013
N= 781
(NICE guideline) |
Adults (aged 80 or older or 65-79 with at least one chronic disease and dependent in at least one ADL) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Any improvement in ADL
Any worsening in ADL |
RR 1.64 (1.01 to 2.66)
RR 0.79 (0.55 to 1.14) |
|
Ell, 2010
N= 781
(NICE guideline) |
Adults (aged 18 years or over) |
Case- or care management (care coordination) |
Sheehan Disability Scale of functional impairment at 18 months. Scale from: 1 to 10. Low scores = better outcome |
+ 0.1 (- 0.5 to + 0.7) |
|
Gitlin, 2006
N= 319
(NICE guideline, Cochrane review)
*Gitlin 2009 *Gitlin 2006 |
Adults (aged 70 years or over) |
Patient-oriented approach (individualized care plan);
self-management support |
Mean function – ADL Scale from: 1 to 5. High scores = poor outcome.
Mean function – IADL Scale from: 1 to 5. High scores = poor outcome.
Mean function (Mobility) Scale from: 1 to 5. High scores = poor outcome. |
- 0.1 (-0.21 to + 0.02)
- 0.12 (- 0.26 to + 0.03)
- 0.14 (-0.29 to +0.01)
|
|
Katon, 2010
N= 214
(NICE guideline) |
Patients with poorly controlled diabetes, coronary heart disease, or both and coexisting depression |
Patient-oriented approach (individualized care plan, medication review);
self-management support |
Sheehan social role disability scale at 12 months Scale from: 0 to 10. High scores = poor outcome.
WHODAS-2 activities of daily living at 12 months Scale from: 0 to 4. High scores = better outcome. |
- 0.7 (-1.55 to +0.15)
0 (- 3.07 to + 3.07) |
|
Metzelthin, 2013
N = 346
(NICE guideline) |
Adults (aged 70 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
GARS – ADL subscale, 11-44, higher is worse outcome
GARS – IADL subscale, 7-28, higher is worse outcome |
+ 0.77 (- 0.05 to + 1.59)
+ 0.40 (- 0.54 to +1.34) |
|
Naylor, 2004
N= 239
(NICE guideline) |
Adults (aged 65 years or over) identified as inpatients, hospitalized with heart failure, intervention planned discharge to community |
Case- or care management (care coordination) |
The Enforced Social Dependency Scale at 12 months. Scale from: 12 to 72. High scores = poor outcome. |
+ 0.2 (- 0.3 to + 0.7) |
* het is niet te herleiden hoe Smith (2016) heeft berekend dat dit effect significant is, daarom kan men twijfelen over de conclusie dat er een significant effect is.
Effect van organisatorische interventies op mentale gezondheid van patiënten met multimorbiditeit
Tien studies onderzochten het effect van organisatorische interventies op mentale gezondheid (Ell, 2010; Hogg, 2009; Behm, 2014; Boult, 2008; Chow, 2014; Barley, 2014; Coventry, 2015; Martin, 2013; Morgan, 2013; Bogner 2008). Behm (2014) rapporteerde dat de interventiegroepen significant lagere odds hadden op achteruitgang in tevredenheid met hun psychologische gezondheid (enkele afspraak: OR 0,30 (95% BI 0,16 tot 0,56); groepsbijeenkomsten: OR 0,40 (95% BI 0,22 tot 0,72). Vier studies, die de mentale gezondheid subschaal van de SF-vragenlijst (SF-12 of SF-36) gebruikten, rapporteerden voor hun algemene, oudere populaties slechts niet-significante, kleine verschillen die in één studie zelfs niet-significante verslechtering liet zien. (Ell, 2010; Hogg, 2009; Boult, 2008; Chow, 2014).
Vijf studies onderzochten het effect van hun interventie in een specifieke populatie: tenminste één chronische ziekte gecombineerd met een depressie. (Barley, 2014; Coventry, 2015; Martin, 2013; Morgan, 2013; Bogner, 2008). Barley (2014) vond in de interventiegroep een niet-significant 3-8% hogere gemiddelde score op de verschillende angst- en depressieschalen ten opzichte van de controle groep. De overige vier studies vonden significante verschillen tussen de interventie- en controlegroep in score op de verschillende angst- en depressieschalen. De interventiegroepen hadden 13-54% significant hogere gemiddelde scores ten opzichte van de controlegroepen.
Tabel 7 Overzicht van effect organisatorische interventies op mentale gezondheid
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Mental health measurement |
Effect |
|
Barley, 2014
N= 81
(Cochrane review) |
Participants with coronary heart disease (with current chest pain) and depression (identified using two stage screening process to confirm diagnosis) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Depression (PHQ)
Depression (HADS)
Anxiety (HADS)
Health-related Quality of Life (Mental subscale)
|
Int 12.6 (SD 7.1) Con 12 (SD 6.9) Absol diff 0.6, Rel % diff 8% Not significant
Int 9.5 (SD 4.6) Con 8.8 (SD 4.8) Absol diff 0.7, Rel % diff 8% Not significant
Int 9.9 (SD 7.1) Con 9.5 (SD 5.4) Absol diff 0.4, Rel % diff 4% Not significant
Int 34.5 (SD 11.6) Con 33.6 (SD 12.5) Absol diff 0.9, Rel % diff 3% Not significant |
|
Behm, 2014
N= 459
(NICE guideline) |
Adults (aged 80 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
self-management support |
Single visit vs control - deterioration in satisfaction with psychological health (QOL)
Group vs control - deterioration in satisfaction with psychological health
|
OR 0.30 (0.16 to 0.56)
OR 0.40 (0.22 to 0.72) |
|
Bogner, 2008
N= 64
(Cochrane review) |
Adults (aged 50-80 years) with depression and hypertension |
Patient-oriented approach (individualized care plan);
Case- or care management (care coordination);
self-management support |
CES depression score
|
Int 9.9 (SD 10.7) Con 19.3 (SD 15.2) Absol diff 9.4, Rel % diff 49% Significant |
|
Boult, 2008
N=904
(NICE guideline, Cochrane review)
*Boyd 2010 *Boult 2011 *Boult 2013 |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
SF-36 mental component (HRQOL). Scale from: 0 to 100. High scores = better outcome. |
+ 1.05 (- 1.06 to +3.16) |
|
Chow, 2014
N=312
(NICE guideline) |
Adults (aged 65 years or over (however patients of age 60 were included according to the results) |
Patient-oriented approach (holistic assessment); Case- or care management (care coordination); self-management support |
SF-36 mental component (HRQOL). Scale from: 0 to 100. High scores = better outcome. |
+ 1.9 (- 0.2 to + 4.0) |
|
Coventry, 2015
N= 387
(Cochrane review) |
Participants with depression and diabetes and/or ischaemic heart disease |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (individualized care plan; medication review);
self-management support |
SCL-D13 depression score
PHQ9 depression score
GAD-7 anxiety score
|
Int 1.76 (SD 0.9) Con 2.02 (SD 0.9) Absol diff 2.6, Rel % diff 13% Significant
Int 11.3 (SD 6.5) Con 13.1 (SD 6.5) Absol diff 1.8, Rel % diff 14% Significant
Int 8.2 (SD 5.8) Con 9.7 (SD 5.9) Absol diff 1.5, Rel % diff 15% Significant |
|
Ell, 2010
N= 781
(NICE guideline) |
Adults (aged 18 years or over) |
Case- or care management (care coordination) |
SF12-mental (HRQOL) at 18 months (high scores = better outcome): |
+ 1.61 (- 0.77 to + 3.99) |
|
Hogg, 2009
N=241
(NICE guideline, Cochrane review) |
Adults (aged 50 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (medication review);
Case- or care management (care coordination). |
SF36-mental (HRQOL) at 15 months Scale from: 0 to 100. High scores = better outcome. |
- 1.1 (- 3.75 to + 1.55) |
|
Martin, 2013
N= 66
(Cochrane review)
* Martin 2015 |
Patients with depression and headache (migraine (66%); and tension-type headache (33%)) |
Patient-oriented approach (individualized care plan);
self-management support |
PHQ9 depression score
BDI -Depression score
BAI Anxiety score
|
Int 6.7 (SD 4.6) Con 12.6 (SD 5.3) Absol diff 5.9, Rel % diff 47% Significant
Int 13.1 (SD 8.6) Con 28.7 (SD 9.5) Absol diff 15.6, Rel % diff 54%
Int 10.5 (SD 10.8) Con 16.4 (SD 9.3) Absol diff 5.9, Rel % diff 36% Significant |
|
Morgan, 2013
N= 400
(Cochrane review) |
Adults (18 years and over) with depression and diabetes and/or ischaemic heart disease |
Patient-oriented approach (individualized care plan, medication review);
self-management support |
PHQ9 depression score
|
Int 7.1 (SD 0.8) Con 9.0 (SD 0.9) Absol diff 1.9, Rel % diff 21% Significant |
Effect van organisatorische interventies op mortaliteit
Veertien studies onderzochten het effect van hun interventie op mortaliteit (Alkema, 2007; Beck, 1997; Berglund, 2015; Bouman, 2008; Eklund, 2013; Hogg, 2009; Naylor, 2004; Sandberg, 2015; Slaets, 1997; Sommers, 2000; Boult, 2008; Coburn, 2012; Gitlin, 2006; Legrain, 2011). Zeven studies vonden een lager relatief risico (of lagere hazard ratio) voor overlijden (Alkema, 2007; Beck, 1997; Naylor, 2004; Sommers, 2000; Boult, 2008; Coburn, 2012; Legrain, 2011), maar alleen de studies van Alkema (2007) en Coburn (2012) rapporteerden een significant lager relatief risico en hazard ratio. De andere zeven studies die ook het effect op mortaliteit onderzochten vonden juist een hoger relatief risico, hogere odds ratio of hazard ratio voor de interventiegroep (Berglund, 2015; Bouman, 2008; Eklund, 2013; Hogg, 2009; Sandberg, 2015; Slaets, 1997; Gitlin, 2006), maar alleen het resultaat van Gitlin (2006), de hazard ratio voor overleving na twee jaar, was significant.
Tabel 8 Overzicht van effect organisatorische interventies op mortaliteit
|
1st author, year
N
(Review/original) |
Population |
Elements of organizational intervention |
Mortality measurement |
Effect |
|
Alkema, 2007
N= 781
(NICE guideline) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment);
Case- or care management (care coordination) |
Mortality at 24 months
|
RR 0.61 (0.44 to 0.83) |
|
Beck, 1997
N= 321
(NICE guideline) |
Adults (aged 65 year or over) |
Improving interdisciplinary approach (multidisciplinary care) |
Mortality at 12 months
|
RR 0.56 (0.19 to 1.63) |
|
Berglund, 2015
N= 161
(NICE guideline) |
Adults (aged 65 years or over) |
Improving interdisciplinary approach (multidisciplinary care) |
Mortality (died during total study) at 12 months
|
RR 1.42 (0.65 to 3.10) |
|
Boult, 2008
N= 904
(NICE guideline, Cochrane review) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
Mortality
|
RR 0.88 (0.59 to 1.31) |
|
Bouman, 2008
N=330
(NICE guideline) |
Adults (aged 70-84 years) |
Patient-oriented approach (holistic assessment, individualized care plan) |
Mortality (died during total study) at 18 months
|
RR 1.34 (0.81 to 2.22) |
|
Coburn, 2012
N= 1736
(NICE guideline) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination);
self-management support |
Mortality at 4.2 years
|
HR 0.73 (0.55 to 0.97) |
|
Eklund, 2013
N= 781
(NICE guideline) |
Adults (aged 80 or older or 65-79 with at least one chronic disease and dependent in at least one ADL) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Mortality at 12 months
|
RR 1.49 (0.91 to 2.45) |
|
Gitlin, 2006
N= 319
(NICE guideline, Cochrane review)
*Gitlin 2009 *Gitlin 2006 |
Adults (aged 70 years or over) |
Patient-oriented approach (individualized care plan);
self-management support |
Survival - 2 years
Survival - 3 years
Survival - 4 years
|
HR 0.39 (0.18 to 0.86)
HR 0.74 (0.45 to 1.23)
HR 0.76 (0.49 to 1.2) |
|
Hogg, 2009
N=241
(NICE guideline, Cochrane review) |
Adults (aged 50 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (medication review);
Case- or care management (care coordination). |
Mortality at 15 months
|
OR 7.58 (0.78 to 73.54) |
|
Legrain, 2011
N=665
(NICE guideline) |
Adults (aged 70 years or over) |
Patient-oriented approach (medication review);
self-management support |
Mortality
|
RR 0.86 (0.62 to 1.19) |
|
Naylor, 2004
N= 239
(NICE guideline) |
Adults (aged 65 year or over) |
Case- or care management (care coordination) |
Mortality at 12 months
|
RR 0.87 (0.41 to 1.86) |
|
Sandberg, 2015
N=153
(NICE guideline) |
Adults (aged 65 years or over) |
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Mortality (died during total study) at 12 months
|
RR 3.04 (0.87 to 10.62) |
|
Slaets, 1997
N=237
(NICE guideline) |
Adults (aged 75 years or over) |
Improving interdisciplinary approach (multidisciplinary care);
Patient-oriented approach (holistic assessment, individualized care plan);
Case- or care management (care coordination) |
Mortality at unclear time point
|
RR 2.49 (0.96 to 6.49) |
|
Sommers, 2000
N= 734
(NICE guideline, Cochrane review) |
Adults (aged 65 years or over) living in the community, with difficulties living independently |
Improving interdisciplinary approach (multidisciplinary care) |
Mortality at 24 months
|
RR 0.87 (0.51 to 1.47) |
Bewijskracht van de literatuur
De bewijskracht van deze gerandomiseerde studies start op redelijk, vanwege de inherente risk of bias die ontstaat door het niet kunnen blinderen van deelnemer en onderzoeker. Uitzondering is mortaliteit, daar start de bewijskracht op hoog.
Tevredenheid van patiënt, naaste(n) en/of zorgverlener
De bewijskracht voor de uitkomstmaat tevredenheid van patiënt, naaste(n) en/of zorgverlener is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias). Er is niet verlaagd voor beperkingen in extrapoleerbaarheid (bias t.g.v. indirectheid), omdat de grootste studie (Salisbury, 2018) de juiste populatie heeft geïncludeerd en de overige resultaten dezelfde kant op wijzen (ondanks dat het een indirecte populatie betreft) en een vergelijkbaar meetinstrument heeft gebruikt als de kleinere studies.
Ervaren zorglast van patiënt/mantelzorger (inclusief continuïteit van zorg)
De bewijskracht voor de uitkomstmaat ervaren zorglast van patiënt/mantelzorger is met 2 niveaus verlaagd gezien de tegenstrijdige resultaten (inconsistentie) en beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), omdat de studies verschillende meetinstrumenten gebruiken en verschillende populaties onderzoeken; De bewijskracht voor de uitkomstmaat continuïteit van zorg is met 1 niveau verlaagd vanwege extrapoleerbaarheid (bias t.g.v. indirectheid) bij één van de twee studies die qua aantal deelnemers een groot aandeel heeft (1/3).
Acuut zorgverbruik in specifieke populatie
De bewijskracht voor de uitkomstmaat acuut zorgverbruik in een specifieke populatie is met 1 niveau verlaagd gezien beperkingen in extrapoleerbaarheid (bias t.g.v. indirectheid) vanwege het includeren van indirecte populaties (ouderen, niet specifiek met multimorbiditeit).
Zorgverbruik in algemene populatie
De bewijskracht voor de uitkomstmaat acuut zorgverbruik in een algemene populatie is met 1 niveau verlaagd gezien beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), vanwege het includeren van een indirecte populaties (ouderen, niet specifiek multimorbiditeit) in meeste van de studies.
Geneesmiddel gerelateerde schade
Vanwege het lage aantal studies en vanwege de heterogeniteit van uitkomstmaten is besloten geen GRADE beoordeling te doen.
Kwaliteit van leven
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met 1 niveau verlaagd vanwege beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), vanwege het includeren van indirecte populaties (ouderen, niet specifiek met multimorbiditeit)
Dagelijks functioneren
De bewijskracht voor de uitkomstmaat dagelijks functioneren is met 1 niveau verlaagd vanwege beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), vanwege het includeren van indirecte populaties (ouderen, niet specifiek met multimorbiditeit).
Mentale gezondheid
De bewijskracht voor de uitkomstmaat mentale gezondheid is met 1 niveau verlaagd vanwege beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), vanwege het includeren van indirecte populaties (ouderen, niet specifiek met multimorbiditeit). De bewijskracht is voor de algemene studies met een interventie die zich niet specifiek richtte op het verbeteren van depressieve symptomen extra verlaagd met 1 niveau vanwege risk of bias (vanwege het gebruiken van kwaliteit van leven – mentale gezondheid subschaal in tegenstelling tot de specifieke interventies die zich richten op depressie).
Mortaliteit
De bewijskracht voor de uitkomstmaat met is 2 niveaus verlaagd vanwege beperkingen in de extrapoleerbaarheid (bias t.g.v. indirectheid), vanwege het includeren van indirecte populaties (ouderen, niet specifiek met multimorbiditeit) en tegenstrijdige resultaten (inconsistentie).
Zoeken en selecteren
De werkgroep baseerde zich bij het opstellen van de zoekvraag op twee eerder geïdentificeerde documenten uit het werkveld. In een Cochrane review van Smith (2016) wordt de effectiviteit van interventies voor patiënten met multimorbiditeit in de eerste lijn en in de algemene samenleving omschreven. In de NICE-richtlijn (Barnett, 2016) is o.a. systematisch gezocht om interventies te identificeren die uitkomsten voor patiënten met multimorbiditeit zouden kunnen verbeteren. De geïdentificeerde interventies kunnen geclassificeerd worden op basis van het organisatieniveau waar de interventies zich op richten. In de Cochrane review van Smith (2016) worden verschillende soorten interventies onderscheiden op basis van de taxonomie van de Cochrane Effective Practice and Organisation of Care (EPOC) uit 2002. In Figuur 1 staan de vijf soorten interventies die in de Cochrane review van Smith (2016) zijn beschreven (financiële, regelgevings-, organisatorische, individuele (professional georiënteerde) en individuele (patiënt georiënteerde interventies) visueel weergegeven, ingedeeld op het organisatieniveau waar deze interventie geïmplementeerd zou moeten worden.
Figuur 1. De verschillende organisatieniveaus in de zorg en de vijf soorten interventies: financiële, regelgevings-, organisatorische, individuele (professional georiënteerde), individuele (patiënt georiënteerde) interventies. De interventies zijn ingedeeld op het organisatieniveau waar de interventie geïmplementeerd wordt. Interventies op macroniveau hebben invloed op de praktijk op alle niveaus, interventies op mesoniveau alleen op de praktijk op het microniveau. De werkgroep focuste zich op het mesoniveau: de lokale zorgorganisatie, en daarom op organisatorische interventies.
De werkgroep besloot zich in deze module uitsluitend te richten op organisatorische interventies op mesoniveau (in de lokale zorgorganisatie). De complexe interventies in de Cochrane review van Smith (2016) en de NICE richtlijn werden verder geclassificeerd door verschillende elementen te onderscheiden, om op die manier inzicht te krijgen in de onderdelen die mogelijk bijdragen aan het effect van de interventie. Interventies die alleen inzetten op bijvoorbeeld zelfmanagement van de patiënt (door middel van training of educatie) zijn volgens de werkgroep dusdanig andere interventies qua organisatie en uitvoering (individuele, patiënt-georiënteerde interventies), dat de werkgroep deze buiten beschouwing liet indien dat het enige element van de interventie was.
Daarnaast heeft de werkgroep uitkomstmaten geformuleerd die belangrijk zijn bij de zorg voor patiënten met multimorbiditeit.
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van organisatorische interventies met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg voor patiënten met multimorbiditeit?
P: Patiënten met multimorbiditeit
I: Organisatorische interventies (zoals omschreven in de Cochrane-review van Smith et al. (2016) met ten minste één element dat zich richt op (het verbeteren van) geïntegreerde zorg
C: Standaardzorg
O: Tevredenheid met de zorg (van patiënt, naaste(n) en/of arts), geneesmiddel gerelateerde schade (adverse drug events), zorgverbruik*, kwaliteit van leven, dagelijks functioneren, mentale gezondheid, ervaren zorglast van patiënt/mantelzorger, mortaliteit
* Onder zorgverbruik kan o.a. verstaan worden aantal polikliniekbezoeken bij medisch specialisten, overmatige, onnodige of dubbele diagnostiek/afspraken, aantal spoedeisendehulpbezoeken, aantal en lengte (aantal dagen) van ziekenhuisopnames.
Relevante uitkomstmaten
De werkgroep achtte tevredenheid met de zorg (van patiënt, naaste(n) en arts), geneesmiddel gerelateerde schade (adverse drug events) en zorgverbruik voor de besluitvorming cruciale uitkomstmaten; en kwaliteit van leven, dagelijks functioneren, mentale gezondheid, ervaren zorglast van patiënt/mantelzorger, mortaliteit
voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaat, maar hanteerde de in de studies gebruikte definities. De werkgroep ging op zoek naar significante verschillen.
Zoeken en selecteren (Methode)
Om deze zoekvraag te beantwoorden is onder andere de NICE-richtlijn Multimorbidity: clinical assessment and management, in het bijzonder hoofdstuk 10.1 Models of care gebruikt. Echter, deze vraag onderzocht uitsluitend complexe organisatorische interventies die uit meerdere elementen bestond voor niet-gespecificeerde patiënten met multimorbiditeit of een indirecte populatie ouderen. Voor deze uitgangsvraag is daarom gekozen voor een bredere aanpak en de zoekstrategie van deze module vereenvoudigd nogmaals uitgevoerd met minder strenge selectiecriteria ten aanzien van de complexe interventies (één element voldoende, tenzij alleen zelfmanagement). Interventies die zich alleen richtten op het verbeteren van de aandoenings-gerelateerde uitkomstmaten werden niet geïncludeerd.
De databases Medline (via OVID) en Embase (via Embase.com) is op 8 mei 2019 met relevante zoektermen gezocht naar vergelijkend onderzoek, zowel primaire studies als systematic reviews van vergelijkend onderzoek. De zoekverantwoording is weergegeven in bijlage 16. De literatuurzoekactie leverde 192 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- (Een systematische review van) vergelijkend onderzoek waarin patiënten werden beschreven met multimorbiditeit en één van de genoemde uitkomstmaten gerapporteerd werd
- Een organisatorische interventie, die voldoet aan de omschrijving zoals beschreven door Smith et al. in 2016, gebaseerd op de Cochrane Effective Practice and Organisation of Care (EPOC) uit 2002. De organisatorische interventies kunnen verder onderverdeeld worden in:
- Zorgprofessional-georiënteerde interventies. Voorbeelden: revisie/verschuiving van professionele rollen (zoals betrekken van een apotheker om medicatiebeoordelingen te doen die voorheen door artsen werden verricht), multidisciplinaire teams, integratie van services of continuïteit van zorg verbeteren door follow-up coördinatie of case-management.
- Interventies gericht op ondersteuning van de patiënt. Voorbeelden: online-bestellen van medicatie, mechanismes om input van patiënten mee te nemen bij de zorgorganisatie
- Structurele interventies. Voorbeelden: verandering in setting of locatie van zorg (zoals bijvoorbeeld consulten in de thuissituatie), verandering in fysieke structuur/faciliteiten/benodigdheden, verandering in Elektronisch Patiënten Dossier (EPD), aanwezigheid van kwaliteitsmonitoringssystemen, organisatie van staf
Interventies die gericht zijn op educatie/zelfmanagement van de patiënt (bijvoorbeeld zelfmanagement interventies) zijn volgens deze definitie geen organisatorische interventies.
Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 22 studies geëxcludeerd (zie exclusietabel in bijlage 17) en 2 studies (Smith, 2016; Salisbury, 2018) definitief geselecteerd. Tevens is hoofdstuk 10.1 Models of Care uit de NICE richtlijn (Barnett, 2016), dat als startpunt voor deze zoekvraag werd gebruikt geïncludeerd.
Resultaten
Drie onderzoeken zijn opgenomen in de literatuuranalyse (Barnett, 2016; Smith, 2016; Salisbury 2018). De NICE-richtlijn (Barnett, 2016) beschrijft studies die volwassen patiënten met multimorbiditeit includeerden in het hoofdstuk ‘What models of care improve outcomes in people with multimorbidity?’. De Cochrane review (Smith, 2016) is een herziening van de review uit 2012, en beschrijft studies met volwassen patiënten met multimorbiditeit in de eerste lijn en in de algemene samenleving. Er is besloten om deze review op te nemen omdat de eerste lijn niet in alle landen vergelijkbaar is met de eerste lijn in Nederland (de eerste lijn in de Verenigde Staten bevindt zich bijvoorbeeld hoofdzakelijk in het ziekenhuis) en omdat de richtlijnwerkgroep op zoek is naar effectieve elementen (en deze kunnen ook uit de eerste lijn of samenleving komen). Als laatste is een cluster-randomised controlled trial (RCT) van Salisbury (2018) opgenomen. Deze studie includeerde patiënten met ten minste drie verschillende type chronische aandoeningen. Deze cluster-RCT is uitgevoerd in de eerste lijn (huisartsenpraktijken in Engeland en Schotland), maar de werkgroep heeft besloten deze trial op te nemen vanwege de kwaliteit van de studie en de overeenkomst van de populatie, elementen van de interventie en de uitkomstmaten.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- American Geriatrics Society (AGS) Expert Panel on the Care of Older Adults with Multimorbidity. (2012). Guiding Principles for the Care of Older Adults with Multimorbidity: An Approach for Clinicians. Journal of the American Geriatrics Society, 60(10), E1–E25. https://doi.org/10.1111/j.1532-5415.2012.04188.x
- Barnett, N. et al. (2016). Multimorbidity: Clinical assessment and management NICE guideline [NG56]. https://www.nice.org.uk/guidance/ng56/evidence/full-guideline-pdf-2615543103
- Cochrane Effective PRactice and Organisation of Care. (2002). EPOC Taxonomy of Interventions. https://epoc.cochrane.org/sites/epoc.cochrane.org/files/public/uploads/EPOC%20Taxonomy%20of%20Interventions%202002.pdf
- Cramm, J. M., & Nieboer, A. P. (2013). High-quality chronic care delivery improves experiences of chronically ill patients receiving care. International Journal for Quality in Health Care, 25(6), 689–695. https://doi.org/10.1093/intqhc/mzt065
- Dijk, L. van, & Nederlands instituut voor onderzoek van de gezondheidszorg (Utrecht). (2016). Informatiebehoeften van patiënten over geneesmiddelen. Nivel.
- Federatie Medisch Specialisten. (2019). FMS Visiedocument Samen beslissen. https://www.demedischspecialist.nl/sites/default/files/FMS_Visiedoc-SamenBeslissen%282019%29_v03.pdf
- Huiskes, V. J. B., Burger, D. M., van den Ende, C. H. M., & van den Bemt, B. J. F. (2017). Effectiveness of medication review: A systematic review and meta-analysis of randomized controlled trials. BMC Family Practice, 18(1), 5. https://doi.org/10.1186/s12875-016-0577-x
- Hussey, P. S., Schneider, E. C., Rudin, R. S., Fox, D. S., Lai, J., & Pollack, C. E. (2014). Continuity and the Costs of Care for Chronic Disease. JAMA Internal Medicine, 174(5), 742. https://doi.org/10.1001/jamainternmed.2014.245
- Kern, L. M., Seirup, J. K., Casalino, L. P., & Safford, M. M. (2017). Healthcare Fragmentation and the Frequency of Radiology and Other Diagnostic Tests: A Cross-Sectional Study. Journal of General Internal Medicine, 32(2), 175–181. https://doi.org/10.1007/s11606-016-3883-z
- Kruis, A. L., Smidt, N., Assendelft, W. J., Gussekloo, J., Boland, M. R., Rutten-van Mölken, M., & Chavannes, N. H. (2013). Integrated disease management interventions for patients with chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews. https://doi.org/10.1002/14651858.CD009437.pub2
- Makovski, T. T., Schmitz, S., Zeegers, M. P., Stranges, S., & van den Akker, M. (2019). Multimorbidity and quality of life: Systematic literature review and meta-analysis. Ageing Research Reviews, 53, 100903. https://doi.org/10.1016/j.arr.2019.04.005
- Marengoni, A., Angleman, S., Melis, R., Mangialasche, F., Karp, A., Garmen, A., Meinow, B., & Fratiglioni, L. (2011). Aging with multimorbidity: A systematic review of the literature. Ageing Research Reviews, 10(4), 430–439. https://doi.org/10.1016/j.arr.2011.03.003
- Nancholas, S. (1998). A Logical Framework. Health Policy and Planning, 13(2), 189–193. https://doi.org/10.1093/heapol/13.2.189
- Nolte, E., Knai, C., Hofmarcher, M., Conklin, A., Erler, A., Elissen, A., Flamm, M., Fullerton, B., Sönnichsen, A., & Vrijhoef, H. J. M. (2012). Overcoming fragmentation in health care: Chronic care in Austria, Germany and the Netherlands. Health Economics, Policy and Law, 7(01), 125–146. https://doi.org/10.1017/S1744133111000338
- NVKG. (2020). Richtlijn Polyfarmacie bij Ouderen. https://richtlijnendatabase.nl/richtlijn/polyfarmacie_bij_ouderen/polyfarmacie_bij_ouderen_-_korte_beschrijving.html
- Nyweide, D. J., Anthony, D. L., Bynum, J. P. W., Strawderman, R. L., Weeks, W. B., Casalino, Lawrence. P., & Fisher, E. S. (2013). Continuity of Care and the Risk of Preventable Hospitalization in Older Adults. JAMA Internal Medicine, 173(20), 1879. https://doi.org/10.1001/jamainternmed.2013.10059
- Pérez-Jover, V., Mira, J., Carratala-Munuera, C., Gil-Guillen, V., Basora, J., López-Pineda, A., & Orozco-Beltrán, D. (2018). Inappropriate Use of Medication by Elderly, Polymedicated, or Multipathological Patients with Chronic Diseases. International Journal of Environmental Research and Public Health, 15(2), 310. https://doi.org/10.3390/ijerph15020310
- Peytremann-Bridevaux, I., Arditi, C., Gex, G., Bridevaux, P.-O., & Burnand, B. (2015). Chronic disease management programmes for adults with asthma. Cochrane Database of Systematic Reviews. https://doi.org/10.1002/14651858.CD007988.pub2
- Pimouguet, C., Le Goff, M., Thiebaut, R., Dartigues, J. F., & Helmer, C. (2011). Effectiveness of disease-management programs for improving diabetes care: A meta-analysis. Canadian Medical Association Journal, 183(2), E115–E127. https://doi.org/10.1503/cmaj.091786
- Rodriguez-Blazquez, C., João Forjaz, M., Gimeno-Miguel, A., Bliek-Bueno, K., Poblador-Plou, B., Pilar Luengo-Broto, S., Guerrero-Fernández de Alba, I., Maria Carriazo, A., Lama, C., Rodríguez-Acuña, R., Cosano, I., Bedoya, J. J., Angioletti, C., Carfì, A., Di Paola, A., Navickas, R., Jureviciene, E., Dambrauskas, L., Liseckiene, I., … Prados-Torres, A. (2020). Assessing the Pilot Implementation of the Integrated Multimorbidity Care Model in Five European Settings: Results from the Joint Action CHRODIS-PLUS. International Journal of Environmental Research and Public Health, 17(15), 5268. https://doi.org/10.3390/ijerph17155268
- Romano, M. J., Segal, J. B., & Pollack, C. E. (2015). The Association Between Continuity of Care and the Overuse of Medical Procedures. JAMA Internal Medicine, 175(7), 1148. https://doi.org/10.1001/jamainternmed.2015.1340
- Salisbury, C., Man, M. S., Bower, P., Guthrie, B., Chaplin, K., Gaunt, D. M., Brookes, S., Fitzpatrick, B., Gardner, C., Hollinghurst, S., Lee, V., McLeod, J., Mann, C., Moffat, K. R., & Mercer, S. W. (2018). Management of multimorbidity using a patient-centred care model: A pragmatic cluster-randomised trial of the 3D approach. Lancet, 392(10141), 41–50. https://doi.org/10.1016/S0140-6736(18)31308-4
- Smith, S. M., Soubhi, H., Fortin, M., Hudon, C., & O’Dowd, T. (2012). Managing patients with multimorbidity: Systematic review of interventions in primary care and community settings. BMJ (Online), 345(7874). https://doi.org/10.1136/bmj.e5205
- Valderas, J. M., Gangannagaripalli, J., Nolte, E., Boyd, C., Roland, M., Sarria‐Santamera, A., Jones, E., & Rijken, M. (2019). Quality of care assessment for people with multimorbidity. Journal of Internal Medicine. https://doi.org/10.1111/joim.12881
- van de Pol, M. H. J., Fluit, C. R. M. G., Lagro, J., Lagro-Janssen, A. L. M., & Olde Rikkert, M. G. M. (2017). [A model for shared decision-making with frail older patients: Consensus reached using Delphi technique]. Nederlands Tijdschrift Voor Geneeskunde, 161, D811.
- van de Pol, M. H. J., Fluit, C. R. M. G., Lagro, J., Slaats, Y. H. P., Olde Rikkert, M. G. M., & Lagro-Janssen, A. L. M. (2016). Expert and patient consensus on a dynamic model for shared decision-making in frail older patients. Patient Education and Counseling, 99(6), 1069–1077. https://doi.org/10.1016/j.pec.2015.12.014
- Verhoeff, M., van der Zaag, H. J., Vermeeren, Y., & van Munster, B. C. (2018). Secondary care experiences of patients with multiple chronic conditions. The Netherlands Journal of Medicine, 76(9), 397–406.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-04-2021
Algemene gegevens
De ontwikkeling van dit adviesrapport werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van het adviesrapport is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die vaak betrokken zijn bij de zorg voor patiënten met multimorbiditeit in het ziekenhuis.
Werkgroep:
- Mw. prof. dr. B.C. van Munster, internist-geriater, voorzitter, namens de Nederlandse Internisten Vereniging (NIV), sectie ouderengeneeskunde
- Mw. drs. O.M. Smit, internist-ouderengeneeskunde, voorzitter, namens de Nederlandse Internisten Vereniging (NIV), sectie ouderengeneeskunde
- Dhr. drs. A.J. Arends, klinisch geriater bij Havenue/Maasstadziekenhuis, voorzitter Nederlandse Vereniging voor Klinische Geriatrie (NVKG) namens de NVKG
- Mw. W.M.E. Bil, MANP, verpleegkundig specialist AGZ, namens de Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Mw. drs. A.M.J. Coremans, internist, namens de Nederlandse Internisten Vereniging (NIV)
- Dhr. drs. C. van Daelen, adviseur Patiëntbelang, namens de Patiëntenfederatie Nederland (PFNL)
- Mw. drs. M. Maas, revalidatiearts, namens de Nederlandse Vereniging van Revalidatiesartsen (VRA)
- Mw drs. E.M. Meulenberg, klinisch geriater Elisabeth-Tweesteden Ziekenhuis, namens de Nederlandse Vereniging voor Klinische Geriatrie (NVKG)
Met ondersteuning van:
- Mw. M. Verhoeff, MSc., adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dhr. Ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Mw. D. Tennekes, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Bij het opstellen van dit document heeft de volgende persoon namens zijn partij meegelezen als agendalid:
- Dhr. prof. dr. J.S. Burgers, hoofd afdeling Richtlijnontwikkeling & Wetenschap Nederlands Huisartsen Genootschap (NHG), Bijzonder hoogleraar ‘Promoting Personalised Care in Clinical Practice Guidelines’ aan de Faculty of Health, Medicine and Life Sciences (FHML) van de Universiteit Maastricht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Meijer-Smit* |
Internist ouderengeneeskunde, Zaans Medisch Centrum |
Bestuurslid NIV Ouderengeneeskunde |
Geen |
Geen actie |
|
04/2015 - heden: Universitair Medisch Centrum Groningen te Groningen (20%), vanaf 2019 fulltime 2019 - heden: Hoogleraar Interne Geneeskunde, ihb. Ouderengeneeskunde/Geriatrie 2019 - heden: Plaatsvervangend opleider geriatrie 2010 – 2019 Afdeling Geriatrie, Gelre Ziekenhuizen te Apeldoorn (80%): 2017 - 2019: Voorzitter expertise centrum ouderengeneeskunde (ECO) 2017 - 2019: Opleider stage interne ouderengeneeskunde 2016 - 2017: Voorzitter werkgroep toekomstgerichte chronische zorg 2014 - 2019 Medisch manager vakgroep geriatrie 2014 - 2019 Bestuurslid Commissie chronische zorg 2010 - 2019 Wetenschappelijke Advies Raad, vanaf 2018 voorzitter• 2017 - 2019: Opleider stage interne ouderengeneeskunde |
Onbetaalde nevenwerkzaamheden: 2020 - heden Voorzitter Alzheimer Centrum Groningen 2020 - heden Afgevaardigde NIV DHFA 2020 - heden Board member ‘European Academy of Medicine of Ageing’ 2019 - heden Expertgroep ‘Aging Academy' 2016 - heden Voorzitter (2019 lid) werkgroep kwaliteit en richtlijnen, kerngroep ouderengeneeskunde 2016 - heden Redacteur 'Tijdschrift gerontologie en geriatrie' 2017 - heden Lid platform kwaliteit NIV namens kerngroep ouderengeneeskunde 2015 - heden Lid werkgroep wetenschap Nederlandse Vereniging Klinische Geriatrie |
Regievoering bij multimorbiditeit is een van mijn aandachtsgebieden binnen de zorg en mijn onderzoekslijn |
Geen actie |
|
|
Bil |
Verpleegkundig specialist AGZ, fulltime werkzaam bij OLVG sinds 2018 (2011-2018 MC Slotervaart) |
Gastdocent (betaald) Lid-beroepsgenoot Regionaal Tuchtcollege voor de Gezondheidszorg te Den Haag (betaald) Lid Landelijk Netwerk Klinische Geriatrie (V&VN) Onbetaald Lid/vicevoorzitter Landelijk Verpleegkundig Specialisten Klinische Geriatrie (V&VN VS) (onbetaald) Lid werkgroep/lid begeleidingscommissie Doorontwikkeling signaleringsinstrument oudermishandeling (VWS) (vacatiegelden) Lid Codecommissie geneesmiddelen en hulpmiddelen (GMH) (vactiegelden) Lid Kamer Verpleegkundig specialisten Capaciteitsorgaan (vacatiegelden) |
Geen |
Geen actie |
|
klinisch geriater, Maasstadziekenhuis en medisch manager |
voorzitter NVKG (vacatiegelden) vanaf 5-2-2019 secretaris kwaliteit NVKG (vacatiegelden) tot 5-2-2019 Secretaris bestuur Dutch Hip Fracture Audit (vacatiegelden) voorzitter project Modulair onderhoud (vacatiegelden) tot 31-12-2020 |
Geen |
Geen actie |
|
|
Van Daelen |
Programma-coördinator Kwaliteitsgelden Patiëntenfederatie bij Patiëntenfederatie Nederland (ca 28 uur/week) Adviseur Patiëntenbelang bij Patiëntenfederatie Nederland (ca. 4 uur/week) |
Geen |
Geen |
Geen actie |
|
Coremans |
Internist MedischLeider Chronische Zorg |
Geen |
In Bernhoven betrokken bij het opzetten van een poli Intensieve Chronische Zorg |
Geen actie |
|
Maas |
Revalidatiearts, contract bij klimmendaal. Volledig gedetacheerd naar Gelre ziekenhuizen |
Lid VRA, Werkgroep WCN, bijeenkomst ziekenhuis revalidatie (allemaal ontbetaald) |
Geen |
Geen actie |
|
Meulenberg |
Klinisch geriater, Elisabeth TweeSteden ziekenhuis |
Detachering vanuit ETZ naar NVKG, kwaliteitszaken |
Geen |
Geen actie |
|
Verhoeff |
Adviseur bij het Kennisinstituut van Federatie Medisch Specialisten |
Promotieonderzoek naar multimorbiditeit, regie en zorgorganisatie in het ziekenhuis (gefinancierd door het Kennisinstituut) |
Geen |
Geen actie |
|
Barneveld |
Algemeen Directeur Kennisinstituut van de Federatie Medisch Specialisten |
Raad van Advies SKML |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een invitational conference voor patiëntenverenigingen in samenwerking met de Patiëntenfederatie Nederland, een focusgroep, een afgevaardigde patiëntenvereniging in de werkgroep en een schriftelijke inventarisatie door de Patiëntenfederatie Nederland. De verslagen hiervan [zie bijlagen] zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. Het concept adviesrapport is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een enquête onder medisch specialisten en een schriftelijke inventarisatie onder patiëntenorganisaties. Tevens zijn er knelpunten aangedragen via invitational conferences voor wetenschappelijke verenigingen en patiëntenorganisaties. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
