Mifepriston + misoprostol vs. misoprostol bij Miskraam
Uitgangsvraag
Aanbeveling
Geef bij de medicamenteuze behandeling van een miskraam een combinatietherapie van mifepriston met misoprostol, waarbij er een tijdsinterval van 24 tot 48 uur tussen de mifepriston en misoprostol dient te zitten met een doseringsschema volgens lokaal protocol.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Succesvolle behandeling
Er werden drie studies in deze vergelijking geïncludeerd en deze lieten een toegevoegde waarde zien van mifepristonvoorbehandeling voor het percentage succesvolle behandeling van een miskraam. Het gepoolde effect laat zien dat in de interventiegroep het percentage succesvolle behandelingen 85% (190/223) was en in de controlegroep was het percentage succesvolle behandelingen 58% (131/224) (figuur 1). Dit leidde tot een risk ratio van 1,79 (95% BI 1,10 – 2,93, p=0,12) met een random effect model en met een hoge heterogeniteit (I2 87%). Dit houdt in dat er statistisch significant en een klinisch relevant verschil is tussen de twee interventiegroepen. De kwaliteit van de studies werd gegradeerd als laag, twee studies waren niet geblindeerd hoewel in een studie de beoordelaar van de uitkomsten was geblindeerd voor de interventie.
De drie studies lieten een significant voordeel zien voor de behandeling van mifepriston met misoprostol voor een miskraam. Bij 85% patiënten behandeld met combinatie van mifepriston en misoprostol was er sprake van een succesvolle behandeling. In de groep met alleen misoprostol was dit 58%. De studie van Fang uit 2009 rapporteert voor beide groepen hoge percentages volledige expulsie. Maar ook een hoog percentage re-interventie (76% in combinatie groep en 80% in misoprostol alleen groep) zonder significant verschil tussen beiden groepen. Ook de meest recente studies van Sinha en Schreiber uit 2018 in de NEJM, laten een voorkeur zien voor de combinatie van mifepriston en misoprostol voor succesvolle behandeling van een miskraam.
De bewijskracht voor de primaire uitkomstmaat succesvolle behandeling met combinatie behandeling mifepriston + misoprostol ten opzichte van een behandeling met misoprostol alleen heeft een lage gradering van evidence. Dit is te verklaren door de grote mate van heterogeniteit binnen en tussen de drie studies. De systematische review van Van den Berg (2015) liet ook een grote heterogeniteit in behandelregimes en vergelijkingen tussen studies zien.
De werkgroep is van mening dat op basis de drie studies er een voorkeur is voor een combinatie van mifepriston en misoprostol bij de behandeling van een miskraam.
Beide behandelmethoden kunnen poliklinisch worden voorgeschreven. De therapietrouw zal bij de combinatietherapie met eenmalig mifepriston voorafgaand aan de misoprostol niet in het geding komen. In overleg met de voorschrijvend hulpverlener kan cliënte voor beide regimes zelf bepalen wanneer zij dit wil innemen dan wel inbrengen. In de beschreven studies werd een dosering van 200 milligram mifepriston voorgeschreven. In de Triple M studie (voor meer informatie zie kopje ‘Kennislacunes’) die momenteel loopt wordt er 600 milligram mifepriston voorgeschreven. Hier dient bij het opnemen van de resultaten van de Triple M studie in de toekomst rekening mee gehouden te worden.
Er is een verschil in tijdsduur tussen de start van een medicamenteuze behandeling van een miskraam met misoprostol in vergelijking tot mifepriston + misoprostol, en het optreden van de miskraam. De tijdsduur bij mifepriston + misoprostol is 1-2 dagen langer omdat de mifepriston 24-48 uur voorafgaand aan de misoprostol gegeven wordt. Een patiënt dient hier goed over ingelicht worden. Dit bij voorkeur al voorafgaand aan de verwijzing naar een huisarts, abortuskliniek of ziekenhuis na vaststelling van de miskraam.
In studies over APLA’s wordt beschreven dat het tijdsinterval tussen mifepriston en misoprostol minimaal 8 uur dient te zijn.
Overige uitkomsten
Er lijkt dat er geen verschil bestaat in mate van complicaties zoals serieuze bijwerkingen waaronder braken of misselijkheid tussen combinatie behandeling of behandeling met misoprostol alleen. Evidence hiervoor is echter laag gegradeerd. Schreiber (2018) rapporteerde over de noodzaak tot bloedtransfusie, pelviene infectie, misselijkheid en diarree. De incidentie van bloedtransfusie was laag en vergelijkbaar in beide groepen (300 patiënten, RR 3,04, 95% CI 0,32 – 28,90). Ook de incidentie van pelviene infectie was laag en gelijk in beide groepen (300 patiënten, RR 1,01, 95% CI 0,14 – 7,10). Misselijkheid en braken waren meer voorkomende bijwerkingen, maar de incidentie verschilde niet tussen de groepen (misselijkheid: 300 patiënten, RR 1,01, 95% CI 0,76 – 1,36; diarree: 300 patiënten, RR 0,94, 95% CI 0,66 – 1,35).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het belangrijkste doel van de medicamenteuze behandeling van een miskraam is een succesvolle behandeling met zo min mogelijk complicaties en noodzaak tot re-interventies en een zo groot mogelijke patiënttevredenheid. Er lijkt geen verschil te zijn in patiënttevredenheid tussen de combinatie therapie en behandeling met misoprostol alleen. De bewijskracht hiervoor op basis van de beschreven studies is laag. Alleen de studie van Sinha liet een significant verschil zien in de patiënttevredenheid ten faveure van de combinatie mifepriston met misoprostol.
Kosten (middelenbeslag)
Het kostenaspect in beschouwing nemend, brengt medicamenteuze therapie met het met alleen misoprostol iets lagere kosten met zich mee dan wanneer een combinatie van mifepriston samen met misoprostol wordt voorgeschreven (een tablet van 200 milligram mifepriston kost 11,99 euro; misoprostol 800 microgram kost 4,18 euro). Daar tegenover staat dat indien de combinatie behandeling een hoger succespercentage met zich mee brengt dat dit weer kosten bespaart (minder chirurgische behandelingen, minder ziekenhuis opnames). Al met al zijn de kosten voor beide interventies laag.
Aanvaardbaarheid voor de overige relevante stakeholders
In de studies uit de literatuuranalyse zijn geen lange termijn-effecten van deze behandelingen beschreven. De medicatie wordt in een tijdsbestek van een paar dagen gebruikt en de van de werkzame stoffen worden geen lange termijn nadelige effecten verwacht.
Haalbaarheid en implementatie
Het huidige behandelbeleid voor medicamenteuze behandeling van een miskraam ook wel niet-vitale zwangerschap genoemd, kent grote praktijkvariatie. De verschillen zijn onder andere te vinden in combinatie van mifepriston en misoprostol versus monotherapie met misoprostol alleen. De verwachting is dat de aanbeveling van de werkgroep geen implementatieproblemen met zich mee zal brengen wanneer de mifepriston wordt voorgeschreven door verloskundig hulpverleners werkzaam in ziekenhuizen en abortusklinieken met een WAZ vergunning. De werkgroep hoopt juist met de aanbeveling de bestaande praktijk variatie te verminderen en te streven naar een groter percentage succesvolle medicamenteuze behandeling van een miskraam.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Vanuit gepoolde resultaten lijkt er een verschil te zijn tussen therapie met misoprostol gecombineerd met voorafgaand mifepriston en misoprostol alleen. Bijwerkingen zijn vergelijkbaar. Ook wordt er - behoudens in de studie van Sinha - geen verschil in patiënttevredenheid gevonden. De werkgroep is van mening dat er bij de medicamenteuze behandeling van een miskraam op basis van de literatuuranalyse aanwijzingen zijn voor een groter percentage succesvolle behandeling bij de combinatietherapie van mifepriston met misoprostol voor de medicamenteuze behandeling van een miskraam.
Onderbouwing
Achtergrond
Misoprostol is een synthetisch analoog van prostaglandine E1 analoog en is geregistreerd voor preventie van door NSAIDs veroorzaakte maag- en darmulcera en dus als maagbeschermer. Misoprostol heeft als belangrijke bijwerkingen rijping van de cervix en uterus contracties. Dit medicament wordt reeds gebruikt voor medicamenteuze behandeling van een miskraam en wordt ook wisselend gebruikt ter voorbereiding van de cervix voor een hysteroscopie. Bij de medicamenteuze behandeling van een miskraam zijn de bijwerkingen van misprostol vooral gastro-intestinaal van aard.
Mifepriston is een competitieve progesteron-receptor antagonist en een progesteron en glucocorticoïd-receptor antagonist welke het myometrium en de cervix gevoeliger maakt (priming) voor prostaglandine activiteit. Mifepriston zorgt voor verweking en dilatatie van de cervix met name het eerste trimester van de zwangerschap. Mifepriston is geregistreerd voor het medicamenteus induceren van een beëindiging van een vitale-zwangerschap (APLA) in combinatie met een prostaglandine analoog waaronder misoprostol. Het gebruik van mifepriston bij een intacte zwangerschap, met uitzondering van een overtijdbehandeling, is voorbehouden aan vergunning houdende klinieken onder de Wet Afbreking Zwangerschap. In de richtlijn Miskraam wordt de toepassing van mifepriston alleen beschreven in het kader van de behandeling van een niet-vitale zwangerschap.
Mifepriston in combinatie met misoprostol wordt vooralsnog voornamelijk gebruikt bij beëindigingen van vitale zwangerschappen. Mifepriston in combinatie met misoprostol wordt in Nederland wisselend gebruikt bij medicamenteuze behandeling van een miskraam.
Conclusies / Summary of Findings
1. Uitkomstmaat succesvolle behandeling (cruciaal)
|
Redelijk GRADE |
Behandeling met 200 mg mifepriston voorafgaand aan behandeling met misoprostol resulteert waarschijnlijk in een hoger percentage succesvolle behandelingen dan behandeling met alleen misoprostol bij patiënten met een miskraam.
Bronnen (Fang, 2009; Sinha, 2018; Schreiber, 2018) |
2. Uitkomstmaat bijwerkingen (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil te zijn in bijwerkingen (dat wil zeggen serieuze complicaties en bijwerkingen waaronder misselijkheid/ braken) tussen behandeling met 200 mg mifepriston voorafgaand aan behandeling met misoprostol en behandeling met alleen misoprostol bij patiënten met een miskraam.
Bronnen (Fang, 2009; Sinha, 2018; Schreiber, 2018) |
3. Uitkomstmaat patiënttevredenheid (belangrijk)
|
Laag GRADE |
Er lijkt geen verschil te zijn in patiënttevredenheid tussen behandeling met 200 mg mifepriston voorafgaand aan behandeling met misoprostol en behandeling met alleen misoprostol bij patiënten met een miskraam.
Bronnen (Fang, 2009; Sinha, 2018; Schreiber, 2018) |
4. Uitkomstmaat lange termijn gevolgen (belangrijk)
|
- GRADE |
Er is geen GRADE beoordeling voor deze uitkomstmaat in verband met het ontbreken van studies. |
Samenvatting literatuur
Beschrijving studies
Er zijn drie studies die het effect van mifepriston voorafgaand aan misoprostol onderzoeken versus alleen misoprostol. Alle drie de studies (Fang, 2009; Sinha, 2018; Schreiber, 2018) kozen voor vaginale toediening van misoprostol.
Fang (2009) is een gerandomiseerde trial waarin patiënten werden gerandomiseerd in drie groepen: A) (N=30) vaginaal toegediende misoprostol 400 microgram voor vacuümaspiratie. B) (N=30) vaginaal toegediende misoprostol 400 microgram iedere drie uur met maximaal vijf doseringen en C) (N=30) oraal toegediende mifepriston 200 mg 36-48 uur voorafgaand aan vaginaal toegediende misoprostol 400 microgram iedere drie uur met maximaal vijf doseringen. Aanvankelijk werden er voor groep B 30 personen gerandomiseerd maar 15 van deze patiënten werden chirurgisch behandeld voordat ze de medicatie ontvingen in verband met bloedingen. Patiënten met een niet-vitale zwangerschap, (zonder significante vaginale bloedingen) gediagnosticeerd met echo werden geïncludeerd. Complete expulsie (na medicatie, tijdsinterval wordt niet duidelijk beschreven), bijwerkingen, optreden van complicaties, patiënttevredenheid en re-interventie werden gemeten.
Sinha (2018) is een gerandomiseerde trial waarin het effect van mifepriston (200mg) 48 uur voorafgaand aan vaginaal toegediende misoprostol (800 microgram) (N=46) werd vergeleken met placebo 48 uur voorafgaand aan vaginaal toegediende misoprostol (800 microgram) (N=46). Indien er in beide gevallen vier uur na de vaginaal toegediende misoprostol geen expulsie plaatsvond werd iedere drie uur misoprostol (400 microgram) oraal gegeven met een maximum van twee doseringen bij patiënten ≤ negen weken zwangerschapsduur en een maximum van vier doseringen bij patiënten > negen weken zwangerschapsduur. Patiënten met een niet-vitale zwangerschap (I: 66,7%; C: 91,1%) of een vruchtzak zonder embryonale delen (I:33,3%; C: 8,8%) participeerden in de studie. Succesvolle behandeling werd gedefinieerd als geen noodzaak tot chirurgische interventie. Chirurgische interventie werd uitgevoerd indien 1) geen bloeding aanwezig was 48 uur na voltooien van het medicatie protocol; 2) extreem bloedverlies; 3) na twee weken een intacte vruchtzak of endometrium dikte ≥ 15 mm. Ook werden bijwerkingen en re-interventie gemeten.
Schreiber (2018) is een gerandomiseerde trial waarin het effect van oraal toegediende mifepriston (200 mg) 24 uur voorafgaand aan vaginaal toegediende misoprostol (800 microgram) werd vergeleken met vaginaal toegediende misoprostol (800 microgram) alleen. In de met mifepriston voorbehandelde groep namen 149 patiënten deel en in de misoprostol-alleen groep 151 patiënten met een vruchtzak zonder embryonale delen (I: 26,8%; C: 24,5%) of een embryonale dood (I:73,2%; C: 75,5%). Bloeding voorafgaand aan randomisatie was aanwezig in 12,1% en 11,3% van de gevallen, in de respectievelijk mifepriston en misoprostol-alleen groep. Aan patiënten waarbij de expulsie niet compleet was werd een afwachtend beleid, een tweede dosering misoprostol of chirurgische behandeling aangeboden. Volledige expulsie na 24 uur tot een maximum van vier dagen na misoprostol toediening, acht dagen en 30 dagen werd gemeten. Daarnaast werden re-interventie en bijwerkingen onderzocht.
Resultaten
1. Uitkomstmaat ‘succesvolle behandeling’ (cruciaal)
Deze uitkomstmaat is in drie studies (Fang, 2009; Sinha, 2018; Schreiber, 2018) beschreven bij in totaal 447 patiënten. Uitkomstmaat succesvolle behandeling werd gedefinieerd als volledige expulsie (Fang, 2009, Schreiber, 2018) of indien er geen chirurgische evacuatie nodig is (Sinha, 2018).
Fang (2009) rapporteerde dat 90% (27/30) van de combinatiegroep (groep C) volledige expulsie had na medicatie vergeleken met 16,7% (5/30) van de patiënten in de groep (groep B) die alleen misoprostol kreeg, hetgeen significant verschillend was (p<0,05). Fang (2009) rapporteerde dat 23/30 (76,7%) vervolgens chirurgische behandeling kreeg in de combigroep (groep C) vergeleken met 12/15 (80%) in de misoprostolgroep alleen (groep B). De andere 15 patiënten in deze groep werden reeds voor inname van de medicatie vanwege bloedingen chirurgisch behandeld. Het gevonden verschil tussen groep B en groep C was niet statistisch significant (p>0,05).
Sinha (2018) rapporteerde dat 39/45 (88,7%) van de patiënten in de combinatiegroep geen chirurgische evacuatie nodig had versus 26/45 (57,8%) in de misoprostolgroep na het voltooien van het medicatieprotocol (p=0,009). Vijftien patiënten (34,1%) in de combinatiegroep en 39 patiënten (88,6%) in de misoprostol-alleen groep, hadden additionele misoprostol doseringen nodig (p=0,000). De noodzaak tot chirurgische re-interventie was 13,34% in de combinatiegroep versus 42,2% in de misoprostolgroep (p=0,002).
Schreiber (2018) rapporteerde een behandelsucces van 124/148 patiënten in de combinatiegroep (83,8%; 95% BI 76,8 tot 89,3%) en 100/149 patiënten (67,1%; 95% BI, 59,0% tot 74.6%) in de misoprostol-alleen groep (relatieve risico, 1,25; 95% BI 1,09 tot 1,43) tijdens de eerste controle (24 uur tot maximaal vier dagen na misoprostol toediening). Van de patiënten die een tweede dosering misoprostol kregen, hadden 2 patiënten (1,4%) en 5 patiënten (3,4%) volledige expulsie na 8 dagen en 5 patiënten (3,4%) en 7 patiënten (4,7%) na 30 dagen in de respectievelijk mifepriston en misoprostolgroep. Een chirurgische behandeling werd uitgevoerd (op basis van de wens van de patiënt en de klinische aanbeveling, dit laatste wordt niet nader gespecificeerd in de studie) bij 13 patiënten (8,8%) in de mifepriston-misoprostol groep en 35 patiënten (23,5%) in de misoprostol-alleen groep (RR: 0,37, 95% BI 0,21 tot 0,68).
Het gepoolde effect laat zien dat in de interventiegroep het percentage succesvolle behandelingen 85% (190/223) was en in de controlegroep was het percentage succesvolle behandelingen 58% (131/224) (figuur 1). Dit leidde tot een risk ratio van 1,79 (95% BI 1,10 – 2,93, p=0,12) met een random effect model en met een hoge heterogeniteit (I2 87%). Dit houdt in dat er een klinisch relevant verschil is tussen de twee interventiegroepen in het voordeel van de combinatie mifepriston + misoprostol die meer succesvolle behandelingen tot gevolg heeft.

Figuur 1. Uitkomstmaat succesvolle behandeling vergelijking mifepriston + misoprostol versus misoprostol alleen. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval, MP:mifepriston.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘succesvolle behandeling’ is met één niveau verlaagd gezien de overlap tussen de grens van klinische relevantie en het betrouwbaarheidsinterval van het effect (-1, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘redelijk’.
2. Uitkomstmaat bijwerkingen (cruciaal)
Deze uitkomstmaat is in drie studies (Fang, 2009; Sinha, 2018; Schreiber, 2018) beschreven bij in totaal 447 patiënten. Voor de uitkomstmaat bijwerkingen werden de in de studies gehanteerde definities gebruikt.
In de studie van Fang (2009) traden er geen serieuze bijwerkingen op. Twee patiënten (2/30) in de combinatiegroep en drie patiënten (3/30) in de misoprostolgroep kregen een spoed chirurgische behandeling in verband met zeer ruim vaginaal bloedverlies. De overige bijwerkingen die in de methoden worden genoemd (misselijkheid, braken en infectie) worden in de resultaten niet meer genoemd (Fang, 2009). Sinha (2018) rapporteerde dat in beide groepen bij één patiënt (2,2%) een acute chirurgische behandeling werd uitgevoerd in verband met zeer ruim bloedverlies. Misselijkheid en braken kwam minder vaak voor in de combinatiegroep dan in de misoprostolgroep (17,8% versus 42,2%, p=0,009). Schreiber (2018) rapporteerde de volgende serieuze bijwerkingen: in 2,0% en 0,7% van de patiënten trad er zeer ruim bloedverlies op dat een bloedtransfusie vereiste (RR: 3,04 , 95% BI 0,32 tot 28,6, p=0,31) en in 1,3% en 1,3% (RR: 1,01, 95% BI 0,15 tot 7,01, p=0,99) trad er een infectie op in de respectievelijk mifepriston-misoprostol en misoprostol-alleen groep. Het gemiddelde aantal bijwerkingen (vermoeidheid, hoofdpijn, duizeligheid, rillingen, misselijkheid, diarree, braken, extreme krampen en koorts) per deelnemer was 6,1 en 5,6, (RR: 1,09, 95% BI 0,99 tot 1,19, p=0,08), waarvan alleen braken statistisch significant vaker voorkwam in de mifepriston-misoprostol groep (26,8%) dan in de misoprostol-alleen groep (15,2%) (RR: 1,76, 95% BI 1,11 tot 2,79, p=0,01). Het gepoolde effect voor misselijkheid / braken (Schreiber, 2018; Sinha, 2018) laat zien dat in de interventiegroep het percentage misselijkheid/ braken 25% (48/193) was en in de controlegroep was dit percentage 22% (42/194) (figuur 2). Dit leidde tot een risk ratio van 1,13 [95% BI 0,28 – 4,58, p=0,86] met een random effect model en met een hoge heterogeniteit (I2 91%). Dit houdt in dat er geen klinisch relevant verschil is tussen de twee interventiegroepen.
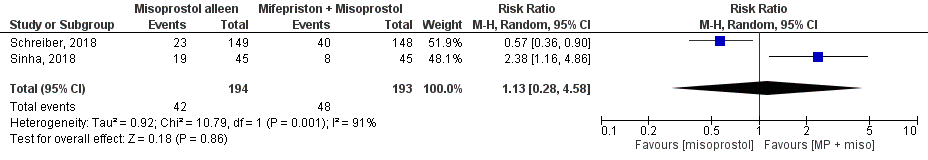
Figuur 2. Uitkomstmaat bijwerkingen misselijkheid / braken vergelijking mifepriston + misoprostol versus misoprostol alleen Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval, MP:mifepriston .
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘bijwerkingen’ is met twee niveaus verlaagd gezien tegenstrijdige resultaten (-1, inconsistentie) en het overlappen van de grenzen van klinische relevantie (-1, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
3. Uitkomstmaat patiënttevredenheid (belangrijk)
Deze uitkomstmaat is in drie studies (Fang, 2009; Sinha, 2018; Schreiber, 2018) beschreven bij in totaal 437 patiënten. Voor de uitkomstmaat patiënttevredenheid werden de in de studies gehanteerde definities gebruikt.
Fang (2009) onderzocht tevredenheid en patiënten konden daarvoor de volgende scores geven: tevreden, acceptabel of onacceptabel. De combinatiegroep scoorde 14 keer (46,7%) tevreden en 16 keer (53,3%) acceptabel versus acht keer (53,3%) tevreden en zeven keer (46,7%) acceptabel in de misoprostolgroep. Dit was niet significant verschillend (p>0,05). Sinha (2018) rapporteerde het percentage dat opnieuw zou kiezen voor medicamenteuze behandeling en vond dat 84,4% van de combinatiegroep dat zou doen versus 60% van de misoprostolgroep, wat statistisch significant van elkaar verschilde (p=0,012). Schreider (2018) rapporteerde dat 89,4% van de patiënten in de mifepriston groep en 87,4% in de misoprotolgroep de behandeling als ‘goed’ of ‘neutraal’ had ervaren.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘patiënttevredenheid’ is met twee niveaus verlaagd gezien de verschillende manieren waarop de uitkomstmaat is gemeten (-1, indirectheid) en vanwege de overlap van het 95% BI met de grenzen voor klinische relevantie (-1, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
4. Uitkomstmaat lange termijn gevolgen (belangrijk)
Fang (2009), Sinha (2018) en Schreiber (2018) rapporteerden deze uitkomstmaat niet.
Bewijskracht van de literatuur
Er is geen GRADE beoordeling voor de uitkomstmaat ‘lange termijn gevolgen’ in verband met het ontbreken van studies.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Leidt mifepriston + misoprostol of misoprostol alleen tot betere uitkomsten bij de medicamenteuze behandeling van een miskraam?
P patiënten die medicamenteus behandeld worden voor een miskraam;
I mifepriston + misoprostol;
C misoprostol;
O succesvolle behandeling, bijwerkingen, patiënttevredenheid, re-interventies, lange termijn gevolgen fertiliteit.
Relevante uitkomstmaten
De werkgroep achtte succesvolle behandeling en bijwerkingen voor de besluitvorming cruciale uitkomstmaten; en patiënttevredenheid, re-interventies en lange termijn gevolgen fertiliteit voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten succesvolle behandeling, bijwerkingen, patiënttevredenheid, re-interventies en lange termijn gevolgen fertiliteit, maar hanteerde de in de studies gebruikte definities. Bij complicaties valt te denken aan infecties, bloedverlies, intra-uteriene adhesies (onder andere het syndroom van Asherman) en perforatie van de uterus.
De werkgroep definieerde vooraf voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie voor dichotome uitkomstmaten en vergeleken de resultaten met deze grenzen: RR < 0,80 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevante benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Elsevier) is op 12 december 2018 met relevante zoektermen gezocht naar studies die een behandelstrategie van misoprostol + mifepriston vergeleken met misoprostol alleen bij de medicamenteuze behandeling van een miskraam. Voor deze vraag is gebruikt gemaakt van beschikbare literatuur (een studie) over deze vergelijking uit de NICE-richtlijn ‘Ectopic pregnancy and miscarriage’ (NICE, 2012). In de NICE-richtlijn is tot begin 2012 gezocht naar literatuur. Deze search is aangevuld met een literatuursearch uitgevoerd door de werkgroep. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1005 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- gepubliceerd in het Nederlands of Engels;
- gepubliceerd na 2012 (vanaf laatste searchdatum NICE-richtlijn);
- primair vergelijkend onderzoek;
- studiedesign RCT of SR (voor uitkomstmaat lange termijn fertiliteit cohortstudies);
- vergelijking van misoprostol + mifepriston of alleen misoprostol bij de medicamenteuze behandeling van een miskraam.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 36 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en twee studies definitief geselecteerd. Een andere studie was beschreven in de NICE-richtlijn.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- van den Berg J, Gordon BB, Snijders MP, Vandenbussche FP, Coppus SF. The added value of mifepristone to non-surgical treatment regimens for uterine evacuation in case of early pregnancy failure: a systematic review of the literature. Eur J Obstet Gynecol Reprod Biol. 2015 Dec;195:18-26.
- Fang AH, Chen, QF, Zhen W, Li YH, Chen RY. Termination of Missed Abortion in A Combined Procedure: A Randomized Controlled Trial. J of Reprod & Contracep. 2009 Mar.;20(1):45-49
- Schreiber CA, Creinin MD, Atrio J, Sonalkar S, Ratcliffe SJ, Barnhart KT. Mifepristone Pretreatment for the Medical Management of Early Pregnancy Loss. N Engl J Med. 2018 Jun 7;378(23):2161-2170
- Sinha P, Suneja A, Guleria K, Aggarwal R, Vaid NB. Comparison of Mifepristone Followed by Misoprostol with Misoprostol Alone for Treatment of Early Pregnancy Failure: A Randomized Double-Blind Placebo-Controlled Trial. J Obstet Gynaecol India. 2018 Feb;68(1):39-44.
Evidence tabellen
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/ likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/ likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/ likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/ likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/ likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/ likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Fang, 2009 |
computer-generated random numbers |
unlikely |
No obvious serious limitations Note: Participants were not blinded to their treatment allocation; |
Unlikely |
Unlikely, not reported |
Likely, This paper reports that in the fepristone/misoprostol group, there was 90% complete expulsion after medication. However, it also reports that 23/30 women required curettage, and that a similar proportion of women in each medical group required curettage. It is unclear what their definition of success is. |
Unlikely |
30 women were initially randomised to the misoprostol only group, however 15 were excluded because they required an emergency curettage due to haemorrhage. |
|
Sinha, 2018 |
simple randomization using computer generated random tables |
Unlikely |
Unlikely, Hence, both the treating obstetrician and the patient were blinded regarding the nature of the drug. |
Unlikely, Hence, both the treating obstetrician and the patient were blinded regarding the nature of the drug. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Schreiber, 2018 |
Participants were randomly assigned in permuted blocks of two to eight, stratified according to trial site, with the use of Research Electronic Data Capture software (REDCap, Vanderbilt University). |
Unlikely |
Unlikely |
Unlikely |
Unlikely; investigator who was unaware of the treatment-group assignments |
Unlikely |
Unlikely |
Unlikely |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Agrawal, 2014 |
Labor induction |
|
Van den Berg, 2015 |
Bevat niet de recente RCTs van Sinha, 2018; Schreiber, 2018 en Fang, 2009. |
|
Van den Berg, 2014 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Bettahar, 2016 |
Artikel in het Frans. Voldoet niet aan PICO. |
|
Blum, 2012 |
Geen antwoord op PICO. APLA. |
|
Chaudhuri, 2015 |
Labor induction > 20 weeks. Valt buiten afbakening RL. |
|
Chen, 2015 |
Geen antwoord op PICO. APLA. |
|
Colleselli, 2014 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Coughlin, 2004 |
Alle patiënten ontvange mifepristone. Voldoet niet taan PICO. |
|
Dabash, 2015 |
Geen antwoord op PICO. APLA. |
|
Dahiya, 2012 |
Geen antwoord op PICO. APLA. |
|
Dahiya, 2005 |
Geen antwoord op PICO. APLA. |
|
Dunford, 2018 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Greenland, 2003 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Kahn, 2000 |
Geen antwoord op PICO. APLA. |
|
Kapp, 2018 |
Geen antwoord op PICO. APLA. |
|
Kapp, 2018 |
Geen antwoord op PICO. APLA. |
|
Kollitz, 2011 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Kulier, 2011 |
Geen antwoord op PICO. APLA. |
|
Kulier, 2004 |
Oude versie van Kulier, 2011 |
|
Ngoc, 2011a |
Geen antwoord op PICO. APLA. |
|
Ngoc, 2011b |
Geen antwoord op PICO. APLA. |
|
Niinimäki, 2017 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Panda, 2013 |
Labor induction |
|
Raymond, 2013 |
Geen antwoord op PICO. APLA. |
|
Reeves 2016 |
Geen antwoord op PICO. APLA. |
|
Rønlund, 2002 |
Niet de juiste vergelijking. Voldoet niet aan PICO. |
|
Schaff, 2006 |
Geen antwoord op PICO. APLA. |
|
Schreiber, 2006 |
Alle patiënten ontvange mifepristone. Voldoet niet aan PICO. |
|
Sharma, 2011 |
Na 28 weken zwangerschap. Voldoet niet aan PICO. |
|
Song, 2018 |
Geen antwoord op PICO. APLA. |
|
Stockheim, 2006 |
Niet de juiste interventie. Voldoet niet aan PICO. |
|
Torky, 2018 |
Geen vergelijking met Mifepriston. Geen antwoord op PICO. |
|
Värynen, 2007 |
Na 21 weken zwangerschap. Voldoet niet aan PICO. |
|
Wagaarachchi, 2002 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
|
Wagaarachchi, 2001 |
Geen antwoord op PICO. Geen beschrijving lange termijn fertiliteit |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-07-2020
Beoordeeld op geldigheid : 24-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de NVOG of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVOG is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de verschillende richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Misoprostol of Mifepriston + Misoprostol |
NVOG |
2020 |
2021 |
1x 5 jaar |
NVOG |
Publicatie resultaten Triple M studie. |
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van verschillende relevante specialismen die betrokken zijn bij de zorg voor patiënten die een miskraam hebben doorgemaakt. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Drs. E. Hink, gynaecoloog, werkzaam in het Radboudumc, Nijmegen, Nederlandse Vereniging voor Obstetrie en Gynaecologie (voorzitter).
- M.M.J. van den Berg MSc., fertiliteitsarts, werkzaam in het Academisch Medisch Centrum, Amsterdam, Vereniging van Fertiliteitsartsen.
- Dr. F.M. van Dunné, gynaecoloog, werkzaam in het Haaglanden Medisch Centrum, Den Haag, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Prof. dr. M. Goddijn, hoogleraar Voortplantingsgeneeskunde & gynaecoloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- M. Hermus, verloskundige, werkzaam bij Verloskundigen Oosterhout, Oosterhout, Koninklijke Nederlandse Organisatie van Verloskundigen. (tot april 2019)
- Drs. A. B. Hooker, gynaecoloog, werkzaam in het Zaans Medisch Centrum, Zaandam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. S. Kuc, fertiliteitsarts, werkzaam in het St. Antonius Ziekenhuis, Utrecht, Vereniging van Fertiliteitsartsen.
- Dr. M. Lemmers, AIOS gynaecologie, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. R.H.F. van Oppenraaij, gynaecoloog, werkzaam in het Maasstad Ziekenhuis, Rotterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- A.J.Y. van Sluis, echoscopist, oa. werkzaam bij Rivas Zorggroep, Gorinchem, Beroepsvereniging Echoscopisten Nederland.
- K. Spijkers, patiëntvertegenwoordiger, Utrecht, Patiëntenfederatie Nederland.
Meelezer
- A. Beuckens, Beleidsmedewerker KNOV, Koninklijke Nederlandse Organisatie van Verloskundigen. (vanaf mei 2019)
Met ondersteuning van
- A.A. Lamberts MSc., senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- L.H.M. Niesink-Boerboom MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Overzicht Belangenverklaringen |
|||||||||
|
Achternaam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie? |
|
van den Berg |
Fertiliteitsarts, Amsterdam UMC locatie AMC |
ESHRE, Bestuurslid SIG Implantation & Ectopic Pregnancy (onbetaald) Travelgrants t/m juli 2021 |
geen |
geen |
geen |
geen |
geen |
18-7-2018 |
Geen actie nodig |
|
Dunné |
Gynaecoloog, Haaglanden Medisch Centrum (HMC) te Den Haag |
Lid Werkgroep Otterlo (landelijke richtlijnen commissie Obstetrie) (onbetaald) |
geen |
geen |
geen |
geen |
geen |
9-3-2018 |
Geen actie nodig. |
|
Goddijn |
Hoogleraar Voortplantingsgeneeskunde, gynaecoloog, pijlerhoofd Voortplantingsgeneeskunde, Amsterdam UMC |
-Bestuurslid SIG Fertiliteitspreservatie NVOG (vice-voorzitter/ onbetaald) |
geen |
geen |
Onderzoeks financiering vanuit ZonMw en KWF/Pink Ribbon. Niet conflicterend met onderwerp richtlijn. |
geen |
geen |
5-3-2018 |
Geen actie nodig. |
|
Hink |
Gynacoloog perinatoloog Radboudumc te Nijmegen |
geen |
geen |
geen |
geen |
geen |
geen |
19-3-2018 |
Geen actie nodig |
|
Hooker |
Gynaecoloog, Zaans Medisch Centrum (ZMC), te Zaandam. |
Docent 2-daagse cursus Zicht op Ziekenhuizen, studiecentrum voor Bedrijf en Overheid. Onderwerp: kwaliteit en veiligheid in de zorg en veranderde positie van de medisch specialist. (betaald). |
Adviseur firma Fziomed (USA), advies bij ontwikkelen middel ter preventie intra-uteriene verklevingen (betaald). |
geen |
Was hoofdonderzoeker van de Post Abortion Prevention of Adhesion |
Zie kolom extern gefinancierd onderzoek |
geen |
12-5-2018 |
Besloten dat indien er een vraag over dit specifieke onderwerp in het raamwerk wordt opgenomen Angelo Hooker hier geen voortrekker van zal zijn. |
|
Klapwijk-Hermus |
Verloskundigen Oosterhout – eerstelijns verloskundige, eigenaar praktijk |
Promotietraject, onderwerp: evaluatie van geboortecentra in Nederland. Afrondend, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
14-5-2018 |
Geen actie nodig |
|
Kuc |
Fertiliteitsarts , St. Antonius Ziekenhuis, te Nieuwegein |
Bestuurslid vereninging van fertiliteitsartsen VVf (onbetaald) |
geen |
geen |
geen |
geen |
geen |
3-5-2018 |
Geen actie nodig |
|
Lamberts |
Adviseur Kennisinstituut |
Beleidsmedewerker Kwaliteit NVKG |
geen |
geen |
geen |
geen |
geen |
2014 |
Geen actie nodig |
|
Lemmers |
AIOS Gynaecologie VUMC te Amsterdam |
Arts-onderzoeker (onbetaald). Uitvoeren Cochrane review medicamenteuze behandeling miskraam tot 20 weken. |
geen |
geen |
geen |
geen |
geen |
15-3-2018 |
Geen actie nodig. |
|
Oppenraaij |
Gynaecoloog, Maasstad Ziekenhuis, te Rotterdam |
Bestuurslid werkgroep jonge zwangerschap NVOG (onbetaald) |
geen |
geen |
Deelname ahrends studie van Bayer onderzoek naar nieuwe medicatie bij vrouwen met endometriose. Onderzoek is inmiddels gesloten zonder enige inclusie in ons ziekenhuis. |
geen |
geen |
5-5-2018 |
Geen actie nodig. |
|
Sluis |
Obstetrisch en Gynaecologisch echoscopiste bij Screeningscentrum Fara te Ede (8u per week) |
Bestuurslid BEN, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
1-6-2018 |
Geen actie nodig |
|
Spijkers |
Senior Beleidsadviseur/ projectmanager Patiëntenfederatie Nederland |
Voorzitter Stichting Samen voor Duchenne, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
24-5-2018 |
Geen actie nodig |
|
Viester |
Adviseur Kennisinstituut |
geen |
geen |
geen |
geen |
geen |
geen |
2018 |
Geen actie nodig |
|
Beuckens (meelezer) |
Beleidsmedewerker kwaliteit en implementatie KNOV |
Coaching/luisterend oor - betaald (minder dan 5 keer per jaar) |
geen |
geen |
geen |
geen |
geen |
2019 |
Geen actie nodig |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland zitting te laten nemen in de werkgroep. Patiëntenverenigingen Freya en VSOP zijn eveneens gevraagd zitting te nemen in de werkgroep, zij gaven echter aan de voorkeur te hebben om alleen bij de invitational conference aanwezig te zijn en input te leveren tijdens de commentaarfase. Er is in samenwerking met de Patiëntenfederatie Nederland op 1 mei 2019 een focusgroep georganiseerd, de resultaten hiervan zijn meegenomen in de richtlijntekst. Een verslag van de bijeenkomst is als aanverwant product opgenomen bij de richtlijn. Er heeft een invitational conference plaatsgevonden aan de start van het traject waar verschillende patiëntenorganisaties voor waren uitgenodigd (Freya, VSOP, Patiëntenfederatie Nederland, Stichting Kind&Ziekenhuis). Een verslag hiervan is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VSOP, Freya en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Voor deze richtlijn is waar mogelijk uitgegaan van de NICE-richtlijn ‘Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage’ uit 2012. Bruikbare onderdelen zijn van een update voorzien zodat ook recente evidence is meegenomen.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen tijdens de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is op 1 februari 2019 oriënterend gezocht naar literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief) in de databases Medline (Ovid) & Embase (Elsevier). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende hoeveelheid studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van Zorg’ en onder het kopje Patiëntenperspectief.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
NICE. Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage. 2012. Update in 2019.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Kennisinstituut van Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. 2015
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – december 2018
|
1 FETAL VIABILITY/ (1728) 2 exp PREGNANCY OUTCOME/ (51905) 3 ((f?etus$ or f?etal or embryo$ or pregnan$ or gestat$) adj3 (viab?l$ or non?viab?l$ or continu$ or term or outcome$ or live or living or alive)).ti,ab. (72593) 4 ((live or term) adj3 birth$).ti,ab. (26799) 5 exp FETAL DEATH/ (28346) 6 exp ABORTION, SPONTANEOUS/ (33702) 7 miscarr$.ti,ab. (12551) 8 ((spontaneous or threatened or imminent or imminens or missed or delay$ or inevitable or incomplete$ or complete$ or early or silent or quiescent) adj2 abort$).ti,ab. (14617) 9 ((pregnan$ or embryo$ or f?etal or f?etus$) adj3 (loss$ or demise or death$ or resorp$ or disintegrat$ or wast$ or reject$ or fail$)).ti,ab. (32833) 10 (anembryo$ or empty sac$).ti,ab. (187) 11 (blight$ adj2 (ova or ovum)).ti,ab. (203) 12 exp GESTATIONAL TROPHOBLASTIC DISEASE/ (5546) 13 (trophoblast$ adj3 (gestat$ or pregnan$ or disease$ or tumo?r$ or neoplas$)).ti,ab. (5114) 14 ((hydatid$ or invasi$) adj3 mol$).ti,ab. (5351) 15 molar pregnan$.ti,ab. (1237) 16 (placenta$ adj3 (tumo?r$ or neoplas$)).ti,ab. (1003) 17 (chorio carcinoma$ or chorio?carcinoma$).ti,ab. (6219) 18 (non vital* or avital*).ti,ab. (736) 19 1 or 2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 (206766) 20 exp *Abortifacient Agents/ or exp *Mifepristone/ or exp *Misoprostol/ or exp *PROSTAGLANDINS/ or (abortifacient agent* or mifepriston* or mifepriston or mifeprex or misoprostol* or cytotec or arthrotec or napratec or prostaglandin* or progesterone receptor antagonist* or antigestagen).ti,ab. (132417) 21 exp *Misoprostol/ or (misoprostol* or cytotec or arthrotec or napratec).ti,ab. (4717) 22 19 and 20 and 21 (1401) 23 limit 22 to (english language and yr="2000 -Current") (1129) 24 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (376664) 25 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1809301) 26 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3082454) 27 23 and 24 (79) 28 23 and 25 (604) 29 28 not 27 (549) 30 23 and 26 (466) 31 30 not 27 not 29 (245) 32 27 or 29 or 31 (873) = 873 |
1005 |
|
Embase (Elsevier) |
('spontaneous abortion'/exp OR 'ectopic pregnancy'/exp OR 'trophoblastic tumor'/exp OR 'fetus death'/exp OR miscarr*:ti,ab OR (((spontaneous OR threatened OR imminent OR imminens OR missed OR delay* OR inevitable OR incomplete* OR early OR silent OR quiescent) NEAR/2 abort*):ti,ab) OR (((pregnan* OR embryo* OR f?etal OR f?etus*) NEAR/3 (loss* OR demise OR death* OR resorp* OR disintegrat* OR wast* OR reject* OR fail* OR viab?l* OR non?viab?l*)):ti,ab) OR anembryo*:ti,ab OR 'empty sac*':ti,ab OR ((blight* NEAR/2 (ova OR ovum)):ti,ab) OR (((ectopic OR 'extra uterine' OR 'extra?uterine' OR tub* OR ampullary OR isthm* OR fimbrial OR cornual OR interstitial OR abdom* OR ovar* OR cervi*) NEAR/3 (pregnan* OR gestat*)):ti,ab) OR ((pregnan* NEAR/3 (unknown OR uncertain) NEAR/3 (location* OR site*)):ti,ab) OR pul:ti,ab OR ((trophoblast* NEAR/3 (gestat* OR pregnan* OR disease* OR tumor* OR tumour* OR neoplas*)):ti,ab) OR (((hydatid* OR invasi*) NEAR/3 mol*):ti,ab) OR 'molar pregnan*':ti,ab OR ((placenta* NEAR/3 (tumor OR tumour OR neoplas*)):ti,ab) OR 'chorio carcinoma*':ti,ab OR chorio?carcinoma*:ti,ab OR 'non vital*':ti,ab OR avital*:ti,ab) AND ('abortive agent'/exp/mj OR 'mifepristone'/exp/mj OR 'prostaglandin'/exp/mj OR 'misoprostol'/exp/mj OR 'diclofenac plus misoprostol'/exp/mj OR 'antigestagen'/exp/mj OR 'abortifacient agent*':ti,ab OR mifepriston*:ti,ab OR mifepriston:ti,ab OR mifeprex:ti,ab OR misoprostol*:ti,ab OR cytotec:ti,ab OR arthrotec:ti,ab OR napratec:ti,ab OR prostaglandin*:ti,ab OR 'progesterone receptor antagonist*':ti,ab OR antigestagen:ti,ab) AND ('misoprostol'/exp/mj OR 'diclofenac plus misoprostol'/exp/mj OR misoprostol*:ti,ab OR cytotec:ti,ab OR arthrotec:ti,ab OR napratec:ti,ab) AND [english]/lim AND [2000-2018]/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 46
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 356
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomizedcontrolled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 68 = 470 |

