Behandeling van een Miskraam
Uitgangsvraag
Hoe dient de behandeling van een miskraam eruit te zien?
- Verdient een afwachtend beleid of een chirurgische behandeling van een miskraam de voorkeur?
- Verdient een afwachtend beleid of een medicamenteuze behandeling van een miskraam de voorkeur?
- Verdient een chirurgische behandeling of een medicamenteuze behandeling van een miskraam de voorkeur?
Aanbeveling
Bespreek met de patiënt de verschillende behandelopties voor een miskraam en besluit samen wat de best passende behandeling is (Shared Decision Making).
Bied patiënten met een miskraam expectatief beleid aan en indien gewenst een medicamenteuze behandeling.
Overweeg een chirurgische behandeling bij patiënten:
- met een verhoogd bloedingsrisco;
- die geen 24/7 toegang hebben tot medische spoedzorg;
- met een verdenking op een geïnfecteerde miskraam;
- met ruim bloedverlies en hemodynamische instabiliteit
- met een traumatische ervaring op het gebied van miskraam, IUVD of fluxus post partum;
- die om een andere reden geen expectatief beleid of medicamenteus beleid kunnen of willen ondergaan.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Zoals hierboven beschreven zijn er meerdere behandelopties voor een miskraam. Minst invasief zijn expectatief beleid, en medicamenteuze behandeling. Invasiever is de chirurgische behandeling. Hoewel invasief is chirurgische behandeling wel het meest effectief voor de succesvolle behandeling van een miskraam. Toch zijn ook afwachtend beleid en medicamenteuze therapie zeer succesvol. Het succespercentage van deze twee laatst genoemde behandelingen is sterk afhankelijk van de gekozen definitie van succes. Hoe langer men bereid is om af te wachten des te succesvoller deze behandeling zal zijn. Vaak wordt een periode van minimaal twee weken bedoeld vanaf de diagnose (Casikar, 2010). Ook voor medicamenteuze behandeling geldt dat de miskraam vaker compleet zal zijn indien er wordt gekozen voor een langer interval tussen de medicatie en de beoordeling op compleetheid.
In veel studies opgenomen in deze richtlijn werd ‘noodzaak tot (re) interventie’ als uitkomstmaat genomen. Wat de aanleiding gaf tot de interventie was wisselend: medische noodzaak zoals ruim bloedverlies, of de vraag van de patiënt voor alsnog een chirurgische behandeling, of de verdenking op een incomplete miskraam. Het echoscopisch beoordelen van een uterus ten aanzien van de compleetheid van een miskraam is lastig en leidt dan ook geregeld tot het onterecht stellen van de diagnose incomplete miskraam. Dit maakt een directe vergelijking tussen chirurgische behandeling en medicamenteus beleid, of chirurgische behandeling en expectatief beleid lastiger. Het bloedverlies dat bij de medicamenteuze behandeling vaak langer aanhoudt dan bij een chirurgische behandeling is een reden dat patiënten vaker om een interventie vragen. In de vergelijking tussen expectatief beleid en medicamenteus beleid is er een klein voordeel van medicatie. Deze behandeling leidt vaker tot een complete miskraam.
Wat betreft andere secundaire uitkomstmaten waren er nauwelijks verschillen tussen de verschillende behandelmodaliteiten. Chirurgische behandeling leidt minder vaak tot de noodzaak voor bloedtransfusie in vergelijking met afwachtend beleid (0,2% versus 1,7%), voor chirurgische behandeling versus medicamenteuze behandeling werd dit verschil niet gevonden. Voor de overige secundaire uitkomstmaten werden geen verschillen gevonden. Het voorkomen van infecties was niet verschillend, de patiënttevredenheid was vergelijkbaar bij alle behandelmodaliteiten en er werden geen verschillen gevonden in uitkomsten met betrekking tot toekomstige fertiliteit en levend geboren kinderen in de zwangerschappen erna (Hooker, 2014). Het is bekend dat er na een chirurgische behandeling intra-uteriene adhesievorming kan optreden. Dit wordt vaker gezien na meerdere chirurgische behandelingen. De klinische relevantie is veelal niet duidelijk. Een meta-analyse (Hooker, 2014) kon geen relatie met verminderde fertiliteit aantonen, terwijl gelijke zwangerschapsuitkomsten werden gezien na conservatieve, medicamenteuze of instrumentele behandelingen. In de studies geïncludeerd voor deze analyse wordt geen verschil gevonden ten aanzien van fertiliteit na behandeling van een miskraam. In een groot aantal studies is niet gekeken naar toekomstige fertiliteit, en in de studies waar dit wel als uitkomstmaat is gebruikt, wordt hoogstwaarschijnlijk geen verschil gevonden door gebrek aan power bij een relatief lage incidentie.
Er wordt eveneens geen verschil gevonden in aantal levend geboren kinderen bij patiënten die middels expectatief beleid, medicamenteus of middels chirurgische behandeling worden behandeld voor een miskraam. Ook hier is opnieuw erg weinig onderzoek verricht met een follow-up duur lang genoeg om de uitkomst van een volgende zwangerschap te beoordelen. Er is wel uitgebreid observationeel onderzoek waarbij wordt gezien dat bij patiënten met een eerdere chirurgische behandeling vanwege een miskraam de kans op vroeggeboorte < 37 weken in een volgende zwangerschap is verhoogd OR 1,29 (95% BI 1,17 tot 1,42) en de kans op een extreme vroeggeboorte onder de 32 weken significant verhoogd is met een OR van 1.69 (95% BI 1.20; 2.38). (Lemmers, 2016).
Termijn chirurgische behandeling
Een zuigcurettage is mogelijk tot 12 weken en een instrumentele abortus (dilatatie en chirurgische behandeling) tot een zwangerschapsduur van 22 weken. De literatuur geeft aan dat, hoe verder de zwangerschapsduur, chirurgische behandeling middels dilatatie & chirurgische behandeling, toegepast bij beëindiging van de zwangerschap (vooral indien sprake van een re-operatie vanwege een rest), het risico op intra-uteriene adhesies verhoogd is. Het risico op vroeggeboorte is ook verhoogd mogelijk ten gevolge van schade aan de cervix ten gevolge van het chirurgisch ingrijpen (McCarthy, 2013; Gilman Barber, 2014; Hooker, 2014; Hooker, 2016; Hooker, 2017).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten horen voorgelicht te worden over de verschillende behandelopties waarbij de eigenschappen van de behandeling en mogelijke voor- en nadelen zullen worden besproken. Uit eerdere studies bleek dat patiënten vaak met verschillende argumenten voorkeur hebben voor een bepaalde behandeling. Veel patiënten zullen een vlotte behandeling willen en het grootste gedeelte van deze populatie heeft een actieve kinderwens. Bij een keuze tot behandeling spelen argumenten een rol als ‘meer natuurlijk/’of dat de behandeling mogelijk is in de eigen omgeving ‘(medicamenteuze behandeling) versus ‘er zo snel mogelijk vanaf willen zijn’ (instrumentele behandeling). De behoefte om afscheid te nemen van een (intacte) foetus kan mee spelen in de voorkeur voor medicamenteuze behandeling. Er is beperkt bewijs dat na een chirurgische behandeling de duur tot een volgende zwangerschap niet korter is in vergelijking met afwachtend beleid of medicamenteuze therapie. Juist bij patiënten met een actieve kinderwens is het daarom van belang om een behandeling te kiezen die zo weinig mogelijk invloed heeft op toekomstige fertiliteit en zwangerschap.
Kosten (middelenbeslag)
Een chirurgische behandeling is kostbaarder dan medicamenteus of afwachtend beleid. De medicatie is goedkoop en dus zal medicamenteuze behandeling nauwelijks in kosten verschillen in vergelijking met afwachtend beleid aangezien de follow-up vergelijkbaar is. Er wordt wisselend gerapporteerd over de extra kosten van de chirurgische behandeling, afhankelijk van het land en de omstandigheden en afhankelijk vanuit welk perspectief de kosten worden bekeken. Ondanks de mogelijk extra bezoeken door patiënten met afwachtend of medicamenteus beleid blijft chirurgische behandeling een duurdere behandeloptie.
Aanvaardbaarheid voor de overige relevante stakeholders
Afhankelijk van de setting waarin de zorg voor een miskraam geleverd wordt kan er vanuit het perspectief van de zorgverlener een voorkeur zijn voor een bepaalde behandeling. Doorgaans is een chirurgische behandeling in een academisch ziekenhuis lastiger te plannen en zal mede om die reden vaker in eerste instantie gekozen worden voor expectatief of medicamenteus beleid. Als er om logistieke redenen een behandeling niet mogelijk is kan een doorverwijzing naar een streekziekenhuis of abortuskliniek verzorgd worden, dit geldt ook voor een medicamenteuze behandeling.
Haalbaarheid en implementatie
In Nederland worden in alle ziekenhuizen alle behandelopties voor de behandeling van een miskraam aan patiënten aangeboden. Patiënten zijn doorgaans tevreden over de behandeling die zij ondergingen. De tevredenheid is groter wanneer patiënten zelf mee beslissen over de behandeling die zij ondergaan. Uit patiëntpreferentie studies blijkt dat patiënten doorgaans een vlotte behandeling willen voor de miskraam, maar tegelijkertijd ook een behandeling wensen die zo min mogelijk invloed heeft op toekomstige fertiliteit en zwangerschap.
Van belang is dat samen met de vrouw wordt gekeken naar een behandeling die op dat moment het beste bij haar past.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Voor de ontwikkeling van deze richtlijn is de huidige NICE-richtlijn als uitgangspunt genomen, aangevuld met meer uitgangsvragen en een up-to-date literatuur search. De NICE-richtlijn beveelt expectatief beleid als eerstelijns behandeloptie aan voor patiënten met een miskraam. Andere behandelopties moeten worden overwogen indien de patiënt een verhoogd bloedingsrisico heeft, er eerdere traumatische ervaring is op het gebied van miskraam, IUVD of hemorragie post partum of indien er de verdenking is op infectie.
Indien afwachtend beleid geen acceptabele behandeloptie is voor de patiënt dan zou zij medicatie voorgeschreven moeten krijgen. Chirurgische behandelingwordt volgens de NICE-richtlijn niet standaard aangeboden.
De werkgroep is van mening dat expectatief beleid en medicamenteus beleid altijd overwogen horen te worden voor de behandeling van een miskraam. Hoewel chirurgische behandeling de meest effectieve behandeling is voor een miskraam, is deze behandeling in observationeel onderzoek geassocieerd met meer kans complicaties als intra-uteriene adhesies en vroeggeboorte (Lemmers, 2016). Desalniettemin kunnen er indicaties blijven bestaan voor het verrichten van een chirurgische behandeling zoals het niet 24/7 toegang hebben tot medische spoedzorg, en de argumenten zoals ook hierboven beschreven uit de NICE-richtlijn (NICE, 2012 & 2019). Zuigcurettages zijn veelal mogelijk tot een CRL van 12 weken, waar dilatatie en chirurgische behandeling (instrumentele abortus) mogelijk is tot een zwangerschapsduur van 22 weken.
Onderbouwing
Achtergrond
Tot op heden bestaat er in Nederland, behoudens de NHG-standaard Miskraam, geen landelijke richtlijn die de behandeling van een miskraam beschrijft. Er zijn verschillende behandelopties voor een vrouw bij wie een miskraam is vastgesteld: afwachtend beleid, medicamenteuze behandeling of een chirurgische interventie (chirurgische behandeling). In de praktijk wordt er regelmatig gekozen voor een geplande chirurgische behandeling. Voor de patiënt is dit een snelle manier om de miskraam af te ronden. Echter, deze behandeling is duurder en brengt potentieel meer risico’s met zich mee op korte en lange termijn dan de alternatieven. Het beantwoorden van de uitgangsvraag kan ervoor zorgen dat de patiënten de juiste informatie krijgen van de betrokken hulpverlener om zo een weloverwogen beslissing te kunnen nemen.
Conclusies / Summary of Findings
Uitgangsvraag 1
Verdient een afwachtend beleid of een chirurgische behandeling van een miskraam de voorkeur?
1. Uitkomstmaat ‘Succesvolle behandeling’ (cruciaal)
|
Redelijk GRADE |
Chirurgische behandeling leidt waarschijnlijk tot meer succesvolle behandelingen vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam. Bronnen (Trinder, 2006; Shelley, 2005; De Waard, 2002; Nielsen, 1995; Al- Ma’ani, 2014; Nadarajah, 2014; Kong, 2013; Dangalla, 2012). |
2. Uitkomstmaat ‘Complicaties- ernstig bloedverlies’ (cruciaal)
|
Laag GRADE |
Er is mogelijk geen verschil in ernstig bloedverlies na chirurgische behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bron (Kong, 2013). |
3. Uitkomstmaat ‘Complicaties- bloedtransfusie’ (cruciaal)
|
Redelijk GRADE |
Er is waarschijnlijk een lager risico op bloedtransfusies na chirurgische behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Al-Ma’ani, 2014; Nadarajah, 2014; Dangalla, 2012; Trinder, 2006; Shelley, 2005; De Waard, 2002). |
4. Uitkomstmaat ‘Complicaties – Infectie na de behandeling’ (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil te zijn in infecties na een chirurgische behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam. Bronnen (Al-Ma’ani, 2014; Dangalla, 2012; Trinder, 2006; Shelley, 2005; De Waard, 2002; Chipchase, 1997; Nielsen, 1995). |
5. Uitkomstmaat ‘Pijn – duur’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in duur (aantal dagen) van pijn na behandeling na chirurgische behandeling in vergelijking met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam. Bronnen (Al-Ma’ani, 2014; Kong, 2013; Shelley, 2005; de Waard, 2002; Chipchase, 1997; Nielsen, 1995). |
6. Uitkomstmaat ‘Pijnbeleving’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in pijnbeleving na chirurgische behandeling in vergelijking met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bron (Shelley, 2005). |
7. Uitkomstmaat ‘Tevredenheid ten aanzien van de behandeling’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in tevredenheid tussen chirurgische behandeling of afwachtend beleid bij patiënten gediagnosticeerd met een miskraam. Bronnen (Nadarajah, 2014; Dangalla, 2012; Chipchase, 1997). |
8. Uitkomstmaat ‘Fertiliteit - zwangerschapskans (belangrijk) & Uitkomstmaat 9. Fertiliteit-aantal levendgeborene in een volgende zwangerschap’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er verschillen zijn in fertiliteit (zwangerschapskans en aantal levendgeborene in volgende zwangerschappen) tussen chirurgische behandeling in vergelijking met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Smith, 2009; Blohm, 1997; Chipchase, 1997). |
Uitgangsvraag 2
Verdient een afwachtend beleid of een medicamenteuze behandeling van een miskraam de voorkeur?
1. Uitkomstmaat ‘Succesvolle behandeling’ (cruciaal)
|
Redelijk GRADE |
Medicamenteuze behandeling leidt waarschijnlijk niet tot klinisch relevant meer succesvolle behandelingen vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Fernlund, 2018; Kong 2013; Torre, 2012; Trinder, 2006; Shelley, 2005; Ngai, 2001; Nielsen, 1999) |
2. Uitkomstmaat ‘Complicaties- ernstig bloedverlies’ (cruciaal)
|
Laag GRADE |
Er is mogelijk geen verschil in ernstig bloedverlies bij medicamenteuze behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bron (Kong, 2013) |
3. Uitkomstmaat’ Complicaties – bloedtransfusies’ (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil te zijn in bloedtransfusies bij medicamenteuze behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Fernlund, 2018; Ngai, 2001; Shelley, 2005; Trinder, 2006; Torre, 2012) |
4. Uitkomstmaat ‘Complicaties – infecties na de behandeling’ (cruciaal)
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in risico op infecties bij medicamenteuze behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Kong, 2013; Trinder, 2006; Shelley, 2005; Ngai, 2001; Nielsen, 1999) |
5. Uitkomstmaat ‘Pijn – duur’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in duur van de pijn bij medicamenteuze behandeling vergeleken met afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Fernlund, 2018; Kong, 2013; Shelley, 2005). |
6. Uitkomstmaat ‘Pijnbeleving’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in pijnbeleving tussen medicamenteuze behandeling en afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Fernlund, 2018; Shelley, 2005; Nielsen, 1999) |
7. Uitkomstmaat ‘Tevredenheid’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in tevredenheid ten aanzien van medicamenteuze behandeling ten opzichte van afwachtend beleid bij patiënten met een gediagnosticeerde miskraam.
Bronnen (Kong, 2013; Nielsen, 1999) |
8. Uitkomstmaat ‘Fertiliteit - aantal levendgeborene uit een volgende zwangerschap’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in ‘fertiliteit – aantal levendgeborene’ tussen medicamenteuze behandeling of afwachtend beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen (Smith, 2009) |
Uitgangsvraag 3
Verdient een chirurgische behandeling of een medicamenteuze behandeling van een miskraam de voorkeur?
1. Uitkomstmaat ‘Succesvolle behandeling’ (cruciaal)
|
Hoog GRADE |
Chirurgische behandeling leidt tot meer succesvolle behandelingen (gedefinieerd als geen noodzaak voor ongeplande interventies) vergeleken met medicamenteus beleid bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Chigbu, 2012; Chung, 1999; Dabash, 2010; Dao, 2007; de Jonge, 1995; Demetroulis, 2001; Egarter, 1995; Fang, 2009; Graziosi, 2004; Montesinos, 2011; Moodliar, 2005; Muffley, 2002; Niinimaki, 2006; Patua, 2013; Sahin, 2001; Shaheen, 2017; Shelley, 2005; Shuaib, 2013; Shwekerela, 2007; Taylor, 2011; Trinder, 2006; Zhang, 2005) |
2. Uitkomstmaat ‘Complicaties – ernstig bloedverlies’ (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil in ernstig bloedverlies bij medicamenteuze behandeling vergeleken met chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Kong, 2013; Patua, 2013) |
3. Uitkomstmaat ‘Complicaties – bloedtransfusie’ (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil in bloedtransfusies bij medicamenteuze behandeling vergeleken met chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Dabash, 2010; Davis, 2007; de Jonge, 1995; Demetroulis, 2001; Graziosi, 2004; Muffley, 2002; Shelley, 2005; Shuaib, 2013; Trinder, 2006) |
4. Uitkomstmaat ‘Complicaties – infecties na behandeling’ (cruciaal)
|
Laag GRADE |
Er is mogelijk geen verschil in infecties tussen medicamenteuze of chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Chung, 1999; Kong, 2013; Moodliar, 2005; Sahin, 2001; Shelley, 2005; Shuaib, 2013; Shwekerela, 2007; Trinder, 2006; Zhang, 2005) |
5. Uitkomstmaat ‘Pijn – duur’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in pijnduur tussen medicamenteuze of chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Chung, 1999; Dao, 2007; Demetroulis, 2001; Dabash, 2010; Kong, 2013; Montesinos, 2011; Shelley, 2005; Taylor, 2011) |
6. Uitkomstmaat ‘Pijnbeleving’ (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in pijnbeleving tussen medicamenteuze of chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Chigbu, 2012; Das, 2012; Dao, 2007; Fang, 2009; Graziosi, 2004; Moodliar, 2005; Patua, 2013; Shelley, 2005; Shwekerala, 2007; Zhang, 2005) |
7. Uitkomstmaat ‘Tevredenheid’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in patiënttevredenheid tussen medicamenteuze of chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Chigbu, 2012; Dabash, 2010; Dao, 2007; Demetroulis, 2001; Fang, 2009; Montesinos, 2011; Niinimaki, 2006; Sahin, 2001; Shuaib, 2013; Shwekerela, 2007; Taylor, 2011) |
8. Uitkomstmaat ‘Fertiliteit – aantal levendgeborene uit een volgende zwangerschap’ (belangrijk)
|
Laag GRADE |
Er is mogelijk geen verschil in ‘fertiliteit – aantal levendgeborene’ tussen medicamenteuze of chirurgische behandeling bij patiënten gediagnosticeerd met een miskraam.
Bronnen: (Smith, 2009; Tam, 2005, Graziosi, 2004) |
Samenvatting literatuur
Uitgangsvraag 1
Verdient een afwachtend beleid of een chirurgische behandeling van een miskraam de voorkeur?
Beschrijving studies
In totaal werden elf studies geïncludeerd die chirurgische behandeling vergeleken met afwachtend beleid, zeven studies die eerder waren geïncludeerd in de NICE-richtlijn (2012) (Smith, 2009; Trinder, 2006; Shelley, 2005; De Waard, 2002; Chipchase, 1997, Nielsen, 1995; Blohm, 1997) en vier studies gepubliceerd na de search van de NICE-richtlijn (Al Ma’ani, 2014; Nadarajah, 2014; Kong, 2013; Dangalla, 2012).
De studie van Al-Ma’ani (2014) is een RCT waarin patiënten werden geïncludeerd met incomplete miskraam en niet-vitale zwangerschap (n=234). Succesvolle behandeling na expectatief beleid was gedefinieerd als spontane complete evacuatie van de uterus binnen 4 weken na inclusie. Succesvolle behandeling na chirurgische ingreep was gedefinieerd als het niet herhalen van chirurgische behandeling binnen 4 weken.
De studie van Nadarajah (2014) is een RCT waarin patiënten werden geïncludeerd met incomplete miskraam en niet-vitale zwangerschap volgens de RCO-richtlijn (n=360). Succesvolle behandeling was gedefinieerd als complete evacuatie van de uterus zonder enige complicaties binnen 6 weken.
De studie van Kong (2013) is een RCT waarin patiënten werden geïncludeerd met incomplete miskraam en niet-vitale zwangerschap (n=180). Patiënten werden gerandomiseerd naar medicamenteuze behandeling, chirurgische behandeling of afwachtend beleid.
De studie van Dangalla (2012) is een RCT waarin patiënten met een ongecompliceerde incomplete miskraam (miskraamrest 15 tot 50mm) werden geïncludeerd (n=160) en chirurgische behandeling werd vergeleken met afwachtend beleid. De uitkomstmaat succesvolle behandeling werd gerapporteerd op 1, 2, en 4 weken na behandeling en was gedefinieerd als complete miskraam na een bepaalde periode.
Resultaten
1. Uitkomstmaat ‘Succesvolle behandeling (complete evacuatie van zwangerschapsrest)’ (cruciaal)
In drie studies werd de uitkomstmaat gedefinieerd als ‘noodzaak voor ongeplande chirurgische interventie’ gerapporteerd (Nielsen, 1995; Shelley, 2005; Trinder, 2006). De Waard (2002) rapporteerde succesvolle behandeling na 6 weken. In de groep afwachtend beleid was succesvolle behandeling gedefinieerd als spontane miskraam binnen 6 weken en in de groep chirurgische behandeling indien er geen vervolgbehandeling (herhaalde chirurgische behandeling) nodig was. Al-Ma’ani (2014) definieerde succesvolle behandeling na expectatief beleid als spontane complete evacuatie van de uterus binnen 4 weken na inclusie. Succesvolle behandeling na chirurgische ingreep was gedefinieerd als het niet herhalen van chirurgische behandeling binnen 4 weken. Nadarajah (2014) definieerde succesvolle behandeling als complete evacuatie van de uterus zonder enige complicaties binnen 6 weken. Kong (2013) en Dangalla (2012) definieerden succesvolle behandeling als complete miskraam na 4 weken.
Het gepoolde effect laat zien dat in de interventiegroep het percentage succesvolle behandelingen 95% (913/961) was en in de controlegroep was het percentage succesvolle behandelingen 72,8% (727/998) (figuur 1). Dit leidde tot een risk ratio van 1,27 (95% BI 1,01 tot 1,61, p=0.04) met een random effect model en met een hoge heterogeniteit (I2=98%). Dit houdt in dat het percentage succesvolle behandelingen klinisch relevant hoger is in de groep die chirurgisch behandeld is.
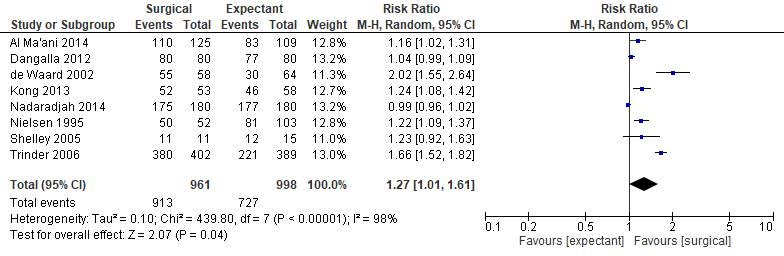
Figuur 1. Uitkomstmaat succesvolle behandeling vergelijking chirurgisch versus afwachtend beleid.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘succesvolle behandeling’ is met een niveau verlaagd gezien het overschrijden van de grens van klinische relevantie (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
2. Uitkomstmaat ‘Complicaties – ernstig bloedverlies’ (cruciaal)
Kong (2013) rapporteerde de uitkomstmaat ‘ernstig bloedverlies’. In de groep chirurgisch behandeld werd bij één patiënt ernstig bloedverlies gerapporteerd (1/60) en geen ernstig bloedverlies in de groep afwachtend beleid (0/60).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernstig bloedverlies is met twee niveaus verlaagd gezien het zeer beperkt aantal patiënten (slechts een studie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
3. Uitkomstmaat Complicaties -Bloedtransfusie (cruciaal)
De uitkomstmaat bloedtransfusies werd in zes studies gerapporteerd (Al-Ma’ani, 2014; Nadarajah, 2014; Dangalla, 2012; Trinder, 2006; Shelley, 2005; De Waard, 2002).
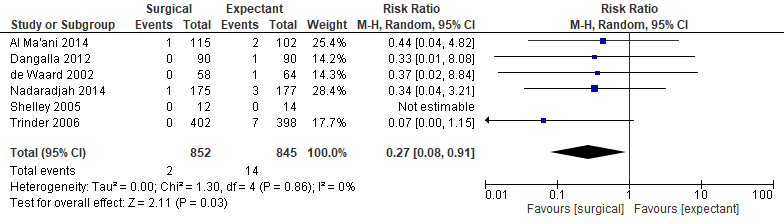
Figuur 2. Uitkomstmaat bloedtransfusie vergelijking chirurgisch versus afwachtend beleid.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Het gepoolde effect laat zien dat in de interventiegroep het percentage bloedtransfusies 0,2% (2/852) was en in de controlegroep was het percentage bloedtransfusies 1,7% (14/845) (figuur 2). Dit leidde tot een risk ratio van 0,27 (95% BI 0,08 tot 0,91, p=0,03) met een random effect model en met een lage heterogeniteit (I2=0%). Dit houdt in dat er klinisch relevant minder bloedtransfusies zijn in de groep chirurgisch behandeld vergeleken met de groep afwachtend beleid.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘bloedtransfusie’ is met een niveau verlaagd gezien het overschrijden van de grens van klinische relevantie (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘redelijk’.
4. Uitkomstmaat Complicaties- Infectie na de behandeling (cruciaal)
De uitkomstmaat infectie werd in zeven studies gerapporteerd (Al-Ma’ani, 2014; Dangalla, 2012; Trinder, 2006; Shelley, 2005; De Waard, 2002; Chipchase, 1997; Nielsen, 1995).
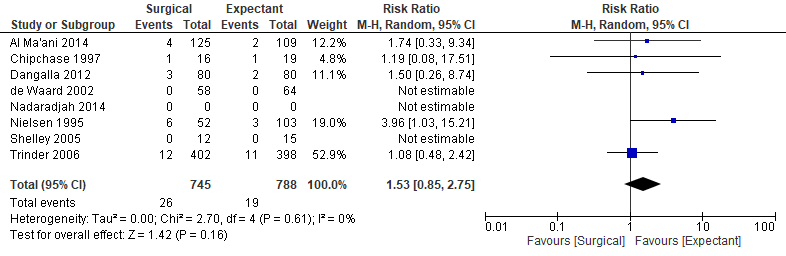
Figuur 3. Uitkomstmaat infectie na de behandeling vergelijking chirurgisch versus afwachtend beleid. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Het gepoolde effect laat zien dat in de interventiegroep het percentage infecties 3,5% (26/745) was en in de controlegroep was het percentage infecties 2,4% (19/788) (figuur 3). Dit leidde tot een risk ratio van 1,53 (95% BI 0,85 tot 2,75, p=0,16) met een random effect model en met een lage heterogeniteit (I2=0%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘infectie na de behandeling’ is met twee niveaus verlaagd gezien het overschrijden van de grens van klinische relevantie en de grens van geen effect (imprecisie) en is ‘laag’.
5. Uitkomstmaat Pijn – duur (belangrijk)
Duur van de pijn werd in zes studies gerapporteerd (Al-Ma’ani, 2014; Kong, 2013; Shelley, 2005; de Waard, 2002; Chipchase, 1997; Nielsen, 1995).
Al-Ma’ani (2014) rapporteerde een significant kortere duur in de groep chirurgisch behandeld (gemiddelde 5,5 dagen (sd 1,7)) vergeleken met de groep afwachtend beleid (gemiddelde 8,1 dagen (sd 2,7), p= 0,0001).
Kong (2013) rapporteerde een gemiddelde duur in de groep chirurgisch behandeld (van 4,91 dagen (sd 4,20) vergeleken met een gemiddelde van 4,12 dagen (sd 4,28) in de groep afwachtend beleid. Dit was niet verschillend tussen beide groepen.
Nielsen (1995) rapporteerde geen significant verschil tussen de groepen met een gemiddelde van 1,92 dagen (sd 1,47) in de groep afwachtend beleid (n=103) ten opzichte van 1,69 dagen (sd 1,46) in de groep chirurgisch behandeld (n= 52)
Shelley (2005) rapporteerde een langere pijnduur in de groep die chirurgisch werd behandeld. In de groep afwachtend beleid (n=15) was de mediaan 3,0 (range 0,0 tot 11,0) en in de groep chirurgisch behandeld (n=12) was de mediaan 2,0 (range 0,2 tot 12,0)
De Waard (2002) rapporteerde geen significant verschil in aantal dagen pijn tussen de groepen. In de groep afwachtend beleid (n=64) was de mediaan 14 (IQR 7 tot 24) en in de groep chirurgisch behandeld (n=58) was de mediaan 11 (IQR 6 tot 26).
Chipchase (1997) rapporteerde geen verschil in aantal dagen pijn tussen de groepen. In de groep afwachtend beleid (n=19) was de mediaan 0 (range 0 tot 5) en in de groep chirurgisch behandeld (n=16) was de mediaan 0 (range 0 tot 2).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijn – duur’ is met drie niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, geen blindering) en de tegenstrijdige resultaten (inconsistentie) naar ‘zeer laag’.
6. Uitkomstmaat Pijnbeleving (belangrijk)
Eén studie (Shelley, 2005) rapporteerde de uitkomstmaat pijnintensiteit. Shelley (2005) rapporteerde in de groep afwachtend beleid (n=15) een mediaan van 3 (range 1 tot 7) en in de groep chirurgisch behandeld (n=12) een mediaan van 3 (range 1 tot 10).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘pijnbeleving‘ is met drie niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, blindering) en zeer beperkt aantal patiënten (imprecisie, n=27, slechts één studie) naar ‘zeer laag’.
7. Uitkomstmaat Tevredenheid (belangrijk)
Drie studies rapporteerden tevredenheid ten aanzien van de behandeling (Chipchase, 1997; Dangalla, 2012; Nadarajah, 2014).
Chipchase (1997) rapporteerde tevredenheid in de groep afwachtend beleid bij 100% van de patiënten (19/19) en in de groep chirurgisch behandeld 87,5% van de patiënten (14/16) (RR 1,14, 95%BI 0,95 tot 1,38). In deze studie werd niet beschreven hoe tevredenheid werd gemeten.
Dangalla (2012) rapporteerde zowel in de groep afwachtend beleid (78/80) als in de groep chirurgisch behandeld (78/80) 97,5% van de patiënten als tevreden, in deze studie werd niet beschreven hoe tevredenheid werd gemeten.
Nadarajah (2014) rapporteerde tevredenheid gemeten op een schaal van 1 tot 10. Er was geen verschil in tevredenheid ten aanzien van de behandeling tussen de groep afwachtend beleid en de groep chirurgisch behandeld (7,57 in beide groepen, n=180).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘tevredenheid’ is met twee niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risico op bias, geen blindering) en het beperkt aantal patiënten (imprecisie). Het niveau van bewijskracht wordt gegradeerd als ‘laag’.
8. Uitkomstmaat Fertiliteit – (spontane) zwangerschapskans (belangrijk)
Twee studies rapporteerden het aantal spontane zwangerschappen (Blohm, 1997; Chipchase, 1997).
Blohm (1997) rapporteerde cumulatieve conceptie na 6 maanden in de groep afwachtend beleid was 0,7 ten opzichte van 0,6 in de groep chirurgische behandeling (schattingen op basis van een grafiek; data niet gerapporteerd in de tekst). Er werden geen significante verschillen gevonden tussen de groepen (geen p waarden gerapporteerd) .
Chipchase (1997) rapporteerde de uitkomstmaat conceptie als aantal zwangerschappen/aantal met een zwangerschapswens (%). In de groep afwachtend beleid was dit 9/12 (75%) en in de groep chirurgische behandeld 6/9 (66,7%) (RR=1,13, 95%BI van 0,64 tot 1,98)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘(spontane) zwangerschapskans’ is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en het zeer beperkt aantal patiënten (imprecisie). Het niveau van de bewijskracht wordt gegradeerd als ‘zeer laag’.
9. Uitkomstmaat Fertiliteit-aantal levendgeborene in een volgende zwangerschap (belangrijk)
Smith (2009) rapporteerde geen verschil in het aantal levendgeborene in een volgende zwangerschap (lange termijn follow-up van de MIST trial, Trinder, 2006). In de groep chirurgisch behandeld was dit 81,7% (192/235) en in de groep afwachtend beleid was dit 79,0% (177/224) (RR 0,99, 95%BI 0,91 tot 1,07).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘fertiliteit- aantal levendgeborene in een volgende zwangerschap’ is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het beperkt aantal patiënten (imprecisie, slechts één studie). Het niveau van de bewijskracht wordt gegradeerd als ‘zeer laag’.
Uitgangsvraag 2
Verdient een afwachtend beleid of een medicamenteuze behandeling van een miskraam de voorkeur?
Beschrijving studies
In totaal zijn zeven studies geïncludeerd die medicamenteuze behandeling vergeleken met afwachtend beleid, waarvan vier studies eerder beschreven in de NICE-richtlijn van 2012 (Trinder, 2006; Shelley, 2005; Nielsen, 1999; Ngai, 2001) en drie studies uit de aanvullende literatuursearch (Fernlund, 2018; Kong 2013; Torre, 2012).
Vier studies vergeleken behandeling met misoprostol (MISO) met afwachtend beleid (Fernlund, 2018; Kong 2013; Shelley, 2005; Ngai, 2001) en drie studies vergeleken de combinatie van misoprostol met mifepriston (MIFE+MISO) met afwachtend beleid (Torre, 2012; Trinder, 2006; Nielsen, 1999).
De studie van Kong (2013) is hierboven beschreven (2a). De studie van Fernlund (2018) is een RCT waarin patiënten met een niet-vitale zwangerschap (n=94) werden geïncludeerd en behandeld met afwachtend beleid of vaginale misoprostol (vaginaal). De studie van Torre (2012) is een RCT waarin patiënten werden geïncludeerd met een incomplete miskraam of niet-vitale zwangerschap <14 weken (n=182) en behandeld met mifepriston en misoprostol (vaginaal) of afwachtend beleid gedurende één week.
Resultaten
1. Uitkomstmaat ‘Succesvolle behandeling’ (cruciaal)
De uitkomstmaat succesvolle behandeling bij patiënten die medicamenteus of afwachtend werden behandeld, is apart gerapporteerd voor behandeling met misoprostol of een combinatie van misoprostol en mifepriston.
Fernlund (2018) rapporteerde de uitkomstmaat succesvolle behandeling als ‘complete evacuatie zonder noodzaak tot chirurgische interventie ’ (binnen 10, 17 ,25 en 31 dagen). Binnen 31 dagen in de groep MISO 81/94 (86,2%) en in de groep afwachtend beleid 55/90 (61,1%) (verschil 25,1 (11,6 tot 37,5). Kong (2013) rapporteerde ‘noodzaak voor ongeplande chirurgische interventie’. In de groep medicamenteus behandeld 42/60 (70%) en in de groep afwachtend beleid 46/60 (79,3%). Shelley (2005) rapporteerde ‘noodzaak voor ongeplande chirurgische interventie’ in de groep afwachtend beleid 3/15 (20%) en in de groep MISO 2/10 (20%). Succesvolle uitkomst in de groep afwachtend beleid is 12/15 en in de groep MISO 8/10. Ngai (2001) rapporteerde succesvolle behandeling gedefinieerd als ‘geen chirurgische interventie tot de tijd tot volgende menstruatie’. In de groep medicamenteus behandeld 25/30 (83,3%) en in de groep afwachtend beleid 14/29 (48,3%), p<0.05.
Torre (2012) rapporteerde het aantal chirurgische interventies in beide groepen. In de groep medicamenteus behandeld 17/89 (19,1%) en in de groep afwachtend beleid 37/85 (43,5%) (p= 0,001). De percentages patiënten die geen tweede interventie ondergingen verschilden significant in de groep medicamenteus behandeld 72/89 (81%) en in de groep afwachtend beleid 48/85 (56%). Trinder (2006) rapporteerde ‘noodzaak voor ongeplande chirurgische interventie’ (chirurgische behandeling binnen 8 weken). In de groep afwachtend beleid 177/398 (44%) en in de groep medicamenteuze behandeling 142/398 (35,6%). Succesvolle behandeling in de groep medicamenteus behandeld 256/398 (64%) en in de groep afwachtend beleid 221/398 (56%). Nielsen (1999) rapporteerde het aantal patiënten met een ‘leeg cavum’ binnen vijf dagen na inclusie. In de groep MISO 49/60 (82%) en de groep afwachtend beleid 47/62 (76%) (OR= 1,41, 95%BI: 0,59 tot 3,41).
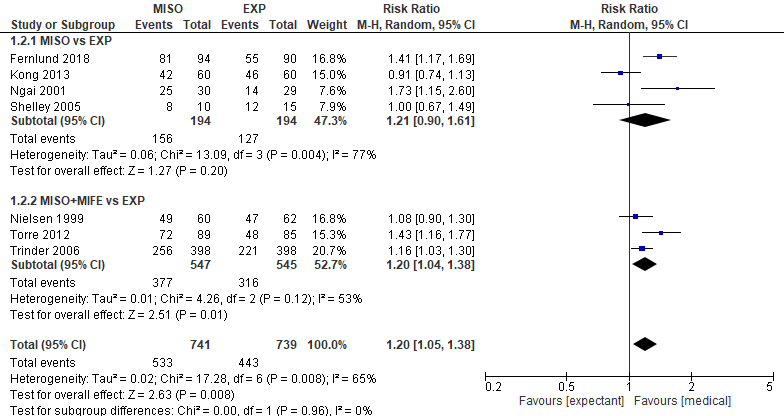
Figuur 4. Uitkomstmaat succesvolle behandeling vergelijking medicamenteus versus afwachtend beleid.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Het gepoolde effect laat zien dat in de groep medicamenteus behandeld het percentage succesvolle behandelingen 72% (533/741) was en in de groep afwachtend beleid was het percentage succesvolle behandelingen 60% (443/739) (figuur 4). Dit leidde tot een risk ratio van 1,20 [95% BI 1,05 tot 1,38, p=0,008] met een random effect model en met een hoge heterogeniteit (I2=65%). Hetgeen inhoudt dat het percentage succesvolle behandelingen niet klinisch relevant hoger is in de groep medicamenteus behandeld dan in de expectatieve groep.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘succesvolle behandeling’ met een niveau verlaagd vanwege tegenstrijdige resultaten (heterogeniteit) en is ‘redelijk’.
2. Uitkomstmaat ‘Complicaties – ernstig bloedverlies’ (cruciaal)
Kong (2013) rapporteerde in beide groepen geen gevallen van ernstig bloedverlies (gedefinieerd als de saturatie van meer dan een dik maandverband per uur voor meer dan 2 uur achtereen of meer dan 1 dik maandverband per 30 min gedurende 1 uur).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘complicaties - ernstig bloedverlies’ is met twee niveaus verlaagd gezien het beperkt aantal patiënten (imprecisie, n=88, slechts een studie) naar ‘laag’.
3. Uitkomstmaat ‘Complicaties – bloedtransfusie’ (cruciaal)
Vijf studies rapporteerden de uitkomstmaat bloedtransfusies (Fernlund, 2018; Ngai, 2001; Shelley, 2005; Trinder, 2006; Torre, 2012)
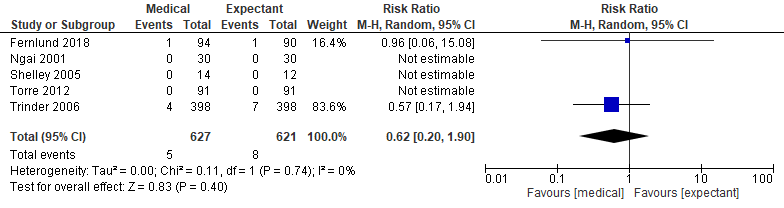
Figuur 5. Uitkomstmaat bloedtransfusies vergelijking medicamenteus versus afwachtend beleid.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Het gepoolde effect laat zien dat in de groep die medicamenteus behandeld werd het percentage bloedtransfusies 0,8% (5/627) was en in de groep afwachtend beleid was het percentage bloedtransfusies 1,3% (8/621) (figuur 5). Dit leidde tot een risk ratio van 0,62 [95% BI 0,20 tot 1,90, p=0,40] met een random effect model en met een lage heterogeniteit (I2=0%).
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘complicaties - bloedtransfusie’ is met twee niveaus verlaagd gezien het overschrijden van de grens van klinische relevantie en is ‘laag’.
4. Uitkomstmaat ‘Complicaties – infecties na de behandeling’ (cruciaal)
Vijf studies rapporteerden de uitkomstmaat infecties na de behandeling (Kong, 2013; Trinder, 2006; Shelley, 2005; Ngai, 2001; Nielsen, 1999)
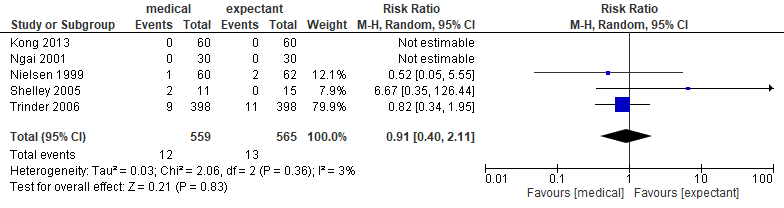
Figuur 6. Uitkomstmaat infecties vergelijking medicamenteus versus afwachtend beleid.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Het gepoolde effect laat zien dat in de groep medicamenteus behandeld het percentage infecties 2,1% (12/559) was en in de groep afwachtend beleid was het percentage infecties 2,3% (13/565) (figuur 6). Dit leidde tot een risk ratio van 0,91 [95% BI 0,40 tot 2,11, p=0,83] met een random effect model en met een lage heterogeniteit (I2=3%). Dit houdt in dat het percentage infecties niet klinisch relevant verschilt tussen de groepen.
Bewijskracht van de literatuur
De bewijskracht van de uitkomstmaat ‘complicaties – infecties na de behandeling‘ is met een niveau verlaagd gezien het brede betrouwbaarheidsinterval (imprecisie) en is ‘redelijk’.
5. Uitkomstmaat ‘Pijn – duur’ (belangrijk)
Drie studies rapporteerden de uitkomstmaat pijn duur (Fernlund, 2018; Kong, 2013; Shelley, 2005). Fernlund (2018) rapporteerde het aantal dagen ernstige pijn. Er was geen verschil in aantal dagen pijn tussen de groepen. In de groep medicamenteus behandeld was het aantal dagen 1,3 (sd 1,6) en in de groep afwachtend beleid was het aantal dagen 1,3 (sd 1,5) (verschil 0,02 95%BI van -0,5 tot 0,5).
Kong (2013) rapporteerde een gemiddelde duur in de groep medicamenteus behandeld van 5,4 dagen (sd 3,95) vergeleken met een gemiddelde van 4,1 dagen (sd 4,28) in de groep afwachtend beleid (verschil 1,3 95%BI -0,17 tot 0,77).
Shelley (2005) rapporteerde geen verschil in pijnduur tussen de groepen. In de groep afwachtend beleid (n=15) was de mediaan 3,0 (range 0,0 tot 11,0) en in de groep medicamenteus behandeld (n=11) was de mediaan 3,0 (range 0,2 tot 16,0).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijn – duur’ is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, geen blindering) en het geringe aantal patiënten (imprecisie) naar ‘laag’.
6. Uitkomstmaat ‘Pijnbeleving’ (belangrijk)
Drie studies rapporteerden de uitkomstmaat pijnintensiteit (Fernlund, 2018; Shelley, 2005; Nielsen, 1999).
Fernlund (2018) rapporteerde het aantal patiënten met ernstige pijn (geen definitie van ernstig in de studie beschreven) in de groep medicamenteus behandeld was dit 64/91 (70,3%) en in de groep afwachtend beleid 47/77 (61,0%). Er was geen statistisch significant verschil tussen de groepen (gemiddeld verschil 9,3, 95%BI van −5,8 tot 24,2).
Shelley (2005) rapporteerde pijnintensiteit met behulp van een aangepaste versie van de Brief Pain Inventory (BPI). De mediaan in de groep medicamenteus behandeld (n=11) was 3 (range 1 tot 8) en in de groep afwachtende beleid (n=15) was de mediaan 3 (range 1 tot 7). Nielsen (1999) rapporteerde pijnintensiteit meteen VAS score (0-100). De groep medicamenteus behandeld (n=60) had een gemiddelde pijnscore van 66,1 (sd 26,3) de groep afwachtend beleid (n=62) had een gemiddelde pijnscore van 62,0 (sd 30,1). Er was geen significant verschil tussen de groepen (gemiddeld verschil -4,10, 95%BI -12,97 tot 4.77).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijnbeleving’ is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, geen blindering) en het geringe aantal patiënten (imprecisie) naar ‘laag’.
7. Uitkomstmaat ‘Tevredenheid’ (belangrijk)
Twee studies rapporteerden de uitkomstmaat tevredenheid (Kong, 2013; Nielsen, 1999).
Kong (2013) rapporteerde de CSQ8-score. Tevredenheid was lager in de groep medicamenteus behandeld (3,17, sd 0,67, n=60) ten opzichte van de groep afwachtend beleid (3,41, sd 0,50, n=60, p < 0,05).
Nielsen (1999) rapporteerde gemiddelde tevredenheid in de groep afwachtend beleid (25,2 sd 25,6, n = 62) en in de groep medicamenteuze behandeling (28,6, sd 24,8, n = 60). Er was geen significant verschil tussen de groepen (gemiddeld verschil 3,40, 95%BI -11.32 tot 4,52, p= 0,174).
De bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘tevredenheid’ is met drie niveaus verlaagd gezien de beperkingen in onderzoeksopzet (risk of bias, geen blindering) het geringe aantal patiënten (imprecisie) en tegenstrijdige resultaten (inconsistentie) naar ‘zeer laag’
8. Uitkomstmaat ‘Fertiliteit – aantal levendgeborene uit een volgende zwangerschap’ (belangrijk)
Smith (2009) rapporteerde geen verschil in het aantal levendgeborene uit een volgende zwangerschap (lange termijn follow-up van de MIST trial, Trinder, 2006). In de groep medicamenteus behandeld was dit 78,7% (181/230) en in de groep afwachtend beleid was dit 79,0% (177/224) (RR 0,99, 95%BI 0,91 tot 1,10).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘fertiliteit - aantal levendgeborene in een volgende zwangerschap’ is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet en het beperkt aantal patiënten (imprecisie, slechts één studie). Het niveau van de bewijskracht wordt gegradeerd als ‘zeer laag’.
Uitgangsvraag 3
Verdient een chirurgische behandeling of een medicamenteuze behandeling van een miskraam de voorkeur?
Beschrijving studies
In de literatuursamenvatting zijn 24 studies opgenomen die eerder zijn beschreven in de NICE-richtlijn uit 2012 (Chung, 1999; Dabash, 2010; Dao, 2007; Davis, 2007; de Jonge, 1995; Demetroulis, 2001; Egarter, 1995; Fang, 2009; Graziosi, 2004; Graziosi, 2005a; Graziosi, 2005b; Lee, 2001; Montesinos, 2011; Moodliar, 2005; Muffley, 2002; Niinimaki, 2006; Sahin, 2001; Shelley, 2005; Shwekerela, 2007; Smith, 2009; Tam, 2005; Taylor, 2011; Trinder, 2006; Zhang, 2005) en 6 studies uit de geactualiseerde literatuurzoekactie (Shaheen, 2017; Das, 2014; Kong, 2013; Patua, 2013; Shuaib, 2013; Chigbu, 2012). De studie van Kong (2013) is hierboven beschreven (1).
De studie van Shaheen (2017) is een RCT waarin patiënten met een niet-vitale zwangerschap <12 weken (n=120) werden geïncludeerd en chirurgische behandeling werd vergeleken met misoprostol (vaginaal).
De studie van Das (2014) is een RCT waarin patiënten met een incomplete miskraam <12 weken (n=222) werden geïncludeerd en chirurgische behandeling werd vergeleken met behandeling met misoprostol.
De studie van Patua (2013) is een RCT waarin patiënten met een incomplete miskraam (n=100) werden geïncludeerd en chirurgische behandeling werd vergeleken met behandeling met misoprostol (vaginaal).
De studie van Shuaib (2013) is een RCT waarin patiënten met een niet-vitale zwangerschap werden geïncludeerd en waarin chirurgische behandeling werd vergeleken met behandeling met misoprostol (vaginaal).
De studie van Chigbu (2012) is een RCT waarin patiënten werden geïncludeerd met een incomplete miskraam (n=320) en waarin chirurgische behandeling werd vergeleken met behandeling met misoprostol (oraal).
Resultaten
1. Uitkomstmaat ‘Succesvolle behandeling’ (cruciaal)
In de NICE-richtlijn uit 2012 werd de uitkomstmaat gedefinieerd als ‘noodzaak voor ongeplande chirurgische interventie’ gerapporteerd. Dit betrof een chirurgische behandeling (waaronder re-interventie) als gevolg van niet succesvolle initiële behandeling, spoedchirurgie voorafgaand aan toegewezen behandeling, chirurgische behandeling op verzoek van de vrouw of behandeling als gevolg van een complicatie van de initiële behandeling. De meta-analyse van 18 studies eerder beschreven in de NICE-richtlijn (NICE, 2012) (Chung, 1999; Dabash, 2010; Dao, 2007; de Jonge, 1995; Demetroulis, 2001; Egarter, 1995; Fang, 2009; Graziosi, 2004; Montesinos, 2011; Moodliar, 2005; Muffley, 2002; Niinimaki, 2006; Sahin, 2001; Shelley, 2005; Shwekerela, 2007; Taylor, 2011; Trinder, 2006; Zhang, 2005) werd aangevuld met vier studies (Shaheen, 2017; Patua, 2013; Chigbu, 2012; Shuaib, 2013).
Patua (2013) rapporteerde ‘miskraamrest / noodzaak tot (herhaalde) zuigcurettage’. Chigbu (2012) definieerde succesvolle behandeling als ‘niet leidend tot een secundaire chirurgische behandeling’. Shuaib (2013) rapporteerde succesvolle behandeling als ‘complete evacuatie zonder de noodzaak om chirurgisch te behandelen en bevestigd middels echoscopie’. In de groep medicamenteus behandeld was het percentage succesvolle behandeling 80,7% (42/52) en in de groep chirurgisch behandeld was dit 100% (55/55). In tien casus in de groep medicamenteus behandeld (10/52) volgde chirurgische behandeling.
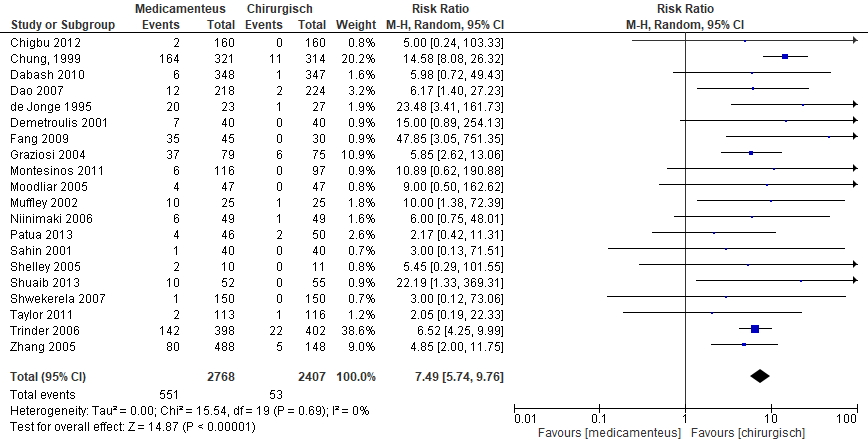
Figuur 7. Uitkomstmaat succesvolle behandeling- ongeplande interventie vergelijking medicamenteus versus chirurgisch.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Das (2012) rapporteerde succesvolle behandeling gedefinieerd als ‘complete evacuatie’ na 7 dagen. In de groep medicamenteus behandeld was dit 97,3% (108/111) en in de groep chirurgisch behandeld 98,2% (109/111). Kong (2013) rapporteerde complete miskraam na 2 weken. In de groep medicamenteus behandeld was dit 70% (42/60) en in de groep chirurgisch behandeld was dit 98,1% (52/60). Shaheen (2017) rapporteerde succesvolle behandeling gedefinieerd als complete evacuatie. In de groep medicamenteus behandeld was dit 65% (13/52) en in de groep chirurgisch behandeld was dit 96,3% (26/52).
Het gepoolde effect laat zien dat in de groep medicamenteus behandeld het percentage ongeplande interventies 19,9% (551/2768) was en in de groep chirurgisch behandeld was het percentage ongeplande interventies 2,2% (53/2407 (figuur 7). Dit leidde tot een risk ratio van 7,49 [95% BI 5,74 tot 9,76, p <0,00001] met een random effect model en met een lage heterogeniteit (I2=0%). Dit houdt in dat het percentage ongeplande interventies klinisch relevant hoger is in de groep medicamenteus behandeld vergeleken met de groep chirurgisch behandeld.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle behandeling is ‘hoog’.
2. Uitkomstmaat ‘Complicaties – ernstig bloedverlies’ (cruciaal)
Twee studies rapporteerden de uitkomstmaat ernstig bloedverlies (Kong, 2013; Patua, 2013). Kong (2013) definieerde ernstig bloedverlies als “saturatie van meer dan 1 dik maanverband elke uur in meer dan 2 uur of meer dan 1 maandverband per 30 minuten in 1 uur”. Patua (2013) definieerde ernstig bloedverlies als “saturatie van meer dan 5 dikke maanverbanden per 24 uur of verlies van ruim bloedverlies en/of stolsels”.
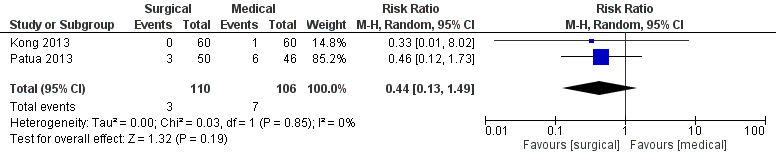
Figuur 8. Uitkomstmaat complicaties – ernstig bloedverlies vergelijking medicamenteus versus chirurgisch.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Het gepoolde effect laat zien dat het percentage ernstig bloedverlies 6,6% (7/106) was in de groep medicamenteus behandeld en 2,7% (3/110) in de groep chirurgisch behandeld (figuur 8). Dit leidde tot een risk ratio van 0,44 [95% BI 0,13 tot 1,49, p=0,19] met een random effect model en met een lage heterogeniteit (I2=0%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘complicaties - ernstig bloedverlies’ is met twee niveaus verlaagd gezien het zeer beperkt aantal patiënten (imprecisie) naar ‘laag’.
3. Uitkomstmaat ‘Complicaties – bloedtransfusie’ (cruciaal)
Negen studies rapporteerden de uitkomstmaat bloedtransfusies (Dabash, 2010; Davis, 2007; de Jonge, 1995; Demetroulis, 2001; Graziosi, 2004; Muffley, 2002; Shelley, 2005; Shuaib, 2013; Trinder, 2006).
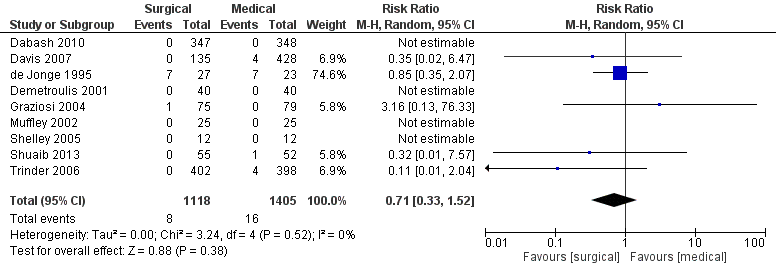
Figuur 9. Uitkomstmaat bloedtransfusies vergelijking medicamenteus versus chirurgisch.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Het gepoolde effect laat zien dat in de groep die medicamenteus werd behandeld het percentage bloedtransfusies 1,1% (16/1405) was en in de groep chirurgisch behandeld was het percentage bloedtransfusies 0,7% (8/1118) (figuur 9). Dit leidde tot een risk ratio van 0,71 [95% BI 0,33 tot 1,52, p=0,38] met een random effect model en met een lage heterogeniteit (I2=0%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘complicaties – bloedtransfusie’ is met twee niveaus verlaagd (imprecisie) en is ‘laag’.
4. Uitkomstmaat ‘Complicaties – infecties na behandeling’ (cruciaal)
Negen studies rapporteerden de uitkomstmaat infectie (incidentie tot 15 dagen) (Chung, 1999; Kong, 2013; Moodliar, 2005; Sahin, 2001; Shelley, 2005; Shuaib, 2013; Shwekerela, 2007; Trinder, 2006; Zhang, 2005).
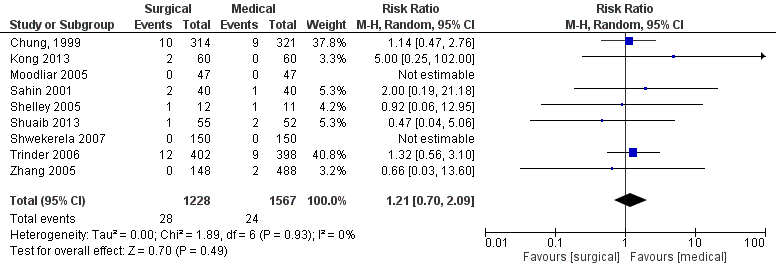
Figuur 10. Uitkomstmaat Infecties vergelijking medicamenteus versus chirurgisch.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Het gepoolde effect laat zien dat in de groep medicamenteus behandeld het percentage infecties 1,5% (24/1567) was en in de groep chirurgisch behandeld was het percentage infecties 2,3% (28/1228) (figuur 10). Dit leidde tot een risk ratio van 1,21 [95%BI 0,70 tot 2,09, p=0,49] met een random effect model en met een lage heterogeniteit (I2=0%). Hetgeen inhoudt dat het percentage infecties niet klinisch relevant verschilt tussen de groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘complicaties – infecties na behandeling’ is met twee niveaus verlaagd gezien het brede betrouwbaarheidsinterval (imprecisie) en is ‘laag’.
5. Uitkomstmaat ‘Pijn – duur’ (belangrijk)
Acht studies rapporteerden de uitkomstmaat pijnduur (Chung, 1999; Dao, 2007; Demetroulis, 2001; Dabash, 2010; Kong, 2013; Montesinos, 2011; Shelley, 2005; Taylor, 2011).
Eén studie (Demetroulis, 2001) rapporteerde een langere pijnduur in de groep medicamenteus behandeld (gemiddeld aantal dagen 4,7 (sd 2,4, n = 36) ten opzichte van de groep chirurgisch behandeld (gemiddeld aantal dagen 2,8 (sd, 1,6, n= 35) (MD 1,9 95%BI 0,95 tot 2,85), P < 0,0001
De overige zeven studies rapporteerden geen verschil tussen de groepen. Kong (2013) rapporteerde in de groep chirurgisch behandeld een duur van 4,91 dagen (sd 4.20) en in de groep medicamenteus behandeld 5,40 dagen (sd 3.95) (MD 0,49 95%BI -0,97 tot 1,95). Dabash (2010) rapporteerde in de groep medicamenteus behandeld 2,63 dagen (sd niet gerapporteerd, n=327) en in de groep chirurgisch behandeld 2,63 dagen (sd niet gerapporteerd, n= 316). Shelley (2005) rapporteerde in de groep medicamenteus behandeld een mediaan van 3,0 dagen (Range 0,2-16,0, n = 11) in de groep medicamenteus behandeld en een mediaan van 2,0 dagen in de groep chirurgisch behandeld (range 0,2-12,0, n = 12). Montesinos (2011) rapporteerde in de groep medicamenteus behandeld 2,5 dagen (sd niet gerapporteerd) en in de groep chirurgisch behandeld 2,6 dagen (sd niet gerapporteerd). Taylor (2011) rapporteerde in de groep medicamenteus behandeld 1,44 dagen (sd niet gerapporteerd) en in de groep chirurgisch behandeld 1,34 dagen (sd niet gerapporteerd). Chung (1999) rapporteerde in de groep medicamenteus behandeld 0,17 dagen (sd niet gerapporteerd, n= 321) en in de groep chirurgisch behandeld 0,25 dagen (sd niet gerapporteerd, n= 314). Dao (2007) rapporteerde in de groep medicamenteus behandeld 1,4 dagen (sd niet gerapporteerd, n= 223) en in de groep chirurgisch behandeld 1,3 dagen (sd niet gerapporteerd., n= 224).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijn – duur’ is met twee niveaus verlaagd gezien de beperkingen in studieopzet (risk of bias, geen blindering) en de tegenstrijdige resultaten (inconsistentie) naar ‘laag’
6. Uitkomstmaat ‘Pijnbeleving’ (belangrijk)
Drie studies (Graziosi, 2004; Moodliar, 2005; Zhang, 2005) rapporteerden het aantal patiënten met pijnintensiteit 10 op de VAS score. De gepoolde resultaten van deze studies laten zien dat de pijnintensiteit hoger is in de groep medicamenteus behandeld (n = 602) ten opzichte van de groep chirurgisch behandeld (n= 263) (mean difference 2,3 95%BI 1,92 tot 2,68, P < 0,00001).
Shelley (2005) rapporteerde pijnintensiteit met behulp van een aangepaste Brief Pain Inventory (BPI) (geen verdere informatie beschreven) en rapporteerde geen verschil tussen de groepen, in de groep medicamenteus (n=11) was de mediaan 3 (range 1 tot 8) en in de groep chirurgisch behandeld (n=12) was de mediaan 3 (Range 1-10).
Fang (2009) rapporteerde geen verschil tussen de groepen: in de groep medicamenteus behandeld hadden 5/45 (11%) een score van 7-10 en in de groep chirurgisch behandeld 3/30 (10%) een score van 7 tot 10 (RR 1,11 95%BI 0,29 tot 4,31).
Dao (2007) rapporteerde pijnintensiteit als de incidentie van pijn/krampen op een 7-punts Likert schaal (VAS).
Er werd een lagere gemiddelde pijnscore gerapporteerd van 2,32 in de groep medicamenteus behandeld (sd niet gerapporteerd) en 2,73 in de groep chirurgisch behandeld (sd niet gerapporteerd) (mean difference 0,41, 95%BI niet gerapporteerd).
Shwekerala (2007) rapporteerde pijnintensiteit op een 7-punt Likert schaal met een lagere pijnscore van 3,0 (sd niet gerapporteerd) in de groep medicamenteus behandeld ten opzichte van en 3,5 in de groep chirurgisch behandeld (mean difference 0,5, 95%BI niet gerapporteerd).
Patua (2013) rapporteerde ernstige pijn gedefinieerd als VAS-score 7-10 voor ontslag. In de groep medicamenteus behandeld waren dit 5/46 patiënten en in de groep chirurgisch behandeld 9/50 patiënten (RR 0,6 95%BI 0,22 tot 1,67).
Das (2012) rapporteerde het aantal patiënten met pijn (als categoriale variabele), in de groep chirurgisch behandeld werd geen pijn gerapporteerd en in de groep medicamenteus behandeld rapporteerden 3 (2,7%) patiënten pijn.
Chigbu (2012) rapporteerde het aantal patiënten met pijn/krampen (gemeten op een 7-punts Likert schaal) in de groep chirurgisch behandeld rapporteerden significant meer patiënten pijn/krampen (140/160, 87,5%) met een gemiddelde pijnscore van 4,5 dan in de groep medicamenteus behandeld (84/160, 52,5%) met een gemiddelde pijnscore van 3,0.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijnbeleving’ is met drie niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, geen blindering) en tegenstrijdige resultaten (inconsistentie) naar ‘zeer laag’.
7. Uitkomstmaat ‘Tevredenheid’ (belangrijk)
Elf studies rapporteerden over patiënttevredenheid (Chigbu, 2012; Dabash, 2010; Dao, 2007; Demetroulis, 2001; Fang, 2009; Montesinos, 2011; Niinimaki, 2006; Sahin, 2001; Shuaib, 2013; Shwekerela, 2007; Taylor, 2011).
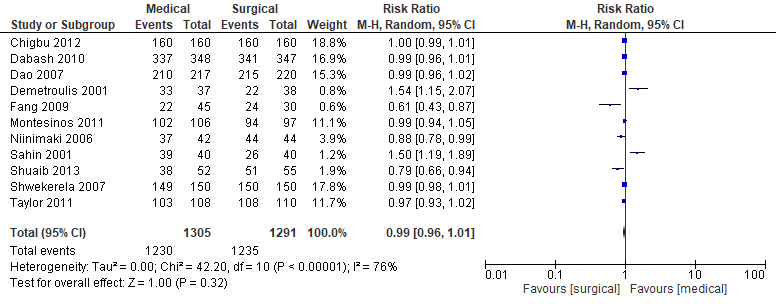
Figuur 11. Uitkomstmaat tevredenheid vergelijking medicamenteus versus chirurgisch.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Het gepoolde effect laat zien dat in de groep medicamenteus behandeld het percentage patiënttevredenheid 94% (1230/1305) was en in de groep chirurgisch behandeld was het percentage patiënttevredenheid 96% (1235/1291) (figuur 11). Dit leidde tot een risk ratio van 0,99 (95%BI 0,96 tot 1,01, p=0,32) met een random effect model en met een hoge mate van heterogeniteit (I2=76%). Hetgeen inhoudt dat patiënttevredenheid niet klinisch relevant verschilt tussen de groepen.
Kong (2013) rapporteerde de CSQ8-score. Er was geen verschil is tevredenheid in de groep medicamenteus behandeld (3,17, sd 0,67, n=60) ten opzichte van de groep chirurgisch behandeld (3,23, sd 0,61, n=60).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘tevredenheid’ is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, geen blindering) en tegenstrijdige resultaten (inconsistentie, hoge mate van heterogeniteit) naar ‘laag’.
8. Uitkomstmaat ‘Fertiliteit – aantal levendgeborene uit een volgende zwangerschap’ (belangrijk)
De gepoolde resultaten van twee studies (Smith, 2009; Tam, 2005) laten zien dat in de groep medicamenteus behandeld het percentage levendgeborenen 80,3% (290/361) was en in de groep chirurgisch behandeld was dit 83,3% (304/365) (RR 0,96 95%BI 0,90 tot 1,03). Smith (2009) includeerde echter ook patiënten die niet opnieuw zwager wilden worden in de analyse. Graziosi (2004) rapporteerde geen verschil in ‘doorgaande zwangerschap bij 12 weken AD’ tussen de groepen (RR 0,98 95%BI 0,66 tot 1,5).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘fertiliteit – aantal levendgeborene uit een volgende zwangerschap’ is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, loss to follow up) en extrapoleerbaarheid (bias t.g.v. indirectheid) naar ‘laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Vergelijking 1: Leidt een chirurgische behandeling of een afwachtend beleid tot betere uitkomsten bij patiënten gediagnosticeerd met een miskraam en patiënten met een niet-vitale zwangerschap?
P patiënten gediagnosticeerd met een miskraam of niet-vitale zwangerschap;
I chirurgische behandeling;
C afwachtend beleid (nb. geen placebo);
O succesvolle behandeling, bloedverlies, pijn, vervolgbehandelingen, complicaties, toekomstige fertiliteit, patiënttevredenheid.
Vergelijking 2: Leidt een medicamenteuze behandeling of een afwachtend beleid tot betere uitkomsten bij patiënten gediagnosticeerd met een miskraam en patiënten met een niet-vitale zwangerschap?
P patiënten gediagnosticeerd met een miskraam of niet-vitale zwangerschap.
I medicamenteuze behandeling.
C afwachtend beleid (nb. geen placebo).
O succesvolle behandeling bloedverlies, pijn, vervolgbehandelingen, complicaties, toekomstige fertiliteit, patiënttevredenheid.
Vergelijking 3: Leidt een chirurgische behandeling of een medicamenteuze behandeling tot betere uitkomsten bij patiënten gediagnosticeerd met een miskraam en patiënten met een niet-vitale zwangerschap?
P patiënten gediagnosticeerd met een miskraam of niet-vitale zwangerschap.
I chirurgische behandeling.
C medicamenteuze behandeling.
O succesvolle behandeling, bloedverlies, pijn, vervolgbehandelingen, complicaties, toekomstige fertiliteit, patiënttevredenheid.
Relevante uitkomstmaten
De werkgroep achtte succesvolle behandeling en complicaties (ernstig bloedverlies/bloedtransfusie, pijn, infectie) voor de besluitvorming cruciale uitkomstmaten; en patiënttevredenheid, vervolgbehandelingen en lange termijn gevolgen voor fertiliteit voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten succesvolle behandeling, complicaties, bloedverlies, pijn, infectie patiënttevredenheid, vervolgbehandelingen en lange termijn gevolgen fertiliteit, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde vooraf voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie voor continue uitkomstmaten en vergeleken de resultaten met deze grenzen: RR < 0,80 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van dichotome uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevante benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) & Embase (via Elsevier) is op 30 januari 2019 met relevante zoektermen gezocht naar studies die verschillende behandelingen vergeleken bij patiënten gediagnosticeerd met een actieve miskraam en patiënten met een niet-vitale zwangerschap. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
Voor deze vraag is gebruikt gemaakt van beschikbare literatuur (35 studies) over deze vergelijking uit de NICE-richtlijn ‘Ectopic pregnancy and miscarriage’ (NICE, 2012). In de NICE-richtlijn is tot begin 2012 gezocht naar literatuur. Deze search is aangevuld met een literatuursearch uitgevoerd door de werkgroep. De literatuurzoekactie leverde 813 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- gepubliceerd in het Nederlands of Engels;
- gepubliceerd na 2012;
- studiedesign SR, RCT of cohort (voor uitkomstmaat fertiliteit);
- beschrijven en vergelijken verschillende chirurgische, medicamenteuze behandelingen of afwachtend beleid.
In de NICE richtlijn (2012) worden reeds 35 studies beschreven die voldoen aan de PICO. Er werd door de werkgroep een zeer recente netwerkanalyse van Al-Wattar (2019) geselecteerd. Omdat het op basis van deze publicatie niet mogelijk is om een GRADE beoordeling uit te voeren voor de beschreven uitkomstmaten, zijn de individuele studies in de literatuursamenvatting geïncludeerd. Uit deze netwerkanalyse voldeden 10 studies aan de PICO.
Op basis van titel en abstract werden er uit de aanvullende search in eerste instantie 21 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd. Dit leverde nog een studie op die niet was opgenomen in de review van Al-Wattar (2019).
In totaal zijn 46 onderzoeken opgenomen in de literatuuranalyse, namelijk 35 reeds beschreven in de NICE richtlijn, plus 10 uit de netwerkanalyse van Al-Wattar en één uit de aanvullende search. De 35 studies uit de NICE worden niet in detail beschreven, deze beschrijving is opgenomen in de NICE-richtlijn (NICE, 2012). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Referenties
- Al-Ma'ani W, Solomayer EF, Hammadeh M. Expectant versus surgical management of first-trimester miscarriage: a randomised controlled study. Arch Gynecol Obstet. 2014 May;289(5):1011-5. doi: 10.1007/s00404-013-3088-1. Epub 2013 Nov 16. PubMed PMID: 24240972.
- Al-Wattar B, Murugesu N, Tobias A, Zamora J, Khan KS. Management of first-trimester miscarriage: a systematic review and network meta-analysis. Hum Reprod Update. 2019 May 1;25(3):362-374. doi: 10.1093/humupd/dmz002. PubMed PMID: 30753490.
- Casikar I, Bignardi T, Riemke J, Alhamdan D, Condous G. Expectant management of spontaneous first-trimester miscarriage: prospective validation of the '2-week rule'. Ultrasound Obstet Gynecol. 2010 Feb;35(2):223-7. doi: 10.1002/uog.7486. PubMed PMID: 20049981.
- Chigbu B, Onwere S, Aluka C, Kamanu C, Ezenobi O. IS MISOPROSTOL A SUITABLE ALTERNATIVE TO THE SURGICAL EVACUATION OF INCOMPLETE ABORTION IN RURAL SOUTH-EASTERN NIGERIA? East Afr Med J. 2012 May;89(5):172-7. PubMed PMID:26875224.
- Dangalla DP, Goonewardene IM. Surgical treatment versus expectant care in the management of incomplete miscarriage: a randomised controlled trial. Ceylon Med J. 2012 Dec;57(4):140-5. doi: 10.4038/cmj.v57i4.5077. PubMed PMID: 23292054.
- Das C, Sharma M, Pardeep K, Khurshid F. To Compare the Safety and Efficacy of Manual Vacuum Aspiration with Misoprostol (ST mom) 600mg in Incomplete Miscarriage. J Liaquat Uni Med Health Sci 2014; Vol 13: No. 03.
- Fernlund A, Jokubkiene L, Sladkevicius P, Valentin L. Misoprostol treatment vs expectant management in women with early non-viable pregnancy and vaginal bleeding: a pragmatic randomized controlled trial. Ultrasound Obstet Gynecol. 2018 Jan;51(1):24-32. doi: 10.1002/uog.18940. Epub 2017 Dec 5. PubMed PMID: 29072372.
- Gilman Barber AR, Rhone SA, Fluker MR. Curettage and Asherman's syndrome-lessons to (re-) learn? J Obstet Gynaecol Can. 2014 Nov;36(11):997-1001. doi: 10.1016/S1701-2163(15)30413-8. PubMed PMID: 25574677.
- Kong GW, Lok IH, Yiu AK, Hui AS, Lai BP, Chung TK. Clinical and psychological impact after surgical, medical or expectant management of first-trimester miscarriage--a randomised controlled trial. Aust N Z J Obstet Gynaecol. 2013 Apr;53(2):170-7. doi: 10.1111/ajo.12064. Epub 2013 Mar 13. PubMed PMID: 23488984.
- Lemmers M, Verschoor MA, Hooker AB, Opmeer BC, Limpens J, Huirne JA, Ankum WM, Mol BW. Dilatation and curettage increases the risk of subsequent preterm birth: a systematic review and meta-analysis. Hum Reprod. 2016 Jan;31(1):34-45. doi: 10.1093/humrep/dev274. Epub 2015 Nov 2. Review. PubMed PMID: 26534897.
- Hooker AB, Lemmers M, Thurkow AL, Heymans MW, Opmeer BC, Brölmann HA, Mol BW, Huirne JA. Systematic review and meta-analysis of intrauterine adhesions after miscarriage: prevalence, risk factors and long-term reproductive outcome. Hum Reprod Update. 2014 Mar-Apr;20(2):262-78. doi: 10.1093/humupd/dmt045. Epub 2013 Sep 29. Review. PubMed PMID: 24082042.
- Hooker AB, Aydin H, Brölmann HA, Huirne JA. Long-term complications and reproductive outcome after the management of retained products of conception: a systematic review. Fertil Steril. 2016 Jan;105(1):156-64.e1-2. doi: 10.1016/j.fertnstert.2015.09.021. Epub 2015 Oct 9. Review. PubMed PMID: 26453977.
- Hooker AB, de Leeuw R, van de Ven PM, Bakkum EA, Thurkow AL, Vogel NEA, van Vliet HAAM, Bongers MY, Emanuel MH, Verdonkschot AEM, Brölmann HAM, Huirne JAF. Prevalence of intrauterine adhesions after the application of hyaluronic acid gel after dilatation and curettage in women with at least one previous curettage: short-term outcomes of a multicenter, prospective randomized controlled trial. Fertil Steril. 2017 May;107(5):1223-1231.e3. doi: 10.1016/j.fertnstert.2017.02.113. Epub 2017 Apr 6. PubMed PMID: 28390688.
- McCarthy FP, Khashan AS, North RA, Rahma MB, Walker JJ, Baker PN, Dekker G, Poston L, McCowan LM, O'Donoghue K, Kenny LC; SCOPE Consortium. Pregnancy loss managed by cervical dilatation and curettage increases the risk of spontaneous preterm birth. Hum Reprod. 2013 Dec;28(12):3197-206. doi: 0.1093/humrep/det332. Epub 2013 Sep 19. PubMed PMID: 24052504.
- Nadarajah R, Quek YS, Kuppannan K, Woon SY, Jeganathan R. A randomised controlled trial of expectant management versus surgical evacuation of early pregnancy loss. Eur J Obstet Gynecol Reprod Biol. 2014 Jul;178:35-41. doi: 10.1016/j.ejogrb.2014.02.021. Epub 2014 Feb 20. PubMed PMID: 24813099.
- NICE. NICE-guideline ‘Ectopic pregnancy and miscarriage: diagnosis and initial management’. 2012 & Update in 2019.
- Patau B, Dasgupta M, Bhattacharyya S, Bhattacharyya S, Hasan S, Saha S. An approach to evaluate the efficacy of vaginal misoprostol administered for a rapid management of first trimester spontaneous onset incomplete abortion, in comparison to surgical curettage. Arch Gynecol Obstet (2013) 288:1243–1248
- SHAHEEN H, SIDDIQUE KHOSA M, HANIF, H. Comparison of Efficacy of Manual Vacuum Aspiration (MVA) and Medical Treatment in the Management of First Trimester Missed Miscarriage. P J M H S Vol. 11, NO. 1, JAN – MAR 2017.
- Shuaib A, Alharazi A. Medical versus surgical termination of the first trimester missed miscarriage. Alexandria Journal of Medicine (2013) 49, 13–16.
- Torre A, Huchon C, Bussieres L, Machevin E, Camus E, Fauconnier A. Immediate versus delayed medical treatment for first-trimester miscarriage: a randomized trial. Am J Obstet Gynecol. 2012 Mar;206(3):215.e1-6. doi: 10.1016/j.ajog.2011.12.009. Epub 2011 Dec 16. PubMed PMID: 22381604.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Al Wattar, 2019
[individual study characteristics deduced from [Al Wattar, 2019]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to [june/2018]
A: Al-Ma’ani, 2014 B: Bagratee, 2004 C: Bique, 2007 D: Blohm, 2005 E: Chigbu, 2012 F: Dabash, 2010 G: Dangalla, 2012 H: Dao, 2007 I: Das, 2014 J: Demetrioulis, 2001 K: Fang, 2009 L: Fernlund, 2018 M:Ganguly, 2010 N: Graziosi, 2004 O: Gronlund, 2002 P: Herabutya, 1997 Q: Holanda, 2003 R: Chung, 1999 S: Karlsen, 2001 T:Kittiwatanakul,2012 U:Kong, 2013 V: Lister, 2005 W: Montesinos, 2011 X: Moodliar, 2005 Y: Muffley, 2002 Z: Nadarajah, 2014 AA:Ngai 2001 AB: Nielsen1995 AC: Nielsen1999 AD: Niinimäki 2006 AE: Patua 2013 AF: Pereira 2006 AG: Sahin 2001 AH: Schreiber 2018 AI: Shelley 2005 AJ: Shuaib 2013 AK: Shwekerela 2007 AL: Sinha 2018 AM: Stockheim 2006 AN: Taylor 2011 AO:Torre 2012 AP: Trinder 2006 AQ: Weeks 2005 AR: Wijesinghe 2011 AS: Wood 2002
Study design: RCT
Setting and Country: A third of included trials were conducted in European countries (14/46, 30.4%) and 14 in Asian countries (14/46, 30.4%). Most studies included a two arms comparison and four included three arms. The median study sample size was 60 (range: 12–402). The majority of trials were conducted in tertiary healthcare settings (35/46, 76.1%). One study was conducted in outpatient settings. Eight were multicentre randomized trials (8/46, 17.3%).
Source of funding and conflicts of interest: SR: ‘No funding was received in support of this work.’ ‘Conflict of interest None.’ |
Inclusion criteria SR:
Randomized trials that evaluated any treatment option in women with first-trimester miscarriage (defined as a spontaneous loss of a non-viable intrauterine pregnancy between 0 and 14 weeks’ gestation)
Studies that included a combination of two treatment options (e.g. medical plus surgical).
Studies with multiple comparison arms.
Exclusion criteria SR:
Quasi-randomized studies and those reporting on elective termination of pregnancy.
Studies that compared variations of the same treatment in both arms (e.g. misoprostol 400 μg vs misoprostol 600 μg) were reported narratively and excluded from the meta-analysis.
Studies that reported on secondary outcomes only.
46 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: XX patients, XX yrs B: C: ….
Sex: A: % Male B: C: ….
Groups comparable at baseline. |
Describe intervention:
A: EXP B: MISO 600 µg PV C: MISO 600 µg PO D: MISO 400 µg PV E: MISO 800 µg PO F: MISO 400 µg SL G: H: I: .....
|
Describe control:
A: EVAC B: Placebo C: MVA D: Placebo E: MVA F: MVA G: EVAC H: MVA I: MVA .....
|
End-point of follow-up:
A: not reported B: C: D: E: F: G: H: I: ….
For how many participants were no complete outcome data available? (intervention/control) A: 102/115 B: 52/52 C: 123/124 D: 64/62 E: -/- F: G: H: I: ….
|
PICO 1. Surgical versus expectant management
Outcome measure-1: success rate Defined as complete evacuation of products of conception
Effect measure: RR, RD, mean difference [95% CI]: A: B: …
EXP versus D+C (D) RR 0.79, 95%CI 0.71-0.88
EXP versus EVAC (D) RR 0.79, 95%CI 0.64-0.98
Outcome measure-2 ....
Outcome measure-3 ....
PICO 2. Medical versus expectant management
Outcome measure-1: success rate Defined as complete evacuation of products of conception
Pooled effect (random effects model / fixed effects model): …. [95% CI …to…] favoring …. Heterogeneity (I2):
EXP versus MISO (D) RR 0.51, 95%CI 0.33-0.78
MIFE+MISO versus EXP (D) RR 1.55, 95%CI 0.97-2.05
PICO 3. Surgical versus medical management
Outcome measure-1: success rate Defined as complete evacuation of products of conception
D+C versus MISO RR 1.09, 95%CI 0.99-1.20
EVAC versus MISO (D) RR 1.23, 95%CI 1.04-1.45
MIFE+MISO versus EVAC (D) RR 0.84, 95%CI 0.72-0.99
MVA versus MISO (D) RR 1.01, 95%CI 0.98-1.04
Outcome measure-2: blood transfusion
Blood transfusion Infection/PID Need for analgesia Satisfaction Serious complications Fever/Diarrhoea/Vomiting/Nausea
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Network analysis. Data from direct comparisons are extracted for success-rate, due to inconsistency in effect measures from the network analysis
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Risk of Bias assessment
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Al Wattar, 2019 |
Yes |
Yes |
Unclear |
Yes |
NA |
Yes, Cochrane risk of bias assessment tool |
Unclear, statistical heterogeneity not reported |
Yes, funnel plot supplement |
Yes |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/ unclear)
|
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/ unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/ unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/ unclear) |
|
Fernlund, 2018 |
“This was a randomized controlled, open-label trial with individual randomization into two parallel groups 1:1, i.e. treatment with vaginal misoprostol or expectant management” |
Likely, open-label |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Al Ma’ani, 2014 |
‘Randomisation was done by a computer generated list of random numbers.’ |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Nadarajah, 2014 |
‘Randomisation was in blocks of ten using a computer-generated random sequence, and sequentially numbered sealed envelopes were prepared and provided by the study coordinator.’ |
Unlikely, the randomisation list was kept by an independent member of staff not involved in the trial. |
Likely, ‘no attempt was made to conceal the intervention assignment schedule from the patients or clinicians as the methods for the study groups were obviously different.’ |
Likely |
Unlikely |
unlikely |
unlikely |
Unlikely |
|
Dangalla, 2012 |
‘Sequentially numbered sealed opaque envelopes with a card mentioning the study arm were prepared earlier by the second author. After TVS, uncomplicated patients (n=160) who fulfilled the criteria (RPC between 15-50 mm in AP diameter) were randomised to two groups by block randomisation.’ |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
|
Das, 2014 |
“Sample was randomized using computer generated random sequence, treatment was printed on a card and that card was closed in a envelop. Envelops were then sealed and were mixed randomly, then serial numbers were given to envelops from 1 to 222.” |
Unlikely |
Likely |
Likely |
Unclear |
Unclear |
Unlikely |
Unlikely |
|
Kong, 2013 |
“Participants who agreed to join the study were randomised according to a computer-generated numbers into three groups, and the investigators would not be aware of the randomisation schedule” |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Patua, 2013 |
‘The women were allocated to two groups using a random number table.’ |
Unlikely |
Likely
|
Likely |
Unlikely ‘double blinding could not be done as the observers were responsible for the clinical management of the patients too and thus had to know the treatment that each patient was offered. ‘the sonographer performing the follow-up scan was unaware of the type of previous interventions.’ |
Unlikely |
Unlikely |
Unlikely |
|
Shuaib, 2013 |
‘Fifty-five women (n =55) were selected randomly to undergo surgical evacuation as dilatation and curettage (D&C) and 52 women to receive medical termination.’ |
Unclear |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Chigbu, 2012 |
“Consenting women were randomly assigned to one of the two study regimens. The randomisation allocation was 1:1 (600μg misoprostol tablet taken orally: MVA) and was accomplished using sequentially numbered envelopes. When a new participant was enrolled in the study, a trained nurse would open the next envelope in the numbered series and the woman would receive the treatment specified therein.’ |
Likely, open-label |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Torre, 2012 |
‘For each patient, an inclusion form was faxed to a centralized statistics department for randomization into 2 groups, using a computer-generated list, in blocks of 4.’ |
Unlikely |
Likely, ‘neither the patients nor the physicians were blinded to the treatment arm.’ |
Likely, ‘neither the patients nor the physicians were blinded to the treatment arm.’ |
Unlikely |
Unlikely |
Unlikely |
Unlikely, ‘Patients who requested a change in treatment after randomization were analysed as part of their initial group, on an intention-to-treat basis.’ |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Raymond, 2019 |
Voldoet niet aan de PICO, niet juiste vergelijking |
|
Kim, 2017 |
Voor SR AL-wattar 2019 |
|
Saccone, 2016 |
Voldoet niet aan de PICO, niet juiste vergelijking |
|
Lemmers, 2016 |
Voldoet niet aan de PICO, niet juiste populatie |
|
Hooker, 2016 |
voldoet niet aan de PICO, alleen chirurgische behandeling |
|
Hooker, 2014 |
voldoet niet aan de PICO, alleen chirurgische behandeling |
|
Neilson, 2013 |
Voor SR AL-Wattar 2019 |
|
Nanda, 2012 |
Voor SR AL-Wattar 2019 |
|
Lemmers, 2018 |
Voldoet niet aan de PICO, niet juiste populatie |
|
Lemmers, 2017 |
Voldoet niet aan de PICO, niet juiste populatie |
|
Salam, 2016 |
Voldoet niet aan de PICO, niet de juiste vergelijking |
|
Lemmers, 2016 |
Voldoet niet aan de PICO, niet juiste populatie |
|
Sajan, 2015 |
Observationele studie, niet juiste uitkomstmaat |
|
Shokry, 2014 |
Observationele studie, niet juiste uitkomstmaat |
|
Verschoor, 2013 |
Voldoet niet aan de PICO, niet juiste populatie |
|
Cubo-Nava, 2019 |
Voldoet niet aan de PICO, niet juiste uitkomstmaten |
|
Shaikh, 2017 |
observationele studie, niet juiste uitkomstmaat |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-07-2020
Beoordeeld op geldigheid : 24-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de NVOG of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVOG is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de verschillende richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Behandeling van een miskraam |
NVOG |
2020 |
2025 |
1x per 5 jaar |
NVOG |
|
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van verschillende relevante specialismen die betrokken zijn bij de zorg voor patiënten die een miskraam hebben doorgemaakt. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Drs. E. Hink, gynaecoloog, werkzaam in het Radboudumc, Nijmegen, Nederlandse Vereniging voor Obstetrie en Gynaecologie (voorzitter).
- M.M.J. van den Berg MSc., fertiliteitsarts, werkzaam in het Academisch Medisch Centrum, Amsterdam, Vereniging van Fertiliteitsartsen.
- Dr. F.M. van Dunné, gynaecoloog, werkzaam in het Haaglanden Medisch Centrum, Den Haag, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Prof. dr. M. Goddijn, hoogleraar Voortplantingsgeneeskunde & gynaecoloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- M. Hermus, verloskundige, werkzaam bij Verloskundigen Oosterhout, Oosterhout, Koninklijke Nederlandse Organisatie van Verloskundigen. (tot april 2019)
- Drs. A. B. Hooker, gynaecoloog, werkzaam in het Zaans Medisch Centrum, Zaandam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. S. Kuc, fertiliteitsarts, werkzaam in het St. Antonius Ziekenhuis, Utrecht, Vereniging van Fertiliteitsartsen.
- Dr. M. Lemmers, AIOS gynaecologie, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. R.H.F. van Oppenraaij, gynaecoloog, werkzaam in het Maasstad Ziekenhuis, Rotterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- A.J.Y. van Sluis, echoscopist, oa. werkzaam bij Rivas Zorggroep, Gorinchem, Beroepsvereniging Echoscopisten Nederland.
- K. Spijkers, patiëntvertegenwoordiger, Utrecht, Patiëntenfederatie Nederland.
Meelezer
- A. Beuckens, Beleidsmedewerker KNOV, Koninklijke Nederlandse Organisatie van Verloskundigen. (vanaf mei 2019)
Met ondersteuning van
- A.A. Lamberts MSc., senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- L.H.M. Niesink-Boerboom MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Overzicht Belangenverklaringen |
|||||||||
|
Achternaam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie? |
|
van den Berg |
Fertiliteitsarts, Amsterdam UMC locatie AMC |
ESHRE, Bestuurslid SIG Implantation & Ectopic Pregnancy (onbetaald) Travelgrants t/m juli 2021 |
geen |
geen |
geen |
geen |
geen |
18-7-2018 |
Geen actie nodig |
|
Dunné |
Gynaecoloog, Haaglanden Medisch Centrum (HMC) te Den Haag |
Lid Werkgroep Otterlo (landelijke richtlijnen commissie Obstetrie) (onbetaald) |
geen |
geen |
geen |
geen |
geen |
9-3-2018 |
Geen actie nodig. |
|
Goddijn |
Hoogleraar Voortplantingsgeneeskunde, gynaecoloog, pijlerhoofd Voortplantingsgeneeskunde, Amsterdam UMC |
-Bestuurslid SIG Fertiliteitspreservatie NVOG (vice-voorzitter/ onbetaald) |
geen |
geen |
Onderzoeks financiering vanuit ZonMw en KWF/Pink Ribbon. Niet conflicterend met onderwerp richtlijn. |
geen |
geen |
5-3-2018 |
Geen actie nodig. |
|
Hink |
Gynacoloog perinatoloog Radboudumc te Nijmegen |
geen |
geen |
geen |
geen |
geen |
geen |
19-3-2018 |
Geen actie nodig |
|
Hooker |
Gynaecoloog, Zaans Medisch Centrum (ZMC), te Zaandam. |
Docent 2-daagse cursus Zicht op Ziekenhuizen, studiecentrum voor Bedrijf en Overheid. Onderwerp: kwaliteit en veiligheid in de zorg en veranderde positie van de medisch specialist. (betaald). |
Adviseur firma Fziomed (USA), advies bij ontwikkelen middel ter preventie intra-uteriene verklevingen (betaald). |
geen |
Was hoofdonderzoeker van de Post Abortion Prevention of Adhesion |
Zie kolom extern gefinancierd onderzoek |
geen |
12-5-2018 |
Besloten dat indien er een vraag over dit specifieke onderwerp in het raamwerk wordt opgenomen Angelo Hooker hier geen voortrekker van zal zijn. |
|
Klapwijk-Hermus |
Verloskundigen Oosterhout – eerstelijns verloskundige, eigenaar praktijk |
Promotietraject, onderwerp: evaluatie van geboortecentra in Nederland. Afrondend, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
14-5-2018 |
Geen actie nodig |
|
Kuc |
Fertiliteitsarts , St. Antonius Ziekenhuis, te Nieuwegein |
Bestuurslid vereninging van fertiliteitsartsen VVf (onbetaald) |
geen |
geen |
geen |
geen |
geen |
3-5-2018 |
Geen actie nodig |
|
Lamberts |
Adviseur Kennisinstituut |
Beleidsmedewerker Kwaliteit NVKG |
geen |
geen |
geen |
geen |
geen |
2014 |
Geen actie nodig |
|
Lemmers |
AIOS Gynaecologie VUMC te Amsterdam |
Arts-onderzoeker (onbetaald). Uitvoeren Cochrane review medicamenteuze behandeling miskraam tot 20 weken. |
geen |
geen |
geen |
geen |
geen |
15-3-2018 |
Geen actie nodig. |
|
Oppenraaij |
Gynaecoloog, Maasstad Ziekenhuis, te Rotterdam |
Bestuurslid werkgroep jonge zwangerschap NVOG (onbetaald) |
geen |
geen |
Deelname ahrends studie van Bayer onderzoek naar nieuwe medicatie bij vrouwen met endometriose. Onderzoek is inmiddels gesloten zonder enige inclusie in ons ziekenhuis. |
geen |
geen |
5-5-2018 |
Geen actie nodig. |
|
Sluis |
Obstetrisch en Gynaecologisch echoscopiste bij Screeningscentrum Fara te Ede (8u per week) |
Bestuurslid BEN, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
1-6-2018 |
Geen actie nodig |
|
Spijkers |
Senior Beleidsadviseur/ projectmanager Patiëntenfederatie Nederland |
Voorzitter Stichting Samen voor Duchenne, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
24-5-2018 |
Geen actie nodig |
|
Viester |
Adviseur Kennisinstituut |
geen |
geen |
geen |
geen |
geen |
geen |
2018 |
Geen actie nodig |
|
Beuckens (meelezer) |
Beleidsmedewerker kwaliteit en implementatie KNOV |
Coaching/luisterend oor - betaald (minder dan 5 keer per jaar) |
geen |
geen |
geen |
geen |
geen |
2019 |
Geen actie nodig |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland zitting te laten nemen in de werkgroep. Patiëntenverenigingen Freya en VSOP zijn eveneens gevraagd zitting te nemen in de werkgroep, zij gaven echter aan de voorkeur te hebben om alleen bij de invitational conference aanwezig te zijn en input te leveren tijdens de commentaarfase. Er is in samenwerking met de Patiëntenfederatie Nederland op 1 mei 2019 een focusgroep georganiseerd, de resultaten hiervan zijn meegenomen in de richtlijntekst. Een verslag van de bijeenkomst is als aanverwant product opgenomen bij de richtlijn. Er heeft een invitational conference plaatsgevonden aan de start van het traject waar verschillende patiëntenorganisaties voor waren uitgenodigd (Freya, VSOP, Patiëntenfederatie Nederland, Stichting Kind&Ziekenhuis). Een verslag hiervan is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VSOP, Freya en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Voor deze richtlijn is waar mogelijk uitgegaan van de NICE-richtlijn ‘Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage’ uit 2012. Bruikbare onderdelen zijn van een update voorzien zodat ook recente evidence is meegenomen.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen tijdens de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is op 1 februari 2019 oriënterend gezocht naar literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief) in de databases Medline (Ovid) & Embase (Elsevier). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende hoeveelheid studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van Zorg’ en onder het kopje Patiëntenperspectief.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
NICE. Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage. 2012. Update in 2019.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Kennisinstituut van Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. 2015
Zoekverantwoording
|
Uitgangsvraag: UV2a-b-c: Wat is de optimale (zo min mogelijk invloed op toekomstige fertiliteit en zwangerschapsuitkomst) behandeling van een miskraam? |
|
|
Database(s): Medline, Embase |
Datum: 30-01-2019 |
|
Periode: > 2012 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2012 – januari 2019
|
1 exp ABORTION, SPONTANEOUS/ (33834) 2 miscarr$.ti,ab. (12816) 3 ((spontaneous or threatened or imminent or imminens or missed or delay$ or inevitable or incomplete$ or early or silent or quiescent) adj2 abort$).ti,ab. (14211) 4 ((pregnan$ or embryo$ or f?etal or f?etus$) adj3 (loss$ or demise or death$ or resorp$ or disintegrat$ or wast$ or reject$ or fail$ or viab?l$ or non?viab?l$)).ti,ab. (37973) 5 (anembryo$ or empty sac$).ti,ab. (191) 6 (blight$ adj2 (ova or ovum)).ti,ab. (203) 7 or/1-6 (78139) 8 (surg$ adj3 (manag$ or approach$ or care$)).ti,ab. (124836) 9 exp "DILATATION AND CURETTAGE"/ (2982) 10 ((dilatation or dilation) adj3 cur?ett$).ti,ab. (1764) 11 "D and C".ti,ab. (5898) 12 ((dilatation or dilation) adj3 (evacuat$ or extract$)).ti,ab. (547) 13 "D and E".ti,ab. (11781) 14 ((vacuum or suction or uterine) adj3 (cur?ett$ or aspirat$ or evacuat$)).ti,ab. (3247) 15 "evacuation of retained products of conception".ti,ab. (55) 16 ERPC.ti,ab. (79) 17 or/8-16 (148628) 18 (medical$ adj3 (manag$ or approach$ or care$)).ti,ab. (102404) 19 exp ABORTIFACIENT AGENTS/ (57941) 20 exp ABORTIFACIENT AGENTS, STEROIDAL/ (5891) 21 (anti progest$ or anti?progest$ or antigestagen$ or (progestational adj3 antagonist$)).ti,ab. (1887) 22 MIFEPRISTONE/ (5798) 23 (mifepristone or mifegyne or mifeprex or RU?486 or RU 486).ti,ab. (6374) 24 exp ABORTIFACIENT AGENTS, NONSTEROIDAL/ (52114) 25 exp PROSTAGLANDINS/ (98567) 26 exp PROSTAGLANDINS E, SYNTHETIC/ (5791) 27 prostaglandin$.ti,ab. (95524) 28 MISOPROSTOL/ (3906) 29 (misoprostol or cytotec or arthrotec or napratec).ti,ab. (4624) 30 gemeprost.ti,ab. (275) 31 or/18-30 (278511) 32 WATCHFUL WAITING/ (2981) 33 ((expectant$ or conservative$ or natural$) adj3 (manag$ or approach$ or care$)).ti,ab. (36361) 34 "wait and see".ti,ab. (1343) 35 (watch$ adj3 wait$).ti,ab. (3231) 36 or/32-35 (42817) 37 17 or 31 or 36 (454393) 38 7 and 37 (5007) 39 limit 38 to english language (4366) 40 limit 39 to animals (733) 41 limit 39 to (animals and humans) (113) 42 40 not 41 (620) 43 39 not 42 (3746) 44 limit 43 to yr="2012 -Current" (1073) 45 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (387645) 46 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1834583) 47 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3134073) 48 44 and 45 (101) 49 44 and 46 (228) 50 49 not 48 (186) 51 44 and 47 (457) 52 51 not 48 not 50 (333) 53 48 or 50 or 52 (620) = 620 |
813 |
|
Embase (Elsevier) |
((('spontaneous abortion'/exp OR miscarr*:ti,ab OR ((spontaneous OR threatened OR imminent OR imminens OR missed OR delay* OR inevitable OR incomplete* OR early OR silent OR quiescent) NEAR/2 abort*):ti,ab OR ((pregnan* OR embryo* OR fetal OR fetus*) NEAR/3 (loss* OR demise OR death* OR resorp* OR disintegrat* OR wast* OR reject* OR fail* OR viab* OR nonviab*)):ti,ab OR (anembryo*:ti,ab OR 'empty sac*':ti,ab) OR (blight* NEAR/2 (ova OR ovum)):ti,ab) AND (((surg* NEAR/3 (manag* OR approach* OR care*)):ti,ab OR 'dilatation and curettage'/exp OR ((dilatation OR dilation) NEAR/3 curett*):ti,ab OR 'd and c':ti,ab OR ((dilatation OR dilation) NEAR/3 (evacuat* OR extract*)):ti,ab OR 'd and e':ti,ab OR ((vacuum OR suction OR uterine) NEAR/3 (curett* OR aspirat* OR evacuat*)):ti,ab OR 'evacuation of retained products of conception':ti,ab OR erpc:ti,ab) OR ((medical* NEAR/3 (manag* OR approach* OR care*)):ti,ab OR 'abortive agent'/exp OR ('anti progest*':ti,ab OR antiprogest*:ti,ab OR antigestagen*:ti,ab OR ((progestational NEAR/3 antagonist*):ti,ab)) OR 'mifepristone'/exp OR (mifepristone:ti,ab OR mifegyne:ti,ab OR mifeprex:ti,ab OR ru486:ti,ab OR 'ru 486':ti,ab) OR ('prostaglandin'/exp OR 'prostaglandin e'/exp) OR prostaglandin*:ti,ab OR 'misoprostol'/exp OR (misoprostol:ti,ab OR cytotec:ti,ab OR arthrotec:ti,ab OR napratec:ti,ab) OR gemeprost:ti,ab) OR ('watchful waiting'/exp OR ((expectant* OR conservative* OR natural*) NEAR/3 (manag* OR approach* OR care*)):ti,ab OR 'wait and see':ti,ab OR (watch* NEAR/3 wait*):ti,ab))) NOT ([animals]/lim NOT [humans]/lim)) AND [english]/lim AND [2012-2019]/py NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 102
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 265
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomizedcontrolled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 262 = 629 |




